-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Postavení miniinvazivní a robotické chirurgie v léčbě nádorů jícnu a žaludku
Status of robotic and minimally invasive foregut tumour surgery
Esophagectomy and gastrectomy are essential curative methods in the treatment of non-metastatic malignancies of the esophagus and stomach. Video-assisted minimally invasive resections of the esophagus and stomach have demonstrated surgical and oncological safety and can be used as part of multimodal treatment strategy. Robot-assisted surgical operations are a new technology in the field of mini-invasive upper gastrointestinal surgery. The technical advantages of robotic systems combining minimally invasive surgical approaches with the possibility of multi-element articulation of robotic instruments in the operating field lead to a worldwide expansion of robotic centers. Further technological development can be expected to enhance support and facilitation of minimally invasive surgery and to further reduction of the surgical stress while adhering to the criteria of radical oncosurgery.
Keywords:
robotic surgery – esophagectomy – Gastrectomy – Minimally invasive surgery – laparoscopy
Autori: Pohnán R.; Pažin J.; Kalvach J.; Langer D.; Hadač J.; Ryska M.
Pôsobisko autorov: Chirurgická klinika 2. LF UK a ÚVN Praha
Vyšlo v časopise: Gastroent Hepatol 2021; 75(5): 424-431
Kategória:
doi: https://doi.org/10.48095/ccgh2021424Súhrn
Ezofagektomie a gastrektomie jsou principiálními léčebnými metodami v řešení nemetastazujících malignit jícnu a žaludku. U resekcí jícnu i žaludku prokázaly videoasistované mininvazivní operační postupy chirurgickou i onkologickou bezpečnost a zároveň je jejich využití možné i v rámci multimodální léčby. Novou technologií v oblasti miniinvazivních operací horní části trávicí trubice jsou roboticky asistované chirurgické operace. Technické výhody robotických systémů kombinujících miniinvazivní chirurgické přístupy s možností víceprvkové artikulace robotických nástrojů v operačním poli vedou k celosvětové expanzi robotických center. Lze očekávat, že další technologický rozvoj přispěje k podpoře a usnadnění miniinvazivních operací a k dalšímu snížení operační zátěže při zachování všech kritérií onkochirurgické radikality.
Klíčová slova:
laparoskopie – robotická chirurgie – ezofagektomie – miniinvazivní chirurgie – gastrektomie
Úvod
Základem chirurgické léčby nemetastazujícího karcinomu žaludku a jícnu je radikální resekční výkon se systematickým odstraněním spádových lymfatických uzlin. Gastrektomie s D2 lymfadenektomií je standardní chirurgickou léčbou u karcinomu žaludku (≥ T1b) [1,2]. V případě karcinomu jícnu je operační metodou s kurativním záměrem transthorakální resekce jícnu doplněná systematickou disekcí spádových lymfatických polí [3].
Před 140 lety provedl Billroth první úspěšnou resekci žaludku. Postupně byla vyvinuta řada resekčních technik, které umožnily snížit letalitu výkonu z 55,2 % prezentovaných Billrothem [4,5] k současné úrovni, kdy specializovaná centra udávají pooperační úmrtnost u laparotomické gastrektomie mezi 2 a 13 % [6,7].
O 32 let později (1913) referoval Torek úspěšnou resekci jícnu pro nádor [8], avšak přežívání pacientů v meziválečném období bylo ojedinělé. Etapa rozsáhlých resekcí jícnu započala až po konci druhé světové války, kdy došlo ke skokovému rozvoji chirurgických a anesteziologických technik [9,10]. Kompilace ze světové literatury prezentovaly postupně se snižující pooperační letalitu ezofagektomie, která dosahovala v poslední dekádě 20. století 4,9–8,8 % [11].
V důsledku zpřesnění indikací, nasazením miniinvazivních technik a zavedením multimodální léčby dosahují v dnešní době specializovaná centra méně než 5% letality [12].
Hlavními výhodami miniinvazivních operačních technik je nižší bolestivost, časnější rekonvalescence, menší traumatizace břišní (a hrudní) stěny a celkově nižší morbidita [1,5,12]. Z těchto důvodů se miniinvazivní techniky celosvětově rozšířily a u řady indikací jsou dnes videoasistované operace standardní metodou léčby. Z původních jednoduchých ablativních výkonů, jako jsou cholecystektomie, appendektomie nebo adnexektomie, byly vyvinuty komplexní techniky orgánových resekcí s vytvářením propracovaných rekonstrukcí.
Resekce žaludku a jícnu patří k technicky náročným operačním výkonům, kde je mimo vlastní resekci postiženého orgánu nedílnou součástí operace i precizní disekce retroperitoneálních a mediastinálních lymfatických polí s následnou rekonstrukční fází s vytvořením anastomózy na ponechanou část jícnu. Určité limity konvenčních laparoskopických výkonů spojených s omezenou manipulací v úzkém pracovním prostoru a s neergonomickou pozicí operační skupiny řeší zavádění roboticky asistovaných operací, které mají snížit náročnost složitých laparoskopických výkonů a zlepšit celkové výsledky chirurgické léčby. V tomto článku předkládáme přehled aktuálního stavu laparoskopické a roboticky asistované chirurgie v léčbě nádorů jícnu a žaludku.
Laparoskopická resekce žaludku
První aplikaci miniinvazivní operační techniky využité k resekci žaludku prezentovali v roce 1991 Kitano et al v Japonsku [13]. Postupně se laparoskopická gastrektomie (LG) celosvětově rozšířila a s vývojem nových chirurgických instrumentů a spolu s technologickými inovacemi (zobrazovací systémy, koagulační a disekční systémy využívající energetické technologie) se LG stala rutinní miniinvazivní chirurgickou technikou k léčbě žaludečního karcinomu. LG je technicky náročný postup s nutností adaptace pokročilých laparoskopický technik, proto trvalo relativně dlouhou dobu, než byla potvrzena bezpečnost a onkologická efektivita této metody [1,5].
Z pohledu medicíny založené na důkazech prokázaly klinické studie účinnost LG nejdříve u časného karcinomu žaludku. Na získávání evidence se významnou měrou podílela japonská společnost pro klinickou onkologii – Japan Clinical Oncology Group (JCOG). V této pracovní skupině byla provedena řada prospektivních multicentrických studií využívajících systematizovanou národní databázi při vysoké incidenci karcinomu žaludku v Japonsku. Tyto práce validovaly předkládaná očekávání LG s dosaženými výsledky a definovaly roli LG v léčbě karcinomu žaludku [14]. Prvními průlomovými pracemi byly studie JCOG0703 a JCOG0912. Ve studii JCOG0703 byla prokázána bezpečnost distální laparoskopické gastrektomie (DLG). Non-inferiorita LDG k otevřené distální gastrektomii (ODG) v léčbě karcinomu žaludku v klinickém stadiu I z hlediska „disease free survival“ (DFS) byla závěrem studie JCOG0912 [15,16]. V dalších studiích JGOC byla prokázána bezpečnost a efektivita laparoskopické totální gastrektomie (LDG) v léčbě karcinomu žaludku ve stadiu I (JCOG1401) [17]. V roce 2014 se LG stala standardním terapeutickým postupem v léčbě žaludečního karcinomu ve stadiu I [14].
Jednou z prvních prací analyzujících výsledky LG v léčbě lokálně pokročilého karcinomu žaludku byla prospektivní studie CLASS01 čínských autorů, kde bylo randomizováno 1 056 pacientů s nádory T2–T4a N0–3 (stadia Ib–III) [18]. V této studii se ve 3letém intervalu nelišilo DFS mezi porovnávanou LDG a ODG. Non-inferioritu LDG ku ODG potvrdila i prospektivní randomizovaná korejská studie KLASS02 [19]. Předpokládá se, že na základě výsledků studie Japanese Laparoscopic Surgery Study Group (JLSSG) [5,20] bude LG v tomto roce zařazena v Japanese Gastric Cancer Treatment Guidelines mezi standardní léčebné postupy v terapii lokálně pokročilého karcinomu žaludku.
Incidence karcinomu žaludku v Evropě je významně nižší než v Asii a reproducibilita výsledků dosahovaných v Japonsku, Číně a Koreji je často diskutovaným tématem.
Studie STOMACH byla prováděna ve třinácti centrech šesti evropských zemí. Zařazeno bylo 96 pacientů s iniciální neoadjuvantní chemoterapií indikovaných v totální gastrektomii (TG). Výsledkem této prospektivní randomizované studie bylo vyhodnocení non-inferiority laparoskopické totální gastrektomie (LTG) v porovnání s otevřenou totální gastrektomií (OTG) v konceptu multimodální léčby (perioperační chemoterapie) lokálně pokročilého karcinomu žaludku [21]. I v Evropě a v USA se očekává, že se miniinvazivní gastrektomie stane standardní součástí léčebných protokolů resekabilních lokálně pokročilých stadií žaludečního karcinomu.
Jednou z bariér, která brání většímu rozšíření LG, je technická náročnost této komplexní procedury s delší dobou učení (learning curve) a s nepodkročitelnými nároky na onkologickou radikalitu a kvalitu D2 lymfadenektomie. Při provádění systematické D2 lymfadenektomie byl dokumentován vyšší výskyt pankreatické píštěle u LG než u otevřených výkonů, zatímco celkový počet zaznamenaných komplikací byl u LG nižší [22]. Přes jednoznačné benefity laparoskopické operace dané nižší mírou operační zátěže trvalo téměř 20 let, než byly získány dostatečné důkazy o onkologické efektivitě LG [1]. Implementace LG vyžaduje centralizaci nemocných do onkochirurgických high-volume center, která jim mohou zajistit veškerý profit z miniinvazivní operace [21].
Robotická gastrektomie
Současné robotické chirurgické systémy spojují výhody miniinvazivních operací vedoucích k minimální traumatizaci břišní stěny s 3dimenzionálním zobrazováním operačního pole a zejména s možností víceúrovňové artikulace nástrojů robotického manipulátoru. Řeší tak technologické limity vyplývající z konstrukce lineárních laparoskopických nástrojů a jejich omezené manipulovatelnosti v operačním poli. Robotický systém zároveň eliminuje nežádoucí třes a pohyby nástrojů a eliminuje vynucené neergonomické polohy operatéra i asistentů. Nevýhodou robotické chirurgie je jednak cena robotického chirurgického systému a také vyšší ekonomická náročnost jednotlivých procedur.
Jedněmi z prvních pionýrů, kteří publikovali výsledky roboticky asistované gastrektomie (RG) pro žaludeční karcinom, byli v roce 2002 a 2006 japonští autoři Hashizume et al [23] a Kakeji et al [24]. Možnosti, které přinášejí roboticky asistovaná operace, vedly k jejich celosvětovému rozšíření a popularizaci, zejména v Japonsku, USA a v zemích západní Evropy. V současnosti je nejrozšířenějším robotickým chirurgickým manipulátorem da Vinci Surgical System od společnosti Intuitive (obr. 1, 2). Roboticky asistovaný výkon je evolucí laparoskopických výkonů, kdy kombinuje prvky z otevřených operačních technik s výhodami miniinvazivního přístupu.
Obr. 1. Robotický chirurgický systém Da Vinci® Xi během výkonu. Operující chirurg ovládá robotický manipulátor prostřednictvím konzole v pravé části obrázku.
Fig. 1. Da Vinci® Xi robotic surgical system during the procedure. The operating surgeon controls the robotic manipulator via a console in the right part of the image.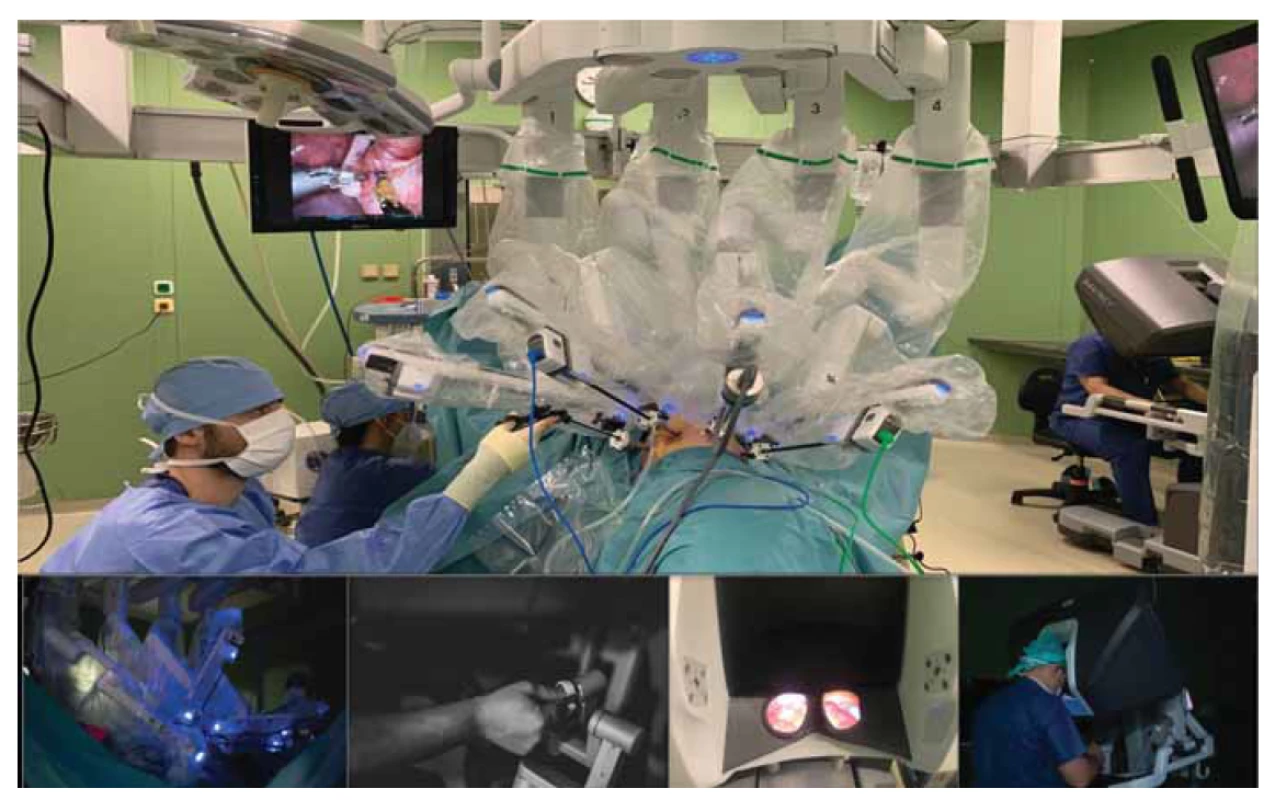
Obr. 2. Sekvence snímků z roboticky asistované totální gastrektomie.
Obr. 2a, b) Preparace terminálního jícnu.
Obr. 2c) Lymfadenektomie.
Obr. 2d) Izolace větví truncus coeliacus.
Obr. 2e) Přerušení terminálního jícnu robotickým staplerem.
Obr. 2f) Konstrukce ezofagojejunoanastomózy.
Fig. 2. Sequence of images from robotically assisted total gastrectomy.
Fig. 2a, b) Preparation of the terminal esophagus.
Fig. 2c) Lymfadenektomy.
Fig. 2d) Isolation of branches of truncus coeliacus.
Fig. 2e) Interruption of the terminal esophagus by a robotic stapler.
Fig. 2f) Construction of esophageal jejunoanastomosis.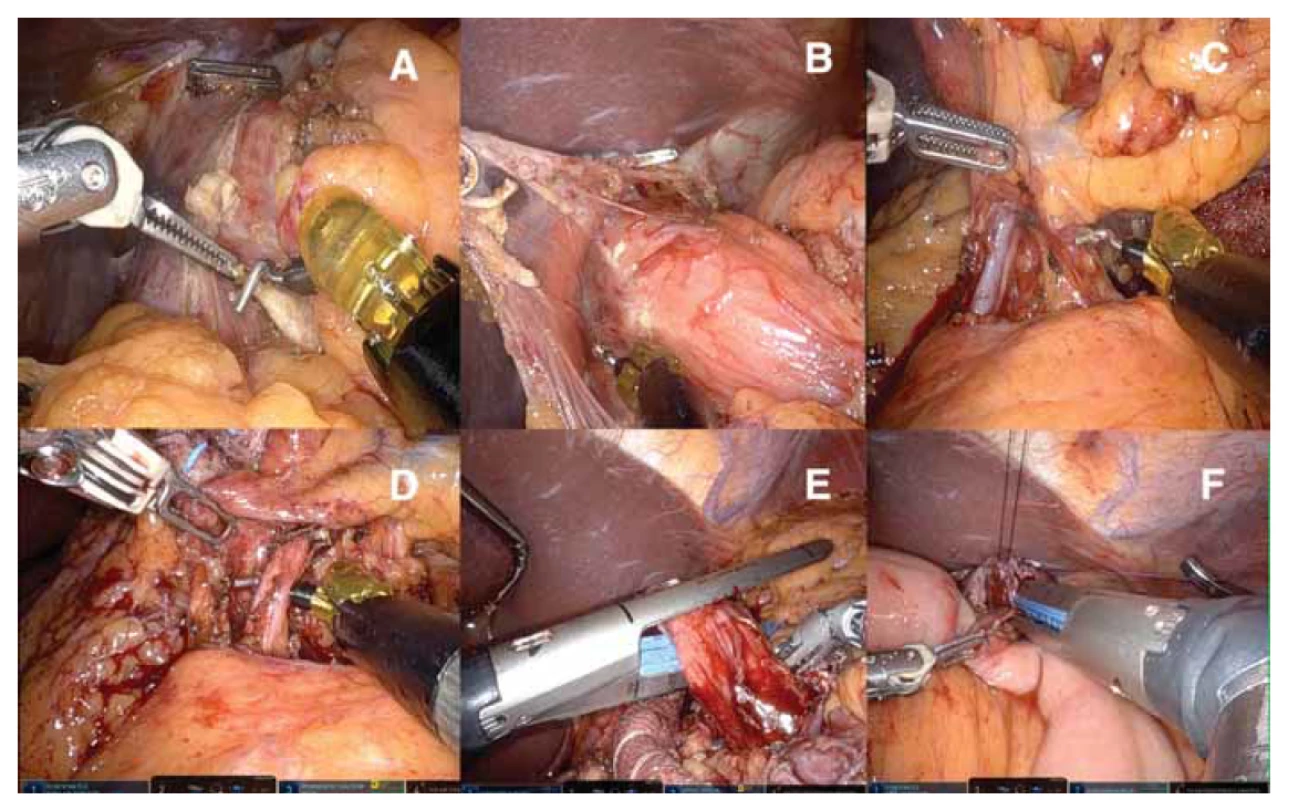
Robotická chirurgie se dynamicky rozšiřuje zejména v USA a v zemích západní Evropy. Významným popularizátorem roboticky asistovaných operací je však stále Japonsko. Bezprostředně po ověření bezpečnosti a proveditelnosti RG byla zahájena její evaluace. Několik metaanalýz si dalo za cíl porovnat RG a LG. Italská metaanalýza publikovaná v loňském roce hodnotila 40 retrospektivních studií s celkovým objemem 17 712 operovaných pacientů [25]. Výsledky po - ukázaly na delší operační čas, nižší krevní ztráty a menší počet komplikací u robotických operací. RG vykázaly při lymfadenektomii jednoznačně vyšší počet získaných lymfatických uzlin. Závěrem autorů je, že LG a RG vykazují obdobnou úroveň bezpečnosti, technické proveditelnosti a srovnatelné onkologické výsledky, zároveň však poukazují na to, že robotický přístup dosahuje lepších krátkodobých chirurgických výsledků [25].
V japonské multicentrické prospektivní kohortové studii referovali autoři redukci pooperačních komplikací u RG o více než 50 % při srovnání s laparoskopickými operacemi [26].
Ke stanovení přínosu roboticky asistovaných operací při resekcích žaludku budou nutné další dostatečně robustní prospektivní randomizované studie. V současné době JCOG provádí multicentrickou prospektivní randomizovanou studii fáze III (JCOG1907) s cílem ověřit superioritu RG v nižší míře perioperační morbidity. Primárním cílovým parametrem ve studii je výskyt intraabdominálních infekčních komplikací, velikost studovaného souboru pacientů byla stanovena na 1 040 případů [6]. Souběžně probíhají další studie v USA, v Nizozemsku a Itálii.
Roboticky asistovaná operace má oproti laparoskopii kratší dobu učení, a to zejména v nácviku techniky precizní a jemné disekce a přesných technik chirurgické sutury [27]. V blízké budoucnosti se očekává větší nasazení robotických chirurgických systémů nejen z důvodů kvalitativního posunu chirurgické disekce a snadnějšího vytváření anastomózy na jícen, ale i z důvodů možností real-time konzultace při řešení složitých případů, kde oslovení experti nemusí být přítomni přímo na operačním sále. Tím je možné prohloubit přímou mezioborovou spolupráci k dosažení nejlepších možných výsledků pro nemocné s nádory žaludku.
Miniinvazivní resekce jícnu
Incidence karcinomu jícnu v ČR setrvale narůstá a stoupá i podíl adenokarcinomu jícnu. Ezofagektomie zůstává zásadním a zároveň kritickým prvkem v konceptu multimodální terapie nemetastazujícího karcinomu jícnu. Chirurgický přístup k jícnu byl vždy obtížný a rizikový a v průběhu různých historických etap léčby byla vyvinuta řada chirurgických technik resekce a následné rekonstrukce jícnu.
V euroatlantickém prostoru je nejčastějším typem výkonu Ivor Lewisova transthorakální resekce jícnu využívající 2dutinový přístup [28]. Společným jmenovatelem všech různých typů otevřené resekce jícnu je vysoká operační zátěž provázená významnou morbiditou a letalitou [11].
Na přelomu tisíciletí byly vyvinuty techniky miniinvazivní resekce ezofagu (MIE), které významnou měrou zlepšily pooperační kvalitu života. První popis transthorakální MIE publikovali v roce 1992 Cuschieri et al [29] a transhiatální přístup popsali DePaula et al v roce 1995 [30]. Nicméně za celosvětovým rozšířením MIE, která se stala standardem léčby časných stadií karcinomu jícnu, stojí práce Luketiche et al [31], kde na souboru 222 pacientů popsali techniku a výsledky MIE. V tomto souboru dosáhli velmi nízké letality 1,4 % a MIE umožnila zkrátit dobu hospitalizace na 7 dní. Na základě těchto výsledků byla realizována multicentrická prospektivní studie fáze II ECOG 2202, která prokázala, že MIE je bezpečná a proveditelná, s nízkou pooperační morbiditou a letalitou a s dobrými onkologickými výsledky [32].
Jednou z průlomových prací byla prospektivní multicentrická randomizovaná studie publikovaná v roce 2012 v časopise Lancet srovnávající MIE s otevřenou transthorakální ezofagektomií. Výsledky studie ukázaly jednoznačně lepší krátkodobé výsledky pacientů ve skupině MIE (zejména nižší výskyt plicních komplikací), při stejné míře onkologické radikality [33].
Hybridní MIE je operace kombinující laparoskopickou mobilizaci žaludku s otevřenou pravostrannou thorakotomií. Hybridní MIE dosahuje ve srovnání s otevřenou transthorakální resekcí jícnu nižšího výskytu pooperačních komplikací, přičemž se neliší v dosažených onkologických výsledcích [34]. V současnosti je laparoskopická mobilizace žaludku s vytvořením žaludečního tubusu považována za standardní postup [3].
Miniinvazivní resekce ezofagu je komplexní procedurou s vysokou technickou náročností, přesto má miniinvazivní postup jednoznačný benefit v časném pooperačním období, vede k nižší operační zátěži a k menšímu výskytu pooperačních komplikací [28].
Realizace MIE a komplexní možnosti léčby potenciálních komplikací vyžadují centralizaci nemocných do onkochirurgických high-volume center [3].
Robotická ezofagektomie
Omezená manipulace laparoskopickými a thorakoskopickými instrumenty v úzkém prostoru a dobré výsledky roboticky asistovaných operací v jiných oblastech vedly k implementaci robotického manipulátoru do jícnové chirurgie. Od roku 2004 je využívána metoda roboticky asistované transthorakální ezofagektomie (RAMIE) (obr. 3, 4) [35]. Postupně řada pracovišť konvertovala z MIE k RAMIE, kde byla hlavním argumentem pro RAMIE jednodušší disekce pomocí robotického manipulátoru s nižším výskytem peroperačních poranění, menší krevní ztrátou, zvýšeným počtem odebraných lymfatických uzlin a kratší dobou učení [36,37]. Limitujícím hodnoticím faktorem je malý počet randomizovaných prospektivních studií. Studie The ROBOT nizozemských autorů [38] srovnávala RAMIE s otevřenou ezofagektomií. RAMIE dosáhla nižšího procenta komplikací, s nižší pooperační bolestivostí, lepším hodnocením kvality života a s časnější rekonvalescencí. Onkologické výsledky byly srovnatelné.
Obr. 3. Využití indocyaninové zeleně během RAMIE.
Obr. 3a, b) Identifikace větvení truncus coeliacus.
Obr. 3c, d) Kontrola vaskularizace žaludečního konduitu před rekonstrukční fází (a, d – vizualizace ve fluorescenčním zobrazovacím módu FireflyTM).
Fig. 3. Utilization of indocyanine green during RAMIE.
Fig. 3a, b) Identification of branching of truncus coeliacus.
Fig. 3c, d) Checking the vascularization of the gastric conduit before the reconstruction phase (a, d – visualization in the fluorescence imaging mode FireflyTM).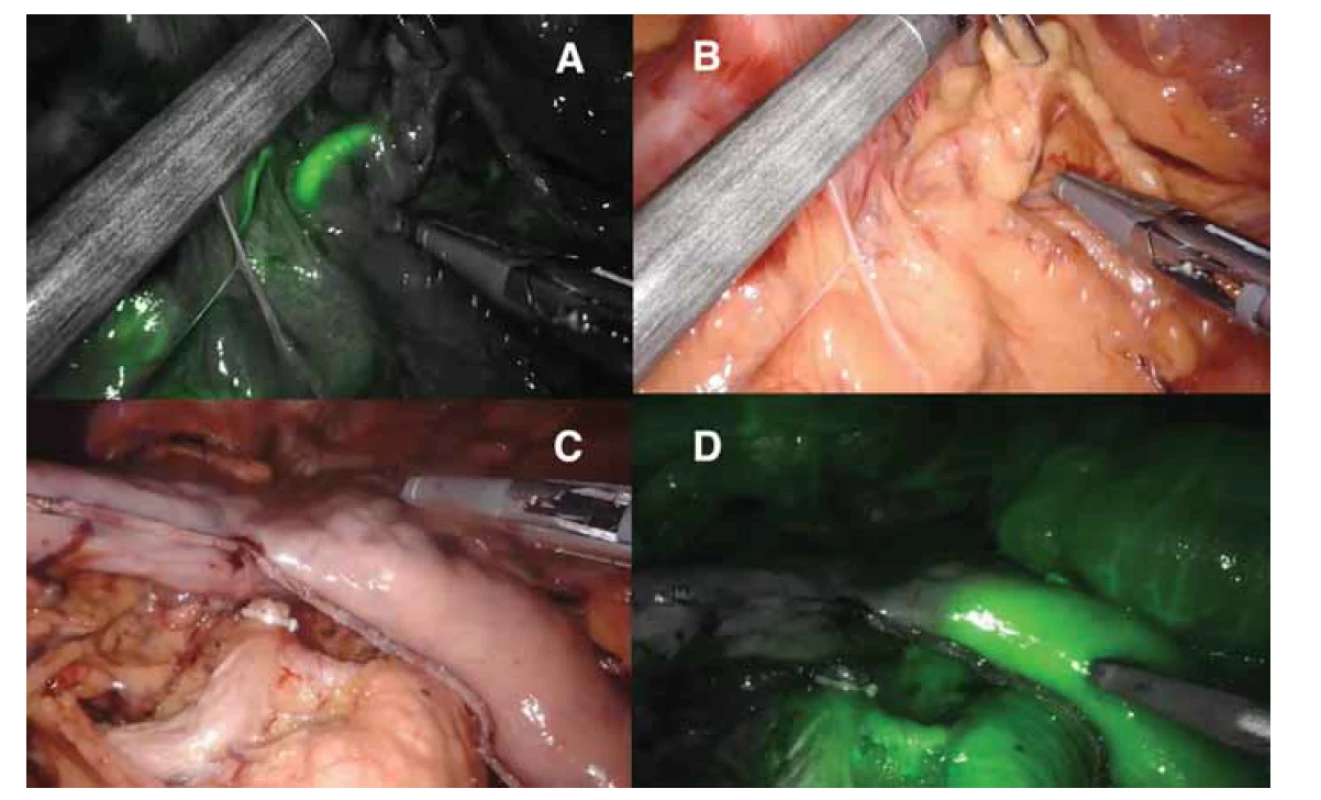
Obr. 4a) Pozice pracovních portů při hrudní fázi RAMIE.
Obr. 4b) Stav 9 měsíců po operaci.
Obr. 4c) Pozice pracovních portů při břišní fázi RAMIE.
Obr. 4d) Stav 5 měsíců po MIE.
Fig. 4a) Position of working ports during the chest phase of RAMIE.
Fig. 4b) Condition 9 months after surgery.
Fig. 4c) Position of working ports during abdominal phase RAMIE.
Fig. 4d) Condition 5 months after MIE.
Ke komplexnímu zhodnocení efektivity RAMIE vs. MIE bude potřeba provést další prospektivní randomizované studie. Přesto dosavadní výsledky ukazují, že RAMIE může být velmi účinnou metodou v léčbě resekabilního karcinomu jícnu a krátkodobé i dlouhodobé onkologické výsledky RAMIE jsou srovnatelné s jinými resekčními technikami [38–40].
Závěr
Chirurgické miniinvazivní postupy, laparoskopické operace a nyní i roboticky asistované operace jsou k řešení nádorů jícnu a žaludku využívány stále častěji. Miniinvazivní resekce patří na základě medicíny založené na důkazech (EBM – evidence based medicine) ke standardním terapeutickým technikám a roboticky asistované metody prokázaly svou bezpečnost, proveditelnost i onkologickou efektivitu. Robotické systémy pomocí specializovaných instrumentů s možností víceprvkové artikulace usnadňují disekci a suturu v limitovaných prostorech, kde konvenční laparoskopie dosahuje svých limitů. Roboticky asistovaná operace má oproti laparoskopii kratší dobu učení. Výhodou robotických chirurgických systémů bude možnost intraoperační konzultace s real-time přenosem informací mezi experty i mimo operační sál. Tím cílí robotická chirurgie na složité případy. Indukční onkologická léčba u lokálně pokročilého karcinomu žaludku a jícnu není automatickou kontraindikací miniinvazivního nebo roboticky asistovaného výkonu. Volba operačního postupu by měla být založena na rozsahu a lokalizaci nádoru a na komplexním zhodnocení erudovaným multioborovým indikačním týmem. Nesporná je nutnost centralizace pacientů s nádory jícnu a žaludku do high-volume center poskytujících komplexní multimodální péči.
Seznam zkratek
LG: laparoskopická gastrektomie
JCOG: Japan Clinical Oncology Group
DLG: distální laparoskopická gastrektomie
ODG: otevřená distální gastrektomie
DFS: disease free survival/přežití bez nemoci
JLSSG: Japanese Laparoscopic Surgery Study Group
TG: totální gastrektomie
LTG: laparoskopická totální gastrektomie
OTG: otevřená totální gastrektomie
RG: roboticky asistovaná gastrektomie
MIE: miniinvazivní resekce ezofagu
RAMIE: robotická miniinvazivní resekce ezofagu
ORCID autorů
R. Pohnán ORCID 0000-0002-1003-4883,
J. Pažin ORCID 0000-0003-3227-0956,
J. Kalvach ORCID 0000-0003-3541-9939,
D. Langer ORCID 0000-0002-1369-3702,
J. Hadač ORCID 0000-0002-1595-1736,
M. Ryska ORCID 0000-0003-1861-8506.
Doručeno/Submitted: 15. 9. 2021
Přijato/Accepted: 28. 9. 2021
doc. MUDr. Radek Pohnán, Ph.D.
Chirurgická klinika
2. LF UK a ÚVN
U Vojenské nemocnice 1200
169 02 Praha 6
Zdroje
1. Berlth F, Knospe L, Jansen-Winkeln B et al. Status of minimally invasive gastrectomy: current advancements: robotic surgery and intraoperative imaging for gastric cancer. Chirurg 2021; 92 (6): 528–534. doi: 10.1007/s00 104-021-01391-z.
2. Smyth EC, Verheij M, Allum W et al. Gastric cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol 2016; 27 (5): 38–49. doi: 10.1093/annonc/mdw 350.
3. Lordick F, Mariette C, Haustermans K et al. Oesophageal cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2016; 27 (Suppl 5): v50–v57. doi: 10.1093/annonc/mdw329.
4. Billroth T. Über 124 vom November 1878 bis Juni 1890 in meiner Klinik und Privatpraxis ausgeführte Resectionen am Magen‐Darmcanal, Gastro‐Enterostomien und Narbenlosungen wegen chronischer Krankheitsprocesse. Wiener klin Wochenschrift 1891; 4: S625–S628.
5. Terashima M. The 140 years‘ journey of gastric cancer surgery: from the two hands of Billroth to the multiple hands of the robot. Ann Gastroenterol Surg 2021; 5 (3): 270–277. doi: 10.1002/ags3.12442.
6. Degiuli M, Sasako M, Ponti A et al. Italian gastric cancer study group. Randomized clinical trial comparing survival after D1 or D2 gastrectomy for gastric cancer. Br J Surg 2014; 101 (2): 23–31. doi: 10.1002/bjs.9345.
7. Jínek T, Adamčík L, Vrba R et al. Risk factors and post-operative complications after gastrectomy for cancer. Rozhl Chir 2018; 97 (8): 384–393.
8. Torek F. The first successful case of resection of the thoracic portion of the oesophagus for carcinoma. Surg Gyn Obstetr 1913; 16 : 614.
9. Lewis I. The surgical treatment of carcinoma of the oesophagus; with special reference to a new operation for growths of the middle third. Br J Surg 1946; 34 : 18–31. doi: 10.1002/bjs.180034 13304.
10. Orringer MB, Sloan H. Esophagectomy without thoracotomy. J Thorac Cardiovasc Surg 1978; 76 (5): 643–654.
11. Jamieson GG, Mathew G, Ludemann R et al. Postoperative mortality following oesophagectomy and problems in reporting its rate. Br J Surg 2004; 91 (8): 943–947. doi: 10.1002/bjs.4596.
12. Lerut T, Wiesel O. History of esophagectomy for cancer of the esophagus and the gastroesophageal junction. Ann Transl Med 2021; 9 (10): 897. doi: 10.21037/atm-21-676.
13. Kitano S, Iso Y, Moriyama M et al. Laparoscopy‐assisted Billroth I gastrectomy. Surg Laparosc Endosc 1994; 4 (2): 146–148.
14. Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2018 (5th edition). Gastric Cancer 2021; 24 (1): 1–21. doi: 10.1007/s10120-020-01042-y.
15. Katai H, Sasako M, Fukuda H et al. Safety and feasibility of laparoscopy‐assisted distal gastrectomy with suprapancreatic nodal dissection for clinical stage I gastric cancer: a multicenter phase II trial (JCOG 0703). Gastric Cancer 2010; 13 (4): 238–244. doi: 10.1007/s10120-010-05 65-0.
16. Katai H, Mizusawa J, Katayama H et al. Survival outcomes after laparoscopy‐assisted distal gastrectomy versus open distal gastrectomy with nodal dissection for clinical stage IA or IB gastric cancer (JCOG0912): a multicentre, noninferiority, phase 3 randomised controlled trial. Lancet Gastroenterol Hepatol 2020; 5 (2): 142–145. doi: 10.1016/S2468-1253 (19) 30332-21.
17. Hyung WJ, Yang HK, Han SU et al. A feasibility study of laparoscopic total gastrectomy for clinical stage I gastric cancer: a prospective multi‐center phase II clinical trial, KLASS 03. Gastric Cancer 2019; 22 (1): 214–222. doi: 10.1007/ s10120-018-0864-4.
18. Yu J, Huang CM, Sun YH et al. Effect of laparoscopic vs open distal gastrectomy on 3‐year disease‐free survival in patients with locally advanced gastric cancer. The CLASS‐01 randomized clinical trial. JAMA 2019; 321 : 1983–1992. doi: 10.1001/jama.2019.5359.
19. Hyung WJ, Yang HK, Park YK et al. Long‐term outcomes of laparoscopic distal gastrectomy for locally advanced gastric cancer: The KLASS‐02‐RCT randomized clinical trial. J Clin Oncol 2020; 38 (28): 3304–3313. doi: 10.1200/JCO.20.01210.
20. Etoh T, Shiroshita H, Shiraishi N et al. Ongoing clinical studies of minimally invasive surgery for gastric cancer in Japan. Transl Gastroenterol Hepatol 2016; 11 (1): 31. doi: 10.21037/tgh.2016.03.15.
21. van der Wielen N, Straatman J, Daams F et al. Open versus minimally invasive total gastrectomy after neoadjuvant chemotherapy: results of a European randomized trial. Gastric Cancer 2021; 24 (1): 258–271. doi: 10.1007/s10120-020-01109-w.
22. Hiki N, Honda M, Etoh T et al. Higher incidence of pancreatic fistula in laparoscopic gastrectomy. Real-world evidence from a nationwide prospective cohort study. Gastric Cancer 2018; 21 (1): 162–170. doi: 10.1007/s101 20-017-0764-z.
23. Hashizume M, Shimada M, Tomikawa M et al. Early experiences of endoscopic procedures in general surgery assisted by a computer-enhanced surgical system. Surg Endosc 2002; 16 (8): 1187–1191. doi: 10.1007/s004640080154.
24. Kakeji Y, Konishi K, Ieiri S et al. Robotic laparoscopic distal gastrectomy: a comparison of the da Vinci and Zeus systems. Int J Med Robot 2006; 2 (4): 299–304. doi: 10.1002/rcs.104.
25. Guerrini GP, Esposito G, Magistri P et al. Robotic versus laparoscopic gastrectomy for gastric cancer: the largest meta-analysis. Int J Surg 2020; 82 : 210–228. doi: 10.1016/ j.ijsu.2020.07.053.
26. Kuwabara S, Okabe H, Terashima M. Clinical advantages of robotic gastrectomy for clinical stage I/II gastric cancer: a multi-institutional prospective single-arm study. Gastric Cancer 2019; 22 (2): 377–385. doi: 10.1007/s101 20-018-00906-8.
27. Giri S, Sarkar DK. Current status of robotic surgery. Indian J Surg 2012; 74 (3): 242–247. doi: 10.1007/s12262-012-0595-4.
28. Shemmeri E, Wee JO. Robotics and minimally invasive esophageal surgery. Ann Transl Med 2021; 9 (10): 898. doi: 10.21037/atm-20-4138.
29. Cuschieri A, Shimi S, Banting S. Endoscopic oesophagectomy through a right thoracoscopic approach. J R Coll Surg Edinb 1992; 37 (1): 7–11.
30. DePaula AL, Hashiba K, Ferreira EA et al. Laparoscopic transhiatal esophagectomy with esophagogastroplasty. Surg Laparosc Endosc 1995; 5 (1): 1–5.
31. Luketich JD, Alvelo-Rivera M, Buenaventura PO et al. Minimally invasive esophagectomy: outcomes in 222 patients. Ann Surg 2003; 238 (4): 486–494; doi: 10.1097/01.sla.0000089858.40725.68.
32. Luketich JD, Pennathur A, Franchetti Y et al. Minimally invasive esophagectomy: results of a prospective phase II multicenter trial-the eastern cooperative oncology group (E2202) study. Ann Surg 2015; 261 (4): 702–707. doi: 10.1097/SLA.0000000000000993.
33. Biere SSAY, van Berge Henegouwen MI, Maas KW et al. Minimally invasive versus open oesophagectomy for patients with oesophageal cancer: a multicentre, open-label, randomised controlled trial. Lancet 2012; 379 (9829): 1887–1892. doi: 10.1016/S0140-6736 (12) 605 16-9.
34. Mariette C, Markar SR, Dabakuyo-Yonli TS et al. Fédération de Recherche en Chirurgie (FRENCH) and French Eso-Gastric Tumors (FREGAT) Working Group. Hybrid Minimally Invasive Esophagectomy for Esophageal Cancer. N Engl J Med 2019; 380 (2): 152–162. doi: 10.1056/NEJMoa1805101.
35. Kernstine KH, DeArmond DT, Karimi M et al. The robotic, 2-stage, 3-field esophagolymphadenectomy. J Thorac Cardiovasc Surg 2004; 127 (6): 1847–1849. doi: 10.1016/j.jtcvs.2004.02. 014.
36. Chao YK, Wen YW, Chuang WY et al. Transition from video-assisted thoracoscopic to robotic esophagectomy: a single surgeon‘s experience. Dis Esophagus 2020; 33 (2): doz033. doi: 10.1093/dote/doz033.
37. Okusanya OT, Sarkaria IS, Hess NR et al. Robotic assisted minimally invasive esophagectomy (RAMIE): the University of Pittsburgh Medical Center initial experience. Ann Cardiothorac Surg 2017; 6 (2): 179–185. doi: 10.21037/acs.2017.03.12.
38. van der Sluis PC, van der Horst S, May AM et al. Robot-assisted minimally invasive thoracolaparoscopic esophagectomy versus open transthoracic esophagectomy for resectable esophageal cancer: a randomized controlled trial. Ann Surg 2019; 269 (4): 621–630. doi: 10.1097/SLA.0000000000003031.
39. van der Sluis PC, Ruurda JP, Verhage RJ et al. Oncologic long-term results of robot-assisted minimally invasive thoraco-laparoscopic esophagectomy with two-field lymphadenectomy for esophageal cancer. Ann Surg Oncol 2015; 22 Suppl 3: S1350–1356. doi: 10.1245/s10434-015-4544-x.
40. Weksler B, Sullivan JL. Survival after esophagectomy: a propensity-matched study of different surgical approaches. Ann Thorac Surg 2017; 104 (4): 1138–1146. doi: 10.1016/j.athoracsur.2017.04.065.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článek Gastrointestinálna onkológiaČlánek Kvíz z klinické praxeČlánek Recenze knihČlánek Videomaraton
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2021 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Gastrointestinální onkologie – mezioborová spolupráce
- Gastrointestinálna onkológia
- Kvíz z klinické praxe
- Endoscopic ultrasound fine-needle aspiration of pancreatic cystic lesions – a single-centre experience, and comparison with resection histology
- Screening karcinomu pankreatu: nastal čas vykročit?
- Primárny lymfóm pankreasu – kazuistika
- The potential of spectroscopy in the diagnosis of hepatocellular carcinoma – a pilot study
- Roboticky asistovaná léčba zhoubných nádorů kolorekta a hepatopankreatobiliární oblasti
- Role molekulární biologie v diferenciální diagnostice pankreatických cystických neoplazií
- Postavení miniinvazivní a robotické chirurgie v léčbě nádorů jícnu a žaludku
- Diagnostika a endoskopická intervence u raritního MALT lymfomu proximálního jejuna
- Monocentrická retrospektívna analýza asociácie hidradenitis suppurativa a chronických zápalových ochorení čreva
- Jak mohou ledviny ovlivnit léčbu pacientů s gastroenterologickými chorobami
- Komentář k doporučení Americké gastroenterologické asociace (AGA) pro léčbu středně těžké a těžké Crohnovy nemoci
- Recenze knih
- Životné jubileum prof. MUDr. Rudolfa Hyrdela, CSc
- Prof. MUDr. Marian Bátovský, CSc., MPH, 70-ročný
- Za Ivanom, kolegom, priateľom, ktorý nás učil žiť... MUDr. Ivan Bunganič (1952–2021)
- Výběr z mezinárodních časopisů
- Správná odpověď na předchozí kvíz Buried karcinom
- Kreditovaný autodidaktický test: gastrointestinální onkologie
- 7. kongres ČGS ČLS JEP 10.–12. listopadu 2021 Virtuální konference
- Videomaraton
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Screening karcinomu pankreatu: nastal čas vykročit?
- Postavení miniinvazivní a robotické chirurgie v léčbě nádorů jícnu a žaludku
- Primárny lymfóm pankreasu – kazuistika
- Role molekulární biologie v diferenciální diagnostice pankreatických cystických neoplazií
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



