-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Role molekulární biologie v diferenciální diagnostice pankreatických cystických neoplazií
The role of molecular biology in the differential diagnosis of pancreatic cystic neoplasias
Pancreatic cysts have been detected ever more frequently in recent years due to the advanced and wider use of imaging methods. We find them on CT or MR also in asymptomatic patients who do not have a history of any pancreatic disease. Pancreatic cystic lesions represent a wide range of pathological changes from simple cysts through precancerous lesions to malignant cysts. Accurate diagnosis remains difficult despite the combination of clinical status evaluation, imaging findings, and biochemical and cytological examination. Molecular biological examination of cyst aspirate obtained by endosonographic examination increases the detection rate of mucinous cysts (KRAS/GNAS/VHL) and cysts with a high risk of malignancy (KRAS/GNAS/p53/PIK3CA/PTEN/CDKN2A/SMAD4) and optimizes therapeutic approach. Larger prospective validation studies are necessary to make this costly and limited method a routine part of clinical practice.
Keywords:
molecular biology – neoplasia – pancreatic cysts
Autori: Horný I. 1; Tomáš Hucl 2
Pôsobisko autorov: Interní oddělení, Nemocnice Strakonice, a. s. 1; Klinika hepatogastroenterologie IKEM, Praha 2
Vyšlo v časopise: Gastroent Hepatol 2021; 75(5): 417-423
Kategória: Pôvodná práca
doi: https://doi.org/10.48095/ccgh2021417Súhrn
Pankreatické cysty jsou v posledních letech díky pokrokům a širšímu užití zobrazovacích metod detekovány stále častěji. Na CT nebo MR je nacházíme i u asymptomatických pacientů, kteří v anamnéze nemají žádné dřívější onemocnění pankreatu. Pankreatické cystické léze reprezentují široké spektrum patologických změn od prostých cyst přes prekancerózy až k cystám maligním. Stanovení přesné diagnózy zůstává navzdory kombinaci klinického stavu, nálezu zobrazovacích metod a biochemického a cytologického vyšetření obtížné. Molekulárně biologické vyšetření aspirátu cysty získaného při endosonografickém vyšetření zvyšuje detekci mucinózních cyst (KRAS/GNAS/VHL) a cyst s vysokým rizikem malignity (KRAS/GNAS/p53/PIK3CA/PTEN/CDKN2A/SMAD4) a optimalizuje další terapeutický postup. Nezbytné jsou větší prospektivní validační studie, aby se tato finančně náročná a omezeně dostupná metoda stala rutinní součástí klinické praxe.
Klíčová slova:
neoplazie – pankreatické cysty – molekulární biologie
Úvod
Pankreatické cysty jsou v posledních letech identifikovány čím dál častěji vzhledem k prodlužujícímu se věku pacientů i díky širšímu užívání neustále se zlepšujících zobrazovacích metod v diagnostice nitrobřišních afekcí. Na CT nebo MR jsou detekovány u 1,2–13,5 % pacientů [1]. U pacientů mladších 40 let se vyskytují u méně než 0,5 % vyšetřovaných, mezi 70 a 79 lety u 25 % a u pacientů starších 80 let jsou detekovány až u 37 % vyšetřených.
Pankreatické cystické léze (PCL) lze obecně rozdělit na nenádorové, jejichž nejčastějším zástupcem je pseudocysta, a nádorové, které dělíme podle přítomnosti mucinu na mucinózní a nemucinózní cystické neoplazie. Do skupiny mucinózních neoplazií patří intraduktální papilární mucinózní neoplazie (IPMN) a mucinózní cystická neoplazie (MCN), které jsou potenciálními prekurzory karcinomu pankreatu a mohou mít jak nízké riziko (premaligní s nízkým stupněm dysplazie), tak vysoké riziko (premaligní s vysokým stupněm dysplazie nebo maligní). Skupina nemucinózních neoplazií zahrnuje serózní cystadenomy (SCA), solidní pseudopapilární neoplazie (SPN) či cystadenomy z acinárních buněk (ACCs) [2]. Vedle těchto nejčastějších typů lézí se také můžeme setkat s cystickými neuroendokrinními nádory či cystickým adenokarcinomem z duktálních buněk.
Vzhledem k heterogenitě maligního potenciálu pankreatických cystických neoplazií, zvyšující se frekvenci a nezanedbatelné morbiditě a mortalitě chirurgických intervencí je žádoucí jejich co nejpřesnější předoperační diagnóza. V okamžiku stanovení diagnózy volíme další postup dle míry rizika přítomnosti či vzniku malignity. Toto riziko však není dokonale známé, důkazem toho jsou výrazné odlišnosti v doporučených postupech [3] publikovaných různými odbornými společnostmi [4]. Základními postupy u mucinózních neoplazií jsou na základě posouzení maligního potenciálu operační řešení nebo pravidelné sledování, zatímco u většiny nemucinózních lézí není nutná ani dispenzarizace, ani chirurgická intervence.
Pankreatické cystické léze představují v běžné praxi často významný klinický problém. Možný maligní potenciál některých z nich klade výrazný požadavek na jejich přesnou diagnostiku, ta je však často nedokonalá i při použití širokého spektra dostupných vyšetřovacích metod. Prováděná vyšetření jsou nákladná a představují zátěž pro pacienta, především vzhledem k nutnosti jejich opakovaného provádění. Z nejisté definitivní diagnózy plyne nemalá psychická zátěž pro pacienta i pro ošetřujícího lékaře. Výhodou správné diagnózy může být prevence vzniku invazivního karcinomu či ukončení sledování, rizikem nesprávné diagnózy je vznik maligního nádoru či neadekvátní zátěž velkou nitrobřišní operací s vysokou morbiditou a nezanedbatelnou mortalitou. V posledních letech se objevily nové informace o specifických molekulárně biologických alteracích, které lze u pacientů s cystami vyšetřit z aspirovaného materiálu a které jednotlivé léze charakterizují a do určité míry odlišují.
Diagnostika pankreatických cystických neoplazií
Pankreatické cystické neoplazie (PCN) jsou typicky diagnostikovány zobrazovacími metodami, jako je abdominální ultrasonografie, CT a MR. V indikovaných případech je indikováno vyšetření endoskopickou ultrasonografií, které je již invazivní a je zatíženo určitým rizikem komplikací. Lze jej doplnit o aspirační biopsii, jejíž obsah lze hodnotit biochemicky, cytologicky a nově také molekulárně biologicky.
Radiologické zobrazovací metody
Přestože se zobrazovací metody, jako abdominální ultrasonografie, CT nebo MR neustále zdokonalují, přesné rozlišení maligních cystických útvarů od benigních stále neumožňují. Pokroky v difuzně vážené MR jsou příslibem v odlišení mucinózních cyst od serózních s relativně vysokou senzitivitou (84–88 %) a specificitou (66–72 %) [5]. Mezi výhody MR patří absence radiačního záření a možnost posouzení vztahu cystické léze k pankreatickým vývodům, a je tak doporučeným vyšetřením především u pacientů indikovaných k pravidelnému sledování.
Indikace k invazivnímu vyšetření endoskopickou ultrasonografií (EUS) by měla být pečlivě zvážena a mělo by následovat adekvátní zhodnocení předchozího nálezu základních zobrazovacích metod. Provádíme ji u pacientů, u nichž bude mít její závěr zřejmý dopad na další léčbu či sledování pacienta.
Jednotlivé PCN mají pouze částečně typický endosonografický obraz, a samotné EUS zobrazení tak má v diagnostice specifického typu PCN omezenou přesnost. Uplatňuje se v detekci komunikace léze s pankreatickým vývodem (odlišení IPMN z vedlejších vývodů, BD-IPMN) a v identifikaci rizikových stigmat. Hlavní výhodou je možnost provedení aspirační biopsie (EUS-FNA). Pokud to anatomické poměry dovolují, je doporučeno provést jen jeden vpich do nitra cysty a odsát veškerou tekutinu. Riziko komplikací je při FNA cystických lézí vyšší než u FNA solidních tumorů [6]. Je doporučena ATB profylaxe (obvykle i.v. ciprofloxacin) před punkcí [7]. Při cytologické analýze dosahuje specificita získaných vzorků 100 %, avšak senzitivita je podstatně nižší (v různých studiích se pohybuje od 55 do 97 %) [8].
Klinická potřeba zlepšit diagnostiku vedla k vývoji mikrokleští [9] (Moray, US Endoscopy, Mentor, Ohio), které je možné při EUS zavést skrze 19G jehlu do nitra cystické neoplazie a za kontroly zraku odebrat buněčnou tkáň ze stěny cysty, nodulu nebo intracystického septa, kterou lze na rozdíl od často bezbuněčné tekutiny podrobit histologickému či genetickému vyšetření. Vzhledem k vysokému technickému úspěchu [10] a přiměřenému bezpečnostnímu profilu [11] zlepšuje toto nové akcesorium diagnostickou přesnost při rozlišování subtypů pankreatických neoplazií [12].
EUS-FNA cytologie
Analýza cystické tekutiny získané při FNA napomáhá odlišení mucinózní od nemucinózní léze. Přítomnost mucinu v aspirátu má 80% senzitivitu, 100% specificitu a 83% pozitivní prediktivní hodnotu v diagnóze mucinózních cyst [13]. Rozbor je rovněž využitelný k identifikaci pokročilé neoplazie pro nízkou buněčnou nálož v cystické tekutině s vysokou specificitou (88 %), ale nízkou senzitivitou (63 %) [14].
EUS-FNA nádorové markery
V současnosti je hlavním nádorovým markerem používaným v diagnostice typu cystických lézí pankreatu karcinoembryonální antigen (CEA). Je detekován ve vysokých koncentracích u IPMN, zatímco u pseudocyst nebo SCA jsou přítomny nízké hladiny [15]. Hladina ve většině případů používaná k odlišení mucinózních a nemucinózních cyst byla stanovena na 192 ng/ml. V rozlišení mucinózních cyst od ostatních typů má hladina CEA vyšší senzitivitu (79 %) než samotná morfologie (51 %) nebo cytologický preparát získaný z cysty (59 %). Na druhé straně svědčí nízká hladina CEA (< 5 ng/ml) s vysokou specificitou a senzitivitou pro serózní cystadenom. Neexistuje však žádná korelace mezi výškou hladiny CEA a rizikem malignity. Ke stanovení hladiny CEA vyžadují laboratoře dostatečné množství materiálu (0,25–1,0 ml tekutiny), což může představovat v některých případech problém. Navíc je CEA test standardizován pro detekci CEA v séru, ale ne v cystách, z čehož vzniká obtížná interpretace a srovnání výsledků mezi jednotlivými pracovišti. Jiným problémem jsou fluktuující hodnoty CEA mezi jednotlivými odběry ze stejné cysty [16]. Zvýšená hladina CEA neukazuje na přítomnost high-grade dysplazie nebo invazivního karcinomu v cystické lézi pankreatu [8].
Vysoké hodnoty amylázy či lipázy svědčí pro pseudocystu či přítomnost komunikace s pankreatickým vývodem, nerozliší však mucinózní od nemucinózní cysty [17].
EUS-FNA molekulárně biologické markery
Navzdory zdokonalení v zobrazovací diagnostice pankreatických cystických lézí včetně endoskopické ultrasonografie zůstává přesná diagnostika pankreatických cystických lézí obtížná. Cytologie má vysokou senzitivitu, avšak nízkou senzitivitu v diagnostice mucinózní neoplazie. Ve studii Gaddama et al [18] vedlo užití hranice CEA 192 ng/ml k nesprávné diagnóze u 39 % cystických mucinózních neoplazií. V jiné retrospektivní studii se předoperační diagnóza (CT, MR a/nebo EUS) lišila od konečné diagnózy stanovené z resekátu až u téměř třetiny pacientů. Vedle toho bylo 15 % cyst diagnostikovaných jako mucinózní benigní bez maligního potenciálu [19].
Nejistota při stanovení diagnózy vyvolává obavy jak u pacientů, tak u lékařů. Molekulární testování by mohlo být spolehlivou metodou nejen ke klasifikaci cystické léze, ale k posouzení jejího možného maligního potenciálu a k identifikaci možné progrese v adenokarcinom pankreatu [20].
Karcinom pankreatu je genetické onemocnění, které vzniká z neinvazivních intraduktálních prekurzorů, ve kterých jsou v čase postupně akumulovány genetické alterace. Mezi tyto prekurzorové léze patří pankreatická intraepiteliální neoplazie (PanIN) a makroskopické mucinózní cysty, které zahrnují především IPMN a MCN [21]. Některé z těchto genetických alterací vznikají časně v průběhu onkogeneze, a mohou tak přispět k odlišení lézí s maligním potenciálem, některé vznikají později v průběhu onkogeneze a jejich přítomnost svědčí pro pokročilou high-grade lézi či již malignitu. Část těchto alterací sdružených s maligním potenciálem či maligní transformací lze detekovat v aspirátu pankreatických cyst (tab. 1).
Tab. 1. Analýza aspirátu pankreatické cysty [31].
Tab. 1. Analysis of pancreatic cyst aspirate [31].![Analýza aspirátu pankreatické cysty [31].<br>
Tab. 1. Analysis of pancreatic cyst aspirate [31].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/404b160fbf8d569f5529b49afdb52108.png)
SCA – serózní cystadenom, IPMN – intraduktální papilární mucinózní neoplazie, MCN – mucinózní cystická neoplazie, panNET – pankreatický neuroendokrinní tumor, PDAC – adenokarcinom pankreatu, CEA – karcinoembryonální antigen, AMS – amyláza, HR – high-risk. Ke stanovení přítomnosti genetických alterací v aspirátu získaného při EUS-FNA používáme nové molekulárně biologické techniky jako next-generation sequencing (NGS) – velmi senzitivní techniku umožňující detekci genetických mutací v předdefinovaném panelu genů dokonce i u vzorků s limitovaným obsahem DNA. Technika NGS vyžaduje adekvátní infrastrukturu, analýzu značného množství dat a je spojeno s vysokými finančními náklady dávajícími požadavek na zpracování většího množství vzorků najednou.
Pseudocysta
Pseudocysty nalézáme typicky u pacientů s anamnézou pankreatitidy, chybí jim vlastní epiteliální výstelka a ve většině případů v nich nalézáme vysokou hladinu amylázy a nízkou hladinu CEA. Cytologicky chybí epiteliální buňky. U pseudocyst (či jiných nenádorových cyst) nebyly zjištěny genetické alterace [21].
Serózní cystadenomy
Serózní cystadenomy jsou benigní cystické epiteliální neoplazie charakterizované buněčnou výstelkou bohatou na glykogen a serózní tekutinou. Nachází se spíše u žen, průměrný věk v době diagnózy je 65 let. Jsou typicky solitární, dobře ohraničené, s lehkou predominancí v těle a kaudě pankreatu. Většinou se jedná o cystadenomy složené z malých cyst, jejich diagnóza pak nečiní takové problémy jako v případě oligocystického typu, který se podobá mucinózním lézím. Jsou vystlány jedno - až vícevrstevnatými kuboidními buňkami obsahujícími glykogen a centrálně uložené jádro. Biochemicky nalézáme typicky nízkou hladinu CEA (5 ng/ml) a nízkou hladinu amylázy.
Alterace supresorového genu VHL (von Hippel-Lindau, inaktivující mutace nebo ztráta heterozygozity nebo aneuploidie chromozomu 3p) je detekována u 89–100 % SCA. VHL kóduje E3 ubiquitin ligázu, která inhibuje transaktivační funkce onkogenu hypoxia-inducibilního faktoru 1-alfa (HIF1-α) a způsobuje jeho degradaci. Inaktivace VHL ústí u SCA v transaktivaci HIF1-α, která podporuje buněčné přežívání, angiogenezi a růst [21]. Mutace ve VHL genu nebyly identifikovány u mucinózních cyst, byly však nalezeny u pacientů s cystickými neuroendokrinními nádory [22].
Mucinózní cystické neoplazie
Mezi mucinózní cystické léze řadíme intraduktální papilární mucinózní neoplazie (IPMN) a mucinózní cystické neoplazie (MCN). Mucinózní cystické neoplazie jsou na základě běžných vyšetřovacích metod charakterizovány přítomností vazké tekutiny obsahující mucin, mucinózním epitelem v cytologickém obraze a zvýšenou hladinou CEA > 192 ng/ml. Podle stupně dysplazie je dělíme na neoplazie s nízkým a vysokým stupněm, může být přítomen již invazivní karcinom. Rozlišení obou typů je v některých situacích důležité pro rozdílný terapeutický přístup (European guidelines), což je však na základě pouze zobrazení v řadě případů nemožné. Hladiny CEA či cytologický obraz toto rozlišení také neumožňuje. Molekulárně biologické alterace jsou u IPMN a MCN z části shodné a z části odlišné. Mezi alterace objevující se časně v průběhu onkogeneze řadíme mutace KRAS, GNAS a RNF43, mezi alterace objevující se později v progresi v karcinom patří mutace v TP53, PIK3CA, PTEN, CDKN2A a SMAD4.
Intraduktální papilární mucinózní neoplazie (obr. 1, 2)
Obr. 1. MD-IPMN.
Fig. 1. MD-IPMN.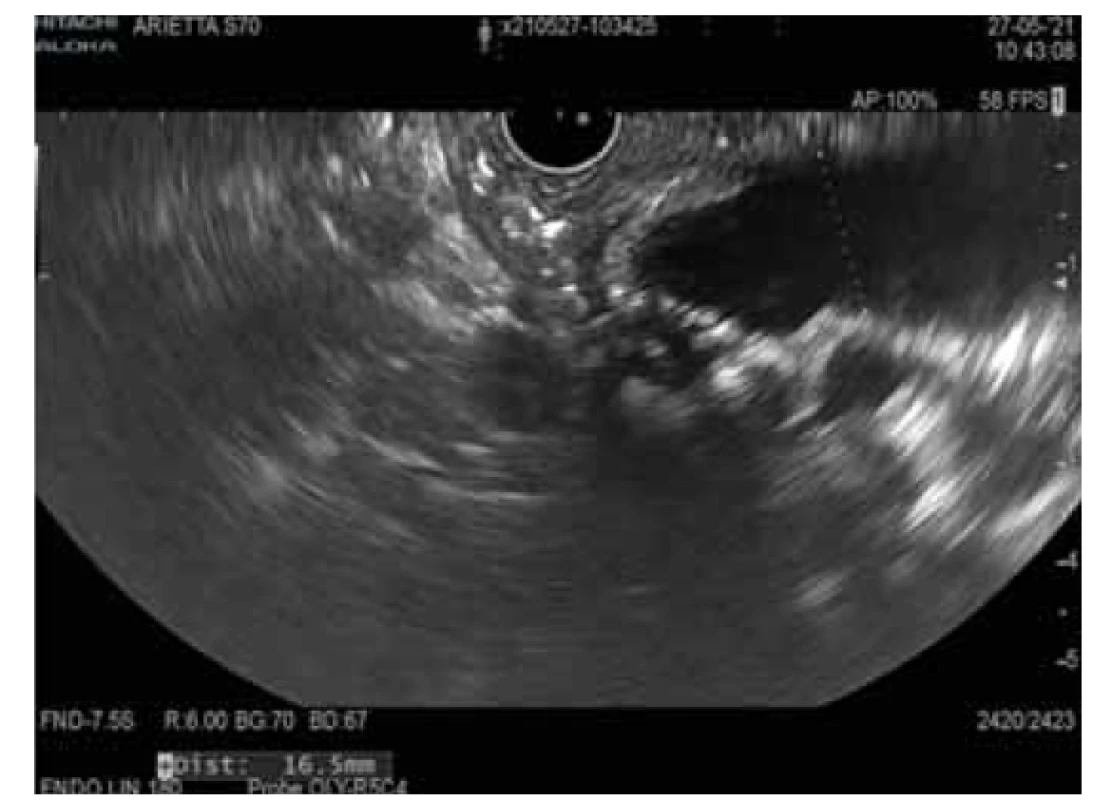
Obr. 2. BD-IPMN.
Fig. 2. BD-IPMN.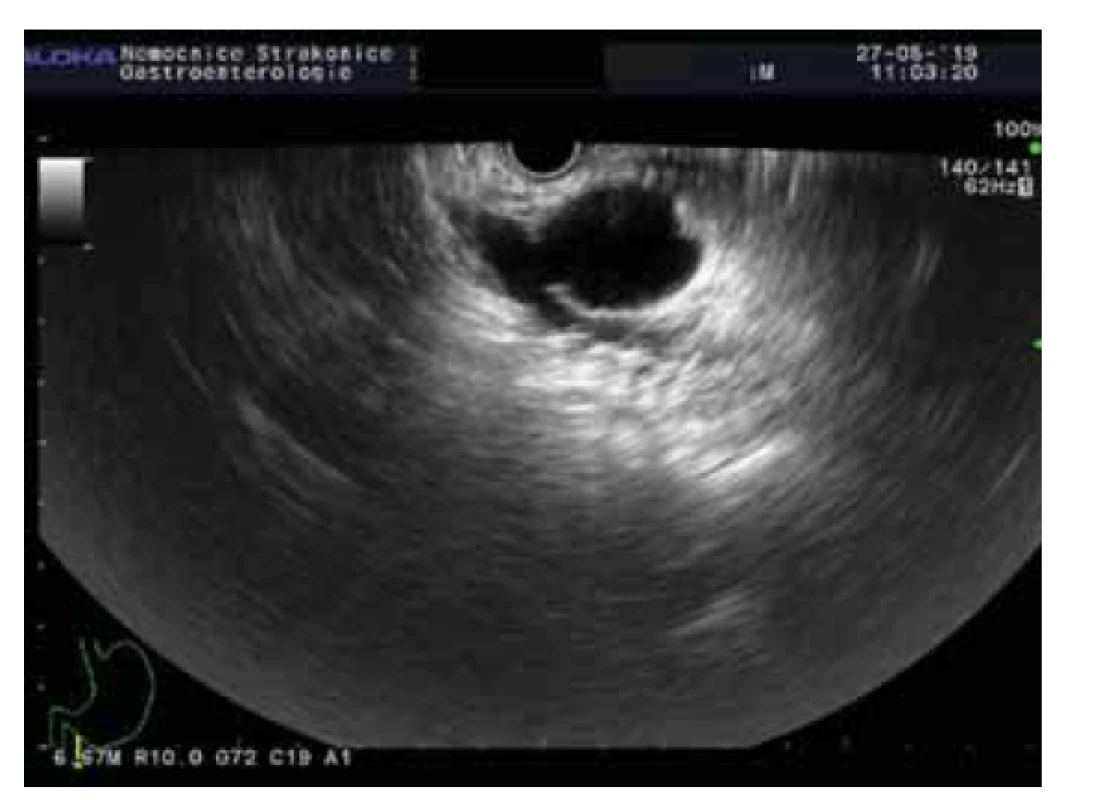
Intraduktální papilární mucinózní neoplazie je mucin produkující epiteliální neoplazie vznikající z hlavního pankreatického vývodu nebo jeho větví. IPMN je většinou > 1 cm, lokalizována v hlavě pankreatu a je častější u mužů (3 : 2), průměrný věk pacientů je 65 let. U IPMN z hlavního vývodu je přítomna malignita až ve 40 % případů v době diagnózy, toto riziko je u IPMN z vedlejších vývodů výrazně nižší.
U IPMN mohou být nalezeny různé genetické mutace. Jelikož se některé liší od mutací, které se nacházejí u MCN, mohou být důležité pro diferenciální diagnostiku. Nejfrekventnější genetickou alterací je KRAS mutace s prevalencí až 80 %. KRAS kóduje protein s GTPázovou aktivitou. KRAS mutace jsou detekovány u všech čtyř histologických subtypů IPMN, ale nejčastěji u gastrického a pankreatobiliárního [21]. Se vzrůstajícím stupněm dysplazie narůstá výskyt mutací.
Vedle toho byly až u 66 % IPMN nalezeny mutace v onkogenu GNAS. U resekovaných IPMN byly nalezeny v asi polovině všech případů a 33 % resekovaných časných IPMN. Navíc mutace GNAS se vyskytují exkluzivně u IPMN, nebyly prokázány u MCN nebo solidního adenokarcinomu pankreatu, mají tak 100% specificitu pro IPMN. Některé studie prokázaly přítomnost GNAS mutace v pankreatické šťávě získané z duodena u pacientů s IPMN se stejnou prevalencí jako v resekovaných vzorcích. GNAS kóduje G-protein stimulující alfa-podjednotku a s ní spojenou adenylátcyklázu. V důsledku mutace dochází k autonomní syntéze cAMP a nekontrolovanému růstu. Mutace GNAS se typicky vyskytují u intestinálního subtypu IPMN. Ve studii s 626 pankreatickými cystickými lézemi byla KRAS a/nebo GNAS mutace přítomna u 100 % IPMN [23].
Mutace inaktivující supresorový gen RNF43 se objevují u 14–38 % IPMN [24]. Dalšími potenciálními mutovanými geny u IPMN jsou TP53, PIK3CA, PTEN, CDKN2A a SMAD4. Jedná se o geny, jejichž mutace jsou detekovány v pozdější fázi tumorogeneze, a jejich přítomnost tak svědčí pro pokročilou neoplazii bez ohledu na specifický histologický typ. Mutace PIK3CA a delece v PTEN jsou úzce spojeny s high-grade dysplazií IPMN a s karcinomem pankreatu. Ztráty v CDKN2A jsou málo častým nálezem, avšak s výraznou prevalencí u IPMN s high-grade dysplazií oproti IPMN s low-grade dysplazií [21]. CDKN2A může být poškozen metylací, jeho inaktivace je časným momentem v progresi IPMN z premaligní cysty do cysty maligní, pro což svědčí výskyt u 10–60 % benigních cyst a u 90–100 % maligních cyst s asociovaným karcinomem [25].
Gen SMAD4 je zřídka inaktivován u IPMN s low-grade dysplazií, ale mutace s korespondující ztrátou heterozygozity typicky vznikají u pokročilé neoplazie.
V nedávné době se prokázalo, že miRNA může být alterována u IPMN. Může mít funkci onkogenu či tumor supresoru. Mnohé studie prokázaly, že specifické miRNA jako miRNA 21, miRNA 155, miRNA 211 a miRNA 17-3p mohou hrát důležitou roli biomarkeru v progresi IPMN do maligního tumoru nebo jako diagnostický rozlišovací znak mezi mucinózními a nemucinózními cystami [26]. V jedné studii bylo prokázáno, že analýza miRNA z aspirátu cysty (panel 9 miRNA) v porovnání s miRNA z mikroskopických vzorků z resekovaných IPMN dokázala predikovat pokročilou neoplazii s 89% senzitivitou a 100% specificitou, a tak rozlišit pacienty indikované k chirurgické intervenci od pacientů vhodných ke sledování [27], avšak v prospektivní validaci za použití stejného panelu miRNA byla senzitivita pouze 10 % [28]. Ke klinickému použití je nezbytné dosažení lepší validace.
Mucinózní cystická neoplazie
Podobně jako IPMN je MCN mucin produkující epiteliální neoplazie, která na rozdíl od IMPN vzniká mimo pankreatický vývod. Téměř výlučně vzniká v těle nebo kaudě pankreatu a je mnohem běžnější u žen než u mužů. Průměrný věk v době stanovení diagnózy je 50 let. MCN bývají solitární a nekomunikují s d. Wirsungi. Mikroskopicky jsou vystlány vysokým cylindrickým mucin produkujícím epitelem s různým stupněm dysplazie a obsahují ovariální typ stromatu, jehož buňky mohou exprimovat hormonální receptory. MCN je prekurzorová léze karcinomu pankreatu, jehož riziko se pohybuje mezi 10 a 17 %.
U MCN byly detekovány genetické alterace v KRAS, RNF43, TP53, PIK3CA, PTEN, CDKNA a SMAD4. KRAS mutace je nejčastější, její výskyt koreluje se stupněm dysplazie a pohybuje se kolem 30 % u nízké dysplazie a až u 80 % rizikových MCN. Na rozdíl od IPMN se u MCN nikdy neobjevuje mutace GNAS [21]. Podobně jako u IPMN se nachází u 8–35 % MCN somatické mutace RNF43. U pokročilých MCN jsou detekovány mutace a/nebo delece TP53, PIK3CA, PTEN, CDKN2A a SMAD4.
Solidní pseudopapilární neoplazie (obr. 3)
Obr. 3. Solidní pseudopapilární neoplazie.
Fig. 3. Solid pseudopapillary neoplasia.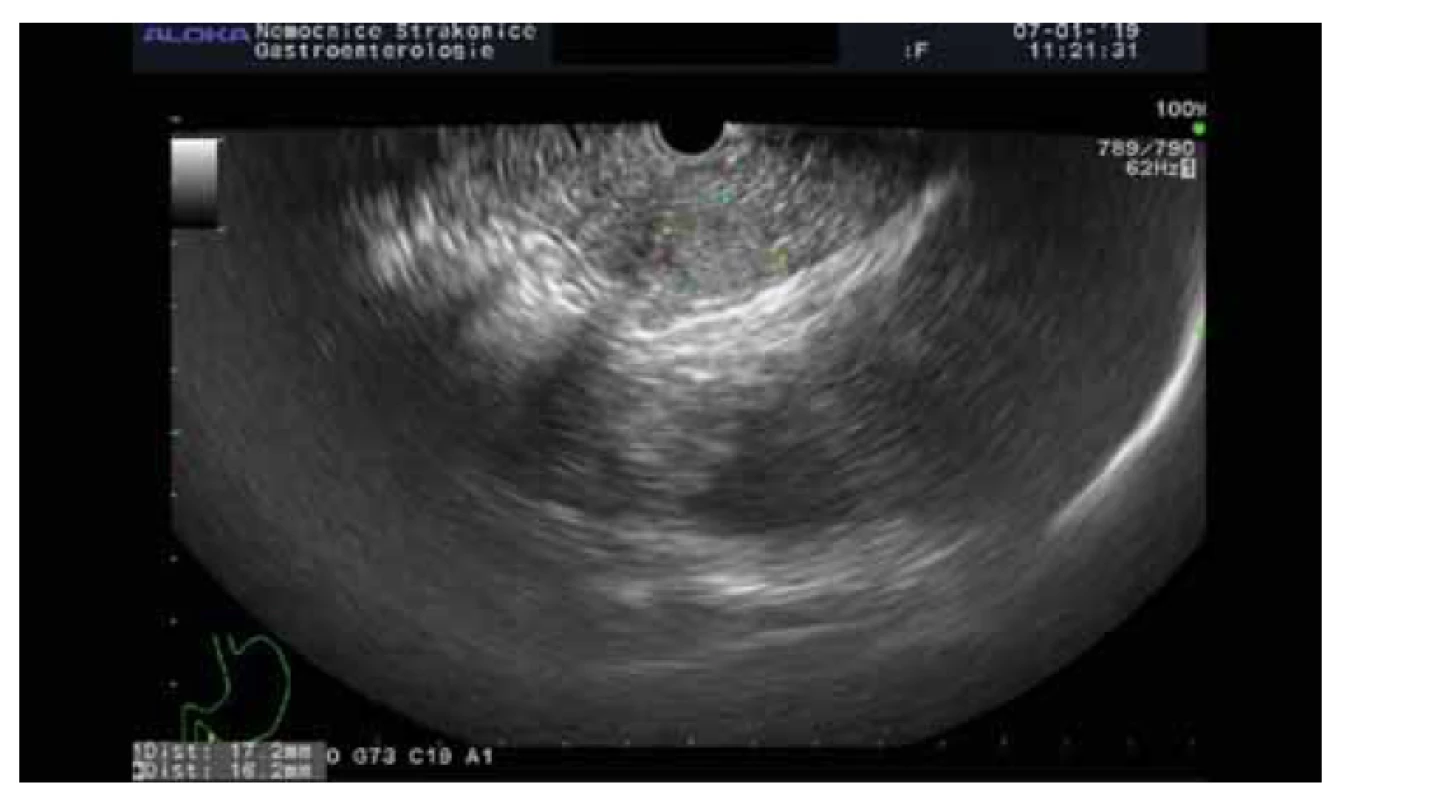
Jedná se o vzácné epiteliální neoplazie postihující mladé ženy s průměrným věkem 25 let. Vyskytují se kdekoli v pankreatu, jsou solitární, průměrně dosahují velikosti až 7,5 cm. Genetickým sekvenováním byly zjištěny jen ojedinělé genetické alterace. Rekurentní mutace byly zjištěny na onkogenu CTNNB1, který je za normálních okolností zaměřen na degradaci fosforylace. Vzácně jsou u solidní pseudopapilární neoplazie detekovány mutace v TP53 a PIK3CA, naproti tomu u tohoto druhu neoplazie se nevyskytují mutace KRAS, GNAS, RNF43, PTEN, CDKN2A, SMAD4 a VHL [21].
Klinická aplikace genetického testování
Zásadní poznatky o předoperační diagnostice mucinózních a vysoce rizikových cyst přinesla pittsburská studie, která hodnotila celkem 626 vzorků od 595 pacientů pomocí NGS a kohortu 159 vzorků hodnocených pomocí Sangerova sekvenování. KRAS/GNAS mutace měly 89% senzitivitu a 100% specificitu pro diagnózu mucinózní cysty za použití NGS, avšak pouze 65% senzitivitu při zachovalé 100% specificitě pomocí Sangerova sekvenování. Při použití kombinace KRAS/GNAS a TP53/PIK3CA/PTEN bylo dosaženo 89% senzitivity a 100% specificity pro vysoce rizikovou neoplazii, což bylo výrazně lepší než dosud používaná kritéria (dilatace vývodu, murální nodul, pozitivní cytologie, senzitivita 42, 32 a 32 %, specificita 74, 94 a 98 %) [23].
Při hodnocení genetického vyšetření aspirátu cyst je nezbytné srovnání s doposud existujícími a široce dostupnými metodami diagnostiky. Faias et al hodnotili 52 zmrazených vzorků na přítomnost mutací v exonu 8 a 9 genu GNAS a exonů 2 a 3 genu KRAS pomocí Sangerova sekvenování. Pro identifikaci mucinózní cysty byla hladina CEA > 192 ng/ml lepší než mutační analýza. Pouze u dvou pacientů došlo ke správné změně terapeutického postupu [29].
V recentní multicentrické studii bylo retrospektivně hodnoceno 37 resekovaných cyst a prospektivně 71 nově diagnostikovaných cyst pomocí cílené mutační analýzy NGS. V retrospektivní skupině došlo za pomoci NGS oproti cytologii k vzestupu senzitivity z 87,1 na 94,1 % a specificity z 50 na 100 % v diagnóze mucinózní cysty. V prospektivní části studie byl popsán vzestup senzitivity z 57 na 92 % v detekci mucinózní cysty a z 50 na 71 % v detekci rizikové neoplazie [30].
Zajímavé je srovnání dvou doplňujících metod – genetického vyšetření a endosonografické mikrobiopsie v systematickém review a metaanalýze osmi studií s 1 206 pacienty. V diagnóze benigních cyst byly tyto metody srovnatelné, avšak molekulární analýza byla lepší v diagnóze mucinózních a rizikových cyst (senzitivita 0,89 vs. 0,57 při srovnatelné specificitě 0,88). Překvapivě byla diagnostická výtěžnost vyšší u mikrobiopsie (0,73 vs. 0,54) [2].
Závěr
Se stoupajícím počtem diagnostikovaných pankreatických cyst, z nichž některé mají maligní potenciál, narůstá potřeba nalézt přesné a cenově dostupné diagnostické testy, které umožní jejich správnou diagnózu a odpovídající léčbu. Zásadním úkolem je rozpoznání a následné sledování či resekce rizikových cyst před jejich maligním zvratem a zároveň vyhnutí se zbytečnému sledování nebo operaci pacientů s pankreatickými cystami bez rizika. Současně běžně dostupné metody kombinující nález zobrazovacích metod s vyšetřením aspirátu cysty biochemicky a cytologicky mají diagnostické limitace. Molekulárně biologické vyšetření aspirátu poskytuje doplňující hodnotné informace pro přesnější diagnózu a může pomoci odlišit mucinózní léze a léze s vysokým rizikem malignity. Překonání limitů technické, technologické a finanční náročnosti umožní jeho větší dostupnost.
ORCID autorů
I. Horný ORCID 0000-0003-1398-9332,
T. Hucl ORCID 0000-0002-5648-4011.
Doručeno/Submitted: 16. 9. 2021
Přijato/Accepted: 28. 9. 2021
prim. MUDr. Ivo Horný
Interní oddělení
Nemocnice Strakonice, a. s.
Radomyšlská 336
386 29 Strakonice
Zdroje
1. Lee KS, Sekhar A, Rofsky NM et al. Prevalence of incidental pancreatic cysts in the adult population on MR imaging. Am J Gastroenterol 2010; 105 (9): 2079–2084. doi: 10.1038/ajg.2010. 122.
2. Faias S, Pereira L, Luís  et al. Genetic testing vs microforceps biopsy in pancreatic cysts: systematic review and meta-analysis. World J Gastroenterol 2019; 25 (26): 3450–3467. doi: 10.3748/wjg.v25.i26.3450.
3. Vege SS, Ziring B, Jain R et al. American gastroenterological association institute guideline on the diagnosis and management of asymptomatic neoplastic pancreatic cysts. Gastroenterology 2015; 148 (4): 819–822. doi: 10.1053/j.gastro.2015.01.015.
4. European study group on cystic tumours of the pancreas. European evidence-based guidelines on pancreatic cystic neoplasms. Gut 2018; 67 (5): 789–804. doi: 10.1136/gutjnl-2018-316027.
5. Plougmann JI, Klausen P, Karstensen JG et al. Molecular biomarkers have the potential to improve the diagnostic work-up of pancreatic cystic lesions. Scand J Gastroenterol 2017; 52 (9): 932–940. doi: 10.1080/00365521.2017.1333628.
6. Wang K-X, Ben Q-W, Jin Z-D et al. Assessment of morbidity and mortality associated with EUS-guided FNA: a systematic review. Gastrointest Endosc 2011; 73 (2): 283–290. doi: 10.1016/j.gie.2010.10.045
7. ASGE standards of practice committee, Khashab MA, Chithadi KV et al. Antibiotic prophylaxis for GI endoscopy. Gastrointest Endosc 2015; 81 (1): 81–89. doi: 10.1016/j.gie.2014.08. 008.
8. Hawes R, Fockens P, Varadarajulu S. Endosonography. [online]. Dostupné z URL: https: //www.elsevier.com/books/link/link/9780323221511.
9. Barresi L, Tarantino I, Ligresti D et al. A new tissue acquisition technique in pancreatic cystic neoplasm: endoscopic ultrasound-guided through-the-needle forceps biopsy. Endoscopy 2015; 47 Suppl 1 UCTN: E297–298. doi: 10.1055/s-0034-1392031.
10. Mittal C, Obuch JC, Hammad H, et al. Technical feasibility, diagnostic yield, and safety of microforceps biopsies during EUS evaluation of pancreatic cystic lesions (with video). Gastrointest Endosc. 2018; 87 (5): 1263-1269. doi: 10.1016/j.gie.2017.12.025
11. Basar O, Yuksel O, Yang DJ et al. Feasibility and safety of microforceps biopsy in the diagnosis of pancreatic cysts. Gastrointest Endosc 2018; 88 (1): 79–86. doi: 10.1016/j.gie.2018.02.039
12. Zhang ML, Arpin RN, Brugge WR et al. Moray micro forceps biopsy improves the diagnosis of specific pancreatic cysts. Cancer Cytopathol 2018; 126 (6): 414–420. doi: 10.1002/cncy.21988.
13. Walsh RM, Henderson JM, Vogt DP et al. Prospective preoperative determination of mucinous pancreatic cystic neoplasms. Surgery 2002; 132 (4): 628–634. doi: 10.1067/msy.2002.127543.
14. Thosani N, Dasari CS, Bhutani MS et al. Molecular pathogenesis of intraductal papillary mucinous neoplasms of the pancreas. Pancreas 2010; 39 (8): 1129–1133. doi: 10.1097/MPA.0b013e3181f66cdf.
15. Frossard JL, Amouyal P, Amouyal G et al. Performance of endosonography-guided fine needle aspiration and biopsy in the diagnosis of pancreatic cystic lesions. Am J Gastroenterol 2003; 98 (7): 1516–1524. doi: 10.1111/j.1572 - 0241.2003.07530.x.
16. Nakai Y, Iwashita T, Shinoura S et al. Role of serial EUS-guided FNA on pancreatic cystic neoplasms: a retrospective analysis of repeat carcinoembryonic antigen measurements. Gastrointest Endosc 2016; 84 (5): 780–784. doi: 10.1016/j.gie.2016.03.1500.
17. Al-Rashdan A, Schmidt CM, Al-Haddad M et al. Fluid analysis prior to surgical resection of suspected mucinous pancreatic cysts. A single centre experience. J Gastrointest Oncol 2011; 2 (4): 208–214. doi: 10.3978/j.issn.2078-6891. 2011.020.
18. Gaddam S, Ge PS, Keach JW et al. Suboptimal accuracy of carcinoembryonic antigen in differentiation of mucinous and nonmucinous pancreatic cysts: results of a large multicenter study. Gastrointest Endosc 2015; 82 (6): 1060–1069. doi: 10.1016/j.gie.2015.04.040.
19. de Pretis N, Mukewar S, Aryal-Khanal A et al. Pancreatic cysts: diagnostic accuracy and risk of inappropriate resections. Pancreatology 2017; 17 (2): 267–272. doi: 10.1016/j.pan.2017.01.002.
20. Khalid A, McGrath KM, Zahid M et al. The role of pancreatic cyst fluid molecular analysis in predicting cyst pathology. Clin Gastroenterol Hepatol 2005; 3 (10): 967–973. doi: 10.1016/s1542-3565 (05) 00409-x.
21. Theisen BK, Wald AI, Singhi AD. Molecular diagnostics in the evaluation of pancreatic cysts. Surg Pathol Clin 2016; 9 (3): 441–456. doi: 10.1016/j.path.2016.04.008.
22. Reid MD, Choi H, Balci S et al. Serous cystic neoplasms of the pancreas: clinicopathologic and molecular characteristics. Semin Diagn Pathol 2014; 31 (6): 475–483. doi: 10.1053/ j.semdp.2014.08.009.
23. Singhi AD, McGrath K, Brand RE et al. Preoperative next-generation sequencing of pancreatic cyst fluid is highly accurate in cyst classification and detection of advanced neoplasia. Gut 2018; 67 (12): 2131–2141. doi: 10.1136/gutjnl - 2016-313586.
24. Wu J, Jiao Y, Molin MD et al. Whole-exome sequencing of neoplastic cysts of the pancreas reveals recurrent mutations in components of ubiquitin-dependent pathways. Proc Natl Acad Sci 2011; 108 (52): 21188–21193. doi: 10.1073/pnas.1118046108.
25. Biankin AV, Biankin SA, Kench JG et al. Aberrant p16 (INK4A) and DPC4/Smad4 expression in intraductal papillary mucinous tumours of the pancreas is associated with invasive ductal adenocarcinoma. Gut 2002; 50 (6): 861–868. doi: 10.1136/gut.50.6.861.
26. Farrell JJ, Toste P, Wu N et al. Endoscopically acquired pancreatic cyst fluid microRNA 21 and 221 are associated with invasive cancer. Am J Gastroenterol 2013; 108 (8): 1352–1359. doi: 10.1038/ajg.2013.167.
27. Matthaei H, Wylie D, Lloyd MB et al. miRNA biomarkers in cyst fluid augment the diagnosis and management of pancreatic cysts. Clin Cancer Res 2012; 18 (17): 4713–4724. doi: 10.1158/1078-0432.CCR-12-0035.
28. Utomo WK, Looijenga LH, Bruno MJ et al. A microRNA panel in pancreatic cyst fluid for the risk stratification of pancreatic cysts in a prospective cohort. Mol Ther Nucleic Acids 2016; 5 (8): e350. doi: 10.1038/mtna.2016.61.
29. Faias S, Duarte M, Albuquerque C et al. Clinical impact of KRAS and GNAS analysis added to CEA and cytology in pancreatic cystic fluid obtained by EUS-FNA. Dig Dis Sci 2018; 63 (9): 2351–2361. doi: 10.1007/s10620-018 - 5128-y.
30. Haeberle L, Schramm M, Goering W et al. Molecular analysis of cyst fluids improves the diagnostic accuracy of pre-operative assessment of pancreatic cystic lesions. Sci Rep 2021; 11 (1): 2901. doi: 10.1038/s41598-021-81065-2.
31. Zhang ML, Pitman MB. Practical applications of molecular testing in the cytologic diagnosis of pancreatic cysts. J Mol Pathol 2021; 2 (1): 11–22. doi: https: //doi.org/10.3390/jmp2010002.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článek Gastrointestinálna onkológiaČlánek Kvíz z klinické praxeČlánek Recenze knihČlánek Videomaraton
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2021 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Gastrointestinální onkologie – mezioborová spolupráce
- Gastrointestinálna onkológia
- Kvíz z klinické praxe
- Endoscopic ultrasound fine-needle aspiration of pancreatic cystic lesions – a single-centre experience, and comparison with resection histology
- Screening karcinomu pankreatu: nastal čas vykročit?
- Primárny lymfóm pankreasu – kazuistika
- The potential of spectroscopy in the diagnosis of hepatocellular carcinoma – a pilot study
- Roboticky asistovaná léčba zhoubných nádorů kolorekta a hepatopankreatobiliární oblasti
- Role molekulární biologie v diferenciální diagnostice pankreatických cystických neoplazií
- Postavení miniinvazivní a robotické chirurgie v léčbě nádorů jícnu a žaludku
- Diagnostika a endoskopická intervence u raritního MALT lymfomu proximálního jejuna
- Monocentrická retrospektívna analýza asociácie hidradenitis suppurativa a chronických zápalových ochorení čreva
- Jak mohou ledviny ovlivnit léčbu pacientů s gastroenterologickými chorobami
- Komentář k doporučení Americké gastroenterologické asociace (AGA) pro léčbu středně těžké a těžké Crohnovy nemoci
- Recenze knih
- Životné jubileum prof. MUDr. Rudolfa Hyrdela, CSc
- Prof. MUDr. Marian Bátovský, CSc., MPH, 70-ročný
- Za Ivanom, kolegom, priateľom, ktorý nás učil žiť... MUDr. Ivan Bunganič (1952–2021)
- Výběr z mezinárodních časopisů
- Správná odpověď na předchozí kvíz Buried karcinom
- Kreditovaný autodidaktický test: gastrointestinální onkologie
- 7. kongres ČGS ČLS JEP 10.–12. listopadu 2021 Virtuální konference
- Videomaraton
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Screening karcinomu pankreatu: nastal čas vykročit?
- Postavení miniinvazivní a robotické chirurgie v léčbě nádorů jícnu a žaludku
- Primárny lymfóm pankreasu – kazuistika
- Role molekulární biologie v diferenciální diagnostice pankreatických cystických neoplazií
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



