-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Klinické využití protilátek u roztroušené sklerózy
Clinical use of antibodies in multiple sclerosis
There is much evidence to implicate B cells and antibody immunity in the pathogenesis of multiple sclerosis (MS) in the last decade. The presence of cerebrospinal fluid oligoclonal bands of IgG class not detectable in serum provides powerful evidence for the diagnosis of MS, since it occurs in 95 % of patients with MS. The determination of antibody specificity has been unsuccessful so far. The search for an antibody or a combination of antibodies continues in order to improve the diagnosis, the classification and the prediction of the further course. Antimyelin antibodies to myelin oligodendrocyte glycoprotein and myelin basic protein are the most popular in the recent years. Their prognostic value originally accepted with a great expectation is not confirmed with the latest data. Evidence of axonal pathology was reflected in the interest in antiaxonal antibodies. The results are not consistent, however. New methods and analysis of other factors of humoral immunity may result in identifying antibodies as biological markers of MS.
Key words:
multiple sclerosis, cerebrospinal fluid, antibody, intrathecal synthesis, oligoclonal bands, immunoglobulins
Autori: A. Bartoš
Pôsobisko autorov: Neurologická klinika 3. LF UK a FNKV, Praha
Vyšlo v časopise: Cesk Slov Neurol N 2008; 71/104(1): 26-33
Kategória: Přehledný referát
Súhrn
V poslední době přibývá dokladů o úloze B-lymfocytů a protilátkové imunity v patogenezi roztroušené sklerózy (RS). Klinicky se využívá přítomnosti oligoklonálních pásů IgG v mozkomíšním moku bez sérového korelátu jako významné podpory pro diagnózu RS, protože se vyskytuje až u 95 % pacientů s RS. Hledání protilátkové specifity bylo neúspěšné. Přesto se v séru nebo mozkomíšním moku pacientů zkouší nalézt protilátka nebo kombinace protilátek, které by zlepšily diagnostiku nebo klasifikaci klinických forem nebo které by předpovídaly další průběh onemocnění. V současnosti jsou předmětem zájmu antimyelinové protilátky proti myelinovému oligodendrocytárnímu glykoproteinu a myelinovému bazickému proteinu. Jejich prognostická hodnota se posledními poznatky nepotvrzuje. Průkaz axonálního postižení se také odrazil v zájmu o antiaxonální protilátky u pacientů s RS, avšak výsledky nejsou zatím konzistentní. Nové metodické postupy a analýzy dalších faktorů protilátkové imunity jsou nadějí pro použití protilátek jako biologických ukazatelů RS.
Klíčová slova:
roztroušená skleróza, mozkomíšní mok, protilátky, intratekální sytnéza, oligoklonální pásy, imunoglobulinyÚvod
Autoimunitní charakter roztroušené sklerózy (RS) je podmíněn nejen buněčnými mechanizmy, ale také změnami v humorální imunitě. B-buňky, plazmatické buňky, složky komplementu a různé protilátky byly nalezeny v mozkových lézích, v séru nebo mozkomíšním moku pacientů s RS (obr. 1) [1-4]. Protilátky u RS mohou být ukazatelem choroby jako její sekundární epifenomén, mohou být primárně patogenní nebo naopak protektivní [5]. Jedním z možných patogenetických mechanizmů RS je protilátkově vázaná demyelinizace [6]. S tím může souviset příznivý efekt intravenózních imunoglobulinů a plazmaferézy při léčbě RS [7,8]. Nově se zkouší léčba RS pomocí monoklonální protilátky proti CD20 (rituximab) vedoucí ke snížení B-lymfocytů a T-lymfocytů [9].
Obr. 1. Schematické znázornění interakce plazmocytů s nervovým vláknem, produkce protilátek a axonálního přerušení a demyelinizace 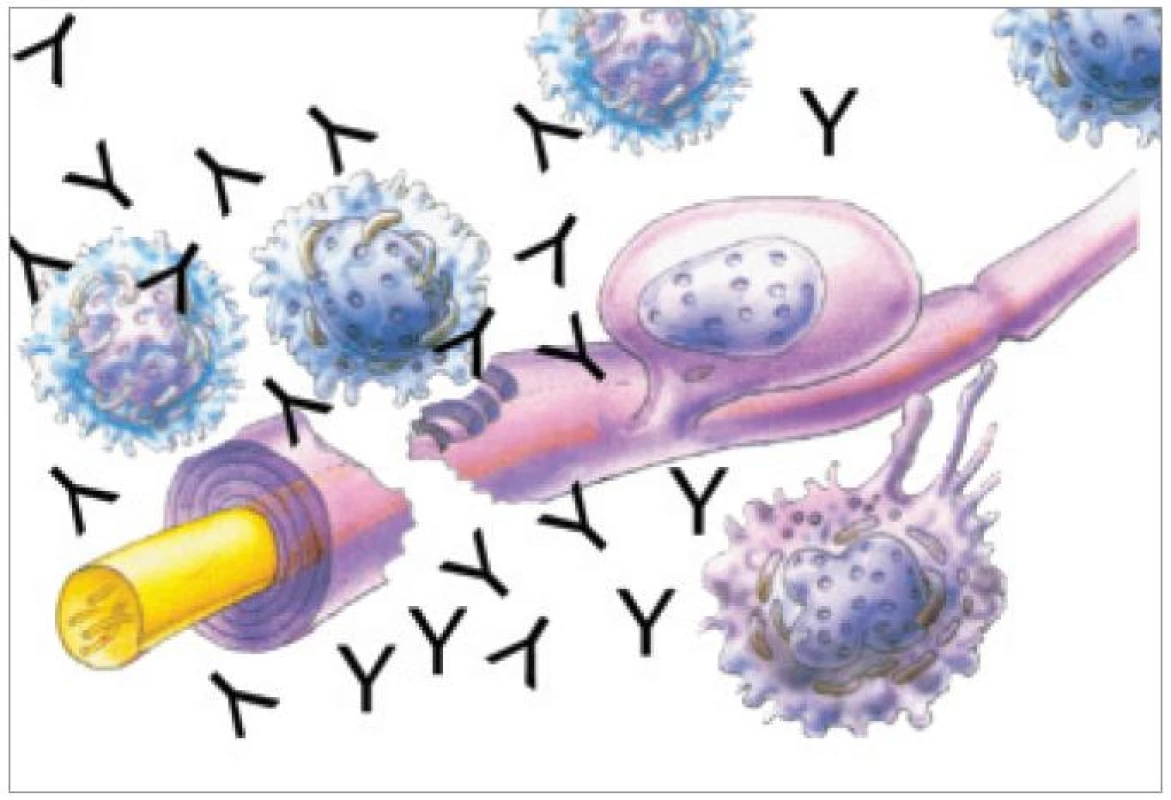
Protilátky u RS mohou být součástí obecné „nonsense“ protilátkové odpovědi, autoimunitní reakcí na nějaký antigen nebo se může při jejich tvorbě uplatňovat fenomén zvaný molekulární mimikry (viz dále). U pacientů s RS jsou protilátky namířené proti různým antigenům:
- cizorodé antigeny – např. viry (viry spalniček, zarděnek, varicella-zoster a herpes simplex) [10-12], lidský herpesvirus typ 6 [13] a jiná infekční agens – Pseudomonas aeruginosa, Acinetobacter spp [14,15], Chlamydophila pneumoniae [16]
- vlastní autoantigeny neuronů nebo oligodendrocytů [1,2,4,17]:
- proteiny a komplexní molekuly myelinu – myelinový bazický protein (MBP), myelinový oligodendrocytární glykoprotein (MOG), glykoprotein asociovaný s myelinem (MAG), proteolipidový protein (PLP), sulfatidy, gangliosidy, Nogo-A a jeho receptor, galaktocerebrosid [18-25]
- axonální proteiny – tubulin, neurofilamenta [14,26-30]
- vlastní ostatní autoantigeny [17] – např. antikardiolipinové protilátky, protilátky proti nukleárním a tyreoidálním mikrosomálním antigenům, protilátky proti bílkovinám tepelného šoku tzv. heat shock proteins, protilátky proti proteazomu, jadernému ribonukleoproteinu, dvojšroubovici DNA, synapsinu [23,31-36]
- antigeny „nonsense“ specifity
Není jasné, zda B-buněčná odpověď je výsledkem určité charakteristické reakce v rámci RS vyvolávané přítomností antigenu nebo zda se jedná o nespecifickou polyklonální B-buněčnou aktivaci bez vazby na RS. Zdá se, že alespoň část imunitní reakce je vyvolávána antigenem [37]. Na hledání specificity sérových nebo mozkomíšních imunoglobulinů bylo vynaloženo velké úsilí, ale antigenní cíl převažující části intratekálních protilátek není dosud jasný [17,38]. Z četných studií vyplývá velká heterogenita protilátek, pravděpodobně jako součást polyspecifické humorální odpovědi u RS. Jedním z vysvětlení je fenomén tzv. rozšiřování epitopů. Po úvodní zánětlivé příhodě se uvolněním nových antigenů může aktivovat autoreaktivní buněčná a humorální imunitní odpověď, která zahrnuje další myelinové a nemyelinové antigeny nebo epitopy [39]. Protilátky mohou vznikat jako autoimunitní duální reakce na různé antigeny se strukturální podobností fenoménem tzv. molekulárních mimikry. Exogenní struktury (např. peptidy odvozených od virových partikulí nebo bakterií) mohou vytvářet protilátky, které zkříženě reagují s neuronálními antigeny [40-42].
Cílem klinického využití protilátek je zpřesnění diagnózy, identifikace rizikovějších pacientů, prognózování dalšího osudu nemocného a vhodná volba léčebné strategie. Lze přitom sledovat dva hlavní směry využívající jednak celkové a jednak specifické protilátky.
Klinické využití celkových protilátek u roztroušené sklerózy
Konstantním rysem pacientů s RS je intratekální syntéza imunoglobulinů IgG v mozkomíšním moku (MMM). Proto nález autochtonní produkce IgG významně podporuje diagnózu RS. Intratekální syntéza se prokazuje kvalitativně přítomností oligoklonálních IgG pásů v mozkomíšním moku nebo kvantitativně zvýšenou produkcí IgG v CNS [43-45].
Dva nebo více oligoklonálních pásů IgG v MMM bez odpovídajících sérových pásů odráží lokální reakci B-buněk v CNS. IgG pásy znamenají izoelektrickou fokusací rozdělené IgG vyskytující se v MMM nebo séru. Každý pás je tvořen homogenní skupinou imunoglobulinů – protilátek, které jsou produkovány jednou populací identických B-lymfocytů (tzv. klonem). Imunoglobuliny mohou do MMM přestoupit také z krve. Několik klonů B lymfocytů (tzv. oligo) produkuje lokálně protilátky, které se při vyšetření projeví jako oligoklonální pásy IgG. Autoimunitní produkce protilátek v CNS se potvrdí tím, že některé oligoklonální pásy se detekují výhradně v MMM a nikoli v séru od téže osoby (obr. 2). Při použití standardizované metodiky (nejlépe separace bílkovin izoelektrickou fokusací následované imunoblotingem) má asi 95 % pacientů s RS detekovatelné mozkomíšní pásy IgG, aniž by byly podobné pásy zjistitelné v séru [46]. Specifita bývá kolem 85-90 % [44]. Pro detekci oligoklonálních pásů IgG byl nedávno vyvinut nový test, který je více senzitivní (až 96 %), specifický (až 99,5 %) a snadnější k interpretaci než dříve popsané metodiky [47]. Jakmile jsou oligoklonální pásy v mozkomíšním moku vytvořeny, přetrvávají u jednotlivého pacienta bez ohledu na průběh RS nebo léčbu [46].
Obr. 2. Přítomnost oligoklonálních IgG pásů v mozkomíšním moku, které nejsou v séru (z archivu vyšetření provedených autorem při stážích v neuroimunologické laboratoři v Innsbrucku, Rakousko, 2002 a 2003) 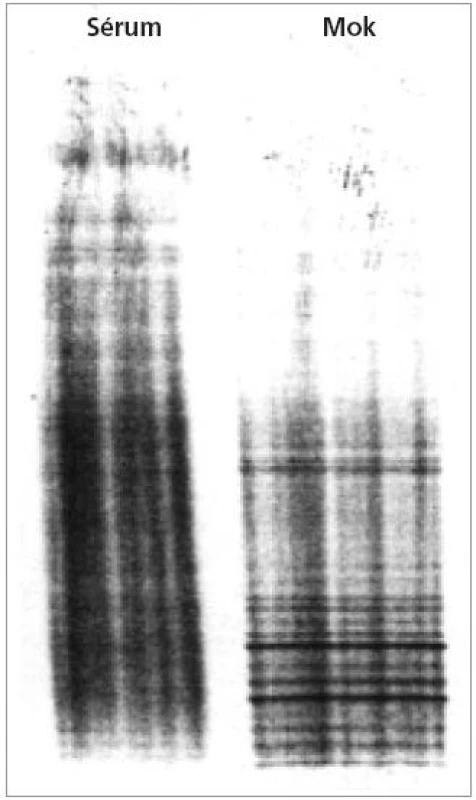
K určení množství IgG produkovaných lokálně v CNS existují různé výpočty. Mezi nejznámnější a nejpoužívanější patří Linkův IgG index a Reiberova formule a diagram [48]. Výhodou tohoto přístupu je kvantitativní zhodnocení a rychlejší a snadnější provedení než analýza oligoklonálních pásů. IgG index (bezrozměrné číslo) je roven poměru koncentrací IgG v MMM/séru (tzv. IgG kvocient) vztažený k poměru koncetrací albuminu v MMM/séru (tzv. albuminový kvocient). IgG index je zvýšen asi u 70 % pacientů s RS a vzácně u pacientů s chybějícími oligoklonálními pásy v MMM [46]. Výpočet podle Reiberovy formule zohledňuje hyperbolický vztah mezi albuminovým a IgG kvocientem a zavádí limitní IgG kvocient na základě měření obrovského množství vzorků pacientů. Výsledek v mg/l nebo % lze vypočítat podle složitého vzorce nebo najít v tzv. Reiberově diagramu vyjadřující vztah mezi IgG a albuminovým kvocientem (obr. 3) [48]. Intratekální syntéza celkových IgG je podle této formule zvýšena u 72 % pacientů s roztroušenou sklerózou [49]. Oba typy výpočtů se považují za stejně citlivé u RS jako většinou u stavu bez poruchy hematolikvorové bariéry, tj. s normálním albuminovým kvocientem [50]. Vzhledem k nižší senzitivitě nemohou být ani IgG index ani Reiberova formule doporučeny jako náhrada oligoklonálních pásů IgG v diagnostice RS [46]. Zlatým standardem je tedy v současnosti stanovení oligoklonálních pásů IgG v MMM metodou izoelektrické fokusace [43-45].
Obr. 3. Reiberův diagram vyjadřující souvislost mezi imunoglobulinovým kvocientem Q IgG (poměr koncentrací IgG v moku a séru) a albuminovým kvocientem Q alb (poměr koncentrací albuminu v moku a séru). Čtvereček ukazuje příklad průsečíku obou hodnot osoby bez poruchy hematolikvorové bariéry a bez autochtonní tvorby protilátek (z likvorové laboratoře Neurologické kliniky FNKV, 3. LF UK) 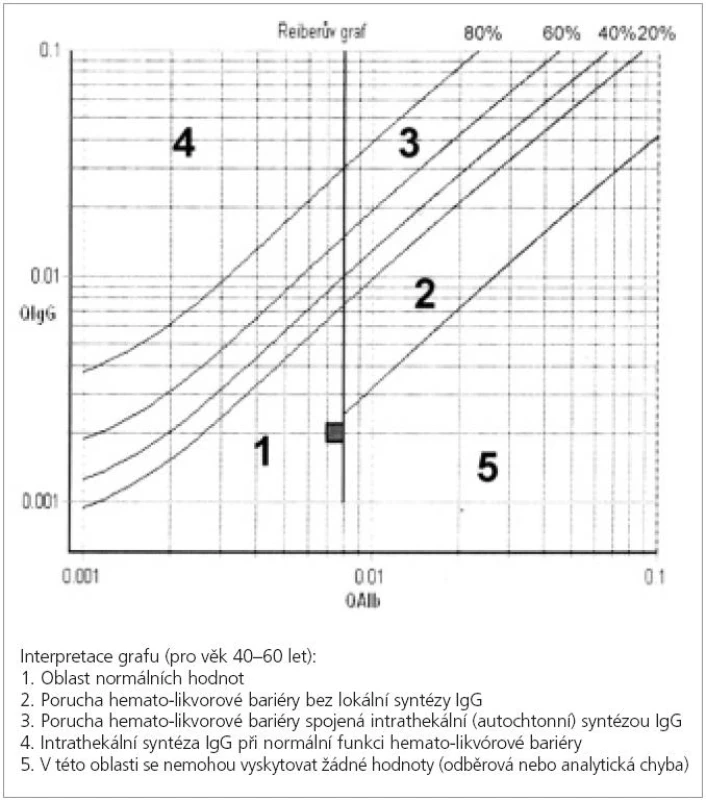
V poslední době se pozornost upíná na předpovědní hodnotu celkové protilátkové reakce. Pacienti s RS se zvýšeným IgG indexem (zvýšenou intratekální syntézou celkových IgG protilátek) mohou mít vyšší riziko progrese choroby [51]. Pacienti s intratekální syntézou protilátek ve třídě IgM mají větší pravděpodobnost konverze do roztroušené sklerózy, častější ataky a horší průběh s větší invalidizací než pacienti bez intratekální IgM syntézy [52,53]. Pacienti po klinicky izolovaném syndromu s prokázanou intratekální syntézou oligoklonálními IgG mají větší riziko zvratu do RS. Přítomnost oligoklonálních pásů IgG v MMM je vysoce specifická (94 %) a senzitivní (91 %) pro konverzi pacientů s první atakou RS do klinicky jisté RS určené druhou atakou. To je užitečná informace na počátku onemocnění, zvl. s normálním nálezem na magnetické rezonanci (MR) mozku [54,55]. Naopak pacienti s chyběním oligoklonálních IgG pásů v MMM mají delší fázi relaps-remitujícího období a pozdější nástup progrese invalidizace [16].
Klinické využití protilátek proti specifickým strukturám u roztroušené sklerózy
Současný výskyt protilátek proti virům spalniček, zarděnek a varicella-zoster (MRZ) u jedné osoby s jiným onemocněním než RS je nepravděpodobný, což se může uplatňovat v diferenciální diagnostice autoimunitních onemocnění. Tato tzv. MRZ reakce doplňuje výsledek oligoklonálních pásů o větší specificitu pro onemocnění RS [10-12]. Novinkou zasluhující ověření jsou protilátky proti galaktocerebrosidu, které jsou specifické pro RS a nebyly nalezeny u zdravých osob na rozdíl od antimyelinových protilátek [24]. Novou nadějnou protilátkou, která by mohla být použita k diagnostice a monitoraci RS za pomoci jednoduchého krevního testu, je protilátka proti jednomu typu z glykanů, které se vyskytují na povrchu buněk. Hladiny IgM protilátek proti Gα4Gα byly významně vyšší v séru pacientů s RS bez ohledu na stadium či léčbu oproti pacientům s jinými neurologickými nemocemi nebo dalšími autoimunitními chorobami (senzitivita 57 %, specificita 85 %) [56].
Sérová autoprotilátka IgG specifická pro neuromyelitis optica (anti-NMO) se váže selektivně k akvaporinu 4. Akvaporin 4 je membránový proteinový kanál pro průchod vody [57]. Optická neuromyelitida je zánětlivé demyelinizační onemocnění, které selektivně postihuje zrakové nervy a míchu. Často bývá zaměňována za RS nebo bývá považovaná za těžkou variantu RS. Doposud nebyl k dispozici rozlišující ukazatel. Anti-NMO IgG protilátka je novým druhem imunoglobulinu u autoimunitně podmíněných poruch membránových kanálů podporující diagnózu optické neuromyelitidy [58].
Jiným typem imunoglobulinů jsou protilátky proti neuronálním autoantigenům – antimyelinové a antiaxonální protilátky.
Antimyelinové protilátky u roztroušené sklerózy
Možnými terči pro protilátky u RS jsou myelinové nebo oligodendrocytární proteiny, které jsou na povrchu dobře přístupné imunitnímu systému. Mezi takové potenciální kandidáty patří: myelinový bazický protein, proteolipidový protein, glykoprotein sdružený s myelinem, 2´,3´-cyklická nukleotid 3´ - fosfodiesteráza a myelinový oligodendrocytární glykoprotein (obr. 4) [59].
Obr. 4. Schematické znázornění rozmístění hlavních proteinů v myelinové pochvě (MOG – myelinový oligodendrocytární glykoprotein, MBP – myelinový bazický protein, MAG – glykoprotein asociovaný s myelinem, PLP – proteolipidový peptid) (převzato z Krejsek et al. Neurol pro praxi 2002; se souhlasem). 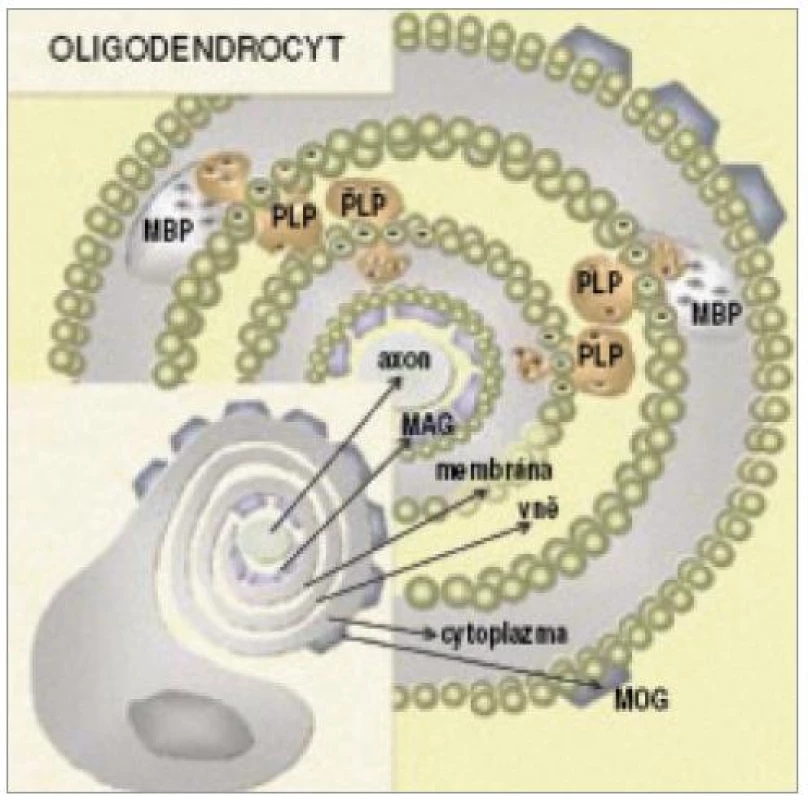
Myelinový bazický protein (MBP) tvoří největší, asi 30% podíl mezi myelinovými proteiny a je tradičně považován za hlavní cíl imunitní odpovědi u RS. Výsledky detekce sérových a mozkomíšních protilátek proti MBP u pacientů s RS jsou rozporuplné, i když se převážně nalezly ve zvýšené míře u pacientů s RS než u zdravých jedinců. Je to dáno jednak různými imunochemickými metodikami detekce protilátek a zřejmě i různými populacemi pacientů s RS. Četnost anti-MBP protilátek vzrůstá u pacientů s RS po první atace (12 %) do období relaps-remitujícího (32 %) a dále v chronické progresi (40 %). Jsou považovány za ukazatel neurologického poškození spíše než za primární příčinu [60-62].
Myelinový oligodendrocytární glykoprotein (MOG) může být důležitým imunitním terčem u RS, přestože zaujímá pouze malou část myelinových proteinů (nejvíce 0,05 %). MOG je specifickým proteinem CNS, je lokalizován výlučně na zevní části oligodendrogliální membrány a myelinu a je silně imunogenní [17].
U pacientů s RS byla zjištěna zvýšená frekvence buněk produkujících protilátky proti MBP nebo PLP [63]. U řady pacientů s RS se nalezly protilátky proti extracelulární části MOG s převahou IgM třídy. Protilátky proti MOG se vyskytují v séru a mozkomíšním moku u třetiny pacientů již v době první ataky RS. Protilátky jsou přítomny ve stabilním titru a ve stejné četnosti u všech stadií RS. Reakce proti MOG se objevuje i u meningitid. U nich však protilátky časem vymizí, zatímco u RS přetrvávají [61]. Imunomodulační léčba interferonem beta nebo glatiramer acetatem nemá větší vliv na anti-MOG imunoreaktivitu po jednom roce léčby [64].
Jedním z významných pokusů předpovídat další osud pacientů po první atace roztroušené sklerózy bylo ověření vztahů mezi přítomností sérových antimyelinových protilátek a klinickým vývojem onemocnění. Pacienti se sérovými anti-MOG a anti-MBP protilátkami měli relapsy častěji a dříve než pacienti bez těchto protilátek. Séropozitivní pacienti pro obě protilátky vyvinuli druhou atakou klinicky jistou RS častěji (95 % vs 23 %) a dříve (7 měsíců vs 45 měsíců) oproti séronegativním pacientům [20]. V jiné studii pacienti s oběma typy protilátek proti MOG a MBP měli druhou ataku významně dříve než seronegativní pacienti (5 měsíců vs 25 měsíců) [65].
Následné průřezové studie zabývající se porovnáním pacientů s RS a kontrol z hlediska anti-MOG protilátek přinesly rozporuplné výsledky. Protilátky proti MOG jsou v mozkomíšním moku pacientů s RS zvýšeny (30 %) ve srovnání s kontrolními jedinci (8 %) [22]. Sérové protilátky proti nativnímu glykosylovanému MOG byly měřeny ELISA metodou u pacientů s RS a kontrolních jedinců. Anti-MOG protilátky byly zvýšené u pacientů s první atakou RS. Vyšší anti-MOG IgG protilátky byly nalezeny u pacientů s atakou a u sekundárně progresivních pacientů s RS při srovnání s pacienty v remisi nebo zdravými kontrolami [66]. Hladina protilátek IgG, ale ne IgM, proti nativnímu proteinu MOG měřená vysoce senzitivním testem byla u pacientů s RS (a zejména s primárně progresivní formou) zvýšená oproti různým kontrolním skupinám [67]. Naproti tomu sérové anti-MOG protilátky měřené radioimunotestem (RIA) metodou v kapalné fázi ve třídě IgM i IgG byly nalezeny se stejnou četností u pacientů s RS a zdravých jedinců [68]. V dalších studiích se ukazuje, že přítomnost anti-MOG protilátek u pacientů s RS je podobná jako u pacientů s různými neurologickými diagnózami [25,69,70]. Tyto diskrepance lze vysvětlit rozdílnými populacemi pacientů, použitím různých antigenů – rekombinantních [21,25,68,69] nebo nativních [66,67,70] proteinů MOG a stanovování různými technikami – westernblot [20,25], ELISA [66,69,70] a RIA v kapalné fázi [68]. Rekombinantní proteiny neobsahují posttranslační modifikace (jako např. fosforylace či glykosylace), které mohou měnit významně terciární strukturu bílkoviny nezbytnou pro vazbu protilátek. Proto použití nativního a rekombinantního proteinu může dávat různé výsledky. Dalším vysvětlením je, že anti-MOG protilátky nejsou zřejmě specifické pro RS a vyskytují se i u kontrolních jedinců [25,69,70].
Změněná struktura proteinu MOG v ELISA uspořádání překonává nová metodika. Ta je založena na vazbě IgG k lidskému proteinu MOG s jeho přirozenou konformací vyskytující se v membráně savčích buněk. Při srovnání se zdravými jedinci byly protilátky IgG proti MOG nalezeny ve zvýšené míře u pacientů s první atakou RS a pacientů v relabující-remitující fázi, hraničně u sekundárně progresivních forem RS, a vůbec ne u primární progrese RS. Z toho plyne, že epitopy na přirozeném glykosylovaném proteinu MOG in vivo jsou časným cílem patogenních protilátek a nemusí být detekovány klasickou ELISA metodou [71].
Poslední pozorování vyvrátila naděje vkládané do antimyelinových protilátek k prognózování pacientů s první atakou RS. Velká studie s více než 400 pacienty neprokázala předpovědní hodnotu sérových protilátek proti MOG a MBP pro progresi do klinicky jisté roztroušené sklerózy [72]. Nedávno bylo zveřejněno několik studií, ve kterých se nepotvrdila souvislost mezi přítomností antimyelinových protilátek a časnějším přechodem nebo vyšším rizikem konverze do klinicky jisté RS [65,72-75].
Antiaxonální protilátky u roztroušené sklerózy
V posledních letech došlo s novými poznatky k přehodnocení některých názorů na roztroušenou sklerózu (RS). Původně se tradovalo, že se jedná o autoimunitní demyelinizační onemocnění postihující roztroušeně bílou hmotu centrálního nervového systému (CNS). Vlnu velkého zájmu o axonální problematiku spustily doklady o přerušení axonů jak imunohistochemickými metodikami, tak na MR mozku a míchy. Ukázalo se, že k axonálnímu poškození dochází u RS nejen v zánětlivých ložiscích, ale i ve zdánlivě normální tkáni bílé i šedé hmoty CNS od časných stadií RS [76-78].
Dnes se choroba považuje za vytrvale probíhající autoimunitní a neurodegenerativní proces bílé i šedé hmoty CNS zahrnující demyelinizační i axonální poškození již od časných fází. Axonální poškození u roztroušené sklerózy může být zodpovědné za trvalý nebo narůstající neurologický deficit a být cílem neuroprotektivní léčby. Proto má význam hledat ukazatele tohoto pochodu také v mozkomíšním moku nebo séru.
V rámci autoimunitní povahy onemocnění se mohou vytvářet protilátky proti strukturám specifických pro axon. Typickou cytoskeletální bílkovinou pro neuron jsou neurofilamenta, která se skládají ze tří podjednotek: lehké (light - NFL), střední (medium – NFM) a těžké (heavy – NFH). Protilátky proti neurofilamentům se mohou podílet na poranění axonu, což zatím experimentálně nebylo prokázáno. Axonální přerušení a následná Wallerova degenerace distální části vede k uvolnění neurofilament. Autoimunitní odpověď namířená proti těmto jinak skrytým antigenům může být provázena tvorbou protilátek jako sekundární epifenoménem autodestrukčních procesů (obr. 1). Anti-neurofilamentové (anti-NF) protilátky v séru a mozkomíšním moku u pacientů s RS, bez ohledu na jejich primární nebo sekundární roli, tak obecně mohou odrážet axonální patologii. Přestože axonální proteiny jsou skryté uvnitř nervového vlákna, tvorbu protilátek proti cytoskeletu to nevylučuje. Po poškození nervové tkáně se mohou cytoskeletální proteiny dostat do interakce s dysregulovaným imunitním systémem (fenomén tzv. rozšiřování epitopů). Jsou také známy paraneoplastické syndromy, při kterých se protilátky mohou vázat na cytoplazmatické nebo jaderné struktury neuronů [79,80]. Navíc se může uplatňovat fenomén molekulárních mimikry [40]. Literatura na detekci antiaxonálních protilátek u roztroušené sklerózy je nepoměrně chudší než problematika antimyelinových protilátek.
Protilátky ve třídě IgA, IgM a IgG proti směsi lehkých, středních a těžkých neurofilament byly zvýšené u pacientů s RS oproti pacientům s ikty nebo zdravým osobám [14]. Intratekální produkce anti-NFL protilátek byla významně zvýšená u pacientů s RS s primárně nebo sekundárně progresivním průběhem. Hladina protilátek proti NFH byla u pacientů s RS podobná jako u kontrolních jedinců. Protilátky proti NFL a NFH souvisely s trváním choroby a mírou invalidity [26]. Intratekální produkce protilátek proti NFL pacientů s RS korelovala s atrofickými změnami na MR mozku [27]. Sérové IgG protilátky proti NFL byly významně zvýšené u pacientů s primárně progresivním průběhem RS [28]. Intratekální produkce protilátek IgM a IgG proti střední podjednotce NFM u pacientů s RS byla vyšší než u kontrolních osob [30]. Hladina intratekálních protilátek IgG proti lehké podjednotce NFL nebyla jednoznačně zvýšená u pacientů s RS a v případě IgM typu protilátek byla stejná jako u věkově vázaných kontrolních osob [29]. Nepodařilo se najít nějakou podskupinu pacientů se společnými rysy RS, u kterých byla intratekální syntéza antineurofilamentových protilátek zvýšená. Na rozdíl od intratekálních protilátek se absolutní hladiny protilátek proti NFL či NFM v séru nebo mozkomíšním moku zásadně neodlišovaly mezi pacienty RS a kontrolními jedinci [29,30].
Závěr
Průkaz oligoklonálních IgG pásů v mozkomíšním moku má již své stabilní místo podporující diagnózu RS. Zatím se nepodařilo najít spolehlivou protilátku pro prognózu nebo progresi onemocnění nebo monitorování nemoci či léčby. Doposud nebyla prokázána protilátková reakce specifická pro RS a namířená proti určitému cílovému antigenu CNS. Většina protilátek detekovaných u RS je také nalezena u pacientů s jinými chorobami a v menší míře i u zdravých osob. Neúspěch lze vysvětlit několika faktory. Ještě se nepodařilo určit patogenní protilátky u RS. Protilátky u RS mohou mít různý charakter: patogenní, regulační, sekundární jako epifenomén či dokonce reparativní. Rozporuplné nálezy autoprotilátek u RS mohou být výsledkem technických otázek týkajících se testů s odlišnými detekčními systémy nebo různých forem antigenů použitých pro imunochemické stanovení. Ačkoli protilátky nejsou biologickým ukazatelem specifickým pro RS, mohou být v budoucnu použity k určování a odlišování různých imunopatologických podtypů RS. Pokud se potvrdí užitečnost anti-NMO protilátek pro diagnózu a prognózu optické neuromyelitidy v jiných laboratořích, anti-NMO-IgG protilátky by mohly být prvním biologickým ukazatelem rozlišující pacienty s NMO od pacientů s klasickou RS. Je pravděpodobné, že teprve kombinací několika protilátek u jednotlivých pacientů bude možné lépe klasifikovat pacienty k optimální léčbě.
Přijato k recenzi: 20. 4. 2007
Přijato do tisku: 6. 8. 2007
Adresa ke korespondenci
MUDr. Aleš BARTOŠ, PhD.
Neurologická klinika 3. LF UK, FNKV
Šrobárova 50
100 34 Praha 10
e-mail: abartos@fnkv.cz
Přehledný referát vznikl jako výsledek soustavného zájmu a výzkumu podpořeného výzkumným záměrem MŠMT ČR 0021620816.
Zdroje
1. Archelos JJ, Storch MK, Hartung HP. The role of B cells and autoantibodies in multiple sclerosis. Ann Neurol 2000; 47 : 694-706.
2. Cross AH, Trotter JL, Lyons J. B cells and antibodies in CNS demyelinating disease. J Neuroimmunol 2001; 112 : 1-14.
3. Cross AH, Stark JL. Humoral immunity in multiple sclerosis and its animal model, experimental autoimmune encephalomyelitis. Immunol Res 2005; 32 : 85-98.
4. Teunissen CE, Dijkstra C, Polman C. Biological markers in CSF and blood for axonal degeneration in multiple sclerosis. Lancet Neurol 2005; 4 : 32-41.
5. Martino G, Adorini L, Rieckmann P, Hillert J, Kallmann B, Comi G et al. Inflammation in multiple sclerosis: the good, the bad, and the complex. Lancet Neurol 2002; 1 : 499-509.
6. Lucchinetti C, Bruck W, Parisi J, Scheithauer B, Rodriguez M, Lassmann H. Heterogeneity of multiple sclerosis lesions: implications for the pathogenesis of demyelination. Ann Neurol 2000; 47 : 707-717.
7. Sorensen PS. Treatment of multiple sclerosis with intravenous immunoglobulin: review of clinical trials. Neurol Sci 2003; 24 Suppl 4: S227-230.
8. Keegan M, Konig F, McClelland R, Bruck W, Morales Y, Bitsch A et al. Relation between humoral pathological changes in multiple sclerosis and response to therapeutic plasma exchange. Lancet 2005; 366 : 579-582.
9. Cross AH, Stark JL, Lauber J, Ramsbottom MJ, Lyons JA. Rituximab reduces B cells and T cells in cerebrospinal fluid of multiple sclerosis patients. J Neuroimmunol 2006; 180 : 63-70.
10. Reiber H, Lange P. Quantification of virus-specific antibodies in cerebrospinal fluid and serum: sensitive and specific detection of antibody synthesis in brain. Clin Chem 1991; 37 : 1153-1160.
11. Štourač P, Bednářová J. Intratekální, antivirová a oligoklonální IgG syntéza u sclerosis multiplex a její význam v diferenciální diagnostice neurologických onemocnění. Klin Biochem Metabol 2000; 8 (4): 204-208.
12. Bednarova J, Stourac P, Adam P. Relevance of immunological variables in neuroborreliosis and multiple sclerosis. Acta Neurol Scand 2005; 112 : 97-102.
13. Derfuss T, Hohlfeld R, Meinl E. Intrathecal antibody (IgG) production against human herpesvirus type 6 occurs in about 20% of multiple sclerosis patients and might be linked to a polyspecific B-cell response. J Neurol 2005; 252 : 968-971.
14. Hughes LE, Bonell S, Natt RS, Wilson C, Tiwana H, Ebringer A et al. Antibody responses to Acinetobacter spp. and Pseudomonas aeruginosa in multiple sclerosis: prospects for diagnosis using the myelin-acinetobacter-neurofilament antibody index. Clin Diagn Lab Immunol 2001; 8 : 1181-1188.
15. Ebringer A, Hughes L, Rashid T, Wilson C. Acinetobacter immune responses in multiple sclerosis: etiopathogenetic role and its possible use as a diagnostic marker. Arch Neurol 2005; 62 : 33-36.
16. Annunziata P, Giorgio A, De Santi L, Zipoli V, Portaccio E, Amato MP et al. Absence of cerebrospinal fluid oligoclonal bands is associated with delayed disability progression in relapsing-remitting MS patients treated with interferon-beta. J Neurol Sci 2006; 244 : 97-102.
17. Reindl M, Khalil M, Berger T. Antibodies as biological markers for pathophysiological processes in MS. J Neuroimmunol 2006; 180 : 50-62.
18. Acarin N, Rio J, Fernandez AL, Tintore M, Duran I, Galan I et al. Different antiganglioside antibody pattern between relapsing-remitting and progressive multiple sclerosis. Acta Neurol Scand 1996; 93 : 99-103.
19. Genain CP, Cannella B, Hauser SL, Raine CS. Identification of autoantibodies associated with myelin damage in multiple sclerosis. Nat Med 1999; 5 : 170-175.
20. Berger T, Rubner P, Schautzer F, Egg R, Ulmer H, Mayringer I et al. Antimyelin antibodies as a predictor of clinically definite multiple sclerosis after a first demyelinating event. N Engl J Med 2003; 349 : 139-145.
21. Reindl M, Khantane S, Ehling R, Schanda K, Lutterotti A, Brinkhoff C et al. Serum and cerebrospinal fluid antibodies to Nogo-A in patients with multiple sclerosis and acute neurological disorders. J Neuroimmunol 2003; 145 : 139-147.
22. Markovic M, Trajkovic V, Drulovic J, Mesaros S, Stojsavljevic N, Dujmovic I et al. Antibodies against myelin oligodendrocyte glycoprotein in the cerebrospinal fluid of multiple sclerosis patients. J Neurol Sci 2003; 211 : 67-73.
23. Lily O, Palace J, Vincent A. Serum autoantibodies to cell surface determinants in multiple sclerosis: a flow cytometric study. Brain 2004; 127 : 269-279.
24. Menge T, Lalive PH, von Budingen HC, Cree B, Hauser SL, Genain CP. Antibody responses against galactocerebroside are potential stage-specific biomarkers in multiple sclerosis. J Allergy Clin Immunol 2005; 116 : 453-459.
25. Onoue H, Satoh JI, Ogawa M, Tabunoki H, Yamamura T. Detection of anti-Nogo receptor autoantibody in the serum of multiple sclerosis and controls. Acta Neurol Scand 2007; 115 : 153-160.
26. Silber E, Semra YK, Gregson NA, Sharief MK. Patients with progressive multiple sclerosis have elevated antibodies to neurofilament subunit. Neurology 2002; 58 : 1372-1381.
27. Eikelenboom MJ, Petzold A, Lazeron RH, Silber E, Sharief M, Thompson EJ et al. Multiple sclerosis: Neurofilament light chain antibodies are correlated to cerebral atrophy. Neurology 2003; 60 : 219-223.
28. Ehling R, Lutterotti A, Wanschitz J, Khalil M, Gneiss C, Deisenhammer F et al. Increased frequencies of serum antibodies to neurofilament light in patients with primary chronic progressive multiple sclerosis. Mult Scler 2004; 10 : 601-606.
29. Bartoš A, Fialová L, Soukupová J, Kukal J, Malbohan I, Piťha J. Antibodies against light neurofilaments in multiple sclerosis patients. Acta Neurol Scand 2007, in press.
30. Bartoš A, Fialová L, Soukupová J, Kukal J, Malbohan I, Piťha J. Elevated intrathecal antibodies against the medium neurofilament subunit in multiple sclerosis. J Neurol 2007; 254 : 20-25.
31. Heinzlef O, Weill B, Johanet C, Sazdovitch V, Caillat-Zucman S, Tournier-Lasserve E et al. Anticardiolipin antibodies in patients with multiple sclerosis do not represent a subgroup of patients according to clinical, familial, and biological characteristics. J Neurol Neurosurg Psychiatry 2002; 72 : 647-649.
32. Mayo I, Arribas J, Villoslada P, Alvarez DoForno R, Rodriguez-Vilarino S, Montalban X et al. The proteasome is a major autoantigen in multiple sclerosis. Brain 2002; 125 : 2658-2667.
33. Almeras L, Lefranc D, Drobecq H, de Seze J, Dubucquoi S, Vermersch P et al. New antigenic candidates in multiple sclerosis: identification by serological proteome analysis. Proteomics 2004; 4 : 2184-2194.
34. Bitsch A, Dressel A, Meier K, Bogumil T, Deisenhammer F, Tumani H et al. Autoantibody synthesis in primary progressive multiple sclerosis patients treated with interferon beta-1b. J Neurol 2004; 251 : 1498-1501.
35. Chiba S, Yokota S, Yonekura K, Tanaka S, Furuyama H, Kubota H et al. Autoantibodies against HSP70 family proteins were detected in the cerebrospinal fluid from patients with multiple sclerosis. J Neurol Sci 2006; 241 : 39-43.
36. Cid C, Regidor I, Alcazar A. Anti-heat shock protein 90beta antibodies are detected in patients with multiple sclerosis during remission. J Neuroimmunol 2007; 184 : 223-226.
37. Qin Y, Duquette P. B-cell immunity in MS. Int MS J 2003; 10 : 110-120.
38. Correale J, de los Milagros Bassani Molinas M. Oligoclonal bands and antibody responses in multiple sclerosis. J Neurol 2002; 249 : 375-389.
39. Havrdová E. Neuroimunologie. Praha: Maxdorf Jessenius 2001.
40. Wekerle H, Hohlfeld R. Molecular mimicry in multiple sclerosis. N Engl J Med 2003; 349 : 185-186.
41. Hughes LE, Smith PA, Bonell S, Natt RS, Wilson C, Rashid T et al. Cross-reactivity between related sequences found in Acinetobacter sp., Pseudomonas aeruginosa, myelin basic protein and myelin oligodendrocyte glycoprotein in multiple sclerosis. J Neuroimmunol 2003; 144 : 105-115.
42. Prat A, Antel J. Pathogenesis of multiple sclerosis. Curr Opin Neurol 2005; 18 : 225-230.
43. Andersson M, Alvarez-Cermeno J, Bernardi G, Cogato I, Fredman P, Frederiksen J et al. Cerebrospinal fluid in the diagnosis of multiple sclerosis: a consensus report. J Neurol Neurosurg Psychiatry 1994; 57 : 897-902.
44. Freedman MS, Thompson EJ, Deisenhammer F, Giovannoni G, Grimsley G, Keir G et al. Recommended standard of cerebrospinal fluid analysis in the diagnosis of multiple sclerosis: a consensus statement. Arch Neurol 2005; 62 : 865-870.
45. Deisenhammer F, Bartos A, Egg R, Gilhus NE, Giovannoni G, Rauer S et al. Guidelines on routine cerebrospinal fluid analysis. Report from an EFNS task force. Eur J Neurol 2006; 13 : 913-922.
46. Link H, Huang YM. Oligoclonal bands in multiple sclerosis cerebrospinal fluid: an update on methodology and clinical usefulness. J Neuroimmunol 2006; 180 : 17-28.
47. Villar LM, Masjuan J, Sadaba MC, Gonzalez-Porque P, Plaza J, Bootello A et al. Early differential diagnosis of multiple sclerosis using a new oligoclonal band test. Arch Neurol 2005; 62 : 574-577.
48. Reiber H, Peter JB. Cerebrospinal fluid analysis: disease-related data patterns and evaluation programs. J Neurol Sci 2001; 184 : 101-122.
49. Reiber H, Ungefehr S, Jacobi C. The intrathecal, polyspecific and oligoclonal immune response in multiple sclerosis. Mult Scler 1998; 4 : 111-117.
50. Sellebjerg F, Christiansen M, Rasmussen LS, Jaliachvili I, Nielsen PM, Frederiksen JL. The cerebrospinal fluid in multiple sclerosis. Quantitative assessment of intrathecal IgG synthesis by empirical formulae. Eur J Neurol 1996; 3 : 548-559.
51. Izquierdo G, Angulo S, Garcia-Moreno JM, Gamero MA, Navarro G, Gata JM et al. Intrathecal IgG synthesis: marker of progression in multiple sclerosis patients. Acta Neurol Scand 2002; 105 : 158-163.
52. Villar LM, Masjuan J, Gonzalez-Porque P, Plaza J, Sadaba MC, Roldan E et al. Intrathecal IgM synthesis is a prognostic factor in multiple sclerosis. Ann Neurol 2003; 53 : 222-226.
53. Perini P, Ranzato F, Calabrese M, Battistin L, Gallo P. Intrathecal IgM production at clinical onset correlates with a more severe disease course in multiple sclerosis. J Neurol Neurosurg Psychiatry 2006; 77 : 953-955.
54. Sastre-Garriga J, Tintore M, Rovira A, Grive E, Pericot I, Comabella M et al. Conversion to multiple sclerosis after a clinically isolated syndrome of the brainstem: cranial magnetic resonance imaging, cerebrospinal fluid and neurophysiological findings. Mult Scler 2003; 9 : 39-43
55. Masjuan J, Alvarez-Cermeno JC, Garcia-Barragan N, Diaz-Sanchez M, Espino M, Sadaba MC et al. Clinically isolated syndromes: a new oligoclonal band test accurately predicts conversion to MS. Neurology 2006; 66 : 576-578.
56. Schwarz M, Spector L, Gortler M, Weisshaus O, Glass-Marmor L, Karni A et al. Serum anti-Glc(alpha1,4)Glc(alpha) antibodies as a biomarker for relapsing-remitting multiple sclerosis. J Neurol Sci 2006; 244 : 59-68.
57. Lennon VA, Kryzer TJ, Pittock SJ, Verkman AS, Hinson SR. IgG marker of optic-spinal multiple sclerosis binds to the aquaporin-4 water channel. J Exp Med 2005; 202 : 473-477.
58. Lennon VA, Wingerchuk DM, Kryzer TJ, Pittock SJ, Lucchinetti CF, Fujihara K et al. A serum autoantibody marker of neuromyelitis optica: distinction from multiple sclerosis. Lancet 2004; 364 : 2106-2112.
59. Krejsek J, Kopecký O, Taláb R. Imunopatogeneze roztroušené sklerózy. Neurol pro Praxi 2002; 3 (5): 236-243.
60. Vincent A, Lily O, Palace J. Pathogenic autoantibodies to neuronal proteins in neurological disorders. J Neuroimmunol 1999; 100 : 169-180.
61. Reindl M, Linington C, Brehm U, Egg R, Dilitz E, Deisenhammer F et al. Antibodies against the myelin oligodendrocyte glycoprotein and the myelin basic protein in multiple sclerosis and other neurological diseases: a comparative study. Brain 1999; 122 (Pt 11): 2047-2056.
62. O'Connor KC, Chitnis T, Griffin DE, Piyasirisilp S, Bar-Or A, Khoury S et al. Myelin basic protein-reactive autoantibodies in the serum and cerebrospinal fluid of multiple sclerosis patients are characterized by low-affinity interactions. J Neuroimmunol 2003; 136 : 140-148.
63. Sellebjerg F, Jensen CV, Christiansen M. Intrathecal IgG synthesis and autoantibody-secreting cells in multiple sclerosis. J Neuroimmunol 2000; 108 : 207-215.
64. Khalil M, Reindl M, Lutterotti A, Kuenz B, Ehling R, Gneiss C et al. Epitope specificity of serum antibodies directed against the extracellular domain of myelin oligodendrocyte glycoprotein: Influence of relapses and immunomodulatory treatments. J Neuroimmunol 2006; 174 : 147-156.
65. Rauer S, Euler B, Reindl M, Berger T. Antimyelin antibodies and the risk of relapse in patients with a primary demyelinating event. J Neurol Neurosurg Psychiatry 2006; 77 : 739-742.
66. Gaertner S, de Graaf KL, Greve B, Weissert R. Antibodies against glycosylated native MOG are elevated in patients with multiple sclerosis. Neurology 2004; 63 : 2381-2383.
67. Zhou D, Srivastava R, Nessler S, Grummel V, Sommer N, Bruck W et al. Identification of a pathogenic antibody response to native myelin oligodendrocyte glycoprotein in multiple sclerosis. Proc Natl Acad Sci U S A 2006; 103 : 19057-19062.
68. Lampasona V, Franciotta D, Furlan R, Zanaboni S, Fazio R, Bonifacio E et al. Similar low frequency of anti-MOG IgG and IgM in MS patients and healthy subjects. Neurology 2004; 62 : 2092-2094.
69. Mantegazza R, Cristaldini P, Bernasconi P, Baggi F, Pedotti R, Piccini I et al. Anti-MOG autoantibodies in Italian multiple sclerosis patients: specificity, sensitivity and clinical association. Int Immunol 2004; 16 : 559-565.
70. Zadro I, Brinar VV, Horvat G, Brinar M. Clinical relevance of antibodies against myelin oligodendrocyte glycoprotein in different clinical types of multiple sclerosis. Clin Neurol Neurosurg 2007; 109 : 23-26.
71. Lalive PH, Menge T, Delarasse C, Della Gaspera B, Pham-Dinh D, Villoslada P et al. Antibodies to native myelin oligodendrocyte glycoprotein are serologic markers of early inflammation in multiple sclerosis. Proc Natl Acad Sci USA 2006; 103 : 2280-2285.
72. Kuhle J, Pohl C, Mehling M, Edan G, Freedman MS, Hartung HP et al. Lack of association between antimyelin antibodies and progression to multiple sclerosis. N Engl J Med 2007; 356 : 371-378.
73. Lim ET, Berger T, Reindl M, Dalton CM, Fernando K, Keir G et al. Anti-myelin antibodies do not allow earlier diagnosis of multiple sclerosis. Mult Scler 2005; 11 : 492-494.
74. Pelayo R, Tintore M, Montalban X, Rovira A, Espejo C, Reindl M et al. Antimyelin antibodies with no progression to multiple sclerosis. N Engl J Med 2007; 356 : 426-428.
75. Pittock SJ, Reindl M, Achenbach S, Berger T, Bruck W, Konig F et al. Myelin oligodendrocyte glycoprotein antibodies in pathologically proven multiple sclerosis: frequency, stability and clinicopathologic correlations. Mult Scler 2007; 13 : 7-16.
76. Bjartmar C, Wujek JR, Trapp BD. Axonal loss in the pathology of MS: consequences for understanding the progressive phase of the disease. J Neurol Sci 2003; 206 : 165-171.
77. Bartoš A, Piťha J. Axonální patologie v časných stadiích roztroušené sklerózy. Cesk Slov Neurol N 2004; 67/100 (5): 381.
78. Piťha J, Havrdová E. Axonální patologie u roztroušené sklerózy. Cesk Slov Neurol N 2005; 68/101 (3): 154–158.
79. Štourač P. Paraneoplastické autoimunitní neurologické syndromy. Cesk Slov Neurol N 2005; 68/101 (2): 80-89.
80. Bartos A, Stourac P, Rusina R, Sejdova M, Velenska Z. Paraneoplastische Degeneration des Kleinhirns bei einem Ovarialkarzinom: anti-Yo positive Immunreaktivität der Kleinhirn - und Tumorzellen. Nervenarzt 2002; 73 : 995-998.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článek Webové okénkoČlánek Dopis redakciČlánek Dopis redakciČlánek ÚvodníkČlánek Myasténia gravis
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2008 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Myastenie s pozitivními anti-MuSK protilátkami u mladého muže: kazuistika
- Webové okénko
-
Analýza dat v neurologii. VII.
Reprodukovatelnost a opakovatelnost měření u spojitých dat - Dopis redakci
- Dopis redakci
- Cohen-Gadol AA, Spenser DD. The Legacy of Harvey Cushing. Stuttgart, New York: Thieme 1999. ISBN973-3-13-147861-0.
- Anderson DG, Vaccaro A. Decision Making in Spinal Care. Stuttgart, New York: Thieme 2000. ISBN 3 13 140481-7.
- Klinické využití protilátek u roztroušené sklerózy
- Idiopatické generalizované epilepsie s typickými absencemi v dospělosti
- Difuzní gliomy mozkového kmene u dětí. Noční můra dětského onkologa.
- Bezpečnosť MRI vyšetrenia u pacientov s kovovými implantátmi a implantovanými prístrojmi
- Komentár k článku Nevrlý et al. Ovlivnění plazmatické hladiny homocysteinu u pacientů s Parkinsonovou chorobou terapií L-DOPA a entacaponem.
- Ovlivnění plazmatické hladiny homocysteinu u pacientů s Parkinsonovou chorobou terapií L-DOPA a entacaponem
- Úvodník
- Efekt nízké dávky manitolu na sérovou osmolalitu
- Komentář ke článku Charvát F et al. Mechanická embolektomie pomocí MERCI katétru u nemocných s akutním uzávěrem mozkových tepen.
- Mechanická embolektomie pomocí Merci katétru u nemocných s akutním uzávěrem mozkových tepen
- Myasténia gravis
- Komplementarita stentingu a endarterektomie karotid: tříleté zkušenosti
- Ageneze laterálního semicirkulárního kanálku: kazuistika
- Případ multifokální encefalitidy reagující na léčbu steroidy jako příčiny obtížně zvládnutelných epileptických záchvatů frontálního laloku
- Vznik neuritidy optického nervu v důsledku mukokély vedlejších nosních dutin - příčinná souvislost či koincidence? Kazuistika
- Mikroskopický nález kryptokoka v mozkomíšním moku jako první příznak rozvinutého stadia AIDS. Kazuistika
- Komentář ke článku Ehler E, Latta J. Myastenie s pozitivními anti-MuSK protilátkami u mladého muže: kazuistika
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Bezpečnosť MRI vyšetrenia u pacientov s kovovými implantátmi a implantovanými prístrojmi
- Difuzní gliomy mozkového kmene u dětí. Noční můra dětského onkologa.
- Myasténia gravis
- Klinické využití protilátek u roztroušené sklerózy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



