-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Diagnostika hyponatremií v neurointenzivní péči: úloha renálních funkčních parametrů
Diagnosis of hyponatraemia in neurointensive care: the role of renal function parameters
Introduction:
Hyponatraemia with hypoosmolality in acute brain diseases can be associated with two syndromes: the cerebral salt wasting syndrome (CSW) and the syndrome of inappropriate secretion of the antidiuretic hormone (CSW). Distinguishing between the two is essential as each of the syndromes requires a different therapy and is done with the use of renal function parameters. The objective of the study was to evaluate hyponatraemia after introducing the above parameters in clinical practice at our neurologic-neurosurgical care unit (NNICU).Methods:
We retrospectively analysed all hyponatraemia (SNa+ < 135 mmol/l) in patients (pts) with acute brain diseases admitted to our NNICU over a period of five years. First we divided them according to measured serum osmolality, and then we diagnosed the group with hypoosmolality (SOsm < 275 mmol/kg) using renal function parameters (p-value related to normal levels).Results:
There were 251 pts with a total of 736 days of hyponatraemia over the period under observation. The majority of pts had normal serum osmolality (155 pts, 297 days), some had hyperosmolality (38 pts, 41 days), and only 50 pts (169 days) had low plasma osmolality. Serum osmolality was not measured for the rest of hyponatraemias. In the hypoosmolal group renal function parameters were examined in 31 patients (62%). 25 patients of the above patients were diagnosed for the CSW syndrome (dUNa+ 546.6 + 383.7 mmol/day, p < 0,001; CEl 0.065 ± 0.036 ml/s, p < 0.001; CNa+ 0.061 ± 0.036 ml/s, p < 0.001; EWC -0.015 ± 0.032 ml/s, p = 0.030; FENa+ 0.029 ± 0.016, p < 0.001), 6 patients had other causes of hyponatraemia. None of the patients had SIADH.Conclusion:
Renal function parameters represent a very easy and available method of differential diagnosis of hyponatraemias in patients receiving neurointensive care.Key words:
hyponatraemia – hypoosmolality – CSW – SIADH – renal function parameters
Autoři: V. Špatenková 1; A. Kazda 2; P. Barsa 1; V. .beneš 1; P. Škrabálek 3; D. Králová 4; P. Suchomel 1
Působiště autorů: Neurocentrum, Krajská nemocnice Liberec, a. s. 1; Katedra klinické biochemie IPVZ, Praha 2; Oddělení klinické biochemie, Krajská nemocnice Liberec, a. s. 3; Institut biostatistiky a analýz, LF a PřF MU, Brno 4
Vyšlo v časopise: Cesk Slov Neurol N 2008; 71/104(2): 156-162
Kategorie: Původní práce
Souhrn
Úvod:
Hyponatremie s hypoosmolalitou je u akutního onemocnění mozku spojována se 2 syndromy: syndromem cerebrálně podmíněné ztráty soli (CSW) a syndromem nepřiměřené sekrece antidiuretického hormonu (SIADH). Jejich rozlišení je vzhledem k různé terapii podstatné a je možné pomocí renálních funkčních parametrů.
Cílem práce bylo zhodnocení hyponatremií po zavedení těchto parametrů do klinické praxe na naší neurologicko-neurochirurgické jednotce intenzivní péče.Metoda:
V retrospektivní studii jsme za období 5 let zhodnotili všechny hyponatremie (SNa+ < 135 mmol/l) u pacientů s akutním onemocněním mozku. Nejprve jsme je rozdělili podle měřené sérové osmolality a v další fázi jsme analyzovali hypoosmolální hyponatremie pomocí měřených a vypočtených funkčních renálních parametrů (p-hodnota vztažena k normě).Výsledky:
Za sledované období jsme hyponatremii zjistili u 251 pacienta v celkovém trvání 736 dní. Hyponatremie ve spojení s normoosmolalitou se vyskytla u 155 pacientů (297 dní), s hyperosmolalitou u 38 pacientů (41 den) a pouze u 50 pacientů (169 dní) s hypoosmolalitou. Zbylé hyponatremie neměly změřenou sérovou osmolalitu. Renální funkční parametry byly vyšetřeny u 31 (62 %) pacienta s hypoosmolální hyponatremií. CSW byl diagnostikován u 25 pacientů (dUNa+ 547 ± 384 mmol/den; p < 0,001; CEl 0,065 ± 0,036 ml/s; p < 0,001; CNa+ 0,061 ± 0,036 ml/s; p < 0,001; EWC -0,015 ± 0,032 ml/s; p = 0,030; FENa+ 0,029 ± 0,016; p < 0,001), 6 pacientů mělo jinou příčinu hyponatremie. SIADH jsme nezjistili u žádného pacienta.Závěr:
Renální funkční parametry představují snadnou a dostupnou metodu v diferenciální diagnostice hyponatremií u pacientů v neurointenzivní péči.Klíčová slova:
hyponatremie – hypoosmolalita – CSW – SIADH – renální funkční parametryÚvod
Hyponatremie patří mezi časté poruchy efektivní osmolality u akutního onemocnění mozku [1,2]. U subarachnoidálního krvácení (SAK) se vyskytuje až u 30–40 % pacientů [3–6]. Nachází se i u dalších mozkových lézí: u pacientů s tumorem, abscesem mozku, bakteriální meningitidou, hydrocefalem a po kraniocerebrálním traumatu (KCT) [5].
Hyponatremie znamená vážnou komplikaci v neurointenzivní péči, je spojena s vyšší morbiditou a mortalitou [3]. Její závažnost spočívá ve vzniku edému mozku. Akutní hyponatremie vede k signifikantnímu zvětšení objemu kontuze u traumatu na zvířecím modelu [7]. Unterberg et al [8] udávají hyponatremii jako příčinu refrakterní nitrolební hypertenze u pacientů s KCT. Wijdicks [9] sledoval vztah hyponatremie a vzniku ischemie u SAK. Signifikantně větší výskyt ischemií nalezl u pacientů s hyponatremií.
Edém mozku je výsledkem základní regulace osmolality v organizmu. Jedná se o udržování stejné osmolality v extracelulární (ECT) a intracelulární tekutině (ICT). Pokud nastává změna osmolality v určitém prostoru, vzniklý osmotický gradient je následně vyrovnáván přesunem vody. Na efektivní osmolalitě ECT se nejvíce podílí natrium. Při jeho poklesu dochází k hypotonicitě ECT a osmotický gradient mezi ECT a ICT vede k přesunu vody z ECT do buněk [10].
U akutního onemocnění mozku byla hyponatremie poprvé popsaná Petersem v roce 1950 [11]. Nyní je nejčastěji spojována se 2 syndromy vznikajícími na základě zcela odlišných příčin (tab. 1). Jedná se depleční hyponatremii způsobenou ztrátami natria močí (natriurézou) u syndromu cerebrálně podmíněné ztráty soli (cerebral salt wasting, CSW syndrome) a diluční hyponatremii, která vzniká při retenci čisté vody u syndromu nepřiměřené sekrece antidiuretického hormonu (syndrome of inappropriate secretion of antidiuretic hormone, SIADH). Prvním popsaným syndromem v literatuře byl CSW syndrom, publikovaný Petersem (1950) a Cortem (1954) [11,12]. Později v roce 1957 Schwartz uvedl syndrom SIADH [13]. Diferenciální diagnostika obou syndromů podle základních laboratorních parametrů (měřená sérová osmolalita, natremie, poměr močové osmolality k sérové) není možná, protože je pro oba syndromy shodná (hypoosmolalita, osmolalita moči vyšší než sérová) [14]. Jejich rozlišení však umožňují renální funkční parametry, které byly poprvé v této souvislosti vyhodnoceny v 90. letech [15,16]. Jedná se o dopočítané parametry renálních funkcí. V 1992 Lolin a Jackowski [15] použili první vypočítané ukazatele – osmolální clearance (COsm), clearance bezsolutové vody (CH2O), frakční exkrece natria (FENa+) a frakční exkrece vody (FEH2O). Mezi novější parametry patří clearance elektrolytová (electrolyte clearance, CEl), clearance bezelektrolytové vody (electrolyte-free water clearance, EWC) a clearance natria (CNa+). Tyto parametry tzv. „druhé řady“ jsou vhodnější pro sledování poruch natriového metabolizmu, zejména EWC, protože lépe charakterizují poruchy efektivní osmolality a poruchy osy antidiuretický hormon (ADH) – ledviny [17]. Diferenciální diagnostika obou výše uvedených syndromů je pomocí těchto parametrů poměrně jednoduchá, ale za hlavní přednost považujeme dostupnost v klinické praxi. Uplatnění spatřujeme také při sledování efektu léčby. U CSW, kdy je přítomna natriuréza, jsou zvýšené odpady natria v moči (dUNa+), zvýšená COsm, CEl, CNa+, FENa+ a FEH2O. Pro SIADH vzhledem k retenci čisté vody je charakteristická negativní EWC. Stanovení hormonů, které se podílejí na vzniku jednotlivých syndromů, ADH u SIADH a natriuretických peptidů (NP) u CWS, je v každodenní klinické praxi nedostupné. Význam jejich stanovení klesá s obligátním rozvojem kompenzačních mechanizmů [14]. Renální funkční parametry zaujímají primární místo v diagnostice hyponatremií. Diferenciální diagnóza hyponatremií je přitom esenciální, protože různý mechanizmus vzniku předpokládá zcela odlišnou terapii [4,18].
Tab. 1. Charakteristika syndromu CSW a SIADH. 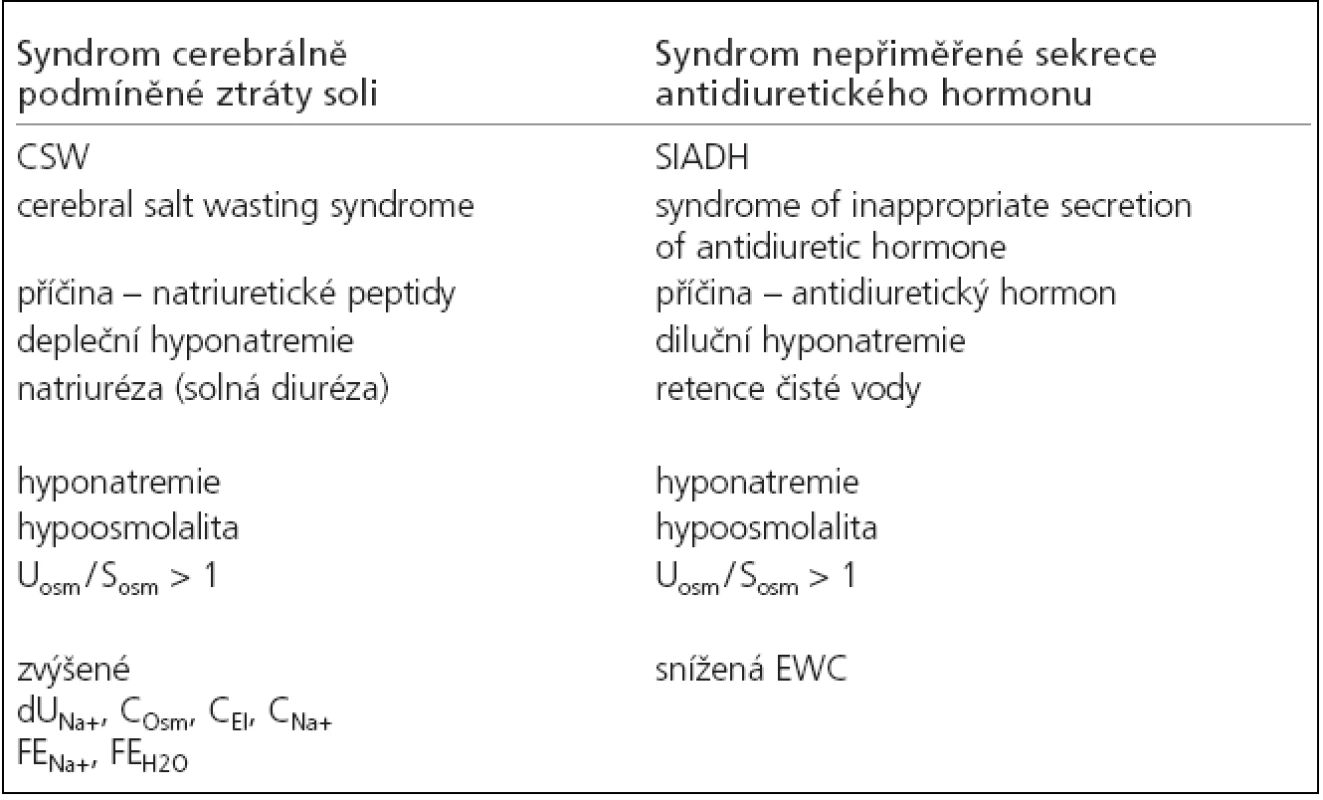
V následující práci jsme si stanovili cíl zhodnotit možnost diagnostiky hyponatremií prostřednictvím vyšetření renálních funkčních parametrů u pacientů s akutním onemocněním mozku na naší neurologicko-neurochirurgické jednotce intenzivní péče (NNJIP).
Soubor a metodika
Retrospektivní studie zahrnovala všechny pacienty s akutním onemocněním mozku hospitalizované na NNJIP za období 5 let, jejichž hodnoty sérového natria se pohybovaly pod 135 mmol/l.
V 1. fázi jsme hyponatremie rozdělili podle měřené sérové osmolality (SOsm, referenční meze 275–295 mmol/kg) do 3 skupin: 1. hyponatremie s hodnotou SOsm v referenčních mezích, 2. hyponatremie s hyperosmolalitou (SOsm > 295 mmol/kg) a 3. hyponatremie s hypoosmolalitou (SOsm < 275 mmol/kg). Byla provedena podrobná analýza jednotlivých skupin: diagnóza onemocnění mozku, typ operace a časový vztah k operaci, doba hospitalizace, doba trvání hyponatremie, Glasgow coma scale (GCS) při vzniku hyponatremie, mortalita na NNJIP (porovnána s mortalitou u normonatremických pacientů), vliv terapie (diuretika, manitol) a infuzních roztoků. Dále byl sledován příjem tekutin (ml/den), diuréza (ml/den), bilance tekutin (ml/den), z biochemických sérových parametrů: kalium, chloridy, glykemie, proteiny, albumin, urea, kreatinin.
V další fázi byla provedena diferenciální diagnostika hyponatremií s hypoosmolalitou pomocí měřených a vypočtených funkčních renálních pararametrů: denní odpady natria v moči (dUNa+, referenční meze 100–260 mmol/den), osmolální clearance (COsm, referenční meze 0,03–0,05 ml/s), elektrolytová clearance (CEl, meze 0,011–0,023 ml/s), clearance natria (CNa+, referenční meze 0,008–0,016 ml/s), clearance bezsolutové vody (CH2O, referenční meze -0,027 až 0,007 ml/s), bezelektrolytové vody (EWC, referenční meze -0,000 ± 0,006 ), frakční exkrece osmolální (FEOsm, referenční meze 0,01–0,035), frakční exkrece natria (FENa+, referenční meze 0,004–0,012 ml/s) a frakční exkrece vody (FEH2O, referenční meze 0,01–0,02). Dopočítané renální parametry byly přiřazeny k měřeným funkčním parametrům do biochemického přehledu na oddělení klinické biochemie.
Jako samostatný podsoubor byly vybrány hyponatremie s hodnotou sérového natria (SNa+) pod 130 mmol/l. Sledovali jsme vztah těchto závažných hyponatremií k ostatním, tj. s hodnotou SNa+ 130–134 mmol/l.
Biochemická stanovení byla prováděna na automatickém analyzátoru COBAS Integra 800 firmy Roche s výjimkou osmolality, která byla měřena na kryoskopickém osmometru Fiske 210 firmy Advanced. Pro výpočet hodnot clearance a frakčních exkrecí byly použity funkce z LIS Stapro s.r.o. Rovnice pro výpočet bezelektrolytové vody a rovněž očekávaná rozmezí k těmto renálním parametrům byly převzaty z práce Shoker AS [16].
Výsledky byly zpracovány programem Statistika 7.1, StatSoft, Inc. (2005) STATISTICA (data analysis software system), version 7.1. www.statsoft.com. U žádného parametru nebyla prokázána normalita, proto byl pro hodnocení rozdílu ve spojitém parametru použit neparametrický Kruskal-Wallis ANOVA test. Pro testování kategoriálních proměnných byl použit M-L Chi-square test. Pro porovnání hodnot měřených parametrů s normou byl použit jednovýběrový t-test.
Výsledky
Za sledované 5leté období jsme zjistili hyponatremii u 251 pacienta. Soubor zahrnoval 160 mužů a 91 ženu s průměrným věkem 53,9 ± 16,0 let (rozmezí 9–86 let). Průměrná doba hospitalizace činila 11,8 ± 10,1 dne (rozmezí 1–73 dny). Nejčastější diagnózou v našem souboru představovala cévní mozková příhoda (101 pacient; 40,2 %: subarachnoidální krvácení 40,6 %, intracerebrální hematom 35,6 %, ischemická cévní mozková příhoda 23,8 %). Dále byli zastoupeni pacienti s tumorem (80; 31,9 %), kraniocerebrálním traumatem (33; 13,1 %), infekcí (13; 5,2 %), epilepsií (12; 4,8 %), hydrocefalem (7; 2,8 %) a ostatní diagnózy (5; 2,0 %). Převážná část pacientů (188; 74,9 %) byla operována a hyponatremie nejčastěji vznikla až po operaci (161 pacient).
Celkem bylo zaznamenáno 736 dní hyponatremie s průměrnou dobou trvání 2,9 ± 3,8 dne (rozmezí 1–39 dnů). Průměrné GCS při vzniku hyponatremie činilo 13,6 ± 2,2 (rozmezí 3–15). U žádného pacienta nedošlo v souvislosti se změnami hladin natria k pontinní myelinolýze.
Hyponatremie byla nejčastěji spojena se sérovou normoosmolalitou (154 pacienti, 297 dní), část s hyperosmolalitou (38 pacientů, 41 den) a pouze 50 pacientů (169 dní) mělo hypoosmolalitu séra (graf 1). Ostatní hyponatremie byly bez měřené sérové osmolality. Podrobnou charakteristiku jednotlivých skupin uvádí tab. 2 a 3.
Graf 1. Počet pacientů s hyponatremií ve vztahu k měřené sérové osmolalitě. 
Tab. 2. Základní charakteristika pacientů s normoosmolální, hyperosmolální a hypoosmolální hyponatremií. 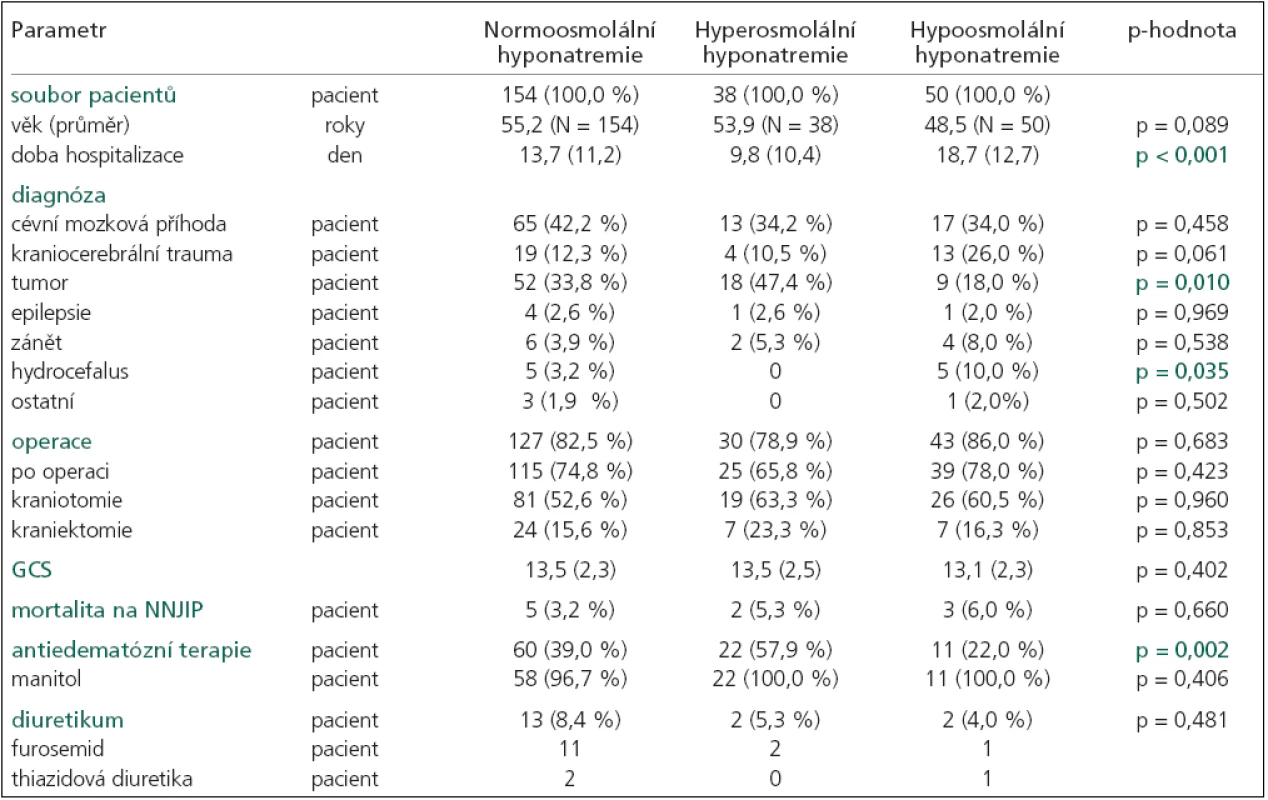
p-hodnota určuje hladinu významnosti, na které se jednotlivé typy hyponatremií mezi sebou navzájem liší (každá p-hodnota je výsledkem ANOVA testu pro více skupin a platí pro parametr na korespondujícím řádku tabulky), průměr (směrodatná odchylka), GCS při vzniku hyponatremie. Tab. 3. Charakteristika hyponatremií rozdělených podle měřené sérové osmolality do 3 skupin: 1. normoosmolální, 2. hyperosmolální a 3. hypoosmolální. 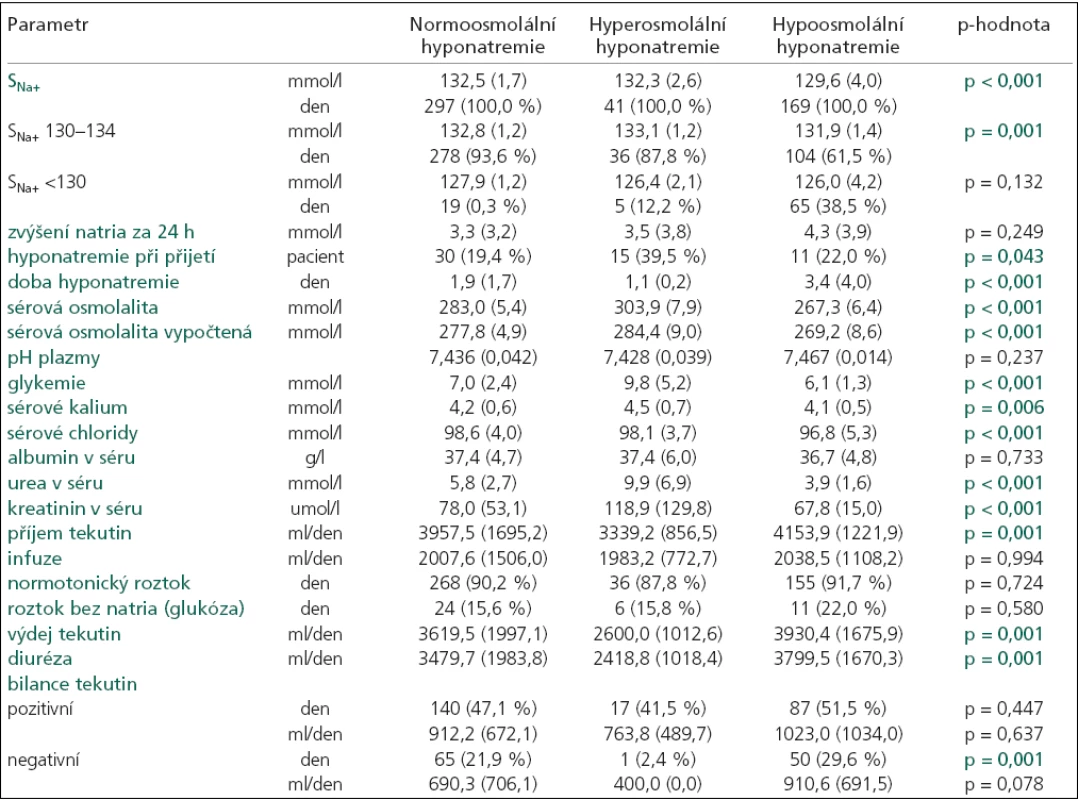
p-hodnota určuje hladinu významnosti, na které se jednotlivé typy hyponatremií mezi sebou navzájem liší (každá p-hodnota je výsledkem ANOVA testu pro více skupin a platí pro parametr na korespondujícím řádku tabulky), průměr (směrodatná odchylka), SNa+ – natremie, den = celkový počet dní. Průměrná hodnota sérového natria byla významně nižší u hypoosmolální hyponatremie (p = 0,001). V této skupině se nejvíce hodnot SNa+ nacházelo pod hranicí 130 a také doba hyponatremie byla významně delší (p = 0,001). Průměrná doba trvání hypoosmolální hyponatremie činila 3,4 ± 4 dny (rozmezí 1–22 dny). Nejkratší dobu trvaly hyperosmolální hyponatremie (průměrná doba 1,1 ± 0,2; rozmezí 1–2 dny). Normoosmolální hyponatremie se pohybovaly uprostřed, průměrná doba činila 1,9 ± 1,7 dne (rozmezí 1–13 dní).
Antiedematózní terapie manitolem byla nejčastěji podávána u pacientů s hyperosmolální hyponatremií (57,9 %). V této skupině hyponatremií jsme také zaznamenali statisticky významně vyšší hodnoty glykemie (p = 0,001) a urey v séru (p = 0,001). Hyperglykemii mělo 7 pacientů, zvýšenou ureu 6 a oba zvýšené biochemické parametry současně 6 pacientů. Všechny tyto vlivy se podílely i na příčině normoosmolální hyponatremie. Manitol mělo 58 (39 %) pacientů, hyperglykemie 2, zvýšenou ureu 4 a oba zvýšené parametry 4 pacienti. Další příčiny podílející se na vzniku normoosmolální hyponatremie ukazuje tab. 3.
Diferenciální diagnostiku hypoosmolálních hyponatremií bylo možné provést jen u 31 (62 %) pacienta, protože ostatní pacienti neměli renální funkční parametry. CSW byl diagnostikován u 25 pacientů (tab. 4), 6 pacientů mělo jinou příčinu hyponatremie. U 4 z nich byla hyponatremie následkem nesprávně podaného desmopresinu. SIADH nebylo diagnostikováno u žádného pacienta.
Tab. 4. Renální funkční parametry u CSW. 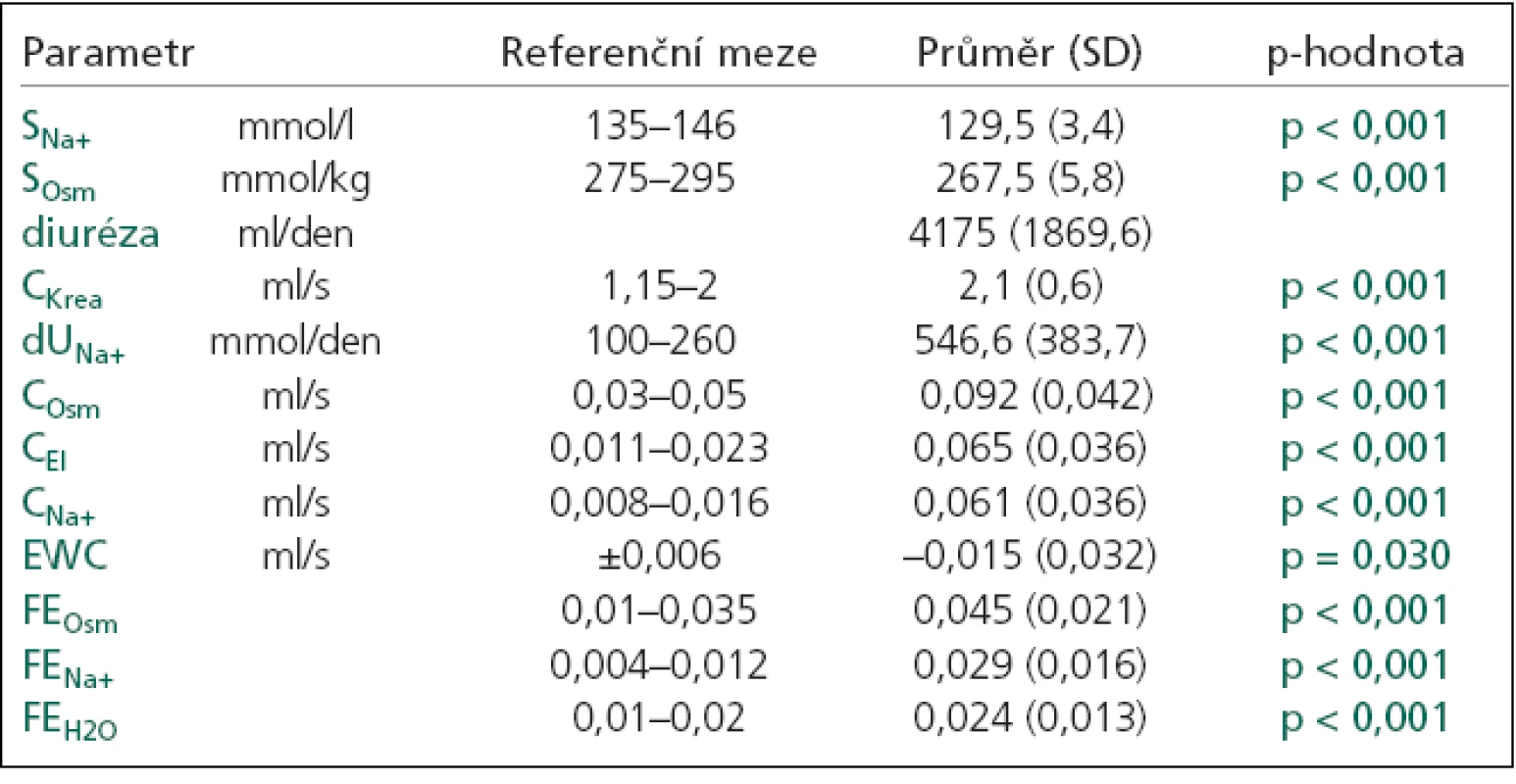
SNa+: natremie, SOsm: měřená sérová osmolalita, CKrea: clearance kreatininu, dUNa+: denní odpady natria v moči, COsm: osmolální clearance, CEl:elektrolytová clearance, CNa+: clearance natria, CH2O: clearance bezsolutové vody, EWC: clearance bezelektrolytové vody, FEOsm: frakční exkrece osmolální, FENa+: frakční exkrece natria, FEH2O: frakční exkrece vody, p-hodnota: statistická významnost vztažena k normě. Jednotlivé typy hyponatremií se významně nelišily v mortalitě na NNJIP (p = 0,660), ale mezi nejzávažnější patřila s 6% mortalitou hypoosmolální hyponatremie (3 pacienti: 1 KCT, 1 tumor, 1 hydrocefalus). Narozdíl od pacientů s normonatremií, kde mortalita na NNJIP činila 1,6 % (CMP 63,0 %, tumor 29,6 %, KCT 3,7 %, hydrocefalus 3,7 %).
Z 251 pacienta s hyponatremií se závažné hyponatremie s hodnotou sérového natria pod 130 mmol/l vyskytly u 51 pacienta (21 %). Celkem se jednalo o 106 dní, nejčastěji jsme zaznamenali hypoosmolální hyponatremie (65 dní, 61 %), méně normoosmolální (19 dní, 18 %) a nejméně byla zastoupena hyperosmolální hyponatremie (5 dní, 5 %). Zbylé hyponatremie neměly změřenou sérovou osmolalitu. U pacientů s touto závažnou hyponatremií byla sice významně delší doba hospitalizace (p < 0,001), doba trvání hyponatremie (p < 0,001), více cerebrálních komplikací (p < 0,001) a nižší GCS při vzniku hyponatremie (p = 0,018), nebyla však spojena s větší úmrtností na NNJIP (p = 0,103), tab. 5. Při srovnání natriurézy u hypoosmolální hyponatremie mezi skupinou s SNa+ pod 130 mmol/l a 130–134 mmol/l nebyl zjištěn významný rozdíl (p = 0,46).
Tab. 5. Srovnání skupiny hyponatremií s hodnotami sérového natria pod 130 mmol/l s ostatními hyponatremiemi. 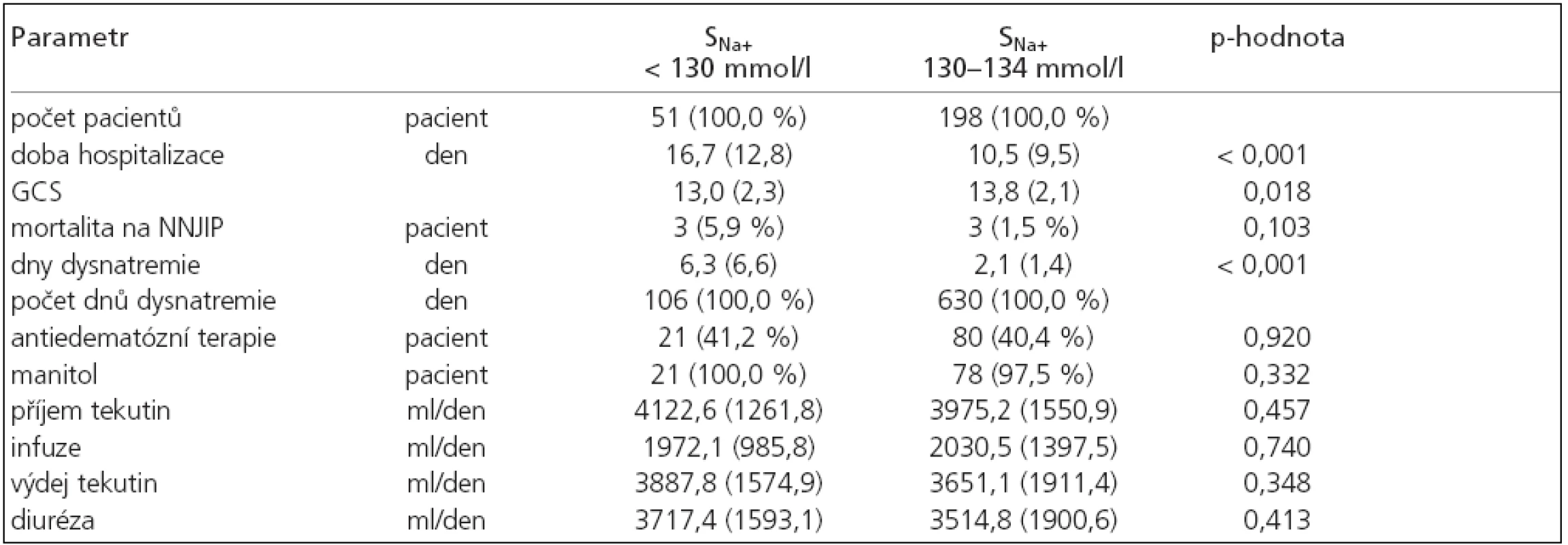
průměr (směrodatná odchylka), p-hodnota: statistické srovnání souboru hyponatremií s hodnotami sérového natria (SNa+) pod 130 mmol/l s 130–134 mmol/l, GCS: při vzniku hyponatremie. Diskuse
Hyponatremie patří mezi závažné komplikace v neurointenzivní péči, pokud je spojená s poklesem efektivní osmolality, to znamená vyskytuje-li se společně s hypoosmolalitou séra [3]. Mluvíme ale o měřené sérové osmolalitě, ne o vypočtené, která je pouze orientační a je dána součtem koncentrace natria, urey a glykemie. Význam vypočtené osmolality klesá zejména při osmoterapii manitolem, protože se s ním ve výpočtu nepočítá. Proto 1. krokem při nálezu hyponatremie je zjištění hodnoty měřené sérové osmolality.
Z našich výsledků vyplývá, že hypoosmolální hyponatremie nepatří mezi nejčastěji se vyskytující hyponatremie. Většina hyponatremií měla měřenou sérovou osmolalitu v referenčním rozmezí hodnot. Vysvětlení vidíme především v hyperglykemii, zvýšené hladině urey, osmoterapii manitolem nebo v negativní tekutinové bilanci. Vzácně můžeme při hyponatremii diagnostikovat dokonce hyperosmolalitu.
Hyponatremie je spojena s vyšší morbiditou a mortalitou u pacientů v neurointenzivní péči [3]. Vzhledem k závažnosti hyponatremie je důležitá včasná a správná diagnóza, kterou lze poměrně snadno zjistit pomocí měřených a vypočítaných renálních funkčních parametrů. Jejich velkou výhodou je dostupnost v běžné klinické praxi. Jabor [20] uvádí, že EWC by se měla stanovovat jako základní dopočtený renální funkční ukazatel. V neurointenzivní péči je hyponatremie spojována s 2 různými syndromy – častěji se vyskytujícím CSW a méně SIADH [19], což se ukázalo i v naší studii. V našem souboru jsme dokonce nenalezli žádný případ SIADH. Diagnostika však nebyla provedena u všech pacientů s hypoosmolální hyponatremií (62 %), protože u části pacientů renální funkční parametry chyběly. Při diagnostice je vždy důležité odlišit její příčinu od kompenzační reakce organizmu. V případě normonatremie s polyurií o nízké specifické váze moči, pozitivní EWC znamená kompenzační mechanizmus organizmu [20], a podáme-li desmopresin, může vzniknout hyponatremie následkem retence čisté vody. K takové situaci došlo u 4 pacientů v našem souboru.
Pokud nenacházíme typické syndromy doprovázející onemocnění mozku, CSW a SIADH, musíme se zaměřit na další příčiny hyponatremie [21]. Patří mezi ně hypokortikalizmus, hypoaldosteronizmus, polydypsie čistou vodou nebo hyponatremie u chronického etylizmu. V našem souboru jsme měli 1 pacienta s posledně jmenovanou příčinou.
Diferenciální diagnóza hyponatremií je esenciální vzhledem k různému mechanizmu vzniku a následné terapii [4,18]. U CSW [22] se jedná o substituci natria a tekutin, u SIADH [2] o restrikci tekutin a aplikaci diuretik a u hypokortikalizmu podání hydrokortizonu. Při terapii hyponatremie musíme vždy myslet na pravidla korekce natremie. Při rychlém vzestupu natremie hrozí riziko pontinní a extrapontinní myelinolýzy – poškození myelinu [23–25]. V 1. kroku při úpravě natremie je důležité si uvědomit, zda se jedná o akutní nebo chronickou hyponatremii [26]. V neurointenzivní péči se častěji setkáváme s hyponatremií akutně vzniklou. V našem souboru jsme zaznamenali jen 1 pacienta s chronickou hyponatremií. Jednalo se chronického etylika. V dalším kroku je potřeba si stanovit cílovou hodnotu natremie za 24 h. V tom případě nám častější kontroly natremie (minimálně po 6 h) usnadní předejít této závažné komplikaci. V našem 5letém sledování jsme myelinolýzu nediagnostikovali, i když jsme jednou překročili bezpečné pásmo posunu natremie. Došlo k vzestupu o 20 mmol/24 h.
Renální funkční parametry znamenají velký přínos v diagnostice hyponatremií [12,13], protože podle základních laboratorních parametrů (měřená sérová osmolalita, natremie, poměr močové osmolality k sérové) ji není možné provést. Pro oba syndromy – CSW i SIADH – vycházejí obdobné hodnoty. Po zavedení renálních funkčních parametrů došlo dokonce k přehodnocení původně diagnostikovaných SIADH na CSW [12,15].
Stanovení hormonů, které se podílejí na příčině těchto syndromů, není jednak přínosné, vzhledem ke kompenzačním změnám volumu tekutin, ale také v praxi nedostupné. U SIADH retence čisté vody vede k volumové expanzi a k následné stimulaci NP. U CSW je situace opačná, primární zvýšení NP vede k objemové depleci a k sekundárnímu zvýšení hladin ADH. Renální funkční parametry tak zaujímají primární místo v diferenciální diagnostice hyponatremií.
Závěr
Vzhledem k závažnosti hyponatremie u akutního onemocnění mozku je včasné a správné určení příčiny nutné. Zavedení renálních funkčních parametrů do klinické praxe znamená vyřešení tohoto závažného klinického problému a je vhodné pro kterékoliv pracoviště, jež se s hypoosmolálními hyponatremiemi setkává.
MUDr. Věra Špatenková
Neurocentrum
Husova 10
Krajská nemocnice
460 63 Liberec
vera.spatenkova@nemlib.cz
Přijato k recenzi: 26. 6. 2007
Přijato do tisku: 13. 11. 2007
Zdroje
1. Sivakumar V, Rajshekhar V, Chandy MJ. Management of neurosurgical patients with hyponatremia and natriuresis. Neurosurgery 1994; 34 : 269–274.
2. Betjes MG. Hyponatremia in acute brain disease: the cerebral salt wasting syndrome. Eur J Intern Med 2002; 13 : 9–14.
3. Fraser JF, Stieg PE. Hyponatremia in the neurosurgical patient: epidemiology, pathophysiology, diagnosis, and management. Neurosurgery 2006; 59 : 222–229.
4. Naval NS, Stevens RD, Mirski MA, Bhardwaj A. Controversies in the management of aneurysmal subarachnoid hemorrhage. Crit Care Med 2006; 34 : 511–524.
5. Harrigan MR. Cerebral salt wasting syndrome: a review. Neurosurgery 1996; 38 : 152–160.
6. Qureshi AI, Suri MF, Sung GY, Straw RN, Yahia AM, Saad M et al. Prognostic significance of hypernatremia and hyponatremia among patients with aneurysmal subarachnoid hemorrhage. Neurosurgery 2002; 50 : 749–755.
7. Ke C, Poon WS, Ng HK, Tang NL, Chan Y, Wang JY et al. The impact of acute hyponatraemia on severe traumatic brain injury in rats. Acta Neurochir Suppl 2000; 76 : 405–408.
8. Unterberg A, Kiening K, Schmiedek P, Lanksch W. Long-term observations of intracranial pressure after severe head injury. The phenomenon of secondary rise of intracranial pressure. Neurosurgery 1993; 32 : 17–23.
9. Wijdicks EF, Ropper AH, Hunnicutt EJ, Richardson GS, Nathanson JA. Atrial natriuretic factor and salt wasting after aneurysmal subarachnoid hemorrhage. Stroke 1991; 22 : 1519–1524.
10. Kazda A, Balík M. Osmolální dysbalance v intenzivní péči a jejich monitorování. Klin Biochem Metab 1996; 4 : 223–227.
11. Peters JP, Welt LG, Sims EA, Orloff J, Needham J. A salt-wasting syndrome associated with cerebral disease. Trans Assoc Am Physicians 1950; 63 : 57–64.
12. Cort JH. Cerebral salt wasting. Lancet 1954; 266 : 752–754.
13. Schwartz WB, Bennett W, Curelop S, Bartter FC. A syndrome of renal sodium loss and hyponatremia probably resulting from inappropriate secretion of antidiuretic hormone. Am J Med 1957; 23 : 529–542.
14. Kazda A, Špatenková V, Škrabálek P. Akutní onemocnění mozku – poruchy vodního a natriového hospodářství, natriuretické peptidy. Klin Biochem Metab 2003; 11 : 74–82.
15. Lolin Y, Jackowski A. Hyponatraemia in neurosurgical patients: diagnosis using derived parameters of sodium and water homeostasis. Br J Neurosurg 1992; 6 : 457–466.
16. Shoker AS. Application of the clearance concept to hyponatremic and hypernatremic disorders: a phenomenological analysis. Clin Chem 1994; 40 : 1220–1227.
17. Jabor A. Clearance bezelektrolytové vody u selhávajících ledvin, při hypernatremii a hyponatremii. Klin Biochem Metab 1997; 5 : 248–250.
18. Kröll M, Juhler M, Lindholm J. Hyponatraemia in acute brain disease. J Intern Med 1992; 232 : 291–297.
19. Berendes E, Walter M, Cullen P, Prien T, Van Aken H, Horsthemke J et al. Secretion of brain natriuretic peptide in patients with aneurysmal subarachnoid haemorrhage. Lancet 1997; 349 : 245–249.
20. Jabor A. Hodnocení poruch osmolality s využitím efektivní osmolální clearance, clearance sodíku, clearance bezelektrolytové vody a modelu extracelulárního a intracelulárního prostoru. Klin Biochem Metab 1997; 5 : 241–247.
21. Fall PJ. Hyponatremia and hypernatremia. A systematic approach to causes and their correction. Postgrad Med 2000; 107 : 75–82.
22. Singh S, Bohn D, Carlotti AP , Cusimano M, Rutka JT, Halperin ML. Cerebral salt wasting: truths, fallacies, theories, and challenges. Crit Care Med 2002; 30 : 2575–2579.
23. Adams RD, Victor M, Mancall EL. Central pontine myelinolysis: a hitherto undescribed disease occurring in alcoholic and malnourished patients. AMA Arch Neurol Psychiatry 1959; 81 : 154–172.
24. Tomlinson S, Hendy GN, O'Riordan JL. A in vivo experimental model for the study of resistance to the renal action of parathyroid hormone in man. Calcif Tissue Res 1976; 21(Suppl): 267–271.
25. Norenberg MD, Leslie KO, Robertson AS. Association between rise in serum sodium and central pontine myelinolysis. Ann Neurol 1982; 11 : 128–135.
26. Sterns RH, Cappuccio JD, Silver SM, Cohen EP. Neurologic sequelae after treatment of severe hyponatremia: a multicenter perspective. J Am Soc Nephrol 1994; 4 : 1522–1530.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článek Roztroušená sklerózaČlánek Žena a iktusČlánek Soutěž o nejlepší publikaceČlánek Webové okénko
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2008 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Roztroušená skleróza
- Zlyhanie farmakologickej antiepileptickej liečby
- Patofyziologie bloku vedení u neuromuskulárních chorob
- Žena a iktus
- Soutěž o nejlepší publikace
- Diagnostika hyponatremií v neurointenzivní péči: úloha renálních funkčních parametrů
- Úskalí diagnostiky a léčby flekčně-distrakčních poranění hrudní a bederní páteře: prospektivní studie
- Efekt endoskopické a klasické operace pro syndrom karpálního tunelu
- Mírná řízená hypotermie jako neuroprotektivní metoda při pozdních ischemických komplikacích v resuscitační péči u pacientů s těžkým spontánním subarachnoidálním krvácením při ruptuře aneuryzmatu
- Komentář ke článku Charvát F, Mašková J, Lacman J, Beneš V. Intrakraniální angioplastika a implantace stentu u aterosklerotických lézí.
- Intrakraniální angioplastika a implantace stentu u aterosklerotických lézí
- Familiárna agregácia Parkinsonovej choroby: genealogická štúdia
- PCR diagnostika herpetických virů u pacientů s akutní „idiopatickou“ parézou lícního nervu
- Výsledky léčby gliomů nízkého stupně malignity u dětí (retrospektivní analýza dat)
- Komentář k článku Valchář J et al. Hemangioblastom a jeho léčba pomocí Leksellova gama nože
- Hemangioblastom a jeho léčba pomocí Leksellova gama nože
- Syndrom Smithové-Magenisové: kazuistika
- Webové okénko
-
Analýza dat v neurologii
VIII. Binomické rozdělení -
Zpráva z Prvního kongresu Mezinárodní společnosti intraoperační neurofyziologie
Luzern, Švýcarsko 15.–18. 11. 2007 - Závěry „Winter GLIO TRACK Meeting“ 2008
- Zpráva z Neurovaskulárního kongresu, Ostrava 2008
- K životu a práci prof. MUDr. P. Varsika, DrSc. (18. 9. 1941–29. 12. 2005)
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Roztroušená skleróza
- Hemangioblastom a jeho léčba pomocí Leksellova gama nože
- Syndrom Smithové-Magenisové: kazuistika
- Výsledky léčby gliomů nízkého stupně malignity u dětí (retrospektivní analýza dat)
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



