-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Mírná řízená hypotermie jako neuroprotektivní metoda při pozdních ischemických komplikacích v resuscitační péči u pacientů s těžkým spontánním subarachnoidálním krvácením při ruptuře aneuryzmatu
Mild controlled hypothermia – a neuroprotective method for late ischaemic complications in resuscitation care for patients with severe spontaneous subarachnoid hemorrhage caused by aneurism rupture
Introduction:
The article deals with the potential for the use and the benefit of mild controlled hypothermia in resuscitation care for patients with spontaneous subarachnoid hemorrhage (SAH) of grade IV and V according to Hunt and Hess scale (H-H), with the objective to increase the tolerance of ischemia developing in the cerebral tissue as a result of vasospasms (delayed cerebral ischemia, DCI).Patient set:
3 groups of patients with SAH H-H IV and V. Group 1 included patients treated in 2003, a total of 12 patients aged 56 on average, with mean Fisher score 3.25. Group 2 included patients treated from the beginning of 2004 to mid 2005, a total of 13 patients aged 51 years on average, with mean Fisher score 3.23. Group 3 of patients (with retrospectively acquired data) were those treated in 2002, a total of 12 patients aged 50 years on average, with mean Fisher score 3.50. Only the patients with proven aneurysm treated with coiling were enrolled in the study.Methodology:
Mild controlled hypothermia at 34° C was applied, induced by means of surface cooling for the period of 72 hours (a Hypo 01 apparatus made by the Czech Space Research Centre, s.r.o). In the first group of patients, hypothermia was induced immediately after admission. In the second group of patients, hypothermia was applied after the evidence of vasospasms (by means of transcranial Doppler imaging (TCD), or detected by CT in case of ischaemia). The third group of patients (with retrospectively acquired data) was the control group.Results:
The use of hypothermia applied immediately after admission (the first above-mentioned group) did not improve the results of treatment (evaluated using the Glasgow Outcome Score, GOS). The use of hypothermia only upon detection of vasospasms (the second group of patients) did improve the results of treatment, but the improvement did not achieve the level of statistical significance (p=0.11).Conclusions:
Mild controlled hypothermia at 34˚ C lasting for 72 hours applied to patients with detected vasospasms was observed to improve the results of treatment of patients with SAH H-H IV and I at risk of ischaemia. However, improvement of treatment results did not achieve the level of statistical significance.Key words:
spontaneous subarachnoid hemorrhage – vasospasm – cerebral ischaemia - mild controlled hypothermia
Autoři: E. Neuman 1; M. Smrčka 1; R. Gál 2; R. Jura 3
Působiště autorů: Neurochirurgická klinika LF MU a FN Brno 1; Klinika anestezie, resuscitace a intenzivní medicíny LF MU a FN Brno 2; Neurologická klinika LF MU a FN Brno 3
Vyšlo v časopise: Cesk Slov Neurol N 2008; 71/104(2): 180-187
Kategorie: Původní práce
Souhrn
Úvod:
Práce se zabývá možnostmi použití a přínosem mírné řízené hypotermie v resuscitační péči u pacientů se spontánním subarachnoidálním krvácením (SAH) stupně IV a V dle Hunta a Hesse (H-H) s cílem zvýšit toleranci ischemie vznikající v mozkové tkáni v důsledku vazospazmů (delayed cerebral ischemia, DCI).Soubor:
3 skupiny pacientů se SAH H-H IV a V. 1. skupinu tvoří pacienti léčení v roce 2003, celkem 12 pacientů, průměrný věk 56 let, průměrné Fisher skóre 3,25. 2. skupinu tvoří pacienti léčení od začátku roku 2004 do poloviny roku 2005, celkem 13 pacientů, průměrný věk 51 let, průměrné Fisher skóre 3,23. 3. skupina pacientů (s retrospektivně získanými údaji) jsou pacienti léčeni v roce 2002, celkem 12 pacientů, průměrný věk 50 let, průměrné Fisher skóre 3,50. Do studie byli zařazeni pouze pacienti s prokázaným aneuryzmatem ošetřeným coilingem.Metodika:
Použita byla mírná řízená hypotermie 34°C indukovaná pomocí povrchového chlazení (přístroj Hypo 01, vyrobil Czech Space Research Centre, s.r.o) na dobu 72 h. U 1. jmenované skupiny pacientů byla hypotermie zavedena ihned po přijetí. U .2. jmenované skupiny pacientů byla hypotermie aplikována po průkazu vazospazmů (pomocí transkraniálního dopplerovkého vyšetření (TCD), případně při ischemii patrné na CT). 3. jmenovaná skupina pacientů (s retrospektivně zjištěnými údaji) sloužila jako kontrolní skupina.Výsledky:
Použití hypotermie aplikované ihned po přijetí (1. jmenovaná skupina pacientů) nezlepšilo léčebné výsledky (hodnocené pomocí Glasgow Outcome Score, GOS). Použití hypotermie až při zjištění vazospazmů (2. jmenovaná skupina pacientů) léčebné výsledky zlepšilo, zlepšení ale nedosáhlo hladiny statistické významnosti (p = 0,11).Závěr:
Mírná řízená hypotermie 34˚C trvající 72 hodin aplikovaná u pacientů se zjištěnými vazospazmy podle našich pozorování zlepšuje výsledky léčby pacientů se SAH H-H IV a V, ohrožených ischemií. Zlepšení výsledku léčby však nedosáhlo statistické významnosti.Klíčová slova:
spontánní subarachnoidální krvácení – vazospazmus – ischemie mozku –mírná řízená hypotermieÚvod
Delayed cerebral ischemia (DCI, „opožděná ischemie mozku“) se objevuje nejčastěji v 1. a nebo 2. týdnu po proběhlém spontánním subarachnoidálním krvácení (SAH) při ruptuře aneuryzmatu a je vedle časného opakovaného krvácení (rebleedingu) nejzávažnější a nejobávanější komplikací u pacientů se SAH. Postihuje asi 20–30 % pacientů [1–3] a u řady z nich vede k závažným neurologickým následkům, příp. k úmrtí.
DCI je způsobena vazospazmy tepen cerebrálního řečiště. Příčina vazospazmů není doposud známá. Podle současné hypotézy aktivuje oxyhemoglobin uvolňovaný z rozpadajících se erytrocytů v subarachnoidálním prostoru gen pro endotelin-1, což je 1 z nejsilnějších známých vazokonstriktorů. Zároveň se oxyhemoglobin váže na molekuly oxidu dusnatého (NO), snižuje množství NO v cévní stěně a tím dále umožňuje nástup vazospazmů [4–6].
Obecně ale ischemie mozku pozorovaná u pacientů se SAH může mít i příčiny jiné. Může jít o komplikaci chirurgického nebo endovaskulárního výkonu, důsledek akutního hydrocefalu, otoku mozku, případně i o následek embolizace do tepen mozkového řečiště [7].
Navzdory mnoha letům intenzivního výzkumu nebyla patogeneze vzniku DCI zcela objasněna. Výskyt DCI souvisí do jisté míry s těžším stavem pacienta při přijetí [8–10], s rostoucím množstvím krve v subarachnoidálních prostorech [9–12], s vyšším věkem [8,13], s hyperglykemií [8], s hypotenzí použitou při anestezii během operace aneuryzmatu [14], s přítomností akutního hydrocefalu při přijetí [15] a s délkou trvání bezvědomí bezprostředně po vzniku SAH [16].
Léčba vazospazmů je dosud nedostatečně účinná. Příznivý efekt byl prokázán u nimodipinu [17], jehož profylaktické podávání se v současné době obecně doporučuje. Účinnost nimodipinu není ale vysoká. V případě již zjištěných vazospazmů se pak běžně užívá 3H terapie (triple H therapy – hypervolemie, hypertenze, hemodiluce). Zde je však účinnost dokonce nejistá [17]. Nadějných výsledků (srovnatelných s nimodipinem) se v klinických studiích dosahuje s podáváním magnézia [17]. Naopak případný příznivý efekt řady ostatních testovaných látek (statiny, antagonisté endotelinu, endotekálně podávané fybrinolytické látky, nikardipin) nebyl zatím prokázán [17]. Určitou naději pro léčbu vazospazmů skýtá intratekální aplikace nitroprusidu sodného, jakožto zdroje exogenního NO [18]. Zkouší se i endovaskulární intervence [19–22] – buď balonková plastika na zúženém místě cévy (metoda je účinná, klinické zlepšení se objevuje v 60–80 %, je ale riziková) a vazodilatace intraarteriálními injekcemi papaverinu, případně verapamilu, nimodipinu, nikardipinu.
Jiným přístupem k léčbě DCI (a obecně ischemie s jakoukoliv příčinou) je využití neuroprotekce, tedy snaha o minimalizaci následků ischemie. Ischemická tkáň propadá infarzaci postupně od oblasti s nejmenším kolaterálním oběhem (jádro infarktu) k oblasti s lepším kolatelárním oběhem (penumbra). Důležité je, že dokud penumbra existuje, je potenciálně zachranitelná [23,24].
Nejúčinnější známou neuroprotekcí je hypotermie. Hypotermií rozumíme stav, kdy je teplota tělesného jádra pod teplotním rozmezím charakteristickým pro člověka. Pod pojmem řízená hypotermie rozumíme stav, kdy tělesná teplota je udržována v úzkém teplotním rozmezí pod fyziologickou hodnotou pomocí zvýšených tepelných ztrát. Rozdělení hypotermie [25] podle tělesné teploty a popis účinků hypotermie na organizmus uvádí tab. 1.
Tab. 1. Rozdělení hypotermie podle tělesné teploty a popis účinků hypotermie na organizmus. 
Hluboká hypotermie má výjimečný neuroprotektivní potenciál. V dlouhodobé resuscitační péči však není pro své kardiální účinky (závážné arytmie, srdeční zástava) použitelná.
Neuroprotektivní efekt mírné hypotermie byl zkoušen u pacientů resuscitovaných po srdeční zástavě a při ní proběhlé globální ischemii mozku [26–29]. Nejvýznamnější dosud publikovanou studií tohoto druhu byla prospektivní randomizovaná, multicentrická studie [30] (The Hypothermia after Cardiac Arrest Study Group), používající povrchové chlazení 33˚C na 24 hodin. V hypotermické skupině bylo 136 pacientů, 55 % dobrých výsledků léčby, v normotermické 137 pacientů, 39 % dobrých výsledků léčby.
Kromě neuroprotektivního účinku mírné řízené hypotermie u globální ischemie mozku byla hypotermie zkoušena i u fokální ischemie [31]. Tzv. COOL AID Pilot Study, ukázala, že skupina 10 pacientů s masivním mozkovým infarktem léčených trombolýzou, u kterých byla použita i mírná hypotermie, měla lepší neurologické výsledky, než kontrolní skupina 9 pacientů léčená bez hypotermie. Výsledky ale nedosáhly statistické významnosti [32]. V roce 2004 pak bylo publikováno pokračování této studie [33] (randomizovaná studie, opět se jednalo o pacienty po trombolýze, 18 pacientů léčených hypotermií 33˚C, intravaskulární chlazení, trvání hypotermie 24 hodin, 22 pacientů léčených bez použití hypotermie). Léčebné výsledky v obou skupinách byly srovnatelné.
Zkušenosti s využitím mírné hypotermie přímo u SAH jsou malé. V literatuře se uvádí, že mírná hypotermie snižuje incidenci vazospazmů po SAH [34–36]. Hypotermie byla také zkoušena během operací aneuryzmat (studie IHAST [37]), zde nebyl ale shledán rozdíl v obou skupinách, tj. pacientů operovaných v hypotermii a bez hypotermie. V České republice se použitím hypotermie u SAH zabývala práce doc. MUDr. R. Gála [38].
Mechanizmy, kterými hypotermie chrání mozek před poškozením, jsou multifaktoriální a zahrnují alespoň tyto děje: snížení buněčného metabolizmu [39], blokování uvolnění excitačních neurotransmiterů [40] a s ním úzce spjatá ztráta schopnosti buňky udržet homestázu kalcia [41] ochrana syntézy proteinů normalizací hladiny ubiquitinu [42], snížení akumulace tepla v mozku [43], snížení tvorby otoku [44] a modulace zánětlivé odpovědi[45–49].
Pro dosažení a udržení mírné hypotermie bylo dosud ve většině klinických studií (a i v této) používáno povrchové chlazení vodou promývanými chladicími matracemi. Výhodou metody povrchového chlazení je, že chladicí zařízení je jednoduché, nenáročné na obsluhu a snadno se aplikuje na pacienta. Nevýhodou je pomalost v dosahování cílové teploty, neefektivnost u pacientů s vysokou tělesnou hmotností a výskyt třesu a periferní vazokonstrikce [50].
Cíle práce
Cílem práce bylo vyhodnotit možné zlepšení špatných výsledků v léčbě pacientů po SAH H-H IV a V, ohrožených rozvojem ischemických komplikací následkem cévních spazmů, použitím hypotermie v resuscitační péči o tyto pacienty.
Materiál a metodika
Do studie (2002–2005) bylo zařazeno celkem 37 pacientů s SAH H-H IV a V, vzniklými při ruptuře aneuryzmatu, u nichž bylo aneuryzma ošetřeno coilingem. Průměrný věk pacientů byl 52 let a jednalo se o 14 mužů a 23 žen. Ze studie byli vyřazeni pacienti starší 70 let a pacienti s infaustní prognózou (oboustranná mydriáza, areflexie nad C1). Do studie nebyli zařazeni pacienti s intracerebrálním hematomem vyžadujícím chirurgické ošetření, pacienti bez prokázaného zdroje krvácení (aneuryzmatu) a pacienti, u nichž bylo aneuryzma ošetřeno jinak než coilingem. Sledováno bylo i množství krve v subarachnoidálních prostorách. Toto bylo hodnoceno pomocí Fisherova skóre, jež předvídá stupeň rizika vazospazmu [11].
U všech pacientů byla v nejkratší možné době provedena diagnostika zdroje krvácení mozkovou panagiografií, po diagnostice následovalo ihned endovaskulární ošetření aneuryzmatu (coiling).
Ve studii se používala mírná řízená hypotermie 34°C trvající 72 hodin (přístroj pro řízenou hypotermii Hypo 01, Czech Space Research Centre s.r.o.). Centrální tělesná teplota byla měřena v močovém měchýři (obr. 1). Doba ochlazení na požadovaných 34°C z normotermie byla do 3 hodin od zahájení chlazení. Po ukončení chlazení nebyli pacienti nijak zahříváni, jejich tělesná teplota se pasivně vrátila do fyziologických hodnot.
Obr. 1. Schematické znázornění uspořádání řízené hypotermie. Chladicí vodní matrace jsou umístěny pod i nad pacientem. Centrální teplota pacienta je snímána teplotním čidlem z močového měchýře. 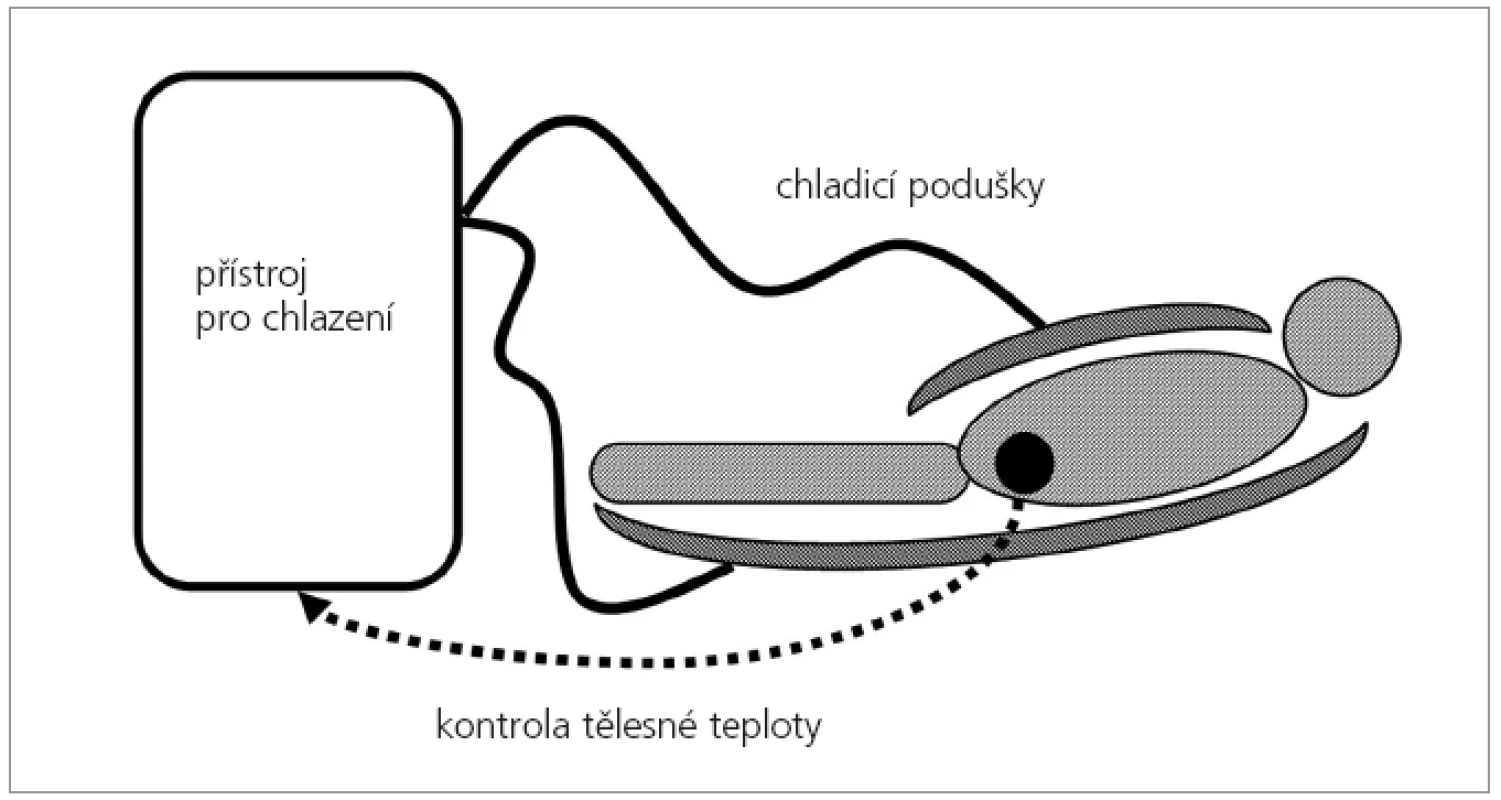
Za známky vazospazmů byl v této studii považován nález zrychlených toků na transkraniálním dopplerovském vyšetření (TCD, 120 cm/s a více) eventuálně přítomnost ischemií na CT. TCD bylo u všech pacientů prováděno denně, CT vyšetření pak dle potřeby v intervalech 1–3 dny.
Hypotermie byla jiným způsobem používána na počátku studie a v jejím pozdějším období:
U pacientů z roku 2003 bylo chlazení zahájeno ihned po přijetí. Takto bylo léčeno 12 pacientů (4 muži, 8 žen, průměrný věk 56 let) s průměrným Fisher skóre 3,25. V dalším textu je tato podskupina pacientů nazývána skupinou „pilotní studie“.
Vzhledem k tomu, že již po roce bylo zřejmé, že takto aplikovaná hypotermie neovlivňuje příznivě výsledek léčby, byla metodika pozměněna. Od začátku roku 2004 do poloviny 2005 byla hypotermie aplikována jen těm pacientům, u nichž byly zjištěny známky vazospazmů, tj. zpravidla 4.–5. den. Takto bylo léčeno 13 pacientů (4 muži, 9 žen, průměrný věk 51 let) s průměrným Fisher skóre 3,23. V dalším textu je tato podskupina pacientů nazývána skupinou „vlastní studie“.
Pro vyhodnocení byly ke srovnání vyhledány v dokumentaci výsledky léčby pacientů se SAH H-H IV a V, léčených v roce 2002. Jednalo se o 12 pacientů (6 mužů, 6 žen, průměrný věk 50 let) s průměrným Fisher skóre 3,50. V dalším textu je tato skupina nazývána „retrospektivní skupinou“.
Vyhodnocen byl vliv mírné řízené hypotermie na výsledek léčby kvantifikovaný pomocí Glasgow Outcome Score (GOS) 6 měsíců po vzniku SAH pro všechny 3 jmenované skupiny. Vliv mírné řízené hypotermie na výsledek léčby byl statisticky zpracován Studentovým T-testem (hodnoceny rozdíly průměrného GOS).
Výsledky
Pilotní studie (rok 2003)
Soubor: 12 pacientů, průměrný věk 56 let, průměrné Fisher skóre 3,25, detailnější údaje o pacientech ukazuje tab. 2.
Tab. 2. Tabulka GOS, Fisher skóre, přítomnosti zrychlených toků na TCD a přítomnosti ischemií na CT u pacientů skupiny pilotní studie a pacientů skupiny vlastní studie. Dále je v tabulce GOS a Fisher skóre pacientů retrospektivní skupiny. 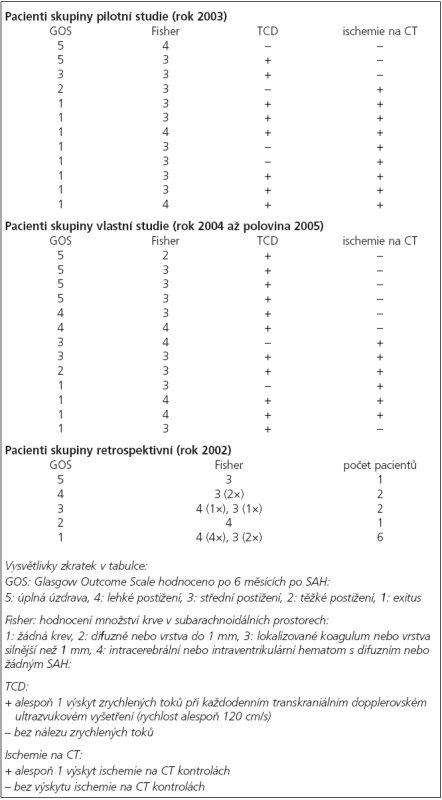
Metoda: řízená hypotermie 34˚C aplikovaná ihned po přijetí, trvající 72 hodin.
Průměrné GOS u skupiny pilotní studie bylo 1,92, podrobněji tab. 2 a graf 1.
Graf 1. GOS pacientů skupiny pilotní studie, skupiny vlastní studie a skupiny retrospektivní. 
Vlastní studie (2004–polovina 2005)
Soubor: 13 pacientů, průměrný věk 51 let, průměrné Fisher skóre 3,23, detailnější údaje o pacientech, ukazuje tab. 2.
Metoda: řízená hypotermie 34˚C aplikovaná po zjištění známek vazospazmů, trvající 72 hodin.
Průměrné GOS u skupiny vlastní studie bylo 3,08, podrobněji tab. 2 a graf 1.
Retrospektivní studie (2002)
Soubor: 12 pacientů, průměrný věk 50 let, průměrné Fisher skóre 3,50, detailnější údaje o pacientech ukazuje tab. 2.
Metoda: léčeni bez hypotermie.
Průměrné GOS u retrospektivní skupiny bylo 2,25, podrobněji tab. 2 a graf 1.
Diskuse
Soubory pacientů jsou si podobné, a to jak věkovým průměrem, tak i tíží SAH. Soubory pacientů jsou si podobné i pokud jde o způsob léčby. (Coiling, využívaný na neurochirurgické klinice ve FN Brno především u pacientů se SAH H-H IV a V, byl na tomto pracovišti zaveden do praxe během let 2000–2001. Od té doby se zatím léčebná strategie u pacientů se SAH nezměnila.)
Zlepšila hypotermie výsledek léčby těžkých SAH?
V již citovaném článku [36] je naznačeno, že by hypotermie mohla pomoci zlepšit výsledky léčby pacientů se SAH. Porovnání GOS u skupiny vlastní studie a GOS u skupiny retrospektivní studie (tab. 2, graf 1) umožňuje posoudit, zda použití hypotermie příznivě ovlivní výsledek léčby u pacientů s vazospazmy. V naší studii je GOS u pacientů léčených hypotermií v průměru lepší, což nasvědčuje, že hypotermie aplikovaná pacientům po detekci vazospazmů zlepší výsledky léčby. Retrospektivní skupina ale není pro porovnávání výsledků léčby ideální. Skupina vlastní studie představuje totiž specifickou podskupinu pacientů (jen ti s prokázanými známkami vazospasmů), zatímco retrospektivní skupina zahrnuje všechny pacienty, kteří by věkem a stavem při přijetí byli akceptovatelní do studie. Tato odlišnost obou skupin ale skupinu vlastní studie s největší pravděpodobností nezvýhodňuje (dá se očekávat, že pacienti s vazospazmy budou předurčení k horším výsledkům léčby).
Průměrné GOS skupiny retrospektivní a skupiny vlastní studie a statistické zhodnocení ukazuje tab. 3. Průměrné GOS pacientů léčených hypotermií je vyšší. Zlepšení GOS ale nedosahuje obvykle sledované hladiny významnosti 5 %.
Tab. 3. Statistické zhodnocení. 
Srovnání výsledků léčby (GOS) skupiny pilotní studie a skupiny retrospektivní
Přestože je na první pohled zřejmé, že výsledky léčby se u skupiny pilotní studie ve srovnání s retrospektivní skupinou nijak nezlepšily, pro úplnost je provedeno statistické vyhodnocení (tab. 3). Průměrné GOS pacientů skupiny pilotní studie zde vychází dokonce o něco hůře, rozdíl je ale statisticky nevýznamný.
Kterému z pacientů hypotermie pomohla?
Pro další analýzu výsledků vytvoříme ze skupiny pilotní studie podskupinu zahrnující všechny pacienty se známkami vazospazmů (tab. 4). Porovnáním GOS skupiny vlastní studie a GOS podskupiny pilotní studie srovnáváme pacienty, kteří v době vazospazmů byli (skupina vlastní studie) a nebo nebyli (podskupina pilotní studie) léčeni s použitím hypotermie. Léčebné výsledky jsou lepší ve skupině vlastní studie (graf 2). Pokud jako nepravděpodobnou zavrhneme možnost, že hypotermie použitá v prvních 72 hodinách ihned po přijetí zhoršuje léčebné výsledky, pak v naší studii hypotermie použitá 72 hodin po detekci vazospazmů léčebné výsledky zlepšuje.
Tab. 4. Podskupina pacientů skupiny pilotní studie obsahující všechny pacienty z této skupiny, u nichž byly nalezeny známky vazospazmů. 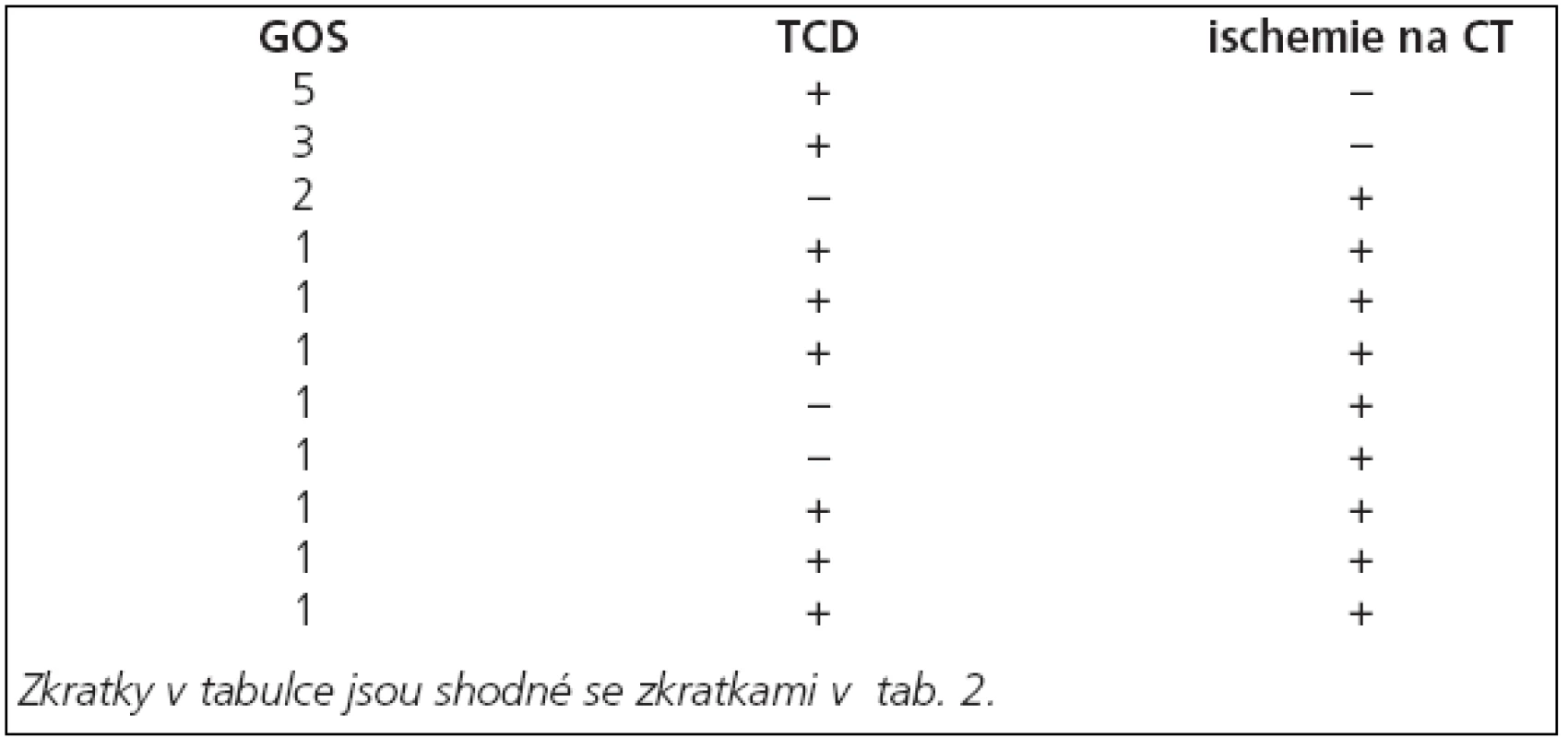
Graf 2. Srovnání GOS při léčbě s hypotermií a bez hypotermie. Čísla ve sloupcích představují GOS. Skupina „s hypotermií“ představuje skupinu vlastní studie. Skupinu „bez hypotermie“ představují vybraní pacienti ze skupiny pilotní studie (ti, u nichž se objevily známky vazospazmů). Tito pacienti byli sice hypotermií léčeni prvních 72 hodin, ale v době zjištění vazospazmů již v hypotermii nebyli, proto mohou sloužit jako srovnávací skupina pro pacienty hypotermií léčené. 
Analýza pacientů skupiny vlastní studie (graf 3) ukazuje, že dobrých výsledků léčby (stanoveno jako GOS 4 a 5) bylo dosaženo pouze u pacientů bez ischemií na CT (jedná se o pacienty se známkami vazospazmů na TCD). Vždy špatných výsledků (GOS 1 až 3) bylo dosaženo u pacientů s ischemiemi na CT. Lze se domnívat, že hypotermie příznivě působí při lehčích stupních vazospazmů, kdy vazospazmy ještě nevedou k infarzaci, případně dokáže ochránit penumbru před přeměnou v infarkt.
Graf 3. Analýza pacientů skupiny vlastní studie. Pacienti jsou rozděleni do 2 skupin (pravé a levé pole grafu) dle výskytu ischemií na CT a výsledku TCD. V rámci obou skupin jsou dále rozděleni na podskupiny podle GOS (5–4 jako dobrý výsledek léčby, 3–1 jako špatný výsledek léčby, GOS je v obrázku zaznačeno jako číslo ve sloupcích). Dobrých výsledků léčby bylo dosaženo pouze u pacientů bez ischemií na CT (jedná se o pacienty se zrychlenými toky na TCD). Naopak vždy špatných výsledků léčby bylo dosaženo u pacientů s ischemiemi na CT. 
Za povšimnutí stojí, že u několika pacientů se rozvinuly ischemické změny, aniž by na TCD byly zachyceny zrychlené toky. Jak bylo zmíněno výše, ischemie pozorovaná u pacientů se SAH obecně může mít i jiné příčiny než vazospazmy. Ale i detekce zrychlených toků pomocí TCD má svá úskalí. TCD může odhalit hrozící vazospazmy detekcí zrychleného toku v cévách v důsledku jejich zúžení. Avšak u řady pacientů se i přes detekci zrychlených toků DCI nerozvine [51,52]. A navíc, TCD detekci uniká případné zúžení distálních větví cerebrálních tepen, takže se DCI může rozvinout, aniž by TCD vyšetření na zúžení tepen upozornilo [53]. Dá se říci, že jen rychlosti < 120 cm/s dobře korespondují s vyloučením vzniku DCI a rychlosti > 200 cm/s naopak se vznikem DCI. Rychlosti toků se ale u 60 % pacientů nacházejí v rozmezí mezi těmito hodnotami [54].
Závěr
Hypotermie 34˚C použitá profylakticky prvních 72 hodin po SAH u pacientů H-H IV a V léčených coilingem prokázaného aneuryzmatu nezlepšuje výsledky léčby. Výsledky práce nasvědčují, že hypotermie 34˚C aplikovaná pacientům se SAH H-H IV a V až po detekci vazospazmů a ponechaná 72 hodin výsledky léčby zlepšuje. Zlepšení výsledků léčby nedosáhlo obvykle sledované statistické hladiny významnosti 5 %. Zlepšení výsledků léčby se pravděpodobně týká pacientů s lehčími stupni vazospazmů, u kterých hypotermie zabrání rozvoji mozkového infarktu.
Poděkování
Děkujeme střednímu zdravotnickému personálu JIP A neurochirurgické kliniky, bez jehož pomoci a ochoty by nebylo možné zvolenou metodiku studie používat.
Studie byla podporována grantem IGA MZ ČR č. 7671-3.
MUDr. et Ing. Eduard Neuman
Neurochirurgická klinika
Fakultní nemocnice Brno
Jihlavská 20
625 00 Brno
eneuman@fnbrno.cz
Přijato k recenzi: 20. 7. 2007
Přijato do tisku: 11. 1. 2008
Zdroje
1. Heros RC, Zervas NT, Varsos V. Cerebral vasospasm after subarachnoid hemorrhage: an update. Ann Neurol 1983; 14 : 599–608.
2. van Gijn J, Rinkel GJ. Subarachnoid haemorrhage: diagnosis, causes and management. Brain 2001; 124 : 249–278.
3. Kassell NF, Sasaki T, Colohan AR, Nazar G. Cerebral vasospasm following aneurysmal subarachnoid hemorrhage. Stroke 1985; 16 : 562–572.
4. Ohlstein EH, Storer BL. Oxyhemoglobin stimulation of endothelin production in cultured endothelial cells. J Neurosurg 1992; 77 : 274–278.
5. Fuwa I, Mayberg M, Gadjusek C, Harada T, Luo Z. Enhanced secretion of endothelin by endothelial cells in response to hemoglobin. Neurol Med Chir (Tokyo) 1993; 33 : 739–743.
6. Thomas JE, Nemirovsky A, Zelman V, Giannotta SL. Rapid reversal of endothelin-1-induced cerebral vasoconstriction by intrathecal administration of nitric oxide donors. Neurosurgery 1997; 40 : 1245–1249.
7. Giller CA, Giller AM, Landreneau F. Detection of emboli after surgery for intracerebral aneurysms. Neurosurgery 1998; 42 : 490–493.
8. Charpentier C, Audibert G, Guillemin F, Civit T, Ducrocq X, Bracard S et al. Multivariate analysis of predictors of cerebral vasospasm occurrence after aneurysmal subarachnoid hemorrhage. Stroke 1999; 30 : 1402–1408.
9. Inagawa T. Cerebral vasospasm in elderly patients treated by early operation for ruptured intracranial aneurysms. Acta Neurochir (Wien) 1992; 115 : 79–85.
10. Rabb CH, Tang G, Chin LS, Giannotta SL. A statistical analysis of factors related to symptomatic cerebral vasospasm. Acta Neurochir (Wien) 1994; 127 : 27–31.
11. Fisher CM, Kistler JP, Davis JM. Relation of cerebral vasospasm to subarachnoid hemorrhage visualized by computed tomographic scanning. Neurosurgery 1980; 6 : 1–9.
12. Hirai S, Ono J, Yamaura A. Clinical grading and outcome after early surgery in aneurysmal subarachnoid hemorrhage. Neurosurgery 1996; 39 : 441–447.
13. Lanzino G, Kassell NF, Germanson TP, Kongable GL, Truskowski LL, Torner JC et al. Age and outcome after aneurysmal subarachnoid hemorrhage: why do older patients fare worse? J Neurosurg 1996; 85 : 410–418.
14. Chang HS, Hongo K, Nakagawa H. Adverse effects of limited hypotensive anesthesia on the outcome of patients with subarachnoid hemorrhage. J Neurosurg 2000; 92 : 971–975.
15. Fujii Y, Takeuchi S, Sasaki O, Minakawa T, Koike T, Tanaka R. Serial changes of hemostasis in aneurysmal subarachnoid hemorrhage with special reference to delayed ischemic neurological deficits. J Neurosurg 1997; 86 : 594–602.
16. Hop JW, Rinkel GJ, Algra A, van Gijn J. Initial loss of consciousness and risk of delayed cerebral ischemia after aneurysmal subarachnoid hemorrhage. Stroke 1999; 30 : 2268–2271.
17. Weyer GW, Nolan CP, Macdonald RL. Evidence-based cerebral vasospasm management. Neurosurg Focus 2006; 21: E8.
18. Raabe A, Zimmermann M, Setzer M, Vatter H, Berkefeld J, Seifert V. Effect of intraventricular sodium nitroprusside on cerebral hemodynamics and oxygenation in poor-grade aneurysm patients with severe, medically refractory vasospasm. Neurosurgery 2002; 50 : 1006–1014.
19. Song JK, Elliott JP, Eskridge JM. Neuroradiologic diagnosis and treatment of vasospasm. Neuroimaging Clin N Am 1997; 7 : 819–835.
20. Eskridge JM, Newell DW, Winn HR. Endovascular treatment of vasospasm. Neurosurg Clin N Am 1994; 5 : 437–447.
21. Bejjani GK, Bank WO, Olan WJ, Sekhar LN. The efficacy and safety of angioplasty for cerebral vasospasm after subarachnoid hemorrhage. Neurosurgery 1998; 42 : 979–987.
22. Rosenwasser RH, Armonda RA, Thomas JE, Benitez RP, Gannon PM, Harrop J. Therapeutic modalities for the management of cerebral vasospasm: timing of endovascular options. Neurosurgery 1999; 44 : 975–980.
23. Hossmann KA. Viability thresholds and the penumbra of focal ischemia. Ann Neurol 1994; 36 : 557–565.
24. Ginsberg MD, Pulsinelli WA. The ischemic penumbra, injury thresholds, and the therapeutic window for acute stroke. Ann Neurol 1994; 36 : 553–554.
25. Hammer MD, Krieger DW. Acute ischemic stroke: is there a role for hypothermia? Cleve Clin J Med 2002; 69 : 770–777.
26. Bernard SA, Jones BM, Horne MK. Clinical trial of induced hypothermia in comatose survivors of out-of-hospital cardiac arrest. Ann Emerg Med 1997; 30 : 146–153.
27. Yanagawa Y, Ishihara S, Norio H, Takino M, Kawakami M, Takasu A et al. Preliminary clinical outcome study of mild resuscitative hypothermia after out-of-hospital cardiopulmonary arrest. Resuscitation 1998; 39 : 61–66.
28. Zeiner A, Holzer M, Sterz F, Behringer W, Schörkhuber W, Müllner M et al. Mild resuscitative hypothermia to improve neurological outcome after cardiac arrest. A clinical feasibility trial. Hypothermia After Cardiac Arrest (HACA) Study Group. Stroke 2000; 31 : 86–94.
29. Bernard SA, Gray TW, Buist MD, Jones BM, Silvester W, Gutteridge G et al. Treatment of comatose survivors of out-of-hospital cardiac arrest with induced hypothermia. N Engl J Med 2002; 346 : 557–563.
30. Hypothermia after Cardiac Arrest Study Group. Mild therapeutic hypothermia to improve the neurologic outcome after cardiac arrest. N Engl J Med 2002; 346 : 549–556.
31. Schwab S, Schwarz S, Spranger M, Keller E, Bertram M, Hacke W. Moderate hypothermia in the treatment of patients with severe middle cerebral artery infarction. Stroke 1998; 29 : 2461–2466.
32. Krieger DW, De Georgia MA, Abou-Chebl A, Andrefsky JC, Sila CA, Katzan IL et al. Cooling for acute ischemic brain damage (cool aid): an open pilot study of induced hypothermia in acute ischemic stroke. Stroke 2001; 32 : 1847–1854.
33. De Georgia MA, Krieger DW, Abou-Chebl A, Devlin TG, Jauss M, Davis SM et al. Cooling for Acute Ischemic Brain Damage (COOL AID): a feasibility trial of endovascular cooling. Neurology 2004; 63 : 312–317.
34. Thomé C, Schubert G, Piepgras A, Elste V, Schilling L, Schmiedek P. Hypothermia reduces acute vasospasm following SAH in rats. Acta Neurochir 2001; 77(Suppl): 255–258.
35. Piepgras A, Elste V, Frietsch T, Schmiedek P, Reith W, Schilling L. Effect of moderate hypothermia on experimental severe subarachnoid hemorrhage, as evaluated by apparent diffusion coefficient changes. Neurosurgery 2001; 48 : 1128–1134.
36. Nagao S, Irie K, Kawai N, Kunishio K, Ogawa T, Nakamura T et al. Protective effect of mild hypothermia on symptomatic vasospasm: a preliminary report. Acta Neurochir 2000; 76(Suppl): 547–550.
37. Todd MM, Hindman BJ, Clarke WR, Torner JC; Intraoperative Hypothermia for Aneurysm Surgery Trial (IHAST) Investigators. Mild intraoperative hypothermia during surgery for intracranial aneurysm. N Engl J Med 2005; 352 : 135–145.
38. Gál R, Smrčka M. Neuroprotektivní použití mírné hypotermie během intrakraniální chirurgie mozkových aneuryzmat. Cesk Slov Neurol N 2006; 69/102 : 371–375.
39. Erecinska M, Thoresen M, Silver IA. Effects of hypothermia on energy metabolism in Mammalian central nervous system. J Cereb Blood Flow Metab 2003; 23 : 513–530.
40. Baker AJ, Zornow MH, Grafe MR, Scheller MS, Skilling SR, Smullin DH et al. Hypothermia prevents ischemia-induced increases in hippocampal glycine concentration in rabbits. Stroke 1991; 22 : 666–673.
41. Nicholls DG, Ward MW. Mitochondrial membrane potential and neuronal glutamate excitotoxicity: mortality and millivolts. Trends Neurosci 2000; 23 : 166–174.
42. Yamashita K, Eguchi Y, Kajiwara K et al. Mild hypothermia ameliorates ubiquitin synthesis and prevents delayed neuronal death in the gerbil hippocampus. Stroke 1991; 22 : 1574–1581.
43. Hayashi N. Enhanced neuronal damage in severely brain–injured patients by hypothalamus, pituitary, and ardenal axis neurohormonal changes. In: Hayashi N (ed). Brain Hypothermia. Tokyo: Springer-Verlag 2000 : 3–25.
44. Dietrich WD. Therapeutic hypothermia in experimental models of traumatic brain injury. In: Hayashi N (ed). Brain Hypothermia. Tokyo: Springer-Verlag 2000 : 39–46.
45. Mantovani A, Sozzani S, Introna M. Endothelial activation by cytokines. Ann N Y Acad Sci 1997; 832 : 93–116.
46. Carlos TM, Harlan JM. Leukocyte-endothelial adhesion molecules. Blood 1994; 84 : 2068–2101.
47. Chatzipanteli K, Alonso OF, Kraydieh S, Dietrich WD. Importance of posttraumatic hypothermia and hyperthermia on the inflammatory response after fluid percussion brain injury: biochemical and immunocytochemical studies. J Cereb Blood Flow Metab 2000; 20 : 531–542.
48. Whalen MJ, Carlos TM, Clark RS, Marion DW, DeKosky MS, Heineman S et al. The relationship between brain temperature and neutrophil accumulation after traumatic brain injury in rats. Acta Neurochir1997; 70(Suppl): 260–261.
49. Gundersen Y, Vaagenes P, Pharo A, Valo ET, Opstad PK. Moderate hypothermia blunts the inflammatory response and reduces organ injury after acute haemorrhage. Acta Anaesthesiol Scand 2001; 45 : 994–1001.
50. Tisherman SA. To control temperature, all you need is a "cool" line. Crit Care Med 2002; 30 : 2598–2600.
51. Sloan MA, Haley EC jr, Kassell NF, Henry ML, Stewart SR, Beskin RR et al. Sensitivity and specificity of transcranial Doppler ultrasonography in the diagnosis of vasospasm following subarachnoid hemorrhage. Neurology 1989; 39 : 1514–1518.
52. Sloan MA, Burch CM, Wozniak MA, Rothman MI, Rigamonti D, Permutt T et al. Transcranial Doppler detection of vertebrobasilar vasospasm following subarachnoid hemorrhage. Stroke 1994; 25 : 2187–2197.
53. Okada Y, Shima T, Nishida M, Yamane K, Hatayama T, Yamanaka C et al. Comparison of transcranial Doppler investigation of aneurysmal vasospasm with digital subtraction angiographic and clinical findings. Neurosurgery 1999; 45 : 443–449.
54. Vora YY, Suarez-Almazor M, Steinke DE, Martin ML, Findlay JM. Role of transcranial Doppler monitoring in the diagnosis of cerebral vasospasm after subarachnoid hemorrhage. Neurosurgery 1999; 44 : 1237–1247.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článek Roztroušená sklerózaČlánek Žena a iktusČlánek Soutěž o nejlepší publikaceČlánek Webové okénko
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2008 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Roztroušená skleróza
- Zlyhanie farmakologickej antiepileptickej liečby
- Patofyziologie bloku vedení u neuromuskulárních chorob
- Žena a iktus
- Soutěž o nejlepší publikace
- Diagnostika hyponatremií v neurointenzivní péči: úloha renálních funkčních parametrů
- Úskalí diagnostiky a léčby flekčně-distrakčních poranění hrudní a bederní páteře: prospektivní studie
- Efekt endoskopické a klasické operace pro syndrom karpálního tunelu
- Mírná řízená hypotermie jako neuroprotektivní metoda při pozdních ischemických komplikacích v resuscitační péči u pacientů s těžkým spontánním subarachnoidálním krvácením při ruptuře aneuryzmatu
- Komentář ke článku Charvát F, Mašková J, Lacman J, Beneš V. Intrakraniální angioplastika a implantace stentu u aterosklerotických lézí.
- Intrakraniální angioplastika a implantace stentu u aterosklerotických lézí
- Familiárna agregácia Parkinsonovej choroby: genealogická štúdia
- PCR diagnostika herpetických virů u pacientů s akutní „idiopatickou“ parézou lícního nervu
- Výsledky léčby gliomů nízkého stupně malignity u dětí (retrospektivní analýza dat)
- Komentář k článku Valchář J et al. Hemangioblastom a jeho léčba pomocí Leksellova gama nože
- Hemangioblastom a jeho léčba pomocí Leksellova gama nože
- Syndrom Smithové-Magenisové: kazuistika
- Webové okénko
-
Analýza dat v neurologii
VIII. Binomické rozdělení -
Zpráva z Prvního kongresu Mezinárodní společnosti intraoperační neurofyziologie
Luzern, Švýcarsko 15.–18. 11. 2007 - Závěry „Winter GLIO TRACK Meeting“ 2008
- Zpráva z Neurovaskulárního kongresu, Ostrava 2008
- K životu a práci prof. MUDr. P. Varsika, DrSc. (18. 9. 1941–29. 12. 2005)
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Roztroušená skleróza
- Hemangioblastom a jeho léčba pomocí Leksellova gama nože
- Syndrom Smithové-Magenisové: kazuistika
- Výsledky léčby gliomů nízkého stupně malignity u dětí (retrospektivní analýza dat)
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



