Evokované odpovědi a elektromyografie v intraoperační monitoraci v neurochirurgii
Evoked Responses and Electromyography in Intraoperative Monitoring in Neurosurgery
The requirement that perioperative morbidity decrease in neurosurgery becomes ever more pressing. A possible contribution may be made by intraoperative monitoring of conduction in important tracts during general anaesthesia. The techniques of central sulcus identification (somatosensory evoked potential, SEP phase reversal) and motor strip location by cortical stimulation are well developed. Intraoperative motor tract monitoring is advisable in the performance of resection of intramedullary tumours. Monitoring of ascendant tracts and cranial nerves is an integral part of high‑risk surgery in the cerebellopontine angle and in the brain stem. The techniques used for stimulation and recording, as well as the ways in which responses and changes are evaluated, differ from common electromyographical practice. Close teamwork among the prime movers in the operating theatre – the neurosurgeon, the anaesthesiologist and the neurophysiologist – is vital to worthwhile and reliable monitoring.
Key words:
evoked potentials – electromyography – intraoperative monitoring – general anaesthesia
Autori:
S. Ostrý; L. Stejskal
Pôsobisko autorov:
Neurochirurgická klinika 1. LF UK, IPVZ a ÚVN Praha
Vyšlo v časopise:
Cesk Slov Neurol N 2010; 73/106(1): 8-19
Kategória:
Minimonografie
Súhrn
Požadavky na snižování pooperační morbidity v neurochirurgii narůstají. Jednou z možností je intraoperační sledování vodivosti důležitých drah v celkové anestezii. Jsou vyvinuty techniky identifikace centrálního sulku na konvexitě mozku (zvrat fází somatosenzorických evokovaných potenciálů, SEPs) a určení primární motorické krajiny přímou korovou stimulací. Operace intramedulárních nádorů se již neobejde bez intraoperačního monitorování (IOM) motorických odpovědí. Monitorace především ascendentních drah a hlavových nervů je nedílnou součástí rizikových operací v oblasti mostomozečkového koutu (MMK) a kmene. Technika stimulace a registrace i způsob hodnocení odpovědí se liší od obvykle používaných technik v běžné elektromyografické praxi. Aby bylo monitorování spolehlivé, je nutná vzájemná souhra hlavních účastníků operace: neurochirurga, anesteziologa a neurofyziologa.
Klíčová slova:
evokované odpovědi – elektromyografie – intraoperační monitorace – celková anestezie
Úvod
Klinická neurofyziologie sleduje přirozené elektrické projevy nervové a svalové tkáně i její vnucené odpovědi na zevní podněty. Některá vyšetření je možné provádět v celkovém znecitlivění a sledovat změny odpovědí v čase nebo v závislosti na operačním vstupu do nervového systému.
Aby byly dostatečně omezeny rušivé vlivy generované v okolí, jsou elektrofyziologická vyšetření prováděna na specializovaném místě, v neurofyziologické laboratoři. Operační sál je přeplněn množstvím techniky, každý přístroj představuje generátor elektrického pole. Navzdory tomu snímání mikrovoltových hodnot bioelektrických změn je díky technickému vybavení, vedení anestezie a technice stimulace běžně prováděno na sálech neurochirurgických, ORL, cévních chirurgů i dalších odborností.
Autoři předkládají shrnutí základů vyšetřování intraoperačních evokovaných odpovědí (IOM) v oblasti neurochirurgie, techniky provedení a hodnocení a vlastní praktické zkušenosti. Sama technika montáže elektrod, stimulačních a registračních parametrů již souhrnně byla popsána [1], a proto zde bude uvedena pouze výběrově.
Předoperační příprava
Indikace k IOM má být výsledkem vzájemného konsenzu neurochirurga a neurofyziologa. Nabídka monitorování je stálá, čeká se pouze na požadavek neurochirurga. Aby bylo monitorování úplné a spolehlivé, je nutná příprava. Nedílnou součástí předoperační přípravy je klinické i elektrofyziologické vyšetření v laboratoři. Aktivní znalost výbavnosti a architektury těch odpovědí, které budou monitorovány, je bezpodmínečně nutná. K provedení těchto vyšetření je zapotřebí čas i prostor. Pak je možné předvídat hranice účelného neurofyziologického monitorování, výbavnost jednotlivých odpovědí. Není‑li možné vybavit odpovědi u bdělého pacienta (v laboratoři), nedají se se očekávat v celkové anestezii (na sále) [2].
Např.: Nemocný s míšní expanzí projevující se parapallhypestezií a paraparézou (sv. síla 3–4); somatosenzorické evokované potenciály (SEPs) n. tibialis snížené amplitudy na 0,5 µV, výbavná pouze primární odpověď; skalpové motorické evokované potenciály (MEPs) s mírně prodlouženou latencí s prahem výbavnosti 65% výkonu magnetického stimulátoru. Na sále budou skalpové (SEPs) zřejmě nevýbavné. Výbavnost svalových MEPs z dolních končetin bude nesnadná, bude potřeba vysoká intenzita podnětu, která bude provázena významnými paravertebrálními kontrakcemi. Míšní D-vlna bude pravděpodobně dobře výbavná.
Materiál a vybavení
IOM evokovaných odpovědí na sále má mnoho společného s vyšetřováním v laboratoři. Princip je identický. Evokovaná odpověď nemění svůj charakter v závislosti na prostředí, kde dochází ke snímání. Vnější vlivy mohou ovlivnit parametry snímání. Shodné jsou standardní zapojení elektrod, základní parametry stimulace a registrace. Odlišnosti nejsou velké:
- Elektrody jsou na sále téměř výhradně jehlové nebo spirálkové, aby přechodový odpor a nebezpečí dislokace pod rouškami byly co nejnižší.
- Poloha pacienta je dána typem operace, instalace elektrod a monitorace se tomu přizpůsobí.
- Parametry stimulace a registrace jsou upraveny (omezeny) dle výskytu rušení (např. 50 Hz ze sítě). Poměr „signál/šum“ je na sále obvykle nižší než v laboratoři.
- Přístroj pro IOM je mnohokanálový (8, 16, 32, 64 i více), v laboratoři většinou stačí čtyři kanály.
Informace, varování, alarm
Způsob komunikace neurofyziologa s neurochirurgem je odstupňován. Naléhavost sdělení je závislá především na poklesu amplitudy odpovědí, méně často na změně latence a výskytu charakteristických, prognosticky nepříznivých fenoménů (např. rané potenciály).
Žádné dvě odpovědi nejsou vzájemně zcela identické, existuje určitá míra intraindividuální variability všech odpovědí. Tato podprahová „trial-to-trial“ variabilita tvaru, amplitudy a latence je považována za změnu nevýznamnou. Neurofyziolog tyto změny nekomentuje.
Málo významné změny jsou takové, které nemají klinický dopad, ale přesahují běžnou variabilitu odpovědí. Tehdy neurofyziolog informuje. Chirurg by měl zbystřit, zjemnit techniku, případně zpomalit postup preparace. Anesteziolog zkontroluje krevní tlak (TK), saturaci, hladiny podaných anestetik, případně další hodnoty. Významné změny jsou takové, které představují nebezpečí dočasného pooperačního deficitu. Tehdy je vysloveno varování. Chirurg by měl výkon přerušit a následně změnit místo preparace nebo resekce. Anesteziolog zvýší TK, farmakologicky podpoří mikrocirkulaci a udržuje ostatní parametry v optimálních mezích. Pokud se významné změny dále prohlubují, trvají dlouho nebo se opakují, je vyhlášen alarm. Tehdy je vysoké riziko trvalého deficitu. Chirurg okamžitě přeruší výkon, uvolní retraktory a vyčkává, zda dojde k úpravě odpovědí. Přerušení výkonu bývá i na několik desítek minut. Úloha anesteziologa je stejná jako v předchozím případě. Zvláště důležitá je v této fázi stabilní hloubka anestezie, mírná řízená hypertenze a dostatečná oxygenace. Pokud se odpovědi upraví, je možné pokračovat v operaci. Neupraví‑li se nebo dojde‑li k opakovanému vyhlášení alarmu, je vhodné výkon ukončit.
Změny systémové
V případě poklesu amplitudy SEPs obou-stranně (např. při endarterektomii vpravo) nebo MEPs kraniálně i kaudálně (při ope-raci míšní expanze) je obvykle příčina systémová (pokles TK, bolusové podání anestetika, opiátu, výraznější krvácení v operačním poli, porucha perfuze, pokles teploty tkáně v operačním poli, hematokritu, saturace apod.).
Anestezie
Naprostá většina anestetik je tlumivých. Útlum se týká hlavně korových evokovaných potenciálů (EP). Méně jsou tlumeny EP, které nevstupují do kortexu. Kontinuální aplikace eliminuje výkyvy sérových hladin, a tím i různou míru systémového ovlivnění odpovědí. Preparáty s krátkým poločasem jsou vhodnější, lépe se titrují [3].
Vybraná anestetika
Inhalační anestetika a N2O snižují amplitudu SEPs a prodlužují centrální převodní čas (CSCT). MEPs jsou velmi redukované [4], až eliminované [5]. Inhalační anestetika a N20 se navzájem potencují [6].
Tiopental má dlouhý poločas eliminace. Významně snižuje, až eliminuje MEPs. Prodlužuje CSCT a snižuje amplitudu SEPs – především pozdních odpovědí [7].
Propofol má krátký poločas eliminace [4]. Snižuje amplitudu MEPs a I-vln [3,8]. Při kontinuální aplikaci je snížení amplitud MEPs malé [3]. Bolusová aplikace zvýrazňuje tlumivý efekt, ten trvá 15–30 min [9]. Nicméně je anestetikem volby pro monitoraci motorického systému.
Myorelaxancia: nejlepší jsou krátkodobá, aplikována jsou vždy v úvodu do anestezie. Další myorelaxace závisí na souhře přání neurofyziologa a potřebě anesteziologa. Pro monitorování motorických odpovědí je optimální úplná absence myorelaxace. Částečná blokáda sice tlumí záškuby axiálního svalstva [5,8,10–14], stejně tak tlumí i MEPs z končetin. Částečná blokáda není zcela spolehlivá [15].
Opioidy jsou užívány v průběhu celé operace a mohou být dávkovány kontinuálně [13] nebo bolusově [16]. Amplitudu MEPs snižují málo [3].
Dexmedetomidine je silný selektivní agonista alfa 2-receptorů: Navozuje silnou analgezii, má nižší efekt hypnotický, netlumí dechovou aktivitu a významně zvyšuje účinky ostatních anestetik. Neovlivňuje výbavnost ani amplitudu SEPs i MEPs [17].
Vedení anestezie u operací s IOM
Operace míšních expanzí je standardně vedena v intravenózní anestezii (TIVA, to-tal intravenous anaesthesia). Standardní protokol: propofol při úvodu do anestezie bolus 60mg, dále kontinuálně 25 až200 μg/kg/min. Opioidy: bolus v úvodu a potom kontinuálně.
Pacient s expanzivním procesem v ZJ a baze je standardně operován v celkové inhalační anestezii bez svalové relaxace [18,19].
Operace s bdělou fází je vedena v analgosedaci, pacient spontánně ventiluje. V úvodu je pacient saturován fenytoinem 750–1 000mg. Kontinuální aplikace propofolu 20–40 μg/kg/min. Myorelaxancia nejsou a nesmí být podána!!! K místnímu znecitlivění pro provedení kraniotomie a durotomie se užívá mezokain (maximálně 25ml 1% roztoku).
Neurofyziologie a magnetická rezonance (MR)
Neurofyziologické testy mají výhodu v možnosti téměř neomezeného opakování. Dají se provést kdykoliv v průběhu operace s nezměněnou přesností odpovědí. Podmínkou je pouze stabilní anestezie a ustálené vnitřní prostředí pacienta. Uložení motorické krajiny a dráhy je možné zjistit i v obraze MR. Určení funkční zóny v obraze funkční MR (fMR) neodpovídá přesně zóně určené elektrickou korovou stimulací. Oblast aktivní zóny na fMR je obrazem intravaskulární změny koncentrace deoxy - proti oxyhemoglobinu v krvi zapříčiněné zvýšenou neuronální aktivitou [20].
Bílá hmota je anizotropní, difuze vody neprobíhá všemi směry stejně snadno. Nejsnadněji probíhá v paralelních osách axonů kompaktní dráhy: zobrazení „diffusion tensor imaging“ (DTI) umožní zobrazit průběh hlavního svazku dráhy, např. kortikospinální, zrakové, řečových atd.
Neuronavigace vymodeluje 3D obraz hlavy a mozku pacienta. Každé místo hlavy a mozku je jednoznačně určeno v obraze MR. To pomáhá chirurgovi v orientaci. Sloučením obrazů MR, fMR i DTI je možné určit vztah ložiska k důležitým korovým oblastem a drahám v bílé hmotě. Přesnost neuronavigace je 1–5mm. Při operaci se situace v operačním poli mění, obraz MR navigace se však nemění a vzniká nepřesnost. Tzv. tkáňový posun v operačním poli je dán řadou vlivů: velikostí expanze a rozsahem resekce, gravitací, polohou pacienta, vypuštěním likvoru apod. Výsledná nepřesnost může přesahovat 10mm. Obrazy fMR ani DTI nezobrazují přesně celou požadovanou zónu, resp. právě všechna vlákna traktu. Skutečný rozsah funkční oblasti a průběh drah, které rozhodují o rozsahu resekce, musí být vždy ověřeny stimulací (obr. 1).
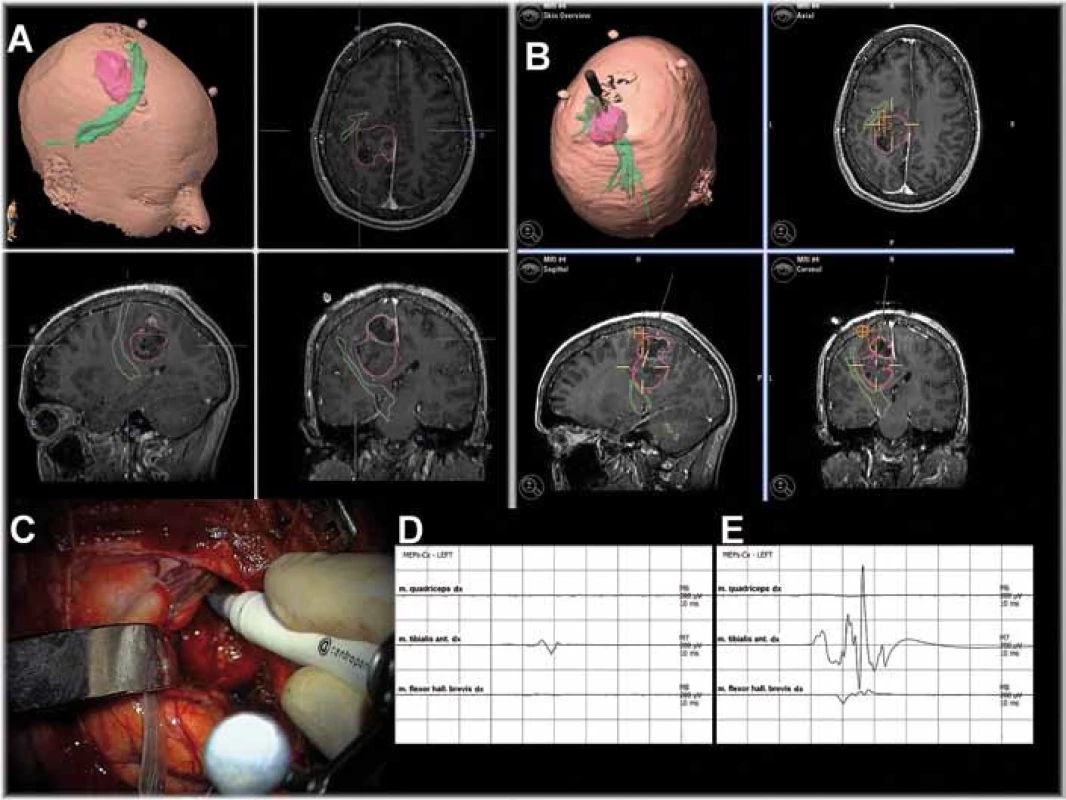
Neurofyziologové verzus neurochirurgové
Rychlost vedení axony, latence a amplituda odpovědí jsou interindividuálně variabilní. Intraindividuálně se odpovědi mění také. Ovlivněny jsou vnějšími (teplo, farmaka atd.) i vnitřními vlivy (vědomí, pozornost, svalová relaxace). Porucha funkce (paréza, hypestezie, hypakuze, afázie) je obvykle provázena změnou příslušné evokované odpovědi (prodloužení latence, pokles amplitudy, snížená diferenciace, absence).
IOM má dvě všeobecně platné fáze: 1. vyhledávání odpovědi a 2. sledování odpovědi v průběhu operačního výkonu. Každá operace má své důležité nebo rizikové fáze, které ovlivňují výsledek operace. Je nutné, aby byly pro každý typ operace nalezeny, spolehlivě určeny, systematicky sledovány a dokumentovány. Je vhodné, aby každá významná změna odpovědí byla hlášena chirurgovi nebo anesteziologovi. Ti by potom měli změnit svůj postup tak, aby byla odvrácena hrozící porucha.
Každý chirurg se snaží, aby měl ty nejlepší výsledky svých operací. Úspěch operace nezávisí jen na správné indikaci a zručnosti chirurga, ale také na předoperační rozvaze, plánu a přípravě výkonu. Před operací je nezbytné vytvořit spolehlivý shodný projekt (které odpovědi budou vyhledány a sledovány a jaké budou registrační cíle). Všichni účastníci operace znají své úlohy. Jedinečnost každé operace vyžaduje diskuzi zúčastněných stran a respektování přípravy každé z nich. Pokud vázne jeden článek, selže i celek. Co na tom, že vestibulární schwannom byl radikálně odstraněn, když pacient má po operaci periferní plegii n. facialis s lagoftalmem a ohluchl?
Operace vyžadující IOM patří k obtížnějším. Na sále se může setkat zkušený neurochirurg a méně zkušený neurofyziolog. Chirurg může být netrpělivý zejména tehdy, když je nutné přerušení výkonu a jeho přímá spoluúčast (hledání zvratu fáze SEPs, mapování primární motorické nebo řečové krajiny, sledování průběhu kortikospinální dráhy v podkoří). Právě tehdy je nutné nalézt takový způsob konfrontace, aby byl pacient mimo nebezpečí. Chirurg a neurofyziolog jsou partneři jednající na ekvivalentní úrovni. Submisivita začínajícího neurofyziologa je pochopitelná. Výsledku operace prospěje, když chirurg projeví porozumění a trpělivost.
Neurofyziolog provádějící IOM musí bezpečně zvládnout techniku elektrofyziologických vyšetření, zapojení elektrod, základní principy fyziky, řešit nesnáze přímo na místě, v průběhu operace a ovládat přístrojovou techniku. Komunikace s chirurgem je vrcholně důležitá. Na sále není čas na dlouhé přemítání o příčinách nevýbavnosti nebo ztráty odpovědí. Neurofyziolog referuje jednoznačně, jeho výroky mají být jasné a krátké. Jeho úkolem je vystihnout správný okamžik varování nebo alarmu. Příliš častá neurofyziologova varování z obavy přehlédnutí změn odpovědí budí chirurgické rozpaky. Působí spíše rušivě než ochranně, ztrácí na naléhavosti a nakonec mohou být ostatními členy operačního týmu bagatelizovány. Opačný extrém (referovat co nejméně) je rovněž na škodu.
Monitorace somatosenzorických odpovědí (SEPs)
SEPs jsou užívány k identifikaci centrálního sulku na povrchu hemisféry mozku, ke sledování korové perfuze velkého mozku, vodivosti vzestupných kmenových drah a k ochraně sfinkterových funkcí.
Identifikace centrálního sulku
Terminace somatosenzorické dráhy je uložena v primární somatosenzorické oblasti (S-I), anatomicky odpovídá postcentrálnímu gyru, Brodmanovým areám 3, 1, 2. Generátor kortikální odpovědi je uložen v zadní stěně centrálního sulku (area 3b) [21,22]. Generátor somatosenzorické odpovědi n. medianus se promítá na skalp 7cm laterálně od vertexu na spojnici Cz’ a předělu zadní a střední 1/3 zygomatického oblouku. Tato spojnice přibližně odpovídá průmětu postcentrálního gyru na skalp. Vektor dipólu je orientován tangenciálně k povrchu mozku, svým kladným pólem frontálně. Při snímání stripovou elektrodou je možné zachytit v 85–95% obrácení polarity somatosenzorických odpovědí mezi svody z frontální a parietální oblasti, tzv. zvrat fází. Zvrat fází se týká časných „primárních“ korových odpovědí N20/P25, i pozdních (obr. 2) [21–23]. Aby bylo dosaženo úplného zvratu fází, musí být osa stripu rovnoběžná s vektorem dipólu (poloha „on-axis“) [24–26]. To často vyžaduje opakovaně měnit polohu stripu. Registrace může být referenční (všechny póly jsou aktivní a reference je společná na skalpu) nebo diferenční (snímají se potenciálové změny mezi póly stripu). Zvrat fází SEPs je pozorován při záznamech kortikálních, epidurálních i skalpových.
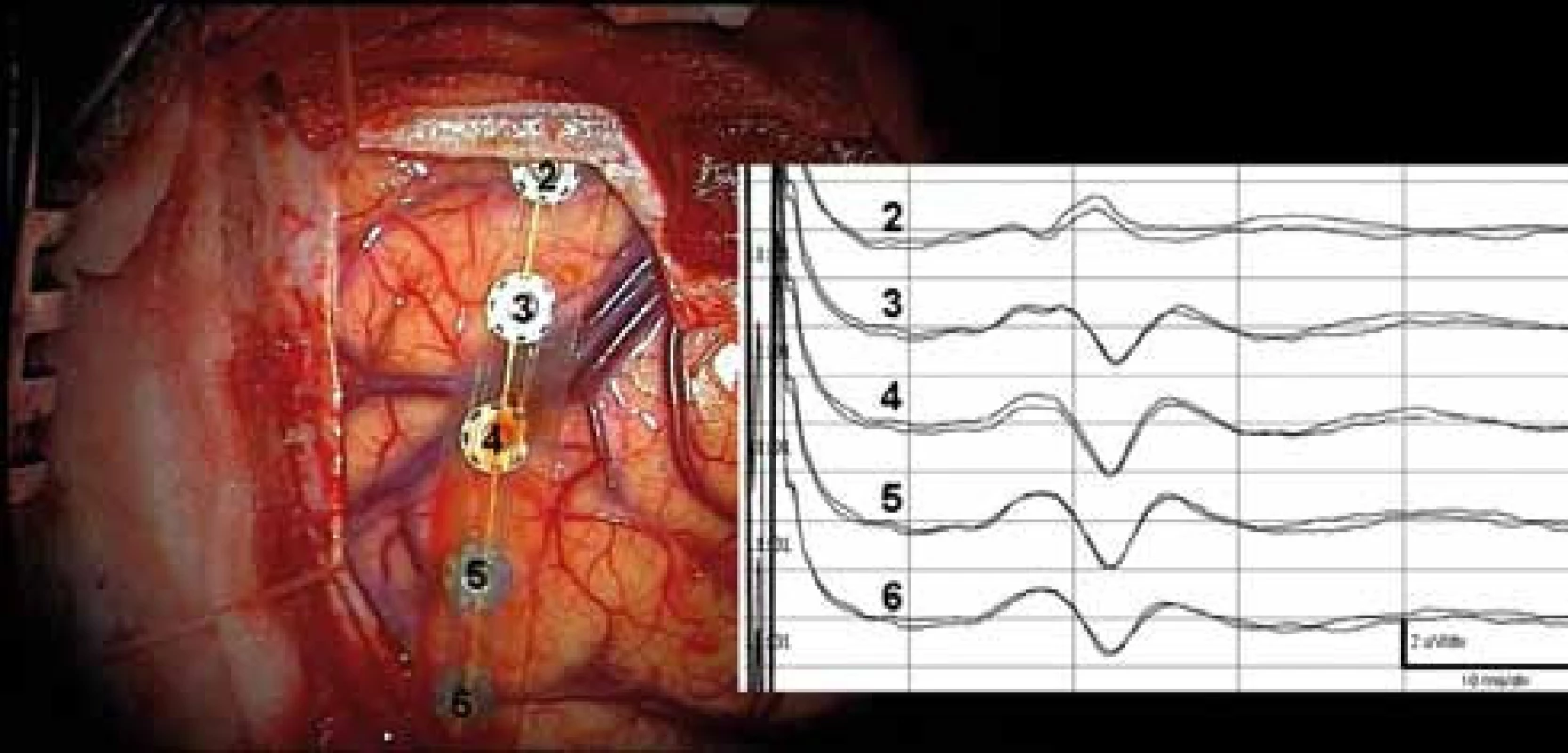
Precentrální i postcentrální gyrus mají ve vzdálenosti 6–8cm od střední čáry, kde je reprezentace ruky, variabilní uspořádání a jejich šíře kolísá v těch místech od 13 do 20mm. Z pouhé aspekce po durotomii nikdy není jistota, který sulkus je centrální. Každá operace v centrální oblasti má být zahájena spolehlivým určením zvratu fází, to jest zadní hranice motorické oblasti.
Karotická endarterektomie (CEA)
Odstranění aterosklerotického plátu vnitřníkrkavice je prováděno při dočasné okluzi vnitřní, zevní i společné krkavice. Perfuze mozku je obvykle zajištěna z ostatních tepen přes kolaterály na spodině mozku.
Jsou čtyři hlavní způsoby CEA: 1. operace v celkové anestezii (CA) bez shuntu; 2. operace v CA s obligatorním použitím intraluminálního shuntu; 3. operace v CA se selektivním použitím shuntu dle souběžných výsledků IOM; 4. operace v lokální anestezii (LA) s použitím shuntu dle souběžného klinického stavu. Cévní chirurgové obvykle používají způsob „4“, méně často „1“ nebo „2“. Bezpečné a oprávněně používané jsou způsoby „3“ a „4“ (používané na neurochirurgiích). Jejich výborné operační výsledky se navíc dle poslední randomizované studie jen nevýznamně liší [27].
Se stupněm výbavnosti skalpových SEPs souvisí regionální průtok krve mozkem (rCBF) [28,29]. Pokles rCBF je provázen poklesem amplitudy SEPs. Nejprve mizí pozdní odpovědi, nakonec se snižuje amplituda primární odpovědi N20/P25. Výbavnost SEPs závisí i na vodivosti talamokortikální radiace [30–33].
Při CEA může nastat hypoperfuze po uzavření arteria carotis interna (ACI) ve sledovaném povodí arteria cerebri media (ACM). Když k hypoperfuzi dojde, objevují se dva typické scénáře: 1. Brzy po uzavření ACI (1–2 min) nastane významný pokles amplitudy N20/P25 na straně operace < 50% úvodních hodnot. Znamená nebezpečí rozvoje ischemie a je důvodem k rychlému obnovení průtoku krve vložením intraluminálního shuntu. 2. Pozvolný pokles amplitudy SEPs trvá 10–15 min, než dosáhne hranice významnosti. Je rovněž známkou rozvoje ischemie. Ovšem tehdy je obvykle plát již odstraněn, takže ACI je urychleně zašita a průtok v ní co nejrychleji obnoven. Vložení shuntu by trvalo stejně dlouho, byla by větší manipulace s tepnou a vyšší riziko embolizace nebo disekce distální ACI.
Operace aneuryzmat ACI a jejích větví
SEPs jsou citlivé především na změny perfuze korové. Změny perfuze v podkoří a s tím související predikce pooperační parézy jsou přesněji znázorněny MEPs [34,35].
Proximální kontrola mateřské tepny dočasným klipem při ošetření aneuryzmatu M1/2 může způsobit kritickou hypoperfuzi v bazálních gangliích a capsula interna snížením průtoku v perforátorech. Tato změna perfuze se nemusí v obraze SEPs projevit tak rychle a tak významně jako v MEPs (1–2 min).
Klip v distálním řečišti ohrožuje především funkce korové. Bezpečná doba ponechání klipu je delší, asi 20 min. Po tu dobu je nutné udržovat mozek na nízké úrovni metabolické aktivity pomocí barbiturátů. Hloubka barbiturátového kómatu je sledována elektroencefalograficky (EEG) nebo elektrokortikograficky (ECoG) v obraze „burst suppresion“. Při pozdějším obnovení průtoku barbituráty se následky ischemie prohlubují.
Při všech cévních operacích je podmínkou dobrých výsledků udržování stacionární řízené mírné hypertenze s MAP okolo 100 mmHg. Vznik ischemie při hypotenzi je výrazně častější a představuje závažnější a hůře řešitelnou komplikaci než vznik krvácení související s hypertenzí.
Mostomozečkový kout, IV. komora a sinus cavernosus
Mozkovým kmenem prochází množství drah vzestupných (lemniscus medialis a lateralis, tractus spinothalamicus atd.) i sestupných (kortikospinální dráha, kortikobulbární dráha atd.), sítě spojů retikulární formace, jader hlavových nervů a jejich aferentních a eferentních vláken. Z kmene vystupují mozkové nervy a procházejí prostorem [36] mezi kmenem a bazí a vstupují do lební baze. Porušena může být hybnost a koordinace končetin, inervace okohybná, obličeje a nosohltanu (diplopie, dysfonie, dysfagie) a dokonce i základní vitální funkce a stav vědomí. Při operacích expanzí vycházejících z obalů nervů nebo mozkových plen jsou ohroženy především mozkové nervy.
Vodivost kmenových vláken můžeme sledovat v obraze evokovaných odpovědí somatosenzorických a kmenových sluchových (BAEPs), viz kapitola Monitorace sluchových odpovědí (AEPs). Na základě skalpových SEPs je přímo hodnocena vodivost lemniscus medialis. Úsek dráhy v úrovni kmene nemá synapsi, tzn. reprezentuje rezistentní dráhu. Pokud vznikly změny v SEPs, nastaly již pravděpodobně poruchy vodivosti i v jiných drahách. Úbytek amplitudy N20/P25 představuje stupeň blokády vedení. Může být provázen i prodloužením latence N20. Pokles amplitudy na ≤ 50% je důvodem k varování, při dalším poklesu je vyhlášen alarm. Prodloužení latence o > 1 a ≤ 2 ms je významné a chirurg je varován, další prodloužení je důvodem pro alarm.
V mozkovém kmeni je řada důležitých drah, které monitorovat zatím nelze: 1. Retikulární formace (RF) je fragilní systém mnoha jader a vzájemných spojů uložených ve všech etážích kmene. Ascendentní systém (rafeální) s projekcí do celého neokortexu ovlivňuje vigilitu, internukleární kontroluje pohledové funkce, descendentní zajišťuje podkorovou kontrolu především svalového tonu a axiální motoriky. 2. Fasciculus longitudinalis medialis (FLM) probíhající parasagitálně těsně pod spodinou IV. komory rovněž není možné monitorovat, rozvoj internukleární oftalmoplegie nelze zachytit [37,38].
Při operaci nádorů v sinus cavernosus je riziko poranění karotidy, a tím i změna perfuze velkého mozku. Směrodatná je amplituda N20/P25. Je obrazem funkční zdatnosti generátoru korové somatosenzorické odpovědi.
Operace míšního konu
Trvalá sfinkterová porucha nebo porucha erekce nastává při poruše inervace segmentů S3–5. Zásadní ochrana těchto funkcí je při resekci expanzí míšního konu. Riziko chabé paraparézy je nižší. Inkontinence významně snižuje kvalitu života, komfort a společenské uplatnění pacienta. Pudendálními SEPs je možné funkci sfinkterů sledovat. Spolehlivost je vyšší než pro bulbokavernózní reflex. Registrace odpovědí je validní pouze z úrovně míšní, nad expanzí. Skalpová registrace je nespolehlivá [39].
Monitorace motorických odpovědí (MEPs)
Neurony primární motorické krajiny (M-I) mohou být stimulovány přes skalp – transkraniálně, z povrchu mozku – kortikálně nebo mohou být stimulovány axony kortikospinální dráhy v podkoří – subkortikálně. Každý ze způsobů stimulace je vhodný pro určitou skupinu operací. Transkraniální stimulace se používá při operacích míšních expanzí, skolióz nebo intrakraniálních aneuryzmat, kortikální při operacích v rolandické krajině na konvexitě a subkortikální při řešení expanzí, jejichž hranice v bílé hmotě je v intimním kontaktu s průběhem kortikospinální dráhy. Lze stimulovat motorickou dráhu i v úrovni míšní.
Stimulace
Transkraniální
Jedině elektrická stimulace je pro IOM vhodná a spolehlivá. Stimulace magnetická je nespolehlivá. Umístění spirálových subdermálních elektrod na skalp je snadné, rychlé, přesné, riziko dislokace nízké. Bolestivé vjemy kontrakce při stimulaci jsou v CA nepodstatné. Generovaný potenciál vzniká především v iniciálním segmentu axonů pyramidových buněk, odpovědí je „D-vlna“ (direct wave). Podrážděny jsou též dendrity pyramidových buněk a vertikálního větvení kortikálních interneuronů. Odpovědí je sekvence vln „I-vlny“ (indirect waves) opožděné o 1–2 ms [3]. Obě odpovědi jsou registrovány z míchy.
Stimulus má podobu krátké série rychle po sobě jdoucích pravoúhlých pulzů „train“ [12–14,40–43]. Stimulace může být prou-dová nebo napěťová. Aktivní elektrodou je vždy anoda uložená tam, kde se promítá primární korová oblast (M-I) na skalp (C3 a C4). Stimulus je monofázický – zapojení C3-Fz nebo C4-Fz, nebo bifázický – zapojení C3-C4, event. C1-C2 pro lepší dosažitelnost motoneuronů meziální plochy hemisféry (M-I pro DK) (obr. 3) [1,44,45].
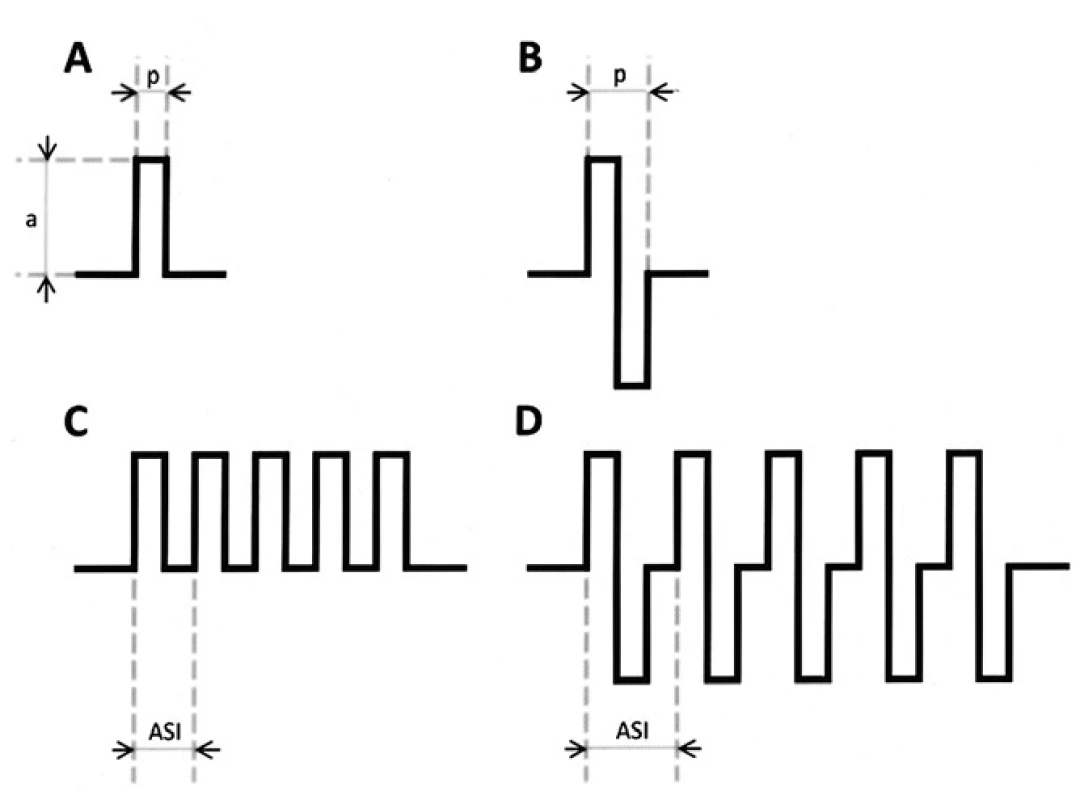
Magnetická stimulace je pro intraoperační použití nevhodná (viz výše). Spolehlivá fixace téměř není možná, je zapotřebí více cívek s vnitřním chlazením. Cívky jsou proti elektrodám několikanásobně větší, těžší a dražší. Odpovědí jsou pouze I-vlny, není možné vybavit D-vlnu.
Kortikální
Jsou zavedeny dvě techniky. Starší, nízkofrekvenční – Penfieldova, a novější, vysokofrekvenční krátký train – Taniguchiho [36]. Penfieldovou technikou byl kortex stimulován bipolární elektrodou trainem 50–60 Hz po dobu 1–2 s, šíře pulzu 1 ms. Stimulace je vysoce epileptogenní. Četnost intraoperačních záchvatů je 20–30%. Dosud je používána pro mapování řeči. Při stimulaci je vždy pořizován kortikogram a sledovány následné výboje (afterdischarges) a v případě jejich přetrvávání (self-sustained afterdischarges), které již představují záchvat, je mozek ochlazen ledovým fyziologickým roztokem, aby se šíření záchvatu zabránilo.
Vysokofrekvenční technika je podobnátranskraniální. Stimulace je proudová, krát-kým monofázickým trainem 3–5 pulzů šíře 0,3–0,4 ms a frekvence 300–500 Hz, intenzitou maximálně 25 mA, aby nedošlo k poškození mozku [46]. Stimulace je unipolární – anodou, katoda je na skalpu (Fpz) nebo bipolární. Pro mapování kůry se hledá prahová intenzita podnětu k vyvolání MEP. Epileptogenicita stimulace je < 1%. Rolandická oblast není pojem anatomický, není totožná s precentrálním gyrem. Motorická oblast je pojem funkční a je třeba ji vyšetřit funkčním způsobem. Každá operace v blízkosti motorické oblasti má být sledována stimulační IOM.
Subkortikální
V podkoří je nebezpečí poškození kortikospinální dráhy. Opakovanou stimulací bipolární a/nebo unipolární na stěnách resekční dutiny při postupující resekci je možné identifikovat místo, kde se hranice resekce blíží k průběhu kortikospinální dráhy. Pokud je odpověď vybavena podnětem > 10 mA, znamená to ještě bezpečnou vzdálenost motorické dráhy, paréza po operaci nevznikne. Pokud jepráh ≤ 5 mA, dráha je příliš blízko a paréza bude pravděpodobně trvalá.
Míšní
Bipolární stimulační elektroda (viz Registrace nMEPs) je uložena kraniálně od místa operace subdurálně na zadní straně míchy. Jednoduchý pravoúhlý pulz, intenzity 10–15 mA, vyvolá pohybující se potenciál ve všech vláknech míchy, který narozdíl od naturálního podnětu se šíří ortodromně i antidromně drahami vzestupnými (spinotalamická dráha, zadní provazce) i sestupnými (kortikospinální dráha). Nejblíže stimulační elektrodě jsou dráhy vzestupné.
Registrace
Svalová (myogenní MEPs) – mMEPs
Doporučuje se volit svalové skupiny standardně. Registrace z více svalů může přinést zpřesnění. Periferní skupiny svalů končetin jsou voleny záměrně, mají větší korovou reprezentaci v M-I. Podrážděno je více korových neuronů, vzruch je veden více axony kortikospinální dráhy, svalová odpověď je snadněji výbavná.
Míšní (neurogenní MEPs) – nMEPs
Dvoupólová stripová nebo trubičková registrační elektroda je zavedena v horními dolním pólu laminotomie epidurálně nebosubdurálně. Snímání je bipolární. Odpovědi vyžadují zprůměrnění 50–100 přeběhů [5,47]. Výbavnost D-vlny a I-vln není snížena myorelaxancii. Stimulace je jednotlivým transkraniálním pulzem, ten nevyvolá nežádoucí významnou kontrakci axiálních svalů.
Hodnocení MEPs
Myogenní odpovědi (mMEPs) jsou velmi citlivé ukazatele poškození motorické dráhy. Citlivost je způsobena synapsemi motoneuronu a na ploténce. Hlavní je výbavnost odpovědí. Při ohrožení míšních drah blokádou, kterou způsobuje operace, zmenšují se a mizí nejprve mMEPs. Když mMEPs vymizí na delší dobu než 1 min, je chirurg varován. Trvá‑li absence další minutu, znamená to alarm. Ztráta mMEPs může nastat po naložení retraktorů, preparaci tumoru nebo dočasném klipu mateřské tepny aneuryzmatu. Uvolněním retraktorů, přerušením resekce nebo preparace či uvolněním klipu se mMEPs obvykle obnoví během několika desítek sekund až minuty. Pokud není úprava úplná, chirurga informujeme. Pokud se mMEPs neobnoví, je chirurg varován. Ztráta mMEPs představuje riziko parézy. Ta může být přechodná i trvalá.
Neurogenní odpovědi (nMEPs): hlavním sledovaným parametrem je amplituda „D-vlny“. Důležité je porovnání záznamů z míšních elektrod nad lézí, pod lézí a mMEPs. Informací ke zvýšení pozornosti pro neurofyziologa je pokles amplitudy nMEP z kaudální elektrody o 30% původní hodnoty. Když je pokles o 50%, je chirurg varován [12]. Tehdy vzniká riziko rozvoje nové trvalé parézy. Pokud pokles trvá nebo se prohlubuje, je vyhlášen alarm.
Technika a úskalí monitorace MEPs
Monitorace MEPs je spolehlivější než SEPs v predikci pooperační parézy. Výbavnost mMEPs je na dolních končetinách obtížnější než na horních. Důvodem je anatomie uložení M-I pro horní a dolní končetinu. Proudová hustota je největší v blízkosti stimulační elektrody na skalpu (konvexita), nejnižší je právě uprostřed mezi elektrodami (meziální plocha hemisfér). S rostoucímstupněm parézy výrazně klesá výbavnost mMEPs. Jelikož jsou dolní končetiny postiženy častěji a obvykle ve vyšším stupni, je z těchto dvou hlavních důvodů výbavnost výrazně ztížena.
Motorické odpovědi při stimulaci míchy mohou být výsledkem vedení vzruchu motorickou drahou i senzitivními drahami [48]. Účast senzitivních drah je převažující [49]. Byly popsány dva případy pooperační paraplegie s falešně negativními odpověďmi ze svalů při stimulaci míšní [50]. Tato zkušenost neopravňuje považovat tuto techniku za spolehlivou.
Většina katastrof nastává v posledních minutách operace. Chirurg chce dokončittotální resekci, ale právě neúnosná radikalita výkonu někdy přináší trvalý deficit. Proto nelze nevýbavnost odpovědí podcenit. Manipulace s nervovou tkání může způsobit lokální vazospazmy v mikrocirkulaci a/nebo zvýšení koncentrace K+ v extracelulárním prostoru. Přerušení výkonu na několik minut a výplach rány fyziologickým roztokem přináší informaci o funkční obnovitelnosti kortikospinální dráhy. Jakákoliv obnova odpovědí je známkou zachované vodivosti motorických drah a chirurg může v práci pokračovat.
Rozlišení nebezpečí trvalé a přechodné parézy odliší až výbavnost odolnější D-vlny potom, co mMEPs již vymizely. Proto je účelné současně snímat svalové i míšní odpovědi. Zákrok pak není zbytečně par-ciální při ztrátě mMEPs a naopak je včas ukončen při poklesu D-vlny pod expanzí. Když je jakýkoliv pokles amplitudy D-vlny pod expanzí u astrocytomu, je rozumné resekci ukončit. U ependymomu je možné a účelné opakovaně resekci přerušit, vyčkat úpravy odpovědí a pak resekci provést radikálněji. Když jde o hemangioblastom, tam přestat nelze, ať je pokles jakýkoliv.
Míšní expanze především snižuje kvalitu života pacienta. Rozvoj deficitu probíhá obvykle monofázicky. Zvrat osudu nemocného zastavením dalšího zhoršování nabízí pouze uvolnění míchy odstraněním expanze. Riziko operace je zřejmé. Intra-operačním sledováním motorické míšní vodivosti se dá určit okamžik ohrožení a předejít vzniku nové poruchy. Intramedulární ložiska představují vyšší riziko ztráty a výrazně nižší možnost obnovy funkce. Čím lepší je kondice pacienta před operací, tím lepší je jeho pooperační prognóza [51]. IOM je možná pouze tehdy, má‑li pacient deficit nejhůře lehkého stupně, později již odpovědi nelze vybavit.
Intraoperační elektromyografie a neurografie
Nejčastější poruchou hlavových nervů je periferní paréza n. VII. Nejzávažnější poruchu představuje dysfagie spojená s rizikem aspirace způsobená parézou n. IX a X. Kvalitu života značně snižuje dysfonie nebo diplopie. Nerv je patrný buď na povrchu tumoru a v průběhu operace je registrací jeho vodivosti sledována jeho funkce, nebo je nádorem roztlačen a dislokován natolik, že je nejprve nutné nalézt jeho průběh. Nerv je třeba stimulovat v jeho proximálních částech (u kmene), protože i po anatomickém přerušení nervu jsou výbavné odpovědi na stimulaci periferního pahýlu ještě po dobu mnoha hodin i dní během probíhající Wallerovy degenerace [52,53].
Stimulační EMG – „triggered EMG“
Stimulace se provádí bipolární elektrodou krátkým monofázickým pravoúhlým pulzem šíře 50 µs a intenzity 0,01–4,0 mA v MMK a na bazi; 0,01–1,0 mA na spodině IV. komory. Frekvence stimulace je 1–2 Hz. Stimulovány jsou i kořeny v oblasti foramin při stabilizačních operacích, intenzita podnětu je 3–20 mA.
Stimulace v operačním poli má dvě fáze: 1. vyhledávací: stimuluje se vyšší intenzitou s cílem nalézt průběh nervu i pod vrstvou jiné tkáně, např. tumoru. 2. sledovací: stimulace anatomicky identifikovaného nervu je nejnižší intenzitou, která vyvolá konstantně myogenní odpověď [15]. Nejčastější příčinou poškození je přehřátí bipolární koagulací. Jakmile prahová intenzita podnětu v proximální porci nervu stoupne o ≥ 50%, je riziko vzniku pooperační parézy, proto chirurga varujeme. Další vzestup prahové intenzity indikuje alarm. Jakmile jednou odpověď zcela vymizí, bývá již většinou pozdě a plegie je trvalá.
Při hemifaciálním spazmu (HFS) dochází k abnormálnímu přenosu vzruchu mezi vlákny n. VII v segmentu lokální demyelinizace n. VII v místě neurovaskulárního konfliktu. Stimulací jedné z větví n. VII je registrována i odpověď z větve jiné s prodlouženou latencí. Tato „abnormální“ odpověď po provedení mikrovaskulární dekomprese (MVD) vymizí (obr. 4) [55].
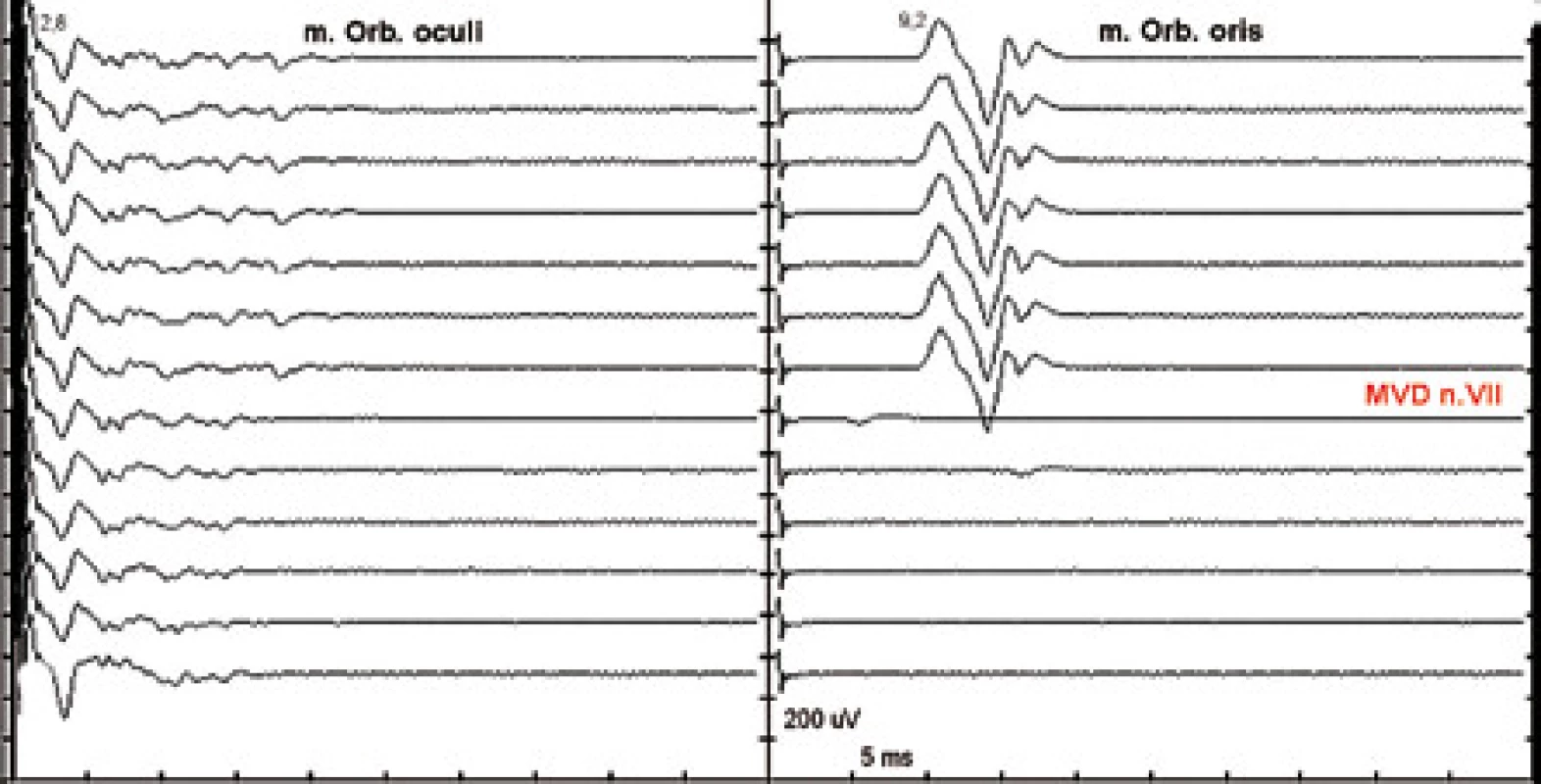
Nativní EMG – „free run EMG“
Mechanická manipulace, komprese, trakce,termický vliv bipolární koagulace aj. mo-hou způsobit intraneurální poranění se stimulačním účinkem. Takové podráždění může vyvolat akční potenciály axonů, které jsou pak snímány ze svalu jako rané potenciály („injury potentials“) [55]. Výboje se dělí na „spikes“, „bursts“ a „trains A, B, C“. Prognosticky nejvýznamnější je výskyt A-trainu (krátký 2–5 ms trvající bifázický výboj, amplitudy 100–300 uV, frekvence 100–200 Hz, vyskytuje se ve shlucích trvajících desítky milisekund). Hodnocení je kvalitativní i kvantitativní. Jeho výskyt vždy znamená varování. Senzitivita i specificita jsou 85, resp. 89% [56].
Neurografie při operacích periferních nervů
Sledování vodivosti periferních nervů má mnoho společného s operacemi v MMK a bazi lební. Zmíněny zde proto budou jen odlišnosti. Při těchto operacích je sledována vodivost nervu přes místo poranění nebo již dříve provedené sutury nervu. Vzácně při resekci nádoru.
Stimulační EMG hodnotí zachování nebo blokádu vedení motorických vláken, která dosahují od místa stimulace až k nervosvalové ploténce. Pokud není CMAP při stimulaci proximálně od poranění výbavný, není možné rozhodnout, zda regenerující vlákna ještě nedosáhla cílového svalu nebo neregenerují vůbec. Vždy je nutné aktivně prokázat, že stimulace neprobíhá na distálním pahýlu nervu (viz kapitola Intraoperační elektromyografie a neurografie). Předmětem IOM je zjištění vodivosti nervu přes místo poranění. Úspěšně výbavný neurogram (NAP) má trifázický tvar odpovědi PNP (iniciální pozitivita-negativita‑terminální pozitivita). Jestliže je blok vedení částečný, obrazem je snížení amplitudy nebo polyfázie. IOM vede k určení, zda vodivost vláken v daném úseku zachována je nebo není. Je‑li vodivost alespoň zčásti zachována (obnovena), je na místě uvolnění z jizvy. Při úplné blokádě je indikace k resekci poškozeného úseku a ke spojovací operaci.
Neurografie má řadu nesnází daných blízkostí stimulační a registrační elektrody. Proto je nutné, aby úsek monitorovaného nervu byl vypreparovaný v dostatečné délce. Vzdálenost mezi stimulací a registrací musí být alespoň 5cm (obr. 5). Někdy to znamená značně rozšířit operační ránu. Aby nebyly snímány a hodnoceny falešné odpovědi, je nutné místo stimulace řádně vysušit, stimulace je vždy bipolární, háčkovými elektrodami [53,57–60], případně tripolární (potlačení stimulus-artefaktu a extraneurálního šíření) [57].
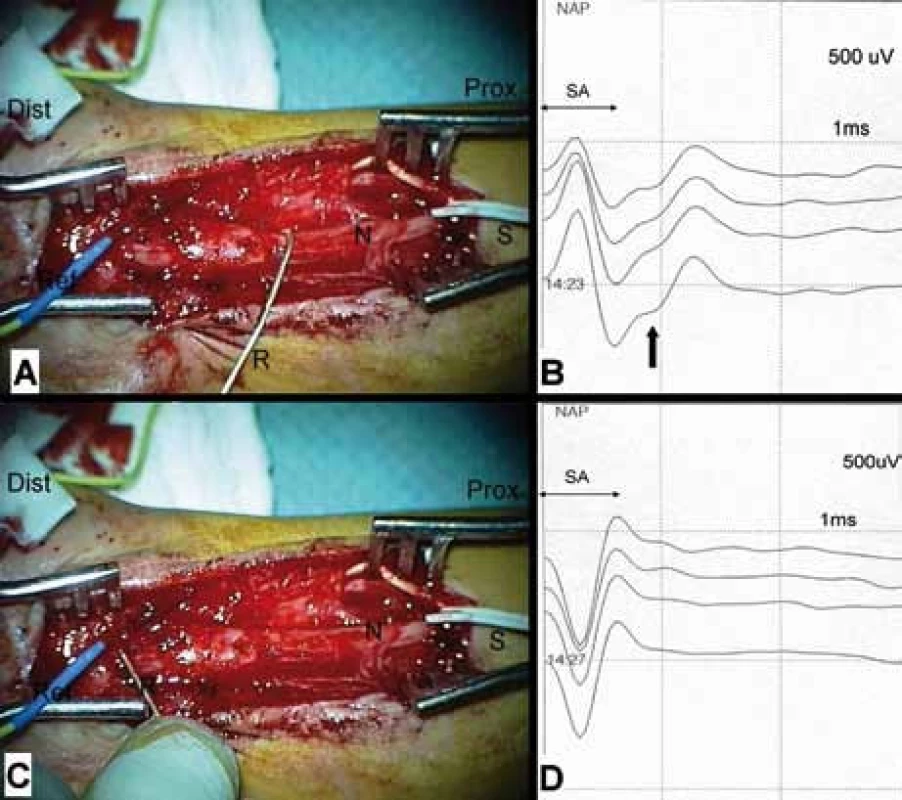
Transpedikulární stabilizace
Při stabilizaci bederní páteře je sledovánvztah mezi vrutem a průběhem kořene. Cílem je nalézt práh pro vybavení souhrnného svalového akčního potenciálu (CMAP). Když je práh < 10 mA, je nebezpečí poranění kořene, a pozice vrutu musí být opravena [61].
Monitorace sluchových odpovědí (AEPs)
Sluchová dráha probíhá v dorzolaterální části pontu od kochleárních jader a v dorzální části tegmenta mesencephala. Dráha má mohutné křížení v nukleární i v supranukleárních etážích (úroveň jader n. VIII–III)a to neumožňuje jednoznačně odlišit jednostranné a oboustranné poruchy. Hlavním důvodem IOM sluchových odpovědíjsou operace mozkového kmene a v MMK (schwannom n. VIII, MVD při HFS nebo neuralgii trigeminu). Naděje na zachování sluchu klesá se stupněm postižení před operací [62,63].
Drážděn je periferní sluchový analyzátor širokopásmovým nefiltrovaným klikem. Způsoby snímání odpovědí jsou tři: „far-field“ BAEPs ze skalpu, „near-field“ neurogram (NAPs) ze sluchového nervu [64,65] a nukleogram jader VIII n. z laterálního recessu IV. komory [58–66].
BAEPs
Odpovědi je možné sledovat bez ohledu na velikost tumoru v MMK. BAEPs mohou být nevýbavné, i když porucha sluchu není těžká. Další nevýhodou je dlouhý akviziční čas (zprůměrnění 1 000–2 000 přeběhů, tzn. 2–3 min) a silné a časté rušení z operačního pole (koagulace, vrtačka, ultrazvukový aspirátor – CUSA).
Cílem monitorace BAEPs je zachování užitečného sluchu. Sledována je výbavnost a amplituda vlny V. Dále pak jsou významné mezivrcholové latence I–V, I–III a III–V. Pro zachování sluchu je směrodatná stabilní výbavnost vlny V a interval I–V ≤ 4,0 ms.
Hodnocení BAEPs
K poškození sluchových funkcí dochází preparací tkáně tumoru (schwannomu) od vláken n. VIII, bipolární koagulací, retrakcí mozečku v mediolaterálním směru, při odvrtávání meatu [69].
Významný je náhlý pokles amplitudy vlny V na ≤ 50% baseline nebo prodloužení intervalu I–V o > 1 ms [70,71]. Náhle vzniklé významné změny jsou podnětem pro varování. Jsou obvykle způsobeny mechanickým poškozením nervu (komprese, trakce). Retraktor na mozečku pak musí být ihned uvolněn, sníží se intenzita bipolární koagulace, změní se místo a technika preparace nebo se výkon přeruší [69,72]. Pokud snížení trvá, je vyhlášen alarm a operace je ihned přerušena. Pokud se latence vln III a V pomalu prodlužují a amplitudy klesají, varování i alarm jsou vyhlášeny dříve [73]. Na vině je spíše porucha mikrocirkulace (vazospazmus kapilár v oblasti nervu). Řešením jsou reologika, zvýšení TK, kalciové blokátory a přerušení mechanického dráždění.
Ztráta výbavnosti všech odpovědí včetněvlny I je projevem zániku periferního gene-rátoru vzruchů, je projevem destrukce kochley – ischemie po koagulaci ve vnitřnímmeatu (a. auditiva interna) [62,68,70,72, 74,75]. Při poruše vedení nervem prodlou-žení latencí vln III–V je bilaterální. Důvodem je bohaté křížení drah v kmeni. Dle změn latencí a amplitud jednotlivých vln BAEPs je možné určit pouze etáž poruchy [19]. Snížení amplitudy a prodloužení všech latencí odpovědí je projevem systémovým (viz kapitola Úvod) [72]. Polysynaptická sluchová dráha reprezentuje dráhu fragilní, porucha vodivosti kmenových drah se v BAEPs projeví nejdříve, i po malých inzultech, když ostatní kmenové dráhy zůstávají většinou neporušeny. Jelikož sluchová dráha nezasahuje do oblongaty, poškození v dolním kmeni se poruchou BAEPs neprojeví.
NAPs a nukleogram
Monitorování sluchu „near-field“ je dosud výjimečné, ale perspektivní zvláště u tumorů mimo n. VIII. Elektroda je unipolární, tenká, flexibilní, na konci odizolována a obalena bavlněným smotkem, aby netraumatizovala nerv nebo kmen a přitom byl zachován dobrý kontakt elektrody s tkání a vodivost. Fixace elektrody je v okraji operačního pole [68]. Reference je na proc. mastoideus. Pro registraci NAPs je registrační elektroda uložena na proximální porci n. VIII mezi tumor a kmen, to jest co nejblíže jádrové oblasti [65–68,76,77]. Odpovědí je trifázická vlna PNP. Hodnotí se latence N1 a amplituda N1/P2. Nukleogram je registrován z laterálního recessu IV. komory, kam je stejná elektroda zavedena cestou foramen Luschkae, odpověď je polyfázická [66–68,76].
Hodnocení NAPs a nukleogramu
Významnou změnou je prodloužení latence N1 neurogramu nebo první negativity nukleogramu o ≥ 0,5 ms či pokles amplitudy na ≤ 50%. To je podnětem k varování. Delší trvání nebo prohloubení těchto změn znamená alarm. Sluch je ohrožen. Ztráta vlny N1 v proximálním segmentu n. VIII je indikátorem trvalé pooperační ztráty sluchu [63].
Spolehlivost „near-field“ odpovědí je výrazně vyšší: vyšší amplituda, kratší akviziční čas (10 s), lepší diferenciace. Nesnází je umístění elektrody. Aby bylo možné elektrodu uložit, expanze v MMK nesmí být příliš veliká. O tom, zda bude elektroda zavedena a kdy, rozhoduje chirurg. Potřeby IOM nesmí být splňovány za cenu neúměrného zvýšení rizika poškození. Elektroda nemusí ležet přímo na nervu, stačí, když bude v jeho blízkosti.
Závěr
Možnosti intraoperačního sledování funkce důležitých oblastí nervového systému a vo-divosti některých důležitých drah představuje prostředek ke snížení peroperační neurologické morbidity nejen v neurochirurgii. Zavedení techniky monitorování motorických drah přináší v oblasti neurochirurgie zvýšení bezpečnosti donedávna vysoce rizikových operací. Např. umožňuje a opravňuje provést resekci míšního nádoru u pacienta asymptomatického s vědomím nejnižšího rizika peroperační morbidity. Vyčkávat na rozvoj paraparézy představuje pro pacienta vyšší riziko pooperačního deficitu.
IOM se již stala integrální součástí řady neurochirurgických operací. Např. CEA, aneuryzmata ACM, expanze v rolandické krajině, IV. komoře, MMK, intramedulární a některé intradurální-extramedulární. Ve světě je IOM již dlouho zavedená technika zvyšující bezpečnost neurochirurgických zákroků. V ČR je již na šesti neurochirurgiích velmi dobře zavedena a na dalších pěti se velmi zdárně rozvíjí a požadavky ze strany neurochirurgů stále rostou.
Přístrojová technika umožňuje v reálném čase shromažďovat a zpracovávat dostatečně velké množství dat, které je podkladem mnohokanálového a multimodálního snímání.
Vysokorychlostní připojení dává možnost „monitorace na dálku“. Ta zatím není u nás praktikována. Význam má pouze jako prostředek dohledu nebo pro školení začínajících neurofyziologů, případně pro on‑line konzultace. Přítomnost neurofyziologa na sále po dobu vlastního výkonu stále je a nadále bude žádoucí.
Přijato k recenzi: 9. 10. 2009
Přijato do tisku: 16. 12. 2009
MUDr. Svatopluk Ostrý, Ph.D.
Neurochirurgická klinika 1. LF UK, IPVZ a ÚVN Praha
U Vojenské nemocnice 1200
169 02 Praha 6
e-mail: svatopluk.ostry@uvn.cz
MUDr. Svatopluk Ostrý, Ph.D.
Dr. Ostrý se narodil 29. 11. 1976 v Novém Jičíně, absolvoval gymnázium se zaměřením na matematiku a přírodní vědy v Bílovci (1995), promoval na 1. LF UK v Praze v oboru lékařství v roce 2001. Nyní působí na Neurochirurgické klinice 1. LF UK, IPVZ a ÚVN, v roce 2007 obhájil dizertační práci v oboru neurověd. Atestace I. a II. stupně z neurologie složil v letech 2004 a 2008. Od roku 2005 se podílí na pregraduální výuce neurochirurgie. Věnuje se klinické neurofyziologii, zvláště pak intraoperační monitoraci a cévní neurologii a neurochirurgii. Je členem České lékařské společnosti JEP, České neurologické, neurochirurgické a neurofyziologické společnosti a mezinárodní společnosti pro intraoperační neurofyziologii (ISIN).
prof. MUDr. Lubor Stejskal, DrSc. (1931)
Prof. Stejskal maturoval na Koleji (dnešní Gymnázium) Jiřího z Poděbrad, lékařství vystudoval na 1. LF UK v Praze, jako sekundární lékař pracoval dva roky na neurologickém oddělení v Kolíně, jako primář působil sedm let na neurologii v Kladrubech a posledních 40 let jako lékař a vědecký pracovník na Neurochirurgické klinice ÚVN Praha. Studoval a publikoval témata z oblasti neurologických poruch hybnosti. Habilitoval v roce 1989, profesura mu byla udělena v roce 1990. Zabývá se klinickou elektrofyziologií, chovem beranů Suffolk a ikonografií města Poděbrady.
Vědomostní test
1. Jaká anestetika jsou vhodná pro monitoraci MEPs?
- a) opioidy
- b) propofol
- c) izofluran
- d) myorelaxancia
2. Vyberte správné tvrzení týkající se intravenózní anestezie (TIVA):
- a) je používána, aby bylo možno monitorovat SEPs
- b) umožňuje monitoraci mMEPs při transkraniální stimulaci motorické kůry
- c) je podáván bolusově N2O
- d) je aplikován kontinuálně propofol
3. Které odpovědi jsou nejméně ovlivněny anestetiky?
- a) SEPs
- b) MEPs
- c) BAEPs
- d) D-vlna
4. Zvrat fází SEPs je možné registrovat:
- a) pouze při snímání z kůry mozku
- b) v časných i pozdních odpovědích
- c) z kůry, epidurálně i ze skalpu
- d) pouze při stimulaci n. medianus
5. Spolehlivou monitoraci pro ochranu sfinkterových funkcí představují:
- a) pudendální SEPs
- b) mMEPs zevního svěrače
- c) bulbokavernózní reflex
- d) stimulace míchy
6. Zachovaná výbavnost SEPs n. medianus při operacích v mozkovém kmeni:
- a) je nepřímou známkou zachování vědomí po operaci
- b) je přímou známkou zachování vědomí po operaci
- c) je nepřímou známkou vodivosti lemniscus medialis
- d) je přímou známkou vodivosti lemniscus medialis
7. Transkraniální stimulace motorické kůry je intraoperačně prováděna:
- a) elektricky
- b) magneticky
- c) elektromagneticky
- d) vysokofrekvenčním trainem
8. Ztráta mMEPs při operaci míšní expanze může znamenat:
- a) přechodnou parézu
- b) trvalou parézu
- c) paraplegii
- d) vše zmíněné
9. Přímou stimulací míchy:
- a) jsou neselektivně podrážděna všechna míšní vlákna
- b) je možné vyvolat motorickou odpověď i při přerušení kortikospinální dráhy
- c) je spolehlivá technika nahrazující transkraniální stimulaci
- d) je nespolehlivá technika monitorování kortikospinální dráhy
10. Trvalé zhoršení svalové síly po operaci nastane, když:
- a) je pokles amplitudy D-vlny na < 50 % úvodních hodnot
- b) vymizí mMEPs
- c) vymizí SEPs
- d) vymizí mMEPs a zároveň poklesne amplituda D-vlny pod 50 %
11. Náhlá ztráta všech komponent BAEPs znamená:
- a) ischemii kochley
- b) technickou závadu stimulace
- c) přerušení sluchového nervu v mostomozečkovém koutu
- d) poruchu vedení lemniscus lateralis kontralaterálně
12. Pozvolný pokles amplitudy a prodloužení latence „vlny V“ v BAEPs znamená:
- a) poruchu funkce kochley
- b) nutnost varovat chirurga a přerušit operaci
- c) vazospazmus v mikrocirkulaci v oblasti n. VIII způsobený mechanickou manipulací
- d) nebezpečí trvalé ztráty sluchu
13. Jednostranná porucha vodivosti n. cochlearis při operaci v MMK se projeví v záznamech BAEPs:
- a) bilaterálně
- b) pouze na straně stimulace
- c) pouze kontralaterálně ke straně stimulace
- d) stimulace je vždy oboustranná, takže se neprojeví
14. Nejcitlivějším markerem pooperační parézy v obraze nativního EMG je:
- a) neexistují takové výboje
- b) bursts
- c) spikes
- d) A-train
15. Stimulací distálního pahýlu periferního nervu:
- a) nelze vyvolat CMAP
- b) lze vyvolat CMAP v akutní fázi poranění
- c) se prokazuje blok vedení
- d) je možné identifikovat míru reinervace
16. Efapse znamená:
- a) abnormální přenos signálu na nervosvalové ploténce
- b) registrovaná ze svalu inervovaného jinou větví nervu, než je stimulována
- c) vymizí ihned po mikrovaskulární dekompresi n. VII
- d) abnormální přenos akčního potenciálu mezi vlákny axonů v místě demyelinizace
17. Monitorování okulomotoriky je možné:
- a) sledováním fasciculus longitudinalis medialis
- b) stimulací okohybných nervů a registrací CMAP z přímých očních svalů
- c) nelze monitorovat
- d) MEPs okohybných svalů
18. Funkční MR zobrazuje:
- a) aktivitu neuronů
- b) intravaskulární změny způsobené neuronální aktivací
- c) změny perfuze v aktivovaných zónách mozku
- d) zvýšení metabolizmu neuronů
19. Jaké se používají registrační elektrody na sále:
- a) povrchové – lepené
- b) spirálkové
- c) jehlové
- d) prstýnkové
20. Klinické a elektrografické vyšetření v laboratoři je pro intraoperační monitoraci:
- a) bezpodmínečně nutné před každým monitoringem
- b) vhodné, ale není nutné
- c) nemá význam
- d) je možné provést na sále bezprostředně před operací
Správná je jedna či více odpovědí.
Za správné vyřešení testu získá řešitel 5 kreditů ČLK. Test můžete vyplnit na:
www.csnn.eu
Zdroje
1. Stejskal L. Intraoperační stimulační monitorace v neurochirurgii. Praha: Grada Publishing; 2006.
2. Urgošík D, Stejskal L, Živný B. Zásady intraoperačního sledování evokovaných odpovědí. Cesk Slov Neurol N 1993; 56/89(3): 104–107.
3. Sloan TB. Anesthesia and motor evoked potential monitoring. In: Deletis V, Shils JL (eds). Neurophysiology in neurosurgery. A modern intraoperative approach. San Diego: Academic Press, Elsevier Science 2002 : 451–474.
4. Sloan TB, Heyer EJ. Anesthesia for intraoperative neurophysiologic monitoring of the spinal cord. J Clin Neurophysiol 2002; 19(5): 430–443.
5. Yang LH, Lin SM, Lee WY, Liu CC. Intraoperative transcranial electrical motor evoked potential monitoring during spinal surgery under intravenous ketamine or etomidate anaesthesia. Acta Neurochir (Wien) 1994; 127(3–4): 191–198.
6. Porkkala T, Jäntti V, Kaukinen S, Hakkinen V. Nitrous oxide has different effects on the EEG and somatosensory evoked potentials during isoflurane anaesthesia in patients. Acta Anaesthesiol Scand 1997; 41(4): 497–501.
7. Pinto FF, Nunes L, Ferraz F, Sampayo F. Down’s syndrome: different distribution of congenital heart diseases between the sexes. Int J Cardiol 1990; 27(2): 175–178.
8. Kawaguchi M, Sakamoto T, Inoue S, Kakimoto M, Furuya H, Morimoto T et al. Low dose propofol as a supplement to ketamine‑based anesthesia during intraoperative monitoring of motor‑evoked potentials. Spine 2000; 25(8): 974–979.
9. Keller BP, Haghighi SS, Oro JJ, Eggers GW jr. The effects of propofol anesthesia on transcortical electric evoked potentials in the rat. Neurosurgery 1992; 30(4): 557–560.
10. Inoue S, Kawaguchi M, Takashi S, Kakimoto M, Sakamoto T, Kitaguchi K et al. Intraoperative monitoring of myogenic motor‑evoked potentials from the external anal sphincter muscle to transcranial electrical stimulation. Spine 2002; 27(21): E454–E459.
11. Lee WY, Hou WY, Yang LH, Lin SM. Intraoperative monitoring of motor function by magnetic motor evoked potentials. Neurosurgery 1995; 36(3): 493–500.
12. Morota N, Deletis V, Constantini S, Kofler M, Cohen H,Epstein FJ. The role of motor evoked potentials during surgery for intramedullary spinal cord tumors. Neurosurgery 1997; 41(6): 1327–1336.
13. Pechstein U, Cedzich C, Nadstawek J, Schramm J.Transcranial high‑frequency repetitive electrical stimulation for recording myogenic motor evoked potentials with the patient under general anesthesia. Neurosurgery 1996; 39(2): 335–344.
14. Pelosi L, Stevenson M, Hobbs GJ, Jardine A, Webb JK. Intraoperative motor evoked potentials to transcranial electrical stimulation during two anaesthetic regimens. Clin Neurophysiol 2001; 112(6): 1076–1087.
15. Holland NR. Intraoperative electromyography. J Clin Neurophysiol 2002; 19(5): 444–453.
16. Calancie B, Harris W, Broton JG, Alexeeva N, Green BA. „Threshold-level“ Multipulse transcranial electrical stimulation of motor cortex for intraoperative monitoring of spinal motor tracts: description of method and comparison to somatosensory evoked potential monitoring. J Neurosurg 1998; 88(3): 457–470.
17. Bala E, Sessler DI, Nair DR, McLain R, Dalton JE, Farag E.Motor and somatosensory evoked potentials are well maintained in patients given dexmedetomidine during spine surgery. Anesthesiology 2008; 109(3): 417–425.
18. Burke D, Nuwer MR, Daube J, Fischer C, Schramm J, Yingling CD et al. Intraoperative monitoring. The International Federation of Clinical Neurophysiology. Electroencephalogr Clin Neurophysiol 1999; 52 (Suppl): 133–148.
19. Legatt AD. Mechanisms of intraoperative brainstem auditory evoked potential changes. J Clin Neurophysiol 2002; 19(5): 396–408.
20. Stejskal L, Ostry S. Vaskulární versus neuronální reaktivita (stav při stenóze vnitřní karotidy a po endarterektomii). Neurol pro praxi 2007; 8(6): 371–375.
21. Allison T, McCarthy G, Wood CC, Williamson PD, Spencer DD. Human cortical potentials evoked by stimulation of the median nerve i. Cytoarchitectonic areas generating short‑latency activity. J Neurophysiol 1989; 62(3): 694–710.
22. Allison T, McCarthy G, Wood CC, Williamson PD, Spencer DD. Human cortical potentials evoked by stimulation of the median nerve II. Cytoarchitectonic areas generating long‑latency activity. J Neurophysiol 1989; 62(3): 711–722.
23. Tomás R, Haninec P, Houstava L. The relevance of the corticographic median nerve somatosensory evoked potentials (SEPs) phase reversal in the surgical treatment of brain tumors in central cortex. Neoplasma 2006; 53(1): 37–42.
24. Berger MS, Kincaid J, Ojemann GA, Lettich E. Brain mapping techniques to maximize resection, safety, and seizure control in children with brain tumors. Neurosurgery 1989; 25(5): 786–792.
25. Cedzich C, Taniguchi M, Schäfer S, Schramm J. Somatosensory evoked potential phase reversal and direct motor cortex stimulation during surgery in and around the central region. Neurosurgery 1996; 38 : 962–970.
26. Wood CC, Spencer DD, Allison T, McCarthy G, Williamson PD, Goff WR. Localization of human sensorimotor cortex during surgery by cortical surface recording of somatosensory evoked potentials. J Neurosurg 1988; 68(1): 99–111.
27. Lewis SC, Warlow CP, Bodenham AR, Colam B, Rothwell PM, Torgerson D et al. General anaesthesia versus local anaesthesia for carotid surgery (GALA): a multicentre, randomised controlled trial. Lancet 2008; 372(9656): 2132–2142.
28. McPherson RW, Eimerl D, Traystman RJ. Interaction of hypoxia and hypercapnia on cerebral hemodynamics and brain electrical activity in dogs. Am J Physiol 1987; 25(4): H890–H897.
29. Branston NM, Symon L, Crockard HA, Pasztor E. Relationship between the cortical evoked potential and local cortical blood flow following acute middle cerebral artery occlusion in the baboon. Exp Neurol 1974; 45(2): 195–208.
30. Stejskal L, Kramár F, Ostrý S, Benes V, Mohapl M, Limberk B. Experience of 500 cases of neurophysiological monitoring in carotid endarterectomy. Acta Neurochir (Wien) 2007; 149(7): 681–688.
31. Kramář F, Zoul J, Mohapl M, Beneš V. Monitorace nemocných během karotické endarterektomie. Cesk Slov Neurol N 1997; 62/95(4): 197–202.
32. Florence G, Guerit JM, Gueguen B. Electroencephalography (EEG) and somatosensory evoked potentials (SEP) to prevent cerebral ischaemia in the operating room. Neurophysiol Clin 2004; 34(1): 17–32.
33. Mraček J, Holečková I, Mork J, Frdlík J, Škorpil J.Postavení peroperační neuromonitorace, neuroprotekce a preventivní karotické endarterektomie u nemocných se zvýšeným rizikem mozkové ischemie indikovaných ke kardiochirurgické operaci. Rozhl Chir 2009; 88(5): 264–268.
34. Deletis V, Shils JL. Neurophysiology in neurosurgery. A modern intraoperative approach. San Diego, CA: Academic Press, Elsevier Science USA 2002.
35. Neuloh G, Schramm J. Monitoring of motor evoked potentials compared with somatosensory evoked potentials and microvascular doppler ultrasonography in cerebral aneurysm surgery. J Neurosurg 2004; 100(3): 389–399.
36. Taniguchi M, Cedzich C, Schramm J. Modification of cortical stimulation for motor evoked potentials under general anesthesia: technical description. Neurosurgery 1993; 32(2): 219–226.
37. Bricollo A, Sala F. Surgery of brainstem lesions. In: Deletis V, Shils JL (eds). Neurophysiology in neurosurgery. A modern intraoperative approach. San Diego: Academic Press, Elsevier Science 2002 : 267–289.
38. Morota N, Deletis V, Epstein FJ. Brainstem mapping. In: Deletis V, Shils JL (eds). Neurophysiology in neurosurgery. A modern intraoperative approach. San Diego: Academic Press, Elsevier Science 2002 : 319–335.
39. Vodusek DB, Deletis V. Intraoperative neurophysiological monitoring of the sacral nervous system. In: Deletis V, Shils JL (eds). Neurophysiology in neurosurgery. A modern intraoperative approach. San Diego: Academic Press, Elsevier Science 2002 : 197–218.
40. Calancie B, Harris W, Brindle GF, Green BA, Landy HJ. Threshold‑level repetitive transcranial electrical stimulation for intraoperative monitoring of central motor conduction. J Neurosurg 2001; 95 (2 Suppl): 161–168.
41. MacDonald DB. Safety of intraoperative transcranial electrical stimulation motor evoked potential monitoring. J Clin Neurophysiol 2002; 19(5): 416–429.
42. MacDonald DB, Al Zayed Z, Khoudeir I, Stigsby B. Monitoring scoliosis surgery with combined multiple pulse transcranial electric motor and cortical somatosensory-evoked potentials from the lower and upper extremities. Spine 2003; 28(2): 194–203.
43. Galanda M, Babicová A, Petráš F, Šulaj J, Béreš A. Peroperačná elektrická stimulácia při operáciách v centrálných oblastiach mozgu a v mieche. Cesk Slov Neurol N 2001; 64/97(5): 338–343.
44. Němec M, Bednařík J, Krbec M, Mokrá M. Peroperační monitorace somatosenzorických a motorických evokovaných potenciálů u operací skolióz. Cesk Slov Neurol N 2006; 69/102(1): 45–51.
45. Ceé J, Sameš M, Bartoš R, Vachata P, Vaněk P, Kašperek J, et al. Peroperační monitorace motorických evokovaných odpovědí za užití transkraniální elektrické stimulace – naše první klinické zkušenosti. Cesk Slov Neurol N2006; 69/102(5): 365–380.
46. Cedzich C, Pechstein U, Schramm J, Schäfer S. Electrophysiological considerations regarding electrical stimulation of motor cortex and brain stem in humans. Neurosurgery 1998; 42(3): 527–532.
47. Péréon Y, Nguyen The Tich S, Delécrin J, Pham Dang C,Bodin J, Drouet JC et al. Combined spinal cord monitoring using neurogenic mixed evoked potentials and collision techniques. Spine 2002; 27(14): 1571–1576.
48. Deletis V. The “motor” inaccuracy in neurogenic motor evoked potentials. Clin Neurophysiol 2001; 112(8): 1365–1366.
49. Toleikis JR, Skelly JP, Carlvin AO, Burkus JK. Spinally elicited peripheral nerve responses are sensory rather than motor. Clin Neurophysiol 2000; 111(4): 736–742.
50. Minahan RE, Sepkuty JP, Lesser RP, Sponseller PD, Kostuik JP. Anterior spinal cord injury with preserved neurogenic “motor” evoked potentials. Clin Neurophysiol 2001; 112(8): 1442–1450.
51. Raco A, Esposito V, Lenzi J, Piccirilli M, Delfini R, Cantore G. Long‑term follow‑up of intramedullary spinal cord tumors: a series of 202 cases. Neurosurgery 2005; 56(5): 972–981.
52. Stejskal L. Rané elektrofyziologické změny v přerušeném periferním nervu u člověka. Vojenské zdravotnické listy 1983; 52(1): 72–79.
53. Zvěřina E, Stejskal L. Poranění periferních nervů. Praha: Avicenum 1979.
54. Ostrý S, Stejskal L, Plas J. Peroperační monitorování při mikrovaskulární dekompresi pro faciální hemispazmus a neuralgii trigeminu. Cesk Slov Neurol N 2003; 66/99 : 404–408.
55. Eisner W, Schmid UD, Reulen HJ, Oeckler R, Olteanu-Nerbe V, Gall C et al. The mapping and continuous monitoring of the intrinsic motor nuclei during brain stem surgery. Neurosurgery 1995; 37(2): 255–265.
56. Romstöck J, Strauss C, Fahlbusch R. Continuous electromyography monitoring of motor cranial nerves during cerebellopontine angle surgery. J Neurosurg 2000; 93(4): 586–593.
57. Happel L, Kline D. Intraoperative neurophysiology of the peripheral nervous system. In: Deletis V, Shils JL(eds). Neurophysiology in neurosurgery. A modern intraoperative approach. San Diego: Academic Press 2002 : 169–195.
58. Kline DG, Hackett ER, May PR. Evaluation of nerve injuries by evoked potentials and electromyography. J Neurosurg 1969; 31(2): 128–136.
59. Kline DG, Hackett ER, May PR. Partial nerve laceration evaluated by evoked potentials. J Surg Res 1970; 10(2): 81–90.
60. Williams HB, Terzis JK. Single fascicular recordings: An intraoperative diagnostic tool for the management of peripheral nerve lesions. Plast Reconstr Surg 1976; 57(5): 562–569.
61. Toleikis RJ. Neurophysiological monitoring during pedicle screw placement. In: Deletis V, Shils JL (eds). Neurophysiology in neurosurgery. A modern intraoperative approach. San Diego: Academic Press, Elsevier Science 2002 : 231–263.
62. Schlake HP, Milewski C, Goldbrunner RH, Kindgen A,Riemann R, Helms J et al. Combined intra-operative monitoring of hearing by means of auditory brainstem responses (ABR) and transtympanic electrocochleography (ecochg) during surgery of intra - and extrameatal acoustic neurinomas. Acta Neurochir (Wien) 2001; 143(10): 985–995.
63. Tonn JC, Schlake HP, Goldbrunner R, Milewski C,Helms J, Roosen K. Acoustic neuroma surgery as an interdisciplinary approach: A neurosurgical series of 508 patients. J Neurol Neurosurg Psychiatry 2000; 69(2): 161–166.
64. Møller AR, Jannetta PJ, Sekhar LN. Contributions from the auditory nerve to the brain‑stem auditory evoked potentials (BAEPs): Results of intracranial recording in man. Electroencephalogr Clin Neurophysiol 1988; 71(3): 198–211.
65. Møller AR, Moller MB, Jannetta PJ, Jho HD. Auditory nerve compound action potentials and brain stem auditory evoked potentials in patients with various degrees of hearing loss. Ann Otol Rhinol Laryngol 1991; 100(6): 488–495.
66. Matthies C, Samii M. Management of vestibular schwannomas (acoustic neuromas): the value of neurophysiology for evaluation and prediction of auditory function in 420 cases. Neurosurgery 1997; 40(5): 919–929.
67. Møller AR, Jannetta PJ, Jho HD. Click‑evoked responses from the cochlear nucleus: A study in human. Electroencephalogr Clin Neurophysiol 1994; 92(3): 215–224.
68. Møller AR. Monitoring auditory function during operations to remove acoustic tumors. Am J Otol 1996; 17(3): 452–460.
69. Jannetta PJ, Møller AR, Moller MB. Technique of hearing preservation in small acoustic neuromas. Ann Surg 1984; 200(4): 513–523.
70. Harper CM, Harner SG, Slavit DH, Litchy WJ, Daube JR, Beatty CW et al. Effect of BAEP monitoring on hearing preservation during acoustic neuroma resection. Neurology 1992; 42(8): 1551–1553.
71. Matthies C, Samii M. Management of vestibular schwannomas (acoustic neuromas): The value of neurophysiology for intraoperative monitoring of auditory function in 200 cases. Neurosurgery 1997; 40(3): 459–468.
72. Battista RA, Wiet RJ, Paauwe L. Evaluation o three intraoperative auditory monitoring techniques in acoustic neuroma surgery. Am J Otol 2000; 21(2): 244–248.
73. Neu M, Strauss C, Romstock J, Bischoff B, Fahlbusch R. The prognostic value of intraoperative BAEP patterns in acoustic neurinoma surgery. Clin Neurophysiol 1999; 110(11): 1935–1941.
74. Sekiya T, Møller AR. Avulsion rupture of the internal auditory artery during operations in the cerebellopontine angle: A study in monkeys. Neurosurgery 1987; 21(5): 631–637.
75. Rowed DW, Nedzelski JM. Hearing preservation in the removal of intracanalicular acoustic neuromas via the retrosigmoid approach. J Neurosurg 1997; 86(3): 456–461.
76. Cueva RA, Morris GF, Prioleau GR. Direct cochlear nerve monitoring: First report on a new atraumatic, self-retaining electrode. Am J Otol 1998; 19(2): 202–207.
77. Samii M, Matthies C. Management of 1000 vestibular schwannomas (acoustic neuromas): Hearing function in 1000 tumor resections. Neurosurgery 1997; 40(2): 248–260.
Štítky
Detská neurológia Neurochirurgia NeurológiaČlánok vyšiel v časopise
Česká a slovenská neurologie a neurochirurgie

2010 Číslo 1
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Kombinace paracetamolu s kodeinem snižuje pooperační bolest i potřebu záchranné medikace
- CIDP: epidemiológia, klinický obraz a diagnostika v kocke
Najčítanejšie v tomto čísle
- Mitochondriální encefalomyopatie na podkladě deficitu proteinu Sco2 s obrazem SMA‑like neurogenní svalové atrofie – kazuistiky
- Vyšetření čichu u neurologických onemocnění pomocí Testu parfémovaných fixů
- Kongenitální myastenické syndromy – kazuistiky
- Evokované odpovědi a elektromyografie v intraoperační monitoraci v neurochirurgii


