-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Magnetická rezonanční relaxometrie u roztroušené sklerózy – měření T2 relaxačního času v centrální šedé hmotě
Magnetic Resonance Relaxometry in Multiple Sclerosis – T2 Relaxation Time Measurement in Central Gray Matter
Objective:
To establish the increased amount of iron deposits in central grey matter structures in patients suffering from multiple sclerosis (MS). MR relaxometry detects iron in normal-appearing grey matter, that is, in advance of any visible MRI manifestation of iron deposits, or T2 hypointensity. A further goal was to correlate T2 relaxation time to the volume of T2 hyperintense lesions-lesion load (LL).Materials and method:
347 patients with clinically defined MS and 117 controls were examined with MRI, using gradient and spin echo sequence (GraSE) for the calculation of T2 relaxation time. The two cohorts were age - and sex-matched in T2 correlation. Further, the MS patients were divided into two subgroups according to LL (LL < 2 cm3: 140 patients, LL > 5 cm3: 80 patients) and were T2 correlated in these age-matched groups.Results:
We established a statistically significant increase of iron deposits in ncl. caudatus bilaterally (left p = 0.004; right p = 0.033) and in left putamen (p = 0.006) in MS patients as opposed to healthy controls. Our measurements indicated no shortening of T2 in either thalamus. Correlation of LL with T2 demonstrated that in the group with LL < 2 cm3 the T2 shortening is statistically more significant than in patients with LL > 5 cm3 in putamen bilaterally (left p < 0.001; right p = 0.006).Conclusions:
There is an increase of iron deposits in the basal ganglia of MS patients in comparison with controls. Further, there is an increase of iron deposits in the basal ganglia of low LL patients in comparison with high LL patients. The changes of iron content in the brain support our hypothesis that there exists a neurodegenerative component in the disease.Key words:
multiple sclerosis – iron deposit – magnetic resonance imaging –T2 relaxometry
Autoři: Andrea Burgetová 1
; Z. Seidl 1,2; M. Vaněčková 1; J. Krásenský 1; D. Horáková 3
Působiště autorů: Radiodiagnostická klinika 1. LF UK a VFN v Praze 1; Vyšší zdravotnická škola, Praha 2; Neurologická klinika 1. LF UK a VFN v Praze 3
Vyšlo v časopise: Cesk Slov Neurol N 2010; 73/106(1): 26-31
Kategorie: Původní práce
Souhrn
Cíl:
Cílem práce je prokázat zvýšené ukládání železa v centrálních strukturách šedé hmoty u pacientů s roztroušenou sklerózou (RS). MR relaxometrie stanovuje železo v normálně vyhlížející šedé hmotě, tedy před MR viditelnými projevy nadměrného ukládání, kterými jsou T2 hypointenzity. Dalším cílem je korelace T2 relaxačního času (T2) a objemu T2 hyperintenzních ložisek (lesion load, LL).Soubor a metodika:
347 pacientů s klinicky definovanou RS a 117 kontrol bylo vyšetřeno na MR, včetně sekvence Multiecho (GraSE, gradient and spin echo) k výpočtu T2. Při korelaci T2 byli pacienti spárováni s kontrolami dle věku a pohlaví. Dále byli pacienti rozděleni na dvě podskupiny dle LL; 1. LL < 2 cm3: 140 pacientů, a LL > 5 cm3: 80 pacientů; a byl korelován T2 mezi oběma skupinami spárovanými dle věku.Výsledky:
Prokázali jsme statisticky významné zvýšené ukládání železa u pacientů s RS proti kontrolám v ncl. caudatus oboustranně (vlevo p = 0,004; vpravo p = 0,033) a v levém putamen (p = 0,006). V talamech dle našich měření dochází k prodlužování T2. Korelace LL s T2 prokázala, že ve skupině s LL< 2 cm3 je zkracování T2 statisticky významnější než u pacientů s LL > 5 cm3 v putamen oboustranně (vlevo p < 0,001; vpravo p = 0,006).Závěry:
Zjistili jsme, že u pacientů s RS dochází v bazálních gangliích k většímu ukládání železa než u zdravých kontrol. Dále jsme zjistili, že v podskupině tzv. nízkoobjemových RS (dle LL) je ukládání železa v bazálních gangliích větší než v podskupině vysokoobjemových RS. Změny obsahu železa v mozku podporují hypotézy o neurodegenerativní složce nemoci.Klíčová slova:
roztroušená skleróza – železo – magnetická rezonance – T2 relaxometrieÚvod
Z tradičního pohledu je roztroušená skleróza (RS) autoimunitně vázaný chronický zánět centrálního nervového systému (CNS) vedoucí k demyelinizaci bílé hmoty. Novější poznatky ukazují, že již od počátku dochází také k axonálním ztrátám, které se projeví později, až se vyčerpají rezervy CNS, a jsou příčnou ireverzibilních neurologických změn [1]. RS je dnes považována za globální onemocnění CNS, které zahrnuje změny zánětlivé, demyelinizační a degenerativní včetně mozkové atrofie [2].
MR se stala nejvýznamnějším paraklinickým nástrojem pro diagnostiku RS. Široké užití MR ale postupně ukázalo, že na konvenční MR viditelná T2, event. FLAIR (fluid‑attenuated inversion recovery) hyperintenzní ložiska často nekorelují s klinickým stavem a průběhem onemocnění. Tato skutečnost se označuje jako klinickoradiologický paradox. Za neurologickými projevy pacientů s RS často stojí změny skrývající se v normálně vyhlížející bílé i šedé hmotě. S cílem postihnout tyto změny se do diagnostiky RS zavádějí nové MR techniky. Tyto metody zahrnují volumometrické zpracování konvenčně získaných MR obrazů: kvantifikace T2 hyperintenzních lézí (LL, lesion load), měření mozkového objemu k detekci atrofie (BPF, brain parechymal fraction) a sledování přítomnosti T2 hypointenzních lézí v šedé hmotě, které bývají malé a při běžném hodnocení často unikají pozornosti. Nové MR techniky dále zahrnují tzv. nekonvenční metody: magnetizační transfer, MR spektroskopii, difuzně vážené obrazy, perfuzně vážené obrazy a funkční MR [3,4].
V poslední době je v literatuře týkající se RS věnována značná pozornost postižení šedé hmoty a T2 hypointenzním ložiskům. Nedávné studie prokazují, že tato ložiska klinicky výrazně korelují s délkou nemoci, klinickým průběhem, stupněm neurologického deficitu a s mozkovou atrofií a jsou mnohem významnějším prediktorem neurologického postižení a klinického vývoje RS než konvenční MR vyšetření [5–7]. Předpokládá se, že podkladem T2 hypointenzit jsou patologická depozita železa [8,9]. Zásobní železo je v mozku ukládáno především ve formě feritinu, to je tzv. bezpečné železo, protože je obklopeno protektivními molekulami proteinu. Toxicita železa se projevuje tehdy, dojde‑li k poškození protektivních molekul či se zvýší podíl volného železa v důsledku nedostatku feritinu v buňkách [10,11]. Volné, nevázané dvojmocné železo je toxické. Neurotoxicita volného železa spočívá v biochemické reakci zahrnující tvorbu reaktivních oxidačních produktů cestou železem indukované oxidace hydroxylů. Výsledkem je volný hydroxylový radikál, který je extrémně reaktivní a vede k degradaci biomolekul a oxi-dační destrukci lipidů důležitých ve struktuře buňky, což může být příčinou apoptózy. Je prokázáno, že k ukládání železa dochází během fyziologického stárnutí mozku [12]. Nadměrné ukládání železa ve strukturách mozku je popisováno u neurodegenerativních chorob [13]. Postupně roste zájem na odkrytí úlohy železa a jeho významu u RS. Existují dvě teorie, jak může železo souviset s patofyziologií RS. Za prvé, depozita železa jsou jen jakýmsi vedlejším fenoménem, který doprovází neurodegenerativní změny v šedé hmotě [14,15]. Za druhé, železo je mediátorem neurotoxicity a přímo se účastní patogeneze RS, když podporuje vznik volných radikálů a oxidačního stresu [10].
Jedinou neinvazivní metodou a nástrojem pro detekci zvýšeného ukládaní železa je T2 relaxometrie (T2). Je metodou volby pro stanovení železa v mozku in vivo a umožňuje výpočet koncentrace železa, přestože jen na základě empirické rovnice. T2 relaxometrie se v diagnostice RS řadí k nekonvenčním kvantitativním metodám, které umožňují detekovat změny v normálně vyhlížející mozkové tkáni, jež unikají konvenčním technikám MR [16].
Cílem naší práce je cestou T2 relaxometrie ověřit hypotézu, že u pacientů s RS se v centrální šedé hmotě hromadí železo více než u zdravých kontrol. Za předpokladu, že zvýšená depozita železa jsou podkladem T2 hypointenzit v šedé hmotě popisovaných u RS, zkracování T2 relaxačního času může detekovat ukládání železa ještě před těmito MR viditelnými projevy.
Dalším cílem je stanovit, jak souvisí hodnoty T2 v měřených strukturách s dalším kvantitativně stanovovaným parametrem u RS, s celkovým objemem ložisek v bílé hmotě (LL, lesion load). Zatímco zkracování T2 reprezentuje neurodegenerativní složku RS, LL je odrazem zánětlivé složky RS.
Soubor a metodika
Celkem bylo vyšetřeno 347 nemocných:122 mužů (průměrný věk 37,3 ± 11,8 roků; medián 35,3) a 225 žen (průměrný věk 37,1 ± 11,9 roků; medián 34,3) z klinické databáze pacientů s RS v centru pro RS Neurologické kliniky VFN v Praze (tab. 1). Všichni pacienti měli klinicky definitivní RS, relaps remitentní formu. Dále byl analyzován podsoubor 287 pacientů s RS, u kterých byly naměřeny hodnoty LL (z toho: 138 s hodnotami LL < 2 cm3; 79 s hodnotami LL > 5 cm3, a zbývajících 70 v rozmezí 2 cm3 ≤ LL ≤ 5 cm3). Vedle pacientů s RS byla vyšetřena skupina 117 kontrol: 42 mužů (průměrný věk 38,4 ± 14,6 roků; medián 35,2) a 75 žen (průměrný věk 37,5 ± 12,9 roků; medián 34,3), kteří byli vyšetřeni ve stejném protokolu. Byli z řad zdravých dobrovolníků doplněných o pacienty s jinou diagnózou než RS, u nichž nebylo podezření na možné změny v metabolizmu železa (většinou byli vyšetřováni pro migrénu).
Tab. 1. Demografická charakteristika vyšetřovaných souborů. 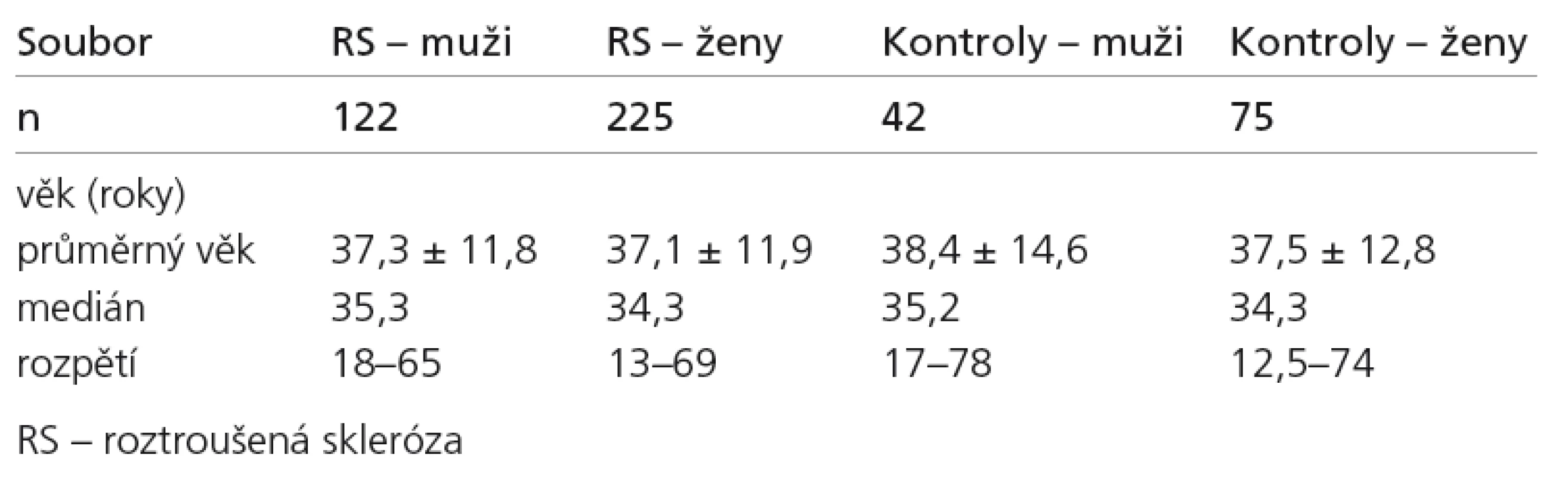
Vyšetření byla provedena na magnetické rezonanci Gyroscan NT 1,5T firmy Philips, použita byla standardní kvadratická hlavová cívka. Vyšetřovací protokol vždy zahrnoval: T1 vážené obrazy (T1WI), sekvenci FLAIR a difuzně vážené obrazy (DWI) v transverzálních řezech. Dále sekvenci Multiecho GraSE k výpočtu relaxačního času s těmito parametry: TR 2 633 ms, TE 20 ms, flip angle (FA) 90st., FOV 230 × 183, tloušťka vrstvy (THK)3,00/0mm. Během každého vyšetření byly tedy hodnoceny následující parametry: 1. Objem hyperintenzních lézí (LL) 2. Stanovení relaxačního času ve vybraných strukturách centrální šedé hmoty.
Objem plak RS (LL) byl v MR stanoven automaticky s pomocí softwaru speciálně vytvořeného k tomuto účelu na našem pracovišti [17,18]. Pro měření objemu plak byla použita sekvence FLAIR s následujícími parametry: TR 11 000 ms, TE 140 ms, TI 2 600 ms, FA 90 st., FOV 256 × 256, THK 1,5/0mm.
K relaxometrii jsou potřeba minimálně dvě echa, ze kterých se vypočítá T2 relaxační čas z rovnice Int = A × exp (–TE / t2), kdy Int je intenzita signálu. Tato formule je výsledkem řešení tzv. Blochových rovnic, kde A je konstanta úměrná koncentraci protonů v daném místě, TE je time to echo nastavovaný pro použitou sekvenci a t2 je žádaný relaxační čas. Parametry: použili jsme 5 ech s TE odstupňovaným po 20 ms (20, 40, 60, 80, 100 s). Schéma sekvence je tedy následující: po 90° RF pulzu následuje v našem případě pět 180° pulzů. Po každém tomto pulzu se vytvoří echo, které je dále rozbito třemi gradientními pulzy na tři podecha. Z toho vyplývá, že na jeden 90° pulz bylo sebráno 25 řádků k prostoru. Při použití této sekvence je klesání signálu prakticky exponenciální, a je tedy vhodná k výpočtu T2 relaxačního času.
Řada studií in vitro [19,20] a in vivo [21–23] prokázala silnou korelaci mezi T2 relaxačním časem a koncentrací železa především v šedé hmotě, což bylo podpořeno histologickými studiemi mozku. Dle publikovaných údajů je T2 relaxační čas lineárně závislý na koncentraci železa ve tkáni [24,25]. Empirická rovnice byla odvozena z výpočtů závislosti koncentrace železa v bazálních gangliích na věku a závislosti T2 relaxačního času (T2) na věku. Koncentrace železa (Fe) v (mg Fe/100g tkáně) je dána rovnicí: (Fe) = 3,7/T2 – 35,8.
T2 jsme měřili ve vybraných strukturách centrální šedé hmoty oboustranně, a to v bazálních gangliích (caput nuclei caudati, putamen) a v talamu. Do centra těchto struktur jsme pro účely měření manuálně umístili měřící objem (ROI, region of interest). V tomto objemu potom program automaticky vypočítával T2. Důvodem, proč jsme zvolili právě tyto struktury, byla jejich dostatečná velikost, dobře definované hranice a potenciální důležitost jak pro kognitivní, tak motorické funkce mozku [26].
Statistická analýza
Prostřednictvím korelačních matic (Pearson, Spearman) byla provedena analýza struktury závislostí mezi T2 relaxačními časy a věkem ve skupinách pacientů s RS a ve skupině kontrolní (pacienti i kontrolní skupina byli rozděleni dle pohlaví) a dále v podskupinách pacientů s RS rozdělených dle LL. Byly testovány rozdíly mezi jednotlivými skupinami (t‑testy, Kruskal‑Wallisův a párový Friedmannův test), porovnávány rozdíly směrnic přímek závislosti T2 na věku mezi jednotlivými skupinami a vypočítávány příslušné p‑hodnoty. Byl použit výpočet přes ANOVU. Ve všech použitých testech byla hodnota p < 0,05 považována za statisticky významnou. Výpočty byly provedeny prostřednictvím statistického programu SPSS verze 16.0, grafická zobrazení v SW Statistica 8.0.
Výsledky
- Ověřili jsme, že v bazálních gangliích se T2 relaxační čas zkracuje s věkem během normálního stárnutí. To se potvrdilo na hladině statistické významnosti u putamen bez ohledu na pohlaví a mozkovou hemisféru (pro muže vlevo p = 0,010; R = –0,395; vpravo p = 0,034, R = –0,328; pro ženy vlevo p = 0,008; R = –0,305; vpravo p = 0,032; R = –0,248) a u ncl.caudatus pro zdravé ženy oboustranně (vlevo p = 0,023; R = –0,262; vpravo p = 0,010; R = –0,297); pro zdravé muže byly výsledky statisticky nevýznamné, pravděpodobně z důvodu nižšího výběrového rozsahu podsouboru mužů. Pro oblast talamu se T2 relaxační časy s věkem naopak prodlužovaly.
- Dále jsme zjistili, že rozdíly v T2 relaxačním čase mezi pohlavím jsou ve skupinách pacientů s RS i zdravých jednotlivců statisticky nevýznamné. Obdobně nevýznamné jsme shledali i rozdíly mezi RS a kontrolami na úrovni jednotlivých pohlaví. (Jedinou výjimku tvoří rozdíl mezi RS a kontrolami pro levé ncl. caudatus u žen [F(1,298) = 5,160; p = 0,024], což může být ale rovněž důsledkem významnějšího zastoupení žen v celém souboru.)
- Prokázali jsme, že se u pacientů s RS ukládá železo v centrální šedé hmotě (v bazálních gangliích) více než u kontrol. Z důvodu závislosti T2 relaxačního času na věku během normálního stárnutí jsme při srovnávání pacientů s RS a kontrol museli zaručit stejné věkové rozložení. Předpoklad zvýšeného ukládání železa proti kontrolní skupině se na hladině statistické významnosti potvrdil v levém ncl. caudatus (p = 0,004; R2 = 0,17), v pravém ncl. caudatus (p = 0,033; R2 = 0,11), v levém putamen (p = 0,006; R2 = 0,22). U talamů se T2 relaxační časy v závislosti na věku u RS pacientů stejně jako u zdravých kontrol naopak prodlužovaly (tab. 2).
- Dalším úkolem bylo zjistit vztah meziT2 relaxačním časem a LL, další kvantita-tivně měřenou hodnotou u skupiny 287 pa-cientů s RS (podskupina s nízkým LL < 2 cm3 a podskupina s velkým LL > 5 cm3), ostatní (LL: 2 cm3 ≤ LL ≤ 5 cm3) byli ze srovnávání vyloučeni. Porovnávali jsme rozdíly směrnic přímek závislosti T2 na věku ve vybraných strukturách v obou definovaných podskupinách, pacienti byli věkově spárováni. Zjistili jsme statisticky významnou rozdílnost hodnot u putamen oboustranně, vlevo (p < 0,001; R2 = 0,30) (graf 1), vpravo (p = 0,006; R2 = 0,17), hraniční statistická významnost byla u ncl. caudatus vpravo (p = 0,054; R2 = 0,15); (tab. 3).
- Na úrovni bilaterálních dvojic měřených struktur byla testována stranová asymetrie. Statisticky významné rozdíly, které svědčily pro predilekční zkracování T2 relaxačního času vlevo, byly zjištěny mezi dvojicí ncl. caudatus u kontrol [pro muže T(41) = 3,071; p = 0,001; pro ženy T(74) = 4,994; p < 0,001] a u pacientů s RS u žen [pro muže T(121) = 0,958; p = 0,340; pro dvě ženy T(224) = 3,071; p < 0,002]. Dále pro ncl. caudatus ve skupině LL < 2 cm3 [T(139) = 2,954; p = 0,004] a u dvojice putamen (vlevo vs vpravo) ve skupině LL > 5 cm3 [T(79) = –2,879; p = 0,005]). Tyto výsledky byly ověřeny ještě neparametrickými testy (Friedmann, Wilcoxon), protože hodnoty veličiny T2 pro talamus nebyly shledány jako normálně rozdělené.
Tab. 2. Hodnoty Pearsonových korelačních koeficientů (R) mezi T2 relaxačními časy a věkem vyšetřených osob (RS pacientů a zdravých kontrol) v šesti vyšetřovaných mozkových strukturách s vyznačenou hladinou významnosti (p). 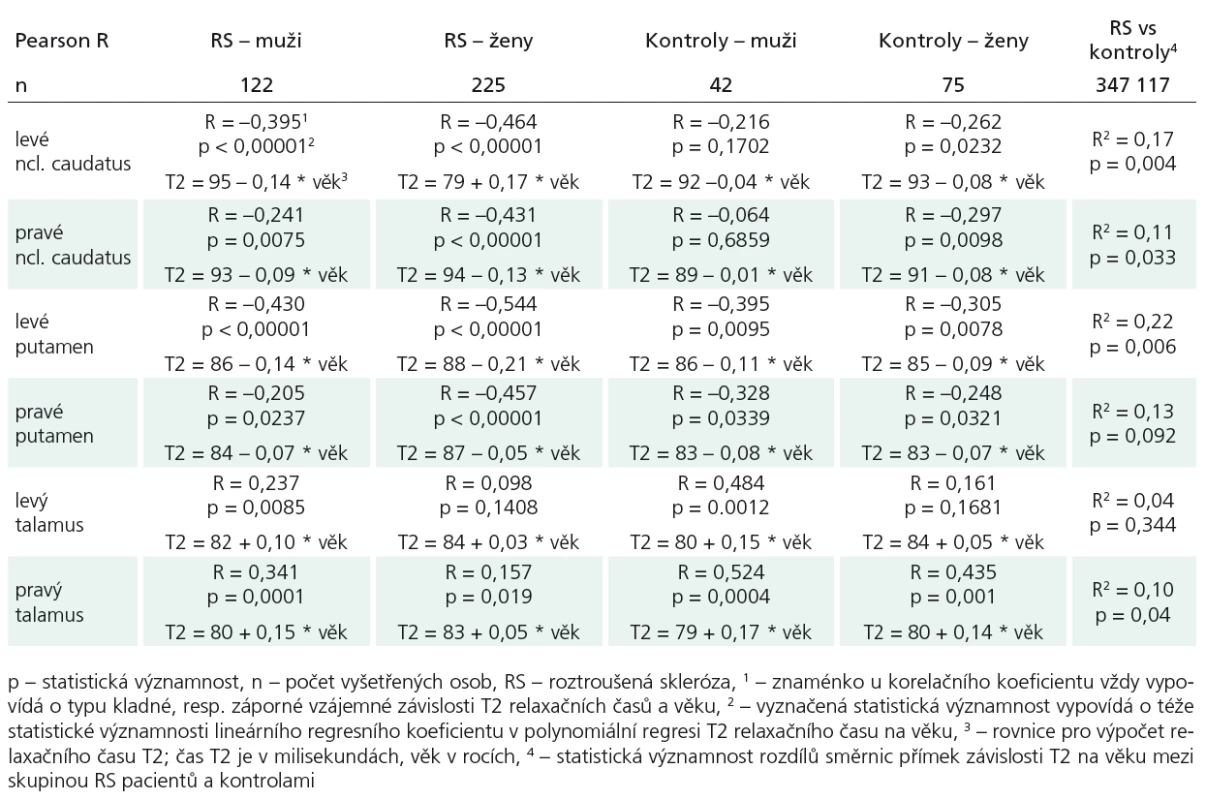
Graf 1. Porovnání T2 relaxačního času u norem, RS (LL < 2 cm<sup>3</sup>) a RS (LL > 5 cm<sup>3</sup>) (levé putamen). 
Tab. 3. Hodnoty Pearsonových korelačních koeficientů (R) mezi T2 relaxačními časy a věkem u vyšetřených osob v šesti mozkových strukturách podle dvou krajních úrovní LL s vyznačenou hladinou významnosti (p). 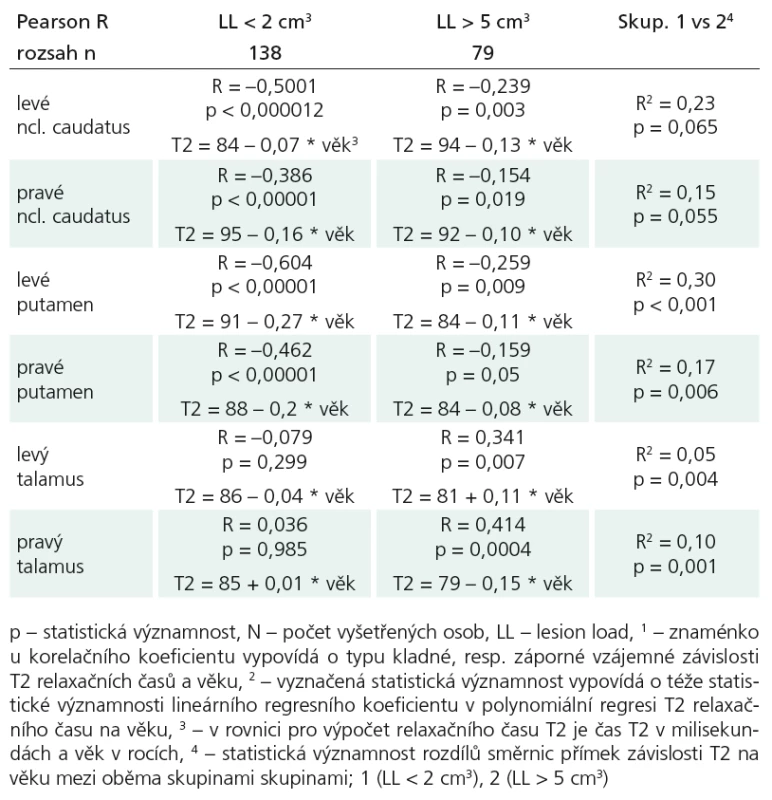
Ověření přesnosti metody
Chyba stanovení T2 relaxačního času jezatím poměrně vysoká. Na souboru 33 pa-cientů, kteří měli tři vyšetření krátce po sobě během jednoho roku, a 120 pacientů, u kterých proběhla dvě měření během jednoho roku, jsme ověřili, že chyba měření je okolo 3%. Měření T2 je třeba dále propracovat; tuto chybu by bylo potřeba snížit alespoň na 0,5%, aby se dalo vyjadřovat k jednotlivým pacientům.
Diskuze
V poslední době výrazně vzrostl zájem o odkrytí úlohy a významu železa v patofyziologii RS. Podíl železa v mozku se zvyšuje s věkem v souvislosti s fyziologickým stárnutím mozku [27], což potvrdily i naše výsledky. Zvýšená depozita železa v mozku byla popsána u mnoha neurodegenerativních chorob: u Alzheimerovy choroby [28–31], u Parkinsonovy choroby [32–35] a dalších, jako Huntingtonova chorea [36,37], Hallervorden‑Spatzova nemoc [38]. Důkazy o přítomnosti železa u těchto chorob vedly k úvahám o možném podílu železa i u jiných onemocnění, která by mohla zahrnovat oxidační stres, např. epilepsie [39]. Některé práce v poslední době poukazují na zvýšenou akumulaci železa také u RS [40,41], což pravděpodobně souvisí s neurodegenerativní komponentou nemoci, která v tradičním pojetí byla především autoimunitně zánětlivá. Předpokládá se, že u pacientů s RS jsou korelátem depozit železa T2 hypointenzity v šedé hmotě. Četné studie prokázaly spojení mezi T2 hypointenzitami, poškozením šedé hmoty a klinickým stavem pacientů. T2 hypointenzity byly v mnohem těsnějším vztahu s tíží klinických projevů než konvenčně měřené léze [6,16,42–44].
Za předpokladu, že za zkracování T2 relaxačního času jsou zodpovědná depozita železa, prověřila naše měření metodou MR relaxometrie hypotézu a podala kvantitativní důkaz, že u pacientů s RS dochází v bazálních gangliích (ncl. caudatus, putamen) k většímu ukládání železa než u zdravých kontrol. Železo jsme detekovali v normálně vyhlížející tkáni, tedy ještě před vznikem na MR viditelných T2 hypointenzit. Ukládání železa se nepotvrdilo v případě obou talamů, zde se T2 relaxační časy s věkem naopak prodlužovaly, a to u zdravých kontrol i u pacientů s RS. Talamus se svým složením liší od bazálních ganglií [45], obsahuje více myelinu či může obsahovat drobné kapičky vody (likvoru). Dle našich pozorování se u pacientů s RS v talamu, na rozdíl od bazálních ganglií, poměrně často vyskytují T2 hyperintenzní ložiska, jejichž podkladem může být edém, demyelinizace či zánět, které výrazně ovlivňují hodnotu T2 relaxačního času.
Dále je zajímavá levostranná predilekce pro ukládání železa. Statisticky významné rozdíly, které svědčily pro predilekční zkracování T2 relaxačního času vlevo, byly zjištěny mezi dvojicí ncl. caudatus u kontrol pro muže (p = 0,001), pro ženy (p < 0,001) a u pacientů s RS u žen (p < 0,002). Předpokládáme, že by to mohlo souviset s dominancí levé hemisféry, která je funkčně více zatížena, což dokládají i naše zkušenosti s výsledky funkční MR, a tedy i její potřeba oxygenace je větší.
Korelace LL s měřenými T2 relaxačnímičasy prokázala, že u tzv. nízkoobjemových(low LL) RS, u nichž je objem na MR viditelných T2, resp. FLAIR hyperintenzních ložisek malý (LL < 2 cm3), je klesánírelaxačního času významnější než u vysokoobjemových (high LL) RS, kde objem na MR viditelných ložisek je velký (LL > 5 cm3). Statisticky významná rozdílnost hodnot T2 relaxačních časů mezi oběma podskupinami byla na úrovni putamen oboustranně, vlevo (p < 0,001), vpravo (p = 0,006), hraniční statistická významnost byla u ncl. caudatus vpravo (p = 0,054). Pokud vycházíme z předpokladu, že nadměrné ukládání železa v ncl. caudatus a putamen reprezentuje neurodegenerativní složku onemocnění RS [6,16,41–44], vyplývá z našich výsledků, že nedá‑li se klinický stav, to znamená stejná manifestace choroby, vysvětlit MR viditelnými zánětlivými plaky, snad by se dala vysvětlit právě neurodegenerativními změnami, jejímž měřitelným výsledkem je mimo rozvoj atrofie i zkracování T2. Tento výsledek podporuje naši práci o stratifikaci pacientů dle MR kritérií – LL a brain parenchymal fraction (BPF), na ty s převážně zánětlivou složkou a na ty převážně degenerativní [46], a navazuje na ni. Je dalším důkazem, že RS je multifaktoriální a komplexní patologický proces a že neurodegenerativní změny mohou hrát u některých pacientů v etiologii onemocnění významnou roli. Vztah T2 a míry atrofie a vztah T2 a klinického stavu bude předmětem dalšího zkoumání.
Je možné, že do skupiny převážně neurodegenerativní budou patřit ti pacienti, kteří dostatečně neodpovídají na konvenční, především protizánětlivě zaměřenou terapii. Všechna tato snažení postihnout neurodegenerativní složku RS by nakonec mohla vést ke stanovení léčebné strategie u převážně neurodegenerativních pacientů, u kterých by se prokázala zvýšená akumulace železa. Pokud předpokládáme abnormální depozita železa jako podklad zkrácení T2 relaxačního času a T2 hypointenzit v šedé hmotě a pokud připustíme teorii, že železo podporuje vznik volných radikálů, je mediátorem neurotoxicity a přímo se podílí na patofyziologii RS, pak by se otevřela zcela nová možnost terapeutického ovlivnění RS. V současně době je u neurodegenerativních chorob sledována terapie cheláty, které vážou volné železo či antioxidanty, což se již zkoušelo ve studiích na zvířatech [39,47,48]. Je teoreticky možné, že by se v budoucnu tato terapie mohla aplikovat u části nemocných s RS.
Poděkování: Tato studie byla podpořena granty ministerstva zdravotnictví MZO/VFN2005 a MSMTO21620849. Dále děkujeme statistikovi RNDr. Jaromíru Běláčkovi, Ph.D., za technickou podporu.
Přijato k recenzi: 11. 6. 2009
Přijato do tisku: 29. 9. 2009
MUDr. Andrea Burgetová
Radiodiagnostická klinika 1. LF UK a VFN v Praze
Kateřinská 30
128 08 Praha 2
e-mail: andrea.burgetova@vfn.cz
Zdroje
1. Trapp BD, Peterson J, Ransohoff RM, Rudick R, Mörk S, Bö L. Axonal transection in the lesions of multiple sclerosis. N Engl J Med 1998; 338(5): 278–285.
2. Havrdová E. Roztroušená skleróza. Cesk Slov Neurol N 2008; 71/104(2):121–132.
3. Seidl Z, Obenberger J, Daneš J, Viták T, Krásenský J,Belšán T. Využití magnetizačního transferu při zobrazování magnetickou rezonancí v CNS. Cesk Radiol 1997; 51(4): 223–226.
4. Vaněčková M, Seidl Z. Roztroušená skleróza mozkomíšní a magnetická rezonance: současnost a nové trendy. Cesk Slov Neurol N 2008; 71/104(6): 664–672.
5. Bakshi R, Shaikh ZA, Janardhan V. MRI T2 shortening (“black T2”) in multiple sclerosis: frequency, location, and clinical correlation. Neuroreport 2000; 11(1): 15–21.
6. Bakshi R, Dmochowski J, Shaikh ZA, Jacobs L. Gray matter T2 hypointensity is related to plaques and atrophy in the brains of multiple sclerosis patients. J Neurol Sci 2001; 185(1): 19–26.
7. Bermel RA, Puli SR, Rudick RA, Weinstock‑Guttman B,Fisher E, Munschauer FE jr et al. Prediction of longitudinal brain atrophy in multiple sclerosis by gray matter magnetic resonance imaging T2 hypointensity. Arch Neurol 2005; 62(9):1371–1376.
8. Drayer BP, Burger P, Hurwitz B, Dawson B, Cain J, Leong J et al. Magnetic resonance imaging in multiple sclerosis: decreased signal in thalamus and putamen. Ann Neurol 1987; 22(4): 546–550.
9. Schenck JF, Zimmerman EA. High‑field magnetic resonance imaging of brain iron: birth of a biomarker? MNR Biomed 2004; 17(7): 433–445.
10. Gutteridge JM. Iron and oxygen radicalsin brain. Ann Neurol 1992; 32 (Suppl): S16–S21.
11. Curtis AR, Fey C, Morris CM, Bindoff LA, Ince PG, Chinnery PF et al. Mutation in the gene encoding ferritin light polypeptide causes dominant adult‑onset basal ganglia disease. Nat Genet 2001; 28(4): 350–354.
12. Pujol J, Junqué C, Vendrell P, Grau JM, Martí‑Vilalta JL, Olivé C et al. Biological significance of iron‑related magnetic resonance imaging changes in the brain. Arch Neurol 1992; 49(7): 711–717.
13. Thompson KJ, Shoham S, Connor JR. Iron and neurodegenerative disorders. Brain Res Bull 2001; 55(2): 155–164.
14. Bermel RA, Innus MD, Tjoa CV, Bakshi R. Selective caudate atrophy in multiple sclerosis: a 3D MRI parcellation study. Neuroreport 2003; 14(3): 335–339.
15. Cifelli A, Arridge M, Jezzard P, Esiri MM, Palace J, Matthews PM. Thalamic neurodegeneration in multiple sclerosis. Ann Neurol 2002; 52(5): 650–653.
16. Neema M, Stankiewicz J, Arora A, Dandamudi VS, Batt CE, Zachary D et al. T1-and T2‑based MRI measures of diffuse gray matter and white matter damage in patients with multiple sclerosis. J Neuroimaging 2007; 17 (Suppl 1): S16–S21.
17. Vaněčková M, Seidl Z, Krásenský J, Obenberger J,Havrdová E, Viták T, Daneš J. Nové trendy v zobrazování magnetickou rezonancí u roztroušené sklerózy mozkomíšní. Technika MR volumometrie vyvinutá a prováděná naším pracovištěm. Cesk Radiol 2002; 56(6): 327–330.
18. Vaněčková M, Seidl Z, Krásenský J, Obenberger J.,Havrdová E., Viták T et al. Sledování objemu ložisek u roztroušené sklerózy mozkomíšní magnetickou rezonancí (MRI study of lesion load in multiple sclerosis). Cesk Slov Neurol N 2002; 65/98(3): 175–179.
19. Chen JC, Hardy PA, Clauberg M, Josuu JG, Parravano J, Deck JH et al. T2 values in the human brain:comparison with quantitative assays of iron and ferritin. Radiology 1989; 173 : 521–526.
20. Vymazal J, Brooks RA, Baumgarner C, Tran V, Katz D, Bulte JW et al. The relation between brain iron and NMR relaxation times: an in vitro study. Magn Reson Med 1996; 35 : 56–61.
21. Gotz ME, Double K, Gerlach M, Youdim MB, Riederer P. The relevance of iron in the pathogenesis of Parkinson’s disease. Ann N Y Acad Sci 2004; 1012 : 193–208
22. Metafratzi Z, Argyropoulou MI, Kiortsis DN, Tsampoulas C, Chaliassos N, Efremidis SC. T(2) relaxation rate of basal ganglia and cortex in patients with thalassemia major. Br J Radiol 2001; 74 : 407–410.
23. Vymazal J, Righini A, Brooks RA, Canesi M, Mariani C, Leopardi M et al. T1 and T2 in the brain of healthy subjects, patients with Parkinson’s disease, and patients with multiple systom atrophy: relation to iron content. Radiology 1999; 211 : 489–495.
24. Hallgren B, Sourander P. The effect of age on the non‑haemin iron in the human brain. J Neurochem 1958; 3 : 41–51
25. Schenker C, Meier D, Wichmann W, Boesiger P, Valavanis A. Age distribution and iron dependency of The T2 relaxation time in the globus pallidus and putamen. Neuroradiology 1993; 35(2): 119–124.
26. Castaigne P, Lhermitte F, Buge A, Escourolle R, Haur JJ, Lyon‑Caen O. Paramedian thalamic and midbrain infarct: clinical and neuropathological study. Ann Neurol 1981; 10 : 127–148.
27. Bartzokis G, Tishler TA, Lu PH, Villablanca P, Altushuler LL, Carter M et al. Brain ferritin iron may invluence age‑and gender related risk of neurodegeneration. Neurobiol Aging 2007; 28(3): 414–423.
28. Connor CR, Snyder BS, Beard JL, Fine RE, Mufson EJ. Regional distribution of iron and iron‑regulatory proteins in the brain in aging and Alzheimer’s disease. J Neurosci Res 1992;31 : 327–335.
29. Honda K, Casadesus G, Petersen RB, Perry G, Smith MA. Oxidative stress and redox‑active iron in Alzheimer’s disease. Ann N Y Acad Sci 2004; 1012 : 179–182.
30. Sayre LM, Zelasko DA, Harris PL, Perry G, Salomon RG, Smith RA. 4-hydroxynonenal‑derived advanced lipid peroxidationand products are increased in Alzheimer’s disease. J Neurochem 1997; 68 : 2092–2097.
31. Smith MA, Perry G. Free radical damage, iron, and Alzheimer’s disease. J Neurol Sci 1995; 134(Suppl): S92–94.
32. Berg D, Hochstrasser H. Iron netabolism in Parkinsonian syndromes. Mov Disord 2006; 21 : 1299–1310.
33. Hirsch EC, Faucheux BA. Iron metabolism and Parkinson’s disease. Mov disord 1998; 13 (Suppl 1): 39–45.
34. Sofic E, Paulus W, Jellinger K, Riederer P, Youdim MB. Selective increase of iron in substantia nigra zona compamta of Parkinsonian brains. J Neurochem 1991; 56(3): 978–982.
35. Jenner P, Olanow CW. Oxidative stress and the pathogenesis of Parkinson’s disease. Neurolgy 1996; 47 (Suppl 3): S161–S170.
36. Bartzokis G, Cummings J, Perlman S, Hance DB, Mintz J. Increased basal ganglia iron levels in Huntington disease. Arch Neurol 1999; 56(5): 569–574.
37. Vymazal J, Klempír J, Jech R, Zidovská J, Syka M, Růzicka E et al. MR relaxometry in Huntington’s disease: correlation between imaging, genetic and clinical parameters. J Neurol Sci 2007; 263(1–2): 20–25.
38. Hájek M, Adamovicová M, Herynek V, Skoch A, Jírů F, Krepelová A et al. MR relaxometry and 1H MR spectroscopy for the determination of iron and metabolite concentrations in PKAN patients. Eur Radiol 2005; 15(5): 1060–1068.
39. Kabuto H, Yokoi I, Ogawa N. Melatonin inhibits iron‑induced epileptic discharges in rats suppressing peroxidation. Epilepsia 1998; 39(3): 237–243.
40. Craelius W, Migdal WM Lussenhop CP, Sugar A, Mihalakis I. Iron deposits surrounding multiple sclerosis plaques. Arch Pathol Lab Med 1982; 106(8): 397–399.
41. Drayer B, Burger P, Hurwitz B, Dawson D, Cain J. Reduced signal intensity on MR images of thalamus and putamen in multiple sclerosis: increased iron content? AJR Am J Roentgenol 1987; 149(2): 357–363.
42. Bakshi R, Benedict RH, Bermel RA, Caruthers SD,Puli SR, Tjoa CW et al. T2 hypointensity in the deep gray matter of patients with multiple sclerosis: a quantitative magnetic resonance imaging study. Arch Neurol 2002; 59(1): 62–68.
43. Brass SD, Benedict RH, Weinstock‑Guttman B, Munschauer F, Bakshi R. Cognitive impairment is associated with subcortical magnetic resonance imaging gray matter T2 hypointensity in multiple sclerosis. Mult Scler 2006; 12(4): 437–444.
44. Tjoa CW, Benedict RH, Weinstock‑Guttman B, Fabiano AJ, Bakshi R. MRI T2 hypointensity of the dentate nucleus is related to ambulatory impairment in multiple sclerosis. J Neurol Sci 2005; 234(1–2): 17–24.
45. Madarász M, Tömböl T, Hajdu F, Somogyi G. Quantitative histological study on the thalamic ventro‑basal complex of the cat. Anat Embryol 1983; 166(2): 291–306.
46. Vaneckova M, Seidl Z, Krasensky J, Havrdova E, Horakova D, Dolezal O et al. Patients’ stratification and correlation of brain MRI parameters to disability progression in multiple sclerosis. Eur Neurol 2009; 61(5): 278–284.
47. Bowern N, Ramshaw I, Clark I, Doherty PC. Inhibition of autoimmune neuropathological process by treatment with an iron‑chelating agent. J Exp Med 1984; 160(5): 1532–1543.
48. Willenborg DO, Bowern N, Danta G, Doherty PC.Inhibition of allergic encephalomyelitis by the iron‑chelating agent desferrioxamine: differential effect depending on type sensitizing encephalitogen. J Neuroimmunol 1988; 17(2): 127–135.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2010 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- CIDP: epidemiológia, klinický obraz a diagnostika v kocke
-
Všetky články tohto čísla
- Prevence cévních mozkových příhod léčbou hypolipidemiky
- Magnetická rezonanční relaxometrie u roztroušené sklerózy – měření T2 relaxačního času v centrální šedé hmotě
- Úvodník
- Vliv repetitivní transkraniální magnetické stimulace cerebella na motoriku horní končetiny u pacientů v iniciálním stadiu Parkinsonovy nemoci – pilotní studie
- Sérový protein S100B jako molekulární marker závažnosti poranění mozku u dětí
- Vyšetření čichu u neurologických onemocnění pomocí Testu parfémovaných fixů
- Diabetická neuropatia u detí a adolescentov – prospektívna 5-ročná štúdia
- Jeden rok po hluboké mozkové stimulaci pacientů s Parkinsonovou nemocí – neuropsychologické výsledky
- Kongenitální myastenické syndromy – kazuistiky
- Myoklonická epilepsie a hluchota u sourozenců s mutací 7512T>C v genu pro mitochondriální tRNASer(UCN) – kazuistiky
- Mitochondriální encefalomyopatie na podkladě deficitu proteinu Sco2 s obrazem SMA‑like neurogenní svalové atrofie – kazuistiky
- Hyperintenzivní léze reagující na steroidy u pacienta s Creutzfeldt‑Jakobovou nemocí
- Evokované odpovědi a elektromyografie v intraoperační monitoraci v neurochirurgii
- Webové okénko
-
Analýza dat v neurologii
XIX. Statistické testy pro četnosti kategorií – binomické a Poissonovo rozdělení - Harvey William Cushing
- Zpráva z II. kongresu Mezinárodní společnosti intraoperační neurofyziologie (ISIN) v Dubrovníku 12.–14. listopadu 2009
- Univ. prof. MUDr. Jaroslav Hympán vo veku 97 rokov zomrel
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Mitochondriální encefalomyopatie na podkladě deficitu proteinu Sco2 s obrazem SMA‑like neurogenní svalové atrofie – kazuistiky
- Vyšetření čichu u neurologických onemocnění pomocí Testu parfémovaných fixů
- Kongenitální myastenické syndromy – kazuistiky
- Evokované odpovědi a elektromyografie v intraoperační monitoraci v neurochirurgii
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



