-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Farmakologická sekundární prevence nekardioembolického mozkového infarktu/tranzitorní ischemické ataky – současnost a budoucnost
Pharmacological Secondary Prevention of Noncardioembolic Cerebral Infarction/Transitory Ischemic Attack – Presence and Future
There is a high risk of ischemic stroke (CVE) recurrence and thus its prevention is important. Prevention is based on a systematic monitoring of primary risk factors and pharmacological prevention with antiplatelet drugs. The single most important risk factor is hypertension; an effective treatment of hypertension significantly reduces the risk of CVE recurrence. The recommended target blood pressure is 130–140/80–85 mmHg. Dyslipidemia and its treatment are also considered as a key measure to reduce the risk of recurrence of ischemic CVE. Diabetes mellitus compensation is an important factor in reducing microvascular and macrovascular complications. Less intensive treatment regimens are being recommended to achieve glycated hemoglobin values between 5.3–6.2%. The antiplatelet agent clopidogrel or a combination of acetylsalicylic acid (ASA) with slow-release dipyridamole are recommended, ASA is an alternative. An intensive development of new molecules, P2Y12 receptor antagonists, continues. These are currently tested in cardiology indications. Recent studies, investigating the effectiveness of new antiplatelet drugs (terutroban, a thrombin receptor antagonist). did not prove higher effectiveness in the secondary prevention of ischemic stroke than ASA.
Key words:
secondary prevention of ischemic stroke – arterial hypertension – hyperlipidemia – hyperglycaemia – antiplatelet drugs – aspirin – dipyridamole – clopidogrel – thrombin receptor antagonist
Autoři: doc. MUDr. Zbyněk Kalita, CSc.
Vyšlo v časopise: Cesk Slov Neurol N 2011; 74/107(3): 261-272
Kategorie: Přehledný referát
Souhrn
Riziko opakování ischemické cévní mozkové příhody (CMP) je vysoké, proto je prevence tak významná. Základ prevence je důsledná kontrola primárních rizikových faktorů CMP a farmakologická prevence protidestičkovými léky. Nejvýznamnější rizikový faktor je hypertenze, její účinná léčba statisticky významně snižuje riziko recidivy, doporučená cílová hodnota krevního tlaku je 130–140/80–85 mmHg. Dyslipidemie a její léčba se považuje rovněž za klíčové opatření, které snižuje riziko opakování ischemické CMP. Kompenzace diabetes mellitus je další významné opatření k omezení vzniku mikro - i makrovaskulárních komplikací, doporučují se mírnější léčebné režimy k dosažení hodnot glykovaného hemoglobinu mezi 5,3–6,2 %. Z protidestičkých léčiv se doporučuje klopidogrel, případně kombinace kyseliny acetylsalicylové (ASA) a dipyridamolu s pomalým uvolňováním, alternativou je ASA. Pokračuje intenzivní vývoj nových molekul, které jsou inhibitory receptoru P2Y12, zatím jsou zkoušeny v kardiologických indikacích. Poslední studie prověřující účinnost dalších nových protidestičkových léků (terutroban, inhibitor trombinových receptorů) v sekundární prevenci ischemických CMP neprokázaly větší účinnost než ASA.
Klíčová slova:
sekundární prevence ischemického iktu – arteriální hypertenze – dyslipidemie – hyperglykemie – protidestičková léčiva – kyselina acetylsalicylová – dipyridamol – klopidogrel – inhibitor trombinových receptorůRiziko opakování ischemické cévní mozkové příhody (CMP) (obr.1) je u nemocných s cerebrovaskulárním onemocněním vysoké, případně mohou být postiženi jinou aterotrombotickou příhodou – zejména kardiovaskulární, méně často ischemickou chorobou dolních končetin [1]. Jednou z hlavních příčin mozkového infarktu je aterotrombóza [1,2] a tuto skutečnost, a tím i význam sekundární prevence potvrdil rovněž registr REACH (Reduction of Atherothrombosis for Continued Health) [2]. Velmi užitečným markerem generalizované aterosklerózy je vedle ultrazvukového měření intimomediální šířky (IMT) a nálezech na angiografiích index kotník-paže (tzv. ABI index), který je spolu s Essen Stroke Risk Score (ESRS) (tab. 1.) významným prognostickým ukazatelem stratifikujícím riziko recidivy mozkového infarktu/tranzitorní ischemické ataky (TIA) [3].
Obr. 1. Zobrazení ischemie v MR skenu. 
Tab. 1. Essen Stroke Risk Score (ESRS) [3]. ![Essen Stroke Risk Score (ESRS) [3].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/6ce4ff2f5880520976124a4d928e6167.jpeg)
Recidivy mozkového infarktu se vyskytují u 5–15 % nemocných za rok [4] a asi 30 % všech CMP/rok reprezentují recidivy CMP [5]. Možnost recidivy zvyšuje také prodělaná tranzitorní ischemická ataka (TIA). Riziko vzniku CMP po TIA je v prvních 90 dnech po příhodě 3–17,3 %, nejvyšší riziko je v prvních 30 dnech [6].
Studie EXPRESS (Early use of eXisting PREventive Strategies for Stroke) prokázala, že zahájení farmakologické sekundární prevence v prvních 24 hodinách po vzniku příznaků TIA snižuje riziko rekurentní nebo invalidizující CMP o neuvěřitelných 80 %. Tato studie také zjistila, že včasné zahájení sekundární prevence po TIA snižuje nejen riziko fatální i nefatální CMP, ale i míru postižení (během šestiměsíčního sledování o více než dva body mRS) nebo pravděpodobnost smrti, snižuje také počet nových hospitalizací, zkracuje délku pobytu v nemocnici, a tím významně šetří vynaložené náklady [7].
Nekardioembolické mozkové infarkty//TIA jsou nejčastější subtypy ischemické CMP a prevence jejich recidivy má dvě roviny.
První rovinou je důsledná kontrola primárních rizikových faktorů (RF), kterými jsou zejména hypertenze, dyslipidemie a diabetes mellitus (DM), druhou pak farmakologická prevence protidestičkovými léčivy.
Kontrola hlavních rizikových faktorů (RF)
Hypertenze
V r. 1997 uveřejněná metanalýza intervenčních studií, tzv. INDIANA (Individual Data Analysis of Antihypertensie Intervention Trials), prokázala, že léčba hypertenze po CMP sníží relativní riziko recidivy (RRR) o 29 %, ale až studie HOPE (Heart Outcomes Prevention Evaluation Study) s ramiprilem a zejména studie PROGRESS (Perindopril protection against recurrent stroke study) přesvědčivě dokázaly prospěšnost léčby hypertenze v sekundární prevenci CMP [8]. Další významná studie PRoFESS (The prevention regimen for effectively avoiding second strokes ) ve větvi s telmisartanem (Telmisartan to Prevent Recurrent Stroke and Cardiovascular Events) rovněž potvrdila, že dlouhodobé snižování TK snižuje riziko opakování CMP//TIA [9,10]. Studie ONTARGET (The Ongoing Telmisartan Alone and in Combination with Ramipril Global Endpoint Trial) ověřila, že telmisartan 80 mg/d je stejně účinný jako ramipril 10 mg/d v sekundární prevenci u nemocných s ischemickou chorobou srdeční (ICHS), ischemickou chorobou dolních končetin, po CMP a s DM. Léčba telmisartanem byla ale lépe tolerována. Studie naopak nepotvrdila vhodnost kombinace obou léčiv, tato kombinace byla spojena se zvýšeným výskytem nežádoucích účinků [11]. V červnu 2010 byla v časopisu Lancet publikována metaanalýza randomizovaných kontrolovaných studií s informací, že užívání antagonistů angiotenzinových receptorů (sartanů) mírně zvyšuje riziko vzniku rakoviny [12], s tím ale firma Boehringer Ingelhem nesouhlasí. V sekundární prevenci kardiovaskulárních příhod byl prokázán přínos pro nemocné ve velkých radomizovaných studiích s ramiprilem, perindoprilem, trandolaprilem a telmisartanem [13]. Případná kombinace různých skupin antihypertenziv je většinou výhodná, působí zpravidla aditivně a snižuje pravděpodobnost vzniku nežádoucích účinků závislých na dávce antihypertenziva a tato kombinovaná léčba je indikována i u pacientů po CMP [14]. Riziko pro vznik CMP je také variabilita krevního tlaku (TK), proto by nemocní s vysokou variabilitou TK měli mít v léčebné kombinaci blokátory kalciových kanálů, které nejlépe tuto variabilitu stabilizují [15].
Léčba hypertenze je prospěšná i pro starší osoby. Prokázala to nedávná studie HYVET (Hypertension in the Very Elderly Trial), kde léčba hypertenze u pacientů starších 80 let snížila celkovou mortalitu, výskyt CMP [16] i výskyt demence [17] a průkazně i u nemocných po CMP (prokázáno např. ve studii PROGRESS) [8].
Probíhá diskuze, jaká má být cílová hodnota TK po prodělané CMP. European Stroke Organisation (ESO) ve svém posledním doporučení konstatuje, že je potřebné po akutní fázi CMP pozvolna snižovat TK k normotenzním hodnotám [18]. Česká kardiologická společnost ve svém posledním Doporučení léčby arteriální hypertenze uvádí, že cílovou hodnotou TK po prodělané CMP má být ≤ 130/80 [19]. Ve studii ACCORD (Action to Control Cardiovascular Risk in Diabetes) se ale prokázalo, že snižování TK po CMP pod 130/80 mmHg výskyt CMP nesnižuje, ale naopak zvyšuje výskyt akutních komplikací ischemické choroby srdeční (ICHS) [20]. Na tato a další data reagovala Evropská společnost pro hypertenzi novelou doporučení. Doporučuje v ní po prodělané CMP snižovat TK maximálně k hodnotám 130––140/80 až 85 [21].
Je nepochybné, že cílová hodnota TK po CMP má být individuální, snižování musí být pozvolné s respektováním subjektivních pocitů a stupně stenotizujících aterosklerotických změn extra - i intrakraniálního řečiště konkrétního jedince. Při výběru antihypertenziva bychom měli dávat přednost takovému léčivu nebo kombinaci, o nichž je množství důkazů, že dostatečně ovlivňují TK a jeho variabilitu.
Dyslipidemie
I když je hypercholesterolemie rizikovější pro vznik kardiovaskulární příhody než pro CMP [1] a údaje o asociaci mezi cholesterolem a vznikem CMP byly dlouho neúplné nebo nedostatečné, je nyní prokázáno, že snížení hladiny cholesterolu statiny snižuje incidenci CMP u vysoce rizikové populace a u pacientů po prodělaném mozkovém infarktu/TIA [22].
Statiny, inhibitory 3-hydroxy-3-metylglutaryl koenzym A (HMG-CoA) reduktázy, konkurenčně inhibují MHG-CoA reduktázu, která katalyzuje přeměnu HMG-CoA na L-mevalonát, jednu z klíčových molekul pro syntézu cholesterolu. Statiny mají vedle schopnosti snižovat cholesterol i jiné důležité, tzv. pleiotropní, účinky – zlepšují endoteliální dysfunkci, působí antioxidačně, antitromboticky a protizánětlivě, redukují proliferaci hladkého svalstva, akumulaci cholesterolu aj. Výskyt málo častých nežádoucích účinků (hepatotoxicita a toxicita pro příčně pruhované svalstvo) je obecně znám [23].
V posledním doporučení ESO se uvádí pro primární prevenci léčba zvýšené hladiny LDL cholesterolu (LDL-c) nad 3,9 mmol/L, a to úpravou životního stylu a statiny. V sekundární prevenci mozkového infarktu/TIA je léčba statiny doporučována pro pacienty po nekardioembolické CMP [18].
Metaanalýza randomizovaných studií zahrnující 165 792 osob léčených statiny potvrdila nižší výskyt mozkového infarktu proti kontrolám a tento účinek byl asociován se stupněm redukce cholesterolu (každé snížení LDL-c o 1 mmol/L snižuje riziko CMP o 21,1 %) [24]. Statiny také výrazně snižují výskyt ostatních kardiovaskulárních příhod u pacientů s nekardioembolickými CMP, a to u všech subtypů [24,25]. Protože byl zaznamenán vyšší výskyt hemoragických CMP ve studii SPARCL (Stroke Prevention by Aggressive Reduction in Cholesterol Levels) [26] a HPS (Heart Protection Study) [27], doporučuje se při zvažování léčby statiny u pacientů, kteří prodělali hemoragický iktus, opatrnost.
Studie SPARCL byla dosud největší studie, která hodnotila přínos vysokých dávek atorvastatinu (80 mg) v sekundární prevenci mozkového infarktu a TIA u nemocných bez známé ICHS. Prokázala signifikantní snížení recidiv CMP a i kardiovaskulárních příhod, i když se mírně zvýšila incidence hemoragických iktů. Snížení RRR u nemocných po CMP léčených atorvastatinem bylo jen 16 %, a to bylo méně, než se očekávalo [28]. Sekundární analýza této studie zjistila, že intenzivní snížení hladiny cholesterolu vysokými dávkami atorvastatinu snižuje riziko vzniku kardiovaskulárních i mozkových příhod zejména u nemocných se stenózou a. carotis interna, ale i bez této stenózy [29].
V r. 2008 byla zveřejněna metanalýza hodnotící přínos statinů v sekundární prevenci u seniorů s ICHS a ta rovněž prokázala jednoznačný přínos této prevence [30]. V následných analýzách studie SPARCL se zjistilo, že u pacientů užívajících atorvastatin se snížil výskyt různých typů koronárních příhod, a to i u pacientů, kteří neměli manifestní ICHS [31].
Proto se nově doporučuje ve společném doporučení American Heart Association a American Stroke Association užívání statinu k intenzivnímu snížení hladiny LDL-c u nemocných po aterotrombogenní CMP/TIA i bez známé přítomnosti ICHS [32]. Jiná analýza studie SPARCL zjistila, že důsledná kontrola dalších rizikových faktorů snižuje výskyt kardiovaskulárních příhod až o 75 %. Snížení vysoké hladiny triglyceridů (TG), dosažení optimálních hodnot LDL-c, HDL cholesterolu (HDL-c) a krevního tlaku má kumulativní efekt. Dosažením optimálních hodnot LDL-c, který je základním rizikovým faktorem, se snížilo riziko CMP a veškerých kardiovaskulárních příhod podstatně výrazněji než u pacientů, jejichž hodnoty LDL-c sice poklesly, ale zůstaly nad optimální hodnotou. Optimalizace hodnot všech čtyř uvedených parametrů snižuje riziko vzniku CMP o 65 % a kardiovaskulárních příhod (infarkt myokardu, úmrtí z kardiovaskulárních příčin) o 75 %. [33]. Jiná analýza studie SPARCL prokázala, že výsledný klinický stav po opakovaném ischemickém iktu byl u nemocných, kteří užívali statiny, příznivější než u nemocných dosud statiny neužívající [34]. Z léčby statinem mohou mít prospěch i jedinci s normální nebo nižší hladinou LDL-c, pokud mají současně vyšší hladinu C-reaktivního proteinu (CRP) [35]. To také potvrdila studie JUPITER (Justification for the Use of statins in Prevention: an Intervention Trial Evaluating Rosuvastatin), která ověřovala, zda rosuvastatin v primární prevenci v dávce 20 mg/d u osob s normální hladinou LDL-c a se současně zvýšeným vysoce senzitivním CRP (hs-CRP) sníží výskyt kardiovaskulárních příhod. Studie byla na základě výsledků první analýzy předčasně ukončena pro průkazně pozitivní ovlivnění výskytu sledovaných primárních cílových ukazatelů (nefatální infarkt myokardu, nefatální CMP, tepenná revaskularizace, hospitalizace pro nestabilní anginu pectoris a kardiovaskulární smrt). I když do této studie byli zařazování jedinci s relativně nízkým kardiovaskulárním rizikem, prokázala tato jedna z největších statinových studií významný prospěch z intenzivní statinové léčby, a to i u jedinců se subnormálními hodnotami LDL-c. Současně prokázala význam hs--CRP pro posuzování kardiovaskulárního rizika a pro rozhodování o zahájení léčby statiny [35–37]. Zajímavým zjištěním ve studii JUPITER byl také průkaz statisticky signifikantního snížení výskytu hluboké žilní trombózy, a tím i jeho následků [38]. Rosuvastatin se tak stal pomyslným vítězem na žebříčku účinnosti mezi statiny. Nejúčinněji snižuje hladiny aterogenních sérových lipidů a podobně jako jiné statiny snižuje hs-CRP, má pleiotropní účinky a působí regresi aterosklerotických změn (studie ASTEROID: A Study to Evaluate the Effect of Rosuvastatin on Intravascular Ultrasound-Derived Coronary Atheroma Burden) [39,40].
Význam léčby statiny můžeme shrnout: V primární prevenci mozkového infarktu//TIA je snížení rizika natolik přesvědčivé, že dostatečně podporují význam léčby statiny i v prevenci sekundární. Proto se tato léčba doporučuje u vysoce rizikových nemocných a je rovněž vhodná i u nemocných po mozkovém infarktu/TIA bez ICHS, nebo hyperlipidemie.
Problémem ovšem je, podobně jako u jiné chronické léčby, adherence nemocných k této léčbě, která je po dvou letech nízká [41].
Podle současného doporučení Evropské kardiologické společnosti a i České společnosti pro aterosklerózu by hodnota LDL-c měla být pod 2,5 u rizikových a pod 2 mmol/ l u nejrizikovějších osob [42,43].
Jak toho dosáhnout? Na prvním místě změnou životního stylu a dietních zvyklostí, pak léčbou medikamentózní – lékem první volby jsou statiny, a nedaří-li se doporučených hodnot dosáhnout, pak léčba kombinovaná. Doporučuje se kombinace ezetimib/statin, která zajišťuje duální účinnost – inhibici vstřebávání cholesterolu ze střeva a současně inhibici endogenní syntézy cholesterolu s výsledným poklesem LDL-c [44]. Další možností, jak ovlivnit aterogenitu dyslipidemie, je zvýšení hladiny HDL-c. Ten působí i jinými patofyziologickými mechanizmy – inhibicí exprese adhezivních molekul, brání oxidaci LDL-c, zvyšuje stabilitu aterosklerotického plátu. Zvýšit HDL-c a snížit triglyceridy umí „stará“ molekula niacin (kyselina nikotinová, nesprávně nazývaná také vitaminem B3, nebo vitamin PPF – pelagra preventive factor) [45]. Hypolipidemický účinek niacinu je zprostředkován snížením uvolňování na TG bohatých lipoproteinů z jater, útlumem tvorby LDL-c a také zvýšením hladiny HDL-c [46,47]. Hladinu HDL-c proti ostatním zvyšuje až 3krát a TG snižuje o 40–50 % [48].
V řadě menších studií, kdy byl podáván niacin se statiny nebo fibráty, se potvrdila regrese aterosklerózy a významný pokles kardiovaskulární mortality. Jednou z posledních velkých studií byla studie ARBITER 6-HALTS Trial (Arterial Biology for Investigation of the Treatment Effects of Reducing Cholesterol 6-HDL and LDL Treatment Strategies in Athero-sclerosis). Ta zjistila větší regresi ztluštění intimo-mediální šíře v krkavicících u pacientů léčených statiny než fibrátem nebo ezetimibem a opět prokázala, že komplexní ovlivnění LDL-c, HDL-c a TG kombinací statin a niacin je účinnější než samotná výrazná redukce LDL-c [49] a příznivě ovlivňuje nejen kardiovaskulární mortalitu a morbiditu, ale i celkovou mortalitu. Nově byly u niacinu zjištěny i extrahypolipidemické účinky (antioxidační působení, potenciace reverzibilního transportu cholesterolu, aktivace PPAR-γ, antitrombotické účinky). Jeho nežádoucím účinkem je možná jaterní toxicita a deteriorace homeostázy glukózy [48] a zejména flush horní poloviny těla. Po objevu za tento účinek odpovědného receptoru (tzv. receptor DP1) s následným zjištěním jeho inhibitoru bylo možné tento nežádoucí účinek eliminovat nebo jeho intenzitu a délku trvání redukovat a tento inhibitor se stal součástí současně užívaného přípravku s niacinem [50].
Proto u jedinců se smíšenou dyslipidemií a vysokým kardiovaskulárním rizikem (např. u pacientů s metabolickým syndromem nebo DM 2 typu) je řešením kombinovaná léčba, která také snižuje koncentraci lipoproteinu (a) a zvyšuje HDL-c. Nejčastější je kombinace statinu s fenofibrátem nebo s inhibitorem absorbce cholesterolu ezetimibem či s omega-3 mastnými kyselinami. Všechny uvedené složky kombinované léčby působí odlišnými mechanizmy a výrazněji zlepšují kontrolu dyslipidemie než monoterapie statinem. Velmi užitečný je kombinovaný lék niacin/laropiprant (Tredaptive®), který je často užíván současně se statiny, pokud selhávají v monoterapii [44,47].
Dalšími faktory, které ovlivňují individuální míru snižování LDL-c, jsou variace nukleotidového polymorfizmu [51,52].
Při léčbě dyslipidemie musíme ve spolupráci s příslušným specialistou usilovat o co nejpříznivější úpravu všech složek lipidového spektra. Úloha dyslipidemie jako rizikového faktoru CMP byla dlouho považována za rozporuplnou, ale na podkladě studií a jejich metanalýz z posledních let je její komplexní léčba pokládána za jedno z klíčových opatření snižujících riziko CMP a její opakování [43,53,54].
Diabetes mellitus
Počet nemocných s diabetem 2. typu (DM2) se stále zvyšuje, a proto se hledají nové léčebné algoritmy, které mají co nejvíce ovlivnit průvodní kardiovaskulární rizika (hypertenze, dyslipidemie, prokoagulační stavy) a také zmírnit základní metabolické defekty. Pouhé snížení hyperglykemie je pro redukci manifestace cévních komplikací nedostačující. Nadějnou skupinou antidiabetických léčiv jsou tiazolidindiony (TZD). Ty zlepšují metabolickou kompenzaci diabetiků tím, že snižují inzulinovou rezistenci. Jsou agonisty jaderných receptorů aktivovaných proliferáty peroxizomů a jejich aktivací se podílejí na regulaci homeostázy jak lipidového, tak sacharidového metabolizmu [55]. V posledním doporučení ESO [18] se na základě studie PROactive (PROspective pioglitAzone Trial In macroVascular Events) uvádí jako nejvhodnější lék pro kompenzaci pacientů s DM2 TZD-pioglitazon [56]. Obdobně působí i rosiglitazon [57]. Léčba glitazony (rosiglitazon a pioglitazon) má také svoje rizika, která prokázala např. studie RECORD (Rosiglitazone Evaluated for Cardiovascular Outcomes in oRal agent combination therapy for type 2 Diabetes) [58] – vyšší riziko vzniku zlomenin a srdečního selhání [58], tato problematika je ale nad rámec tohoto sdělení. U obou těchto léčiv převažují přínosy léčby nad jejich riziky a pro používání pioglitazonu nebyla přijata žádná nová opatření (www.sukl.cz).
Dlouho nebylo jasné, zda intenzivní kontrola glykemie u asymptomatických nemocných s DM2 snižuje vznik komplikací DM. Až studie the United Kingdom Prospective Diabetes Study (UKPDS) a další prokázaly, že pouhá kvalitní kontrola glykemie a optimální léčba hypertenze významně omezila vznik hlavních diabetických komplikací a snížila nejen výskyt komplikací mikrovaskulárních, ale i makrovaskulárních (infarkt myokardu, kardiovaskulární úmrtí) [59]. Jiná studie ADVANCE (Action in Diabetes and Vascular Disease: Preterax and Diamicron MR Controlled Evaluation) rovněž potvrdila, že intenzivní léčba TK a hyperglykemie u diabetiků 2. typu významně snižuje výskyt mikrovaskulárních komplikací, ale počet makrovaskulárních příhod poklesl statisticky nevýznamně [60]. Ve studii ACCORD (The Action to Control Cardiovascular Risk in Diabetes), která měla analogické cíle (intenzivní snížení glykemií k normě s cílovou hodnotou glykovaného hemoglobinu < 6,0 %; intenzivní léčba hypertenze s cílovou hodnotou TK < 120/80) a navíc větev s kombinovanou léčbou dyslipidemie statiny a fibráty [61], prokázala ve větvi s intenzivní léčbou hyperglykemie významně vyšší výskyt hypoglykemií se signifikatním zvýšením úmrtnosti [62]. Proto jsou v posledních letech obavy z razantního snižování glykemie [63]. Ve větvi s kombinovanou léčbou dyslipidemie statinem a fibrátem se celkové kardiovaskulární riziko nesnížilo, ale u podskupiny nemocných s vysokou koncentrací TG a nízkou koncentrací HDL-c se touto léčbou snížil výskyt kardiovaskulárních příhod o třetinu [64]. Přes určité rozpaky z předčasně ukončené studijní větve s intenzivní léčbou hyperglykemie přinesla tato studie i řadu pozitivních informací. I když nepotvrdila celkové snížení kardiovaskulárního rizika, prokázala příznivé ovlivnění mikrovaskulárních komplikací DM2. Studie vyvolala také řadu sporných otázek, zejména jakou cílovou koncentraci glykovaného hemoglobulinu (HbA1c) u této vysoce rizikové populace zvolit [65]. Např. ve studii VADT (Veterans Affairs Diabetes Trial) snížení HbA1c k hodnotám kolem 5,2 % zvýšilo mortalitu [66], obdobně jako ve studii ACCORD, kdy snaha udržovat hodnoty HbA1c pod 4,2 % rovněž zvýšila mortalitu oproti mírnějším léčebným režimům s hodnotami HbA1c 5,3–6,2 % [67]. Proto intenzivní léčba DM musí vždy vyvážit její případná rizika a současně je potřebné motivovat nemocné ke změně životního stylu. Nedávno publikovaná studie prokázala, že dodržování základních pravidel životosprávy (BMI pod 30 kg/m2, nekuřáctví, pravidelná fyzická aktivita a zdravá výživa) sníží pravděpodobnost vzniku DM2 typu o 80 %, i. m. o 78 %, CMP o 50 % a zhoubných nádorů o 30 % [68].
Farmakologická sekundární prevence nekardioembolických CMP/TIA – současnost
CMP je heterogenní onemocnění s více než 150 známými příčinami [69]. Subtypy mozkového infarktu/TIA se dělí do šesti hlavních kategorií (tab. 2) [70]. I když se v této době diskutuje o přesnějším zařazování podle převažující etiologie s jiným procentuálním zastoupením v hlavních kategoriích [69,71], z praktického hlediska se farmakologická sekundární prevence odlišuje podle dvou hlavních příčinných skupin – na nekardioembolický a kardioembolický mozkový infarkt/TIA.
Tab. 2. Subtypy ischemických iktů [72]. ![Subtypy ischemických iktů [72].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/313dab4a4859e5ea733802a754f352c7.jpeg)
Nekardioembolické CMP jsou nejpočetnější, a tím i nejvýznamnější skupina subtypů mozkového infarktu/TIA, jejichž hlavní příčinou je aterotrombóza extra - a intrakraniálních tepen (tab. 2) [1,2]. Adheze krevních destiček, jejich aktivace a agregace jsou klíčové mechanizmy jak u normální hemostázy, tak patologické trombózy a jsou to rozhodující faktory pro iniciaci intravaskulární trombózy s odpovídajícími konsekvencemi [72]. Proto jsou ve farmakologické sekundární prevenci recidivy nekardioembolického mozkového infarktu/TIA základními léky látky s protidestičkovým působením: kyselina acetylsalicylová (ASA), kombinace nízkých dávek ASA a dipyridamolu s modifikovaným uvolňováním (ASA + ER-DP) a klopidogrel. Jde o léky první volby v současném doporučení ESO [18] i v doporučením českém [73].
Kyselina acetylsalicylová
Kyselina acetylsalicylová (ASA, Anopyrin® aj.) je nejdéle užívaný protidestičkový lék a poprvé byl popsán její vliv na koagulaci v r. 1945. Ireverzibilně inhibuje cyklooxygenázu 1 (COX-1), a tím blokuje syntézu nejvýznamnější proagregační a vazokonstrikční látky tromboxanu A (TXA2) a má celou řadu dalších účinků, které jsou v písemnictví podrobně popsány. Snižuje RRR ischemické CMP o 15–25 %. Dávkování a problémy léčby preparáty s ASA jsou uvedeny v tab. 3. ASA působí protektivně u většiny pacientů se zvýšeným rizikem aterosklerotických příhod včetně infarktu myokardu (i. m.) a mozkového infarktu, u stabilní a nestabilní anginy pectoris, po prodělaném i. m. nebo mozkovém infarktu a aterosklerotickém postižení cév končetin, a to v dávce 75–150 mg/den. Vyšší dávky nezvyšují účinnost ASA, stoupá jen výskyt nežádoucích účinků. Vedle nežádoucích účinků jsou problémem léčby s ASA kontraindikace a aspirinová rezistence, která se udává až u 30 % nemocných [74].
Tab. 3. Dávkování a hlavní problémy léčby ASA [74]. ![Dávkování a hlavní problémy léčby ASA [74].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/e25463ff23111e16bf5e934dcca54139.jpeg)
Dipyridamol
Dipyridamol je další léčivo, které bylo zkoušeno v sekundární prevenci ischemické CMP. Jeho účinnost je srovnatelná s ASA, inhibuje fosfodiesterázu a absorpci adenozinu (tab. 4) [75] a nyní se užívá pouze jako součást níže uvedeného kombinovaného léčiva.
Tab. 4. Účinky dipyridamolu [75]. ![Účinky dipyridamolu [75].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/ec28e07a2263e559cec0538e7eb455f4.jpeg)
Výsledkem snahy zvýšit účinnost a snížit výskyt nežádoucích účinků byla kombinace ASA s léky s odlišným protidestičkovým účinkem.
ASA a dipyridamol
Až kombinace ASA a dipyridamolu s protrahovaným uvolňováním (ASA + ER-DP) (Aggrenox®) v European Stroke Prevention Study 2 (ESPS 2) a později i ve studii European/Australasian Stroke Prevention in Reversible Ischaemia Trial (ESPRIT) při dávkování 2 × 25 mg ASA a 2 × 200 mg dipyridamolu s protrahovaným uvolňováním prokázala významné snížení rizika opakování mozkového infarktu/TIA [75–77]. Až rozsáhlá komparativní studie PRoFESS (The Prevention Regimen For Effectively avoiding Second Strokes) porovnávající ASA-ER + DP s klopidogrelem prokázala, že matematická logika, která měla prokázat přibližně další 14% snížení RRR CMP ve srovnání s klopidogrelem, nefunguje. Studie naopak zjistila, že riziko opakování iktu, i. m., nebo smrti z vaskulárních příčin je prakticky shodné u nemocných užívajících ASA + ER-DP nebo klopidogrel, ale i ASA [78].
Klopidogrel
Klopidogrel je tienopyridinový derivát, který reprezentuje podskupinu inhibitorů adenozindifosfátových (ADP) receptorů. Byl uveden na trh jako bezpečnější varianta tiklopidinu a jeho chemická struktura je velmi podobná a působí shodným mechanizmem. Protože pro českého neurologa byl uvolněn předpis tohoto léčiva až po uvedení na trh jeho prvního generika (Trombex®), a to nedávno, věnujeme se tomuto léčivu poněkud podrobněji.
Selektivně a ireverzibilně blokuje destičkový ADP receptor P2Y12, a tím brání ADP-dependentní aktivaci komplexu IIb//IIIa, který je hlavním receptorem pro fibrinogen na povrchu destiček a navíc ovlivňuje ADP indukovanou inhibici adenylátcyklázy. Klopidogrel je proléčivo s nízkou konverzí na aktivní metabolit, protidestičkovou aktivitu získá až po metabolizování (obr. 2). Většina léku je degradována esterázami a zbývajících 10–15 % je metabolizováno v játrech, kde je intenzivně bioaktivován oxidací cytochromovým systémem P-450 na vlastní účinný metabolit [79]. Při jakémkoli snížení aktivity řetězce izoenzymů CYP (2C19, 1A2, 3A4 aj.) podíl léku degradovaného esterázami stoupá a výsledná koncentrace aktivní látky je pod terapeutickou koncentrací [80–82]. Geny kódující jednotlivé enzymy cytochromového komplexu jsou polymorfní s častým zastoupením alel, které snižují funkce cytochromového komplexu. Hlavní roli při bioaktivaci klopidogrelu má cytochrom P450 2C19 [81,82]. Jeho funkce může být z důvodu genového polymorfizmu různá a odhaduje se, že plná třetina nemocných je na úrovni CYP 2C19 geneticky pomalým metabolizátorem. U nositelů tohoto genového polymorfizmu se snižuje koncentrace aktivních metabolitů klopidogrelu o 32,4 % a tato nedostatečná bioaktivace klopidogrelu ve studii TRITON-TIMI 38 (Trial to Assess Improvement in Therapeutic Outcomes by Optimizing Platelet Inhibitio with Prasugrel-Thrombolysis in Myocardial Infarction) zvýšila výskyt kardiovaskulárních příhod až o 53 % [83,84]. Retrospektivní analýza této studie ale zjistila, že většina nemocných léčených v klopidogrelové větvi byla současně léčena inhibitory protonové pumpy (IPP), proto je toto zjištění problematické – viz níže [85]. Přítomnost alespoň jedné inaktivní alely CYP 2C19 u nemocných užívajících klopidogrel zvýšila riziko úmrtí, i. m. nebo CMP téměř dvojnásobně [83,84]. Blokádu konverze klopidogrelu mohou způsobit i lékové interakce. Nejvýznamnější je inhibice CYP 2C19 inhibitorem protonové pumpy (IPP) – omeprazolem [86]. Ostatní inhibitory jsou v tomto smyslu bezpečné: pantoprazol, na funkci cytochromu P450 2C19 prakticky nemají vliv, podobně inhibitory H2 receptorů [80,87]. Podle retrospektivní analýzy bylo u nemocných po akutní koronární příhodě léčených klopidogrelem a IPP (zpravidla omeprazolem) o 86 % vyšší riziko recidivy kardiovaskulární příhody oproti nemocným, kteří IPP neužívali [88]. Ve zvířecím experimentu se zjistila také interakce klopidogrelu s dvěma komponentami hepatálního P450 systému a může interferovat s metabolizmem jiných látek s extenzivním jaterním clearens, jako jsou fenytoin a teofylin. Také lipofilní statiny, které jsou metabolizovány cytochromovým systémem P-450 izoenzymem CYP 3A4, mohou snižovat antiagregační účinek klopidogrelu [89,90]. Proto se v tomto případě doporučuje zvýšit úvodní dávku klopidogrelu [91].
Obr. 2. Schéma působení klopidogrelu. 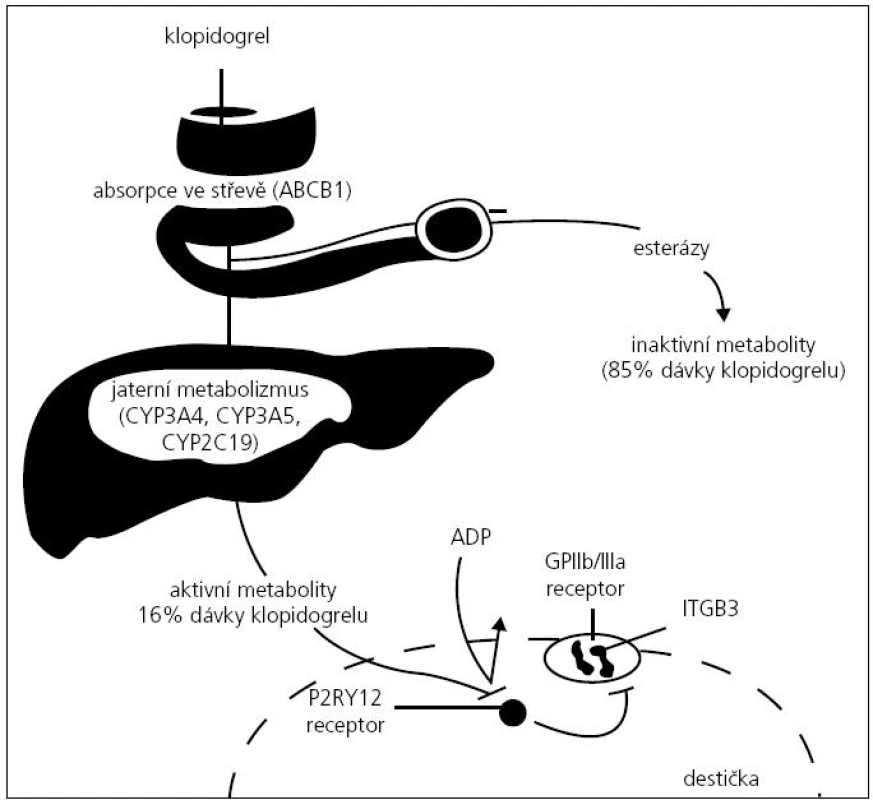
Nežádoucí účinky i závažného charakteru, které jsou ale velmi vzácné, jsou dobře z literatury známy [80]. Nověji se u klopidogrelu udává výskyt rezistence, a to v rozmezí 4–30 % [92,93]. Individuální variabilita odpovědi klopidogrelu na inhibici ADP indukované destičkové agregace kolísá v rozsahu méně než 10 % do téměř kompletní inhibice destičkové agregace a rozlišujeme nemocné na respondéry a non-respondéry klopidogrelu [84]. Plná třetina nemocných je geneticky pomalým metabolizátorem na úrovni CYP 2C19 nebo k blokádě konverze klopidogrelu vedou lékové interakce [80].
Přesto je klopidogrel v současnosti stále jedním z nejvýznačnějších léčiv pro sekundární prevenci nekardioembolického mozkového infarktu/TIA a je dnes nejvýznamnějším představitelem inhibitorů trombocytárních ADP receptorů, které zásadním způsobem přispívají ke zlepšení prognózy nemocných s aterotrombotickým onemocněním. Jeho účinnost byla ověřena v řadě klinických studií. V základní studii CAPRIE (Clopidogrel vs. Aspirin in Patiens at Risk of Ischaemic Events) byla porovnávána účinnost klopidogrelu proti ASA a byl zjištěn malý, ale statisticky významný pokles (o 8,7 %) kardiovaskulárních příhod a klopidogrel snižoval i kombinované riziko ischemické CMP, i. m. nebo vaskulární smrti. Další analýzy studie CAPRIE a multivariační analýza potvrdila přínos klopidogrelu pro prevenci recidivy proti ASA zejména u vysoce rizikových nemocných s manifestním aterosklerotickým postižením a tento závěr potvrdila poslední studie MATCH (Management of Atherothrombosis with Clopidogrel in High-Risk patiens) a CHARISMA (Clopidogrel for High Atherothrombotic Risc and Ischaemic Stabilisation, Management and Avoidance).
Významná studie CURE (Clopidogrel in Unstable Angina to Present Recurrent Ischemic Events) prokázala, že včasné podávání klopidogrelu (bolus 300 mg, následované 75 mg/den) přidaného ke standardní léčbě (ASA 75 až 325 mg/den) výrazně snižuje riziko i. m., CMP a vaskulární smrti u pacientů s akutním koronárním syndromem (nestabilní angina pectoris a non-Q infarkt myokardu) a v další samostatné studii PCI-CURE (Percutaneous Coronary Intervention) se prokázalo, že pacienti, kteří podstoupili perkutánní koronární intervenci, měli z léčby klopidogrelem větší užitek, pokud byl podán před výkonem a užíván následující měsíce až rok po intervenčním výkonu. Na základě těchto závěrů se předpokládalo, že kombinovaná léčba klopidogrelem a ASA bude účinnější i v sekundární prevenci ischemických CMP než jednotlivé léky. Následovala velká studie MATCH (Management of ATherothrombosis with Clopidogrel in High-risk patients), která opět potvrdila větší účinnost klopidogrelu než ASA, ale kombinovaná léčba byla v prevenci hlavních vaskulárních příhod neprůkazně přínosnější (snížení RRR o 6,4 %; absolutní redukce rizika o 1 %), a naopak výskyt život ohrožujících nebo velkých krvácení byl ve skupině s kombinací léčiv významně vyšší, i když nedošlo k průkaznému ovlivnění mortality [79]. Tato duální léčba se v některých zemích stále užívá a krvácivé komplikace se u této léčby vyskytují 2krát méně než u warfarinu a rozdíl ve výskytu závažných krvácení není u obou léčebných strategií statisticky významný [94]. Přínos této duální léčby (klopidogrel + ASA) byl prokázán v prevenci vaskulárních příhod (zejména CMP) u nemocných s fibrilací síní a zvýšeným vaskulárním rizikem, u kterých nebyla indikována antikoagulační léčba [95].
Pilotní studie publikovaná v roce 2010 zjistila, že dvojnásobná dávka klopidogrelu u pacientů s vysokou reaktivitou destiček tuto reaktivitu průkazně snižuje [96]. Klopidogrel stále patří k velmi užitečné farmakologické sekundární prevenci nekardioembolických iktů a je optimální alternativou ASA (i duálních léků) při nesnášenlivosti kyseliny acetylsalicylové [11]. U vysoce rizikových nemocných (např. po prodělané CMP, s ischemickou chorobou dolních končetin, se symptomatickou ICHS nebo s DM) a po operacích srdce je průkazně účinnější [97]. Klopidogrel má proti ASA nižší riziko krvácení do GIT, ale signifikantně zvyšuje výskyt kožní rush a průjmů [98]. Možností řešení protidestičkovou prevenci u non-responderů klopidogrelu je zdvojnásobení dávky [96]. Tuto možnost potvrdila studie CURRENT--OASIS 7 [99], která u pacientů s provedenou perkutánní koronární intervencí (PCI) zjistila, že dvojnásobná dávka klopidogrelu snížila statisticky významně výskyt i. m. a trombóz ve stentu. Počet krvácivých komplikací byl vyšší, ale statisticky nevýznamný. Ve studii PRINCIPLE-TIMI 44 (Prasugrel in comparison to clopidogrel for inhibition of platelet activation and aggregation – TIMI 44) při dvojnásobné dávce klopidogrelu (150 mg) byl výskyt rezistence jen 8 % [85]. Jiná velká studie GRAVITAS (The Gauging Responsiveness with A VerifyNow assay Impact on Thrombosis And Safety) [100], která srovnávala užitečnost dávky 75 mg a 150 mg, neprokázala mezi oběma skupinami rozdíl v četnosti výskytu vaskulárních příhod [101].
Dodatečné analýzy studie PRoFESS potvrdily, že klopidogrel je v prevenci nekardioembolické CMP účinnější, než se myslelo [102], a proto i v posledním doporučení ESO [18] je uveden jako základní a preferovaný lék v sekundární prevenci u nekardioembolických CMP.
Ostatní léčiva užívaná v sekundární prevenci nekardioembolického mozkového infarktu/TIA
Z léků, které nejsou u nás registrovány a mají význam, je to triflusal a cilostazol. Triflusal je novější protidestičkové léčivo s obdobnou strukturou jako salicyláty, je 4-flurometyl derivátem salicylové kyseliny. Na rozdíl od ASA preferenčně inhibuje cyklooxygenázu 2. Nově byla experimentálně zjištěna jeho inhibice zánětlivé cesty. Je podobně účinný jako ASA u nemocných po i. m. nebo CMP, hemoragické komplikace se vyskytují méně často a může být alternativou u nemocných s rezistencí nebo intolerancí ASA a zejména u astmatiků [75,103,104].
Další lék, který byl také zkoušen v léčbě akutního mozkového infarktu, je cilostazol. Ve studii CAIST (Cilostazol in Acute Ischemic Stroke Treatment) bylo prokázáno, že u nemocných nesnášejících ASA může tento lék být alternativou ASA v léčbě akutní CMP [105]. Cilostazol je protidestičkové léčivo, které selektivně inhibuje fosfodiesterázu III, blokuje degradaci cyklického adenozinmonofosfátu (cAMP) a tím zvyšuje hladinu cAMP v destičce, působí vazodilatačně, protektivně na endotel (protiapoptoticky) a v experimentu příznivě ovlivňuje lipidový metabolizmus zvýšením aktivity lipoproteinové lipázy se snížením triglyceridů a zvýšením koncentrace HDL-c [106].
Cilostazol ovlivňuje progresi symptomatické intrakraniální arteriální stenózy [107] a účinně snižuje RRR mozkového infarktu u diabetiků a hypertoniků [106], ale na rozdíl od ASA nezvyšuje výskyt intrakraniálních hemoragií. V Cilostazol Stroke Prevention Study snížil statisticky významně RRR CMP o 41,7 % proti placebu a nejvíce u lakunárních CMP, protože specificky působí na postižení malých tepének a má vaskulární protektivní efekt [108].
Slabinou těchto studií je, že cilostazol byl srovnáván jen s placebem [107,108].
Ve druhé Cilostazol Stroke Prevention Study (CSPS 2), která byla již komparativní (cilostazol versus ASA), bylo zjištěno stejné nebo o něco výraznější snížení RRR proti ASA, výskyt hemoragických komplikací byl nižší, ale zvýšil se počet nezávažných vedlejších účinků (cefalea, průjmy, palpitace apod.) [109]. Po šesti měsících byl již cilostazol účinnější a na konci studie snížil RRR o 38,1 % ve srovnání se skupinou užívající ASA. Potvrzení této účinnosti by měla přinést další větší studie III. fáze [110].
Budoucnost farmakologické sekundární prevence nekardioembolických mozkových infarktů/TIA
Ve fázi slibného pokročilého klinického hodnocení jsou tři molekuly, jež jsou inhibitory receptoru P2Y12: ticagrelor (AZD6140) prasugrel a cangrelor. Byly a jsou zatím testovány ve studiích s kardiologickými indikacemi.
Ticagrelor (AZD6140) je první reverzibilní perorální antagonista receptoru P2Y12 ze skupiny cyklopentyl-triazolo-pyrimidinů s biologickým poločasem okolo 12 hod. Váže se přímo na receptor P2Y12, nepotřebuje metabolickou konverzi a může více komplexně inhibovat ADP zprostředkovanou agregaci destiček. Inhibice receptoru je dependentní na dávce a je vyšší než klopidogrelem [111,112]. Účinkuje rychle, do 30 min, vrchol inhibice nastupuje aproximativně za 2 hod po užití. Biologický poločas mohou prodloužit inhibitory CYP 3A4 (např. diltiazen) a po ukončení podávání léčiva se normální reaktivita destiček obnoví po pěti dnech [113]. Účinnost a bezpečnost ticagrelolu byla testována v řadě kardiologických studií. Ve studii DISPERSE (Dose confirmation study assessing antiplatelet effect of AZD6140 vs. Clopidogrel in non-ST - segment elevation myocardial infarction) byla zjišťována bezpečnost, snášenlivost a iniciální účinnost AZD6140 ve srovnání s klopidogrelem. Bezpečnost a snášenlivost byla srovnatelná, jako reverzibilní inhibitor P2Y12 je pro svoji flexibilitu velmi výhodný v chirurgii [114–116]. Na studii DISPERSE navázala další velká kardiologická studie PLATO (Platelet inhibition and patient outcomes), která prokázala, že ticagrelor v kombinaci s ASA ve srovnání s klopidogrelem s ASA vysoce statisticky významně snižuje úmrtnost z vaskulárních příčin (o 21 %), celkovou mortalitu (o 22 %), výskyt i. m. (o 16 %) nebo CMP, trombózy ve stentu (o 33 %) u pacientů s akutním koronárním syndromem s elevací segmentu ST nebo bez ní. Nedošlo ve srovnání s klopidogrelem ke zvýšení souhrnného procenta velkých krvácení, jen se zvýšil výskyt procedurálních krvácení v souvislosti se zaváděním stentů. Jediným nežádoucím účinkem, který se při léčbě ticagrelorem vyskytoval zhruba dvojnásobně častěji, byla dušnost. Její etiologie je zatím nejasná [117]. Ticagrelor inhibuje aktivaci a agregaci destiček u všech nemocných, tj. je účinný jak u responderů, tak u non-responderů klopidogrelu [118].
Molekula prasugrel je třetí generací tienopyridinů, je rovněž proléčivem s nutností konverze na aktivní metabolit izoenzymem CYP 2C19, podobně jako klopidogrel. Není ovšem inaktivován esterázami a polymorfizmus izoenzymů CYP nebo jejich inhibice nezpůsobí jeho inaktivaci, nebo degradaci na neúčinné metabolity, pouze se zpomalí biotransformace [119]. Prasugrel má spolehlivější protidestičkový účinek, nevyskytují se nemocní, kteří na léčbu neodpovídají. Další výhodou je významně rychlejší nástup účinku (30–60 min) a je v současné díky centrální registraci v Evropské unii registrován pro zatím jedinou schválenou indikaci – prevenci trombotických komplikací u nemocných s akutním koronárním syndromem ošetřených koronární angioplastikou. V registrační megastudii TRITOM-TIMI 38 došlo v této indikaci k poklesu výskytu akutních koronárních příhod včetně trombózy ve stentu o 1/5 proti kontrolní větvi léčenou klopidogrelem s ASA. I když se zvýšil výskyt velkých krvácení, včetně fatálních, převažuje příznivý účinek nad rizikem krvácení [120]. I když analýzy studií zjišťující účinnost klopidogrelu a prasugrelu s kombinací s IPP nebo bez ní nepotvrzují negativní dopad kombinace IPP na snížení antiagregačního účinku [85], jednoznačně to platí pro prasugrel (viz výše). Prokázané farmakokinetické (tab. 5), farmakodynamické (tab. 6) a klinické účinky (tab. 7) prasugrelu jsou uvedeny přehledně v tabulkách [121]. Podle srovnání prasugrelu a ticagreloru v nepřímé komparativní metaanalýze prasugrel snižuje výskyt stentových trombóz a ticagrelor má nižší výskyt krvácivých komplikací. Obě léčiva jsou účinnější než klopidogrel [122]. Větší efektivitu jak prasugrelu, tak ticagreloru oproti klopidogrelu prokázaly i další studie, prasugrel působí rychle a aktuálně je u akutních koronárních příhod v prevenci trombotických komplikací nejúčinnějším léčivem [123,124].
Tab. 5. Farmakokinetika prasugrelu [122]. ![Farmakokinetika prasugrelu [122].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/b83ddd3202d0a2ef417aa4ab46f2d61e.jpeg)
Tab. 6. Farmakodynamika prasugrelu [122]. ![Farmakodynamika prasugrelu [122].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/02a5f88b6ab9a436f8d140c877bc205b.jpeg)
Tab. 7. Klinické efekty prasugrelu [122]. ![Klinické efekty prasugrelu [122].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/67c0be8b4cb8f0efa34b5b4977019157.jpeg)
Cangrelor je intravenózní, reverzibilní, rychle působící non-tienopyridinový inhibitor ADP receptoru. Působí přímo, tj. nepotřebuje konverzi a navíc inhibuje oba základní ADP receptory P2Y1 a P2Y12. Účinkuje rychle (během minut) a krátce (poločas 5–9 min), účinek odezní do 1 hod, proto se aplikuje v kontinuální infuzi [125,126]. Je testován u akutních koronárních příhod a je významně účinnější než klopidogrel pouze v prevenci trombózy ve stentu a v poklesu 30denní mortality [127].
Jiným novým protidestičkovým léčivem inhibujícím P2Y12 receptor je elinogrel (PRT-060128). Je to přímo působící a reverzibilní, kompetitivní antagonista destičkového receptoru P2Y12 a byl vyvinut k intravenózní nebo perorální léčbě akutního koronárního syndromu a pro prevenci sekundárních trombotických příhod. Rychle a kompletně inhibuje ADP zprostředkovanou odpověď destiček, po dobu účinku působí rovnoměrně, po jedné dávce protidestičkový účinek odeznívá během 24 hod, je dobře snášen, nemá významnější nežádoucí účinky. Byl vyvinut pro krátkodobou i dlouhodobou léčbu akutních koronárních syndromů a sekundární prevenci trombotických příhod a podle závěrů II. fáze klinické studie je nadějným kandidátem kardiovaskulární protekce [128,129].
Uvedené molekuly, které jsou v současné době testovány jen v kardiologii, mohou být v budoucnu užitečné i v cévní neurologii zejména u rekanalizačních metod extra - a intrakraniálních tepen.
Dalšími nově zkoušenými antitrombotiky, a to také v sekundární prevenci recidivy ischemických CMP, jsou antagonisté receptoru tromboxanu A2 (TXA2) a destičkových trombinových receptorů (typu PAR-1).
Terutroban (S 18886) je protidestičkové léčivo, které je podle experimentálních studií nejméně stejně účinné jako ASA a má také protisklerotické a protivazokonstrikční účinky. Je specifickým antagonistou receptorů TXA2 a endoperoxidových prostaglandinů (PGG2-PGH2) [130,131]. Vrcholu plazmatické koncentrace dosahuje mezi 30 min až 2 hod, biologický poločas je 5,8–10 hod [131]. Selektivně inhibuje nejen tromboxanové receptory (TP) [132], ale v experimentu inhibuje i aterogenezi [133,134]. Jeho účinnost a bezpečnost byla studována v současnosti největší mezinárodní, dvojitě slepé, randomizované kontrolované studii PERFORM (the Prevention of cerebrovascular and cardiovascular Events of ischemic origin with teRutroban in patiens with history oF ischemic strOke or tRansient ischeMic attack), která měla prokázat, zda specifický antagonista TP receptoru terutroban v dávce 30 mg/d je účinnější než ASA v dávce 100 mg/d [130]. Studie byla zahájena v únoru 2006 a byla předčasně ukončena na jaře roku 2010. Na závěrečné videokonferenci 30. 9. 2010 konstatovala prof. Bousserová, že přestože jsou u terutrobanu prokázány antitrombogenní vlastnosti a endoteliální protekce, nebyl ve studii účinnější než ASA a signifikantně zvyšoval výskyt malých krvácení. Přehled těchto novým a testovaných léčiv uvádí tab. 8.
Tab. 8. Perspektivy antitrombotické prevence. 
Inhibitor trombinových receptorů SCH 530348
Jeho vývoj vycházel z následujících konsekvencí. Trombin komunikuje s buňkami prostřednictvím třídy proteázových receptorů na povrchu buňky (PARs, protease--activated receptors). PARs jsou aktivovány proteolytickým štěpením. Jsou identifikovány čtyři PARs a PAR1 je hlavní receptor pro trombinem zprostředkovanou aktivaci destiček. Jejich význam ve vývoji trombózy je jednoznačný, protože trombin je jedním z nejsilnějších aktivátorů lidských destiček in vitro. Spojují prokoagulační účinek trombinu s různými buněčnými efekty v regulaci trombózy. PARs se podílejí na vývoji aterosklerózy, v postangioplastických restenózách a spojují hemostatickou a zánětlivou cestu [135].
SCH 530348 je selektivní, kompetitivní inhibitor PAR-1 destiček, užívá se perorálně [136]. Antagonisté PAR-1 jsou v experimentu účinnější než ASA nebo antagonisté receptoru P2Y12. Proto mohou účinněji než ASA nebo antagonisté receptorů P2Y12 působit jak v akutní situaci (např. při masivním generování trombinu), tak během dlouhodobého podávání, kdy přetrvává generování trombinu i při užívání ASA a klopidogrelu [137]. Druhá fáze klinické studie [138] prokázala dobrou snášenlivost a bezpečnost SCH 530348 v indikaci neurgentní perkutánní koronární intervence a začátkem roku 2011 byla předčasně ukončena – pro nedostatečnou účinnost – III. fáze velké klinické studie TRA 2ºP TIMI 50 (A multicentre, randomized, double-blind, placebo-controlled study to evaluace the safety and efficacy of SCH 530348 in addition to standard of care in subjects with a history of atherosclerotic disease: Thrombin Receptor Antagonist in Secondary Prevention of Atherothrombotic Ischemic Events), která měla tři větve – kardiologickou, angiologickou (ischemická choroba dolních končetin) a sekundárně preventivní po ischemické CMP.
Problémy sekundární prevence nekardioembolických CMP
Současné možnosti sekundární prevence recidivy nekardioembolických CMP (tab. 9) jsou omezené a nedosahují účinnosti prevence u kardioembolických CMP [139]. V současné době se také diskutuje o tom, jakými dalšími způsoby je možné ovlivnit tzv. reziduální riziko u kardiovaskulárních onemocnění. Jde o přetrvávající riziko makrovaskulárních a mikrovaskulárních komplikací, kterými je ohrožena většina nemocných léčených podle současných terapeutických standardů, včetně dosažení cílových hodnot LDL-c, glykemie a krevního tlaku. I když významné studie (UKPDS, ADVANCE aj.) prokázaly, že důsledná léčba hypertenze, dyslipidemie spolu s antiagregační léčbou snižuje kardiovaskulární riziko u těchto nemocných až o 60 %, praxe je jiná [140]. Důvodem je mimo jiné nedodržování režimových doporučení: nekouření, snížení hmotnosti u obézních, změna dietetických návyků a pravidelné zvýšení fyzické aktivity. Např. v roce 2009 publikovaná studie ukázala, že dodržování základních pravidel životosprávy zcela mění kardiovaskulární a metabolické riziko nemocných na rozdíl od těch, kteří nic z toho nedodržují. Pravděpodobnost vzniku DM2 se snížila o 80 %, i. m. o 78 %, výskyt CMP o 50 % a výskyt karcinomu o 30 % [141]. Hlavním důvodem „selhávání“ v klinických studiích ověřených doporučení je tedy špatná spolupráce pacientů, vedle chybění motivace pro změnu životního stylu je to také velmi nízká adherence k léčbě [142,143], která patří v České republice k nejnižším v Evropě [144]. Odhaduje se, že maximálně polovina pacientů užívá léčiva správně. Nedostatečná adherence k léčbě má mnoho důvodů. Vedle nežádoucích účinků je to užívání nesprávného množství léčiva, případně nesprávným způsobem, velký význam má také dávkovací režim. Zpravidla lepší adherence je při užívání léčiva jednou denně [145,146], proto je všeobecná snaha vyvíjet pro chronickou léčbu léky s pomalým uvolňováním nebo léky, které se užívají jednou denně. Současně je potřebná cílená a přesvědčivá osvěta zahájená již v časném školním věku.
Tab. 9. Současné možnosti farmakologické sekundární prevence u nekardioembolických iktů [18,73,101]. ![Současné možnosti farmakologické sekundární prevence u nekardioembolických iktů [18,73,101].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/d86e50ab8971a7158f32c565cc020fd1.jpeg)
doc. MUDr. Zbyněk Kalita, CSc.
Neurologické oddělení
Krajská nemocnice T. Bati a Ústav zdravotnických studií UTB
Havlíčkovo nábřeží 600
762 75 Zlín
e-mail: kalita@bnzlin.czPřijato k recenzi: 16. 3. 2011
Přijato do tisku: 2. 5. 2011
Zdroje
1. Röther J, Alberts MJ, Touze E, Mas JL, Hill MD, Michel P et al. Risk factor profile and management of cerebrovascular patiens in the REACH registry. Cerebrovasc Dis 2008; 25(4): 366–374.
2. Steg GP, Bhatt DL, Wilson PWF, D´Agostino R, Ohman EM, Röther J et al. One-year cardiovascular event rates in outpatients with atherothrombosis. JAMA 2007; 297(11): 1197–1206.
3. Weimar C, Goertler M, Röther J, Ringelstein EB, Darius H, Nabavi DG et al. Systematic risk score evaluation in ischemic stroke patiens (SCALA). J Neurol 2007; 254(11): 1562–1568.
4. Lopez AD, Mathers C, Ezzati M, Jamison DT, Murray CJL. Global and regional burden of disease and risk factors, 2001: systematic analysis of population health data. Lancet 2006; 367(9524): 1747–1757.
5. Thom T, Haase N, Rosamond W, Howard VJ, Rumsfeld J. Heart disease and stroke statistics to 2006 update. A report from American Heart Association Statistics Committee and Stroke Statistics Subcommitte. Circulation 2006; 113(6): e85–e151.
6. Rosamond W, Flegal K, Friday G, Furie K, Go A, Greenlund K et al. Heart disease and stroke statistics – 2007 update: a report from the American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Circulation 2007; 115(5): e69–e117.
7. Luengo-Fernandez R, Gray AM, Rothwell PM. Effect of urgent treatment for transient ischaemic attack and minor stroke on disability and hospital costs (EXPRESS study): a prospective population-based sequential comparison. Lancet Neurology 2009; 8(3): 235–243.
8. Kalita Z. Léčba hypertenze v sekundární prevenci CMP. In: Kalita Z et al (eds). Akutní cévní mozkové příhody, Praha: Maxdorf 2006 : 371–374.
9. Yusuf S, Diener H, Sacco RL, Cotton D, Ounpuu S, Lawton WA et al. Telmisartan to prevent recurrent stroke and cardiovascular events. N Engl J Med 2008; 359(12): 1223–1237.
10. Špinar J, Ondráčková B. Telmisartan v sekundární prevenci. Remedia 2009; 19(2): 122–127.
11. Yusuf S, Teo KK, Pogue J, Dyal L, Copland I, Schumacher H et al. Telmisartan, ramipril or both in patients a high risk for vascular events. N Engl J Med 2008; 358(15): 1547–1559.
12. Sipahi I, Debanne SM, Rowland DY, Simon DI, Fang JC. Angiotensin-receptor blockade and risk of cancer: meta-analysis of randomised controlled trials. Lancet Oncol 2010; 11(7): 627–636.
13. Suchopár J, Bultas J. Inhibitory ACE a antagonisté AT1 pro angiotensin II (sartany) využitelné v rámci sekundární prevence kardiovaskulárních příhod, porovnání základních údajů. Remedia 2010; 20(2): 134–139.
14. Widimský J sr. Kombinační léčba hypertenze. Prakt Lék 2007; 87(9): 525–530.
15. Rothwell PM, Howard SC, Dolan E, O´Brien E, Dobson JE, Dahlöf B et al. Effect of beta blockers and calcium-channel blockers on within-individual variability in blood pressure and risk of stroke. Lancet Neurol 2010; 9(5): 469–480.
16. Beckett NS, Peters R, Fletcher AE, Staessen JA, Liu L, Dumitrascu D et al. Treatment of hypertension in patiens 80 years of age or older. N Engl J Med 2008; 358(18): 1887–1898.
17. Peters R, Beckett N, Forette F, Tuomilehto J, Clarce R, Ritchie C et al. Incident dementia and blood pressure lowering in the hypertension in very elderly trial cognitive fiction assessment (HYVET-COG): a double-blind, placebo controlled trial. Lancet 2008; 7(8): 683–689.
18. European Stroke Organisation (ESO) Executive Committee; ESO Writing Committee. Guidelines for management of ischaemic stroke and transient ischaemic attack 2008. Cerebrovasc Dis 2008; 25(5): 457–507.
19. Widimský J jr, Cífková R, Špinar J, Filipovský J, Grundmann M, Horký K et al. Doporučení diagnostických a léčebných postupů u arteriální hypertenze – verze 2007. Doporučení České společnosti pro hypertenzi. Cor Vasa 2008; 50(1): K5–K22.
20. Cushman WC, Evans GW, Byington RP, Goff DC jr, Grimm RH jr et al, the ACCORD study group. Effects of intensive blood pressure control in type 2 diabetes mellitus. N Engl J Med 2010; 362(17): 1575–1585.
21. Mancia G, Laurent S, Agabiti-Rosei E, Ambrosioni E, Burnier M, Caulfield MJ et al. Reappraisal of European guidelines on hypertension management: a European Society of Hypertension Task Force document. J Hyperten 2009; 27(11): 2121.
22. Baigent C, Keech A, Kearney PM, Blackwell L, Buck G, Pollicino C et al. Efficacy and safety of cholesterol-lowering treatment: retrospective meta-analysis of data from 90 056 participants in 14 randomised trial of statin. Lancet 2005; 366(9493): 1267–1278.
23. Kalita Z. Inhibitory HMG-CoA-reduktázy – statiny. In: Kalita Z et al (eds). Akutní cévní mozkové příhody. Praha: Maxdorf 2006 : 374–382.
24. Amarenco P, Labreuche J. Lipid management in the prevention of stroke: review and updated meta-analysis of statins for stroke prevention. Lancet Neurol 2009; 8(5): 453–463.
25. Amarenco P, Benavente O, Goldstein LB, Callahan A, Sillesen H, Hennerici MG et al. Results of the stroke prevention by aggressive reduction in cholesterol levels (SPARCL) trial by stroke subtypes. Stroke 2009; 40(4): 1405–1409.
26. Amarenco P, Bogousslavsky J, Callahan A jr, Golstein LB, Hennerici M, Rudolph AE et al. High-dose atorvastatin after stroke or transient ischemic attack. N Engl J Med 2006; 355(6): 549–559.
27. Collins R, Armitage J, Parish S, Sleight P, Peto R. Effects of cholesterol-lowering with simvastatin on stroke and other major vascular events in 20536 people with cerebrovascular dinase or other high-risk conditions. Lancet 2004; 363(9411): 757–767.
28. Amarenco P, Bogousslavsky J, Callahan A jr, Goldstein LB, Hennerici M, Rudolph AE et al. Stroke prevention by aggressive reduction in cholesterol levels (SPARCL) investigators. High-dose atorvastatin after stroke or transient ischemic attack. N Engl J Med 2006; 355(6): 549–559.
29. Sillesen H, Amarenco P, Hennerici MG, Callahan A, Goldstein LB, Zivin J et al. Atorvastatin reduces the risk of cardiovascular events in patiens with carotid atherosclerosis. Stroke 2008; 39(12): 3297–3302.
30. Afilalo J, Duque G, Steele J, Jukema JW, de Craen AJ, Eisenberg MJ. Statins for secondary prevention in elderly patiens. J Am Coll Cardiol 2008; 51(1): 37–45.
31. Amarenco P, Glodstein LB, Sillesen H, Benavente O, Zweifler RM, Callahan A jr et al. Coronary heart disease risk in patiens with stroke or transient ischemic attack and no know coronary heart disease. Findings from the Stroke Prevention by Aggressive Reduction in Cholesterol Levels (SPARCL) trial. Stroke 2010; 41(3): 426–430.
32. Adams RJ, Albers G, Alberts MJ, Benavente O, Furie K, Goldstein LB et al. Update the AHA/ASA recommendation for the prevention of stroke in patiens with stroke and transient ischemic attack. Stroke 2008; 39(5): 1647–1652.
33. Amarenco P, Goldstein LB, Messig M, O´Neill BJ, Callahan A jr, Sillesen H et al. Relative and cumulative effects of lipid and blood pressure control in the stroke prevention by aggressive reduction in cholesterol levels trial. Stroke 2009; 40(7): 2486–2492.
34. Goldstein LB, Amarenco P, Zivin J, Messig M, Altafullah I, Callahan A jr et al. Statin treatment and stroke outcome in the Stroke Prevention by Aggressive Redcuction in Cholesterol Levels (SPARCL) trial. Stroke 2009; 40(11): 3526–3531.
35. Ošťádal P. Studie JUPITER. Remedia 2008; 18(6): 438–439.
36. Ridker PM, Danielson E, Fonseca FA, Genest J, Gotto AM, Kastelein JJP et al. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N Engl J Med 2008; 359(21): 2195–2207.
37. Koenig W, Ridker PM. Rosuvastatin for primary prevention in patients with European systematic coronary risk evaluation risk >=5% or Framingham risk >20%: post hoc analyses of the JUPITER trial requested by European health authorities. Eur Heart J 2011; 32(1): 75–83.
38. McArthur K, Lees KR. Advances in stroke. Advances in emerging therapies 2009. Stroke 2010; 41(2): e67–e70.
39. Chatriwalla AK, Nicholls SJ, Nissen SE. The ASTEROIDtrial: coronary plaque regression with high-dose statin therapy. Future Cardiol 2006; 2(6): 651–654.
40. Nissen SE, Nicholls SJ, Sipahi I, Libby P, Raichlen JS, Ballantyne CM et al. Effect of very high-intensity statin therapy on regression of coronary atherosclerosis: the ASTEROID trial. JAMA 2006; 295(13): 1556–1565.
41. Lardizabal JA, Deedwania PC. Benifits of statin therapy and compliance in high risk cardiovascular patients. Vasc Health Risk Manag 2010; 6 : 843–853.
42. Vrablík M. Prevence cévních mozkových příhod hypolipidemickou léčbou. Remedia 2009; 19(2): 144–148.
43. Vaverková H, Soška V, Rosolová H, Češka R, Cifková R, Freiberger T et al. Doporučení pro diagnostiku a léčbu dyslipidemií v dospělosti vypracované výborem české společnosti pro aterosklerózu. Čas. Lék. čes. 2007; 146(6): I–XV.
44. Tenenbaum A, Fisman EZ, Motro M, Adler Y. Optimal management of combined dyslipidemia: what have we blind statins monotherapy? Adv Cardiol 2008; 2008, 45 : 127–153.
45. Berge KG, Canner PL. Coronary drug project: experience with niacin. Eur J Clin Pharmacol 1991; 40 (Suppl 1): S49–S51.
46. Žák A, Zeman M, Vecka M, Tvrzická E. Kyselina nikotinová: lék neprávem opomíjený. Čas Lék. čes. 2006; 145(11): 825–831.
47. Bláha V. Kombinovaná hypolipidemická léčba u pacientů s vysokým kardiovaskulárním rizikem. Interní Med 2009; 11(1): 7–12.
48. McKenney JM, Jones PH, Bays HE. Comparative effects on lipid levels of combination therapy with a statin and extended-release niacin or ezetimibe versus statin alone (the COMPELL study). Atherosclerosis 2007; 192(2): 432–437.
49. Villines TC, Stanek EJ, Devine PJ, Turco M, Miller M, Weissman NJ et al. The ARBITER 6-HALTS Trial (Arterial Biology for Investigation of the Treatment Effects of Reducing Cholesterol 6-HDL and LDL Treatment Strategies in Atherosclerosis): final results and the impact of medication adherence, dose, and treatment duration. J Am Coll Cardiol 2010; 55(24): 2721–2726.
50. Parhofer KG. Review of extended-release niacin/laropiprant fixed combination in the treatment of mixed dyslipidemia and primary hypercholesterolemia. Vasc Health Risk Manag 2009; 5 : 901–908.
51. Barber MJ, Mangravite LM, Hyde CL, Chasman DI, Smith JD, McCarty CA et al. Genome-wide association of lipid-lowering response to statins in combined study population. PLoS One 2010; 5(3): e9763.
52. Mangravite LM, Wilke RA, Zhang J, Krauss RM. Pharmacogenomics of statin response. Curr Opin Mol Ther 2008; 10(6): 555–561.
53. Fuentes B, Martinez-Sánchez P, Diéz-Tejedor E. Lipid-lowering drugs in ischemic stroke prevention and their influence on acute stroke outcome. Cerebrovasc Dis 2009; 27 (Suppl 1): 126–133.
54. Lardizabal JA, Deedwania PC. Benefits of statin therapy and compliance in high risk cardiovasular patients. Vask Health Risk Manag 2010; 6 : 843–53.
55. Brychta T. Kam kráčíte, glitazony? Remedia 2008; 18(4): 287–292.
56. Dormandy JA, Charbonnel B, Eckland D, Erdman E, Massi-Benedetti M, Moules IK et al. Secondary prevention of macrovascular events in patiens 2 diabetes in the PROactive Study (PROspective pioglitAzone Trial In macroVascular Events): a randomised controlled trial. Lancet 2005; 366(9493): 1279–1289.
57. Koblihová H, Kvapil M. Studie RECORD. Hodnocení vlivu rosiglitazonu na výskyt kardiovaskulárních příhod. Remedia 2009; 19(4): 288–289.
58. Home PD, Pocock SJ, Beck-Nielsen H, Curtis PS, Gomis R, Hanefeld M et al. Rosigitazone evaluated for cardiovascular outcomes in oral agent combination therapy for type 2 diabetes (RECORD): a multicentre, randomised, open-label trial. Lancet 2009; 373(9681): 2125–2135.
59. Holman RR, Paul SK, Bethel MA, Matthews DR, Neil HA. 10-year follow-up of intensit glukose control in type 2 diabetes. N Engl J Med 2008; 359(15): 1577–1589.
60. Szabó M. Studie ADVANCE – větev intervence hyperglykémie. Remedia 2008; 18(4): 310–312.
61. Buse JB, Bigger JT, Byington RP, Cooper LS, Cushman WC, Friedewald WT et al. The Action to Control Cardiovascular Risk in Diabetes (ACCORD) trial: design and methods. Am J Cardiol 2007; 99 (Supp12A): 21i–33i.
62. Siegel D, Swislocki AL. The ACCORD Study: The Devil is in the Details. Metab Syndr Relat Disord 2011; 9(2): 81–84.
63. Mitka M. Contradictory findings ignite questions about blood glucuse target in diabetes. JAMA 2008; 299(12): 1413–1415.
64. Fruchart JC, Sacks FM, Herrmans MP. Implication of the ACCORD lipid study: perspective from the residual risk reduction initiative. Curr Med Res Opin 2010; 26(8): 1793–7.
65. Tenenbaum A, Fisman EZ. “If it ain‘ t broke, don‘ t fix it”: a commentary on the positive-negative results of the ACCORD Lipid study. Cardiovasc Diabetol 2010; 15 : 9–24.
66. Duckworth W, Abraira C, Moritz T, Reda D, Emanuele N, Reaven PD et al. Glucose control and vascular complications in veterans with type 2 diabetes. N Engl J Med 2009; 360(2): 129–139.
67. Gerstein HC, Miller ME, Byington RP, Goff DC, Bigger JT, Buse JB et al. Effects of intensive glucose lowering in type 2 diabetes. N Engl J Med 2008; 358(24): 2545–2559.
68. Ford ES, Bergmann MM, Kröger J, Schienkiewitz A, Weikert C, Boeing H. Healthy living is the best revenge: findings from the European Prospective Investigation Into Cancer and Nutrition-Potsdam study. Arch Intern Med 2009; 169(15): 1355–1362.
69. Amarenco P, Bogousslavsky J, Caplan LR, Donnan GA, Hennerici MG. Classification of stroke subtypes. Cerebrovasc Dis 2009; 27(5): 493–501.
70. Kalita Z. Epidemiologie cévních mozkových příhod a dělení. In: Kalita Z et al (eds). Akutní cévní mozkové příhody. Maxdorf 2006 : 16–35.
71. Amarenco P, Bogousslavsky J, Caplan LR, Donnan GA, Hennerici MG. New approach to stroke subtyping: The A-S-C-O (Phenotypic) classification of stroke. Cerebrovasc Dis 2009; 27(5): 502–508.
72. Jennings LK. Mechanisms of platelet activation: need for new strategies to protect against platelet-mediated atherothrombosis. Tromb Haemost 2009; 102(2): 248–257.
73. Kalita Z, Keller O, Bar M, Mikulík R, Škoda O, Neumann J. Doporučený postup sekundární prevence recidivy po akutní cévní mozkové příhodě: mozkovém infarktu/tranzitorní ischemické atace a hemoragické cévní mozkové příhodě. Cesk Slov Neurol N 2008; 71/104(3): 372–378.
74. Kalita Z. Acetylsalicylová kyselina a její význam v léčbě a prevenci ischemické cévní mozkové příhody. Cesk Slov Neurol N 2004; 67/100(3): 149–156.
75. Kalita Z. Sekundární medikamentózní prevence. In: Kalita Z et al (eds). Akutní cévní mozkové příhody. Praha: Maxdorf 2006 : 337–368.
76. Verro P, Gorelick PB, Nguyen D. Aspirin plus dipyridamole versus aspirin for prevention of vascular events after stroke or TIA. A meta-analysis. Stroke 2008; 39(4): 1358–1363.
77. ESPRIT Study Group, Halkes PH, van Gijn J, Kappelle LJ, Koudstaal PJ, Algra A. Aspirin plus dipyridamole versus aspirin alone after cerebral ischaemia of arterial origin (ESPRIT): randomised controlled trial. Lancet 2006; 367(9558): 1665–1673.
78. Sacco RL, Diener HC, Yusuf S, Cotton DPD, Ounpuu S, Lawton WA et al. Aspirin and extended-release dipyridamole versus clopidogrel for recurrent stroke. N Engl J Med 2008; 359(12): 1238–1251.
79. Kalita Z. Clopidogrel v neurologii. Farmakoterapie 2006, 4 : 364–368.
80. Rude MK, Chey WD. Proton-pump inhibitors, clopidogrel, and cardiovascular adverse events: fact, fiction, or something in between? Gastroenterology 2009; 137(3): 1168–1171.
81. Simon T, Verstuyft C, Mary-Krause M, Quteineh L, Drouet E, Ménevea N et al. Genetic determinants of response to clopidogrel and cardiovascular events. N Engl J Med 2009; 360(4): 363–375.
82. Shuldiner AR, O´Connell JR, Bliden KP, Gandhi A, Ryan K, Horenstein RB et al. Association of cytochrome P450 2C19 genotype with antiplatelet effect and clinical efficasy of clopidogrel therapy. JAMA 2009; 302(8): 849–857.
83. Mega JL, Close SL, Wiviott SD. Shen L, Hockett RD, Brandt JT et al. Cytochrome P-450 polymorphismus and response to clopidogrel. N Engl J Med 2009; 360(4): 354–362.
84. Society for Cardiovascular Angiography and Interventions; Society of Thoracic Surgeons; Writing Committee Members, Holmes DR jr, Dehmer GJ, Kaul S, Leifer D, O‘Gara PT, Stein CM. ACC/AHA Clopidogrel clinical alert: Approaches to the FDA “boxed warning”. Circulation 2010; 122(5): 537–557.
85. O’Donoghue ML, Braunwald E, Antman EM, Murphy SA,Bates E, Rozenman Y et al. Pharmacodynamic effect and clinical efficacy of clopidogrel and prasugrel with or without a proton-pump inhibitor: an analysis of two randomized trials. Lancet 2009; 374(9694): 989–997.
86. Gilard M, Arnaud B, Cornily JC, Le Gal G, Lacut K, LeCalvez G et al. Influence of omeprazole on antiplatelet action of clopidogrel associated with aspirin: the randomized, double-blind OCLA (Omeprazole clopidogrel Aspirin) study. J Am Coll Cardiol 2008; 51(3): 256–260.
87. Cuisset T, Frero C, Quilici J, Poyet R, Gaborit B, Bali L et al. Comparison of omeprazole and pantoprazole influence on high 150 mg clopidogrele maintance dose the PACA (Proton Pump Inhibitors And Clopidogrel Association) prospective randomized study. J Am Coll Cardiol 2009; 54(13): 1149–53.
88. Ho PM, Maddox TM, Wang L, Fihn SD, Jesse RL, Peterson ED, Romsfeld JS. Risk of adverse outcomes assotiated with concomitant use of clopidogrel and proton pump inhibitors folowing acute coronary syndrome. JAMA 2009; 301(9): 973–44.
89. Neubauer H, Gunesdogan B, Hanefeld C, Spiecker M, Mugge A. Lipophilic statins interfere with the inhibitory effects of clopidogrel on platelet function – a flow cytometry study. Eur Heart J 2003; 24(19): 1744–1749.
90. Weinberger J. Adverse effects and drug interactions of antithrombotic agents used in prevention of ischaemic stroke. Drug 2005; 65(4): 461–471.
91. Clarke TA, Waskell LS. The metabolism of clopidogrel is catalyzed by human cytochrome P450 3A and is inhibited by atorvastatin. Drug Metab Dispos 2003; 31(1): 53–59.
92. Nguyen TA, Diodati JG. Resistance to clopidogrel: a review of evidence. J Am Coll Cardiol 2005; 45(8): 1157–1164.
93. Wiviott SD, Antman EM. Clopidogrel resistence: a new chapter in fast-moving story. Circulation 2004; 109(25): 3064–3067.
94. Shehab N, Sperling LS, Kegler SR, Budnitz DS. National estimates of emergency department visits for hemorrhage-related averse events from clopidogrel plus aspirin and from warfarin. Arch Intern Med 2010; 170(21): 1926–1933.
95. Connolly S, Pogue J, Hart R, Pfeffer M, Hohnloser S, Chrolavicius S et al. Clopidogrel plus aspirin versus oral anticoagulation for atrial fibrillation in the Atrial fibrillation Clopidogrel Trial with Irbesartan for prevention of Vascular Events (ACTIVE W): a randomised controlled trial. Lancet 2006; 367(9526): 1903–1912.
96. Barker CM, Murray SS, Teirstein PS, Kandzari DE, Topol EJ, Price MJ et al. Pilot study of antiplatelet effect in increased clopidogrel maintance dosing and its relationship to CYP2C19 genotype in patiens with high on-treatment reaktivity. JACC Cardiovasc Interv 2010; 3(10): 1001–1007.
97. Leys D, Balucani C, Cordonnier Ch. Antiplatelet drugs for ischemic stroke prevention. Cerebrovasc Dis 2009; 27 (Suppl 1): 120–125.
98. O’Donnell MJ, Hankey GJ, Eikelboom JW. Antiplatelet therapy for secondary prevention of noncardioembolic ischemic stroke. A critical review. Stroke 2008; 39(5): 1638–1646.
99. Mehta SR, Tanguay JF, Eikelboom JW, Jolly SS, Joyner CD, Granger CB et al. Double-dose versus standard-dose clopidogrel and high-dose versus low-dose aspirin in individuals undergoing percutaneous coronary intervention for acute coronary syndromes (CURRENT-OASIS 7): a randomised factorial trial. Lancet 2010; 376(9748): 1233–1243.
100. Price MJ, Berger PB, Angiolillo DJ, Teirstein PS, Tanguay JF, Kandzari DE et al. Evaluation of individual clopidogrel therapy after drug-eluting stent implantation in patiens with high residual platelet reaktivity: design and rationale of the GRAVITAS trial. Am Heart J 2009; 157(5): 814–824.
101. Horowitz JD, Rosenson RS, McMurray JJ, Marx N, Remme WJ. Clinical trials update AHA congress 2010. Cardiovasc Drugs Ther 2011; 25(1): 69–76.
102. Kent DM, Thaler DE. Stroke prevention – insights from incoherence. N Engl J Med 2008; 359(12): 1287–1289.
103. Murdoch D, Plosker GL. Triflusal: a review of its use in cerebral infarction and myocardial infarction, and as thromboprophylaxis in atrial fibrillation. Drug 2006; 66(5): 671–692.
104. Alvarez-Sabín J, Penalba A, Quintana M, Krupinski J, Garcia-Bonilla L, Montaner J. Triflusal and aspirin have different effects on inflammatory biomarkers measured in patiens with acute ischemic stroke. Cerebrovasc Dis 2009; 28(4): 371–377.
105. Lee YS, Bae HJ, Lee SH, Rha JH, Lee SJ, Lee JH et al. Cilostazol in acute ischemic stroke treatment (CAIST). Cerebrovasc Dis 2009; 27 (Suppl 6): 81.
106. Shinohara Y, Gotoh F, Tohgi H, Hirai S, Terashi A, Fukuuchi Y et al. Antiplatelet cilostazol is beneficial in diabetic and/or hypertensive ischemic stroke patients. Subgroup analysis of the cilostazol stroke prevention study. Cerebrovasc Dis 2008; 26(1): 63–70.
107. Kwon SU, Cho YJ, Koo JS, Bae HJ, Lee YS, Hong KS et al. Cilostazol prevents the progression of symptomatic intracranial arterial stenosis. The multicenter double-blind placebo-controlled trial of cilostazol in symptomatic intracranial arterial stenosis. Stroke 2005; 36(4): 782–786.
108. Matsumoto M. Cilostazol in secondary prevention of stroke: impact of Cilostazol Stroke Prevention Study. Atherosclerosis Suppl 2005; 6(4): 33–40.
109. Shinohara Y, Katayama Y, Uchiyama S, Yamaguchi T, Handa S, Matsuoka K et al. Cilostazol for prevention of secondary stroke (CSPS 2) an aspirin-controlled, double-blind, randomised non-inferiority trial. Lancet Neurol 2010; 9(10): 959–968.
110. Huang Y, Wu J, Li Y, Xu E, Hong Z, Li Z et al. Cilostazol as an alternative to aspirin after ischaemic stroke: a randomised, double-blind, pilot study. Lancet Neurol 2008; 7(6): 494–499.
111. Husted S, Emanuelsson H, Heptinstall S, Sandset PM, Wickens M, Peters G. Pharmacodynamics, pharmacokinetics, and safety of the oral reversible P2Y12 antagonist AZD6140 with aspirin in patiens with atherosclerosis: a double-blind comparison to clopidogrel with aspirin. Eur Heart J 2006; 27(9): 1038–1047.
112. Kowalczyk M, Banach M, Mikhailidis DP, Hannam S, Rysz J. Ticagrelor – a new platelet aggregation inhibitor in patients with acute coronary syndromes. An improvement of other inhibitors? Med Sci Monit 2009; 15(12): MS24–MS30.
113. Husted S, van Giezen JJ. Ticagrelor: the first reversibly binding oral P2Y12 receptor antagonist. Cardiovasc Ther 2009; 27(4): 259–274.
114. Storey RF, Husted S, Harrington RA, Heptinstall S, Wilcox RG, Peters G et al. Inhibition of platelet aggregation by AZD6140, a reversible oral P2Y12 receptor antagonist, compared with clopidogrel in patiens with acute coronary syndromes. J Am Coll Cardiol 2007; 50(19): 1852–1856.
115. Cannon CP, Husted S, Harrington RA, Scirica BM, Emanuelsson H, Peters G et al. Safety, tolerability, and initial efficacy od AZD6140, the first reversible oral adenosine diphosphate receptor antagonist, comprated with clopidogrel, in patiens with non-ST-segment elevation acute coronary syndrome. J Am Coll Cardiol 2007; 50(19): 1844–1851.
116. Wallentin L, Becker RC, Budaj A, Cannon CP, Emanuelsson H, Held C et al. Ticagrelor versus clopidogrel in patiens with acute coronary syndromes. N Engl J Med 2009; 361(11): 1045–1057.
117. Storey RF, Angiolillo DJ, Patil SD, Desai B, Ecob R, Husted S et al. Inhibitory effects of ticagrelor compared with clopidogrel on platelet fuction in patiens with acute coronary syndromes. The PLATO (PLATelet inhibition and patient Outcomes) PLATELET substudy. J Am Coll Cardiol 2010; 56(18): 1456–1462.
118. Gurbel PA, Bliden KP, Butler K, Antonino MJ, Wei V, Teng R et al. Response to ticagrelor in clopidogrel nonresponders and responders and effect of switching therapies: The RESPOND study. Circulation 2010; 121(10): 1188–1199.
119. Niitsu Y, Jakubowski JA, Sugidachi A, Asai F. Pharmacology of CS-747 (prasugrel, LY640315), a novel, potent antiplatelet agent with in vivo P2Y12 receptor antagonist activity. Semin Thromb Hemost 2005; 31(2): 184–194.
120. Wiviott SD, Braunwald E, McCabe CH, Horvath I, Keltai M, Herrman JP et al. Intensive oral antiplatelet therapy for reduction of ischaemic events including stent thrombosis in patiens with acute coronary syndromes treated with percutaneous coronary intervention and stenting in the TRITON-TIMI 38 trial: a subanalysis of a randomised trial. Lancet 2008; 371(9621): 1353–1363.
121. Wiviott SD, Braunwald E, McCabe CH, Montalescot G, Ruzyllo S, Gottlieb S et al. Prasugrel versus clopidogrel in patiens with acute coronary syndromes. N Engl J Med 2007; 357(20): 2001–2015.
122. Wiviott SD, Antman EM, Braunwald E. Prasugrel. Circulation 2010; 122(4): 394–403.
123. Biondi-Zoccai G, Lotrionte M, Agostoni P, Abbate A, Romagnoli E, Sangiorgi G et al. Adjusted inderect comprarison meta-analysis of prasugrel versus ticagrelor for parients with acute coronary syndromes. Int J Cardiol. In press 2010.
124. Gurbel PA, Bliden KP, Butler K, Tantry US, Gesheff T, Wei C et al. Randomized double-blind assessment of the ONSET an OFFSET of antiplatelet effects of ticagrelor versus clopidogrel in patiens with stable coronary artery disease. On ONSET/OFFSET study. Circulation 2009; 120(25): 2577–2585.
125. Ferreiro JL, Ueno M, Angiolillo DJ. Cangrelor: a review on its mechanism of action and clinical development. Expert Rev Cardiovasc Ther 2009; 7(10): 1195–1201.
126. Norgard NB. Cangrelor: a novel P2Y12 receptor antagonist. Expert Opin Investig Drugs 2009; 18(8): 1219–1230.
127. Šimek S. Studie CHAMPION PLATFORM. Interv Akut Kardiol 2010; 9(3): 158–159.
128. Oestreich JH. Elinogrel, a reversible P2Y12 receptor antagonist for the treatment of acute coronary syndroma and prevention of secondary thrombotic events. Curr Opin Investig Drugs 2010; 11(3): 340–348.
129. Ueno M, Rao SV, Angiolillo DJ. Elinogrel: pharmacological principles, preclinical and early phase clinical testing. Future Cardiol 2010; 6(4): 445–453.
130. Bousser MG, Amarenco P, Chamorro A, Fisher M, Ford I, Fox K et al, PERFORM study investigators. The prevention of cerebrovascular and cardiovascular events of ischemic origin with terutroban in patients with history of ischemic stroke or transient ischemic attack (PERFORM study): baseline characteristics of the population. Cerebrovasc Dis 2009; 27(6): 608–613.
131. Gaussem P, Reny JL, Thalamas C, Chatelain N, Kroumova M, Jude B et al. The specific thromboxane receptor antagonist S18886: pharmacokinetic and pharmacodynamic studies. J Thromb Haemost 2005; 3(7): 1437–1345.
132. Breyer RM, Bagdassarian CK, Myers SA, Beryer MD. Prostanoid receptors: subtypes and signaling. Ann Rev Pharmacol Toxicol 2001; 41 : 661–690.
133. Cayatte AJ, Du Y, Oliver-Krasinski J, Lavielle G, Verbeuer TJ, Cohen RA. The tromboxane receptor antagonist S18886 but not aspirin inhibic atherogenesis in apo E-deficient mice: evidence that eicosanoids other than thromboxane contribute to atherosclerosis. Arterioscler Thromb Vasc Biol 2000; 20(7): 1724–1728.
134. Worth NF, Berry CL, Thomas AC, Campbell JH. S 18886, a selective TP receptor antagonist, inhibic development of atherosclerosis in rabbits. Atherosclerosis 2005; 183(1): 65–73.
135. Tolentino AR, Bahou WF. Trombin receptors. In: Michelson AD (ed). Platelets. San Diego: Elsevier Sci 2002 : 117–138.
136. Doc ID 3302825. Investigator’s brochure: informatik for the investigational product SCH 530348 bisulfate. Kenilworth (NJ): Schering-Plough Research Institute 2007.
137. Trumel C, Payrastre B, Plantavid M, Hechler B, Viala C et al. A key role of adenosine diphosphate in irreversible platele aggregation induced by the PAR 1-activating peptide through the late activation of phosphoinositide 3-kinase. Blood 1999; 94(12): 4156–4165.
138. Becker RC, Moliterno DJ, Jennings LK, Pieper KS, Pei J, Niederman A et al. Safety and tolerability of SCH 530348 in patiens undergoing non-urgent percutaneous coronary intervention: a randomised, double-blind, placebo-controlled phase II study. Lancet 2009; 373(9667): 919–928.
139. Bauer J. Antikoagulační terapie v prevenci a léčbě ischemických iktů. Cesk Slov Neurol N 2010; 73/106(5): 480–491.
140. Fruchart JC, Sacks F, Hermans MP, Assmann G, Brown WV, Ceska R et al. The residual risk reduction initiative: a call to action to reduce residual vascular risk in patients with dyslipidemia. Am J Cardiol 2008; 102 (Suppl 10): 1K–34K.
141. Ford ES, Bergmann MM, Kröger J, Schienkiewitz A, Weikert C, Boeing H. Healthy living is the best revenge: findings from the European Prospective Investigation Into Cancer and Nutrition-Potsdam Study. Arch Intern Med 2009; 169(15): 1355–1362.
142. Haynes RB, Ackloo E, Sahota N, McDonald HP, Yao X. Intervention for enhacing medication adherence. Cochrane Database Syst Rev 2008; 2: CD000011.
143. Rájec J, Kriška M, Bublová A. Hodnotenie compliance u pacientov v rámci aspirínovej prevencie. Klin Farmakol Farm 2008; 22(1): 15–17.
144. Cooper C, Carpenter I, Katona C, Schroll M, Wagner C, Fialova D, Livingston G. The AdHOC study of older adults’ adherence to medicatio countries. Am J Geriatr Psychiatry 2005; 13(12): 1067–1076.
145. Vytřísalová M. Adherence k medikamentózní léčbě – známá neznámá. Remedia 2009; 19(3): 225–230.
146. Kriška M, Rájec J, Kriška J, Dukát A, Ambrózy E, Gajdošík J. Percepcia rizika pri antiagregačnej preventívnej terapii. Klin Farmakol Farm 2008; 22(1): 11–14.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článek Léčba adenomů hypofýzyČlánek Vplyv chirurgickej liečby na prognózu dospelých pacientov so supratentoriálnymi low-grade gliómamiČlánek Profit pacientů ze stanovení cerebrovaskulární rezervní kapacity pomocí SPECT mozku a hyperkapnieČlánek Webové okénko
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2011 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- CIDP: epidemiológia, klinický obraz a diagnostika v kocke
-
Všetky články tohto čísla
- Léčba adenomů hypofýzy
- Kognitivní funkce při onemocnění vnitřní krkavice a vliv léčebných intervencí
- Farmakologická sekundární prevence nekardioembolického mozkového infarktu/tranzitorní ischemické ataky – současnost a budoucnost
- Vplyv chirurgickej liečby na prognózu dospelých pacientov so supratentoriálnymi low-grade gliómami
- Pacient ve vegetativním stavu a jeho rehabilitace
- Hypothalamo-hypofyzární dysfunkce po kraniocerebrálních traumatech a po spontánním subarachnoidálním krvácení
- Vliv funkčního mapování na výsledky operací nízkostupňových gliomů WHO grade II
- Profit pacientů ze stanovení cerebrovaskulární rezervní kapacity pomocí SPECT mozku a hyperkapnie
- Stereotaktické ozáření nízkostupňových gliomů na Leksellově gama noži
- Peroperační měření průtoku likvoru pomocí ultrazvuku při dekompresi cervikokraniálního přechodu u Chiariho malformace typu I
- Peroperační monitoring aktivovaného koagulačního času při karotické endarterektomii
- Lehké mozkové poranění – intrakraniální komplikace a indikační kritéria pro CT vyšetření
- Limbická encefalitida – dvě kazuistiky
- Difuzně vážený obraz a možnost predikce vývoje mozkové žilní trombózy na magnetické rezonanci – dvě kazuistiky
- Jednostranné intravitreální krvácení po předávkování metamfetaminem (pervitinem): varianta Tersonova syndromu u 16letého narkomana – kazuistika
- Uzávěr bazilární tepny disekcí v souvislosti s manipulací krční páteře – kazuistika
- Organizovaný chronický subdurální hematom – kazuistiky
- Chronická žilní cerebrospinální insuficience u roztroušené sklerózy – staronový koncept, nové otázky?
- Webové okénko
-
Analýza dat v neurologii.
XXVII. Hodnocení diagnostických testů – vliv prevalence nemoci - VII. olomoucký workshop cévní neurologie 11. neurosonologické dny – „Pokroky v neurosonologii“
- 15. Jedličkovy neuroimunologické a likvorologické dny
- Atypical Parkinsonian Syndromes – an International Symposium on Neurodegenerative Diseases
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Léčba adenomů hypofýzy
- Limbická encefalitida – dvě kazuistiky
- Pacient ve vegetativním stavu a jeho rehabilitace
- Lehké mozkové poranění – intrakraniální komplikace a indikační kritéria pro CT vyšetření
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



