-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Stereotaktické ozáření nízkostupňových gliomů na Leksellově gama noži
Stereotactic Irradiation of Low-grade Glioma Using a Leksell Gamma Knife
Objective:
To evaluate treatment results, radiation-related toxicity and prognostic factors for progression free survival (PFS) in patients with low-grade glioma irradiated by Leksell Gamma Knife.Materials and methods:
A total of 88 patients underwent hypofractionated stereotactic irradiation to treat low-grade glioma. The median minimum applied dose to the planning target volume (PTV) was 25 Gy (12–35). The dosage was prescribed with respect to the several conditions: number of fractions, previous irradiation, planning target volume and age. The radiation toxicity and severity of symptoms (neurological functional class [NFC]) were evaluated according to the RTOG/EORTC system. We analyzed variables affecting progression-free survival (PFS) after treatment and radiation-induced late toxicity (grade, age, volume, biologically effective dose, previous radiotherapy, NFC score before treatment). We used univariate analysis (Kaplan-Meier with log-rank test) and multivariate analysis (Cox regression) to detect differences in survival curves, as well as correlation analysis to detect variables associated with toxicity.Results:
10-year PFS was 78%. As expected, we found a greater surviving proportion among grade I patients, (91% surviving at 5 years, 88% at 10 years) than grade II patients (79% surviving at 5 years, 67% at 10 years), p = 0.010 log-rank, p = 0.025 Cox. Among the other variables we detected as significant positive prognostic factors: age < 30 years (p = 0.044 log-rank), BED 85–110 Gy, which is an intermediate category, (p = 0.019 log-rank), and not previously irradiated (p = 0.032 log-rank, p = 0.075 Cox). In our group of patients we observed grade 3 late toxicity in 10% of cases. Among the variables analyzed we found none associated with incidence of toxicity.Conclusion:
Radiosurgery is a treatment modality for small residual or reoccurrence volumes of low-grade glioma with relatively long-term local control.Key words:
glioma – Leksell gamma knife – prognosis
Autoři: G. Šimonová 1; J. Šemnická 2; R. Liščák 1
Působiště autorů: Nemocnice Na Homolce, Praha Odd. stereotaktické a radiační neurochirurgie 1; Nemocnice Na Homolce, Praha Odd. lékařské fyziky 2
Vyšlo v časopise: Cesk Slov Neurol N 2011; 74/107(3): 312-319
Kategorie: Původní práce
Souhrn
Cíl:
Hodnocení léčebných výsledků, radiační toxicity a prognostických faktorů ovlivňujících délku přežití bez progrese u pacientů s nízkostupňovými gliomy ozářených na gama noži.Soubor a metodika:
Celkově 88 pacientů jsme ozářili na gama noži hypofrakcionačním režimem. Medián minimální aplikované dávky do plánovacího cílového objemu byl 25 Gy (12–35). Předepsaná minimální dávka byla zohledněna následujícími faktory: počtem frakcí, předchozí radioterapií, plánovacím cílovým objemem (PTV) a věkem. Radiační toxicita a závažnost příznaků (neurological functional class, NFC) byla hodnocena systémem RTOG/EORTC. Ve skupině pacientů jsme sledovali několik faktorů ovlivňujících přežití bez progrese (PFS) po léčbě a radiační toxicitu (stupeň nádoru, věk, objem, biologicky efektivní dávku, předchozí radioterapie, závažnost neurologických příznaků před ozářením). Užili jsme univariační (Kaplan-Meier s Log-rank testem) a multivariační analýzu (Coxovu regresi) k detekci rozdílů v křivkách přežití a k detekci faktorů spojených s toxicitou.Výsledky:
Desetileté přežití bez progrese bylo zaznamenáno u 78 % pacientů. Dle očekávání jsme detekovali vyšší procento déle přežívajících bez progrese u pacientů s histopatologickým stupněm I (5leté přežití 91 %, 10leté přežití 88 %) než u pacientů s histopatologickým stupňem II (5leté přežití 79 %, 10leté 67 %); p = 0,010 Log-rank; p = 0,025 Cox). Ze zmíněných faktorů byly jako příznivé detekovány: věk < 30 let (p = 0,044 Log-rank), BED 85–110 Gy, tj. prostřední kategorie (p = 0,019 Log-rank), bez předchozího ozáření (p = 0,032 Log-rank; p = 0,075 Cox). Ve skupině jsme zaznamenali toxicitu stupeň 3 u 10 % případů. Z analyzovaných faktorů nebyl ve vztahu ke komplikacím žádný statisticky signifikantní.Závěry:
Ozáření na gama noži může být léčbou pro objemově vhodné recidivy či rezidua nízkostupňových gliomů s relativně dlouhodobým příznivým léčebným efektem.Klíčová slova:
gliom – Leksellův gama nůž – prognózaÚvod
Nízkostupňové gliomy (LGG) jsou relativně pomalu rostoucí primární mozkové nádory, které představují zhruba 10 % ze všech primárních mozkových nádorů, medián věku v čase diagnózy je okolo 40 let pro dospělé. U dětí a mladých jedinců převažují pilocytární astrocytomy, jejich objemy jsou dobře definovatelné a prakticky nevykazují infiltrativní růst za zobrazitelné hranice nádor-zdravá tkáň, lokalizovány jsou nejčastěji v zadní jámě lební. Neurologické příznaky jsou velmi rozmanité: od pacientů bez příznaků (náhodné nálezy) po projevy epileptické až k funkčně významným deficitům. K maligní transformaci dochází až u 70–80 % nemocných. Neurochirurgická resekce je metoda první volby, radioterapie je indikována jako adjuvantní léčba po operaci (neradikální výkony) a dále v době progrese, většinou spojené již s vyšším stupněm malignity. Radioterapie dle dostupných studií neprodlužuje celkové přežití, u ozářených nemocných je však signifikantně delší přežití bez progrese (EORTC) [2–4]. Co se týče dávky ze zevní frakcionované radioterapie studie EORTC 22844 a North Central Cancer Treatment Group (NCCTG) s RTOG a Eastern Cooperative Oncology Group (ECOG), neprokázala profit z eskalace dávky, doporučená je tedy aplikace dávky v rozmezí 45–54 Gy. Dle proběhlých studií se pětileté celkové přežití pohybuje okolo 60–70 %, zatímco přežití bez progrese (PFS) v rozmezí 40–50 % [1–5].
Podle těchto studií se za prognosticky příznivé považují následující faktory: věk pod 40 let, nádor menší než 6 cm a nepřekračující střední čáru a dále minimální neurologická symptomatika. Dle EORTC 22845 studie časná radioterapie prodlužuje délku přežití bez progrese (PFS), u části nemocných příznivě ovlivňuje sekundární epilepsii, ale neovlivňuje celkové přežití nemocných. Dalším objektem zájmu bylo zhodnocení výsledků pouze sledovaných nemocných (s dobrými prognostickými faktory – věk pod 40 let a radikální resekce nádoru), studie RTOG 98-02 prokázala celkové pětileté přežití 94 %, PFS však pouze 50 % [1–5]. Další výzkum se soustředil na hodnocení kvality života po radioterapii, přínos chemoterapie u LGG a prognostický význam pro PFS delece chromozomu 1p a 19q. Rychlý rozvoj zobrazovacích metod společně s rozvojem konformní radioterapie včetně stereotaktické radioterapie a radiochirurgie v posledních zhruba 15 letech umožňuje aplikovat vyšší dávky do cílových objemů s významně nižší zátěží pro okolní kritické struktury [6–10]. Cílem naší práce bylo zhodnocení léčebných výsledků pacientů léčených na gama noži pro nízkostupňové gliomy (histopatologický stupeň I a II).
Soubor a metodika
V průběhu 10 let bylo na našem oddělení stereotakticky ozářeno na gama noži 88 pacientů s nízkostupňovými gliomy. Tři pacienti byli ztraceni z následného sledování po 52, 60 a 63 měsících, nejkratší následné sledování bylo 91 měsíců pro žijící nemocné. Závažnost neurologické symptomatologie byla hodnocena RTOG systémem, RTOG systém jsme užili i k hodnocení postradiačních komplikací [11].
V souboru nemocných bylo 29 ozářeno zevní frakcionovanou radioterapií a předchozí neurochirurgická resekce byla u 43 pacientů (operováno bylo 23 nemocných s histopatologickým stupněm I a 20 se stupněm II), u 45 pacientů byla provedena stereotaktická biopsie k histologické verifikaci (22 nemocných se stupněm I a 23 s histopatologickým stupněm II). V souboru bylo 45 nemocných s pilocytárním astrocytomem (stupeň I) a 43 pacientů s verifikovaným fibrilárním astrocytomem (stupeň II). Medián věku nemocných v době léčby byl 16 let pro histologický stupeň I (3–62) a 27 let (3–54) pro stupeň II. Zastoupení nemocných podle věku dokumentuje graf 1.
Graf 1. Přežití bez progrese onemocnění – histologický stupeň. 
Prvním neurologickým příznakem u nemocných byla u 32 epilepsie, 27× bolest hlavy, 8× vertigo, 7× hemiparéza, 5× nauzea a zvracení, 5× psychosyndrom, 2× zrakové poruchy, 2× ataxie. U 35 nemocných byl nález lokalizován ve středních hlubokých partiích mozku (mozkový kmen, III. a IV. komora mozková, bazální ganglia).
Medián cílového objemu (PTV, planning target volume) byl 3 300 mm3 (205–25 000) pro stupeň I a 4 000 mm3 (360–18 300) pro stupeň II, medián minimální aplikované dávky byl pro obě skupiny identický – 25 Gy (rozmezí pro stupeň I: 14–30 Gy, pro stupeň II: 12–35). Frakcionační režim: 71 nemocných bylo ozářeno v 5denních frakcích, dva nemocní v 10denních frakcích, jeden pacient ve 2denních frakcích a 14 bylo ozářeno jednorázově. Frakcionační režim tedy nebyl zcela jednotný a pro následné hodnocení výsledků je tedy nutné zavést veličinu biologicky efektivní dávka (BED, biologically effective dose), která vztahuje účinek aplikované dávky a počet užitých frakcí. V praxi se užívá k porovnání efektů různých frakcionačních schémat vzorec:
d
BED = n × d (1+ ----- - ) [12]
α/βVe vzorci n vyjadřuje počet frakcí, d dávku aplikovanou v jedné frakci a poměr α/β charakterizuje tkáň a její odezvu na záření. Jak cílový objem, tak (kritické) okolní struktury jsou typické pozdně reagující tkáně, pro výpočet jsme tedy užili poměr α/β = 2 Gy [12,13]. Medián biologicky ekvivalentní dávky byl 93,6 Gy (37,5–220).
Všechny nemocné jsme pravidelně sledovali klinicky a magnetickou rezonancí (MR) jednou za rok po dobu pěti let, následně jednou za dva roky.
Statistická analýza
Cílem statistické analýzy byla identifikace prognostických faktorů pro přežití bez progrese onemocnění v naší skupině pacientů. Dále jsme si kladli za cíl identifikovat faktory, které ovlivňují výskyt pozdní toxicity.
K identifikaci prognostických faktorů jsme použili Kaplanovu-Meierovu analýzu přežití s Log-rank testem a Coxův regresní model. Sledované faktory jsme rozdělili na: a) předléčebné parametry – věk, histologický stupeň nádoru, stupeň závažnosti neurologických příznaků, předchozí radioterapie a b) faktory léčebné – objem PTV, minimální aplikovaná dávka. Za statisticky signifikantní byly považovány faktory s p ≤ 0,05 pro alespoň jednu uvedenou metodu.
Pro identifikaci faktorů ovlivňujících výskyt pozdní toxicity jsme použili Fisherův exaktní test, event. test chí-kvadrát. Pracovali jsme tedy s kategorizovanými proměnnými. Uvažovali jsme stejné faktory jako pro analýzu přežití.
Dále jsme provedli analýzu přežití pro relativně homogenní skupinu nemocných bez předchozí radioterapie a stereotakticky ozářených na gama noži v 5denních frakcích (celkem 48 nemocných), abychom lépe posoudili vliv jednotlivých faktorů, zvláště pak aplikované dávky.
Na závěr jsme na základě předchozí analýzy rozdělili pacienty na favorizované a nefavorizované z hlediska námi detekovaných příznivých prognostických faktorů a provedli výpočet Kaplanovy-Meierovy křivky přežití.
Veškeré statistické procedury jsme provedli v softwaru PASW Statistics v. 18 (SPSS Inc., USA).
Výsledky
1. Léčebný efekt
V první skupině 45 nemocných s verifikovaným pilocytárním astrocytomem jsme kompletní obrazovou regresi nebo parciální regresi na MR vyšetření prokázali u 38 (84 %) pacientů s mediánem do léčebné odpovědi za 24 měsíců. (Kompletní obrazová regrese byla dosažena u devíti nemocných, parciální u 29 pacientů – obr. 1 a 2). Ve sledovaném souboru došlo u tří (7 %) pacientů k progresi a malignímu zvratu nádoru (za 53, 60 a 100 měsíců po léčbě, u těchto nemocných došlo k výraznému zhoršení klinického stavu, společně s první zaznamenanou progresí na vyšetření magnetickou rezonancí a s nálezem hypermetabolizmu značené glukózy při vyšetření pozitronovou emisní tomografií), dva pacienti byli pro perzistenci nálezu operováni, u šesti nemocných došlo ke zvětšení cystické složky, z toho 4× zvětšení symptomatické (u dvou provedena stereopunkce), 2× operace (histologicky bez nálezu nádoru). Medián PFS byl v této skupině 130 měsíců (24–196).V této skupině bylo desetileté přežití bez progrese 88 %.
Obr. 1. Vlevo: 10letý pacient se stereobiopticky verifikovaným astrocytomem stupeň I, velikost nádorového objemu 1 500 mm<sup>3</sup>, minimální aplikovaná dávka 25 Gy v 5denních frakcích; vpravo: kontrolní vyšetření magnetickou rezonancí za čtyři roky, bez známek pozdní toxicity. 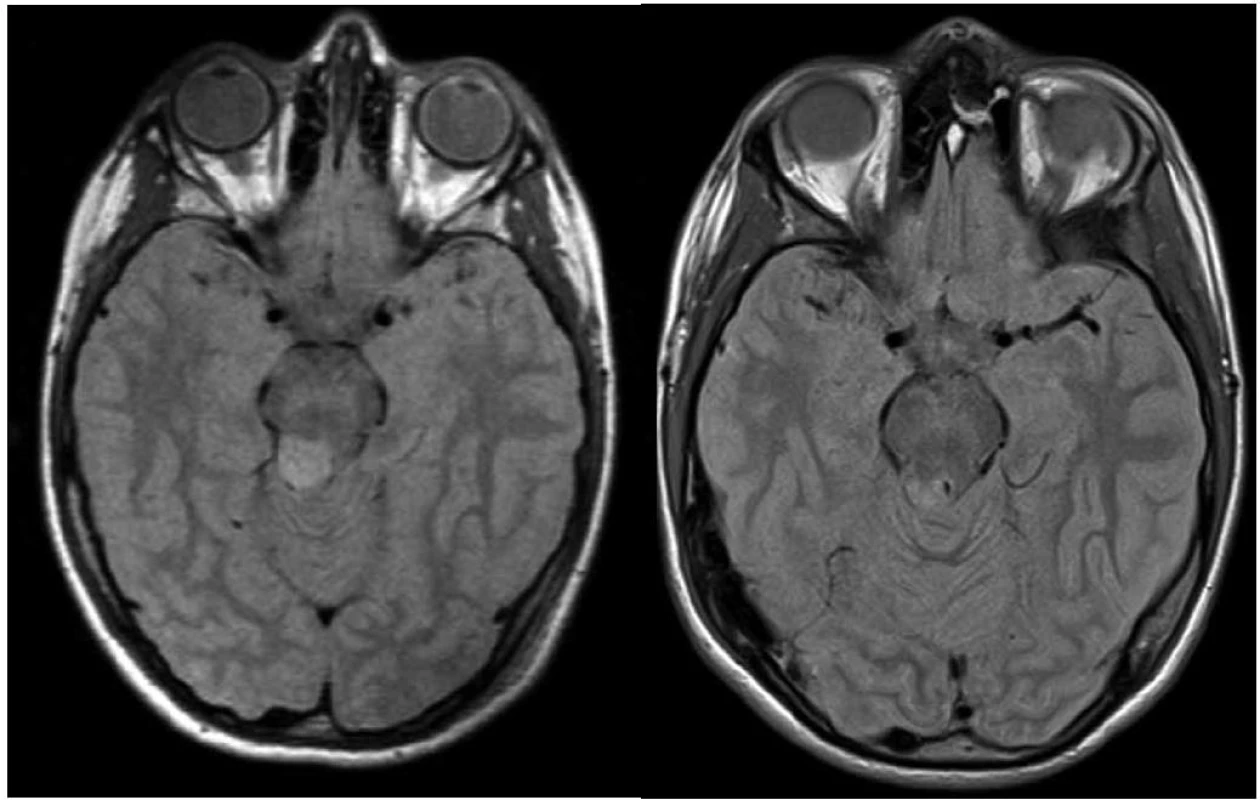
Obr. 2. Nahoře: 4letá pacientka, pooperační reziduum astrocytomu stupeň I, velikost nádorového objemu 8 700 mm<sup>3</sup>, minimální aplikovaná dávka 27 Gy v 5denních frakcích; dole: kontrolní vyšetření magnetickou rezonancí tři roky po léčbě, bez známek pozdní toxicity, přežití bez progrese 11 let. 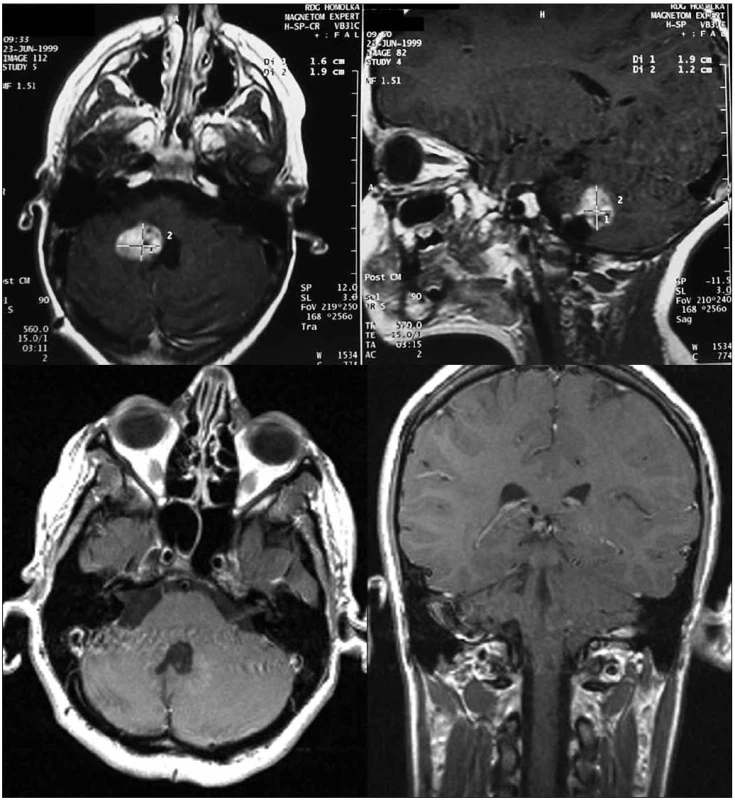
Ve druhé skupině 43 nemocných s fibrilárním astrocytomem jsme kompletní a parciální regresi zaznamenali u 31 (72 %) nemocných, 1× lokální recidiva po předchozí příznivé odpovědi, ve sledované skupině jsme progresi a maligní zvrat nádoru diagnostikovali častěji než u předchozí skupiny, objevila se u 13 (30 %) nemocných v rozmezí 38–102 měsíců po ozáření. Medián přežití bez progrese byl v této skupině nemocných 127 měsíců (12–199). Graf 1 dokumentuje křivky přežití bez progrese pro obě skupiny. Rozdíl mezi těmito dvěma křivkami je statisticky signifikantní (Log-rank p = 0,010; Cox p = 0,016). Desetileté přežití bez progrese pro druhou skupinu bylo 67 %.
2. Prognostické faktory
V celém souboru pacientů byly detekovány statisticky významné příznivé faktory:
- dle očekávání stupeň nádoru I (Log--rank p = 0,010; Cox p = 0,016)
- věk nemocných pod 30 let (Log-rank p = 0,044) – graf 2
- BED 85–110 Gy, což je střední kategorie (Log-rank p = 0,019) – graf 3
- bez předchozí zevní frakcionované radioterapie (Log-rank p=0,032; Cox hraničně p = 0,075) – graf 4.
Graf 2. Přežití bez progrese onemocnění – věk. 
Graf 3. Přežití bez progrese onemocnění – BED. 
Graf 4. Přežití bez progrese onemocnění – předchozí radioterapie. 
U skupiny 48 nemocných léčených 5denním hypofrakcionačním režimem bez předchozí radioterapie byla pro PFS signifikantní a příznivá dávka do 28 Gy (Log--rank p = 0,048; Cox p = 0,002) (graf 5). V této skupině pacientů se dále nepodařilo prokázat význam dalšího faktoru, a to ani histologického stupně. Vysvětlujeme si to tím, že pro zmenšený soubor byl k dispozici již jen malý počet událostí, který nepostačuje k prokázání významného rozdílu v PFS. Z těchto výsledků vyplývá, že nejvyšší dávky byly v našem souboru spojeny s kratším PFS.
Graf 5. Přežití bez progrese onemocnění – pět frakcí, bez radioterapie. 
Rozdílné křivky přežití 27 nemocných s pozitivními prognostickými faktory (věk pod 30 let, histologický stupeň I a bez předchozí radioterapie) a 61 pacienty bez všech pozitivních faktorů jsou patrné na grafu 6. Do skupiny příznivých prognostických faktorů jsme nezahrnuli BED, neboť by ve favorizované skupině zůstal malý počet pacientů (celkem 7).
Graf 6. Favorizovaná skupina: grade I, věk ≤ 30 let, bez předchozí radioterapie. 
3. Postradiační komplikace
Časná toxicita stupeň 2, 3 se objevila u pěti pacientů. U pozdních komplikací jsme nezaznamenali ani jeden případ jednoznačně verifikované postradiační nekrózy, ale u tří nemocných ve skupině I a rovněž tři nemocných ve skupině II došlo ke vzniku symptomatických pozdních cystických formací, celkem u dalších tří nemocných se objevila pozdní postradiační toxicita stupeň 3, která se vyžádala intenzivní antiedematózní terapii, nebo bylo nutné zavést či změnit antiepileptickou terapii, u dvou nemocných byl v postradiačním období neurochirurgem zaveden zkrat (ventrikulo-peritoneální) a dva byli operováni pro progredující cystické formace, bez histologického průkazu recidivy nádoru.
V souboru léčených nemocných jsme zaznamenali pozdní toxicitu stupeň 3 u 10 % nemocných, u osmi nemocných vznik cystických formací, z toho šest symptomatických. Žádný ze sledovaných faktorů nebyl statisticky významně asociován s výskytem pozdních komplikací.
Diskuze
Postradiační odpověď a komplikace
Hodnocení postradiačních komplikací je obtížné, neboť soubor není homogenní, část nemocných byla operována, u části nemocných předcházela zevní frakcionovaná radioterapie. Nelze tedy jednoznačně komplikace, eventuálně i úspěch léčby vztáhnout k ozáření na gama noži.
U dvou pacientů byla indikována (ne z našeho pracoviště) pro perzistenci nádoru na MR operace v průběhu roku a půl po ozáření, u obou nemocných byl prokázán nádor identický s předchozím histologickým vyšetřením.
U nemocných ve skupině I došlo k progresi cystické složky nádoru, u některých se v našem souboru (tři nemocní) objevila v průběhu následného sledování pozdní postradiační toxicita se vznikem „pozdní cystické léze“. V literatuře je tento pozdní postradiační efekt, pozorovaný po jednorázovém ozáření, nazýván „velmi pozdní cystické formace“. Dva nemocní byli operováni a recidiva nádoru u nich nebyla histologicky potvrzena, lze tedy uzavřít, že se jednalo o pozdní postradiační změny. U dalších tří nemocných jsme pozorovali zatím asymptomatické cysty. Podobné cystické formace jsme nalezli i ve skupině II u tří pacientů. Předpokládá se výrazná porucha hemato-encefalické bariéry zřejmě i se vznikem postradiační nekrózy, která ve fázi oddálených pozdních postradiačních změn přechází ve formu cyst s obsahem proteinů, s nestabilní stěnou, některé z nich v čase progredují (s doprovodnou edematózní reakcí, gliózou a demyelinizací) a způsobují neurologickou symptomatologii. Pouze ze zobrazovacího vyšetření nelze tedy usoudit, zda jde o progresi cystické složky nádoru nebo o vznik „postradiační cysty“. Patogeneze není zatím jednoznačně vysvětlena. Tyto cystické léze popsali Pollock, Hara, Yamamoto, Kim a Edmister u dlouhodobě žijících jednorázově stereotakticky ozářených pacientů s arterio-venózními malformacemi (AVM), symptomatické cysty se objevily v rozmezí 34–89 měsíců po ozáření na gama noži [14–18]. Kihlstrom et al popsali podobnou komplikaci 17 let po radiochirurgicky provedené kapsulotomii [18]. Protože se jedná o velmi pozdní postradiační změny, je incidence v souborech pacientů sledovaných 2–3 roky po léčbě AVM pouze 0,2–0,5 %; s prodloužením sledování na pět let stoupá incidence až k 7,9 % [16].
Za povšimnutí stojí, že tento pozdní postradiační efekt (i když dle našich znalostí nebyl dosud prokázán vztah k dávce) se objevuje po vyšších jednorázově aplikovaných dávkách a tedy u AVM a ve funkční radiochirurgii a v našem případě při léčbě gliomů [20]. Po stereotaktickém ozáření benigních nádorů (neurinomy, meningeomy), u kterých se aplikují dávky podstatně nižší, tato velmi pozdní postradiační změna zatím pozorována nebyla [20].
U pilocytárních astrocytomů je situace poněkud odlišná. Cysty jsou součástí vlastního nádoru, zároveň však můžeme předpokládat, že u části nemocných se může jednat o identický pozdní postradiační efekt, jako byl pozorován u AVM. Protože i tato skupina nemocných má vysoké procento dlouhodobého přežití, histologické nálezy rovněž chybí. Někteří autoři uvádějí převážně cystické tumory jako prognosticky nepříznivé a doporučují kombinované postupy se stereotaktickou aspirací cyst, intrakavitární brachyterapií a stereotaktickým ozářením solidních částí nádoru. V současné době tedy nejsme schopni jednoznačně odlišit (kromě operovaných nemocných) progresi cystické složky nádoru od velmi pozdních postradiačních změn ve smyslu vzniku cystických formací.
Prognostické faktory pro PFS
Naše analýza se soustředila na několik výše zmíněných faktorů. I v našem souboru (podobně jako prokázaly studie EORTC/RTOG) nebyla přínosná výrazná eskalace dávky. Nejefektivnější se ukázalo rozmezí aplikované biologicky ekvivalentní dávky BED 85–110 Gy. To patrně potvrzuje i zjištění u podskupiny pacientů léčených v pěti frakcích a bez předchozí radioterapie, u které jsme zjistili větší procento pacientů přežívajících bez progrese onemocnění s dávkou menší než 28 Gy (graf 5).
Dalším identickým pozitivním prognostickým faktorem byl histologický stupeň nádoru a nízký věk nemocných (v našem souboru pod 30 let). V našem souboru pacientů ovšem mladší pacienti převažovali ve skupině s histologickým stupněm I. Proto je poměrně složité odlišit vliv těchto dvou faktorů, což ukazuje i výsledek Coxovy regrese, kde se jednoznačně prokázal pouze vliv histologického stupně na PFS. Nicméně se domníváme, že v souladu s citovanými studiemi je možno nižší věk považovat za příznivý prognostický faktor.
Další známý prognostický faktor – objem nádoru – již v našem souboru nebyl signifikantní, což lze vysvětlit celkově malými cílovými objemy v době indikace ozáření na gama noži. Signifikantní ve studii RTOG byly rozdíly při maximálním průměru nádoru do 6 cm a více než 6 cm, medián průměru v našem hodnoceném souboru byl pro stupeň I 1,7 cm a u stupně II 1,9 cm.
Statisticky významné horší výsledky u nemocných s předchozí radioterapií prakticky potvrzuje známý fakt, že léčba recidiv nebo reziduí je vždy obtížnější, nádorová populace je do značné míry selektovaná předchozí léčbou, a tedy pravděpodobně rezistentnější vůči další radioterapii.
Na závěr radiobiologického bloku na 27. ESTRO konferenci v Göteborgu 2006 proběhlo zhodnocení prospektivních studií a jejich závěry, diskutováno bylo, co z nich víme a co pak skutečně v praxi provádíme. Pro nízkostupňové gliomy bylo opakovaně prokázáno, že radioterapie sice neovlivní celkové přežití, prodlužuje však přežití bez progrese. Přesto se v klinické praxi ne vždy indikuje. Další studie prokázala, že není přínosná eskalace dávky. Pro dlouhodobě příznivý lokální efekt je doporučená dávka v rozmezí 45–54 Gy (1,5–1,8 Gy/fr.), což vyjádřeno pomocí BED dává 78,75–102,6 Gy.
Vzhledem k tomu, že dnes máme k dispozici celou škálu konformních ozařovacích technik, které umožňují snížit zátěž zdravých struktur, a že si jsme vědomi prokázané velikosti účinné dávky (45–54 Gy frakcionovaně), je otázkou, proč je užití radioterapie u nízkostupňových gliomů nejednoznačné. Proběhlé klinické studie dětských pacientů s pilocytárními astrocytomy gr. I zaznamenaly celkové desetileté přežití 100 % u makroskopicky radikálně odstraněných gliomů gr. I [21,22]. Výsledky po neradikálních výkonech v kombinaci s pooperační radioterapií jsou významně horší, Kidd a spolupracovníci u svých pacientů zaznamenali 77 % pětiletého přežití bez progrese u těch, kteří byli ozářeni časně po operaci či biopsii. U oddálené radioterapie (až při progresi) bylo 5leté PFS v souboru jen 50 % [22]. V našem souboru neradikálně operovaných nebo pouze po biopsii pro pilocytární astrocytom stupeň I je 5 - a 10leté přežití relativně příznivé: 91 % a 88 %.
Dlouhodobá lokální kontrola nad nádorovým růstem je v našem souboru příznivá. I u našich nemocných jsme však zaznamenali typický trend zhoršujících se výsledků s prodlužujícím se následným sledováním. Není však tak výrazný jako ve výše jmenovaných studiích RTOG/EORTC. Pro definitivní zhodnocení výsledků bude vhodné ještě delší následné sledování. Stereotaktické radioterapeutické techniky se v léčbě gliomů stále více uplatňují a rozšiřují léčebné možnosti [19,23–26].
Závěry
Stereotaktické hypofrakcionované ozáření může rozšířit léčebné možnosti pro tuto skupinu primárních mozkových nádorů, tedy především pro objemově vhodná rezidua a recidivy.
MUDr. Gabriela Šimonová, CSc.
Odd. stereotaktické a radiační neurochirurgie
Nemocnice Na Homolce
Roentgenova 2
150 30 Praha 5
e-mail: gabriela.simonova@homolka.czPřijato k recenzi: 16. 9. 2010
Přijato do tisku: 17. 1. 2011Poděkování
Mgr. Tumpachové za technickou pomoc a všem spolupracovníkům oddělení stereotaktické a radiační neurochirurgie a spolupracovníkům oddělení radiodiagnostiky, kteří se na naší práci rovněž podíleli.
Zdroje
1. Knisely JP, Lally BE. Validation of the European Organization for Research and Treatment of Cancer (EORTC) Prognostic factors for Low grade Gliomas Utilizing the Surveillance, Epidemiology and End results database. Int J Radiat Oncol Biol Phys 2005; 63 (Suppl 1): 262–263.
2. Shaw E, Arusell R, Scheithauer J, Fallon B, O’Neill R, Dinapoli D et al. Prospective randomize trial of low-versus high dose radiation therapy in adults with supratentorial low-grade glioma: initial report of a North Central Cancer Treatment Group/Radiation Therapy Oncology Group/Eastern Cooperative Oncology Group study. J Clin Oncol 2002; 20(9): 2267–2276.
3. Karim AB, Maat B, Hatlevoll, Menten J, Rutten EH, Thomas DG et al. A randomized trial on dose-response in radiation therapy of low-grade cerebral glioma:EORTC study 22844. Int J Radiat Oncol Biol Phys 1996; 36 : 549–556.
4. Karim ABMF, Afra D, Cornu P, Bleehan N, Schraub S, De Witte O et al. Randomized trial on the efficacy of radiotherapy for cerebral low-grade gliom in the adult: EORTC Study 2285 with the MRC Study BR04: An interim analysis. Int J Radiat Oncol Biol Phys 2002; 52(2): 316–324.
5. Bauman G, Lote K, Larson D, Stalpers L, Leighton Ch, Fisher B et al. Pretreatment factors predict overall surviving for patients with low-grade glioma: a recursive partitioning analysis. Int J Radiat Oncol Biol Phys1999; 45(4): 923–929.
6. Plathow C, Schulz-Ertner D, Thilman Ch, Zuna I, Lichy M, Weber M-A et al. Fractionated stereotactic radiotherapy in low-grade astrocytomas: long-term outcome and prognostic factors. Int J Radiat Oncol Biol Phys 2003, 57(4): 996–1003.
7. Simonová G, Novotná J jr, Liscak R. Low-grade gliomas treated by fractionated gamma knife surgery. J Neurosurg 2005; 10 (Suppl): 19–24.
8. Choucair AK, Scott C, Urtasun R, Nelson D, Mousas B, Curran W. Quality of life and neuropsychological evaluation for patients with malignant astrocytomas:RTOG 91-14. Radiation Therapy Oncology Group. Int J Radiat Oncol Biol Phys 1997; 38(1): 9–20.
9. Kano H, Kondziolka D, Niranjan A, Flickinger JC, Lunsford LD. Stereotactic radiosurgery for pilocytic astrocytomas part 1: outcomes in adult patients. J Neurooncol 2009; 95(2): 211–218.
10. Kano H, Niranjan A, Kondziolka D, Flickinger JC, Pollack IF, Jakacki RI et al. Stereotactic radiosurgery for pilocytic astrocytomas part 2: outcomes in pediatric patients. J Neurooncol 2009; 95(2): 219–229.
11. Cox JD, Stetz J, Pajak TF. Toxicity criteria of the Radiation Therapy Oncology Group (RTOG) and the European Organization for Research and Treatment of Cancer (EORTC). Int J Radiat Oncol Biol Phys 1995; 31(5):1341–1346.
12. Hall EJ. Radiobiology for the radiologist. 5th ed. New York: Lippincott Williams Wilkins 2000 : 397–416.
13. Steel GG. Basic Clinical Radiobiology. 3rd ed. London: Hodeer Arnold 2002 : 135–149.
14. Pollock BE, Brown RD jr. Management of cysts arising after radiosurgery for cerebral arteriovenous malformation. Neurosurgery 2001; 49(2): 259–264
15. Hara M, Nakamura M, Shiokawa Y, Sawa H, Sato E, Koyasu H et al. Delayed cyst formation after radiosurgery for cerebral arteriovenous malformation: two case reports. Minim Invasive Neurosurg 1998, 41(1): 40–45.
16. Yamamoto M, Ide M, Jimbo M, Mitsuhiro H, Saito I, Mori K. Gamma knife radiosurgery for arteriovenous malformations: long-term follow up results focusing on complications occoring more than 5 years after irradiation. Neurosurg 1996, 38(5): 906–914.
17. Kim MS, Lee SI, Sim JH. A case of very large cyst formation with gamma knife radiosurgery for an arteriovenous malformation. Stereotactic Funct Neurosurg 1999; 72 (Suppl 1): 168–174.
18. Kihlström L, Hindmarsh T, Lax I, Lippitz B, Mindus P, Lindquist C. Radiosurgical lesions in the normal human brain 17 years after gamma knife capsulotomy. Neurosurg 1997; 41(2): 396–402.
19. Wallren KE, Gonzales MF, Edwards MS, Wara WM, Sheline GE. Treatment results of juvenile pilocytic astrocytoma. J Neurosurg 1988; 69(2): 171–176.
20. Šimonová G, Novotný HJ jr. Stereotaktická radiochirurgie a radoterapie. In: Šlampa, P, Petera, J et al (eds). Radiační onkologie. Praha: Galén 2007 : 418–420.
21. Sgouros S, Fineron PW, Hockley AD. Cerebellar astrocytoma in childhood: long-term follow up. Childs Nerv Syst 1995; 11(2): 89–96.
22. Kidd EA, Mansur DB, Leonard JR, Michalski JM, Simpson JR. The efficacy of radiation therapy in the management of grade I astrocytomas. J Neurooncol 2006; 76(1): 55–58.
23. Saran FH, Baumert BG, Khoo VS, Adams EJ, Garré ML, Warrington AP et al. Stereotactically guided conformal radiotherapy for progressive low-grade gliomas of childhood. Int J Radiat Oncol Biol Phys 2002; 53(1): 43–51.
24. Marcus KJ, Goumnerova L, Billett AL, Lavally B, Scott M, Bishop K et al. Stereotactic radiotherapy for localized low-grade gliomas in children: Final results of a prospective trial. Int J Radiat Oncol Biol Phys 2005; 61(2): 374–379.
25. Bauman G, Fisher B, Watling Ch, Caimcross JG, MacDonald D Adult supratentorial low-grade glioma: long-term experience at a single institution. Int J Radiat Oncol Biol Phys 2009; 75(2): 1401–1407.
26. Ruiz J, Lesser GJ. Low-grade gliomas. Curr Treat Options 2009; 10(3–4): 231–242.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článek Léčba adenomů hypofýzyČlánek Vplyv chirurgickej liečby na prognózu dospelých pacientov so supratentoriálnymi low-grade gliómamiČlánek Profit pacientů ze stanovení cerebrovaskulární rezervní kapacity pomocí SPECT mozku a hyperkapnieČlánek Webové okénko
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2011 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Léčba adenomů hypofýzy
- Kognitivní funkce při onemocnění vnitřní krkavice a vliv léčebných intervencí
- Farmakologická sekundární prevence nekardioembolického mozkového infarktu/tranzitorní ischemické ataky – současnost a budoucnost
- Vplyv chirurgickej liečby na prognózu dospelých pacientov so supratentoriálnymi low-grade gliómami
- Pacient ve vegetativním stavu a jeho rehabilitace
- Hypothalamo-hypofyzární dysfunkce po kraniocerebrálních traumatech a po spontánním subarachnoidálním krvácení
- Vliv funkčního mapování na výsledky operací nízkostupňových gliomů WHO grade II
- Profit pacientů ze stanovení cerebrovaskulární rezervní kapacity pomocí SPECT mozku a hyperkapnie
- Stereotaktické ozáření nízkostupňových gliomů na Leksellově gama noži
- Peroperační měření průtoku likvoru pomocí ultrazvuku při dekompresi cervikokraniálního přechodu u Chiariho malformace typu I
- Peroperační monitoring aktivovaného koagulačního času při karotické endarterektomii
- Lehké mozkové poranění – intrakraniální komplikace a indikační kritéria pro CT vyšetření
- Limbická encefalitida – dvě kazuistiky
- Difuzně vážený obraz a možnost predikce vývoje mozkové žilní trombózy na magnetické rezonanci – dvě kazuistiky
- Jednostranné intravitreální krvácení po předávkování metamfetaminem (pervitinem): varianta Tersonova syndromu u 16letého narkomana – kazuistika
- Uzávěr bazilární tepny disekcí v souvislosti s manipulací krční páteře – kazuistika
- Organizovaný chronický subdurální hematom – kazuistiky
- Chronická žilní cerebrospinální insuficience u roztroušené sklerózy – staronový koncept, nové otázky?
- Webové okénko
-
Analýza dat v neurologii.
XXVII. Hodnocení diagnostických testů – vliv prevalence nemoci - VII. olomoucký workshop cévní neurologie 11. neurosonologické dny – „Pokroky v neurosonologii“
- 15. Jedličkovy neuroimunologické a likvorologické dny
- Atypical Parkinsonian Syndromes – an International Symposium on Neurodegenerative Diseases
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Léčba adenomů hypofýzy
- Limbická encefalitida – dvě kazuistiky
- Pacient ve vegetativním stavu a jeho rehabilitace
- Lehké mozkové poranění – intrakraniální komplikace a indikační kritéria pro CT vyšetření
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



