-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Peroperační monitoring aktivovaného koagulačního času při karotické endarterektomii
Perisurgical Monitoring of Activated Coagulation Time in Carotid Endarterectomy
The aim of this study was to determine the ideal amount of heparin per kilogram of patient body weight and the amount of protamine necessary for its subsequent neutralization with relation to initial heparin dose and with respect to activated coagulation time (ACT).
Patients and methods:
The prospective study group consisted of 80 patients (20 female, 60 male) 44 of them treated for asymptomatic stenosis, mean age 65.8, range 39–82 years, bilateral stenosis in 4 of them, upon whom a total of 84 carotid endarterectomies had been performed between April 2008 to May 2009. Patients were divided into three groups, according to the amount of heparin administered (1, 1.5 and 2 mg of heparin per kilogram).Results:
In first group, median ACT after heparin administration was 268.0 seconds; in second 334.0 and in the third group 375.0 (p <0.01). Median ACT after protamine administration in the first group was 130 seconds, in the second 137 seconds and in the third group 128 seconds (p = 0.79). A total of 7 postoperative complications occurred, including 2 wound haematomas requiring surgical revision (2.4%), 3 neurological complications (3.6%) and 2 cardiological complications (2.4%). After three months all patients had recovered ad integrum at ambulatory check-up; permanent morbidity is thus 0%.Conclusion:
One milligram of heparin per kilogram is a sufficient dose to achieve adequate anticoagulation, minimizing the risk of postoperative haematoma without increasing the risk of peri-operative ischemic stroke.Key words:
carotid endarterectomy – activated coagulation time – heparin – protamine
Autoři: M. Sameš 1; E. Provazníková 1; F. Cihlář 2; D. Bejšovec 3; R. Bartoš 1; A. Hejčl 1; I. Humhej 1; P. Vachata 1
Působiště autorů: Krajská zdravotní a. s., Masarykova nemocnice v Ústí nad Labem, o. z. Neurochirurgická klinika UJEP 1; Krajská zdravotní a. s., Masarykova nemocnice v Ústí nad Labem, o. z. Radiologické odd. 2; Krajská zdravotní a. s., Masarykova nemocnice v Ústí nad Labem, o. z. Odd. intenzivní medicíny 3
Vyšlo v časopise: Cesk Slov Neurol N 2011; 74/107(3): 325-329
Kategorie: Krátké sdělení
Souhrn
Naším cílem bylo určit ideální množství heparinu na kg hmotnosti pacienta a množství protaminu potřebné k následné neutralizaci dle hodnot aktivovaného koagulačního času (ACT).
Soubor a metodika:
Do prospektivní studie bylo zařazeno 80 pacientů (20 žen, 44 asymptomatických stenóz, průměrný věk 65,8; rozpětí 39–82 let, bilaterální stenóza u čtyř pacientů), kteří v období od dubna 2008 do května 2009 podstoupili 84 karotických endarterektomií (CEA). Pacienty jsme rozdělili do tří skupin podle podané dávky heparinu (1; 1,5 a 2 mg heparinu na kg hmotnosti).Výsledky:
Medián ACT po aplikaci heparinu byl v první skupině 268,0; ve druhé skupině 334,0 a ve třetí skupině 375,0 (p < 0,01). Medián ACT po podání protaminu byl v první skupině 130, ve druhé 137 a ve třetí 128 (p = 0,79). Pooperačně se vyskytlo celkem sedm komplikací, z nichž byly dva hematomy v místě rány s nutností chirurgické revize (2,4 %), tři neurologické komplikace (3,6 %) a dvě kardiologické komplikace (2,4 %). Při ambulantní kontrole za tři měsíce se stav všech pacientů upravil ad integrum, permanentní morbidita tedy činí 0 %.Závěr:
K dosažení adekvátní antikoagulace postačuje dávka 1 mg heparinu na kg váhy, tato dávka minimalizuje riziko vzniku pooperačního cervikálního hematomu a nezvyšuje riziko vzniku perioperační ischemické cévní mozkové příhody (iCMP).Klíčová slova:
karotická endarterektomie – aktivovaný koagulační čas – heparin – protaminÚvod
Karotická endarterektomie (CEA) je standardní léčebná metoda symptomatické i asymptomatické stenózy vnitřní krkavice a její přínos byl prokázán velkými randomizovanými studiemi [1–3]. Pro úspěšnou operaci a minimalizaci rizika perioperační trombózy a ischemické cévní mozkové příhody (iCMP) je důležitá peroperační systémová antikoagulace. Podání heparinu se řídí zvyklostmi jednotlivých pracovišť. Chirurgická obec je rozdělena na čtyři skupiny: jedna doporučuje podání fixní dávky heparinu [4,5], druhá upřednostňuje dávkovat heparin na kilogram pacientovy hmotnosti [6–9], třetí preferuje podání nízké dávky heparinu [10,11] a nově existuje i čtvrtá skupina, která doporučuje nízkomolekulární heparin [12,13]. Měření heparinizace pomocí monitorování aktivovaného koagulačního času (activated coagulation time, ACT) bylo poprvé použito při kardiochirurgických operacích [14,15], od 80. let slouží i při CEA [16].
Aktivovaný koagulační čas je interval vyjádřený v sekundách, za který dojde ke sražení plné krve po styku s kontaktním aktivátorem (kaolin, křemík, skleněné částice) [17]. Umožňuje rychle a bezpečně stanovit míru heparinizace během manipulace s vnitřní karotidou a v závěru operace ověřit efekt neutralizace heparinu protaminem a případně rozhodnout o podání další dávky protaminu.
Cílem naší studie je zmapovat individuální rozdíly ACT po aplikaci heparinu, dále určit ideální množství heparinu na kg hmotnosti pacienta a množství protaminu potřebné k následné neutralizaci dle hodnot ACT a konečně zhodnotit výsledky v závislosti na podané dávce heparinu. Dle našich informací nebyla problematika měření ACT při CEA v české literatuře dosud popsána.
Soubor a metodika
Pacienti
Do prospektivní studie jsme zařadili 80 pacientů, kteří v období od dubna 2008 do května 2009 podstoupili celkem 84 CEA na Neurochirurgické klinice Masarykovy nemocnice a Univerzity Jana Evangelisty Purkyně v Ústí nad Labem a u nichž jsme měli kompletní výsledky měření ACT. Věk se pohyboval mezi 39 a 82 lety (medián 65 let; průměr 65,8 let; 60 mužů a 20 žen). Ve vztahu ke klinickému obrazu bylo 44 pacientů (52,4 %) operováno pro asymptomatickou stenózu a 40 pacientů (47,6 %) pro symptomatickou stenózu. Pacienty jsme rozčlenili do tří skupin: první skupina pacientů dostala 100 IU (1 mg) heparinu na kg hmotnosti, druhá skupina 150 IU (1,5 mg) na kg hmotnosti a třetí skupina 200 IU (2 mg) heparinu na kg hmotnosti. První skupina, která obdržela 100 IU, čítala 52 pacientů (43 mužů; průměrný věk 66,1 let; medián 62 let). Ve vztahu ke klinickému obrazu bylo 26 pacientů bez symptomů a 26 symptomatických. Druhá skupina, s dávkou 150 IU heparinu na kg hmotnosti, čítala 13 pacientů (11 mužů; průměrný věk 62,6; medián 64). Klinicky byly tři stenózy asymptomatické a 10 symptomatických. Třetí skupina, s dávkou 200 IU heparinu na kg hmotnosti, obsahovala 19 pacientů (8 mužů; průměrný věk 67,3 let; medián 63 let). Klinicky bylo 15 pacientů bez symptomů a čtyři symptomatičtí.
Operační postup
Pacienti byli standardně operováni v blokové anestezii s monitoringem neurologického stavu, pokud došlo k jeho alteraci, byl zaveden shunt. Předoperační ACT bylo měřeno pouze u pacientů, jejichž APTT bylo vyšší než 1,3; u ostatních se předpokládala normální hodnota ACT, tedy 107 ± 13 sekund [17]. Před nasazením klipů na arteria thyroidea superior, vnější, vnitřní a společnou karotidu byl podán heparin v dávce 100–200 IU na kg hmotnosti pacienta a po 3 minutách změřeno ACT. Pokud hodnota ACT převyšovala 200 sekund, pokračovalo se v operaci klipováním arterií. Byla-li jeho hodnota nižší než 200 sekund, bylo podáno ještě 50 IU heparinu na kg hmotnosti a opět změřeno ACT. Pacienti pak byli zařazeni do skupiny dle výsledného ACT. Po odstranění plátu (obr. 1) a po sutuře stěny vnitřní karotidy a sejmutí klipů z arteria thyroidea superior, vnější, společné a vnitřní karotidy byl podán protamin v dávce, která zneutralizuje tři čtvrtiny podaného heparinu, tedy 75 IU protaminu na 100 IU heparinu, a po 3 minutách bylo opět změřeno ACT. Při hodnotě ACT nad 150 sekund bylo přidáno dalších 37,5 IU protaminu na 100 IU heparinu.
Obr. 1. Vypreparovaná vnitřní karotida s odstraněným plátem. 
Hospitalizace
Po výkonu byl pacient převezen na jednotku intenzivní péče (JIP). Když byl pacient převzat ze sálu, lékař jej vyšetřil stran neurologického stavu, stavu operační rány, krevního tlaku, EKG křivky a dýchání. Po přesunu na JIP byl pacient vyšetřen laboratorně včetně náběru koagulace a Astrupa. Po změření APTT byl pacient dále heparinizován třikrát 5 000 IU heparinu s.c. po 8 hodinách, pokud hodnota APTT nepřesahovala 1,5–2násobek předoperační kontrolní hodnoty. Při nekomplikovaném průběhu byli pacienti druhý den přeloženi na standardní oddělení a tam dostali jednu dávku Fraxiparinu a byli vertikalizováni. Do domácí péče byli pacienti propouštěni čtvrtý pooperační den. Antiagregační léčba (Anopyrin, Aggrenox) nebyla přerušena.
Technika měření ACT
ACT bylo měřeno přístrojem Hemochron Jr. Signature+ (International Technidyne Corporation, Edison, New Jersey). Kapka periferní krve se nakapala do vzorové testovací jamky. Přístroj odměřil přesně 15 mikrolitrů krve, převedl je do pokusného kanálku uvnitř kyvety ACT+ a smíchal vzorek a činidlo. Vzorek se pak pohyboval předurčenou rychlostí ve výzkumném kanálku ze strany na stranu a bylo sledováno vytvoření koagula. Teplota kanálku byla během testu udržována na 37 °C ± 1 °C. Rychlost pohybu vzorku byla sledována řadou optických detektorů. Jakmile krev začala koagulovat, došlo ke zpomalení toku vzorku mezi detektory, což upozornilo přístroj na to, že se vytvořilo koagulum. Měřil se čas, který uplynul od začátku testu do vytvoření koagula.
Výsledky
Po podání 1 mg heparinu na kg hmotnosti byla průměrná hodnota ACT 280,2; medián 268,0; rozpětí 183–520. Po podání 1,5 mg heparinu na kg hmotnosti byla průměrná hodnota ACT 321,2; medián 334,0; rozpětí 201–386. Po podání 2 mg heparinu na kg hmotnosti byla průměrná hodnota ACT 392,6; medián 375,5; rozpětí 298–715 (p < 0,01) (tab. 1, graf 1).
Tab. 1. Hodnoty ACT po podání heparinu. 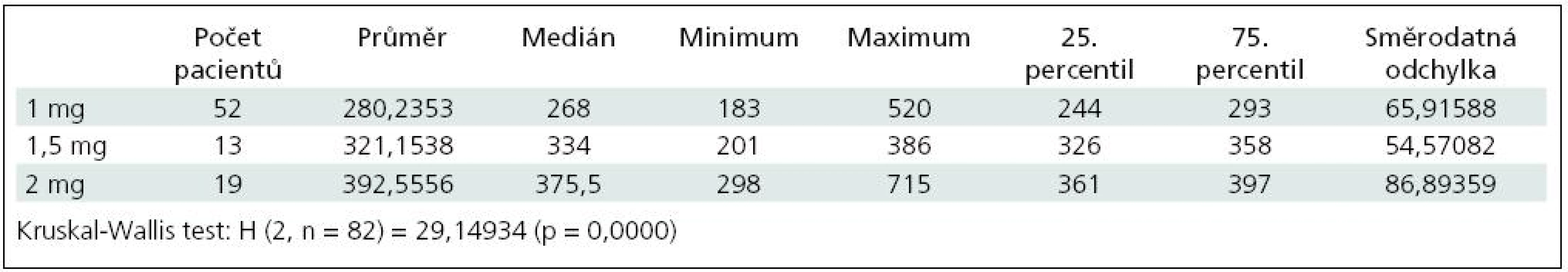
Graf 1. Hodnota ACT v závislosti na dávce heparinu ihned po jeho podání. 
Průměrná hodnota ACT po neutralizaci protaminem (po podání 75 IU nebo po podání 112,5 IU; pokud poloviční dávka nedostačovala) byla v první skupině 134,8; medián 130,0; rozpětí 105–250. Ve druhé skupině byla průměrná hodnota 135,9; medián 137; rozpětí 104–172. Ve třetí skupině byla průměrná hodnota 152,1; medián 128,0; rozpětí 97–389 (p = 0,79). (tab. 2, graf. 2)
Tab. 2. Hodnoty ACT po podání protaminu v množství 75 IU na 100 IU heparinu nebo v množství 112,5 IU; pokud nižší dávka nedostačovala. 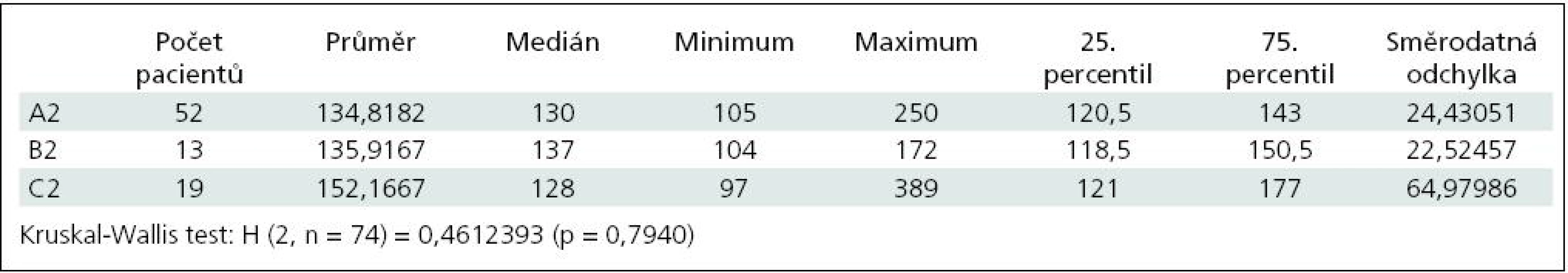
Graf 2. Hodnota ACT v jednotlivých skupinách po neutralizaci heparinu protaminem. 
Při testu okluze ACI došlo ke zhoršení neurologického stavu u osmi pacientů (9,5 %), proto bylo nutné zavedení shuntu.
Pooperačně se vyskytlo celkem sedm komplikací, z nichž byly dva hematomy v místě rány s nutností chirurgické revize (2,4 %), tři neurologické komplikace (3,6 %) a dvě (2,4 %) kardiologické komplikace (non ST infarkt myokardu (NSTEMI) a levostranné srdeční selhání) (tab. 3). Oba pacienti s hematomem v operační ráně dostali 2 mg heparinu a neutralizační dávku protaminu 1,5 mg, v této podskupině tvořili 10,5 %. Z neurologických komplikací jsme pozorovali jednu tranzitorní ischemickou ataku (TIA) (1,2 %), jednu iCMP (1,2 %) a jeden (1,2 %) intracerebrální hematom (ICH). Všichni pacienti s neurologickými a kardiologickými komplikacemi spadali do skupiny s dávkou 1 mg heparinu na kg, v této skupině neurologické komplikace představovaly 5,8 % a kardiologické komplikace 3,8 %, celkem tedy 9,6 %. Ve skupině asymptomatických pacientů se vyskytl jeden hematom v ráně (2,7 %) a jeden NSTEMI (2,7 %), celkem tedy 5,4 %. Ve skupině symptomatických pacientů se objevil jeden hematom v ráně, jedna ICH, jedna iCMP a jedna TIA a jedno levostranné srdeční selhání, komplikace činily 12,5 %. Mortalita a morbidita při propuštění činila ve skupině asymptomatických pacientů 0 % a ve skupině symptomatických pacientů 5 % (perzistující motorický deficit po pooperační iCMP, resp. ICH). Permanentní morbidita (zjišťovaná při ambulantní kontrole za tři měsíce) u symptomatických pacientů byla pak 0 %, neboť neurologický stav obou těchto pacientů se upravil ad integrum.
Tab. 3. Komplikace v souborech. 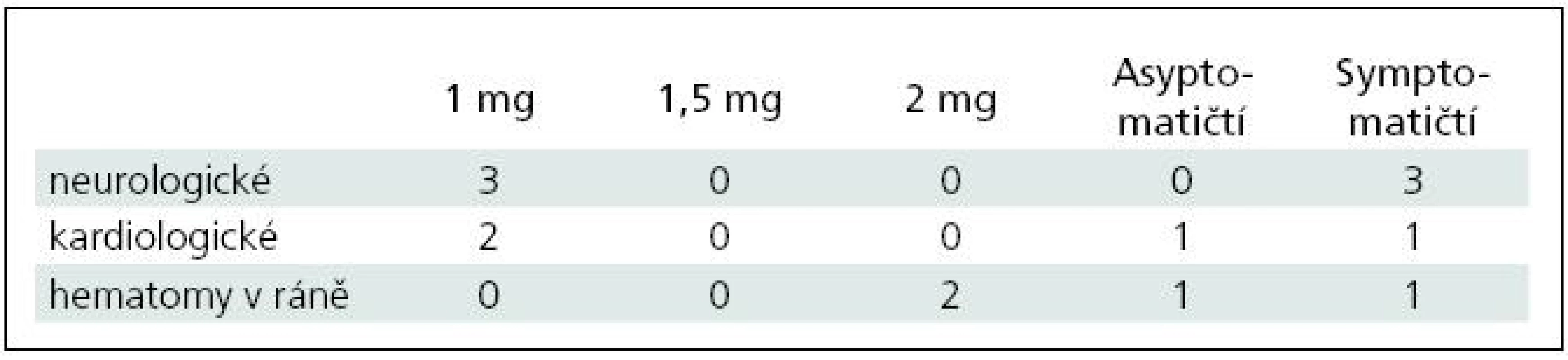
Diskuze
Monitorování ACT při CEA je v dnešní době dominující metoda stanovení míry systémové antikoagulace především pro svou jednoduchost, příznivou cenu a dobrou korelaci hodnoty ACT se sérovou koncentrací heparinu [18]. Optimální systémová antikoagulace je jedním ze základních předpokladů úspěchu tohoto výkonu, neboť na jedné straně je nutné zabránit vzniku trombu v místě sutury cévy adekvátní heparinizací a na druhé straně je třeba peroperačně předcházet vzniku pooperačního hematomu v místě rány neutralizací heparinu. Na dávkování heparinu nepanuje mezi jednotlivými pracovišti neurovaskulární chirurgie jednotný názor.
První možností je podání fixní dávky heparinu. Poisik et al analyzovali 140 pacientů a považují 5 000 IU (rozpětí v dávce u jednotlivých pacientů bylo 44–116 IU heparinu na kg váhy) za dostačující dávku k dosažení peroperační heparinizace bez nutnosti stanovovat ACT před zaklipováním cév. Protamin nebyl v této studii podáván. Autoři pozorovali osm cervikálních hematomů (6 %), z nichž jeden (0,7 %) vyžadoval reoperaci a žádnou iCMP. Výhodou tohoto postupu je zkrácení celkové délky operace [4].
Druhou možností je podání dávky heparinu v závislosti na hmotnosti pacienta. De Sousa et al, Mauney et al a Coyne et al doporučují dávku 100 IU na kg hmotnosti pacienta [6,8,9]. Dorman et al pouze 90 IU na kg hmotnosti [7]. De Sousa et al referují o třech (1,7 %) případech cervikálního hematomu s reoperací a o čtyřech iCMP (2,3 %). Protamin byl podán, pokud ACT na konci operace přesahovalo 200 sekund. Signifikantní mortalita a morbidita činila pouze 1,2 % (jeden pacient zemřel na akutní infarkt myokardu a u jednoho perzistoval motorický deficit). Mauney et al pozorovali pět iCMP (1,4 %) a pět cervikálních hematomů s nutností reooperace (1,4 %). Protamin byl podán u části pacientů (viz dále). Coyne et al zaznamenali jednu iCMP (2 %) a tři případy (7 %) dušnosti pro otok v místě rány s nutností intubace, ovšem bez nutnosti reoperace. Protamin byl podán pouze tehdy, pokud byla rána prosáklá. Naše pracoviště taktéž preferovalo podávání dávky heparinu dle hmotnosti pacienta. V naší studii jsme podávali 100, 150 a 200 IU na kg hmotnosti pacienta. Z komplikací jsme pozorovali dva hematomy v místě rány (2,4 %), jednu iCMP (1,2 %) a jednu ICH (1,2 %). Oba hematomy se vyskytly u pacientů s 2miligramovou dávkou heparinu, iCMP a ICH ve skupině s 1 mg heparinu. Signifikantní mortalita a morbidita (tedy perzistující při dimisi pacienta) činila 0 % ve skupině asymptomatických pacientů a 5 % ve skupině symptomatických (motorický deficit jako důsledek perioperační iCMP a ICH), nicméně oba tyto deficity se do ambulantní kontroly za tři měsíce upravily ad integrum, tedy permanentní morbidita je 0 %.
Třetí možností je podání nízké dávky heparinu. Paty et al a Groudine et al doporučují podání pouze 30 IU na kg hmotnosti. Tato dávka zajistí adekvátní antikoagulaci a umožňuje vyhnout se podání protaminu [10,11]. Paty et al popisují tři případy perioperačního úmrtí (0,9 %), dvě iCMP (0,48 %) a dva hematomy s nutností evakuace (0,48 %). Groudine et al referují o čtyřech iCMP (0,95 %) a žádném pooperačním hematomu.
Čtvrtou možností je podání nízkomolekulárního heparinu (LMWH). Assadian et al poukazují na stejnou účinnost a bezpečnost jako při podání nefrakcionovaného heparinu [12]. McMahon et al prokazují nižší riziko peroperační embolizace při podání 2 500 IU LMWH [13].
Další kontroverzní otázkou je neutralizace heparinu podáním protaminu. Argumentem pro použití protaminu je nižší riziko vzniku život ohrožujícího cervikálního hematomu. Argumentem proti použití protaminu je vyšší riziko pooperační iCMP, možnost rozvoje alergické reakce a jeho kardiodepresivní účinky. Zvláště predisponovanými jedinci k rozvoji alergické reakce jsou diabetici léčení neutral protamin Hagedorn (NPH) inzulinem (humulon), pacienti s alergií na mořské plody a pacienti po operaci varlat [19]. Heparin má navíc poměrně krátký eliminační poločas (90–120 min).
Levison et al analyzoval celkem 407 CEA, při 365 byl protamin podán, u 42 nikoliv. Dávka heparinu nebyla u všech pacientů totožná. Protamin byl podán v dávce 1 mg na 100 IU reziduálního heparinu (při poločasu rozpadu heparinu 90 min). Ve skupině s protaminem bylo celkem 10 pooperačních iCMP (2,7 %) a sedm (1,9 %) cervikálních hematomů, ve skupině bez protaminu se nevyskytla žádná iCMP a celkem čtyři (9,5 %) hematomy, nicméně pouze jeden vyžadoval operační revizi [20]. Mauney et al analyzovali 193 pacientů, kteří dostali protamin, a 155 pacientů, kteří jej nedostali. Heparin byl podán v dávce 100 IU na kg váhy. Protamin byl podán v dávce 1 mg na 100 IU heparinu. Ve skupině s protaminem se vyskytlo pět iCMP (2,6 %) a dva hematomy (1 %), ve skupině bez protaminu nebyla žádná iCMP a tři hematomy (1,9 %). Rozdíl ve výskytu iCMP byl statisticky významný (p = 0,045), rozdíl ve výskytu hematomu nikoliv (p = NS) [8]. Shodným závěrem obou autorů je menší riziko iCMP po CEA bez reverze heparinu.
Treitman et al hodnotil celkem 697 pacientů, reverze proběhla u 328 z nich. Heparin byl podán ve fixní dávce 5 000 IU. Podání protaminu se řídilo subjektivním dojmem operatéra bez měření ACT. Protamin byl podán v dávce 15–75 mg celkem, průměrně 42 mg. CMP se objevila u šesti (1,8 %) pacientů bez reverze a u 10 (2,7 %) pacientů s reverzí, rozdíl není statisticky významný. Cervikální hematom vyžadující evakuaci se vyskytl u šesti (1,8 %) pacientů s reverzí a u 24 (6,5 %) pacientů bez reverze, zde byl rozdíl statisticky významný [5]. Dellagrammaticas et al ve své randomizované studii porovnával celkem 2 158 pacientů, u 594 z nich byl heparin neutralizován protaminem. Heparin byl podán ve fixní dávce 5 000 IU, protamin též ve fixní dávce 25 mg. Míra iCMP ve skupině s protaminem byla 2,9 %; ve skupině bez něj 4,4 %; rozdíl nebyl statisticky významný, navíc ve skupině s protaminem byl větší počet pacientů s asymptomatickou stenózou, tedy i očekávaný počet iCMP byl nižší. Počet hematomů ve skupině bez protaminu byl 157 (10,4 %) a ve skupině s protaminem 44 (7,4 %), rozdíl byl statisticky významný (p = 0,037) [21]. Podání protaminu nezvýšilo riziko pooperační iCMP, ale snížilo riziko reoperace pro hematom.
V našem souboru se jeví nejvýhodnější podání 1 mg heparinu na kg váhy. V této skupině se sice vyskytují komplikace, ale to je do jisté míry dáno tím, že tato skupina čítá nejvíce pacientů (52 pacientů vs 13, resp. 19 pacientů). Obě kardiologické komplikace (NSTEMI a levostranné srdeční selhání) se vyskytly u polymorbidních pacientů (ischemická choroba srdeční, hypertenze, nikotinizmus) a lze předpokládat, že by se vyskytly i při kterémkoliv jiném operačním výkonu. Pacienti byli přeloženi na kardiologickou kliniku a domů propuštěni v kompenzovaném stavu. Pacient s TIA před operací prodělal iCMP, operace byla provedena bez použití shuntu. ACT před nasazením klipů na cévy bylo 248 sekund, po podání protaminu 132 sekund. TIA vznikla na operačním sále, kde také odezněla, poté se objevila opět během hospitalizace na JIP, ovšem i zde se neurologický stav upravil ad integrum, proto tohoto pacienta nezapočítáváme do permanentní mortality a morbidity. Pacient s iCMP před operací prodělal recidivující TIA, operace byla provedena s použitím shuntu, neboť pacient netoleroval okluzní test, paréza extenze III.–V. prstu levé horní končetiny vznikla pooperačně a upravila se ad integrum do tří měsíců. Peroperační ACT bylo 260 sekund, po podání protaminu 180 sekund. Pacient s ICH prodělal před operací též recidivující TIA, operace byla provedena bez použití shuntu. Peroperační ACT bylo 213 sekund, po podání protaminu 131 sekund. Pacient byl jeden den observován na JIP, po překladu na standardní oddělení vznikla fatická porucha, která se během další hospitalizace upravovala, pacient propuštěn s lehkou fatickou lézí, která se upravila ad intergrum. Hodnoty ACT u všech těchto pacientů byly v mezích normy. První pacient s cervikálním hematomem byl před operací bez příznaků, operace byla provedena bez použití shuntu. Peroperační ACT bylo 183 sekund, ACT po podání protaminu bylo 97 sekund. Druhý pacient s cervikálním hematomem prodělal před operací amaurosis fugax, operace byla provedena bez použití shuntu. Peroperační ACT bylo 227 sekund, po podání protaminu bylo ACT 157 sekund. Hodnoty ACT byly i v tomto případě v mezích normy. Oba pacienty bylo nutné operačně revidovat, nicméně propuštěni byli bez nově vzniklého neurologického deficitu.
Podání protaminu je dle našeho názoru bezpečná metoda neutralizace heparinu, nicméně dávka by měla být indikována s rozvahou. Heparin má poměrně krátký poločas eliminace (90–120 min), proto délka operačního výkonu velmi ovlivňuje reziduální množství v krevním oběhu pacienta. My jsme standardně podávali 75 IU protaminu na 100 IU heparinu, tedy dávku, která neutralizuje tři čtvrtiny iniciálně podaného množství heparinu a poté jsme měřili ACT a dle hodnoty případně přidávali dalších 37,5 IU protaminu. Při podávání protaminu by bylo vhodné reflektovat délku operace (heparinizace obvykle trvala zhruba 45 min, což odpovídá polovině eliminačního poločasu heparinu).
Závěr
Naše studie prokazuje, že podáním 1 mg heparinu na kg váhy dosáhneme dostatečné systémové antikoagulace. Podání protaminu umožňuje neutralizovat reziduální množství heparinu. Množství protaminu by mělo být podáno dle délky operace a aktuálního ACT po sutuře cévy. Měřením ACT monitorujeme míru antikoagulace a dle hodnot ACT pak můžeme dávku heparinu a následně i protaminu případně modifikovat dle individuální odpovědi pacienta.
doc. MUDr. Martin Sameš, CSc.
Neurochirurgická klinika
UJEP a Krajská zdravotní a.s., Masarykova nemocnice v Ústí nad Labem, o.z.
Sociální péče 12A
401 13 Ústí nad Labem
e-mail: martin.sames@mnul.czPřijato k recenzi: 22. 7. 2010
Přijato do tisku: 10. 1. 2011Autoři děkují prof. RNDr. Jiřímu Cihlářovi, CSc., za statistické zpracování souboru.
Zdroje
1. Benefit of carotid endarterectomy in patients with symptomatic moderate or severe stenosis. North American Symptomatic Carotid Endarterectomy Trial Collaborators. N Engl J Med 1998 12; 339(20): 1415–1425.
2. Executive Committee for the asymptomatic carotid atherosclerosis study. Endarterectomy for asymptomatic carotid artery stenosis. JAMA 1995; 273(18): 1421–1428.
3. Šilhart Z, Hillová Mannová J, Kysela P, Hamtilová I, Ničovský J, Ševčík P et al. Zhodnocení výsledků operací karotických tepen v letech 1997–2009. Cesk Slov Neurol N 2010; 73/106(3): 294–298.
4. Poisik A, Heyer EJ, Solomon RA, Quest DO, Adams DC, Baldasserini CM et al. Safety and efficacy of fixed-dose heparin in carotid endarterectomy. Neurosurgery 1999; 45(3): 434–441.
5. Treiman RL, Cossman DV, Foran RF, Levin PM, Cohen JL, Wagner WH. The influence of neutralizing heparin after carotid endarterectomy on postoperative stroke and wound hematoma. J Vasc Surg 1990; 12(4): 440–445.
6. de Sousa AA, Dellaretti MA, Faglioni W jr, Carvalho GT. Monitoring of activated coagulation time in carotid endarterectomy. Surg Neurol 2005; 64 (Suppl 1): S6–S9.
7. Dorman BH, Elliott BM, Spinale FG, Bailey MK, Walton JS, Robison JG, Brothers TE, Cook MH. Protamine use during peripheral vascular surgery: a prospective randomized trial. J Vasc Surg 1995; 22(3): 248–255.
8. Mauney MC, Buchanan SA, Lawrence WA, Bishop A, Sinclair K, Daniel TM et al. Stroke rate is markedly reduced after carotid endarterectomy by avoidance of protamine. J Vasc Surg 1995; 22(3): 264–269.
9. Coyne TJ, Wallace MC, Benedict C. Peri-operative anticoagulant effects of heparinization for carotid endarterectomy. Aust N Z J Surg 1994; 64(10): 679–683.
10. Paty PS, Darling RC jr, Kreienberg PB, Chang BB, Groudine SB, Sakawi Y et al. The use of low-dose heparin is safe in carotid endarterectomy and avoids the use of protamine sulfate. Cardiovasc Surg 1999; 7(1): 39–43.
11. Groudine SB, Sakawi Y, Patel MK, Darling C 3rd, Abdel-Raouf A, Paty P et al. Low-dose heparin appears safe and can eliminate protamine use for carotid endarterectomy. J Cardiothorac Vasc Anesth 1998; 12(3): 295–298.
12. Assadian A, Knöbl P, Hübl W, Senekowitsch C, Klingler A, Pfaffelmeyer N et al. Safety and efficacy of intravenous enoxaparin for carotid endarterectomy: a prospective randomized pilot trial. J Vasc Surg 2008; 47(3): 537–542.
13. McMahon GS, Webster SE, Hayes PD, Jones CI, Goodall AH, Naylor AR. Low molecular weight heparin significantly reduces embolisation after carotid endarterectomy – a randomised controlled trial. Eur J Vasc Endovasc Surg 2009; 37(6): 633–639.
14. Zouny JA, Kisker CT, Doty DB. Adequate anticoagulation during cardiopulmonary bypass determined by activated clotting time and the appearance of fibrin monomer. Ann Thorac Surg 1978; 26(3): 231–240.
15. Esposito R, Culliford AT, Colvin SB, Thomas SJ, Lackner H, Spencer FC. The role of the activated clotting time in heparin administration and neutralization for cardiopulmonary bypass. J Thorac Cardiovasc Surg 1983; 85(2): 174–185.
16. Rosenwasser RH, Garrido E, Freed MH, Shupak RC. Monitoring of activated clotting time during carotid endarterectomy: a preliminary report. Neurosurgery 1981; 9(5): 521–523.
17. Hattersley PG. Activated coagulation time of whole blood. JAMA 1966; 196(5): 436–440.
18. Mabry CD, Thompson BW, Read RC. Activated clotting time (ACT) monitoring of intraoperative heparinization in peripheral vascular surgery. Am J Surg 1979; 138(6): 894–900.
19. Brother TE, Robinson JG. Intraoperative anticoagulation and reversal. In: Loftus CM, Kresowik TF (eds). Carotid artery surgery. New York: Thieme 2000 : 391–398.
20. Levison JA, Faust GR, Halpern VJ, Theodoris A, Nathan I, Kline RG et al. Relationship of protamine dosing with postoperative complications of carotid endarterectomy. Ann Vasc Surg 1999; 13(1): 67–72.
21. Dellagrammaticas D, Lewis SC, Gough MJ; GALA Trial Collaborators. Is heparin reversal with protamine after carotid endarterectomy dangerous? Eur J Vasc Endovasc Surg 2008; 36(1): 41–44.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článek Léčba adenomů hypofýzyČlánek Vplyv chirurgickej liečby na prognózu dospelých pacientov so supratentoriálnymi low-grade gliómamiČlánek Profit pacientů ze stanovení cerebrovaskulární rezervní kapacity pomocí SPECT mozku a hyperkapnieČlánek Webové okénko
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2011 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- CIDP: epidemiológia, klinický obraz a diagnostika v kocke
-
Všetky články tohto čísla
- Léčba adenomů hypofýzy
- Kognitivní funkce při onemocnění vnitřní krkavice a vliv léčebných intervencí
- Farmakologická sekundární prevence nekardioembolického mozkového infarktu/tranzitorní ischemické ataky – současnost a budoucnost
- Vplyv chirurgickej liečby na prognózu dospelých pacientov so supratentoriálnymi low-grade gliómami
- Pacient ve vegetativním stavu a jeho rehabilitace
- Hypothalamo-hypofyzární dysfunkce po kraniocerebrálních traumatech a po spontánním subarachnoidálním krvácení
- Vliv funkčního mapování na výsledky operací nízkostupňových gliomů WHO grade II
- Profit pacientů ze stanovení cerebrovaskulární rezervní kapacity pomocí SPECT mozku a hyperkapnie
- Stereotaktické ozáření nízkostupňových gliomů na Leksellově gama noži
- Peroperační měření průtoku likvoru pomocí ultrazvuku při dekompresi cervikokraniálního přechodu u Chiariho malformace typu I
- Peroperační monitoring aktivovaného koagulačního času při karotické endarterektomii
- Lehké mozkové poranění – intrakraniální komplikace a indikační kritéria pro CT vyšetření
- Limbická encefalitida – dvě kazuistiky
- Difuzně vážený obraz a možnost predikce vývoje mozkové žilní trombózy na magnetické rezonanci – dvě kazuistiky
- Jednostranné intravitreální krvácení po předávkování metamfetaminem (pervitinem): varianta Tersonova syndromu u 16letého narkomana – kazuistika
- Uzávěr bazilární tepny disekcí v souvislosti s manipulací krční páteře – kazuistika
- Organizovaný chronický subdurální hematom – kazuistiky
- Chronická žilní cerebrospinální insuficience u roztroušené sklerózy – staronový koncept, nové otázky?
- Webové okénko
-
Analýza dat v neurologii.
XXVII. Hodnocení diagnostických testů – vliv prevalence nemoci - VII. olomoucký workshop cévní neurologie 11. neurosonologické dny – „Pokroky v neurosonologii“
- 15. Jedličkovy neuroimunologické a likvorologické dny
- Atypical Parkinsonian Syndromes – an International Symposium on Neurodegenerative Diseases
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Léčba adenomů hypofýzy
- Limbická encefalitida – dvě kazuistiky
- Pacient ve vegetativním stavu a jeho rehabilitace
- Lehké mozkové poranění – intrakraniální komplikace a indikační kritéria pro CT vyšetření
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



