-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Zkušenosti s evakuací chronického subdurálního hematomu z návrtu kalvy
Experience with a Burr-hole Craniostomy for Chronic Subdural Hematoma
Chronic subdural haematoma is a very common disease of advanced age. Although often considered a trivial affection, its treatment in frequent recurrence may be difficult and its course may be fatal even if mini-invasive methods are used. The most-often used technique is evacuation via a burr-hole craniostomy, increasingly also via a simple twist-drill craniostomy. We present our experience of a group of 180 patients and a total of 201 symptomatic haematomas treated primarily by evacuation and irrigation via a small, burr-hole craniostomy. Drainage was employed in most of the cases. Risk of recurrence of haematoma led to 14.9% of the cases being re-operated. Mortality was low: 0.5% of the patients died soon after the operation. The risk of the recurrence was higher in cases of septated hematoma.
Key words:
chronic subdural hematoma – burr-hole craniostomy – craniotomy
Autori: R. Kaiser 1; L. Douda 1; P. Waldauf 2
; L. Houšťava 1; P. Haninec 1
Pôsobisko autorov: 3. LF UK a FN Královské Vinohrady, Praha Neurochirurgická klinika 1; 3. LF UK a FN Královské Vinohrady, Praha Klinika anesteziologie a resuscitace 2
Vyšlo v časopise: Cesk Slov Neurol N 2011; 74/107(5): 556-559
Kategória: Krátké sdělení
Súhrn
Chronický subdurální hematom je velmi časté onemocnění postihující zejména pacienty ve vyšším věku. Ačkoli je často považován za afekci banální, jeho léčba může být svízelná pro četné recidivy a i přes miniinvazivní postupy může člověka zahubit. Navzdory pokroku v neurochirurgii nejsou dosud stanoveny jasné postupy pro jeho léčbu. Obecně je nejčastěji prováděna evakuace z drobné kraniotomie, stále častěji (pouze) z návrtu. Představujeme zkušenosti se souborem 180 pacientů s 201 symptomatickými hematomy, kteří byli primárně operováni miniinvazivním návrtem a evakuací hematomu s laváží. U většiny byl následně použit drén. Revize pro recidivu byla provedena u 14,9 % hematomů. Časná pooperační mortalita byla 0,5 %. Bylo prokázáno vyšší riziko recidivy v případě septovaných hematomů.
Klíčová slova:
chronický subdurální hematom – návrt lebky – kraniotomieÚvod
Chronický subdurální hematom (CSDH) je jedna z nejčastějších neurochirurgických afekcí. Patofyziologickým základem je natažení přemosťujících žil při atrofii mozku (stařecká či toxická – nejčastěji při abúzu alkoholu, kde spolupůsobí i současná hepatopatická koagulační porucha). Takto protažené cévy jsou velmi zranitelné a obvykle stačí i drobné kraniotrauma k jejich ruptuře s následným drobným zakrvácením, které se díky pomalému venóznímu toku a atrofii mozku klinicky neprojevuje [1]. Vzácněji je hematom lokalizován mimo konvexity [2]. Úraz bývá typicky tak drobný, že jej v anamnéze udává pouze třetina až polovina pacientů. Byly popsány i spontánní případy – rizikovými faktory mohou být hypertenze, přítomnost cévních anomálií mozku, tumory, infekce mozku a koagulopatie. Incidence CSDH kolísá od 1,72 na 100 tisíc obyvatel v severní Evropě až po 13,1 v Japonsku. Muži představují až 75 % pacientů, více než 70 % tvoří pacienti starší 60 let [3]. Za primární příčinu předcházející vlastnímu krvácení je považován únik likvoru do subdurálního prostoru. Ten zde indukuje migraci a proliferaci zánětlivých buněk a fibroblastů formujících membrány hematomu. Vlivem zvýšeného hydrostatického tlaku v novotvořených kapilárách s únikem vody a bílkovin a opakovaným krvácením z jejich stěny způsobeným lokální fibrinolýzou postupně nabývá na objemu, přičemž rozpadové produkty hemoglobinu mění barvu hematomu od červené až po konečnou dehtovitě černou. Pozvolný nárůst a atrofie mozku umožňují rozvoj krvácení rozsáhlých rozměrů s velkým útlakem hemisféry a přetlakem střední čáry. Rezervní kapacita nitrolebního prostoru atrofického mozku schopná pojmout extracerebrální hematom je v průměru 90 ml. Teprve po překročení tohoto objemu se začínají klinicky projevovat příznaky zvýšeného nitrolebního tlaku [1,4]. Příznaky se objevují většinou pozvolna za 3–6 týdnů po úrazu a bývají necharakteristické – bolest hlavy, závratě, celková zpomalenost psychomotorického tempa, poruchy chůze či demence. Tyto symptomy bývají často více vyjádřeny v případě oboustranných hematomů [5]. V rozvinuté fázi se vyvíjí hemiparéza, fatická porucha až poruchy vědomí – ty mohou vzniknout i náhle při akutním zakrvácení do chronického hematomu s prudkým zvětšením jeho objemu [1]. Dominantní vyšetřovací metodou je CT s nálezem typické masy naléhající na hemisféru a přetlačující ji na druhou stranu. Ta bývá při časném záchytu izodenzní (obr. 1), v typickém případě však hypodenzní (obr. 2), v případě akutního zakrvácení jsou přítomny okrsky hyperdenzit [4,6]. Nakaguchi et al rozdělili CSDH podle vnitřní struktury a vývoje do tří základních typů: homogenní (hypodenzní, jeho podtypem je laminární typ s hyperdenzním lemem způsobeným čerstvým zakrvácením podél vnitřní membrány) přecházející v separovaný (rozdělený na ventrální řidší a dorzální hustší část) a dále v trabekulární typ (stadium hojení). Největší tendenci k recidivě má separovaný typ, resp. hematomy umístěné bazálně, naopak nejlepší prognózu mívají homogenní, resp. konvexitární CSDH [7]. MR vyšetření je sice mnohem přínosnější v diagnostice vnitřní struktury se zobrazením všech sept, vzhledem k časové a finanční náročnosti se běžně nepoužívá [8]. Lepší tendenci ke zhojení mají CSDH s vysokým tlakem a již peroperačně viditelnou reexpanzí mozku. Naopak septa v hematomu tomuto průběhu zabraňují, prodlužují celkovou dobu léčby a jsou zodpovědná za většinu recidiv [9]. Od roku 1857, kdy byla tato afekce poprvé Virchowem popsána jako obvykle fatálně končící „pachymeningitis haemorrhagica interna“ [10], došlo k významnému posunu v úspěšnosti léčby onemocnění, kdy nejvyšší popisovaná mortalita činí 13 %. Ani v dnešní době však není shoda v nejlepším terapeutickém postupu a není stanoven jasný guideline pro léčbu.
Obr. 1. CT nález oboustranného izodenzního CSDH – vlevo (1) šíře 23 mm, vpravo (2) šíře 12 mm, přetlak střední čáry o 14 mm doprava. 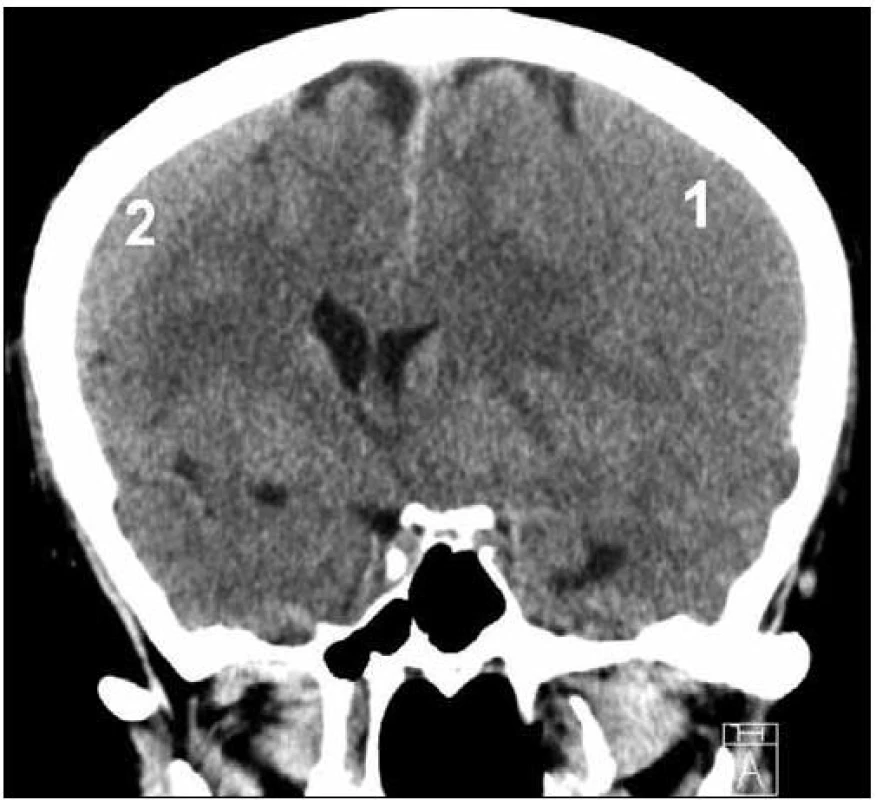
Obr. 2. CT nález levostranného hypodenzního CSDH (3) šíře 26 mm s hyperdenzními septy (šipka), přetlak střední čáry o 14 mm doprava. 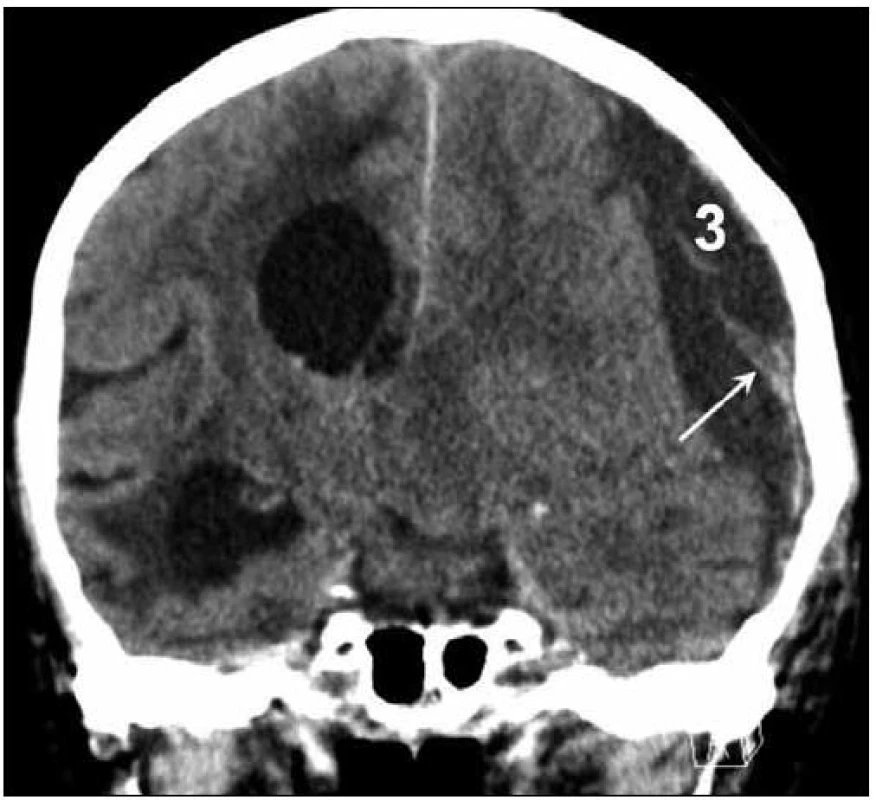
Metodika
Retrospektivní studií byl analyzován soubor 180 pacientů s celkem 201 symptomatickými chronickými subdurálními hematomy operovanými na naší klinice v letech 2005–2010. Do studie nebyly zahrnuty případy akutního zakrvácení do CSDH či subakutní hematomy vyžadující primární otevřený výkon. Statisticky bylo zhodnoceno (pomocí software Statistica 7.0) zastoupení recidiv u pacientů užívajících antikoagulační léčbu, u septovaných nálezů a u pacientů, kterým byl na závěr operace implantován drén.
Indikační kritéria
K evakuaci byly indikovány symptomatické hematomy o šíři větší než 10 mm. Naprostá většina případů byla akutně operována ihned po přijetí do nemocnice. Výjimkou byli pouze pacienti v celkově dobrém stavu, kteří užívali antikoagulační či antiagregační léčbu. Ti byli nejdříve sledováni za hospitalizace minimálně pět dní se zajištěním nízkomolekulárním heparinem, následně bylo provedeno kontrolní CT. V případě stacionárního stavu či progrese velikosti byl hematom evakuován.
Operační technika
Operace byla u naprosté většiny pacientů provedena v analgosedaci, zatímco celková anestezie byla po domluvě s anesteziologem aplikována jen při poruše vědomí či vedlejších onemocněních, které by mohly ovlivnit průběh výkonu (např. známá těžší kardiologická anamnéza). Pacienti byli operováni vleže na zádech s hlavou vytočenou tak, aby centrum hematomu bylo nejvyšším bodem. Zde, nejčastěji temporoparietálně cca 5 cm nad uchem, byl proveden vertikální řez délky cca 4 cm. Následoval návrt lebky, během vrtání hlavu přidržoval asistent. V typických případech začala po durotomii pod tlakem stříkat hnědočerná řídká tekutina. Pak byla provedena laváž subdurálního prostoru pomocí jemné ohebné cévky (originálně určená pro výživu novorozence), která byla šetrně zaváděna do všech směrů. Vyplachování probíhalo vždy až do odbarvení vytékající tekutiny. V případech, kdy zůstal subdurální prostor volný a mozek nereexpandoval, byla cévka ponechána in situ, druhý konec byl vyveden mimo operační ránu a napojen jako drén bez podtlaku ke sběrnému vaku.
Pooperační péče
Pacienti byli po operaci v naprosté většině sledováni na standardním lůžku. Kontrolní CT byla standardně provedena u pacientů v dobrém stavu třetí pooperační den k vyloučení intrakraniální komplikace. Další kontrola proběhla vždy za týden. Drén, pokud byl použit, byl odstraněn druhý pooperační den. Stehy byly ponechány sedm dní. Při celkově dobrém stavu i CT nálezu byl pacient propuštěn do domácí péče, při přetrvávání rezidua 5–10 mm nebo při vyšším věku a dalších komorbiditách byli pacienti přeloženi na spádovou neurologii či internu. Další CT kontrola byla v těchto případech za 10–14 dní, poté za měsíc. Poslední klinická kontrola proběhla za půl roku.
Výsledky
Bylo operováno 201 symptomatických hematomů širších než 10 mm u 180 pacientů – 131 mužů – 72,4 %; průměrný věk 68,7 let (25–89) a 50 žen – 27,6 %; průměrný věk 69,2 let (26–96). Sedmdesát nálezů bylo vlevo, 89 vpravo (celkem 88,4 %) a 21 oboustranně (11,6 %). Symptomy byly velmi různorodé – jak nespecifické (bolest hlavy, závratě, nechutenství, zvracení, porucha chůze, dezorientace až demence), které se samy o sobě vyskytly u 27 % jednostranných a 38 % oboustranných CSDH, tak i specifické, resp. těžké (paréza či hemiparéza, anizokorie, epileptický záchvat, poruchy vědomí), jež se projevily u 73 % jednostranných a 62 % oboustranných hematomů, ať už samostatně, či v kombinaci s nespecifickými (tab. 1). Toto rozdělení má klinický význam, neboť 64 % pacientů s nespecifickými příznaky bylo nejdříve hospitalizováno na interně, neurologii či psychiatrii s tím, že CT bylo provedeno až při nezlepšení stavu a vyčerpání jiných diagnostických možností. Naopak všichni pacienti se specifickými symptomy byli diagnostikováni ihned po prvním kontaktu s lékařem. Anamnézu úrazu hlavy udávalo 59 % pacientů. Průměrná šíře unilaterálních hematomů byla 18 mm (10–36) a přetlak 10 mm (4–22), u bilaterálních byla šíře většího CSDH 19 mm (13–36) a menšího 12,8 mm (9–18), střední čára byla posunuta o 9,2 mm (3–18). Celková délka hospitalizace (včetně následné péče) byla průměrně 14,3 dní (9–47). Antikoagulační či antiagregační terapii užívalo předoperačně 34 pacientů (18,8 %), pouze u sedmi z nich došlo k recidivě. Statisticky nebyla prokázána vyšší tendence k recidivám u těchto pacientů (p = 0,5696). Celkově bylo reevakuováno 30 hematomů (14,9 %), 26 dvakrát a 4 třikrát. Nebyl zaznamenán statisticky signifikantní rozdíl v četnosti recidiv u pacientů s implantovaným drénem oproti případům bez drénu (p = 0,3025). 80 % recidiv (20 dvojnásobně a všechny trojnásobně evakuované CSDH) bylo způsobeno přítomností sept. Ta byla na prvním CT přítomna celkem u 41 hematomů (20,4 %), vyjma tří pacientů se však vždy podařila evakuace bez nutnosti provedení kraniotomie. Přítomná septa jednoznačně zvyšovala riziko neúspěchu první operace (p < 0,001). U výše uvedených tří případů (1,5 %) byly i opakované pokusy o evakuaci neúspěšné a při otevřené operaci byl nalezen organizovaný CSDH. Časná pooperační morbidita se vyskytla u šesti pacientů (3,3 %) – 2× infekce v ráně u opakovaně operovaných pacientů, 1× epileptický záchvat způsobený drénem a 2× drobný intracerebrální hematom způsobený malpozicí drénu (řešen konzervativně). Jedna pacientka (86 let) zemřela tři dny po výkonu na respirační selhání, časná pooperační mortalita tedy činí 0,5 %. Jednoměsíční follow-up (klinická kontrola či telefonická konzultace s jiným pracovištěm) byl dosažen u 174 pacientů (96,6 %), v tomto období zemřeli dva muži na kardiorespirační selhání a jeden na generalizovaný maligní melanom (1,6 %). Šestiměsíční follow-up se zdařil u 128 pacientů (71,1 %), zemřelo dalších osm pacientů (6,25 %) – 3× kardiorespirační, 1× hepatální a 1× renální selhání a 1× karcinom plic. Průměrný věk devíti zemřelých byl 74,6 let. Žádný ze sledovaných pacientů nebyl opakovaně ošetřen pro intrakraniální krvácení.
Tab. 1. Klinické příznaky u pacientů s CSDH. 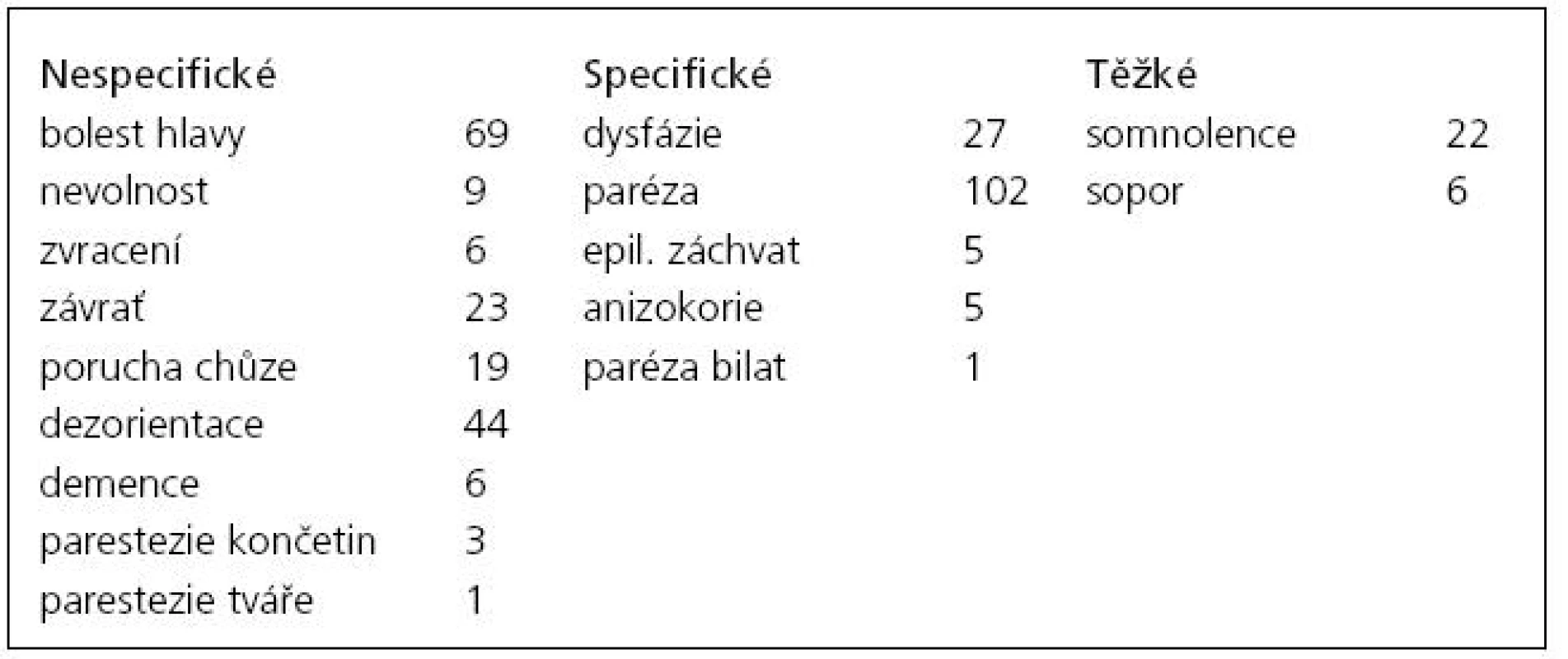
Diskuze
Dle největší souhrnné publikace Weigela et al je nejčastější metodou evakuace hematomu návrt, případně drobná kraniotomie do průměru 30 mm (v anglosaské literatuře označovaná jako burr-hole craniostomy), častá je rovněž drobná trepanace z návrtu lebky do 5 mm (twist drill craniostomy), velká kraniotomie je v případě první operace zřetelně kolikvovaného hematomu již dnes kontraindikována pro až 4krát vyšší morbiditu oproti předchozím metodám (12,3 % ku 3–3,8 %). Využívá se zejména při neúspěchu ostatních postupů. Jednotlivé metody nevykazují významné odchylky v úmrtnosti během hospitalizace, která se pohybuje od 5 do 13 %. V našem souboru však dosahuje pouze cca 2 %. Procento recidiv v naprosté většině souborů narůstá s použitím menšího přístupu – od průměrných 10,8 % u velkých kraniotomií, přes 12,1 % u malých kraniotomií po 18 % u návrtů [4]. Výjimkou je studie 193 pacientů Mondorfa et al se 14,3% četností recidiv u pacientů po návrtu v kontrastu s 27,8% po kraniotomii [11]. Procento recidiv v naší skupině se podobá výsledkům zahraničních studií (14,9 %). Po odtoku hematomu je možno přistoupit k proplachování subdurálního prostoru Ringerovým roztokem. To se obvykle provádí během výkonu do odbarvení vytékající tekutiny nebo kontinuálně pomocí vstupního a výstupního drénu po operaci. Laváž snižuje riziko recidivy zejména v případě nejmenších přístupů [4]. Subdurální prostor lze během výkonu proplachovat z jediného návrtu nebo je možno irigovat tekutinu jedním otvorem a nechat ji vytékat druhým. Výhody tohoto invazivnějšího postupu však nejsou jednoznačné – nemusí mít žádný benefit [12], nebo naopak může vést k až 6krát nižšímu riziku recidiv oproti jednoduchému přístupu [13]. Obecně lze na závěr možno ponechat drén, který taktéž může snížit riziko recidivy zejména tím, že redukuje pooperační pneumocefalus, zejména je-li zaveden do frontální oblasti. Ten totiž působí expanzivně na vnitřní membránu hematomu, což nejen zabraňuje reexpanzi mozkové tkáně a přiblížení vnitřní a zevní membrány jako faktoru nezbytného k uzavření dutiny hematomu a jeho vyléčení, ale způsobuje i tlakovou nerovnováhu na membráně, která může vést k recidivě. Při jeho použití nebyla prokázána vyšší četnost komplikací [4,7,14]. Poslední randomizovaná studie Santariuse et al týkající se účelnosti zavedení drénu po návrtu byla záhy ukončena pro jeho jednoznačnou výhodnost, přičemž vedl k téměř 3krát nižší rekurenci (9,3 ku 24 %) a více než 2krát nižší šestiměsíční mortalitě (8,6 ku 18,1 %) [14]. Naše studie toto nepotvrdila, nelze ji však s randomizovanými studiemi porovnávat – drén jsme ponechávali typicky u těch největších či septovaných nálezů (kdy mozek po dekompresi neexpandoval), kde se vyšší riziko recidivy dá předpokládat. Studie Horna et al a Gökmena et al v rámci hledání nejméně invazivních metod dokazují srovnatelné výsledky při využití návrtu a velmi drobné kraniotomie s laváží a zavedením drénu. Zásadní výhodou menších přístupů je možnost operování v lokální anestezii [3,15]. Zajímavá je práce Abouzariho et al, která prokazuje asi osminásobně nižší riziko recidivy po návrtu s použitím drénu, pokud je pacient tři dny po operaci v horizontální poloze a neposazuje se (2,3 ku 19 %) [16]. Cílem všech uvedených metod je evakuace co největšího objemu subdurální tekutiny, jež obsahuje fibrinolytické látky, které jsou vedle opakovaných krvácení z pouzdra odpovědné za růst hematomu [17,18]. Komplikací výše popsaného klasického průběhu je přítomnost sept v hematomu projevující se na CT jako hyperdenzní linie mezi hypodenzními okrsky. Ta znemožňují odtok veškeré tekutiny po trepanaci. To bývá příčinou naprosté většiny recidiv po evakuaci z prosté či rozšířené trepanace, jejichž četnost dosahuje 3–37 % [4]. Nutná je tedy reoperace, často z velké kraniotomie, jež prodlužuje celkovou dobu hospitalizace. Při otevřeném výkonu je možno odstranit zevní část pouzdra, vždy však musí být ušetřen vnitřní list naléhající pevně na mozek. I přes tento radikálnější postup je nutno počítat s recidivou až ve čtvrtině případů [17].
Závěr
Chronický subdurální hematom je časté onemocnění, na které je třeba myslet zejména u pacientů ve vyšším věku při rychlém rozvoji příznaků demence či nitrolební hypertenze. CT je nejlepší možné vyšetření, záludné může být hodnocení izodenzního hematomu, který méně zkušený lékař může mylně považovat za edém mozku, zejména je-li oboustranný a chybí přetlak středočárových struktur. Symptomatický hematom vyžaduje vždy urgentní výkon, standardizovaným postupem je evakuace z miniinvazivního přístupu. Pacienti musí být pooperačně dlouhodobě sledováni pro riziko opětovného krvácení, jež hrozí hlavně u septovaných nálezů. Stav je dobře chirurgicky řešitelný a má dobrou prognózu.
MUDr. Radek Kaiser
Neurochirurgická klinika
3. LF UK a FN Královské Vinohrady
Šrobárova 50
100 34 Praha 10
e-mail: kaiser@fnkv.czPřijato k recenzi: 31. 1. 2011
Přijato do tisku: 9. 3. 2011Výsledky práce vznikly za podpory výzkumného záměru MSM 0021620816.
Zdroje
1. Crooks DA. Pathogenesis and biomechanics of traumatic intracranial haemorrhages. Virchows Arch A Pathol Anat Histopathol 1991; 418(6): 479–483.
2. Häckel M, Benes V jr. Diagnosis and therapy of chronic subdural hematoma. Rozhl Chir 1993; 72(3): 118–123.
3. Horn EM, Feiz-Erfan I, Bristol RE, Spetzler RF, Harrington TR. Bedside twist drill craniostomy for chronic subdural hematoma: a comparative study. Surg Neurol 2006; 65(2): 150–153.
4. Weigel R, Schmiedek P, Krauss JK. Outcome of contemporary surgery for chronic subdural haematoma: evidence based review. J Neurol Neurosurg Psychiatry 2003; 74(7): 937–943.
5. Tsai TH, Lieu AS, Hwang SL, Huang TY, Hwang YF. A comparative study of the patients with bilateral or unilateral chronic subdural hematoma: precipitating factors and postoperative outcomes. J Trauma 2010; 68(3): 571–575.
6. Houdek M, Kala M, Heřman M. Interhemispheric subdural haematoma. Cesk Slov Neurol N 1996; 59/93(6): 338–340
7. Nakaguchi H, Tanishima T, Yoshimasu N. Factors in the natural history of chronic subdural hematomas that influence their postoperative recurrence. J Neurosurg 2001; 95(2): 256–262.
8. Senturk S, Guzel A, Bilici A, Takmaz I, Guzel E, Aluclu MU, Ceviz A. CT and MR imaging of chronic subdural hematomas: a comparative study. Swiss Med Wkly 2010; 140(23–24): 335–340.
9. Markwalder TM, Reulen HJ. Influence of neomembranous organisation, cortical expansion and subdural pressure on the post-operative course of chronic subdural haematoma – an analysis of 201 cases. Acta Neurochir (Wien) 1986; 79(2–4): 100–106.
10. Virchow R. Das Hämatom der Dura Mater. Verh Phys Med Ges Würzburg 1857; 7 : 134–142.
11. Mondorf Y, Abu-Owaimer M, Gaab MR, Oertel JM. Chronic subdural hematoma-craniotomy versus burr hole trepanation. Br J Neurosurg 2009; 23(6): 612–616.
12. Kansal R, Nadkarni T, Goel A. Single versus double burr hole drainage of chronic subdural hematomas. A study of 267 cases. J Clin Neurosci 2010; 17(4): 428–429.
13. Taussky P, Fandino J, Landolt H. Number of burr holes as independent predictor of postoperative recurrence in chronic subdural haematoma. Br J Neurosurg 2008; 22(2): 279–282.
14. Santarius T, Kirkpatrick PJ, Ganesan D, Chia HL, Jalloh I, Smielewski P et al. Use of drains versus no drains after burr-hole evacuation of chronic subdural haematoma: a randomised controlled trial. Lancet 2009; 374(9695): 1067–1073.
15. Gökmen M, Sucu HK, Ergin A, Gökmen A, Bezircio Lu H. Randomized comparative study of burr-hole craniostomy versus twist drill craniostomy; surgical management of unilateral hemispheric chronic subdural hematomas. Zentralbl Neurochir 2008; 69(3): 129–133.
16. Abouzari M, Rashidi A, Rezaii J, Esfandiari K, Asadollahi M, Aleali H et al. The role of postoperative patient posture in the recurrence of traumatic chronic subdural hematoma after burr-hole surgery. Neurosurgery 2007; 61(4): 794–797.
17. Lee JY, Ebel H, Ernestus RI, Klug N. Various surgical treatments of chronic subdural hematoma and outcome in 172 patients: is membranectomy necessary? Surg Neurol 2004; 61(6): 523–527.
18. Vaverka M, Kala M. Zkušenosti s léčbou chronického subdurálního hematomu dospělých. Cesk Slov Neurol N 1993; 56/89(4): 155–159.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článek Webové okénko
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2011 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Kognitivní evokované potenciály
- Vyšetření očních pohybů v neurologické praxi
- Agregometrie v sekundární prevenci cévních mozkových příhod. Aspirinová rezistence
- Vývojová porucha koordinace – vývojová dyspraxie
- „Awake“ resekcia supratentoriálnych low-grade gliómov lokalizovaných vo vnútri alebo v priamom kontakte s elokventnými oblasťami
- Jaroslav Opavský. Bolest v ambulantní praxi
- Kognitivní dysfunkce u pacientů s klinickým izolovaným syndromem a roztroušenou sklerózou
- Zkušenosti s evakuací chronického subdurálního hematomu z návrtu kalvy
- Prevence žilní trombózy a plicní embolizace v neurochirurgii
- Kvalita života po hluboké mozkové stimulaci u pacientů s pokročilou Parkinsonovou nemocí
- Hereditární časná forma Alzheimerovy nemoci v důsledku zárodečné mutace p.M139V v genu PSEN1 – kazuistika
- Oboustranná ischemická retinopatie a neuropatie optiku jako izolovaný oční projev vysokohorské nemoci – kazuistika
- Progredující spasticita, kognitivní deficit a nevýbavné kortikální motorické evokované potenciály jako klinické příznaky pravděpodobné primární laterální sklerózy – kazuistika
- Kalcifikující pseudoneoplazma nervového systému – tři kazuistiky
- Vysoké štátne vyznamenanie prof. Danielovi Bartkovi
- Přímý inhibitor trombinu dabigatran etexilát schválen v Evropě pro prevenci cévních mozkových příhod u pacientů s fibrilací síní
- Webové okénko
- Analýza dat v neurologii XXIX. - Spolehlivost (reliabilita) klinických testů
- 7. olomoucké neuroimunologické sympozium s mezinárodní účastí - Olomouc, 22.–23. září 2011
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Vývojová porucha koordinace – vývojová dyspraxie
- Kognitivní evokované potenciály
- Progredující spasticita, kognitivní deficit a nevýbavné kortikální motorické evokované potenciály jako klinické příznaky pravděpodobné primární laterální sklerózy – kazuistika
- Zkušenosti s evakuací chronického subdurálního hematomu z návrtu kalvy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



