-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Motorické aspekty poruch řeči u Parkinsonovy nemoci a jejich hodnocení
Motor Aspects of Speech Imparment in Parkinson‘s Disease and their Assessment
Patients with Parkinson’s disease (PD) often suffer from hypokinetic dysarthria (HD) involving impairment of phonation, articulation, prosody and speech fluency. Our paper focuses on parameters used to evaluate motor aspects of speech and on methods of relevant data collection and analysis. An overview of specific parameters of HD and methods used for its evaluation may facilitate development of a diagnostic system for HD and of suitable measures for the assessment of its progression.
Key words:
Parkinson’s disease – hypokinetic dysarthria – speech parameters
Autori: J. Mekyska 1; Z. Smékal 1; M. Košťálová 3,4; M. Mračková 2,3; S. Skutilová 4; I. Rektorová 2,3
Pôsobisko autorov: SPLab, Ústav telekomunikací, FEKT VUT v Brně 1; I. neurologická klinika LF MU a FN u sv. Anny v Brně 2; CEITEC MU, Brno 3; Neurologická klinika LF MU a FN Brno 4
Vyšlo v časopise: Cesk Slov Neurol N 2011; 74/107(6): 662-668
Kategória: Přehledný referát
Súhrn
U pacientů s Parkinsonovou nemocí (PN) se zpravidla vyskytuje hypokinetická dysartrie (HD), projevující se v oblasti fonace, artikulace, prozodie a plynulosti řeči. Naše práce se zabývá parametry, které se využívají při hodnocení motorických aspektů řeči, a metodami, pomocí nichž je možné tyto parametry získat a analyzovat. Přehled specifických parametrů HD a metod jejich hodnocení může prakticky přispět k vytvoření diagnostického systému, který by byl schopen HD u PN jednak rozpoznávat a jednak sledovat vývoj její progrese.
Klíčová slova:
Parkinsonova nemoc – hypokinetická dysartrie – parametry řečiÚvod
Parkinsonova nemoc byla poprvé popsána v roce 1817 Jamesem Parkinsonem v práci s názvem „An Essay on the Shaking Palsy“ [1]. Toto neurodegenerativní onemocnění mozku se vyznačuje zejména progresivním úbytkem dopaminergních neuronů, především v oblasti substancia nigra pars compacta, ale i v dalších oblastech mozku [2–5]. Kromě deficitu dopaminu dochází k progresivním deficitům i v dalších neurotransmiterových systémech. Parkinsonský syndrom je ovšem převážně, i když ne výlučně, zapříčiněn poruchou dopaminergní inervace striata, jež vede k poruše funkce zpětnovazebních okruhů zvaných extrapyramidový systém. Deficit dopaminu je tak příčinou hlavních parkinsonských symptomů a podkladem léčebného účinku dopaminergní medikace na motorické symptomy PN [3,6,7]. Několik studií dokázalo, že progrese PN není lineární. Na počátku lze sledovat rychlý nástup zejména hybných symptomů, ale v dalších stadiích nejsou změny tak prudké [8,9].
Jedním z častých projevů PN je postižení motorických aspektů řeči, které lze shrnout pod označením hypokinetická dysartrie (HD) [10]. Naše práce shrnuje charakteristické projevy HD u PN a podává přehled parametrů, které by mohly sloužit k popisu a diagnostice HD a ke sledování její progrese.
Řeč pacientů postižených PN
Přibližně 70 % pacientů postižených Parkinsonovou nemocí má problémy s řečí [11]. To je dáno především přítomností HD, která se projevuje v oblastech fonace, artikulace, prozodie, plynulosti řeči a faciokineze. [12–15]. Z hlediska zpracování řečových signálů se práce soustředí zejména na první čtyři zmíněné oblasti.
Fonace
Fonace je zpravidla první oblast, ve které se HD projevuje. Z důvodu ztuhlosti svalstva nepracují hlasivky dokonale, např. nedochází k jejich úplnému uzavření. Navíc je turbulentní proudění z plic charakteristické výrazným kolísáním, což se ve výsledku projevuje hlasovým třesem [7,16,17]. U pacientů postižených PN je možné pozorovat zvýšenou střední hodnotu kmitočtu základního tónu F0, a to jak u promluvy delších větných celků [18–20], tak u promluvy prodloužených vokálů [21]. Metter a Hanson [20] rovněž zjistili, že s prodlužující se dobou postižení tato střední hodnota roste, tudíž tento parametr lze využít k posuzování pokročilosti onemocnění. Kolísání a rozptyl F0, většinou popisovaný pomocí směrodatné odchylky [21–23] nebo jitteru [23–26], nabývá u prodloužených vokálů vyšších hodnot, což je zapříčiněno neschopností udržet hrtanové svaly ve stabilní pozici po delší dobu.
Dále je možné u pacientů pozorovat hypofonii (sníženou intenzitu hlasu) [27] a dysfonii (degradace kvality hlasu – chraptivost, drsnost, které snižují srozumitelnost řeči) [28,29]. Úroveň intenzity řečového signálu je nízká [19,30,31] a v důsledku bradykineze a rigidity rovněž příliš nekolísá, tzn. odpovídající shimmer nabývá malých hodnot [17].
Z hlediska respirace řečníci neefektivně hospodaří s dechem [20,32,33]. Stává se, že pacienti náhle zvyšují či snižují tempo řeči, několikrát opakují počáteční slabiku slov, vytváří pauzy tam, kde by být neměly, na jeden nádech vysloví malý počet slabik atd. Při prudkém uvolnění dechového proudu přes nosní dutinu dochází k hypernazalitě [15,34], což se v modulovém spektru řeči projeví zdůrazněním některých formantových kmitočtů.
Artikulace
Druhou nejčastější narušenou oblastí je artikulace. Porucha je zřejmá zejména při vyslovení konsonant [22,35,36]. Největší problémy [36–38] nastávají zvláště při výslovnosti ploziv [p], [t], [k], [b], [d], [g]. Je to opět dáno nesprávnou prací svalstva účastnícího se na tvorbě řeči, v tomto případě aktivních artikulačních orgánů (rtů, špičky jazyka, středu jazyka, kořene jazyka, hrtanové příklopky a hrtanu). Řeč pak zní nesrozumitelně, nedbale a nepřirozeně.
K hodnocení preciznosti artikulace se často využívají DDK (Diadochokinetic Tasks) úlohy [39–41]. Během těchto úloh vyslovují řečníci opakující se slabiky obsahující kombinaci ploziva – samohláska, např. „pa ta ka pa ta ka pa ta ka …“ [42]. Při vyslovení této řady dochází k rychlým změnám v postavení artikulačních orgánů. V některých případech nejsou pacienti schopni tyto rychlé změny provádět, v jiných případech udržují kadenci na úkor snížené pohyblivosti mluvidel, a tudíž zvýšené nesrozumitelnosti. Správné vyslovení vokálů se odvíjí od objemu hrtanu a dutiny ústní, ve kterých dochází k rezonancím. To je možné měřit pomocí formantových kmitočtů, jež s prostorem v dutinách úzce souvisí [14,16,29,43].
Prozodie
Prozodie řečníka se částečně odvíjí od fonace, jelikož mezi tři základní suprasegmentální rysy patří kmitočet základního tónu, intenzita a tempo řeči. Kromě těchto základních parametrů patří mezi prozodické rysy také např. rytmus, intonace, přízvuk atd. Protože je většina těchto faktorů u pacientů narušena, hovoří se o tzv. dysprozodii [20,27,44–46]. Caekebeke et al [46] zjistili, že pacienti postižení PN příliš v řeči nevyjadřují aktivní emoce, jako např. vztek.
Plynulost řeči
Při HD může dojít k narušení plynulosti řeči. Řečníci mohou vytvářet neúmyslné pauzy (hezitace) nebo během řeči zrychleně opakují slova či jednotlivé slabiky (palilalie) [47–49]. Dále dochází během promluvy k náhlému zpomalení (bradyfemie) nebo zrychlení (tachyfemie) řeči [50].
Parametry využívané při popisu HD u PN
Z hlediska analýzy HD pomocí zpracování řečových signálů se přistoupilo především k parametrům popisujícím prozodii a práci mluvidel (např. hrotu jazyka). Problémem některých prací publikovaných na dané téma je velmi malý počet zařazených subjektů, nesignifikantní výsledky, a tudíž i nejednoznačné a nekonzistentní závěry [49,51–53]. Stává se tak, že různé práce přiřazují stejným parametrům jinou váhu.
Kmitočet základního tónu F0
Jak bylo uvedeno v textu výše, patří mezi tři základní suprasegmentální rysy. Tohoto sledovaného parametru se při diagnóze PN hojně využívá, především pak jeho střední hodnoty mean (F0) a odchylky std (F0). V publikacích [54,55] nepozorovali autoři výrazné rozdíly střední hodnoty F0 mezi pacienty s PN a přibližně stejně starými kontrolními řečníky. Nicméně většina publikací se shoduje na tom, že tato hodnota u pacientů dosahuje výrazně vyšších hodnot [18–20,52,56].
K popisu variability F0 se nejčastěji využívá směrodatná odchylka a jitter. V literatuře [21,22,24,52] bylo zjištěno, že při výslovnosti prodloužených vokálů nabývá směrodatná odchylka vyšších hodnot, nicméně z globálního hlediska, při sledování delších větných úseků, mluví pacienti velmi monotónně, a tudíž tato odchylka oproti zdravým řečníkům klesá [18,20,57–59].
Skodda et al [44] sledovali také parametr (F0 Variation Range), který odpovídá rozdílu maximálních a minimálních hodnot vyskytujících se v promluvě:
F0VR = F0max – F0min [Hz]
Normalizace tohoto parametru spolu se směrodatnou odchylkou vede na výpočet dalších parametrů: relativní kolísání a relativní směrodatnou odchylku. Tyto parametry lze vyjádřit pomocí rovnic:
std(F0)
relF0SD = ------------- - × 100 [%]
mean(F0)F0VR
relF0VR = ------------- - × 100 [%]
mean(F0)Intenzita řečového signálu
Intenzita řeči pacientů postižených PN bývá nižší oproti zdravým řečníkům [30,31,60,61] a také příliš nekolísá [38,52,62]. Pokud jsou řečníci vyzváni k hlasité promluvě, tak jsou schopni na krátkou dobu hlas zesílit, avšak po uplynutí této doby intenzita jejich hlasu opět klesá [63].
Tuto intenzitu je možné z hlediska zpracování signálů vyjádřit pomocí krátkodobé energie nebo prostřednictvím Teagrova energetického operátoru TEO (Teager Energy Operator) [64,65]. Kolísání intenzity je možné vyjádřit využitím směrodatné odchylky nebo shimmeru, který sleduje změnu úrovně signálu v čase (výpočet je podobný jako v případě jitteru). Dále se dá sledovat rozdíl maximální a minimální hodnoty energie ΔE či úrovně ΔA.
Tempo řeči
Jako třetí základní suprasegmentální rys se uvádí tempo řeči. Různé výzkumy se neshodují na tom, zda je tempo u pacientů zvýšené [32,38,66], snížené [67] či se oproti tempu řeči kontrolních řečníků nemění [18,20,68].
Tempo řeči je možné vyjádřit pomocí různých charakteristik zmíněných níže. Než budou popsány, je nutné definovat absolutní trvání řečového signálu TST (Total Speech Time), celkové trvání pauz TPT (Total Pause Time) a trvání čistě řečového signálu NST (Net Speech Time). Uvažujme, že TST je trvání řeči, která obsahuje i tiché, např. mezislovní, pauzy. TPT je celková délka pauz delší než 10 ms. NST pak odpovídá rozdílu TST – TPT [44,53].
- Absolutní tempo TSR (Total Speech Rate) [44] – poměr celkového počtu slabik vyskytujících se v řeči a TST (vyjádřeno ve slabikách za sekundu).
- Tempo čistě řečového signálu NSR (Net Speech Rate) [44,53] – poměr celkového počtu slabik vyskytujících se v řeči a NST (vyjádřeno ve slabikách za sekundu).
- Artikulační rychlost AR (Articulation Rate) [16,69] – podobné jako NSR, nicméně v tomto případě jsou pauzy delší než 50 ms.
Tvorba pauz
Změny jako neúmyslné přerušování řeči či prodlužování pauz lze sledovat pomocí následujících parametrů:
- Procentuální poměr pauz PPR (Percentual Pause Ratio) [16,44,53,69] – tento parametr lze vypočítat na základě vztahu PPR = TPT/TST (%).
- Procentuální poměr pauz nacházejících se uvnitř slov RIWP (Ratio of Intra-Word Pauses) [44,53] – hodnota je rovna podílu TIPT/TPT (%), kde TIPT (Total Intra-Word Pause Time) udává celkovou délku pauz uvnitř víceslabičných slov. Tento parametr vyjadřuje preciznost artikulace ploziv.
- Doba mezi pauzami ISD (Interpause Speech Duration) [42] – vyjadřuje se v sekundách.
- Index rytmicity SPIR (Speech Index of Rhytmicity) [42] – v tomto parametru se jistým způsobem odráží rytmus řeči. Hodnota odpovídá počtu mezislovních pauz za minutu.
Formantové kmitočty
Během průchodu turbulentního proudění hlasovým traktem dochází v hrtanu, dutině ústní a nosní k rezonancím. Kmitočty, na kterých k těmto rezonancím dochází, se nazývají formanty (F1, F2, F3…). Hodnoty formantů a odpovídající prostor v dutinách ovlivňují svou polohou mluvidla. Díky tomu je pomocí formantu např. možné sledovat hybnost jazyka [70]. Hillenbrand et al [71] zjistili, že první dva formanty F1 a F2 jsou parametry, které nejvíce vypovídají o produkci vokálů. Proto se, spolu s charakteristikami z nich odvozenými, často používají k popisu řeči pacientů postižených PN.
Normalizované formantové kmitočty
Nevýhodou formantových kmitočtů je, že jsou silně závislé na věku a pohlaví. Sapir et al [72] používali poměr:
F2i
------
F2u(odpovídající hláskám [i] a [u]), u kterého dokázali, že je schopen robustně odlišit zdravou řeč od řeči postižené HD, a navíc bez závislosti na pohlaví.
Vokální oblast hlasového traktu
Pomocí formantových kmitočtů je možné vyjádřit míru pohybu jazyka. Na tomto principu je založen příznak VSA (Vowel Space Area) [43,69,73,74]. Postup výpočtu znázorňuje obr. 1. Nejdříve se z řeči extrahují vokály [a], [e], [i], [o], [u] a následně se odhadnou jejich první dva formanty F1, F2. Hodnoty se zanesou do grafu, což vytvoří pětiúhelník, jehož obsah odpovídá parametru VSA. Někdy je možné použít také příznak lnVSA, který se počítá podobně jako VSA, nicméně hodnoty všech formantů se před výpočtem zlogaritmují [43]. U pacientů postižených PN se předpokládá snížená hybnost jazyka, tudíž i VSA či lnVSA by mělo oproti kontrolním řečníkům dosahovat nižších hodnot [52,69].
Obr. 1. Vokální oblast mužského hlasového traktu. 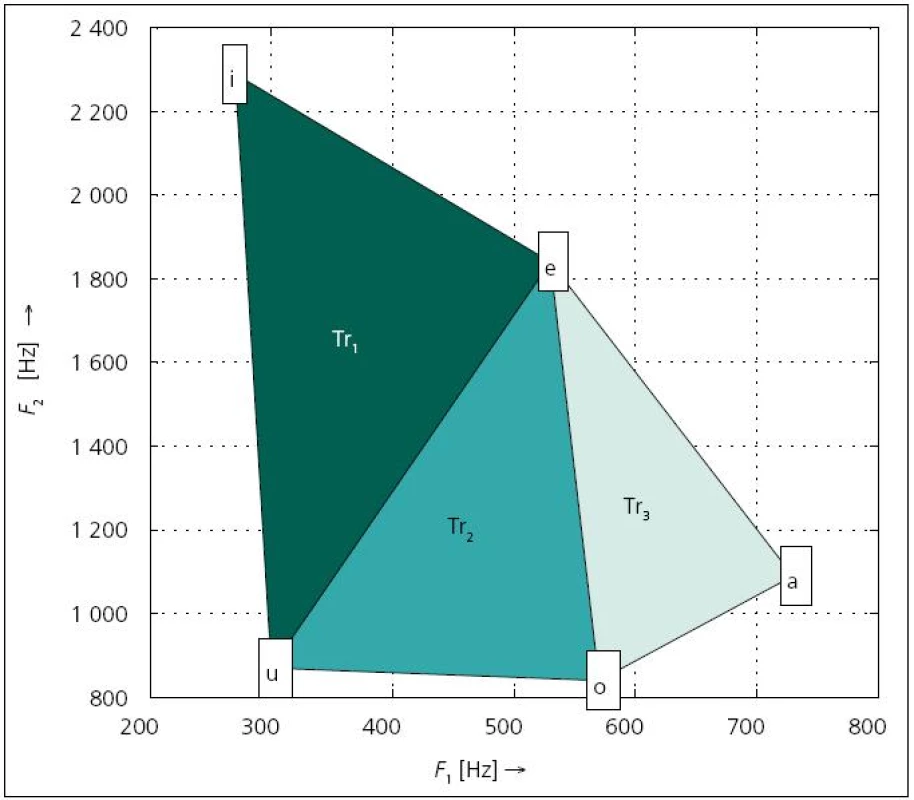
Artikulační index samohlásek a centralizační poměr formantů
Pomocí VSA jsme sice schopni dobře sledovat pohyb jazyka, avšak tato oblast je opět velmi závislá na věku a pohlaví [43]. K vytvoření robustního příznaku je nutné znovu zavést určitou normalizaci, která by tyto rozdíly potlačila. Z tohoto důvodu navrhli Skodda et al [53] artikulační index samohlásek VAI (Vowel Articulation Index) a Sapir et al [43] centralizační poměr formantů FCR (Formant Centralization Ratio). FCR je možné vyjádřit podílem:
F2u + F2a + F1i + F1u
FCR = ------------------------------
F2i + F1aJak je z rovnice patrné, normalizace je zde provedena dělením součtem formantů F2i a F1a. V případě příznaku VAI se jedná pouze o převrácenou hodnotu FCR [53].
Doba navození řeči
Doba navození řeči VOT (Voice Onset Time) je příznak, který je v [75,76] definován jako doba mezi prvním zákmitem plozivy a začátkem vokálu (obr. 2). Tato doba se liší v závislosti na druhu této plozivy. Autor [76] uvádí, že v případě bilabiálních souhlásek ([b], [p] – rty se před uvolněním dechového proudu dotýkají) je VOT nejkratší (okolo 25 ms), v případě alveolárních ([d], [t] – hrot jazyka se dotýká přední části dásňového výstupku) středně dlouhé a v případě velárních souhlásek ([g], [k] – kontakt hřbetu jazyka s měkkým patrem) dosahuje VOT nejvyšších hodnot (až 100 ms).
Obr. 2. VOT při kombinaci hlásek [p] – [a] (<em>ƒ</em><sub>VZ</sub> = 48 kHz). ![VOT při kombinaci hlásek [p] – [a] (<em>ƒ</em><sub>VZ</sub> = 48 kHz).](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/ba9d69f2a9169cd7646358cb6ad00ed0.jpeg)
VOT se rovněž nabízí k popisu řeči postižené HD, nicméně publikace se různí v tom, jaké hodnoty by mělo VOT, vzhledem ke kontrolním řečníkům, dosahovat. Např. autoři Flint et al a Weismer [59,77] zjistili, že u pacientů lze očekávat snížené VOT. Naopak Forrest et al a Ozsancak et al [78,79] se shodují na tom, že by VOT mělo být vyšší. Nakonec Bunton et al [80] udávají, že HD nemá na VOT vliv. V dalších publikacích [81,82] byla tato inkonzistence vysvětlována závislostí VOT na tempu. Proto Fischer a Goberman [51] navrhli normalizovaný VOT jako podíl absolutního VOT a doby trvání slova, u kterého se VOT měří. V práci však přišli na to, že spíš než na tempu je VOT závislé na vertikální poloze jazyka.
Ukončení a navození fonace
Tato poslední charakteristika popisuje změnu kmitočtu základního tónu F0 na konci a začátku znělého úseku řeči POPO (Phonatory Offset and Phonatory Onset). Bylo zjištěno [36,56,83,84], že pacienti mají problémy znělý úsek náhle ukončit. Naopak započetí znělého úseku není příliš odlišné od kontrolních řečníků [84]. Oblast ukončení fonace [84] se označuje jako oblast čítající posledních 10 hlasivkových pulzů ve znělém úseku (obr. 3). Jestliže se perioda mezi prvním a druhým zákmitem označí jako T01, pak její převrácená hodnota odpovídá F01. Podobně pak lze vyjádřit F02 (odpovídá periodě mezi druhým a třetím pulzem),…, F09. Stejným způsobem se pak analyzuje 10 hlasivkových pulzů na začátku znělého úseku (v tomto případě se pouze jako první pulz označuje ten, který je poslední v řadě).
Obr. 3. Ukázka hlasivkových pulzů v oblasti ukončení (zelené kruhy) a navození (černé kruhy) fonace (<em>ƒ</em><sub>VZ</sub> = 48 kHz, část věty „…trpělivý, než…“). 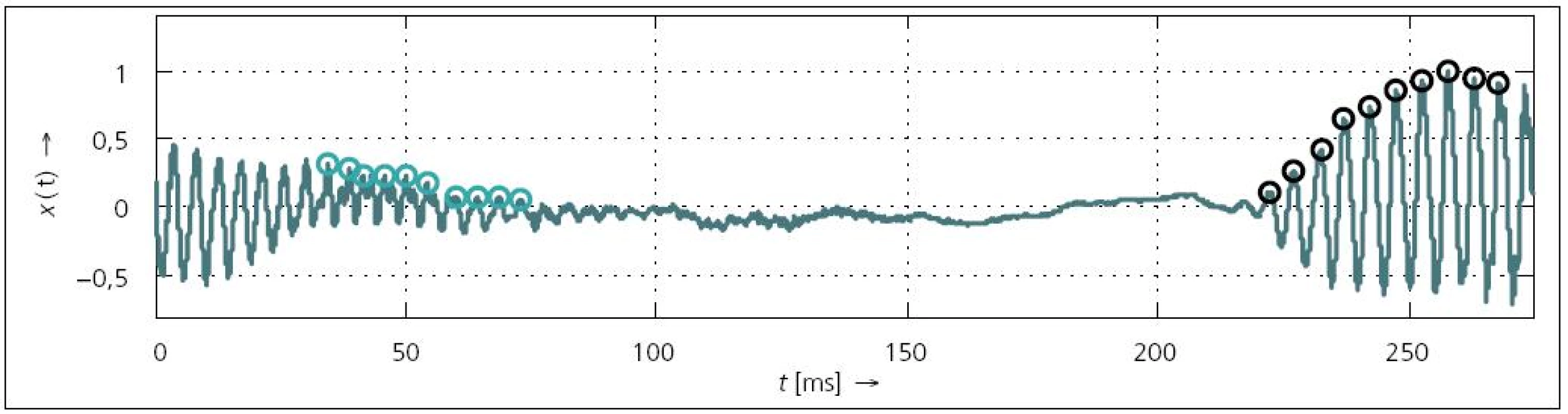
Aby se mohly sledovat změny mezi těmito kmitočty, vyjádří se F02 – F09 pomocí půltónů ST (Semitone) na základě vztahu:
Během analýzy se potom sleduje dynamika změny těchto kmitočtů.
Přehled používaných parametrů
Pro lepší přehled jsou v tab. 1 uvedeny všechny sledované parametry, kterými se tato práce zabývala. Podrobnější informace o těchto parametrech je možné dohledat v citované literatuře, doporučujeme zejména článek Alexandra M. Gobermana [7].
Tab. 1. Přehled parametrů používaných k popisu Parkinsonovy nemoci. 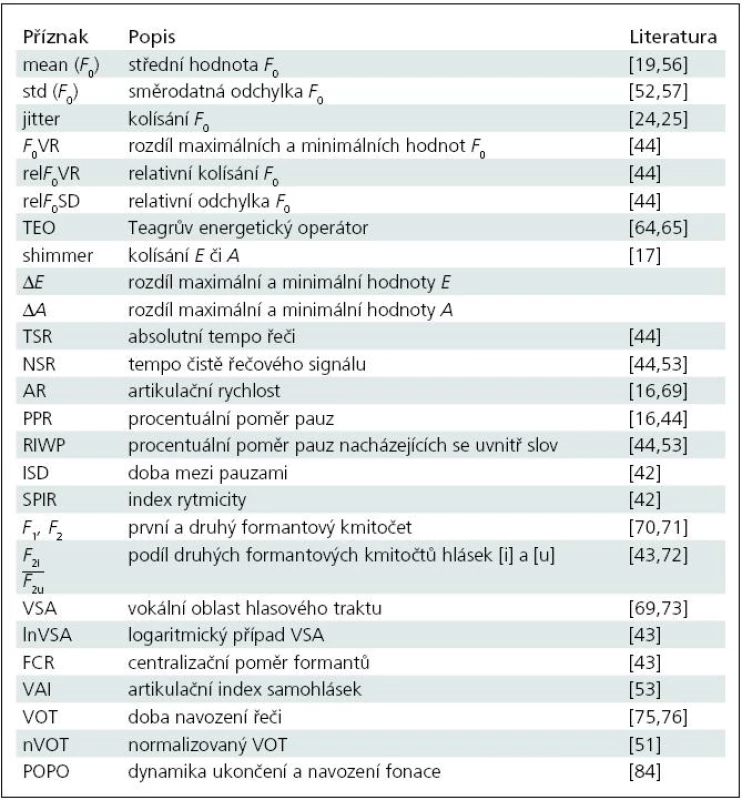
Závěr
Tato práce se zabývá charakteristikami, které se používají k popisu postižení řeči HD. Jsou zde uvedeny oblasti, v nichž se HD projevuje a dále parametry, pomocí kterých je možné míru postižení určitým způsobem kvantifikovat.
Řečové parametry je možné rozdělit na dvě třídy, a sice na parametry, které by bylo možné použít k diagnóze HD, a parametry, které by sloužily ke sledování míry progrese tohoto postižení. K účelům diagnózy se v této práci doporučuje používat parametry, jež jsou schopny signifikantně diferencovat skupinu zdravých a nemocných řečníků. Na základě studované literatury to jsou parametry popisující tvorbu pauz (např. PPR, RIWP či SPIR) a parametry odvozené z formantových kmitočtů
F2i
(---- - lnVSA, FCR).
F2uZ hlediska pozorování progrese doporučujeme využívat parametry založené na změně kmitočtu základního tónu (std(F0), jitter, relF0SD), na tempu řeči (NSR, AR) a popř. na dynamice ukončení a navození fonace (POPO).
Parametry odvozené z energie řečového signálu nedoporučejeme používat k diagnóze ani sledování progrese, jelikož jsou velmi závislé na kalibraci použitého mikrofonu. V případě žádné či nepřesné kalibrace jsou řečové parametry z intenzitního hlediska zkresleny. Také není zatím zcela jasné, zda je výhodné použít parametr VOT, protože se literatura v názoru na očekávanou hodnotu u pacientů různí. Tyto nekonzistentní názory jsou však většinou zapříčiněny testovací množinou čítající nízký počet řečníků.
Poděkování
Tato práce byla podpořena projektem KONTAKT ME 10123 (Výzkum algoritmů pro zpracování digitálních obrazů a obrazových sekvencí), projektem VG20102014033 a výzkumnými záměry CZ.1.05/2.1.00/03.0072 a MŠM 0021622404.
doc. MUDr. Irena Rektorová, Ph.D.
I. neurologická klinika LF MU
a FN u sv. Anny v Brně
Pekařská 53
656 91 Brno
e-mail: irena.rektorova@fnusa.cz
Přijato k recenzi: 22. 4. 2011
Přijato do tisku: 2. 5. 2011
Zdroje
1. Parkinson J. An essay on the shaking palsy. J Neuropsychiatry Clin Neurosci 2002; 14(2): 223–236.
2. Hornykiewicz O. Biochemical aspects of Parkinson‘s disease. Neurology 1998; 51 (Suppl 2): S2–S9.
3. Brodal P. The Central Nervous System: Structure and Function. 3rd ed. New York: Oxford University Press 2003.
4. Kent RD, Kent JF, Duffy J, Weismer G. The dysarthrias: speech-voice profiles, related dysfunctions, and neuropathology. J Med Speech Lang Pathol 1998; 6(4): 165–211.
5. Lang AE, Lozano AM. Parkinson‘s disease. First of two parts. N Engl J Med 1998; 339(15): 1044–1053.
6. Hoehn MM, Yahr MD. Parkinsonism: onset, progression, and mortality. Neurology 1967; 17 (Suppl 3): 427–442.
7. Goberman AM, Coelho C. Acoustic analysis of parkinsonian speech I: speech characteristics and L-Dopa therapy. NeuroRehabilitation 2002; 17(3): 237–246.
8. Jankovic J, Kapadia AS. Functional decline in Parkinson disease. Arch Neurol 2001; 58(10): 1611–1615.
9. Hilker R, Schweitzer K, Coburger S, Ghaemi M, Weisenbach S, Jacobs A et al. Nonlinear progression of Parkinson disease as determined by serial positron emission tomographic imaging of striatal fluorodopa F 18 activity. Arch Neurol 2005; 62(3): 378–382.
10. Rektorová I. Současné možnosti diagnostiky a terapie Parkinsonovy nemoci. Neurol. prax 2009; 10 (Suppl 2): 5–36.
11. Hartelius L, Svensson P. Speech and swallowing symptoms associated with Parkinson‘s disease and multiple sclerosis: a survey. Folia Phoniatr Logop 1994; 46(1): 9–17.
12. Hammen VL, Yorkston KM. Speech and pause characteristics following speech rate reduction in hypokinetic dysarthria. J Commun Disord 1996; 29(6): 429–445.
13. Goberman AM, McMillan J. Relative speech timing in Parkinson’s disease. Commun Science Disord 2005; 32 : 22–29.
14. Sapir S, Ramig L, Fox C. Speech, swallowing disorders in Parkinson disease. Curr Opin Otolaryngol Head Neck Surg 2008; 16(3): 205–210.
15. Spencer KA, Rogers MA. Speech motor programming in hypokinetic and ataxic dysarthria. Brain Lang 2005; 94(3): 347–366.
16. Goberman AM. Correlation between acoustic speech characteristics and non-speech motor performance in Parkinson disease. Med Sci Monit 2005; 11(3): 109–116.
17. Shao J, Maccallum JK, Zhang Y, Sprecher A, Jiang JJ. Acoustic analysis of the tremulous voice: assessing the utility of the correlation dimension and perturbation parameters. J Commun Disord 2010; 43(1): 35–44.
18. Canter GJ. Speech characteristics of patients with Parkinson‘s disease: I. intensity, pitch, and duration.J Speech Hear Disord 1963; 28(3): 221–29.
19. Holmes RJ, Oates JM, Phyland DJ, Hughes AJ. Voice characteristics in the progression of Parkinson‘s disease. Int J Lang Commun Disord 2000; 35(3): 407–418.
20. Metter EJ, Hanson WR. Clinical and acoustical variability in hypokinetic dysarthria. J Commun Disord 1986; 19(5): 347–366.
21. Doyle P, Raade A, Pierre AS, Desai S. Fundamental frequency and acoustic variability associated with production of sustained vowels by speakers with hypokinetic dysarthria. J Med Speech Lang Pathol 1995; 3 : 41–50.
22. Zwirner P, Barnes GJ. Vocal tract steadiness: a measure of phonatory and upper airway motor control during phonation in dysarthria. J Speech Hear Res 1992; 35(4): 761–768.
23. Rusz J, Cmejla R, Ruzickova H, Ruzicka E. Quantitative acoustic measurements for characterization of speech and voice disorders in early untreated Parkinson‘s disease. J Acoust Soc Am 2011; 129(1): 350–367.
24. Hertrich I, Ackermann H. Gender-specific vocal dysfunctions in Parkinson‘s disease: electroglottographic and acoustic analyses. Ann Otol Rhinol Laryngol 1995; 104(3): 197–202.
25. Jiménez-Jiménez FJ, Gamboa J, Nieto A, Guerrero J, Orti-Pareja M, Molina JA et al. Acoustic voice analysis in untreated patients with Parkinson‘s disease. Parkinsonism Relat Disord 1997; 3(2): 111–116.
26. Kent R, Kim H, Weismer G, Kent J, Rosenbek J, Brooks B et al. Laryngeal dysfunction in neurological disease: amyotrophic lateral sclerosis, Parkinson disease, and stroke. J Med Speech Lang Pathol 1994; 2 : 157–175.
27. Baker KK, Ramig LO, Luschei ES, Smith ME. Thyroarytenoid muscle activity associated with hypophonia in Parkinson disease and aging. Neurology 1998; 51(6): 1592–1598.
28. Colton RH, Casper JK, Leonard R. Understanding voice problems: a physiological perspective for diagnosis and treatment. 3rd ed. Philadelphia: Lippincott Williams & Wilkins 2005.
29. Roy N, Nissen SL, Dromey C, Sapir S. Articulatory changes in muscle tension dysphonia: evidence of vowel space expansion following manual circumlaryngeal therapy. J Commun Disord 2009; 42(2): 124–135.
30. Countryman S, Ramig L. Effects of intensive voice therapy on voice deficits associated with bilateral thalamotomy in Parkinson disease: a case study. J Med Speech Lang Pathol 1993; 1(4): 233–250.
31. Ramig LO, Sapir S, Fox C, Countryman S. Changes in vocal loudness following intensive voice treatment (LSVT) in individuals with Parkinson‘s disease: a comparison with untreated patients and normal age-matched controls. Mov Disord 2001; 16(1): 79–83.
32. Solomon NP, Hixon TJ. Speech breathing in Parkinson‘s disease. J Speech Hear Res 1993; 36(2): 294–310.
33. De Letter M, Santens P, De Bodt M, Van Maele G, Van Borsel J, Boon P. The effect of levodopa on respiration and word intelligibility in people with advanced Parkinson‘s disease. Clin Neurol Neurosurg 2007; 109(6): 495–500.
34. Adler CH, Ahlskog JE. Parkinson‘s disease and movement disorders: diagnosis and treatment guidelines for the practicing physician. 1st ed. Totowa (NJ): Humana Press 2000.
35. Logemann JA, Fisher HB, Boshes B, Blonsky ER. Frequency and cooccurrence of vocal tract dysfunctions in the speech of a large sample of Parkinson patients. J Speech Hear Disord 1978; 43(1): 47–57.
36. McNeil MR, Rosenbeck JC, Aronson AE. The dysarthrias: physiology, acoustics, perception, management. San Diego: College Hill Press 1984.
37. Logemann JA, Fisher HB. Vocal tract control in Parkinson‘s disease: phonetic feature analysis of misarticulations. J Speech Hear Disord 1981; 46(4): 348–352.
38. Canter GJ. Speech characteristics of patients with Parkinson‘s disease: III. articulation, diadochokinesis, and over-all speech adequacy. J Speech Hear Disord 1965; 30(3): 217–224.
39. Ackermann H, Konczak J, Hertrich I. The temporal control of repetitive articulatory movements in Parkinson‘s disease. Brain Lang 1997; 56(2): 312–319.
40. Rosen KM, Kent RD, Delaney AL, Duffy JR. Parametric quantitative acoustic analysis of conversation produced by speakers with dysarthria and healthy speakers. J Speech Lang Hear Res 2006; 49(2): 395–411.
41. Tjaden K, Watling E. Characteristics of diadochokinesis in multiple sclerosis and Parkinson‘s disease. Folia Phoniatr Logop 2003; 55(5): 241–259.
42. Fletcher SG. Time-by-count measurement of diadochokinetic syllable rate. J Speech Hear Res 1972; 15(4): 763–770.
43. Sapir S, Ramig LO, Spielman JL, Fox C. Formant centralization ratio (FCR): a proposal for a new acoustic measure of dysarthric speech. J Speech Lang Hear Res 2010; 53(1): 1–20.
44. Skodda S, Rinsche H, Schlegel U. Progression of dysprosody in Parkinson’s disease over time – a longitudinal study. Mov Disord 2009; 24(5): 716–722.
45. Viallet F, Teston B, Ludovic J. Effects of pharmacological versus electrophysiological treatments in Parkinsonian dysprosodie. Curr Opin Otolaryngol Head Neck Surg 2008; 13(3): 205–210.
46. Caekebeke JF, Jennekens-Schinkel A, van der Linden ME, Buruma OJ, Roos RA. The interpretation of dysprosody in patients with Parkinson’s disease. J Neurol Neurosurg Psychiatry 1991; 54(2): 145–148.
47. Moretti R, Torre P, Antonello RM, Capus L, Gioulis M, Zambito Marsala S et al. Speech initiation hesitation following subthalamic nucleus stimulation in a patient with Parkinson’s disease. Eur Neurol 2003; 49(4): 251–253.
48. Stracciari A, Guarino M, Cirignotta F, Pazzaglia P. Development of palilalia after stereotaxic thalamotomy in Parkinson’s disease. Eur Neurol 1993; 33(3): 275–276.
49. Cantiniaux S, Vaugoyeau M, Robert D, Horrelou--Pitek C, Mancini J, Witjas T et al. Comparative analysis of gait and speech in Parkinson‘s disease: hypokinetic or dysrhythmic disorders? J Neurol Neurosurg Psychiatry 2010; 81(2): 177–184.
50. Gentil M, Pollak P, Perret J. Parkinsonian dysarthria. Rev Neurol 1995; 151(2): 105–112.
51. Fischer E, Goberman AM. Voice onset time in Parkinson disease. J Commun Disord 2010; 43(1): 21–34.
52. Goberman AM, Coelho C, Robb M. Phonatory characteristics of parkinsonian speech before and after morning medication: the ON and OFF states. J Commun Disord 2002; 35(3): 217–239.
53. Skodda S, Visser W, Schlegel U. Short - and long-term dopaminergic effects on dysarthria in early Parkinson’s disease. J Neural Transm 2010; 117(2): 197–205.
54. Le Dorze G, Ryalls J, Brassard C, Boulanger N, Ratte D. A comparison of the prosodic characteristics of the speech of people with Parkinson’s disease and Friedreich’s ataxia with neurologically normal speakers. Folia Phoniatr Logop 1998; 50(1): 1–9.
55. Rektorova I, Barrett J, Mikl M, Rektor I, Paus T. Functional abnormalities in the primary orofacial sensorimotor cortex during speech in Parkinson‘s disease. Mov Disord 2007; 22(14): 2043–2051.
56. Duffy JR, Clinic M. Motor speech disorders: substrates, differential diagnosis, and management. 2nd ed. St. Louis: Mosby 2005.
57. Harel B, Cannizzaro M, Snyder PJ. Variability in fundamental frequency during speech in prodromal and incipient Parkinson’s disease: a longitudinal case study. Brain Cogn 2004; 56(1): 24–29.
58. Kegl J, Cohen H, Poizner H. Articulatory consequences of Parkinson’s disease: perspectives from two modalities. Brain Cogn 1999; 40(2): 355–386.
59. Flint AJ, Black SE, Campbell-Taylor I, Gailey GF, Levinton C. Acoustic analysis in the differentiation between Parkinson’s disease and major depression. J Psycholinguist Res 1992; 21(5): 383–399.
60. Ho AK, Iansek R, Bradshaw JL. Regulation of parkinsonian speech volume: the effect of interlocuter distance. J Neurol Neurosurg Psychiatry 1999; 67(2): 199–202.
61. Ho AK, Bradshaw JL, Iansek R, Alfredson R. Speech volume regulation in Parkinson’s disease: effects of implicit cues and explicit instructions. Neuropsychologia 1999; 37(13): 1453–1460.
62. Sanabria J, Ruiz PG, Gutierrez R, Marquez F, Escobar P, Gentil M et al. The effect of levodopa on vocal function in Parkinson’s disease. Clin Neuropharmacol 2001; 24(2): 99–102.
63. Ho AK, Iansek R, Bradshaw JL. Motor instability in Parkinsonian speech intensity. Neuropsychiatry Neuropsychol Behav Neurol 2001; 14(2): 109–116.
64. Teager H. Some observations on oral air flow during phonation. Acoustics, Speech, Signal Processing, IEEE Transactions on 1980; 28(5): 599–601.
65. Kaiser JF. On a simple algorithm to calculate the “energy” of a signal. International Conference on Acoustics, Speech, and Signal Processing; 1990 Apr 3–6; Albuquerque, New Mexico: 381–384.
66. Hirose H. Pathophysiology of motor speech disorders (dysarthria). Folia Phoniatr (Basel) 1986; 38(2–4): 61–88.
67. Ludlow CL, Connor NP, Bassich CJ. Speech timing in Parkinson’s and Huntington’s disease. Brain Lang 1987; 32(2): 195–214.
68. Goberman AM, Coelho CA, Robb MP. Prosodic characteristics of parkinsonian speech: the effect of levodopa-based medication. J Med Speech Lang Pathol 2005; 13(1): 51–68.
69. Goberman AM, Elmer LW. Acoustic analysis of clear versus conversational speech in individuals with Parkinson disease. J Commun Disord 2005; 38(3): 215–230.
70. Weismer G, Jeng JY, Laures JS, Kent RD, Kent JF. Acoustic and intelligibility characteristics of sentence production in neurogenic speech disorders. Folia Phoniatr Logop 2001; 53(1): 1–18.
71. Hillenbrand J, Getty LA, Clark MJ, Wheeler K. Acoustic characteristics of American English vowels. J Acoust Soc Am 1995; 97(5): 3099–3111.
72. Sapir S, Spielman JL, Ramig LO, Story BH, Fox C. Effects of intensive voice treatment (the Lee Silverman voice treatment [LSVT]) on vowel articulation in dysarthric individuals with idiopathic Parkinson disease: acoustic and perceptual findings. J Speech Lang Hear Res 2007; 50(4): 899–912.
73. Kent RD, Kim YJ. Toward an acoustic typology of motor speech disorders. Clin Linguist Phon 2003; 17(6): 427–445.
74. Liu H, Tsao F, Kuhl PK. The effect of reduced vowel working space on speech intelligibility in Mandarin-speaking young adults with cerebral palsy. J Acoust Soc Am 2005; 117(6): 3879–3889.
75. Lisker L, Abramson A. A cross-language study of voicing in initial stops: acoustical measurements. Word 1964; 20(3): 384–422.
76. Kent RD. Acoustic analysis of speech. 2nd ed. San Diego: Singular 2001.
77. Weismer G. Articulatory characteristics of parkinsonian dysarthria: segmental and phrase-level timing, spirantization, and glottal-supraglottal coordination. San Diego: College-Hill 1984.
78. Forrest K, Weismer G, Turner G. Kinematic, acoustic and perceptual analyses of connected speech produced by parkinsonian and normal geriatric males. J Acoust Soc Am 1989; 85(8): 2608–2622.
79. Ozsancak C, Auzou P, Jan M, Leonardo MG, Hannequin D. Pseudobulbar and parkinsonian dysarthria: an acoustical analysis. J Neurol 1997; 244 : 244–253.
80. Bunton K, Weismer G. Segmental level analysis of laryngeal function in persons with motor speech disorders. Folia Phoniatr Logop 2002; 54(5): 223–239.
81. Miller JL, Green KP, Reeves A. Speaking rate and segments: a look at the relation between speech production and speech perception for the voicing contrast. Phonetica 1986; 43 : 106–115.
82. Summerfield Q. Articulatory rate, perceptual constancy in phonetic perception. J Exp Psychol Hum Percept Perform 1981; 7(5): 1074–1095.
83. Berry W. Clinical Dysarthria. San Diego: College-Hill 1983.
84. Goberman AM, Blomgren M. Fundamental frequency change during offset and onset of voicing in individuals with Parkinson disease. J Voice 2008; 22(2): 178–191.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článek Webové okénko
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2011 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- CIDP: epidemiológia, klinický obraz a diagnostika v kocke
-
Všetky články tohto čísla
- Důvody a průběh novelizace české verze Addenbrookského kognitivního testu (ACE-CZ)
- Operační léčba poranění plexus brachialis
- Komentář k článku autorů Haninec a Kaiser Operační léčba poranění plexus brachialis
- Použití dotazníků aktivit denního života u pacientů s Alzheimerovou nemocí
- Parkinsonské fenotypy – na cestě k nové nozologii atypických parkinsonských syndromů
- Současný pohled na patofyziologii migrény
- Motorické aspekty poruch řeči u Parkinsonovy nemoci a jejich hodnocení
- Posturální reflexy v podmínkách zrakové poruchy
- Využití traktografie začleněné do neuronavigace při operacích intraaxiálních tumorů mozku uložených v těsné blízkosti kortikospinální dráhy
- Novelizace české verze Addenbrookského kognitivního testu (ACE-CZ)
- Rozšíření terapeutického časového okna pro intravenózní trombolýzu by nemělo vést k prodloužení „door-to-needle time“ intervalu
- Miller Fisherův syndrom – čtyři vlastní pozorování a přehled současných poznatků
- Parkinsonova nemoc s fenotypem progresivní supranukleární paralýzy – kazuistika
- Kognitivní a emocionální změny pět let po SAH – kazuistika
- Amisulprid v léčbě schizofrenie
- Webové okénko
- Analýza dat v neurologii - XXX. Validita klinických testů v širším kontextu
- MUDr. Jan Pařízek osmdesátníkem
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Miller Fisherův syndrom – čtyři vlastní pozorování a přehled současných poznatků
- Současný pohled na patofyziologii migrény
- Novelizace české verze Addenbrookského kognitivního testu (ACE-CZ)
- Operační léčba poranění plexus brachialis
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




