-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Využití perkutánní endoskopické gastrostomie – přehled indikací, popis techniky a současné trendy v neurologii
The Use of Percutaneous Endoscopic Gastrostomy – Overview of Indications, Description of the Technique and Current Trends in Neurology
Percutaneous endoscopic gastrostomy (PEG) is a mini-invasive method, during which a gastrostomic tube is inserted through the wall of the stomach directly into the stomach using a gastroscope. Considerring the increasing use of this method in an ever expanding spectrum of patients, including neurological patients, and the gradual broadening of therapeutic indications for PEG, the aim of this work is to offer a comprehensive overview of PEG indications with emphasis on neurological diseases. The PEG technique, contraindications and possible complications are also described.
Key words:
nasojejunal tube – percutaneous endoscopic gastrostomy – PEG/jejunal tube – Parkinson’s disease
Autoři: Bohuslav Kianička 1
; J. Žák 2; M. Bareš 3
Působiště autorů: LF MU a FN u sv. Anny v Brně II. interní klinika 1; LF MU a FN u sv. Anny v Brně I. chirurgická klinika 2; LF MU a FN u sv. Anny v Brně I. neurologická klinika 3
Vyšlo v časopise: Cesk Slov Neurol N 2012; 75/108(2): 165-169
Kategorie: Přehledný referát
Souhrn
Perkutánní endoskopická gastrostomie (PEG) je miniinvazivní metoda, při které je zavedena gastrostomická sonda přímo do žaludku přes břišní stěnu pomocí gastroskopu. Vzhledem k postupnému rozšiřování této metody pro stále širší spektrum pacientů, včetně pacientů neurologických, a postupnému nárůstu terapeutických indikací k provedení PEG, je cílem práce podat ucelený přehled indikací PEG s důrazem na neurologická onemocnění. Současně se zmiňujeme o technice aplikace PEG, kontraindikacích a možných komplikacích.
Klíčová slova:
nazojejunální sonda – perkutánní endoskopická gastrostomie – PEG/jejunální sonda – Parkinsonova nemoc1. Úvod
1.1. Definice metody
Perkutánní endoskopická gastrostomie (PEG) je minimálně invazivní metoda, při které je zavedena gastrostomická sonda přímo do žaludku přes břišní stěnu pomocí endoskopického přístroje – gastroskopu. Je určena pacientům, jimž je třeba podávat enterální výživu (EV) delší dobu (nejméně 4–6 týdnů). Obecně je EV indikována u pacientů se skutečnou nebo hrozící malnutricí, jejichž trávicí ústrojí je funkční.
1.2. Historie PEG
První PEG zavedli v roce 1980 Gauderer a Ponsky [1] u dítěte jako alternativní výkon místo provedení chirurgické gastrostomie. V České republice byla poprvé provedena a popsána Axmannem a Kamlerem v roce 1993 [2]. Od té doby se zavedení PEG postupně stalo rutinní metodou v průběhu endoskopie horního gastrointestinálního traktu (GIT). Pokud mají pacienti, u kterých je plánováno zavedení PEG, zvýšené riziko aspirace, je nutné zavést jejunální sondu cestou vnitřního lumen PEG hluboko do postbulbárního duodena, resp. až na začátek jejuna (PEG/J sonda) [3].
2. Cíl sdělení
Cílem práce je zejména podat ucelený přehled indikací PEG, s důrazem na neurologická onemocnění. Současně je uvedena technika aplikace PEG, kontraindikace a možné komplikace.
3. Metodika
3.1. Indikace PEG
3.1.1. Neurologická onemocnění
Neurologická onemocnění jsou velmi častou indikací zavedení PEG, podle různých literárních zdrojů tvoří 10–60 % celkového počtu provedených PEG [3]. K hlavním indikacím patří poruchy polykacího aktu různé etiologie. Nejčastěji se jedná o bulbární a pseudobulbární syndrom po cévní mozkové příhodě (CMP) a amyotrofickou laterální sklerózu, kdy je polykací akt porušen již v počátečních stadiích nemoci [4]. U pacientů s CMP, kteří trpí poruchou polykání, by měl být PEG k zajištění dlouhodobé EV zaveden co nejdříve. Hodnoty nutričních parametrů pak u nich rostou rychleji a zkracuje se délka hospitalizace [5].
Pacienti s trvalou poruchou polykání při normálních psychických funkcích ze zavedení PEG nejvíce profitují, proto je v těchto případech vždy nutné uvažovat o možnosti zavedení PEG a jeho výhodách především v domácím prostředí.
Častou indikací PEG jsou rovněž pacienti v kómatu jakékoliv etiologie, kteří jsou dlouhodobě ventilováni a tlumeni, dále perzistující vegetativní stav neboli vigilní kóma u pacientů po těžkém kraniocerebrálním poranění nebo po kardiopulmonální resuscitaci. PEG je indikován u pacientů s protrahovanou myastenickou krizí a těžkým průběhem polyradikuloneuritidy.
Další indikací PEG jsou rovněž pacienti s demencí – především při Alzheimerově nemoci, kde se uvádí prevalence malnutrice 2–69 %. U těchto pacientů je nutné vždy zvážit přínos podávání výživy; zda se jedná o pacienta v terminální fázi onemocnění, či zhoršení nutričního stavu u pacienta s dlouhodobě neměnnými nebo zlepšujícími se duševními parametry.
PEG je rovněž indikován u neurodegenerativních onemocnění (multisystémová atrofie, progresivní supranukleární paralýza a další), u kterých dominují poruchy polykání a malnutrice.
V pozdních stadiích Parkinsonovy nemoci (PN), v případě rozvoje poruchy polykání a nutnosti podávat EV, kdy je PEG rovněž indikován, lze v posledních letech využít intrajejunální podávání metylester L-DOPA ve formě gelu (Duodopa). Přednosti intrajejunálního podávání L-DOPA pro pacienty s PN jsou: nastavení vyrovnanější plazmatické hladiny L-DOPA, absence průchodu gastrointestinálním traktem, což u pacientů s pokročilou formou PN s poruchami vstřebávání je nespornou výhodou. Výsledkem je významně zlepšený motorický stav, včetně potlačení dyskinéz, který jinak bývá obtížně řešitelný [6]. Antidyskinetický efekt mají i jiné preparáty obcházející trávicí trakt: amantadin sulfát (PK Merz) v infuzní formě a injekční nebo infuzní léčba apomorfinem [7,8].
Vzácnější indikací jsou též mozkové tumory, včetně stavu po jejich odstranění s poškozením okolních struktur (například tumory zadní jámy lební s bulbárním syndromem).
Specifika PEG v indikaci podávání metylester L-DOPA ve formě gelu z pohledu gastroenterologa
Antiparkinsonikum metylester L-DOPA je aplikováno hluboko do postbulbárního duodena prostřednictvím nazojejunální sondy nebo PEG/J sondy. Pacienti s Parkinsonovou nemocí mají některá specifika: hůře polykají, někteří mají menší dechové exkurze a větší tendenci k hypoxemii, je přítomný klidový třes, rigidita a hypokineze. Zavedení PEG je tedy obtížnější než u jiných pacientů, a proto je realizováno týmově, a to gastroenterologem a chirurgem, za standardní asistence anesteziologa. U těchto pacientů je tedy nutné, víc než u kterýchkoliv jiných, zdůraznit nezbytnost mezioborové spolupráce. Základní technika gastroskopie, zavedení PEG a PEG/J sondy byly v zahraničním i našem písemnictví opakovaně popsány [1,3,9–12].
V praxi postupujeme tak, že u vybraného pacienta nejprve zavedeme cestou gastroskopie nazojejunální sondu pokud možno co nejhlouběji do postbulbárního duodena. Další z možností zavedení nazojejunální sondy je ta, že nejprve se nazojejunální sonda zavede do žaludku a poté se čeká na její spontánní „zaplavání“ do stanovené lokalizace pomocí peristaltiky. Definitivní poloha nazojejunální sondy by měla být vždy ověřena rentgenologicky. V následujících 3 dnech neurolog natitruje dávku preparátu metylester L-DOPA, který se podává do duodena nazojejunální sondou. Za 3–5 dní po zavedení nazojejunální sondy se tato extrahuje, poté je na operačním sále standardním způsobem zaveden PEG, a hned následně cestou PEG zavádíme jejunální sondu. Tuto PEG/J sondu zavádíme pomocí gastroskopu hluboko do postbulbárního duodena, event. až na začátek jejuna.
3.1.2. Onemocnění gastrointestinálního ústrojí
3.1.2.1. Maligní: z maligních jsou to především tumory jícnu, které vedou k inanici a anorexii z důvodu především poruchy pasáže potravy. Z dalších tumory tenkého i tlustého střeva, pankreatu a jater. Tyto nádory mohou způsobovat spíše anorexii než poruchu absorpce, mohou však též vyvolávat bolest nebo subileózní stav, které vedou ke snížení příjmu potravy, což lze částečně řešit aplikací EV.
3.1.2.2. Nemaligní: k nemaligním onemocněním gastrointestinálního ústrojí, pro která je indikováno zavedení PEG, patří především akutní a chronická pankreatitida, Crohnova nemoc, stenózy jícnu různé etiologie.
Onemocnění trávicího ústrojí tvoří v různých sestavách 10–80 % indikací zavedení PEG [3].
Jednoduchost a miniinvazivita PEG ve srovnání s klasickou laparotomickou gastrostomií ještě přesahuje rozdíl mezi klasickou laparotomií a laparoskopickou či robotickou da Vinci operací [13–17].
3.1.3. Onkologická onemocnění
Jednou z hlavních indikací zavedení PEG jsou onkologická onemocnění, kdy se v různých sestavách pohybuje podíl indikovaných pacientů mezi 20–70 % [3].
Důvodem pro zavedení PEG jsou tyto nádory:
- zužující horní část trávicí trubice a znemožňující normální příjem potravy (nádory dutiny ústní, hrtanu, hltanu, štítné žlázy a jícnu),
- způsobující poruchu polykání (nádory mozku, a to primární i sekundární – metastázy),
- dále generalizované nádory s nádorovou anorexií, kde podávání výživy většinou zlepšuje kvalitu života nemocných.
3.1.4. Stomatologická a stomatochirurgická onemocnění
K indikacím stomatologickým a stomatochirurgickým patří poranění obličeje a dutiny ústní nebo nádory dutiny ústní či jazyka.
3.1.5. Onemocnění v oblasti krku
Rovněž tato postižení jsou častou indikací k zavedení PEG: nádory hltanu, hrtanu i štítné žlázy často brání polykání, podobně jako stavy po ozáření krku.
3.1.6. Onemocnění v gerontologii
K indikacím v této oblasti patří nejčastěji demence s poruchou polykání či neochotou polykat a dále stavy po CMP s bulbární symptomatologií.
3.1.7. Kriticky nemocní pacienti
V odborné literatuře existuje dostatek údajů o důležitosti trávicího ústrojí a integrity střevní bariéry u kriticky nemocných. Literární údaje se shodují v preferenci EV [18,19]. Srovnání EV a parenterální výživy ukázala, že EV je nutričně stejně efektivní jako parenterální a navíc její aplikace vede k redukci infekčních komplikací o 60–70 % [20,21]. Podání EV má pro organizmus větší benefit než pouhé dodání energie a živin. Je to zejména modulace imunitní odpovědi organizmu, udržování integrity střeva a prevence translokace bakterií [22].
Umělá výživa je indikována u každého kriticky nemocného, pokud je stanovena diagnóza malnutrice, případně pokud lze její vývoj v krátké době předpokládat. Jestliže je funkční trávicí ústrojí, preferujeme EV před parenterální. Obecně lze říci, že čím je stav pacienta závažnější, tím dříve je vhodné začít s EV. Mluvíme o takzvané časné EV, která začíná v průběhu 24–48 hod po vzniku noxy.
Při aplikaci EV u kriticky nemocných je nutné zohlednit některá specifika. I když je podávání EV do žaludku fyziologické, u kriticky nemocných je použití gastrické sondy k podávání EV kontroverzní z důvodu vysoké prevalence poruchy vyprazdňování s rizikem aspirace. Někteří autoři uvádějí vysokou frekvenci intolerance gastrické EV (40–50 %) se signifikantním zvýšením mortality [23–25], ale jiní autoři naopak udávají nižší výskyt této komplikace [26] a doporučují gastrickou cestu podávání EV u kriticky nemocných preferovat. Většina autorů se ale přiklání, i přes nedostatek studií, k aplikaci EV do jejuna. To je navíc z hlediska výživy u kriticky nemocných účinnější než gastrické podávání EV, vzestup prealbuminu je dvojnásobný. Do žaludku je možné podat okolo 40 % požadované energetické potřeby, do jejuna víc než 60 % [27].
Při volbě přístupu do trávicího ústrojí se rozhodujeme podle předpokládané doby podávání EV. Je-li tato doba delší než 4–6 týdnů, volíme PEG (případně PEG/J), v opačném případě nazoenterální sondy (tedy nazogastrickou nebo nazojejunální sondu). Je však nutné vzít v úvahu, že u kriticky nemocných dochází ke specifickým komplikacím nazoenterálních sond. Je to zejména vyšší riziko vzniku tracheoezofageální píštěle, sinusitidy a bakteriální meningitidy u kraniocerebrálních poranění. Výhodou zavedení PEG a aplikace EV u těchto stavů je právě menší frekvence případného vzniku tracheoezofageálních píštělí, aspiračních bronchopneumonií, infekcí dýchacích cest, ucpání nazogastrické sondy či jejího vytažení při neklidu pacienta.
3.1.8. Vzácnější indikace PEG
3.1.8.1. Psychiatrické: nejčastější indikací PEG v psychiatrii je demence (popsáno v odstavci o neurologických onemocněních). Další psychiatrickou diagnózou indikovanou k zavedení PEG je mentální anorexie. V případě častého zvracení nebo výrazné poruchy motility žaludku je preferováno provedení PEG/J sondy.
3.2. Popis provedení PEG
Co se týče vlastního provedení PEG, rozeznáváme dva základní způsoby aplikace PEG:
3.2.1. Některá z variant metody pull
Metoda pull má tyto varianty:
3.2.1.1. Pull through (pull string – Gauderer Ponsky): standardní (a nejčastěji používanou) metodou zavedení PEG je metoda ,,pull through (pull string)“, původně popsaná Gaudererem a Ponským [1]. Při gastroskopii, po provedení transparietální punkce žaludku, uchopíme vodič histologickými kleštěmi nebo polypektomickou kličkou a vytáhneme jej i s gastroskopem z úst ven. Zde navážeme gastrostomický set se špičatým adaptérem a vytáhneme jej zpět – přes jícen, žaludek, stěnu žaludku a peritoneum – břišní stěnou ven. Sonda je fixována v žaludku diskem, který je součástí gastrostomického setu (obr. 1).
Obr. 1. Pacient se sondou PEG. 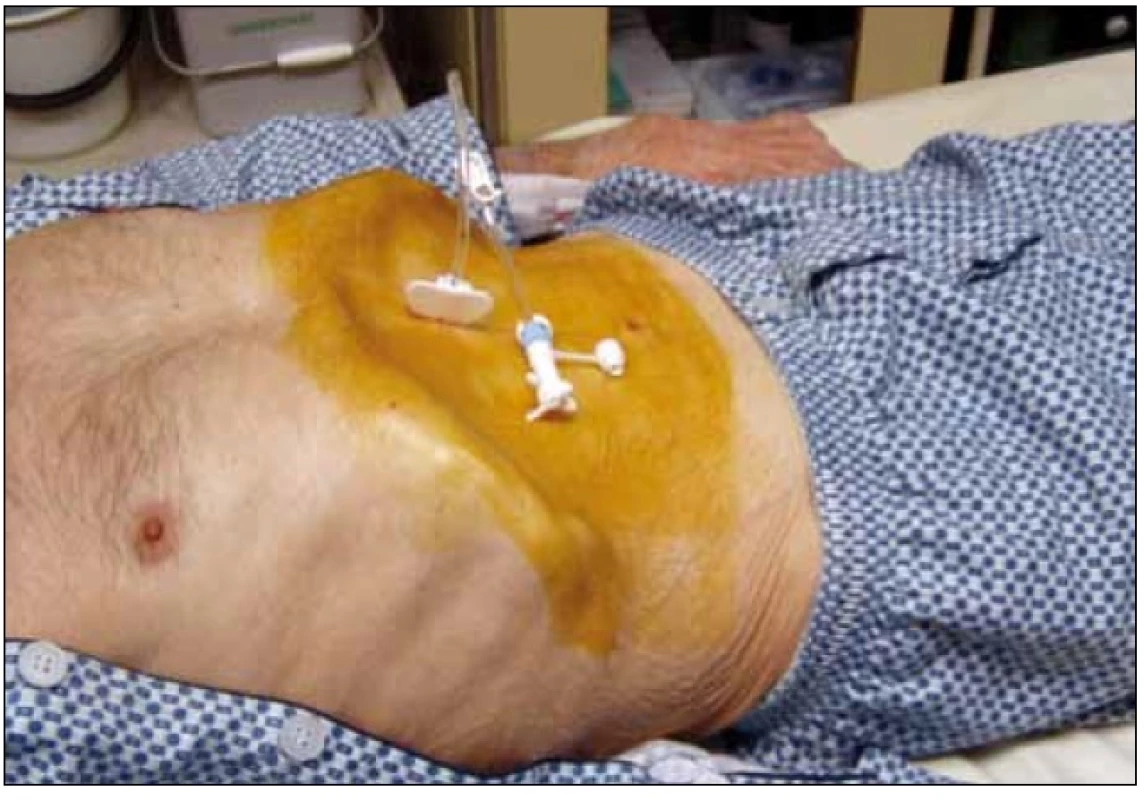
3.2.1.2. Push over wire (push through – Sacks-Vine): variantou metody pull je metoda ,,push over wire (push through)“ podle Sackse a Vinea [9], kdy sonda není tažena za vodič ven, ale naopak po ponechaném drátěném vodiči je tlačena přes břišní stěnu, a poté, po proniknutí břišní stěnou, tahem umístěna v žaludku.
3.2.2. Metoda ,,push“, resp. ,,introducer“ (Russel)
Při metodě „push“, resp. „introducer“, kterou poprvé popsali Russell et al [10], je po punkci žaludku (při gastroskopické kontrole, kontrole pod RTG zesilovačem nebo při laparoskopické asistenci) dilatován kanál do žaludku, kterým je potom přímo zavedena výživová sonda. Tuto sondu následně fixujeme v žaludku.
3.3. Péče o PEG po výkonu
Ihned po výkonu je pacient odvezen na lůžko zvýšeného dohledu s monitorováním. Po výkonu pacient 3 hod nedostává nic per os, a ani do PEG. Poté je po kontrole celkového a lokálního stavu možné podat do PEG malé množství sterilního fyziologického roztoku či vody, perorálně čaj po lžičkách anebo malých doušcích.
Byla-li zavedena PEG/J sonda, je možné zahájit startovací režim EV ihned po výkonu.
Týž den je nutná kontrola celkového stavu pacienta, nálezu na břiše a PEG, případně utažení či povolení fixačního zařízení PEG. Převaz rány se provádí při krvácení, jinak se ponechává na další den.
Od 2. do 10. dne po zavedení PEG je možné zahájit aplikaci EV cestou PEG a obnovit perorální příjem, jedl-li pacient.
Převaz PEG provádíme denně, kontrolujeme místo vpichu, které v případě potřeby ošetříme, a upravujeme tah disku.
Od 10. dne po zavedení postupně zvyšujeme dávku EV podle potřeby a tolerance pacienta. Převazy provádíme ob den a dále podle nálezu na břiše 2krát týdně. Pokud ustane sekrece z rány po zavedení PEG, je možné zcela odstranit mulové krytí okolí PEG, a pak provádíme pouze čištění PEG.
3.4. Komplikace PEG
3.4.1. Vlastní komplikace PEG
Vlastní komplikace PEG lze rozdělit z různých hledisek:
3.4.1.1. Podle tíže (tedy podle klinických konsekvencí) se komplikace dělí na: závažné (těžké) a nezávažné (lehké).
3.4.1.1.1. Závažné komplikace (aspirace, peritonitida, perforace, gastro-kolo-kutánní píštěl, krvácení, nekrotizující fasciitida, implantace tumoru do vývodu PEG, a další) mají za následek prodloužení doby hospitalizace pacienta [28], vedou k nutnosti chirurgických výkonů nebo k úmrtí, které je příčinně spojené s výkonem.
3.4.1.1.2. Nezávažné komplikace (infekce vývodu gastrostomické kanyly, vytékání žaludečního obsahu podél sondy, obstrukce nebo poškození sondy, migrace sondy do tenkého střeva aj.) neovlivní morbiditu ani mortalitu pacientů.
3.4.1.2. Podle doby vzniku se komplikace rozdělují na časné a pozdní, kdy ale v literatuře není jednoznačně stanoven časový úsek, který by rozlišoval časné a pozdní komplikace. Obvykle však o časných komplikacích hovoříme, pokud se vyskytnou v prvním týdnu až měsíci – tedy do 30 dnů po zavedení PEG.
3.4.1.3. Podle druhu lze komplikace dále rozdělit na:
3.4.1.3.1. Infekční: infekce nebo absces v místě vpichu, peritonitida, sepse.
3.4.1.3.2. Mechanické: ucpání gastrostomie, zalomení či vytažení sondy, gastrokolická píštěl, migrace vnitřního fixátoru.
3.4.1.3.3. Gastroenterologické: ulcerace v místě vpichu pod diskem či na protilehlé straně, krvácení, prosakování v místě gastrostomie a burried bumper syndrom (syndrom zanořeného disku), což je ne zcela závažná komplikace PEG, která však většinou vede k nutnosti odstranění PEG. Při této komplikaci vnitřní disk PEG přeroste žaludeční sliznicí a pak již nelze PEG vsunout zpět volně do žaludku. Při nejtěžší formě nelze ani aplikovat enterální výživu. Léčba této komplikace spočívá v odstranění PEG, což lze většinou zvládnout endoskopicky (u lehčích forem). K chirurgickému odstranění PEG je nutno přistoupit méně často.
Řada autorů se shoduje v tom, že množství infekčních komplikací (a to především právě výše uvedené infekce v oblasti vývodu gastrostomické kanyly) lze snížit profylaktickým podáním antibiotik (obvykle jednorázově 30 min před výkonem) až o 25 %, a proto antibiotickou profylaxi doporučuje i Evropská společnost pro gastrointestinální endoskopii (ESGE) [29]. Někteří však antibiotickou profylaxi za účinnou prevenci nepovažují [30].
3.4.2. Specifické komplikace PEG vyskytující se speciálně u pacientů se zavedenou PEG/J sondou
Všechny výše uvedené komplikace PEG se vyskytují i u pacientů se zavedenou jejunální sondou cestou PEG – tedy PEG/J sondou, kdy tato metoda má však i některé další specifické komplikace [31].
3.4.2.1. Ucpání sondy: vzhledem ke svému malému průměru se jejunální sonda může ucpat. Předcházíme tomu sledováním složení roztoků podávaných do jejunální sondy a jejím častým proplachováním čirými roztoky (převařená voda nebo fyziologický roztok podle druhu přípravku EV).
3.4.2.2. Vytažení PEG/J sondy: obvykle neúmyslně při manipulaci s pacientem nebo nevědomky samotným pacientem.
3.4.2.3. Migrace PEG/J sondy: popisuje se vycestování PEG/J sondy do distálních partií trávicí trubice.
3.4.2.4. Prepylorická migrace hrotu PEG/J sondy: jedná se o relativně častou komplikaci, která nemá pro pacienta bezprostřední následky, ale ohrožuje strategii nutriční léčby ztrátou jejunálního přístupu.
3.5. Kontraindikace PEG
Kontraindikace PEG můžeme rozdělit takto:
3.5.1. Kontraindikace gastroskopie
- nemožnost zavést endoskop do žaludku, srdeční nestabilita a nesouhlas pacienta s provedením výkonu.
3.5.2. Kontraindikace vlastního provedení PEG
- absolutní kontraindikace: nepřítomnost diafanoskopie, difuzní peritonitida a ascites, karcinom žaludku, karcinomatóza peritonea, těžké poruchy koagulace,
- relativní kontraindikace: stavy po operacích v horní polovině břicha, stav po resekci žaludku, velká hiátová hernie (skluzná i paraezofageální), žaludeční vřed (podle lokalizace), hepatomegalie, portální hypertenze, žaludeční (fundální) varixy, obezita, těžká malnutrice, peritoneální dialýza.
U těchto stavů je tedy nutné indikaci PEG znovu pečlivě zvážit a výkon provádět s velikou opatrností.
3.6. Postup při odstranění PEG
Po ukončení indikace EV lze PEG odstranit několika způsoby:
3.6.1. Prosté vytažení PEG tahem
Pokud používáme PEG s fixací balónkem nebo jiným mechanizmem, který lze ovládat zvenčí (pigtail, nebo zvonové zakončení – tulip, anebo sonda s tvarovou pamětí), uvolníme tuto fixaci uvnitř žaludku a sondu volně vytáhneme.
3.6.2. Pasáž per vias naturales (metoda ,,cut and push‘‘)
Nejjednodušším způsobem odstranění PEG s diskovým zakončením (které není možné vtáhnout do gastrokutánního kanálu) je odstřižení a vtlačení sondy do žaludku (metoda ,,cut and push“). Sonda projde spontánně trávicím ústrojím (per vias naturales) a odejde stolicí. Vždy je vhodné se objektivně přesvědčit o jejím odchodu stolicí. Tato metoda je bezpečná a ke vzniku komplikací (uvíznutí sondy v trávicí trubici a vznik ileu nebo dokonce perforace střeva) dochází minimálně. Tento způsob odstranění PEG se v současné době v České republice prakticky nepoužívá, a to vzhledem k běžné dostupnosti gastroskopie.
3.6.3. Endoskopické odstranění PEG
Ve většině případů se gastrostomický set odstraňuje gastroskopicky. Nejprve uvolníme zevní fixační zařízení a gastrostomický set vtlačíme do žaludku. Přes vnitřní disk převlékneme polypektomickou kličku a zatáhneme ji okolo setu. Poté odstřihneme gastrostomický set a zbytek PEG i s gastroskopem vytáhneme ven ústy.
Po odstranění PEG se doporučuje přibližně 6 hod nic nepít, do druhého dne se nedoporučuje podávat jídlo. Zevní ústí kanálu se překryje sterilním obvazovým materiálem. K uzavření gastrokutánní píštěle dochází u většiny pacientů v průběhu 24 hod.
4. Závěr
Zavedení PEG jako racionální alternativy pro dlouhodobou výživu nemocných hospitalizovaných na neurologických pracovištích znamená velký přínos s jasně převažujícími pozitivy tohoto postupu. Oproti výživě pomocí nazogastrické sondy je výživa cestou PEG a ošetřování takového pacienta podstatně snadnější jak pro personál různých oddělení a LDN, tak i pro příslušníky rodiny těchto nemocných.
PEG je bezpečná metoda, jejíž bezpečnost roste se zkušenostmi pracoviště a způsobem ošetřování po jejím zavedení. Bezpečnost PEG je jedním z důvodů obliby této metody. Stran komplikací PEG lze říci, že většina z nich je klinicky relativně málo závažná a poměrně snadno se léčí. Nejlepší prevencí komplikací PEG jsou správné indikace zavedení PEG a dále řádná péče o PEG po výkonu [3].
Je možné konstatovat, že PEG se stala metodou volby pro zavedení přístupu aplikace dlouhodobé EV. Jedná se o bezpečný výkon s poměrně nízkým počtem komplikací a prakticky nulovou mortalitou. Při správném ošetřování PEG je i počet pozdních komplikací minimální ve srovnání s nazogastrickou sondou. Nově se metoda využívá k terapeutickému podávání antiparkinsonské medikace v indikaci pozdních stadií Parkinsonovy nemoci.
Přijato k recenzi: 18. 3. 2011
Přijato do tisku: 17. 10. 2011
MUDr. Bohuslav Kianička, Ph.D.
II. interní klinika
LF MU a FN u sv. Anny v Brně
Pekařská 53
656 91 Brno
e-mail: bohuslav.kianicka@fnusa.cz
Zdroje
1. Gauderer MW, Ponsky JL, Izant RJ Jr. Gastrostomy without laparotomy: a percutaneous endoscopic technique. J Pediatr Surg 1980; 15(6): 872–876.
2. Kamler J, Axmann K. Gastrostomie – současnost a budoucnost. Endoskopie 1993; 2 : 49–50.
3. Kohout P, Skládaný Ľ et al. Perkutánní endoskopická gastrostomie a její místo v algoritmu umělé výživy. Praha: Galén 2002.
4. Neudert C, Oliver D, Wasner M, Borasio GD. The course of terminal phase in patients with amyotrophic lateral sclerosis. J Neurol 2001; 248(7): 612–616.
5. Norton B, Homer-Ward M, Donelly MT, Long RG, Holmes GK. A randomized prospective comparison of percutaneous endoscopic gastrostomy and nasogastric tube feeding after acute dysphagic stroke. BMJ 1996; 312(7022): 13–16.
6. Bareš M. Pozdní hybné komplikace Parkinsonovy nemoci – wearing-off fenomén a další motorické komplikace. Neurol Prax 2008; 9(2): 96–99.
7. Kaňovský P, Kubová D, Bareš M, Hortová H, Streitová H, Znojil V. Levodopa-induced dyskinesias and continuous subcutaneous infusions of apomorphine: results of two-years, prospective follow-up. Mov Disord 2002; 17(1): 188–191.
8. Růžička E, Streitová H, Jech R, Kaňovský P, Roth J, Rektorová I et al. Amantadine infusion in treatment of motor fluctuations and dyskinesias in Parkinson’s disease. J Neural Transm 2000; 107(11): 1297–1306.
9. Sacks BA, Vine HS, Palestrant AM, Ellison HP, Shropshire D, Lowe R. A nonoperative technique for establishment of a gastrostomy in the dog. Invest Radiol 1983; 18(5): 485–497.
10. Russell TR, Brotman N, Norris F. Percutaneous gastrostomy: a new simplified and cost-effective technique. Am J Surg 1984; 148(1): 132–137.
11. Kohout P. Perkutánní endoskopická gastrostomie. Postgrad Med 2001; 3 : 413–415.
12. Kohout P, Beneš Z, Antoš Z, Rozmahel M, Puškárová G, Sokol P et al. Perkutánní endoskopická gastrostomie – zkušenosti Centra pro PEG v letech 2002–2008. Prakt Lék 2008; 88(12): 710–716.
13. Vlček P, Veverková L, Čapov I, Korbička J, Chalupník Š, Jedlička V et al. Využití robotického systému da Vinci při řešení kompletního prolapsu rekta. Endoskopie 2010; 19(1): 9–13.
14. Vlček P, Čapov I, Jedlička V, Chalupník Š, Korbička J, Veverková L et al. Robotické výkony v kolorektální chirurgii. Rozhl Chir 2008; 87 : 135–137.
15. Vlček P, Korbička J, Čapov I, Wechsler J, Vlčková P, Dolina J et al. Functional Results of Operative Treatment of Rectal Prolapse. 9th Biennial Congress of the European Council of Coloproctology – ECCP. Athens: Pianoro: International Proceedings Division: 361–368.
16. Vlček P, Korbička J, Čapov I, Wechsler J, Vlčková P, Dolina J et al. Pathogenesis and Management of Rectoceles Outcome Using Selective Criteria for Rectocele repair. 9th Biennial Congress of the European Council of Coloproctology – ECCP. Athens: Pianoro: International Proceedings Division: 369–375.
17. Vlček P, Korbička J, Chalupník Š, Jedlička V, Veverková L, Čapov I et al. Our experience with a 3D mesh in the management of rectal prolapse. Scripta Medica 2006; 79(2): 123–132.
18. Buchman AL, Moukarzel AA, Bhuta S, Belle M, Ament ME, Eckhert CD et al. Parenteral nutrition is associated with intestinal morphologic and functional changes in humans. JPEN J Parenter Enteral Nutr 1995; 19(6): 453–460.
19. Mallampalli A, McClave SA, Snider HL. Defining tolerance to enteral feeding in the intensive care unit. Clin Nutr 2000; 19(4): 213–215.
20. Kudsk KA, Croce MA, Fabian TC, Minard G, Tolley EA, Poret HA et al. Enteral versus parenteral feeding. Effects on septic morbidity after blunt and penetrating abdominal trauma. Ann Surg 1992; 215(5): 503–513.
21. Moore FA, Moore EE, Jones TN, McCroskey BL, Peterson VM. TEN versus TPN following major abdominal trauma: reduced septic morbidity. J Trauma 1989; 29(7): 916–923.
22. Frost P, Bihari D. The route of nutritional support in the critically ill: physiological and economical considerations. Nutrition 1997; 3 (Suppl 9): 58S–63S.
23. Heyland D, Cook DJ, Winder B, Brylowski L, Van deMark H, Guyatt G. Enteral nutrition in critically ill patients: a prospective survey. Crit Care Med 1995; 23(6): 1055–1060.
24. McClave SA, Sexton LK, Spain D, Adams JL, Owens NA, Sullins MB et al. Enteral tube feeding in the intensive care unit: factors impeding adequate delivery. Crit Care Med 1999; 27(7): 1252–1256.
25. Sitzmann JV. Nutritional support of the dysphagic patient: methods, risks, and complications of therapy. JPEN J Parenter Enteral Nutr 1990; 14(1): 60–63.
26. Klodell T, Carroll M, Carrillo EH, Spain DA. Routine intragastric feeding following traumatic brain injury is safe and well tolerated. Am J Surg 2000; 179(3): 168–171.
27. Montecalvo MA, Steger KA, Farber HW, Smith BF, Dennis RC, Fitzpatrick GF et al. Nutricional outcome and pneumonia in critical care patients randomized to gastric versus jejunal tube feedings. The Critical Care Research Team. Crit Care Med 1992; 20(10): 1377–1381.
28. Korbička J, Čapov I, Vlček P. Pneumoperitoneum bez perforace trávícího ústrojí. Rozhl Chir 2002; 81(7): 364–371.
29. Rey JR, Axon A, Budzynska A, Kruse A, Nowak A. Guidelines of the European Society of Gastrointestinal Endoscopy (ESGE). Antibiotic prophylaxis for gastrointestinal endoscopy. European Society of Gastrointestinal Endoscopy. Endoscopy 1998; 30(3): 318–324.
30. Kirby DF, Delegge MH, Fleming CR. American Gastroenterological Association. technical review on tube feeding for enteral nutrition. Gastroenterology 1995; 108(4): 1282–1301.
31. Schapiro GD, Edmundowicz SA. Complications of percutaneous endoscopic gastrostomy. Gastrointest Endosc Clin N Am 1996; 6(2): 409–422.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článek Webové okénko
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2012 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Posturálna instabilita, poruchy chôdze a pády pri Parkinsonovej chorobe
- Sulcus temporalis superior a jeho funkční význam
- Algoritmus vyšetření likvoru v návaznosti na doporučení Sekce neuroimunologie a likvorologie České neurologické společnosti JEP
- Využití perkutánní endoskopické gastrostomie – přehled indikací, popis techniky a současné trendy v neurologii
- Diagnostické možnosti zobrazovacích metod v hodnocení morfologického korelátu kognitivních změn u pacientů s roztroušenou sklerózou
- Poruchy výživy a metabolizmu u Parkinsonovy nemoci
- Měření kognitivního deficitu u pacientů po ošetření mozkových aneuryzmat
- Polysomnografické nálezy u dětí s poruchou pozornosti a hyperaktivitou (ADHD) vyšetřovaných pro poruchu spánku
- Léčba neurogenního hyperaktivního detruzoru po spinálním poranění aplikací botulinumtoxinu A. Porovnání endoskopické subslizniční a intramuskulární aplikace
- Naše zkušenosti s laterálním supraorbitálním přístupem při operacích mozkových aneuryzmat
- Diagnostika a léčba demence českými neurology a psychiatry
- Endoskopická ventrikulostomie III. komory v léčbě hydrocefalu u dětí s mozkovými tumory – zkušenosti jednoho centra
- Zrakové funkce nedonošených dětí s perinatálním mozkovým postižením
- Obstrukční spánková apnoe a CPAP – má význam řešit nosní průchodnost?
- Detekcia anaplastických ložísk v kontrastnou látkou sa nevýrazne farbiacich infiltratívnych gliómoch pomocou 5-aminolevulovej kyseliny – správa o piatich prípadoch
- Terapeutické možnosti prevence cévní mozkové příhody u pacientů s karotickým stump syndromem – kazuistiky
- Oligosymptomatické formy myotonické dystrofie typu 2
- Odeznění traumatické pentaplegie u pacienta po kombinované zlomenině C1–C2
- Klinický standard pro diagnostiku a léčbu myasthenia gravis
- Webové okénko
- Analýza dat v neurologii - XXXII. Bayesovská vs klasická statistika v klinických aplikacích
- Prof. MUDr. Zdeněk Kadaňka, CSc., sedmdesátiletý
- Novinky v diagnostice a léčbě primárních nádorů mozku – závěry mezioborového setkání „Winter GLIO TRACK Meeting“ 2012
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Využití perkutánní endoskopické gastrostomie – přehled indikací, popis techniky a současné trendy v neurologii
- Posturálna instabilita, poruchy chôdze a pády pri Parkinsonovej chorobe
- Algoritmus vyšetření likvoru v návaznosti na doporučení Sekce neuroimunologie a likvorologie České neurologické společnosti JEP
- Obstrukční spánková apnoe a CPAP – má význam řešit nosní průchodnost?
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



