-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Použití botulotoxinu v neurologii
Use of Botulinum Toxin in Neurology
Botulinum toxin is one of the strongest natural toxins. The toxin is produced by anaerobic bacteria Clostridium botulinum. The substance causes a block of acetylcholine release on the neuromuscular endplate with subsequent disruption of impulse transmission on the muscle. At the same time, botulinum toxin causes denervation syndrome of the muscle into which it was administered. There are seven types of botulinum toxin with effects on various proteins in presynaptic ending. In contemporary clinical practice, botulinum toxin has been used for more than 30 years and drugs with botulinum toxin A and B are available. At present, two medicinal products containing botulinum toxin A (Botox® and Dysport®) and one with botulinum toxin B (NeuroBloc®) are available. Botulinum toxin is a highly effective drug used in many clinical conditions associated with increased skeletal muscle activity and increased activity of autonomic system. Botulinum toxin is indicated and reimbursed by insurance companies for cervical dystonia, other dystonias, blepharospasm, hemifacialis spasm, upper limb spasticity after stroke, and upper and lower limb spasticity in cerebral palsy. It also has proven efficacy in chronic headache, sfincter-detrusor dyssynergia of urine bladder, hyperhidrosis, sialorhoea, in gastroenterologic disorders (achalasia, anal fissure), cosmetic indications and in a number of other conditions. Contraindications include pregnancy, lactation, some neuromuscular diseases, haemocoagulation disorders including anticoagulation therapy (INR > 2.8) and inflammatory changes of the skin at the administration site. Adverse events include intensive muscle weakness, pain, hemorrhage into the muscle or subcutaneous tissue, headache as well as flu-like symptoms. Botulinum toxin is injected into muscles or subcutaneous tissue either directly “from hand“, guided by EMG signal with a support of hollow monopolar EMG needle electrode, by direct stimulation of the muscle with hollow EMG needle electrode, guided by ultrasonography (position of the needle and the belly of a muscle) or CT.
Key words:
botulinum toxin – neuromuscular transmission – chemodenervation – dystonia – spasticity
The author declares he has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autori: doc. MUDr. Edvard Ehler, CSc.
Pôsobisko autorov: Neurologická klinika FZS Univerzity Pardubice a Pardubické krajské nemocnice, a. s.
Vyšlo v časopise: Cesk Slov Neurol N 2013; 76/109(1): 7-21
Kategória: Minimonografie
Súhrn
Botulotoxin je jedním z nejsilnějších přírodních toxinů. Je produkován anaerobní bakterií Clostridium botulinum. Způsobuje blokádu uvolnění acetylcholinu na nervosvalové ploténce s následnou poruchou převodu impulzů na sval. Současně vzniká denervační syndrom svalu, do kterého byl botulotoxin aplikován. Existuje sedm typů toxinů, které se liší svým účinkem na proteiny v presynaptickém zakončení. V klinické praxi se používá již více než 30 let a nyní jsou dostupné preparáty botulotoxinu A a B. V současnosti jsou u nás k dispozici dva preparáty botulotoxinu A (Botox® a Dysport®) a jeden typu B (NeuroBloc®). Botulotoxin je velmi účinný lék pro mnoho klinických poruch spojených se zvýšenou aktivitou svalů a zvýšenou činností autonomního systému. Botulotoxin je indikován a hrazen pojišťovnou pro cervikální dystonii a další dystonie, blefarospazmus, hemifaciální spazmus, spasticitu horní končetiny po cévní mozkové příhodě a spasticitu horní i dolní končetiny u dětské mozkové obrny. Má rovněž prokázanou účinnost u chronických bolestí hlavy, dyssynergii sfinkteru a detruzoru močového měchýře, hyperhidrózy, sialorey, v gastroenterologických indikacích (achalázie, anální fisura), v kosmetické indikaci u vrásek v obličeji a u mnoha dalších poruch. Kontraindikací je gravidita, laktace, některé nervosvalové choroby, poruchy hemokoagulace včetně antikoagulační léčby (INR nad 2,8) a zánětlivé kožní změny v místě aplikace. Mezi nežádoucí vedlejší účinky patří přílišné oslabení svalů, bolesti, krvácení a otoky v místě vpichu, cefaylea i příznaky připomínající chřipku. Botulotoxin se aplikuje do svalu či podkoží, a to přímo z ruky, za kontroly EMG signálu pomocí duté EMG elektrody, při stimulaci svalu dutou EMG elektrodou, za pomoci ultrasonografie (poloha jehly a bříška svalu) či CT.
Klíčová slova:
botulotoxin – nervosvalový přenos – chemodenervace – dystonie – spasticitaÚvod
Botuloxin je toxin produkovaný bakterií Clostridium botulinum, která patří mezi anaerobní mikroorganizmy. Intoxikace se vyskytují po požití klobás, konzerv, ale také medu – to jsou intoxikace kojenců a batolat v USA, kde se clostridium množí v úlech, a toto velmi malé množství botulotoxinu představuje nebezpečí pouze pro tak malé děti. Pro kojence jsou nebezpečné i spory clostridia, které se v jeho zažívacím traktu pomnoží a mohou produkovat toxin s následným rozvojem botulizmu [1].
Clostridium produkuje sedm typů toxinu (A–G), ale pouze typy A a B jsou komerčně dostupné pro klinické použití. Vzhledem k možnosti chybného přepočtu jednotek, léčebného schématu i výskytu nežádoucích vedlejších účinků doporučila FDA (Food and Drug Administration, USA) používání generických jmen. Pro botulotoxiny A jsou to onabotulinumtoxin A (Botox® firmy Allergan), abobotulinumtoxin A (Dysport® firmy Ipsen) a incobotulinumtoxin A (Xeomin® firmy Merz). Pro botulotoxin B je to rimabotulinumtoxin B (MyoblocTM/NeuroBloc® firmy Solstice Neurosciences) [2,3].
Principy působení botulotoxinu
Botulotoxin je endopeptidáza štěpící bílkovinu. Molekula botulotoxinu se skládá z lehkého a těžkého řetězce, které jsou spojeny disulfidickým můstkem (obr. 1). Těžký řetězec se naváže na primární acetylcholinový receptor na axonální membráně a vniká do axonu mechanizmem endocytózy. Botulotoxin se predilekčně váže na cholinergní terminální zakončení, a z toho vyplývá paralytický účinek (nikotinové receptory na zakončení motorických axonů s následnou blokádou uvolnění acetylcholinu). Blokádou uvolnění acetylcholinu na muskarinových synapsích vznikají autonomní příznaky (reaktivita zornic, redukce tvorby potu či slin). Lehký řetězec se separuje od těžkého řetězce a v axoplazmě se naváže na SNARE (Soluble N-ethylmaleimide-sensitive factor Attachment REceptor; protein sloužící k navázání na receptor). Botulotoxin A štěpí SNAP-25 (SyNaptosomal Associated Protein) na dvě části (inaktivní) a botulotoxin B štěpí VAMP (Vesicle-Associated Membrane Protein). Tímto mechanizmem dochází k zablokování uvolnění acetylcholinu do synaptické štěrbiny a k blokádě neuromuskulárního přenosu. Následně se objevuje denervační syndrom, který je prokazatelný při EMG vyšetření. Bezprostředně po aplikaci botulotoxinu dojde ke stimulaci pučení terminálních větví axonu (sprouting) a ke tvorbě nových nervosvalových plotének. Obnovení přenosu vzruchu z terminálních větví motorických axonů však není výhradně závislé na sproutingu, ale zčásti se obnoví funkce původních nervosvalových plotének [2].
Obr. 1. Schéma molekuly botulotoxinu. 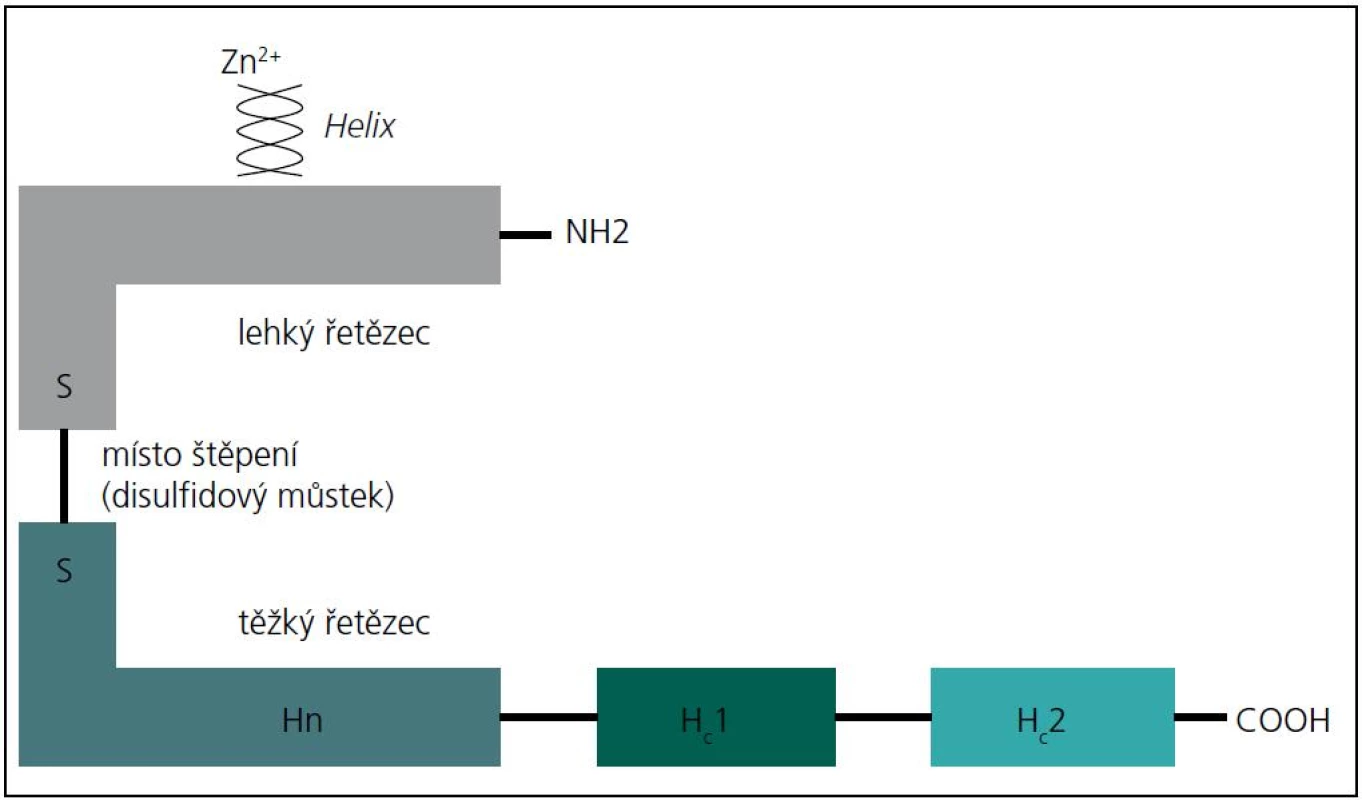
Po aplikaci botulotoxinu s klinicky přítomnou parézou svalu dochází k atrofii svalových vláken s výskytem fibrilací a pozitivních vln s následnou reinervací včetně změn akčních potenciálů motorických jednotek (MUP). Mechanizmus vzniku denervačního syndromu při blokádě neuromuskulárního přechodu není jasný; předpokládá se blokáda uvolnění trofických faktorů z presynaptického zakončení (chemodenervace) [3,4].
Obr. 2. Vazba na bílkovinu u jednotlivých preparátů, a tím je dána velikost komplexu toxin a protein i průstup tkáněmi. Xeomin obsahuje pouze molekulu botulotoxinu (50 lehký a 100 kDa těžký řetězec). 
U autonomních vláken dochází také k blokádě uvolnění acetylcholinu – na synapsích muskarinového typu. Zda dochází k obnovení funkce na podkladě kolaterál – sproutingu – není však jasné. Efekt botulotoxinu je však delší než u kosterních svalů (až rok ve srovnání s 12–14 týdny). Botulotoxin B má větší afinitu k ovlivnění synapsí autonomních vláken.
Botulotoxin (a jeho deriváty) blokují uvolnění i jiných mediátorů a působků v periferním nervovém systému (substance P, vaniloidní receptory). Z toho vyplývá i použití léku v dalších indikací – bolestivé stavy, autonomní poruchy [5].
Léčebná odpověď
Primární chybění léčebné odpovědi na podání botulotoxinu A se udává v 5–7 %. Sekundární non-responzivita je 5 %, přitom pouze u 2 % je možno prokázat neutralizační protilátky [3,6]. Botulotoxin B má podstatně vyšší imunogenicitu. V multicentrické klinické studii s léčbou cervikální dystonie botulotoxinem B se vytvořily protilátky u 1/3 nemocných, kteří na počátku studie neměli prokázánu přítomnost protilátek [26]. Přítomnost či chybění efektu botulotoxinu je možno testovat klinicky. Po aplikaci 5–7 U onabotulinumtoxinu A do m. frontalis se dá po 2–4 týdnech pozorovat snížená až chybějící odpověď – zvednutí obočí. Podstatně výhodnější je však test m. extensor digitorum brevis. Za 2–4 týdny po aplikaci 10 U onabotulinumtoxinu A do tohoto drobného svalu na dorzu nohy se sníží amplituda motorické odpovědi nejméně o 50 % proti původní hodnotě před aplikací (motorická neurografie).
Průnik tkáněmi
Obsah bílkovin v roztoku i aplikovaný objem má vliv na difuzi toxinu do svalu i okolních tkání. Botox® dodávaný v práškově formě se běžně ředí 2 ml fyziologického roztoku (100 U), Dysport® 2,5 ml (500 U). Čím vyšší je ředění a aplikovaný objem roztoku, tím je možnost průniku toxinu tkáněmi vyšší a možnost působení na okolní svaly či vzdálené svaly silnější. Začínají se dodávat hotové přípravky, bez nutnosti přípravy z práškové formy (Dysport RU® – Ready Use). Botulotoxin B se dodává již ve formě roztoku (NeuroBloc®).
Kontraindikace
Mezi kontraindikace podání botulotoxinu patří těhotenství, laktace, známá alergie na botulotoxin (či protein v daném preparátu), poruchy neuromuskulárního přenosu (myastenie, myastenický syndrom), některé nervosvalové choroby (těžší neuropatie), poruchy hemokoagulace (INR nad 2,8), lokální zánětlivé změny v místě plánovaného podání botulotoxinu [7].
Nežádoucí vedlejší účinky
Z nežádoucích vedlejších účinků aplikace botulotoxinu je třeba uvést přílišné oslabení svalů, do kterých byl lék aplikován (např. přílišné oslabení šíjových svalů s přepadáním hlavy u cervikální dystonie). Oslabení jiných svalů na podkladě difuze toxinu do okolí bývá problém (dysfagie při podání botulotoxinu do kývače či skupiny skalenů). Oslabení vzdálených svalů nebo celková slabost a únavnost bývají velmi vzácné [4]. Vyskytují se však bolesti v místě vpichu, krvácení kolem vpichu, někdy otok, anxiózní reakce, bolest hlavy či výjimečně příznaky podobné chřipce.
Možnosti podání botulotoxinu
Botulotoxin se podává intramuskulárně či subkutánně v roztoku. U většiny indikací je možná aplikace z ruky do určitého svalu. Doporučuje se aplikovat do ploténkové zóny svalu a u větších anebo delších svalů do více míst. U hlouběji uložených svalů či u dystonických svalů je vhodná aplikace za EMG kontroly signálu. Použije se dutá EMG a botulotoxin se aplikuje do místa svalu s maximální dystonickou aktivitou nebo u spasticity do místa s výraznou aktivitou provokovanou protažením (či jinou aktivací) svalu. U hlouběji uložených svalů (např. m. flexor pollicis longus či m. flexor digitorum profundus) se využívá stimulace svalu (anebo jeho části) dutou EMG elektrodou a přitom se pozorují záškuby šlachy svalu i motorický efekt svalu – pohyb v segmentu končetiny (např. flexe distálního článku palce u m. flexor pollicis longus). Pro přesné zaměření bříška svalu se při hledání polohy jehly snižuje intenzita stimulace, a to až pod 5 mA. Tím se lékař přesvědčí o správné pozici jehly uprostřed bříška daného svalu. Poloha jehly se může velmi efektivně a neinvazivně sledovat pomocí ultrazvuku a pro některé svaly se využívá i CT navádění (např. pro m. psoas maior) [8].
Pozitivní a negativní příznaky centrální spastické parézy jsou uvedeny v tab. 1.
Tab. 1. Pozitivní a negativní příznaky centrální spastické parézy. 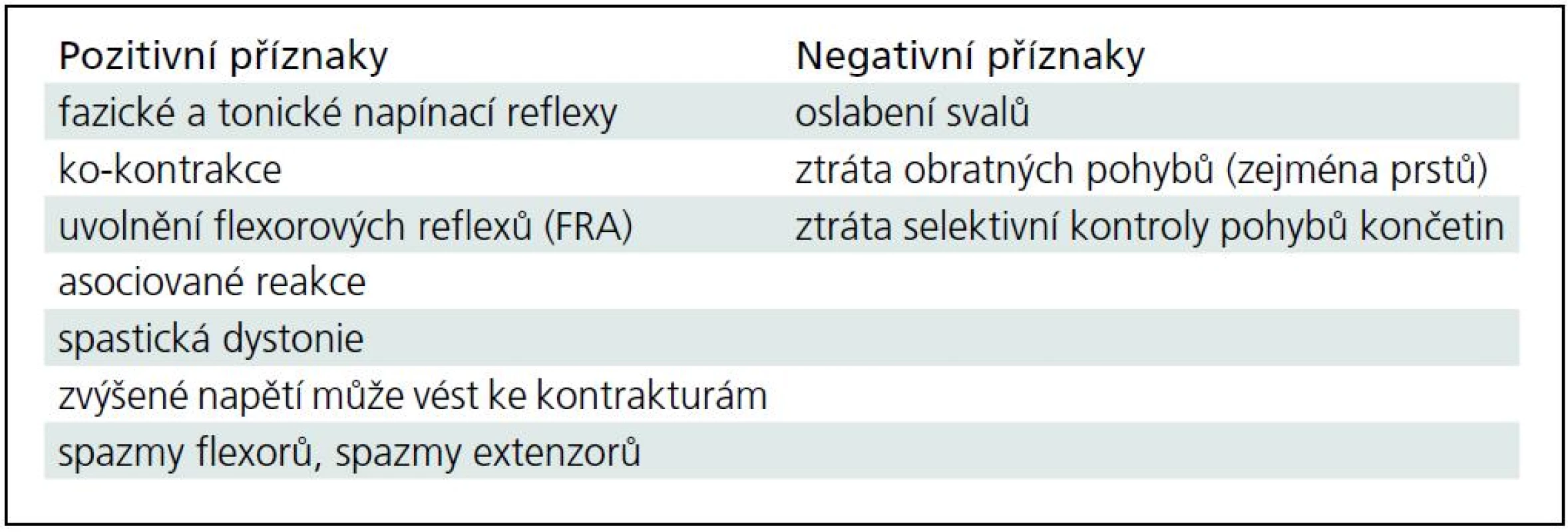
Použití botulotoxinu u jednotlivých chorob
A. Skupina dystonických poruch
Dystonie je charakterizována mimovolními, trvalými či epizodickými, v určitém pohybovém vzorci se opakujícími kontrakcemi svalů, které vedou ke kroutivým, flekčním, extenčním nebo někdy až mačkavým pohybům i k abnormální poloze pohybových segmentů. Dystonie může postihnout kterékoliv skupiny kosterních svalů. Distribuce dystonických svalů může být fokální, multifokální, segmentální či generalizovaná (tab. 2). Mezi charakteristické projevy dystonie patří ko-kontrakce agonistů a antagonistů, mimovolní šíření kontrakce do sousedních svalových skupin anebo do druhostranné končetiny, což se nazývá „zrcadlová dystonie“. Dystonie se často indukuje některými volními pohyby (action-induced). Může se však vyskytovat v klidu, a to zvláště v těžkých případech dystonie či u posttraumatických stavů s indukovanou dystonií.
Tab. 2. Spasticita horní končetiny (HK). 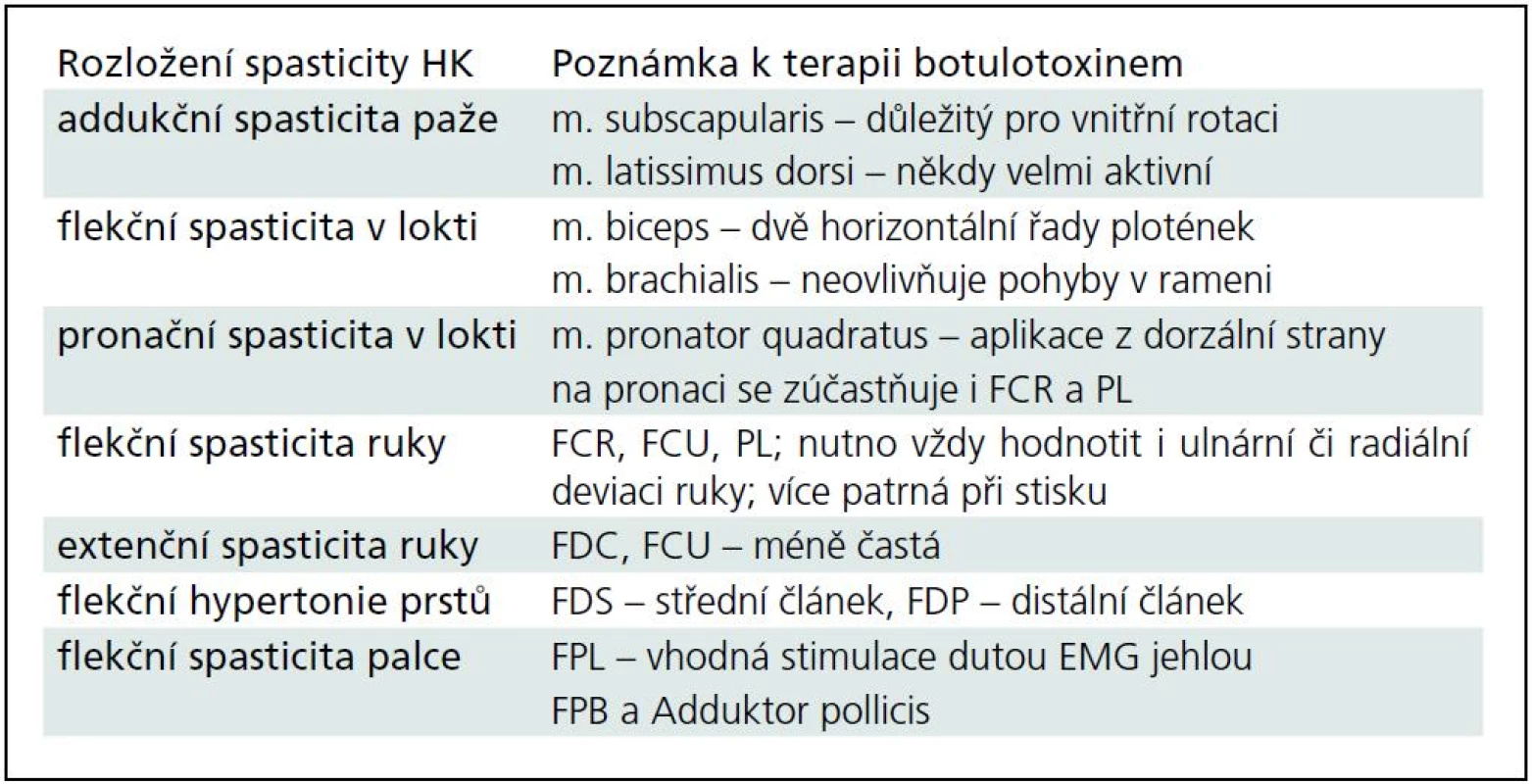
1. Cervikální dystonie
Cervikální dystonie se vyznačuje trvalými mimovolními kontrakcemi šíjových svalů, což vede k abnormálním pohybům či k abnormální poloze hlavy.
Začátek je obvykle mezi 20. a 50. rokem. I když se široce používá název „spazmodická torticollis“, nejsou kontrakce svalů spastické (spazmodické). Charakteristická je změna polohy hlavy, která nezřídka mívá jiný směr než pouze rotaci. Častá je inklinace hlavy (laterocollis), anteflexe, retroflexe, posun osy hlavy v předozadním směru (sagittal shift) či v do strany (lateral shift). Cervikální dystonie bývá provázena tremorem hlavy, který mívá dystonický charakter. Nejčastěji se manifestuje při pokusu o udržení „původní-správné“ polohy hlavy, kdy volní aktivita musí zadržovat dystonické kontrakce postižených svalů. Asi u 25 % nemocných se vyskytuje tremor horních končetin, který má charakter esenciálního tremoru. Nejméně 2/3 nemocných s cervikální dystonií udávají bolesti v šíji.
Obr. 3a) Osmapadesátiletý muž s cervikální dystonií s výraznou elevací levého ramene a lopatky. 
Obr. 3b) Pohled ze strany – rýsuje se levý kývač. 
Pro hodnocení závažnosti cervikální dystonie se používá celá řada klinických škál. TWSTRS (Toronto Western Spasmodic Torticollis Scale) hodnotí jak parametry klinického nálezu, tak rovněž průvodní bolesti i problémy při různých aktivitách. Škála TSUI (podle autora této stupnice – Tsui JKC [3]) hodnotí navíc i tremor a dyskinézy. Elektromyografické (i polygrafické) vyšetření se využívá jak k analýze vzorce dystonie s identifikací svalů s největší dystonickou aktivitou, tak zejména k výběru svalů pro aplikaci botulotoxinu a jeho dávky [7–10].
Úkolem terapie cervikální dystonie je zabránit abnormálnímu držení hlavy a dystonickým kontrakcím šíjových svalů. Stejně důležitá je redukce průvodní bolesti hlavy a šíjových svalů. Dalším úkolem je předejít následným komplikacím – rozvoji cervikální radikulopatie a myelopatie. V terapii cervikální dystonie se zpočátku užívala anticholinergika (trihexyfenidyl), pak benzodiazepiny (klonazepam) i centrální myorelaxancia (baklofen). Medikamentózní terapie cervikální dystonie však nemívá tak výrazný efekt na dystonické kontrakce svalů a kromě toho je doprovázena celou řadou nepříznivých vedlejších účinků. Proto se u nemocných s výraznou cervikální dystonií indikovala operace, která zmírnila, někdy dokonce i odstranila dystonické kontrakce šíjových svalů. Jako průvodní příznak došlo k poruše držení vzpřímeného postavení hlavy, poruše fixace ramen, lopatek, často k určitému stupni dysfagie i k výraznému algickému vertebrogennímu syndromu při paréze s atrofií šíjových svalů. Nejčastěji se jednalo o operaci dle Foerstera a Dandyho s přerušením kořenů C1–C4 bil. a obou nn. accessorii. V současnosti se u nás tato mutilující operace již nepoužívá. U závažných případů s rezistencí na léčbu botulotoxinem je v současné době indikována hluboká mozková stimulace (DBS).
Obr. 4a) Pětašedesátiletý muž, sportovec, před 25 lety provedena operace sec. Foerster a Dandy. Pokles ramen, odstávající lopatky. 
Obr. 4b) Pohled se strany – atrofie svalů na krku (včetně m. trapezius) s nevelkou kyfózou horního krčního úseku. 
Zcela nové období v léčbě cervikální dystonie začalo zařazením botulotoxinu do léčebného schématu. Botulotoxin je indikován jako lék prvé volby u cervikální dystonie, která je klinicky závažná – dle TWSTRS dosáhne tíže 10 a více bodů. U cervikální dystonie jsou nejčastěji postiženy mm. splenius capitis, splenius cervicis, levator scapulae, trapezius, scaleni, semispinalis capitis a sternocleidomastoideus. Před aplikací botulotoxinu do dystonických svalů je důležité provést klinický rozbor s určením svalů, do kterých se bude lék aplikovat, v jaké dávce a do kolika bodů v dystonickém svalu. K určení úrovně a distribuce dystonické aktivity je velmi přínosný neurofyziologický rozbor na podkladě vyšetření jednotlivých šíjových svalů jehlovou EMG elektrodou. Vyšetření jednotlivých dvojic svalů v programu turns/amplitude určí přítomnost dystonické aktivity (T/A nad 100/s), středně výrazný stupeň dystonické aktivity s indikací aplikace botulotoxinu (T/A nad 200/s), určí lokalizaci maxima dystonické aktivity (v průběhu svalu i určitou vrstvu svalu), identifikuje dystonický tremor (pršky potenciálů s určitou frekvencí), kombinaci tremoru s dystonickou kontrakcí i aktivitu svalů při prudkém nárůstu stáčení hlavy s atakovitým výskytem [8].
2. Blefarospazmus
Blefarospazmus se vyznačuje mimovolním zavíráním obou očí při dystonických kontrakcích m. orbicularis oculi se svíráním víček (pretarzální části) i obočí (orbikulární části svalu). Zvýšená frekvence mrkání je spojena s pocitem dráždění či suchosti očí a často tyto pocity předchází pozdější trvalé kontrakci svalu se zavřením očí. Pouze u 20 % nemocných jsou v průběhu let dystonické projevy omezeny na m. orbicularis obou očí. Dystonické kontrakce se šíří na okolní mimické svaly (m. procerus, m. corrugator supercillii), na střední etáž obličeje a někdy se objeví i cervikální či oromandibulární dystonie (syndrom Meigeho). Prevalence blefarospazmu se udává 32 osob na 100 000 obyvatel a ženy jsou postiženy častěji (3 : 1).
Blefarospazmus se provokuje prudkým nebo intenzivním světlem, námahou očí, akcentuje se ve stresové situaci. Tito nemocní pak mají problémy se čtením, psaním, sledováním televize, řízením, často pak nejsou schopni přejít silnici – v této stresové situaci se provokuje trvalá kontrakce orbikulárních svalů. Spazmy se sevřením víček mohou být zmírněny či blokovány mluvením, zíváním, zpíváním anebo jinými „senzorickými triky“. Závažnost blefarospazmu se může hodnotit podle různých škál. Jankovičova škála hodnotí mrkání, třepotání víček a spazmy víček. Přitom vždy vyjadřuje tíži a frekvence jednotlivých příznaků [3]. BSDI (The Blepharospasm Disability Index) posuzuje postižení specifických každodenních aktivit – čtení, sledování televize, nakupování, chůze, denní aktivity a řízení. Každé položce přisuzuje 0–4 body. Nemocní s blefarospazmem mají sníženou kvalitu života s různě výrazným omezením činnosti (čtení, sledování televize, řízení, pobyt na slunci).
Prvé klinické zkušenosti s užitím botulotoxinu pro blefarospazmus popsali Fahn et al v roce 1985 [11]. U svých osmi nemocných aplikovali do m. orbicularis oculi na jedné straně 10 U botulotoxinu A a na opačné straně pouze fyziologický roztok. U nemocných s aplikací botulotoxinu došlo ke klinickému zlepšení, kdežto na straně aplikací fyziologického roztoku zůstaly potíže stejné. Své výsledky podpořili neurofyziologickými nálezy (EMG). O dva roky později potvrdili efekt léčby blefarospazmu pomocí botulotoxinu Jankovic et al [3]. Aplikace 25 IU botulotoxinu A pro jednu stranu vedla ke zlepšení tíže dle Jankovičovy škály u 72 % a subjektivní zlepšení udávalo 61 % nemocných. Efekt léčby začal v průměru po 3,7 dnech od aplikace a trval 12,3 týdnů. Z vedlejších nežádoucích účinků se vyskytla ptóza víčka, lakrimace, ekchymózy, rozmazané vidění i diplopie. Až do současnosti byla provedena celá řada randomizovaných, placebem kontrolovaných studií i studií srovnávajících účinek jednotlivých preparátů (Botox®, Dysport®, Xeomin®, Prosigne®, NeuroBloc®) [1,7,9]. Porovnává se doba nástupu účinku, trvání léčebného efektu, výskyt vedlejších reakcí, místa aplikace a dávky, ředění preparátu. Při použití botulotoxinu B [12] byl docílen dobrý až vynikající klinický efekt, který však trval pouze 7,3 týdnů. Došlo ovšem k výrazným vedlejším nežádoucím účinkům – bolest v místě vpichu (100 %), ptóza (32,3 %) a suchost úst (17,2 %).
V současné době se doporučuje aplikace do pretarzální porce mediálně i laterálně (nikoliv do preseptální části) m. orbicularis oculi, a to do obou víček. Přitom při podání do horního víčka je nutno aplikovat hodně mediálně, a tím se vyhnout případné difuzi léku do velmi citlivého m. levator palpebrae superioris (s následnou ptózou víčka), a při podání do mediální části dolního víčka zase neaplikovat příliš mediálně pro možnost difuze do m. obliquus bulbi inferior (s následnou diplopií). Aplikace do pretarzální části m. orbicularis oculi by měla u značné části nemocných stačit. Výrazný podíl spazmu pretarzální porce je možno diagnostikovat klinicky – pozorováním, přičemž „kymácení řas“ je jeho typickým projevem a dobrou pomůckou pro aplikujícího lékaře. Pokud je přítomen spazmus i v orbikulární porci, je indikována infiltrace této části svalu – ve 2–4 bodech. Šíří-li se spazmus i na čelo, pak je možno aplikovat do m. procerus a m. corrugator supercillii (vraštění obočí, vertikální vráska uprostřed čela). Při asymetrickém zvedání obočí je vhodná aplikace do m. frontalis, při krčení nosu do m. compressor nasi a při roztažení chřípí – m. levator allae nasi. Pokud se spazmus šíří na střední etáž obličeje, je doporučována aplikace do orbikulární porce m. orbicularis oculi, ale nedoporučuje se infiltrace mm. zygomatici či m. levator labii superioris. Tyto svaly jsou totiž vůči botulotoxinu velmi citlivé a jejich oslabení vede k poklesu ústního koutku, k asymetrii mimiky a k funkčním potížím – dysartrii, vytékání slin pokleslým koutkem, velmi senzitivně vnímanému nepříznivému estetickému efektu. Postačí jen aplikace do dolní části orbikulární porce a následným oslabením této části svalu i mírnou difuzí botulotoxinu do svalů tváře se vytvoří dostatečný efekt s redukcí spazmů ve střední etáži obličeje.
V léčbě blefarospazmu se doporučuje aplikace Botoxu® pro jednu stranu v dávce 15–30 U (10–46), Dysportu® 45–80 U (40–160) a NeuroBlocu® 1 000–2 000 U (1 000–9 000).
3. Oromandibulární dystonie
Oromandibulární dystonie se projevuje mimovolními dystonickými spazmy čelisti, úst a jazyka, při kterých se objevuje bruxizmus (skřípání zuby), mimovolní pohyby jazyka, otevírání a zavírání úst, pohyby dolní čelisti do stran i v sagitální rovině (včetně předsunutí mandibuly). Tyto dystonické projevy vadí při žvýkání, artikulaci i polykání. Druhotně dochází k obrušování zubů i k přetížení a strukturálním změnám temporomandibulárního kloubu. U těžších forem se oromandibulární dystonie projeví až těžkou dysartrií, dysfagií, bolestmi dystonických svalů i temporomandibulárního kloubu a sociálními problémy způsobenými viditelnou výraznou dystonií žvýkacích svalů. U části nemocných dochází k rozšíření dystonie na faryngeální a laryngeální svaly s následnou dysfagií, dysfonií, poruchami ventilace i mimovolní vokalizací. Také u oromandibulární dystonie jsou ulevující manévry – „senzorické triky“. Používá se dotek prstu, rtů či brady, žvýkání žvýkačky, aktivní řeč nebo zatlačení na submentální krajinu.
V rámci dysfunkce temporomandibulárního kloubu spojené s dystonií svalů této krajiny (zejména žvýkacích, ale také šíjových) je možno rozlišit několik klinických syndromů – bruxizmus, oromandibulární dystonie, myofasciální bolest (v oblast TM kloubu), hypertrofie m. masseter či m. temporalis superficialis (často jednostranná), trizmus, tenzní bolesti hlavy [3].
Léčba oromandibulární dystonie obvykle začíná fyzikální terapií, stomatologickým přístupem s korekcí okluze a s průvodnou analgetickou medikací (nesteroidní antirevmatika, běžná analgetika). Pokud se zjistí porucha TM kloubu, zvažuje se stomatochirurgický zákrok. Při dystonii však žádná z uvedených metod nevede k trvalejšímu zlepšení potíží. U těchto nemocných je indikováno EMG vyšetření žvýkacích svalů s určením typu kontrakce (dystonie), tíže dystonie i rozsahu postižení. Na zavření úst se účastní mm. masseter, temporalis superficialis, pterygoideus internus. Otevírání úst je funkcí m. pterygoideus externus, m. digastricus (přední bříško) i m. platysma. Laterolaterální pohyby dolní čelisti (m. pterygoideus internus) i předsunutí brady (m. pterygoideus externus a m. platysma) mají složitější mechanizmus a svaly účastnící se těchto pohybů je nutno identifikovat při EMG vyšetření.
Aplikace botulotoxinu do dystonických svalů u oromandibulární dystonie je účelné provést s pomocí duté EMG elektrody a s monitorováním dystonické aktivity jednotlivých žvýkačů. Používá se aplikace botulotoxinu do 4–5 bodů m. temporalis, 3–5 bodů m. masseter. M. pterygoideus medialis je možno aplikovat z intraorálního přístupu, avšak dotek sliznice v oblasti mediální plochy úhlu mandibuly je nepříjemný, bolestivý a může vyvolat zvracivý reflex či nauzeu. Při výskytu těchto potíží je vhodné využít submandibulární přístup. Kromě intraorálního přístupu je možno m. pterygoideus lateralis dosáhnout také extraorálně – vpichem duté EMG před processus coronoides. Sval se aktivuje latero-laterálními pohyby dolní čelisti.
V léčbě oromandibulární dystonie se botulotoxin užívá od konce 80. let minulého století. Používá se aplikace dutou EMG jehlou za monitorování dystonické aktivity svalů, a to zejména pro oba mm. pterygoidei. Infiltrují se svaly na obou stranách. Počáteční dávka Botoxu® pro m. masseter je 25 U (průměrná 15–75), pro m. temporalis 12,5–25 U (12,5–50), pro m. pterygoideus externus 7,5 U (7,5–15) a m. pterygoideus internus 7,5 U (7,5–25). V celé řadě klinických studií se hodnotilo klinické zlepšení oromandibulární dystonie (průměrně v 70 %) za podmínek definice terapeutické odpovědi – 50% redukce bolesti a frekvence bolestivých spazmů [13]. Asi u 10 % se vyskytly nežádoucí vedlejší účinky, a to zejména slabost žvýkačů, mírná změna mimiky (zvláště při smíchu), lokální krvácení a nevelké bolesti v místě vpichu.
4. Meigeho syndrom
Meigeho syndrom je segmentová dystonie, jejíž součástí je oromandibulární dystonie, a to v kombinaci s blefarospazmem či s cervikální dystonií.
Klinická i neurofyziologická diagnostika, aplikace botulotoxinu včetně použití duté EMG jehly je současný postup v terapii [3,7].
5. Fokální dystonie ruky
Fokální dystonie ruky je nejčastější dystonií postihující končetiny. Zpočátku se projevuje pocity napětí a neklidu ruky, postupně se objevuje neobratnost ruky a tuhost svalů, v rozvinutých případech pak rozvoj abnormální postury ruky. Porucha funkce vede k obtížím až nemožnosti psaní, drobných obratných a zejména rychlých pohybů ruky i prstů. Často se vyskytne i pobolívání ruky, předloktí se šířením k rameni. Dystonie obvykle vymizí, když postižená osoba přestane vykonávat ty úkony, které potíže provokovaly. Objeví se však znovu i po delším časovém intervalu při provokující zátěži. U některých osob dochází k progresi příznaků – zpočátku se objevují při provokující zátěži jednoduché křeče, postupně se ztrácí specifita provokovaných křečí, až se objevují „dystonické křeče“, a to při jakékoliv zátěži ruky. Typické dystonické křeče (někdy pouze dystonický tremor) se objevují při psaní, dále u hudebníků (klavíristé – zejména dystonická flexe 4. a 5. prstu, kytaristé – 3. prst, klarinetisté – extenční dystonie 3. prstu atd.), některých povolání (švadleny, dlaždiči atd.) a určitých sportovců (golfisté). Dystonie ruky se vyskytuje také u nemocných s pokročilou Parkinsonovou chorobou. Tehdy bývá dystonie velmi tuhá, fixní („dystonic clenched fist“).
Obr. 5. Písařská křeč u 48leté učitelky mateřské školy. Křečovité (dystonické) sevření tužky se objevuje pouze při psaní, takže je psaní zcela blokováno. 
Prevalence fokální dystonie ruky se udává ve velkém rozmezí – 7 až 69 případů na milión obyvatel. Dystonie hudebníků se podle odhadů vyskytuje u 0,2–0,5 % populace, typicky ve středním věku. Písařská křeč i křeč muzikantů jsou častější u mužů. Asi u 5–20 % nemocných s písařskou či muzikantskou křečí se zjistí v rodině další osoby s projevy dystonie.
Terapeutický postup se obvykle začíná změnou zátěže ruky s úplným ukončením provokující činnosti (psaní, hry na hudební nástroj, speciální pracovní činnosti). U písařské křeče se zkoušejí jiné tvary psacích pomůcek, držadel, dále psaní opačnou rukou. Avšak asi u 25 % se vyskytne dystonie také na druhé ruce. Zkouší se různé fyzikální metody, chirurgické – lezionální – metody (thalamotomie, palidotomie) a hluboká mozková stimulace. Medikamentózní léčba (anticholinergika, benzodiazepiny, baklofen) nemá podstatnější léčebný efekt.
V posledních 25 letech je terapie lokální aplikací botulotoxinu do dystonických svalů standardní postup. I když má botulotoxin výrazný efekt na fokální dystonii ruky, nedosáhne se však nikdy normální funkce ruky, přestože se funkční zapojení ruky v jednotlivých úkonech zlepší. Podstatněji se ovlivní tuhost ruky i její abnormní postavení než jemná motorika ruky. U velmi tuhé dystonie ruky parkinsoniků vede terapie botulotoxinem k ústupu bolesti a umožní provádět dostatečnou hygienu ruky.
Výběr svalů pro léčbu botulotoxinem se stanoví jednak klinickým pozorováním, rozpoznáním dystonických modifikací jednotlivých pohybových vzorců i na podkladě EMG průkazu excesivní aktivace svalů. Vzhledem k velké variabilitě dystonie ruky je selekce svalů vždy pro jedince specifická. Při výběru svalů vhodných k aplikaci botulotoxinu je nutno diferencovat mezi svaly s dystonií a svaly s kompenzační hyperaktivitou. Pro identifikaci dystonických svalů je vhodné snímat EMG aktivitu v průběhu vyvolávající činnosti – psaní tužkou, na klávesnici, při hře na hudební nástroj. EMG u fokální dystonie prokazuje příliš intenzivní kontrakce agonistů i „přelévání“ této aktivity do svalů, které se normálně na tomto pohybu nepodílejí. Používá se ředění s nižší koncentrací botulotoxinu, a to zvláště pro drobné svaly ruky. Dávky botulotoxinu se pohybují do 120 U Botoxu® a 400 U Dysportu®.
Velmi častou nežádoucí vedlejší reakcí je přílišné oslabení svalů, do kterých se botulotoxin aplikoval, a difuze léku do okolních svalů. V rámci klinických studií se přílišné oslabení svalů vyskytovalo v 53–100 % a trvalo v průměru 1–2 měsíce. Z dalších nežádoucích účinků se vyskytují bolesti v místě vpichu, infekce, hematomy, mírné chřipkovité příznaky [7,9].
6. Fokální dystonie nohy
Fokální dystonie nohy se vyskytuje v rámci primární generalizované dystonie u dětí a v dospělosti u parkinsoniků. Izolovaná fokální dystonie nohy je však vzácná a vede k poruše stoje a chůze s výskytem bolesti až u 50 % nemocných. Nejčastější dystonický vzorec nohy je kombinace inverze nohy a flexe prstů. Může se však vyskytovat plantární i dorzální flexe nohy a u některých nemocných bývá spíše extenze než plantární flexe prstů.
V terapii dystonie nohy se zkouší medikamentózní ovlivnění s malou úspěšností, fyzikální léčba, chirurgické zákroky (včetně prodloužení šlach). U některých pacientů má efekt léčba L-dopou. Botulotoxin velmi příznivě ovlivní postavení nohy i prstů. Pro relativně velké svaly (mm. gastrocnemii, solleus, tibialis posterior, flexory či extensory prstů a palce) je však třeba poměrně velké dávky léku. Z vedlejších účinků pak není popisována podstatnější slabost svalů po aplikaci, ale pouze jejich místní bolestivost a lokální krvácení [3].
7. Hemifaciální spazmus
Hemifaciální spazmus se projevuje jednostrannými, mimovolními a nepravidelnými klonickými i tonickými kontrakcemi svalů v inervační oblasti n. facialis. Vyskytuje se většinou sporadicky, i když byl popsán i rodinný výskyt. Kontrakce začínají v oblasti m. orbicularis oculi, často na dolním víčku, pak se postupně šíří na mimické svalstvo. Kontrakce m. frontalis s elevací obočí představuje „Babinského příznak“ – typicky se vyskytující a v diferenciálnědiagnostickém procesu svou přítomností potvrzující přítomnost hemifaciálního spazmu. Nejčastějším patogenetickým mechanizmem je komprese kořene n. facialis v blízkosti kmene, a to jinou anatomickou strukturou (nejčastěji abnormálně probíhající cévou). V přechodné výstupové zóně kořene dochází axono-axonálnímu kontaktu s následnou tvorbou efaptických převodů vzruchů mezi axony i ke zvýšené excitabilitě jádra n. facialis. Existují i oboustranné formy hemifaciálního spazmu, které však na rozdíl od blefarospazmu mají asynchronní kontrakce mimických svalů na obou stranách. Hemifaciální spazmus se projevuje jak poruchou funkce (sevření oční štěrbiny, kdy pacient na jedno oko nevidí), tak je i rušivý ve společenském styku. A protože přetrvává i v noci, ruší spánek a vede k insomnii.
Obr. 6. Hemifaciální spazmus vlevo u 40letého muže, sportovce. Pro noční spazmy se sevřením levé nosní dírky nemůže spát na levém boku. 
V léčbě je perorální medikace málo účinná (karbamazepin, klonazepam, baklofen). Operační řešení – mikrovaskulární dekomprese kořene n. facialis, který je v kontaktu s cévou – mívá sice vysokou efektivitu (88–97 %), ale recidivy bývají až 25% v průběhu dvou let. Vlastní operace je zatížena značným výskytem nežádoucích účinků (porucha sluchu, závratě, kmenové syndromy).
V posledních 20 letech je aplikace botulotoxinu do mimických svalů léčbou první volby. Doporučuje se infiltrovat pretarzální porci obou víček vždy dvěma vpichy. Při šíření spazmu pak také orbikulární porci, mm. procerus, corrugator supercilli, frontalis, levator allae nasi. Nedoporučuje se infiltrace m. orbicularis oris, mm. zygomatici. Pokud jsou kontrakce m. platysma výrazné, pak je infiltrace jednotlivých pruhů platysmatu velmi efektivní. Botox® se používá v dávce 15–50 U, Dysport® 40–130 U, NeuroBloc® 1 000–1 500 U. Účinnost léčby dosahuje 75–100 %. Z nežádoucích vedlejších účinků se vyskytuje ptóza víčka, diplopie, chemóza spojivky, drobná krvácení po vpichu [7,9].
8. Spazmodická dysfonie
Spazmodická dysfonie je fokální laryngeální dystonie a projevuje se spazmy hlasových vazů, které jsou provokovány fonací. Dysfonie se typicky manifestuje při řeči. Klinicky lze snadno rozeznat addukční formu s přiškrceným (strangulovaným) hlasem a abdukční formu s hlasem „plným vzduchu“ (breathy hypophonic voice). Zatímco adduktorický typ spazmodické dysfonie je způsoben dystonickou kontrakcí adduktorů hlasových vazů (zejména mm. thyreartenoideus a cricothyreoideus), abduktorický typ je projevem dystonie abduktorů hlasivek (zvláště m. cricoarytenoideus posterior). Podstatně častější (asi 80%) adduktorický typ mívá také hrubý, mnohdy až roztřesený hlas s častými zárazy fonace, které jsou způsobeny přílišnou addukcí hlasových vazů, někdy přecházející až do kratičkých úseků fonace – „staccato-like voice“. Méně častý abduktorický typ mívá spazmy m. cricoarythenoideus posterior s „dyšným“, namáhavým a hypofonickým hlasem s náhlým ukončením fonace či přechodem do šepotu. Smíšený typ (adduktorický-abduktorický) se projevuje směsicí jak „dyšných přerušovaných úseků“, tak i zhrubělých a utažených zvuků.
Klinické vyšetření obvykle určí typ dysfonie a případného podílu kompenzačních mechanizmů. Pro přesnější zhodnocení a kvantifikaci se využívají škály. The Unified Spasmodic Dysphonia Rating Scale je standardizovaná a validizovaná škála, která hodnotí kvalitu hlasu při čtení, konverzaci, hlasových a řečových úkolech. Global Rating Scale hodnotí jednotlivé kvality hlasu a vyjadřuje je v procentech normy. Laryngoskopie (fibroskop) a stroboskopie poskytují informace o pohybu hlasivek v průběhu fonace. Pomocí laryngeálního EMG lze určit svaly zapojené v produkci tremoru, hyperaktivitu svalů i oblasti maximální dystonie [14].
V terapii se využívá foniatrických metod, včetně behaviorálního přístupu, psychoterapie. Jen v nevelkého počtu nemocných je úspěšná medikamentózní terapie (klonazepam, lorazepam, baklofen, gabapentin, primidon). U rezistentních případů se využívá chirurgických metod (neurotomie – n. recurrens, n. laryngealis superior), zákroky na svalech (m. thyreoarythenoideus) i fixace hlasivek.
Obr. 7. Asociovaná reakce – zvyšující se abdukce levé paže při stoji a chůzi u 66letého muže jeden rok po ischemické CMP v řečišti a. cerebri media vpravo se středně výraznou levostrannou hemiparézou. 
Prvou aplikaci botulotoxinu pro adduktorický typ spazmodické dysfonie provedl v r. 1984 Blitzer. Tentýž autor o čtyři roky později aplikoval botulotoxin do m. cricoarythenoideus posterior pro abduktorických typ. V současné době je botulotoxin v léčbě všech typů spazmodické dysfonie na mnoha pracovištích primární terapií a existují soubory s více 1 000 nemocnými. Botulotoxin je možno aplikovat jednostranně (což mívá dostačující klinický efekt) i oboustranně, a to nejlépe při laryngálním EMG pomocí duté jehly se sledováním úrovně dystonické aktivity. Další možností je aplikace do m. cricoarythenoideus anterior při nepřímé laryngoskopii – přes sliznici. Možná je i infiltrace svalů ze zevního přístupu (přes kůži) a bez sledování EMG signálu. Při zahájení terapie se začíná nízkými dávkami (Botox® 1–2 U či Dysport® 3–5 U do jednoho svalu). Při opakovaných aplikacích lze zvýšit dávku na sval až na 5–10 U či 15–20 U Dysportu®. Z nežádoucích účinků lze uvést pocit mírného nedostatku dechu (až ve 35 %) a pocit dušení (až u 15 %). Při oboustranné aplikaci jsou nežádoucí vedlejší účinky častější – mírná dysfagie, aspirace, pocit dušnosti. Po podání botulotoxinu nemocní kladně hodnotí podstatný ústup potíží.
9. Další poruchy
V oblasti laryngu a mluvidel jsou ještě tři poruchy, u kterých je terapie botulotoxinem účinná.
Spazmodická laryngeální dystonie je addukční dystonie hlasivek s dušností a nápadným dystonickým stridorem, který je nejčastější přítomen v inspiriu. Vyskytuje se u neurodegenerativních chorob (např. u multisystémové atrofie). Botulotoxin se aplikuje do thyreoarytenoidního svalu oboustranně (např. Botox® v dávce do 4 U pro každou stranu).
Koktání je mimovolní, slyšitelné či tiché opakovaní prvků řeči (slabik, zvuků) a slov. V patofyziologii koktání je důležitý výskyt spazmů adduktorů v oblasti laryngu, což zablokuje proud vzduchu (glottal block). Po jednostranně infiltraci m. thyreoarytenoideus botulotoxin zablokuje spazmy laryngu. Tím se uvolní cesta k další logopedické péči.
Tremor hlasu se vyskytuje poměrně často. Je různého typu – parkinsonský (frekvence 4–6 Hz), esenciální, provází spazmodickou dysfonii. Tremor může být ohraničen pouze na hlasivky, ale může být současně spojen se synchronními kontrakcemi svalů jazyka, rtů, laryngu i bránice. Zčásti je možno tremor hlasu ovlivnit medikamentózní léčbou (např. u parkinsoniků či esenciálního tremoru) a u části nemocných je jednostranná infiltrace m. thyreoarytenoideus a případně i cricothyreoideus botuloxinem logickým postupem s dobrým efektem [3,9].
11. Tiky
Tiky jsou náhlé, nepravidelně se opakující, ale stereotypní pohyby nebo zvuky rušící normální aktivitu [10]. Prvé použití botulotoxinu pro tiky bylo u nemocného s Tourettovým syndromem a dystonickými tiky postihujícími oční víčka a šíjové svaly. Efekt léčby trval několik týdnů. Postupně byl botulotoxin použit v léčbě tiků postihujících šíjové svaly, paraspinální svaly v hrudní úrovni ramene, různé etáže mimického svalstva, skalp, předloktí, nohu, m. rectus abdominis . Nástup účinku byl v průměru po 3,8 dnech a léčebný efekt trval 14,4 týdnů. Botulotoxin je indikován i pro hlasové tiky, kdy výrazně zlepšuje kvalitu života těchto nemocných se sociálním hendikepem. Scott et al v r. 1996 publikovali skupinu s vokálními tiky, kterým aplikovali po 2,5 U Botoxu® do m. thyreoarytenoideus. U 93 % došlo ke zlepšení, u 50 % z nich tiky zcela vymizely. Nástup účinku nastal za 5,8 dne a trval 102 dny. Jediným významnějším nežádoucím vedlejším efektem terapie byla lehká hypofonie (až u 80 %) [3,15].
B. Použití botulotoxinu u centrální spastické parézy – spasticity
Syndrom centrálního motoneuronu sestává z příznaků pozitivních i negativních (tab. 1). Spasticita vzniká při poruše pyramidové dráhy a současně i dráhy parapyramidové, která začíná v suplementární motorické korové oblasti. Dochází k dysbalanci řízení motoriky na úrovní míšního segmentu s hyperfunkcí gama-kličky, která je jedním ze základních principů vzniku spastické hypertonie. U léze centrálního motoneuronu se nachází kombinace jak snížené aktivity volních pohybů, tak zvýšené aktivity mimovolní hybnosti (negativní a pozitivní příznaky) [1,16–18].
Spasticita je definována jako zvýšení tonických napínacích reflexů, které je závislé na rychlosti protažení svalů a vzniká poruchou zpracování aferencí na úrovni míšního segmentu. Z důležitých patofyziologických mechanizmů je nutno zdůraznit zvýšenou aktivitu alfa motoneuronů, a to na podkladě změněné aference, pohyby jsou však usnadněny pouze v jednom směru (unidirekcionální facilitace), je změněna reciproční inhibice, ko-kontrakce, fenomén pérového odporu, fenomén sklapovacího nože a další příznaky. Při klinickém a patofyziologickém rozboru spasticity je nezbytné vzít v úvahu nejen spastickou „na protažení závislou“ hypertonii svalu, ale také asociované reakce, flexorové a extenzorové reflexy a spazmy, spastickou ko-kontrakci, spastickou dystonii, změny svalové tkáně i šlach (kontraktury a další), kožní změny, změny kloubů a kostí indukované spastickou, druhotné poruchy osobnosti nemocného a další fakta [19–21].
Obr. 8. Třiašedesátiletá žena s těžší spastickou levostrannou hemiparézou – flekční spasticita předloktí a prstů. 
Obr. 9. Osmapadesátiletá žena šest měsíců po CMP s pravostrannou hemiparézou – spasticita ruky s flexí v zápěstí, extenzí prstů a ulnární dukcí ruky. 
Z funkčního hlediska je možno diferencovat spasticitu generalizovanou, fokální a multifokální. Fokální spasticita se vyznačuje výraznou svalovou hypertonií (a dalšími průvodními projevy – omezením rozsahu pohybů, tvorbou kontraktur, ko-kontrakcí atd.) v segmentu jednoho či dvou sousedních kloubů. Je častěji lokalizována na končetinách. Má dobrou terapeutickou odpověď na botulotoxin [22].
Generalizovaná spasticita je vyznačena jak na končetinách, tak na svalstvu trupu, šíje, v oblasti svalů inervovaných hlavovými nervy. Mívá více difuzních reakcí, spazmů (flekčních i extenčních), viscerálních projevů (např. spastický močový měchýř), tendencí ke vzniku dekubitů a má horší odpověď na terapii botulotoxinem.
Multifokální spasticita je zvýrazněna v oblasti několika kloubů, které však spolu nesousedí.
Z topografického hlediska je možno spasticitu dělit na spasticitu vznikající při hemisferální lézi (kortikální, subkortikální, capsula interna a hlubokých strukturách), kmenové či při lézi spinální. Přitom spasticita cerebrální mívá výraznější projevy fokální, více posturálních vzorců. Spinální spasticita je difuznější, často provázena spazmy, mívá více bolestivých projevů a hůře reaguje na botulotoxin. Podstatně lepší bývá odpověď na celkově podaná myorelaxancia (baklofen, intratékální podání baklofenu pumpou, benzodiazepiny, tizanidin, kanabinoidy).
Spasticita je velmi častý příznak. U cévních mozkových příhod se vyskytuje ve 21–38 %, u recidiv CMP až ve 45 %. U roztroušené sklerózy až v 85 %, přitom se jedná o spasticitu cerebrální, kmenovou a nejčastěji o spinální s rozvojem od extenční až po flekční spasticitu s kontrakturami (po přerušení míšních drah – obou retikulospinálních i vestibulospinální). U stavů po traumatické spinální lézi bývá spasticita v 65–74 %. Vysoký je výskyt spasticity rovněž po traumatických poraněních mozku, u nádorů (míšních i mozkových), zánětlivých chorob (myelitidy, encefalitidy), degenerativních onemocnění (např. ALS či primární laterální skleróza) [17].
V terapii spasticity je vždy základem rehabilitace, a to včetně strečinku, dlahování, ortéz, dále cíleného nácviku základních úkonů (stoje, chůze, úchopové funkce ruky). Nedílnou součástí je i ergoterapie. U generalizované spasticity je účelné začít celkovým podáním myorelaxancií (baklofen, benzodiazepiny, tizanidin, dantrolen). Pokud efekt těchto klasických myorelaxancií nebude dostatečný, je možno zkusit i nověji zavedené léky, které kromě myorelaxačního efektu mají i další účinky (kanabinoidy, neurontin, karbamazepin). Z medikamentózní léčby je u fokální spasticity primární terapie botulotoxinem. Podání botulotoxinu do spastických svalů (po příslušném klinickém a neurofyziologickém rozboru) má mnoha studiemi prokázaný efekt jak na spasticitu, tak na zlepšení funkce (ruky, nohy), jakož i na zlepšení kvality života. Nemocní s fokální spasticitou – zejména nemocní po CMP – nemají být primárně léčeni myorelaxační léčbou. Centrální myorelaxancia nemají výrazný efekt na fokální spasticitu a kromě toho vykazují výrazné vedlejší účinky – sedaci, poruchu paměti, únavnost, zhoršenou spolupráci.
Při hodnocení terapeutického efektu daného léku u spasticity je nutno rozlišit, zda se jedná o spasticitu bez dalšího vývoje (stavy po traumatu míchy, mozku, stabilizovaná spasticita po CMP), či zda se jedná o nestabilní či progredující spasticitu (roztroušená skleróza) anebo o spasticitu u rozvíjejícího se nervového systému a rostoucího dítěte (DMO) [23,24].
Obr. 10. Dvaašedesátiletá žena rok po ischemické CMP s levostrannou hemiparézou – flekční spasticita ruky s ulnární dukcí, addukcí a flexí palce, flexí prstů. 
Obr. 11. Dvaadvacetiletý muž, devět měsíců po krvácení z arteriovenózní malformace s hematomem v pravém frontálním laloku. Spasticita levé ruky s flexí 1.–3. prst a extenzí 4.–5. prstu, s extenzí v zápěstí. 
Obr. 12. Flekčně-pronační spasticita v lokti, flekční v zápěstí, flekční prstů s addukcí a flexí palce. Osmapadesátiletá žena po ischemické CMP v levé hemisféře. 
Obr. 13. Čtyřiatřicetiletá žena s DMO. Flekční a addukční spasticita stehen, extenční bérců. 
Při cílení terapie je vhodné rozdělit efekt na ovlivnění aktivní funkce svalů. Jedná se především o uvolnění pohybu v daném směru, zvýšení síly svalu, koordinaci aktivity svalů a zapojení do pohybových řetězců. Nedílnou součástí terapie spasticity je ovlivnění bolestivých spazmů, bolesti při pohybu, zábrana vzniku kontraktur a usnadnění každodenních aktivit (hygienických úkonů, oblékání) [16,18,25,26].
V rámci komplexní péče o nemocného se spasticitou i pro požadavek adekvátního hodnocení stavu nemocného se používají různé škály. Základními parametry spasticity je svalový tonus, rozsah pohybu v kloubech (ROM, Range Of Motion) a postavení v kloubech (postura). Pro hodnocení spasticity svalu, který je definován jako odpor pasivně protaženého svalu, se používají škály – Ashworthova (AS) a Modifikovaná Ashworthova (MAS). Pro hodnocení disability FIM (Functional Independence Measure) a index Barthelové, pro celkovou disabilitu (ADL index, Fugl-Mayerova škála), pro posouzení obratnosti končetiny (Frenchay test, ARAT – Action Research Arm Test, 9HPT – Nine Hole Peg Test) a pro parametry hodnotící celkovou hybnost škály hodnocení motoriky (Rivermead scale) [17,18,27,28].
Správný výběr škál se zřetelem na hodnocené parametry je nezbytný pro tvorbu klinických studií. V mnoha klinických studiích byl prokázán výrazný efekt botulotoxinu na snížení svalového tonu – dle AS či MAS, avšak nebyl prokázán statisticky významný efekt na postiženou funkci [29,30]. Přitom botulotoxin zcela evidentně snižuje svalový tonus, a to tím více, čím vyšší je stimulace alfa-motoneuronů (overstimulation, zvýšená aktivita gama-kličky). Efekt na zlepšení funkční schopnosti spastické končetiny po aplikaci botulotoxinu lze prokázat použitím funkčního testu, který vskutku testuje léčený segment končetiny. Nejčastěji používané škály (AS, MAS) testují pouze svalový tonus, a to pouze při pasivním protažení svalu. Netestují vlastní funkci svalu a již vůbec se nezabývají zapojením svalu do pohybového schématu, stereotypu. Podstatně významnější je však klinický (a případně i neurofyziologický) rozbor spasticity končetiny (segmentu) a aplikace botulotoxinu na podkladě předem stanoveného reálného cíle této léčby (goal attainment), individuální pro tuto jednotlivou aplikaci [31,32].
Typické situace a problémy při terapii spasticity na HK a DK jsou shrnuty v tab. 2 a 3.
Tab. 3. Spasticita dolní končetiny. Nejedná se o uznanou indikaci aplikace botulotoxinu u dospělých. 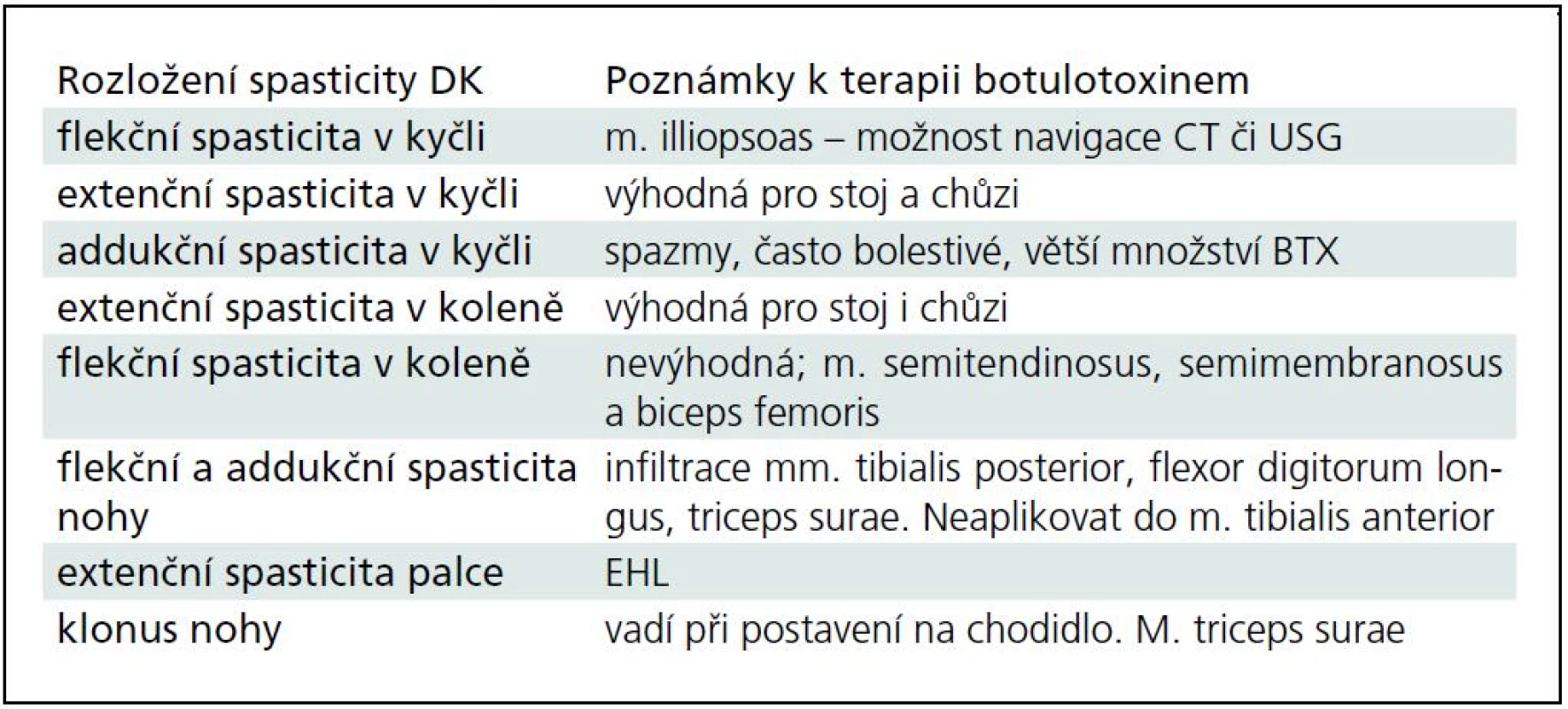
C. Další indikace podání botulotoxinu v neurologii
1. Bolesti hlavy
Na podkladě celé řady klinických studií chronické denní bolesti hlavy (CDH, Chronic Daily Headache) a tenzní bolesti hlavy (TTH, Tension Type Headache) mají velmi dobrou terapeutickou odezvu při léčbě botulotoxinem. Indikace k podání botulotoxinu je u nemocných se špatným efektem dostupné základní terapie těchto typů bolestí hlavy. Bolesti musí být intenzivní, musí být vyzkoušeny dostupné medikace včetně úpravy životosprávy a záchvaty cefaley mají být více než v polovině dnů v měsíci. Snížení frekvence a intenzity bolestí hlavy (chronická migréna či chronická denní bolest hlavy) bylo pozorováno u nemocných s cervikální dystonií, kteří současně trpěli bolestmi hlavy (což je poměrně velmi častá kombinace). Tento nález byl pak podnětem pro celou řadu různě koncipovaných klinických studií.
Recentní studie PREEMPT (dvojitě slepá, s fází kontrolovanou placebem a otevřenou fází, celkem 56 týdnů, 1 384 nemocných) testovala efekt Botoxu® (155–195 U) na celou řadu klinických parametrů u chronické migrény. Ta je definována jako bolest hlavy po více než 15 dnů v měsíci, po více než tři měsíce, přitom nejméně v osmi dnech splňuje kritéria migrény (bez aury). Aplikace Botoxu® vedla k nejméně 50% redukci počtu dnů v měsíci s bolestmi hlavy, snížení intenzity bolestí i snížení počtu hodin s bolestmi hlavy. Efekt terapie byl v 56 týdnech studie u 70 % účastníků a byl výrazně statisticky významný ve dvojitě slepé fázi proti skupině s placebem [33].
Mechanizmus účinku botulotoxinu na bolest hlavy nespočívá pouze v blokádě uvolnění acetylcholinu z presynaptických zakončení motorických vláken a sympatiku, ale rovněž v blokádě uvolnění dalších mediátorů (glutamátu, substance P, CGRP – Calcium Gene - Related Peptide) z nocicepčních zakončení. Inhibice uvolnění těchto transmiterů vede k redukci neurogenních zánětlivých změn, snížení periferní senzitizace a k omezení bolestivých signálů do CNS s následným snížením centrální senzitizace u migrény a dalších bolestivých stavů.
Pro léčbu bolestí hlavy botulotoxinem je důležitý i charakter bolesti. Velmi dobře reagují nemocní s bolestí vnímanou jako komprese, stažení, drcení zvnějšku (imploding headache). U ní se předpokládá rovněž spoluúčast extrakraniálních cév na jejím vzniku. Naopak u bolestí hlavy jdoucích zevnitř (exploding headache, „tlak zevnitř hlavy, mozku“) s výrazným či výhradním podílem cév dura mater, není efekt botulotoxinu tak výrazný [5,34].
Botulotoxin se aplikuje podle určitých zásad a podle převažujících literárních údajů buď do podkoží [3], či do svalů [34]. Podle jednoduchého protokolu s fixními body aplikace se aplikuje toxin do mm. procerus, frontalis, temporalis (4–5 bodů) a svalů CC přechodu a šíje. Další možností je aktivní vyhledávání bodů aplikace – tam, kde nemocný pociťuje bolest při palpaci či vyšetřující zjistí pohmatem zvýšený odpor. Třetí možností je kombinovaný přístup. Dávky Botoxu® se velmi liší (30–200 U). Většina autorů používá dávky kolem 100 U, a to ve 3měsíčních intervalech, podle mohutnosti účinku, jeho trvání a tolerance.
Z nežádoucích vedlejších účinků se objevují bolesti a drobné krvácení v místě aplikace, slabost mimických svalů (zejména asymetrie obočí), ptóza víček, výjimečně i slabost šíjových svalů.
Léčba chronických bolestí hlavy pomocí botulotoxinu je velmi perspektivní. Byla prokázána účinnost této léčby. Profylaktická medikamentózní léčba chronických bolestí hlavy bývá často neúčinná a nemocní konzumují mnohdy nekontrolovatelné množství různých léků (analgetik, sedativ, antidepresiv) s výraznými nežádoucími vedlejšími účinky.
2. Myofasciální bolestivý syndrom
Myofasciální bolestivý syndrom (MPS – Myofascial Pain Syndrome) se vyznačuje myofasciálními spouštěcími body ve svalu (trigger points), které jsou tuhé na pohmat, a při jejich palpaci se provokuje místní i přenesená bolest (vyzařující do různé vzdálenosti). Kromě těchto napjatých, tuhých a bolestivých pruhů ve svalech jsou přítomny také autonomní příznaky (cirkulační, lokální hyperhidróza, piloerekce) i anxieta a deprese. I když se na vzniku MPS podílejí behaviorální a psychologické faktory, je nezbytná také určitá (vrozená) dispozice i přetížení svalů, ať již akutní či chronické, opakující se zátěží. MPS může mít formu generalizovanou i regionální. Typické bolestivé body bývají v oblasti ramen, lopatek, hrudníku, hýždí. V literatuře se zdůrazňuje syndrom m. piriformis. Botulotoxin redukuje zvýšené napětí svalu, uvolní tah na úponová místa, sníží bolestivou percepci (blokuje uvolnění substance P, glutamátu, CGRP) a ovlivní i některé autonomní projevy. V léčbě syndromu m. piriformis se užívají dávky kolem 100 U Botoxu® s aplikací do svalu (pod ultrasonografickou kontrolou či s pomocí fluoroskopie) [3,35].
Botulotoxin v léčbě MPS je zatím ve stadiu klinického zkoušení.
3. Bolestivé syndromy pohybového systému
Bolestivé syndromy pohybového systému mohou být ovlivněny botulotoxinem v několika úrovních. Bolestivé spazmy jsou redukovány mechanizmem blokády neuromuskulárního přenosu, a to se zřetelem na zvýšenou aktivitu těchto svalů. Další možností je blokáda uvolnění neuromediátorů (glutamát, substance P, CGRP) s následným snížením vstupu bolestivých signálů na úrovni míšního segmentu se snížením periferní a ve svém důsledku posléze i centrální senzitizace. Avšak jasný mechanizmus působení botulotoxinu na muskuloskeletální bolest není dosud rozřešen. Byla provedena řada klinických studií na ovlivnění bolestí v zádech, vertebrogenní algický syndrom krčního úseku (včetně stavu po whiplash injury), ovlivnění bolesti i rozvoje skoliózy.
K této kategorii je možno přiřadit i nemocné s plantární fasciitidou. Botulotoxin se aplikoval subfasciálně do bolestivé oblasti ventrálně od paty (tuber calcanei), a to v dávce 200 U Botoxu®. Došlo k výraznému efektu s trváním redukce algie po 14 týdnů.
Botulotoxin se zkoušel také u řady jiných stavů se svalovou hypertonií (Parkinsonova nemoc – fokální motorické příznaky, stiff-person syndrom, myokymie) a u řady úponových bolestí a syndromů (včetně syndromu karpálního tunelu).
4. Neuropatická bolest
U neuropatické bolesti refrakterní na dosavadní medikamentózní léčbu by botulotoxin (a nyní i jeho deriváty se změněnou molekulou) mohl působit mechanizmem blokády uvolnění různých mediátorů s následnou redukcí periferní i centrální senzitizace. Botulotoxin byl již v několika klinických studiích vyzkoušen u postherpetické neuralgie a neuralgie trigeminu [5,36,37].
D. Indikace botulotoxinu v jiných oborech
V současnosti existuje více než 100 různých poruch, ve kterých se používá botulotoxin. Botulotoxin sice příznivě ovlivnil průběh těchto poruch a vedl ke klinickému zlepšení, mnohdy se pomocí klinických studií prokázal „evidence-based“ efekt, ale tyto indikace nebývají dosud zahrnuty v příslušných dokumentech (SPC) či nejsou hrazeny pojišťovnami.
Pro neurologické pacienty má velký význam použití botulotoxinu pro poruchy močového měchýře u spastických syndromů. Jedná se o dyssynergii sfinkter-detruzor a hyperaktivitu močového měchýře u nemocných s roztroušenou sklerózou, při stavech po míšních poraněních a u dalších neurologických poruch. U hyperaktivního detruzoru se pomocí duté EMG jehly, kterou do močového měchýře zavádí urolog, aplikuje 100–300 IU Botoxu® či 500–1 000 U Dysportu®, objem roztoku botulotoxinu je 30 ml a aplikován je do 30 bodů (po 1 ml) již předem zmapovaného (EMG) detrusoru (mimo trigonum). Po třech týdnech dojde k podstatnému zvýšení kapacity močového měchýře, snížení frekvence urgentní mikce (v 85–92 %), zejména nykturie, a vymizí inkontinence (v 90 %). Většina nemocných léčených vyššími dávkami botulotoxinu se však pro vzniklou retenci moči musí cévkovat. Katetrizace (self-cathetrisation) však není podstatný problém [2,37,38].
Autonomní poruchy ve formě hypersalivace či hyperhidrózy se poměrně často vyskytují také u neurologických pacientů.
Hypersalivace v kombinaci s poruchou polykání slin je přítomna u nemocných s demencí, Parkinsonovou nemocí či dalšími degenerativními chorobami. U parkinsoniků se ke zvýšené tvorbě slin přidává ještě vymizení spontánního polykání slin (5–7krát za minutu) i šikmé postavení hlavy. Sliny vytékají na dolní ret a často i odkapávají na košili. Nemocné a jejich opatrovníky vytékání slin trápí a ve svém důsledku může omezovat i sociální kontakty nemocného. Botulotoxin se u této sialorey aplikuje do příušní žlázy (3 body) a někdy i do podčelistní žlázy (s cílením pomocí ultrazvuku). Používají se dávky 30–50 U Botoxu® pro každou stranu. Efekt trvá 3–5 měsíců a je vhodné využít botulotoxin B, který má vyšší afinitu k autonomním vláknům a jeho efekt na autonomní funkce trvá déle.
Botulotoxin se používá i při zvýšené lakrimaci – například u syndromu krokodýlích slz po chybné reinervaci slzné žlázy po lézi lícního nervu. Nemocný pak při kořeněném jídle zvýšeně slzí na straně odeznělé léze n. VII. Botulotoxin se aplikuje přímo do slzné žlázy.
U syndromu von Freyové dochází ke zvýšenému pocení v určitém okrsku tváře, a to často při jídle (kořeněném). Po lézi lícního nervu došlo k chybné reinervaci potních žláz na tváři. Léčba spočívá v subkutánním podání botulotoxinu v celé postižené oblasti. Používá se aplikace vždy 5 U Botoxu® do několika bodů, které jsou od sebe vzdáleny 1 cm. Efekt léčby trvá 4–6 měsíců.
Hyperhidróza může být výrazným problémem pro mnohé nemocné. Hyperhidróza dlaní snižuje kvalitu jemných obratných pohybů (pracovní úkony) a je výrazným hendikepem v sociální oblasti. Hyperhidróza v jiných tělesných oblastech (např. v axile, apokrinní žlázy) je pro nemocné obtěžující jak smáčením částí oděvu, tak i nepříjemným zápachem. Léčba botulotoxinem je velmi efektní. Aplikace je intradermální (hluboká – potní žlázy se nalézají na rozhraní dermis a podkožního tuku), v celé oblasti hyperhidrózy v bodech (řadách) po 1 cm vzdálených. Jedná se o bolestivou proceduru, která přece jen trvá delší dobu (např. do 20 bodů – asi 2 minuty). Podává se 50–200 U Botoxu® na 1 dlaň (50–100 U na jednu axillu). Vhodné je použití botulotoxinu B [3,37].
Kosmetické indikace sice patří do dermatologie, neurolog by však o nich měl vědět a znát možné komplikace. Indikací pro léčbu botulotoxinem jsou vrásky na čele (vertikální – m. corrugator supercillii, horizontální na kořeni nosu – m. procerus, horizontální na čele – m. frontalis), radiální vrásky při laterálním koutku oka („crow’s feet“, m. orbicularis oculi), šikmé vrásky na nosním křídle („bunny lines“, m. nasalis), vrásky směřující radiálně od retní červeně (m. orbicularis oris), hluboká brázda na bradě (m. mentalis), vertikální či šikmé vrásky a pruhy na krku (m. platysma). Až 43 % nemocných po aplikaci botulotoxinu z kosmetických důvodů má nežádoucí vedlejší reakce – lokální bolest, krvácení v místě vpichu, ptóza, edémy, bolesti, nauzea, chemóza spojivek a další [1,3,15,34].
Další indikace podání botulotoxinu je možno rozdělit podle oborů – gastroenterologické, urologické, gynekologické, chirurgické (hojení ran) a další. Tito odborníci se však často dotazují neurologa zkušeného v léčbě botulotoxinem na indikace a kontraindikace, na správnost diagnózy (např. bolestivé stavy v oblasti pánve – gynekolog), na dávky, optimální způsob podání [37].
Botulotoxin se nepoužívá jen v humánní medicíně, ale má i své veterinární indikace. Překvapivá je např. indikace u psů (barking dog – po jednostranné aplikaci botulotoxinu do adduktorů hlasivky přestane nahlas štěkat).
Závěr
Botulotoxin je jeden z nejsilnějších biologických toxinů, který se v léčebné indikaci používá již více než 30 let a získal si své pevné postavení v terapii mnoha chorob. Podává se intramuskulárně či subkutánně (pro mimické svaly a u hyperhidrózy). Blokuje uvolnění acetylcholinu na nervosvalové ploténce (a jiných mediátorů), vede k blokádě převodu impulzu na sval a současně i k rozvoji denervačního syndromu daného svalu (chemodenervace). Uznanými indikacemi jsou cervikální dystonie (a jiné dystonie), blefarospazmus, hemifaciální spazmus, spasticita horní končetiny po cévní mozkové příhodě a spasticita horní i dolní končetiny v rámci dětské mozkové obrny. Postupně se indikace rozšiřují – hyperaktivní močový měchýř, další indikace spasticity, oftalmologické indikace, hyperhidróza a kosmetické indikace (komerční užití). Vzhledem ke své účinnosti je reálné počítat s dalšími poruchami, které budou botulotoxinem léčeny (chronická cefalea, gastrointestinální poruchy).
V současné době jsou k dispozici dva preparáty botulotoxinu A (Botox® firmy Allergan a Dysport® firmy Ipsen) a jeden preparát botulotoxinu B (NeuroBloc® firmy Solstice).
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. Edvard Ehler, CSc.
Neurologická klinika
FZS Univerzity Pardubice a
Pardubické krajské nemocnice, a.s.
Kyjevská 44
532 03 Pardubice
e-mail: eda.ehler@tiscali.cz
Recenzenti
doc. MUDr. Ivana Štětkářová, CSc.
prof. MUDr. Petr Kaňovský, CSc.
doc. MUDr. Edvard Ehler, CSc.
Doc. MUDr. Edvard Ehler, CSc.
Po ukončení studia na Lékařské fakultě UJEP v Brně v roce 1972 nastoupil na neurologické oddělení Městské nemocnice v Ostravě. Po třech letech se přestěhoval do Pardubic a od té doby pracuje na neurologickém oddělení, nyní na Neurologické klinice Pardubické krajské nemocnice a Fakulty zdravotnických studií Univerzity Pardubice. Kromě atestací absolvoval řadu kurzů (manuální medicína – prof. Lewit, EMG – as. Véle, Evokované potenciály a další) a krátkých stáží. V roce 1988 obhájil externí kandidaturu na Neurologické klinice LF UK v Hradci Králové na téma „Proximální diabetická neuropatie“ a po řádném habilitačním řízení (UK v Praze) byl v roce 2002 jmenován docentem neurologie. Doc. Ehler se zabývá klinickými aspekty neurologických chorob, včetně rychle se rozvíjející diagnostiky, a u stále většího počtu nemocí i racionální léčbou. Je vedoucí EMG/EP laboratoře a vedoucí neuromuskulárního centra. Aktivně se podílí na práci iktového centra a moderní neurologické JIP. Věnuje se aplikaci botulotoxinu v různých indikacích i léčbě spasticity. Docent Ehler pravidelně přednáší na kongresech a konferencích, publikuje v českých i zahraničních odborných časopisech, působí v redakčních radách časopisů Neurologie pro praxi a Bulletin Ipsen. Je autor či spoluautor 176 publikovaných prací a osmi knižních publikací. Jeho pravidelná pedagogická činnost na Fakultě zdravotnických studií Univerzity Pardubice a na Lékařské fakultě UK v Hradci Králové je doplňována přednáškami i kurzy v rámci IPVZ Praha. Již více než 20 let je člen Výboru České neurologické společnosti ČLS JEP, kde zastává funkci národního delegáta EFNS, předtím byl rovněž předseda Standardové komise. Kromě odborné činnosti se věnuje také různým sportům (nyní již pouze těm bezpečným druhům) a své rodině i vnučkám.
Zdroje
1. Barnes MP, Johnson GR (eds). Upper motor neurone syndrome and spasticity. Clinical management and neurophysiology. 2nd ed. Cambridge: Cambridge University Press 2001.
2. Panicker JN, Muthane UB. Botulinum toxins: pharmocology and its current therapeutic evidence for use. Neurol India 2003; 51(4): 455–460.
3. Jankovic J, Albanese A, Attassi MZ et al (eds). Botulinum toxin. Therapeutic clinical practice and science. Philadelphia: Saunders Elsevier 2009.
4. Adamová B, Leberová D, Voháňka S, Bednařík J, Bartošíková L. Dlouhodobý vzdálený účinek lokálně aplikovaného botulotoxinu A na nervosvalový přenos. Cesk Slov Neurol N 2003; 66/99(3): 174–177.
5. Aoki KR, Francis J. Updates on the antinociceptive mechanism hypothesis of botulinum toxin A. Parkinsonism Relat Disord 2011; 17 (Suppl 1): S528–S533.
6. Kanovsky P, Slawek J, Denes Z, Platz T, Comes G, Grafe S et al. Efficacy and safety of treatment with incobotulinumtoxin A (botulinum neurotoxin type A free from complexing proteins; NT 201) in post-stroke upper limb spasticity. J Rehab Med 2011; 43(6): 486–492.
7. Albanese A. The current status and use of botulinum toxins. Eur J Neurol 2001; 8 (Suppl 4): 3–7.
8. Lim EH, Quek AM, Seet RC. Accurate targeting of botulinum toxin injections: how to and why. Parkinsonism Relat Disord 2011; 17 (Suppl 1): S534–S539.
9. Comella CL, Pullman SL. Botulinum toxins in neurological disease. Muscle Nerve 2004; 29(5): 628–644.
10. Růžička E. Neurodegenerativní onemocnění mozku. In: Bednařík J, Ambler Z, Růžička E et al (eds). Klinická neurologie. Praha: Triton 2010 : 541–707.
11. Fahn S, List T, Moslowitz C, Brin M, Bressman SB, Burke RE et al. Double-blind controlled study of botulinum toxin for blepharospasm. Neurology 1985; 35 (Suppl 1): 271–272.
12. Dutton JJ, White JJ, Richard MJ. Myobloc for the treatment of bening essential blepharospasm in patients refractory to botox. Ophthal Plast Reconstr Surg 2006; 22(3): 173–177.
13. Tan EK, Jankovic J. Botulinum toxin A in patients with oromandibular dystonia: long-term follow-up. Neurology 1999; 53(9): 2102–2107.
14. Blitzer A, Brin MF, Fahn S, Lange D, Lovelace RE. Botulinum toxin (BOTOX) for the treatment of “spastic dysphonia” as part of a trial of toxin injections for the treatment of other cranial dystonias. Laryngoscope 1986; 96(11): 1300–1301.
15. Kaji R. New and emerging indications of botulinum toxin therapy. Parkinsonism Relat Disord 2011; 17 (Suppl 1): S25–S27.
16. Ward AB. A literature review of the pathophysiology and onset of post-stroke spasticity. Eur J Neurol 2012; 19(1): 21–27.
17. Biering-Sørensen F, Nielsen JB, Klinge K. Spasticity-assessment: a review. Spinal Cord 2006; 44(12): 708–722.
18. Štětkářová I, Ehler E, Jech R. Spasticita a její léčba. Praha: Maxdorf 2012.
19. Shaw L, Rodgers H. Botulinum toxin type A for upper limb spasticity after stroke. Expert Rev Neurother 2009; 9(12): 1713–1725.
20. Brainin M, Norrving B, Sunnerhagen KS, Goldstein LB, Cramer SC, Donnan GA et al. International PSS Disability Study Group. Poststroke chronic disease management: towards improved identification and interventions for poststroke spasticity-related complications. Int J Stroke 2011; 6(2): 42–46.
21. Kaňovský P, Bareš M, Dufek J et al (eds). Spasticita. Mechanismy, diagnostika, léčba. Praha: Maxdorf 2004.
22. Ehler E, Vaňásková E, Štětkářová I. Standard komplexní léčby spasticity po cévní mozkové příhodě. Cesk Slov Neurol N 2009; 72/105(2): 179–181.
23. Kanovsky P, Bares M, Severa S, Richardson A. Dysport Paediatric Limb Spasticity Study Group. Long--term efficacy and tolerability of 4-monthly versus yearly botulinum toxin type A treatment for lower-limb spasticity in children with cerebral palsy. Dev Med Child Neurol 2009; 51(6): 436–445.
24. Kraus J et al (eds). Dětská mozková obrna. Praha: Grada Publishing 2005.
25. Malhotra S, Pandyan AD, Rosewilliam S, Roffe C, Hermens H. Spasticity and contractures of the wrist after stroke: time course of development and their association with functional recovery of the upper limb. Clin Rehabil 2011; 25(2): 184–191.
26. Dobkin BH. Clinical practice. Rehabilitation after stroke. N Engl J Med 2005; 352(16): 1677–1684.
27. Rekand T. Clinical assessment and management of spasticity: a review. Acta Neurol Scand 2010; 190 (Suppl): 62–66.
28. Bakheit AM, Thilman AF, Ward AB, Poewe W, Wissel J, Muller J et al. A randomized double--blind, placebo-controlled, dose-ranging study to compare the efficacy and safety of three doses of botulinum toxin type A (Dysport) with placebo in upper limb spasticity after stroke. Stroke 2000; 31(10): 2402–2406.
29. Pittock SJ, Moore AP, Hardinamn O, Ehler E, Kovac M, Bojakowski J et al. A double blind randomized placebo-controlled evaluation of three doses of botulinum toxin type A (Dysport) in the treatment of spastic equinovarus deformity after stroke. Cerebrovas Dis 2003; 15(4): 289–300.
30. Welmer AK, Widén Holmquist L, Sommerfeld DK. Location and severity of spasticity in the first 1–2 weeks and at 3 and 18 months after stroke. Eur J Neurol 2010; 17(5): 720–725.
31. Rosales RL, Kong KH, Goh KJ, Kumthornhip W, Mok VC, Delgado-De Los Santos MM et al. Botulinum toxin injection for hypertonicity of the upper extremity within 12 weeks after stroke: a randomized controlled trial. Neurorehabil Neural Repair 2012; 26(7): 812–821.
32. Ehler E, Štětkářová I. Botulotoxin v léčbě spasticity. Cesk Slov Neurol N 2009; 72/105(4): 317–321.
33. Aurora SK, Winner P, Freeman MC, Spierings EL, Heiring JO, DeGryce RE et al. OnabotulinumtoxinA for treatment of chronic migraine: pooled analyses of the 56-week PREEMPT clinical program. Headache 2011; 51(9): 1358–1373.
34. Ehler E. Nové perspektivy botulotoxinu. Neurol Prax 2009; 10(2): 91–93.
35. Childers MK, Wilson DJ, Gnatz SM, Conway RR, Sherman AK. Botulinum toxin type A use in piriformis muscle syndrome: a pilot study. Am J Phys Med Rehabil 2002; 81(10): 751–759.
36. Kern U, Martin C, Scheicher S, Müller H. Botulinum-Toxin-A in der Behandlung von Phantomscherzen. Eine Pilotstudie. Schmerz 2003; 17(2): 117–124.
37. Aoki KR. Future aspects of botulinum neurotoxins. J Neural Transm 2008; 115(4): 567–573.
38. Cruz F, Herschorn S, Aliotta P, Brin M, Thompson C, Lam W et al. Efficacy and safety of onabotulinumtoxinA in patients with urinary incontinence due to neurogenic detrusor overacticity: a randomized, double-blind, placebo-controlled trial. Eur Urol 2011; 60(4): 742–750.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2013 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Naděje budí časná diagnostika Parkinsonovy choroby založená na pachu kůže
-
Všetky články tohto čísla
- Tetanus – staronová diagnóza? Kazuistika
- VII. sympozium o léčbě bolesti s mezinárodní účastí
- Gliom vyššího stupně kaudální oblasti míchy imitující myelitidu – kazuistika
- Může souviset úzký páteřní kanál s tvorbou granulomu na konci katétru uloženém v intratékálním prostoru? Kazuistika
- Webové okénko
- Analýza dat v neurologii: XXXVII. Statistické testy srovnávající odhady poměru šancí a relativního rizika
- 1. cena časopisu ČESKÁ A SLOVENSKÁ NEUROLOGIE A NEUROCHIRURGIE
- Pripomienky k neurogénnemu tetanickému syndrómu a simultánnym stavom zvýšenej neuromuskulárnej excitability
- Navrátil L. et al – Neurochirurgie. 1st ed. Praha: Karolinum 2012, 166 stran.
- doc. MUDr. Vilibald Vladyka, CSc., devadesátiletý
- 16. JEDLIČKOVY DNY
- Národní registr cévních mozkových příhod (registr IKTA) – je potřebný?
- Proměnlivá tvář parkinsonské neurodegenerace
- Snížená denzita kostního minerálu u žen s roztroušenou sklerózou
- Mapování mozkové aktivity pomocí funkční magnetické rezonance během plnění močového měchýře
- Vztah deprese a rozeznávání emocí z výrazu tváře u pacientů s mírnou kognitivní poruchou
- Časná chirurgická léčba spontánního intracerebrálního krvácení
- 27. český a slovenský neurologický sjezd a Dunajské symposium 2013
- Častý výskyt lymeské neuroboreliózy u dětí v České republice
- VI. NEUROMUSKULÁRNY KONGRES S MEDZINÁRODNOU ÚČASŤOU
- Použití botulotoxinu v neurologii
- Hydrocefalus jako komplikace subarachnoidálního krvácení
- Bezpečnost a účinnost nového schématu dávkování trombolýzy – pilotní studie
- Atlantookcipitální dislokace – soubor šesti pacientů a přehled problematiky
- Použití transcerebelárního přístupu s obrácenou montáží stereotaktického rámu pro biopsii lézí zadní jámy lební
- Kvalita života u pacientů s demencí
- Posttraumatická transdurální herniace míchy – kazuistika
- X. Afaziologické sympozium
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Použití botulotoxinu v neurologii
- Pripomienky k neurogénnemu tetanickému syndrómu a simultánnym stavom zvýšenej neuromuskulárnej excitability
- Častý výskyt lymeské neuroboreliózy u dětí v České republice
- Tetanus – staronová diagnóza? Kazuistika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




