-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Extrakraniálně metastazující meningeomy
Extracranially Metastasizing Meningiomas
Aim:
The aim of the paper was to retrospectively review patients who underwent surgery for meningioma at the Neurosurgery Clinic of the University Hospital in Ostrava between 2003 and 2005, focusing on evidence of extracranial spread of meningiomas.Material and methods:
In total, 220 patients with 227 meningiomas underwent surgery. In 196 cases (86.3%), meningiomas were grade I, grade II in 26 cases (11.5%) and grade III in 5 cases (2.2%). Convexity meningiomas dominated with 53 cases (23.3%), followed by falcine and parasagittal in 44 cases (19.4%) and other types. The disease recurred in 29 cases with the shortest follow-up of three years (3–8 years).Results:
An extracranial metastasis was found in two patients (0.88%). A female patient with parasagittal meningioma developed solitary right lung metastasis nine years after the first surgery. A male patient with intraventricular meningioma developed solitary metastasis of the right lung with mediastinal nodal involvement within 28 months from the first surgery. Later, metastases were found in the liver. In the female patient, metastases were found during section. The male patient died 16 months after the extracranial spread of meningioma was identified. Both patients suffered from atypical meningioma that later upgraded to anaplastic meningioma.Conclusion:
Meningiomas are rarely able to spread extracranially. However, this possibility must not be overlooked, especially in meningeomas WHO grade II and III, where such spread is relatively frequent. In our opinion, these patients should as part of routine follow-up undergo screening of the most commonly affected organs (lungs, lymph nodes, bones, abdominal organs).Key words:
metastasis – meningioma – brain tumours
Autori: T. Krejčí 1; S. Potičný 1; T. Hrbáč 1; R. Lipina 1,2; Z. Večeřa 1; J. Dvořáčková 2,3; T. Paleček 1
Pôsobisko autorov: Neurochirurgická klinika FN Ostrava 1; Lékařská fakulta OU v Ostravě 2; Ústav patologie FN Ostrava 3
Vyšlo v časopise: Cesk Slov Neurol N 2013; 76/109(3): 322-328
Kategória: Původní práce
Súhrn
Cíl:
Cílem práce je retrospektivní zhodnocení souboru pacientů operovaných pro meningeom na Neurochirurgické klinice FN Ostrava v období let 2003–2008, se zaměřením na známky extrakraniálního šíření meningeomů.Soubor a metodika:
Celkem bylo operováno 220 pacientů s 227 meningeomy. Ve 196 případech (86,3 %) se jednalo o meningeomy grade I WHO klasifikace, ve 26 případech (11,5 %) grade II a v 5 případech (2,2 %) grade III. V souboru převládaly konvexitární meningeomy v 53 případech (23,3 %), dále falcinní a parasagitální meningeomy celkem v 44 případech (19,4 %) a další. Recidivu jsme zaznamenali ve 29 případech, při nejkratší době sledování tři roky (3–8 roků).Výsledky:
Vzdálená metastáza byla nalezena u dvou pacientů (0,88 %). U první pacientky, operované pro parasagitální meningeom, byla zjištěna solitární metastáza pravé plíce devět roků od první operace meningeomu. U druhého pacienta s intraventrikulárním meningeomem byla po 28 měsících od první operace zjištěna solitární metastáza pravé plíce a postižení uzlin mediastina, později pak i generalizace do jater. U první pacientky se jednalo o nález při pitvě. Druhý pacient zmírá 16 měsíců po zjištění generalizace meningeomu. V obou případech se jednalo o atypický meningeom, který posléze upgradoval na meningeom anaplastický.Závěr:
Schopnost vzdáleného metastazování meningeomů je vzácný fenomén. Nelze ji však opomíjet, a to především u meningeomů WHO grade II a III, u kterých může být naopak relativně častá. Z našeho pohledu by bylo vhodné v rámci dispenzarizace těchto pacientů provádět i vyšetření nejčastěji postižených orgánů (plíce, uzliny, skelet, břišní orgány).Klíčová slova:
metastáza – meningeom – nádory mozkuÚvod
Meningeomy jsou jedny z nejčastějších primárních intrakraniálních nádorů (tvoří 15–20 %) [1], jejich incidence je přibližně 4,4 případů na 100 000 obyvatel a rok [2] a jsou jednou z nejčastějších incidentálních lézí při vyšetření mozku magnetickou rezonancí (MR), přibližně v 0,9 % všech vyšetření [3]. Jejich původem jsou arachnoidální buňky zevní vrstvy arachnoidální membrány.
Ačkoliv jsou všeobecně považovány za pomalu rostoucí a veskrze benigní nádory, existují v menší míře formy, jejichž chování je agresivnější, malignější. Z histopatologického hlediska dělíme meningeomy dle WHO klasifikace z roku 2007 na grade I(benigní, tvoří 94,3 %), grade II (atypické, 4,7 %) a grade III (anaplastické, 1 %) [4]. Vyšší stupeň je spojován se statisticky vyšším rizikem recidivy, vyšším rizikem morbidity a mortality [2]. Například atypické meningeomy (grade II) recidivují osmkrát častěji než benigní (grade I), dobu přežití u atypických a maligních meningeomů udávají některé studie do dvou let [2]. Za známku agresivity je také považována invaze do mozku či kosti, nebo výrazný perifokální edém v okolí léze. Dalším nepříznivým faktorem pro úspěšnou léčbu může být lokalizace meningeomů, jež je může činit obtížně dosažitelnými k radikální chirurgické léčbě, např. extradurálně se šířící meningeomy infiltrující bazi lební apod. [5]. V neposlední řadě je jednou ze známek malignity či agresivity nádorů jejich schopnost metastazování. Poněkud známější je schopnost meningeomů metastazovat cestou mozkomíšního moku, u grade (dále gr.) II a III bývá udávána incidence maximálně do 5 % [4], či šířit se do okolních struktur prorůstáním. Schopnost zakládat metastázy ve vzdálených orgánech je zpravidla známkou maligních onemocnění. U meningeomů je tento fenomén vzácný. V našem sdělení prezentujeme vlastní zkušenost s metastazujícími meningeomy a současně přehled literatury věnující se tomuto tématu.
Soubor a metodika
Retrospektivně jsme hodnotili všechny pacienty operované pro meningeom na Neurochirurgické klinice FN Ostrava v období let 2003–2008. Cílem bylo nalézt známky extrakraniálního metastazování meningeomů.
V tomto období bylo operováno celkem 227 meningeomů u 220 pacientů, z toho 65 mužů a 155 žen. Celkový poměr mužů a žen je 1 : 2,4. Průměrný věk pacientů je 59 let (v rozmezí 8–81 roků). Třicetidenní mortalita v našem souboru byla 1,82 %, tzv. ve čtyřech případech, podobně jak uvádí ve svém souboru brněnští kolegové (30denní mortalita 1,7 %) [6]. Ve všech případech se jednalo o ženy, věkové rozmezí 69–78 let. Třikrát bylo příčinou smrti pooperační intrakraniální krvácení a jedenkrát srdeční selhání. V 86,3 % se jednalo o meningeomy WHO gr. I (196 případů, 51 mužů a 138 žen), 11,5 % tvořily meningeomy gr. II (26 případů, 13 mužů a 13 žen) a zbylých 2,2 % šlo o maligní meningeomy gr. III (5 případů, 1 muž a 4 ženy). Z hodnot vyplývá, že u mužů je vyšší riziko přítomnosti atypického či maligního meningeomu, v našem souboru byla některá z těchto forem nalezena u 21,5 % mužů a u 11 % žen. Nejkratší doba sledování jsou 3 roky (3–8 let). Podle lokalizace byly nejvíce zastoupeny konvexitární meningeomy, a to v 53 případech (23,3 %), dále falcinní a parasagitální meningeomy celkem v 44 případech (19,4 %), meningeomy křídla kosti klínové v 32 případech (14 %) a další (podrobně tab. 1). Intraventrikulární meningeom, který byl nalezen u pacienta v druhé kazuistice, byl v našem souboru zaznamenán pouze ve dvou případech z celkového počtu 227 meningeomů. Při hodnocení radikality resekce dle Simpsona jsme I. stupně dosáhli u 105 pacientů (46,3 %), II. stupně u 65 pacientů (29 %), III. a IV. stupně u 8 (3,5 %), resp. u 48 (21,2 %) pacientů (detailně tab. 1). Recidivu jsme zaznamenali ve 29 případech, u 8,6 % meningeomů gr. I (17 případů), u 34,6 % meningeomů gr. II (9 případů) a u 50 % maligních meningeomů (3 případy) (tab. 2). Z celkového počtu 227 meningeomů byla nalezena vzdálená metastáza ve dvou případech (0,88 %).
Tab. 1. Shrnutí všech 227 meningeomů operovaných v období 2003–2008. 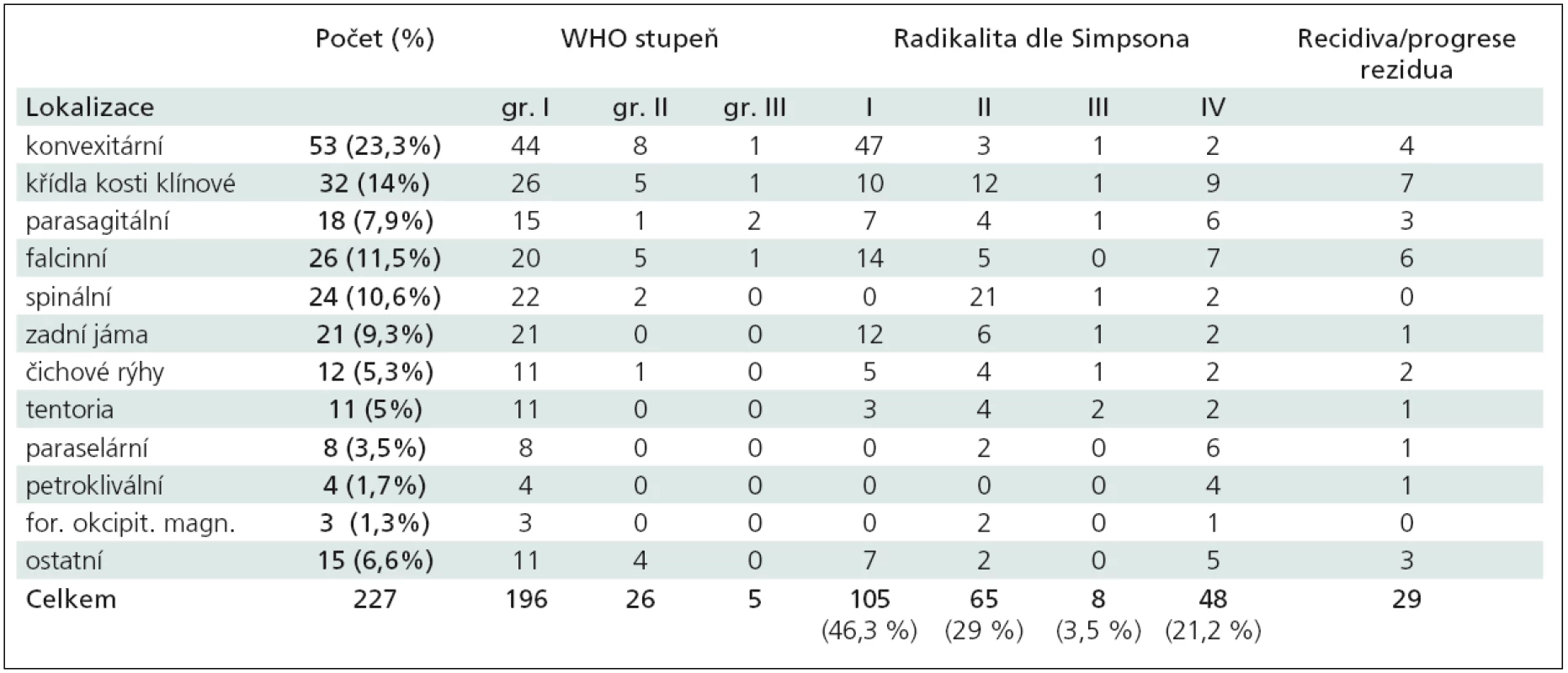
Tab. 2. Shrnutí recidivujících meningeomů s rozdělením podle lokalizace, histopatologického gradu a radikality resekce. 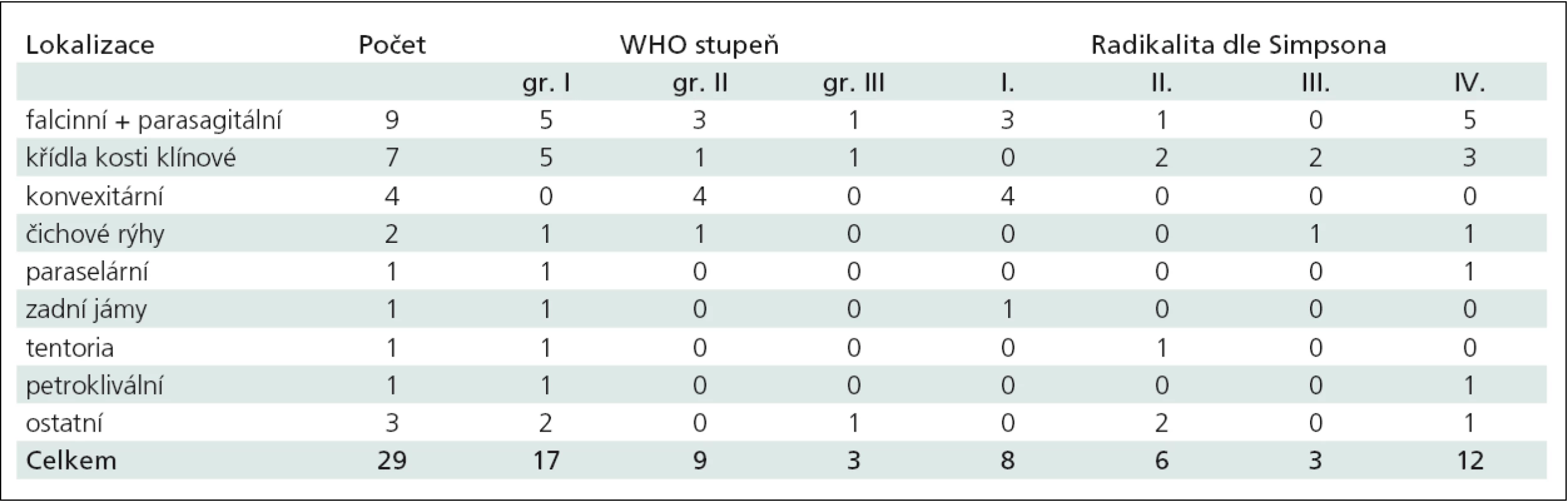
Výsledky
Vzdálená metastáza byla nalezena u dvou pacientů (muže a ženy) z celkového počtu 227 meningeomů (0,88 %). V podskupině meningeomů gr. II a gr. III byla vzdálená metastáza nalezena v 6,5 %. V obou případech byly postiženy plíce, v jednom případě i lymfatické uzliny a játra. První pacientka byla operována ve věku 36 let pro atypický parasagitální meningeom WHO gr. II. Devět roků od první operace meningeomu byla zjištěna solitární metastáza pravé plíce, jednalo se o nález při pitvě. Druhý pacient byl ve věku 40 let operován pro atypický intraventrikulární meningeom WHO gr. II. Po 28 měsících od první operace byla zjištěna solitární metastáza pravé plíce a postižení uzlin mediastina, později pak i generalizace do jater (po 42 měsících po první operaci). Druhý pacient zmírá 16 měsíců po zjištění generalizace meningeomu i přes intenzivní terapii, včetně radikální resekce metastázy, chemoterapie a radioterapie. Přestože byla u obou pacientů primární exstirpace totální, podstoupili opakované operace pro recidivující meningeom (15× a 5× v druhém případě). U obou pacientů došlo v průběhu sledování k upgradu meningeomu na typ anaplastický WHO gr. III. Oba pacienti podstoupili radiochirurgickou léčbu, první pacientka pak i konvenční radioterapii. Cytogenetické vyšetření u pacienta s intraventrikulárním meningeomem prokázalo deleci chromozomu 22, deleci na krátkém raménku 1p, monozomii chromozomu 14 a deleci chromozomu 9, u první pacientky nebylo toto vyšetření provedeno. Průběh onemocnění a léčby obou pacientů viz kazuistika 1 a 2.
Kazuistika 1
Prvním naším pacientem byla 36letá žena. Koncem roku 2002 došetřována pro recidivující, paroxyzmálně vzniklou fatickou poruchu a levostrannou lateralizaci. Na provedeném MR mozku zjištěn parasagitálně uložený tumor F-P vpravo, jehož rozměry byly 6 × 6 × 4 cm. Pacientka byla přijata na naše pracoviště a koncem roku 2002 operována. Nádor byl odstraněn kompletně (stupeň radikality II dle Simpsona), histopatologické vyšetření prokázalo atypický meningeom WHO gr. II. Pooperační CT mozku a MR mozku tři měsíce od operace bez známek rezidua či recidivy meningeomu. První recidiva byla zaznamenána po 14 měsících v lednu 2004, po domluvě s pacientkou byla 3/2004 provedena radiochirurgie pomocí Leksellova gama nože (LGN). Při první kontrole za 6 měsíců došlo ke zmenšení velikosti recidivy. 4/2005 však již zjištěna progrese velikosti meningeomu, pacientka přijata na naše pracoviště, provedena opět totální exstirpace rezidua tumoru (Simpson grade I) včetně přilehlé tvrdé pleny, falxu a části okludovaného šípového splavu. Histologicky již hodnoceno jako maligní meningeom gr. III. Pooperačně provedena konvenční radioterapie (RT) na lůžko tumoru v dávce 60 Gy. K další recidivě tumoru dochází 2/2007, tentokrát v podkoží F krajiny. Následně je pacientka opakovaně operována pro lokální recidivy v podkoží skalpu, ale i intrakraniálně (obr. 1). Stav se postupně stává nezvladatelný pro akcentující se růstovou aktivitu nádoru a současně pro vznikající defekty kožního krytu sahající až do intrakrania. Vzhledem k okolnostem jsme se rozhodli pro radikální resekci. V 8/2011 provedena ve spolupráci s oddělením plastické chirurgie naší nemocnice kalvektomie, totální resekce intrakraniální části tumoru i podkožních mas nádoru (Simpson gr. I, na pooperačním MR mozku bez známek rezidua). Plastika tvrdé pleny byla provedena pomocí kolagenové náhrady (Tissudura fy Baxter) a plastikou lalokem z musculus latissimus dorsi, ten byl následně překryt dermoepidermálním štěpem odebraným z obou stehen pacientky. Recidiva tumoru dosahovala opravdu gigantických rozměrů (obr. 2). Resekovaný skalp infiltrovaný masou maligního meningeomu dosáhl rekordní hmotnosti 955 g. V pooperačním období dochází k deterioraci stavu s levostrannou lateralizací, inhibičním organickým psychosyndromem s podílem negativizmu. Pro známky hyporesorpčního hydrocefalu implantován V-P shunt. Lalok se postupně vhojuje bez větších problémů, výhledově uvažujeme o provedení plastiky kalvy. Stav pacientky se však spíše dále horšil, byl komplikován infekty a posléze i známkami selhání V-P shuntu. Vzhledem k tomu byla indikována jeho revize. Při úvodu do celkové anestezie došlo k fibrilaci komor s přechodem do asystolie, resuscitace nebyla úspěšná a pacientka zemřela. Při následné sekci byla zjištěna solitární metastáza pravé plíce (obr. 3, včetně histopatologického popisu). Celkem pacientka podstoupila 15 resekčních operací recidivujícího meningeomu.
Obr. 1. Pacientka před jednou z exstirpací v podkoží recidivujícího meningeomu. 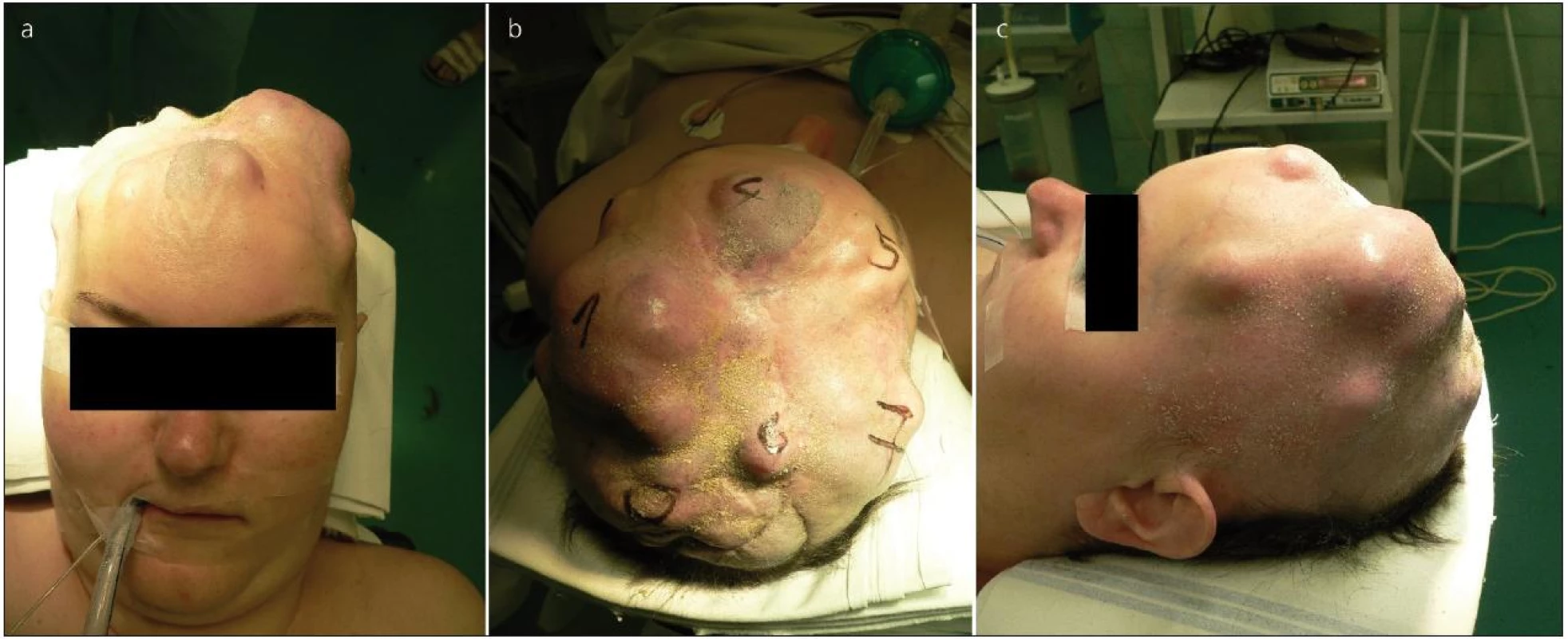
Obr. 2. Gigantický recidivující meningeom s dominantní extrakraniální porcí, MR mozku před provedenou radikální exstirpací s kalvektomii. Na dolním obrázku vlevo patrná i intrakraniální porce tumoru. 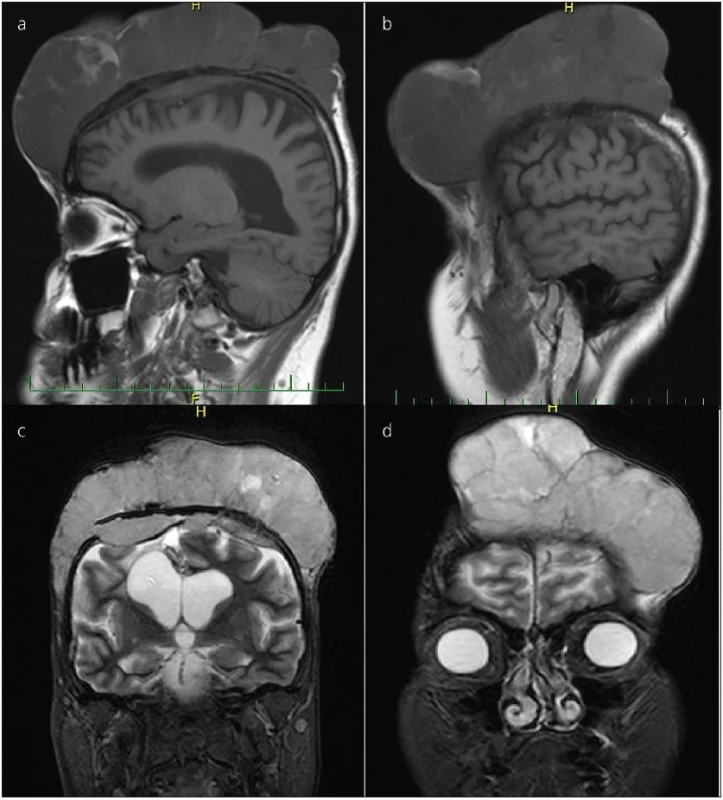
Obr. 3. Překrvená plicní tkáň s ohraničenou metastázou anaplastického meningiomu, obdobného vzhledu jako ve vzorku z intrakrania (a). Struktury anaplastického meningeomu s buněčnou atypií, hyperchromasií a mitotickou aktivitou do 10 mitóz na 10 HPF, invadujícího do kalvy, kůže, fokálně nekrotizujícího (není zachyceno v řezu) a přecházejícího do papilární varianty (b). Barvení hematoxylin eozinem. 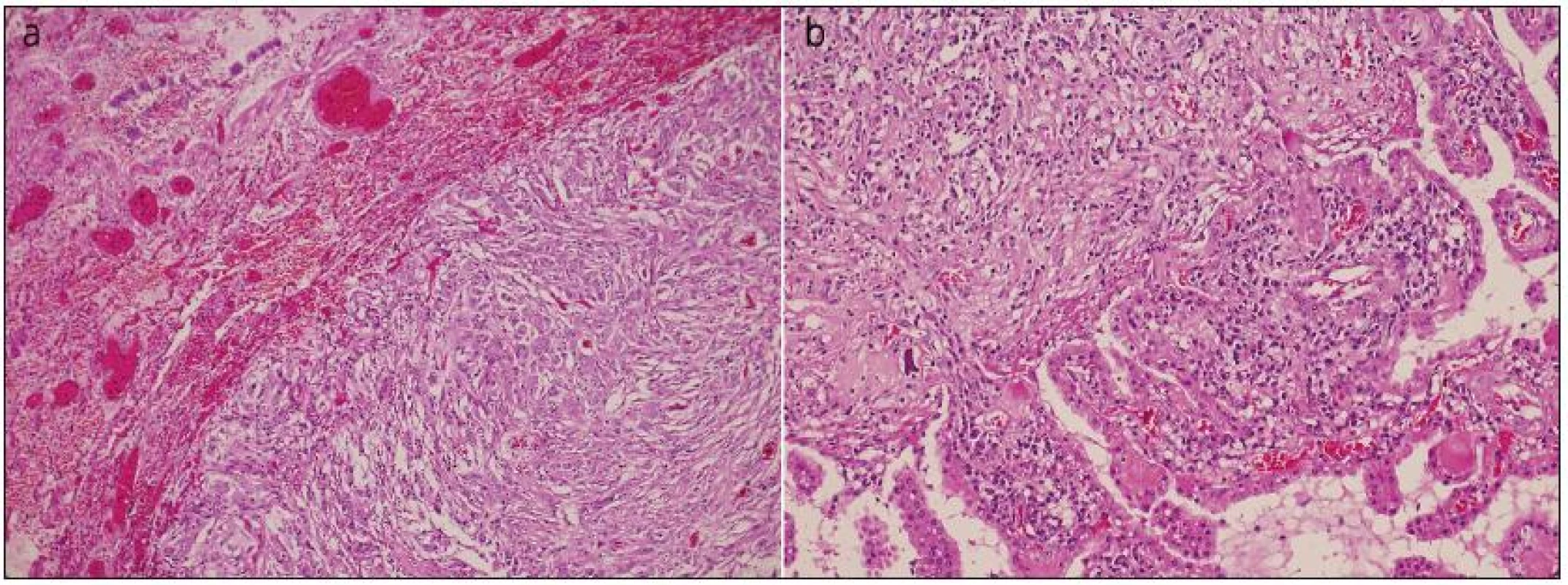
Kazuistika 2
Druhým našim pacientem byl 40letý muž. Začátkem září roku 2008 vyhledal neurologické vyšetření pro bolesti hlavy, závratě a současně pocity mravenčení levostranných končetin. Při neurologickém vyšetření byla zjištěna levostranná hemiparéza lehkého stupně. Na provedeném CT a následně i MR mozku zjištěna objemná, nehomogenní expanze vycházející z těla pravé postranní komory (PPK). Již o 6 dní později je pacient přijímán na Neurochirurgickou kliniku FN Ostrava, k operačnímu řešení. Byla provedena mikrochirurgicky radikální exstirpace tumoru z pravostranné, P-O uložené kraniotomie, transkortikálním přístupem přes trigonum PPK (obr. 4). Histologické vyšetření prokázalo atypický meningeom WHO gr. II. Při kontrolním MR mozku z 12/2008 byla zjištěna drobná recidiva meningeomu do 1 cm, v oblasti splenia kalózního tělesa. Byla indikována radiochirurgie pomocí LGN, ta byla uskutečněna v průběhu 1/2009. Již před radiochirurgií LGN, v průběhu ledna 2009, byla MR zjištěna progrese velikosti rezidua rozměrů 3 × 3 × 2,5 cm. V dubnu 2009, 3 měsíce po radiochirurgii, je nález bez progrese, resp. v mírné regresi, kdy velikost tumoru zmenšena na 2 × 2 × 2,5 cm. Při ambulantní kontrole koncem srpna 2009 zjištěna progrese velikosti tumoru, pacient indikován k operačnímu řešení. 9/2009 provedena mikrochirurgicky radikální exstirpace tumoru. Histologické a molekulárně genetické vyšetření prokázalo anaplastický meningeom gr. III. Kontrolní MR mozku 12/2009 odhaluje drobné reziduum na konci přístupové cesty do 0,5 cm a další drobné ložisko do 1 cm mimo operační pole, v těle PPK (pravděpodobně implantační metastáza). Indikována mikrochirurgická, endoskopicky asistovaná exstirpace obou ložisek 2/2010. 1/2011 řešena další recidiva v PPK. Obě dvě exstirpace byly totální, bez rezidua na pooperačním MR. V průběhu hospitalizace na provedeném RTG plic bylo zjištěno kulovité ložisko v S3 segmentu pravé plíce. Nález potvrzuje vyšetření CT, současně zjištěna infiltrace uzlin mediastina vpravo (obr. 5). CT malé pánve a břicha s normálním nálezem. Nejprve byla provedena biopsie tumoru plic pod CT kon-trolou. Po zdlouhavém histologickém čtení vysloveno podezření na duplicitu – spinocelulární karcinom. Na základě zhodnocení klinického stavu a obrazové dokumentace hrudním chirurgem doporučena a provedena horní plicní lobektomie se snahou o radikální lymfadenektomii. Definitivní histologické vyšetření potvrzuje metastázu plíce a uzlin maligního meningeomu (histopatologický preparát, obr. 6). Jelikož byl výkon hodnocen jako radikální, radioterapie nebyla doporučena. V dubnu 2011 MR mozku bez rezidua. V červenci 2011 na kontrolním RTG a CT plic zjištěna recidiva v oblasti uzlin mediastina. Onkology indikována chemoterapie MAI (mesna, doxorubicin, ifosfamid). Na přelomu srpna a září 2011 CT plic zjištěna progrese metastatického postižení mediastinálních uzlin, současně recidiva intrakraniálně, kde dvě nová ložiska ve stropu PPK šíře 0,5 cm a 2 cm. Vzhledem k progresi byla onkology předčasně zastavena chemoterapie a indikována paliativní RT mediastina v dávce 40 Gy. Stran intrakrania, vzhledem k celkovému stavu a po domluvě s onkology byla indikována radiochirurgie ložisek pomocí přístroje CyberKnife v celkové dávce 20 Gy. V lednu 2012 je intrakraniální nález stacionární bez progrese, nicméně dochází k dalšímu nárůstu mediastinálních uzlin. Pokračováno symptomaticky, paliativně řešena obstrukce dýchacích cest. Pacient podstoupil celkem pět intrakraniálních operací. Začátkem 5/2012 na UZ břicha zjištěny tři metastatická ložiska v játrech, největší o rozměrech 7 × 6 cm. Stav dále nezastavitelně progreduje a pacient po několika dalších dnech zmírá, 16 měsíců od zjištění metastázy meningeomu.
Obr. 4. MR mozku pacienta s intraventrikulárním meningiomem, nahoře vstupní, předoperační snímky. Obrázky dole ukazují stav po radikální exstirpaci. Šipka vlevo dole označuje přístupovou cestu. 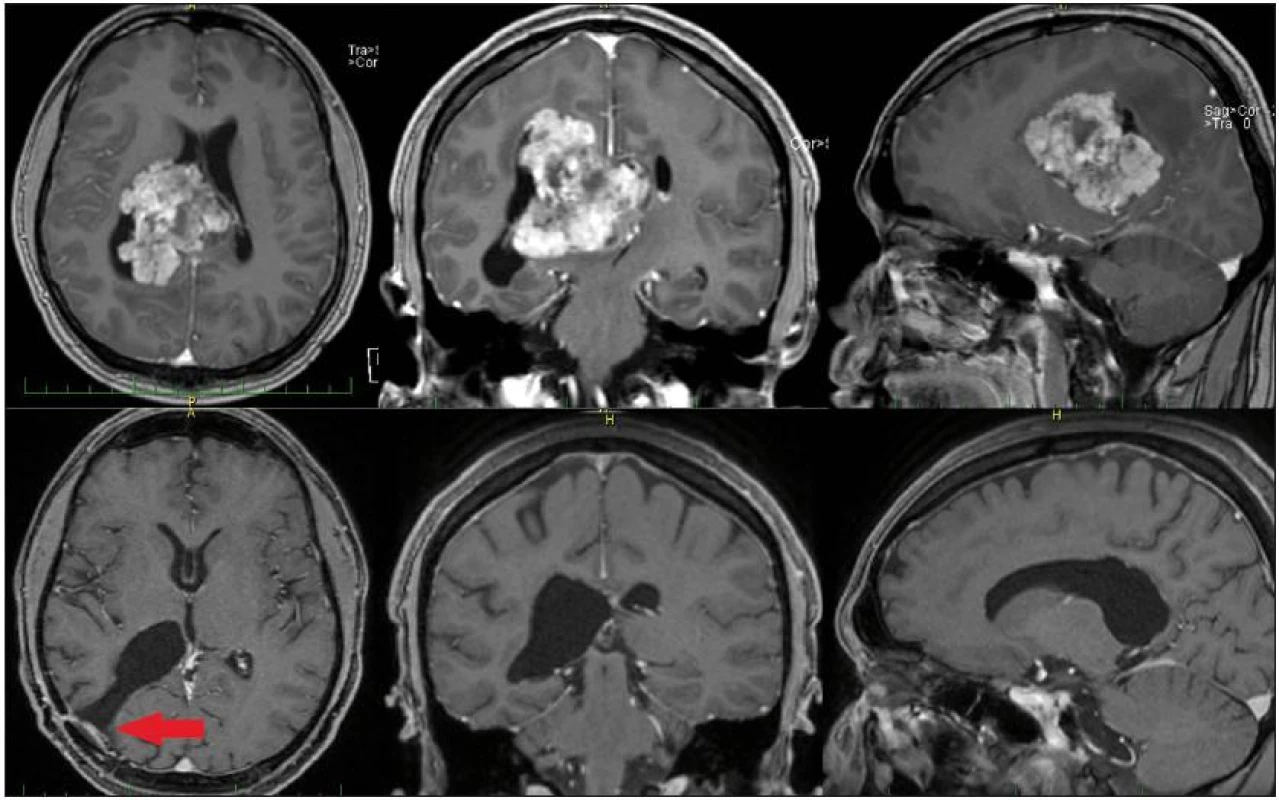
Obr. 5. CT a rtg plic s metastázou meningeomu v pravém plicním laloku (označeno šipkou). 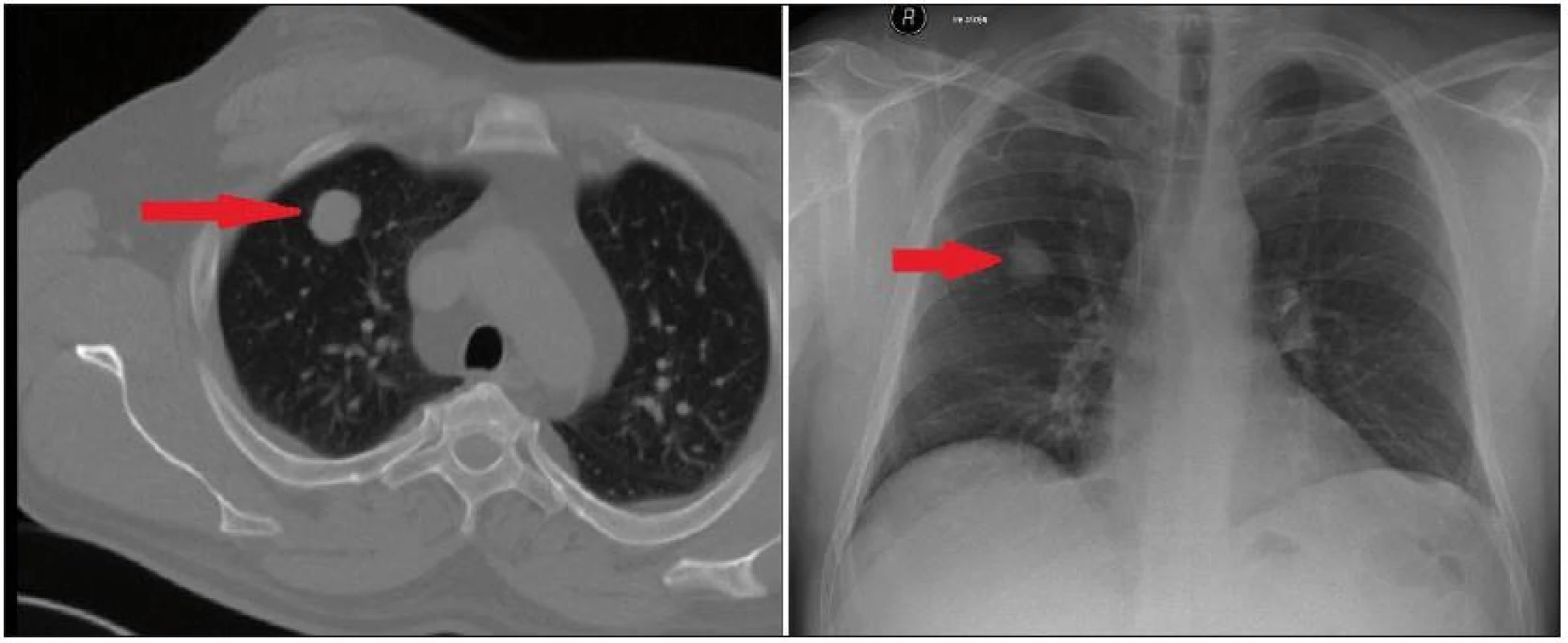
Obr. 6. Struktura prokrvácené plicní tkáně s ložiskem nádoru epiteloidního vzhledu Nádorové elementy jsou negativní v průkazu pancytokeratinů, TTF1 a PR. Silná je exprese vimentinu a fokálně EMA, proliferační aktivita KI67 je 25 %. Morfologie i imunohistochemie odpovídají obrazu metastázy anaplastického meningeomu. Barvení hematoxylin eozinem. 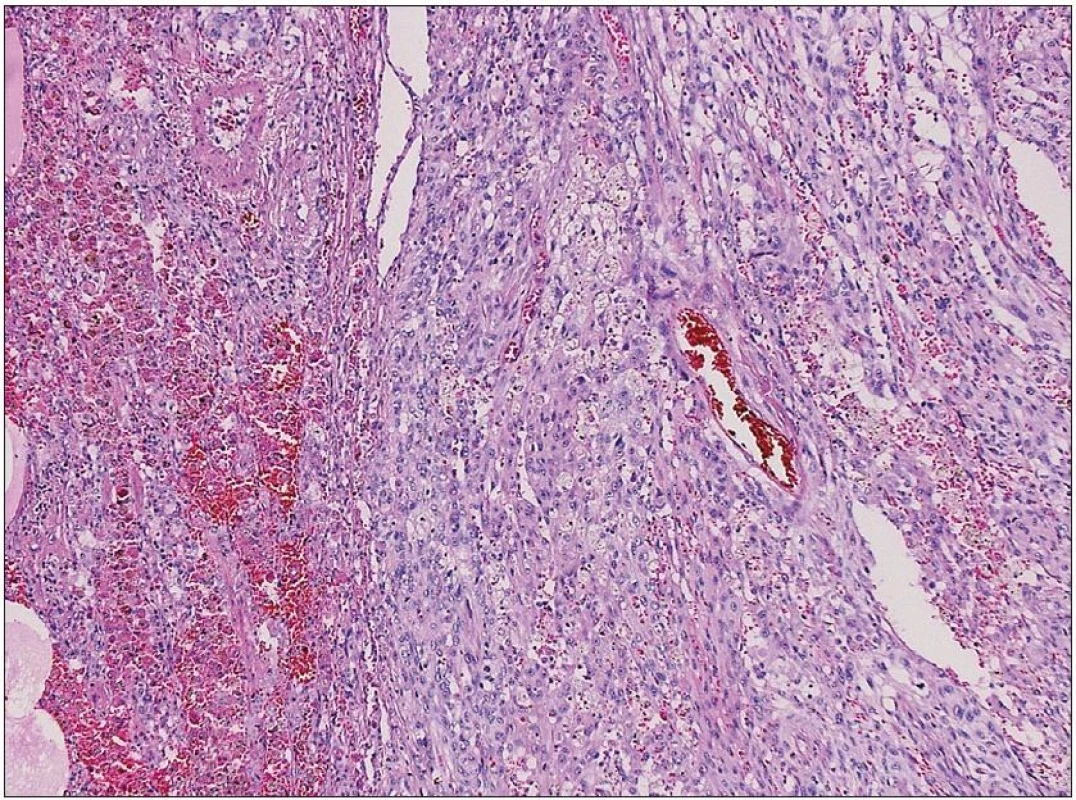
Diskuze
Schopnost vzdáleného metastazování meningeomů je velmi vzácná, frekventně bývá v literatuře udáváno, že asi 0,1 % meningeomů metastazuje [2,4], z některých souborů však vyplývají hodnoty vyšší, například Enam et al udávají hodnotu 0,76 % (3 případy z 396 meningeomů) [4]. V našem souboru 227 meningeomů byla nalezena vzdálená metastáza ve dvou případech, tedy v 0,88 %, resp. u 6,5 % atypických a anaplastických meningeomů. Doba od zjištění diagnózy meningeomu po nález metastázy se v publikovaných souborech značně liší – od několika měsíců až po desítky let. U naší první pacientky byla metastáza zjištěna devět let po první operaci, jakožto sekční nález po úmrtí. U druhého pacienta byla 28 měsíců od prvního určení diagnózy meningeomu zjištěna solitární metastáza plíce a uzlin mediastina, později pak i metastatické postižení jater. Rizikové faktory pro schopnost meningeomů metastazovat nejsou zcela známé. Vzdálené metastázy jsou častější u mužů v poměru 3 : 2 a u malignějších forem [4]. V případě atypických meningeomů WHO gr. II se podle některých souborů vyskytují přibližně v 5 %, u maligních meningeomů pak až v 30–43 % [4,7]. U obou našich pacientů byla prvotní histologie gr. II, následně došlo k upgradu na gr. III dle WHO klasifikace. Vzhledem k užití radioterapie, resp. radiochirurgie nelze vyloučit její podíl na upgradu obou meningeomů [8]. Je však možné se setkat se vzdálenou metastázou meningeomu i u gr. I, což dokládají některá kazuistická sdělení [9]. Je také známo, že mimo histopatologický grading jsou za rizikové faktory rekurence a další progrese meningeomů považovány i určité cytogenetické změny. Mezi ty patří především změny na chromozomu 22 (u 33–46 % benigních, 68–100 % atypických a 73–100 % maligních meningeomů), dále delece na chromozomech 1p, 9p, 10q a 14q, tyto změny jsou spojovány s vyšším rizikem recidivy a s rizikem progrese v malignější formy [10]. Jsou také spojovány s možným metastazováním meningeomů [11]. Pacienti s těmito cytogenetickými alteracemi by měli být důsledně sledováni, tedy i ti s histopatologicky benigním stupněm (riziko progrese ve vyšší stupeň atd.). U našich dvou uvedených pacientů bylo cytogenetické vyšetření provedeno jen u druhého pacienta, prokázalo vícečetné aberace – deleci chromozomu 22, deleci na krátkém raménku 1p, monozomii chromozomu 14 a deleci chromozomu 9. Dalším citovaným rizikovým faktorem pro metastatické šíření jsou udávány opakované recidivy tumoru, opakované chirurgické intervence a invaze do mozkových splavů [12], resp. kontakt s mozkovým splavem: parasagitální, falcinní meningeomy apod. [13]. Tento názor je však kontroverzní, vezme-li v úvahu četnost meningeomů, jež jsou v kontaktu s mozkovým splavem, a incidenci vzdálených metastáz, to samé platí pro opakované chirurgické intervence. Přes nejasnosti jsou tyto faktory literárně udávány jako faktory rizikové a nelze je zcela zavrhnout i s ohledem na naší zkušenost. Naše první pacientka podstoupila celkem 15 operací recidivujícího meningeomu, který infiltroval šípový splav, druhý pacient podstoupil pět výkonů.
Cesta šíření je pravděpodobně hematogenní, kdy meningeomy invadující mozkové splavy, emisární či jiné kra-niální žíly se touto cestou šíří do plicní cirkulace a dále event. do žilního systému veny azygos, hemiazygos a vertebrálních žilních plexů [7,13]. Jelikož jsou metastázy nejčastěji nalezeny v plicích (okolo 60 %) [4,14], je tato cesta šíření velmi pravděpodobná. Tak tomu bylo zřejmě i u našich pacientů. Dále mohou být metastázy nalezeny v játrech či jiných břišních orgánech (okolo 30 %), obratlích, resp. kostech (11–15 %), lymfatických uzlinách (15 %) [4,14]. Tyto statistické údaje opět potvrzují i naše zkušenosti. Nelze vyloučit, že při opakovaných chirurgických intervencích, při manipulaci s nádorem může dojít k uvolnění buněk do cév, event. do lymfatické cirkulace a k dalšímu šíření meningeomu. Nabízí se, že meningeomy invadující kost, resp. u těch se známkami extrakraniálního šíření je riziko založení vzdálené metastázy vyšší, obzvláště jedná-li se o meningeom vyššího stupně [13]. U jednoho z našich pacientů se jednalo o intraventrikulární menigeom. Jelikož je známo, že intraventrikulární menigeomy vyrůstají z choroidálního plexu [15], což je orgán bohatě cévně zásobený, a mohl by tak být cestou vstupu buněk meningeomu do cévního řečiště, pátrali jsme v literatuře o spojitosti vzdáleného metastazování a intraventrikulárních meningeomů. Jednoznačnou spojitost jsme však nenalezli, jsou uváděna spíše jen ojedinělá kazuistická sdělení [7]. Dle našeho názoru však možnou souvislost nelze zcela zavrhnout, a to i s ohledem na fakt, že se jedná o velmi vzácnou podskupinu, tvořící cca 0,5–2 % všech meningeomů [15], a největší publikované soubory tvoří maximálně tři desítky případů. Bylo by tak nutné zkoumání většího souboru k potvrzení či vyloučení této domněnky. Jak již bylo uvedeno výše, je možné, že meningeomy mohou zakládat vzdálené metastázy také cestou lymfatického systému. Lymfatický systém sice nebyl nalezen v centrální nervové soustavě, přesto existují důkazy o jeho spojení se subarachnoidálním prostorem [16]. Tímto místem spojení je především oblast přední jámy lební, kde v místě lamina cribrosa etmoidální kosti prostupují axony čichových buněk (fila olfactoria) z nosní sliznice. Právě zde, v submukóze nosní sliznice, byla prokázána komunikace mezi perineuronálním prostorem a lymfatickou tkání [16]. Dalším možným místem komunikace je oblast durálních rukávců některých hlavových nervů nebo oblast jejich průniku kavernózním splavem [7,13].
Stran léčby metastazujících meningeomůnejsou definována jednoznačná doporučení. Předpokládá se, že radikální chirurgické odstranění doplněné RT přináší nejlepší výsledky. Prognóza takto generalizovaných meningeomů je však zpravidla špatná, i když jsou publikovány dlouhodobé remise po radikální chirurgické léčbě [17]. Zvažována je chemoterapie, hormonální léčba a imunoterapie, především v případech, jsou-li vyčerpány možnosti chirurgické léčby a RT. K těmto léčebným modalitám existují data věnující se recidivujícím meningeomům, s léčbou jejich vzdálených metastáz jsou zkušenosti velmi malé. Z chemoterapie uveďme především hydroxyureu. Její efekt je sice sporný, nicméně některé práce popisují stabilizaci onemocnění na dobu několika měsíců, nežádoucím efektem jsou časté hematotoxické účinky [18]. Hormonální léčba, především antiestrogenní či antiprogesteronové preparáty, může být použita při léčbě rekurentních benigních meningeomů [18]. Jelikož estrogenové a progesteronové receptory jsou spíše vzácně exprimovány na povrchu atypických a anaplastických meningeomů, nejsou u nich doporučeny. Zajímavostí je, že jsou u meningeomů velmi často přítomny receptory pro somatostatin, jejich aktivace je spojována s antiproliferačním efektem v in vitro studiích [18], ale i při klinických testech [19]. Podobný inhibiční efekt na růst meningeomů je připisován blokátorům kalciových kanálů [18,20]. Pozitivní efekt byl také zaznamenán při užití rekombinantního interferonu alfa [18]. Naše první pacientka podstoupila opakované chirurgické intervence včetně RT, přesto stav dále nezastavitelně progredoval, metastatické ložisko bylo nalezeno až po smrti pacientky při sekci. Druhý pacient také podstoupil opakované chirurgické intervence a RT, zjištěná metastáza byla radikálně řešena s následnou chemoterapií a RT, vše jen s velmi krátkodobým efektem, pacient zmírá 16 měsíců od zjištění metastázy meningeomu.
Závěr
Schopnost vzdáleného metastazování meningeomů je s ohledem na jejich relativně vysokou incidenci vzácná. Nelze ji však zcela opomíjet, a to především u maligních forem, u kterých je riziko metastazování, dle některých souborů až 43 % [4,7]. Při dispenzarizaci těchto pacientů bychom měli na tuto možnost pomýšlet. Tento fakt vybízí k otázce, zda v rámci dispenzarizace pacientů s maligním nebo anaplastickým meningeomem neprovádět i skríningové vyšetření nejčastěji postižených orgánů. Nejčastěji jsou postiženy plíce, dále lymfatické uzliny, břišní orgány a skelet. Dle našeho názoru by bylo vhodné u těchto pacientů provést 1–2krát ročně ultrazvukové vyšetření břišní dutiny, jednou ročně RTG srdce a plic a scintigrafii skeletu. Někteří autoři také doporučují, k odhalení diseminace onemocnění, pravidelné celotělové PET kontroly [6]. Histopatologický stupeň je dominantní, literárně udávaný rizikový faktor, další je pak invazivní růst, kontakt s mozkovým splavem, opakované recidivy nádoru a chirurgické intervence.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Tomáš Krejčí
Neurochirurgická klinika FN
17. listopadu 1790
708 52 Ostrava
e-mail: tomk82@seznam.cz
Přijato k recenzi: 22. 6. 2012
Přijato do tisku: 15. 10. 2012
Zdroje
1. Evans JJ, Lee JH, Suh J, Golubic M. Meningiomas. In: Moore AJ, Newell DW (eds). Tumour Neurosurgery, Principle and Practise. London: Springer Verlag 2006 : 205–234.
2. Mawrin C, Perry A. Pathological classification and molecular genetics of meningiomas. J Neurooncol 2010; 99(3): 379–391.
3. Vernooij MW, Ikram MA, Tanghe HL, Vincent AJ, Hofman A, Krestin GP et al. Incidental findings on brain MRI in the general population. N Engl J Med 2007; 357(18): 1821–1828.
4. Enam SA, Abdulrauf S, Mehta B, Malik GM, Mahmood A. Metastasis in meningioma. Acta Neurochir (Wien) 1996; 138(10): 1172–1177.
5. Krejčí T, Hrbáč T, Lipina R, Paleček T. Primárně extradurální meningeom prezentující se Garcinovým syndromem – kazuistika. Cesk Slov Neurol N 2012; 75/108(4): 490–493.
6. Duba M, Mrlian A, Smrčka M, Musil J. Diagnostika, terapie a dispenzarizace meningeomů na NCHK FN Brno v letech 2005–2010. Cesk Slov Neurol N 2013; 76/109(2): 211–216.
7. Lee GC, Choi SW, Kim SH, Kwon HJ. Multiple extracranial metastases of atypical meningiomas. J Korean Neurosurg Soc 2009; 45(2): 107–111.
8. Jančálek R, Novák Z, Chrastina J, Slaná B, Feitová V. Radioterapií indukované meningeomy. Cesk Slov Neurol N 2011; 74/107(2): 191–196.
9. Cerdá-Nicolás M, Lopez-Gines C, Perez-Bacete M, Roldan P, Talamantes F, Barberá J. Histologically benign metastatic meningioma: morphological and cytogenetic study. Case report. J Neurosurg 2003; 98(1): 194–198.
10. Al-Mefty O, Kadri PA, Pravdenkova S, Sawyer JR, Stangeby C, Husain M. Malignant progression in meningioma: documentation of a series and analysis of cytogenetic findings. J Neurosurg 2004; 101(2): 210–218.
11. Gladin CR, Salsano E, Menghi F, Grisoli M, Ghielmetti F, Milanesi I et al. Loss of heterozygosity studies in extracranial metastatic meningiomas. J Neurooncol 2007; 85(1): 81–85.
12. Teague SD, Conces DJ Jr. Metastatic meningioma to the lungs. J Thorac Imaging 2005; 20(1): 58–60.
13. Drummond KJ, Bittar RG, Fearnside MR. Metastatic atypical meningioma: case report and review of the literature. J Clin Neurosci 2000; 7(1): 69–72.
14. Rawat B, Franchetto AA, Elavathil J. Extracranial metastases of meningioma. Neuroradiology 1995; 37(1): 38–41.
15. Liu M, Wei Y, Liu Y, Zhu S, Li X. Intraventricular meninigiomas: a report of 25 cases. Neurosurg Rev 2006; 29(1): 36–40.
16. Brodbelt A, Stoodley M. An anatomical and physiological basis for CSF pathway disorders. In: Mallucci C, Sgouros S (eds). Cerebrospinal Fluid Disorders. New York: Informa 2010 : 1–17.
17. Moubayed SP, Guertin L, Lambert C, Desrochers P, Nehmé J, Coulombe G. Successful treatment of anaplastic meningioma metastatic to cervical lymph nodes. Head Neck. In press. doi: 10.1002/hed. 21938.
18. Sioka C, Kyritsis AP. Chemotherapy, hormonal therapy, and immunotherapy for recurrent meningiomas. J Neurooncol 2009; 92(1): 1–6.
19. Chamberlain MC, Glantz MJ, Fadul CE. Recurrent meningioma: salvage therapy with long-acting somatostatin analogue. Neurology 2007; 69(10): 969–973.
20. Ragel BT, Couldwell WT, Wurster RD, Jensen RL. Chronic suppressive therapy with calcium channel antagonists for refractory meningiomas. Neurosurg Focus 2007; 23(4): E10.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2013 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Mechanizmy spasticity a její hodnocení
- Náklady na poruchy mozku v České republice
- Sclerosis multiplex – úloha regulačných T‑lymfocytov v patogenéze a biologickej liečbe choroby
- Lidské prionové nemoci v České republice – 10 let zkušeností s diagnostikou
- Kolaterální cirkulace mozku – potenciální cíl terapie mozkových infarktů
- Neinvazívne stanovenie hemisferálnej dominancie rečových funkcií a horných končatin u zdravých subjektou
- Extrakraniálně metastazující meningeomy
- Intervenční léčba ischemické cévní mozkové příhody systémem EkoSonic SVTM
- Význam zadněprovazcové symptomatiky v diferenciální diagnostice hereditárních ataxií
- Rizikový profil pacientů s prodělanou ischemickou cévní mozkovou příhodou – analýza dat z registru IKTA
- Srovnání epidemiologických dat u akutních cévních mozkových příhod podle metodiky ÚZIS a IKTA ve zlínském okrese a v ČR
- Mnohočetný ložiskový proces mozku u HIV pozitivní pacientky – kazuistika
- Myozitida s inkluzními tělísky se slabostí šíjových svalů a pozitivním efektem imunoglobulinu – kazuistika
- Apoplexie Rathkeho cysty – kazuistika
- Webové okénko
-
Analýza dat v neurologii
XXXIX. Statistické nástroje pro posouzení homogenity a korekci odhadů poměru šancí a relativního rizika -
X. afaziologické sympozium s českou a slovenskou účastí
14.–15. března 2013, Brno
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Mechanizmy spasticity a její hodnocení
- Lidské prionové nemoci v České republice – 10 let zkušeností s diagnostikou
- Myozitida s inkluzními tělísky se slabostí šíjových svalů a pozitivním efektem imunoglobulinu – kazuistika
- Extrakraniálně metastazující meningeomy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



