-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Stereotaktické biopsie mozkových patologií systémem Varioguide – zkušenosti ze 101 výkonů
Stereotactic Brain Biopsies Using Varioguide System – 101 Cases Experience
Introduction:
Stereotactic brain biopsy is a routine procedure used to evaluate brain pathologies. Knowledge of histological diagnosis is crucial for further management in the majority of cases. In this paper we present our 5-year experience with Varioguide frameless stereotactic system.Material and methods:
Between 2010 and 2014, we treated 97 patients, 54 males and 43 females. Mean age was 61 ± 14 years. Stereobiopsies were performed using trajectories planned on IPlan application based on MRI navigation sequences. Primary outcome was diagnostic yield and rate of severe haemorrhagic complications.Results:
We performed two procedures in four patients, thus we performed 101 procedures together. Median volume of lesion was 18.8 cm3, IQR (interquartile range) 4.6–32 cm3. Lesion volume below 1 cm3 was found in 10 cases. The biopsy was non-diagnostic in eight patients. Out of the 10 less than 1 cm3 lesions, biopsy was non-diagnostic in three cases, significantly more frequently than in larger lesions (p = 0.031). A haemorrhagic complication was encountered in eight cases, bleeding was symptomatic in four. Severe morbidity and mortality was thus 4%. On the day of surgery, a therapeutic dose of LMWH was administered in 10 cases, three of these suffered from post-op haemorrhage (p = 0.031).Conclusions:
Frameless stereobiopsy using Varioguide system is a safe and effective system for brain biopsies. Diagnostic yield was 92%. The only identified predictor of diagnostic yield was lesion volume above 1 cm3. A therapeutic dose of LMWH on the day of surgery seems to be linked to higher incidence of haemorrhagic complications.Key words:
frameless stereotaxy – brain biopsy – MRI navigation – diagnostic yield
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: O. Bradáč; A. Štekláčová; F. Kramář; V. Beneš
Působiště autorů: Neurochirurgická a neuroonkologická klinika 1. LF UK a ÚVN – VFN Praha
Vyšlo v časopise: Cesk Slov Neurol N 2016; 79/112(5): 579-584
Kategorie: Krátké sdělení
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amcsnn2016579Souhrn
Úvod:
Stereotaktická biopsie je standardní, rutinně využívaný výkon v diagnostice mozkových lézí. Bioptické ověření histologického charakteru patologie je nutnost pro další vedení terapie u otevřeně nepřístupných patologií. V naší práci hodnotíme pětileté výsledky užívání bezrámového stereotaktického systému Varioguide.Soubor a metodika:
Mezi lety 2010 a 2014 jsme bioptovali 97 pacientů, 54 mužů a 43 žen. Průměrný věk byl 61 ± 14 let. Stereobiopsie byly prováděny na základě MR navigace, trajektorie byly plánovány na pracovní stanici IPlan. Sledovány byly pooperační komplikace a diagnostický výtěžek v závislosti na objemu ložiska.Výsledky:
V souboru 97 nemocných bylo provedeno celkem 101 biopsií. U čtyř nemocných bylo tedy nutné biopsii opakovat. Medián objemu ložiska byl 18,8 cm3, IQR (mezikvartilové rozpětí) 4,6–32 cm3. Objem pod 1 cm3 mělo 10 ložisek. U osmi pacientů nebyla ve vzorku zastižena patologická tkáň. Z 10 ložisek pod 1 cm3 byly bez známek patologie vzorky u tří případů, významně častěji než u ložisek nad 1 cm3 (p = 0,031). Krvácivá komplikace se vyskytla u osmi pacientů. Symptomatické krvácení bylo zaznamenáno ve čtyřech případech. Závažná morbidita a mortalita v naší sestavě dosáhla tedy 4 %. V den operace byl nízkomolekulární heparin podáván v terapeutické dávce 10 pacientům, u tří došlo ke krvácivé komplikaci (p = 0,031).Závěry:
Bezrámová stereobiopsie systémem Varioguide je bezpečná metoda odběru vzorku při mozkové biopsii. Diagnostický výtěžek dosažený touto metodou je až 92 %. Jediný identifikovaný prediktor výtěžnosti biopsie je objem ložiska nad 1 cm3. Podávání nízkomolekulárního heparinu v antikoagulační dávce v den operace se zdá být spojeno s vyšším výskytem krvácivých komplikací.Klíčová slova:
bezrámová stereotaxe – mozková biopsie – MR navigace – diagnostický výtěžekÚvod
Stereotaktická biopsie je standardní, rutinně využívaný výkon v diagnostice mozkových lézí. Zlatým standardem pro mozkové biop - sie i funkční neurochirurgii je klasická rámová stereotaxe, zejména díky své vysoké přesnosti. Příprava ke stereotaktickému výkonu vč. nasazení referenčního rámu v lokálním znecitlivění a následného lokalizačního grafického vyšetření je však časově náročná a pro pacienta může být nepříjemná [1]. Společně s rozvojem neuronavigačních přístrojů k obrazové navigaci se rozvíjely i metody bezrámové stereotaxe založené na obrazové navigaci. V nejjednodušším případě byla používána metoda „free-hand“, která však klade velké nároky na koordinaci pohybů rukou operatéra s obrazem na obrazovce navigačního přístroje, navíc zde nelze zcela potlačit přirozený třes ruky. Z těchto důvodů bylo postupně uvedeno mnoho přístrojů, jejichž úlohou je držet bioptickou jehlu či zaváděnou elektrodu v předem připravené trajektorii. Bezrámové varianty stereotaktických mozkových procedur se staly často využívanou alternativou klasické rámové stereotaxe [2–4].
Bezrámové stereotaktické přístroje se dají rozdělit do tří hlavních skupin:
- modifikované stereotaktické přístroje – např. modifikovaný Patilův rám [5];
- k lebce přichycené stereotaktické přístroje – např. Nexframe přístroj [6];
- stereotaktické přístroje s adjustovatelným ramenem – např. NeuroArm [4].
Varioguide (BrainLab AG, Feldkirchen, SRN) je stereotaktický přístroj ze třetí skupiny [7]. Sestává z ramene adjustovaného ve třech kloubech pro hrubé zaměření a dalších tří rotačních kloubů na distálním článku ramene, které slouží k jemnému zaměření do finální pozice (obr. 1).
Cílem práce bylo ověření vhodnosti systému Varioguide k provádění mozkových biopsií na základě srovnání dosažených výsledků s publikovanými daty.
Obr. 1. Sestavený přístroj Varioguide. Fig. 1. Assembled Varioguide device. 
Materiál a metody
Do studie byli zařazeni pacienti bioptovaní systémem Varioguide mezi lednem 2010 a prosincem 2014. Databáze pacientů byla budována prospektivně, zhodnocení retrospektivní. Sledovány byly klinický stav před výkonem a po něm hodnocený pomocí Karnofského škály, míra symptomatických krvácivých komplikací, velikost bioptovaného ložiska a počet bioptických vzorků odeslaných k histologickému zpracování. Objem bioptovaného ložiska byl měřen metodou ABC/2 na navigačním vyšetření.
Všichni pacienti měli aktuální navigační vyšetření na našem pracovišti. Preferenčně bylo užito MR zobrazení v T1W s kontrastní látkou i T2W s šíří vrstvy 1,2, resp. 1,0 mm. U pacientů s kontraindikací MR vyšetření bylo provedeno navigační CT s kontrastní látkou, šíře vrstvy opět 1,0 mm. Grafické kontroly byly rutinně prováděny ihned po odběru vzorku pomocí peroperační MR (3T, GE, USA), opět v navigačních sekvencích T1W i T2W a následně nativní CT kontrola do 24 hod po operaci. Pokud byla MR kontraindikována, byla provedena pouze rutinní CT kontrola k ověření místa odběru a vyloučení chirurgických komplikací.
Hlavními sledovanými parametry byly:
- Diagnostický výtěžek mozkových biopsií a jeho závislost na velikosti léze.
- Četnost všech krvácivých komplikací – krvácivá komplikace byla definována jako jakékoli intraparenchymové krvácení větší než bodové v místě odběru ve 30denním období po operaci.
- Četnost těžkých komplikací definovaných jako nově vzniklý neurologický deficit či smrt ve 30denním období po operaci.
- Vztah krvácivých komplikací k podávání nízkomolekulárního heparinu v terapeutické dávce v den operace.
Technika
Na základě navigačního MR, či CT s kontrastní látkou pro vizualizaci cév byla v plánovacím software iPlan Cranial (Brainlab AG, Feldkirchen, SRN) připravena trajektorie biop - tické jehly. Trajektorie byly voleny jako nejkratší spojnice povrchu mozku s ložiskem s respektováním elokventních zón, anatomie povrchových cév a anatomie sulků, které trajektorie nekřížily z důvodu minimalizace rizika intrakraniálního krvácení.
Biopsie systémem Varioguide byly prováděny v celkovém znecitlivění, hlava upnuta ve tříbodové svorce. Po registraci polohy hlavy bylo rameno Varioguide adjustováno do vypočtené polohy a z návrtu provedena biopsie. Pozice side-cut jehly byla v reálném čase zobrazována na obrazovce navigačního přístroje. Vzorky byly vždy odebírány z více směrů v cílovém místě (ideálně na 0, 90, 180 a 270 stupních) (obr. 2). V případě většího ložiska byly vzorky odebírány i z různých hloubek podél naplánované trajektorie. Po odběru vzorku byla rána uzavřena standardním způsobem a provedena peroperační MR k ověření místa odběru a tato fúzována s navigačním vyšetřením pro ověření přesnosti trajektorie (obr. 3).
Obr. 2. Čtyři odebrané vzorky před fixací. Fig. 2. Four samples taken prior to fixation. 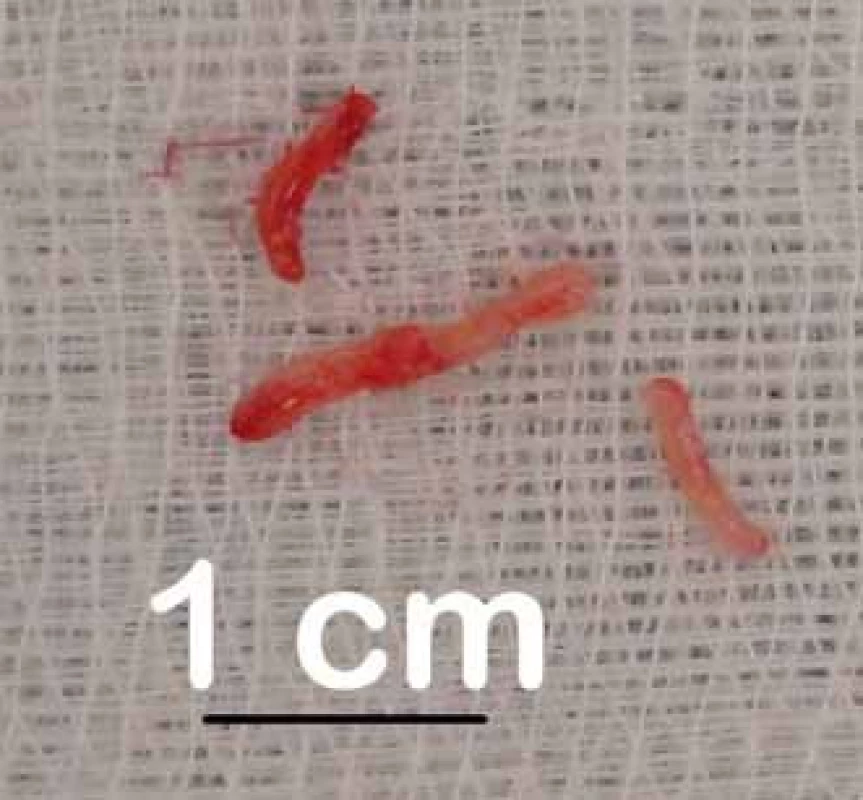
Obr. 3. Peroperační MR. Provedena fúze s navigačními sekvencemi. Modře je trajektorie plánovaná, zeleně pak reálná. Podél trajektorie jsou patrné bublinky vzduchu (hypointenzní ložiska v místě odběru a subkortikálně). Fig. 3. Intraoperative MRI. Fusion with navigation sequences. Planned trajectory in blue, real trajectory in green. Air bubbles visible along the trajectory (hypointese lesions in the area of sampling and subcortically). 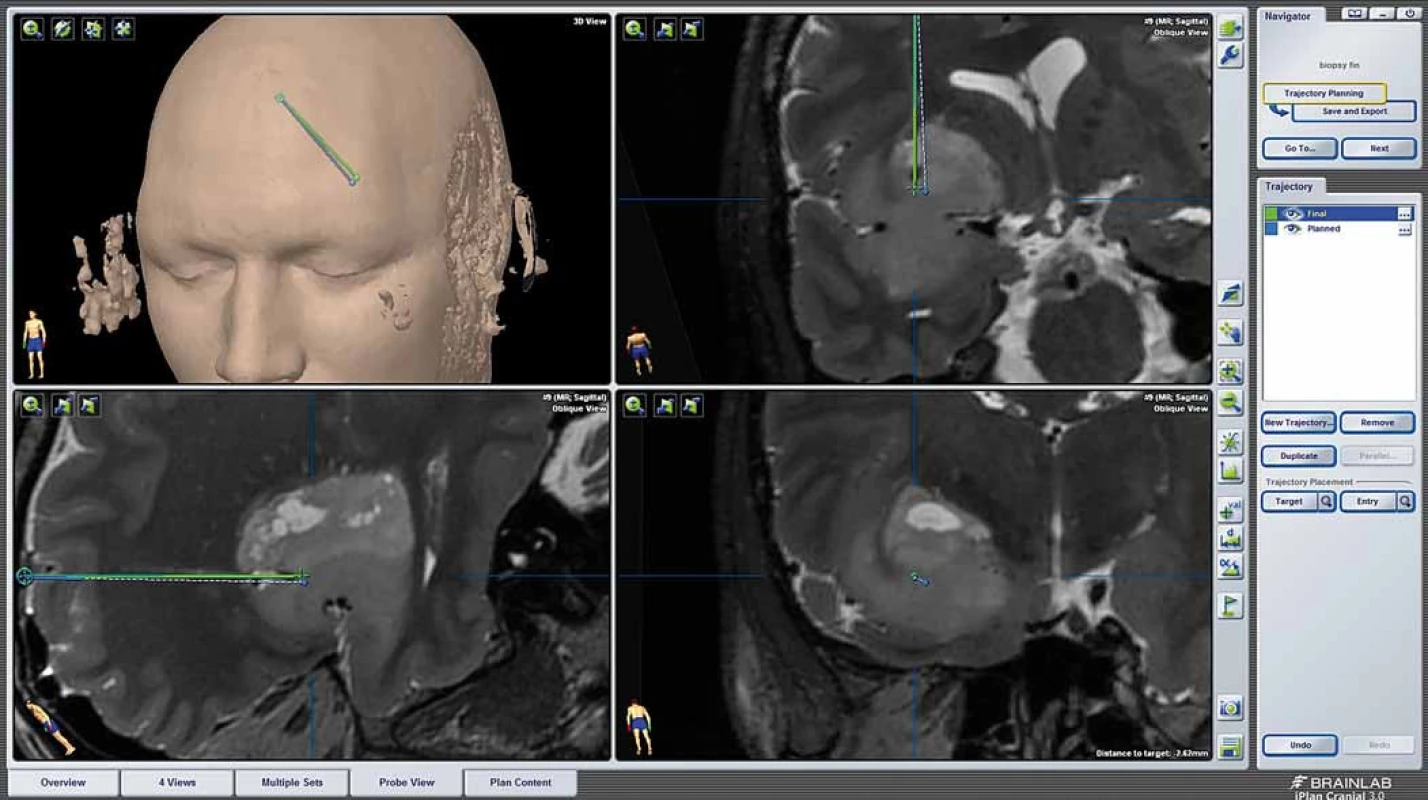
Statistická analýza
Statistické zpracování spojitých proměnných bylo provedeno pomocí parametrických t-testů pro opakovaná měření pro srovnání předoperačního a pooperačního stavu, jinak byly použity dvouvýběrové t-testy. Pro srovnání kategoriálních proměnných byl použit Fisherův test. Za statististicky významnou byla považována hladina p = 0,05. Zpracování bylo provedeno pomocí programu STATISTICA CZ 12.0 (StatSoft CZ, s. r. o.).
Výsledky
Mezi roky 2010 a 2014 bylo na našem pracovišti bioptováno 97 pacientů, průměrný věk byl 61 ± 14 let, 54 mužů a 43 žen. Průměrné KPS (Karnofsky performance status) bylo 77 ± 15. Základní charakteristiky souboru spolu s předoperačním neurologickým stavem jsou uvedeny v tab. 1. Medián objemu bioptovaných ložisek byl 18,8 cm3, mezikvartilové rozpětí 4,6–32 cm3. Objem pod 1 cm3 mělo 10 ložisek. Průměrně bylo během jedné operace odebráno 2,6 ± 1,4 vzorku.
Tab. 1. Základní charakteristiky souboru. 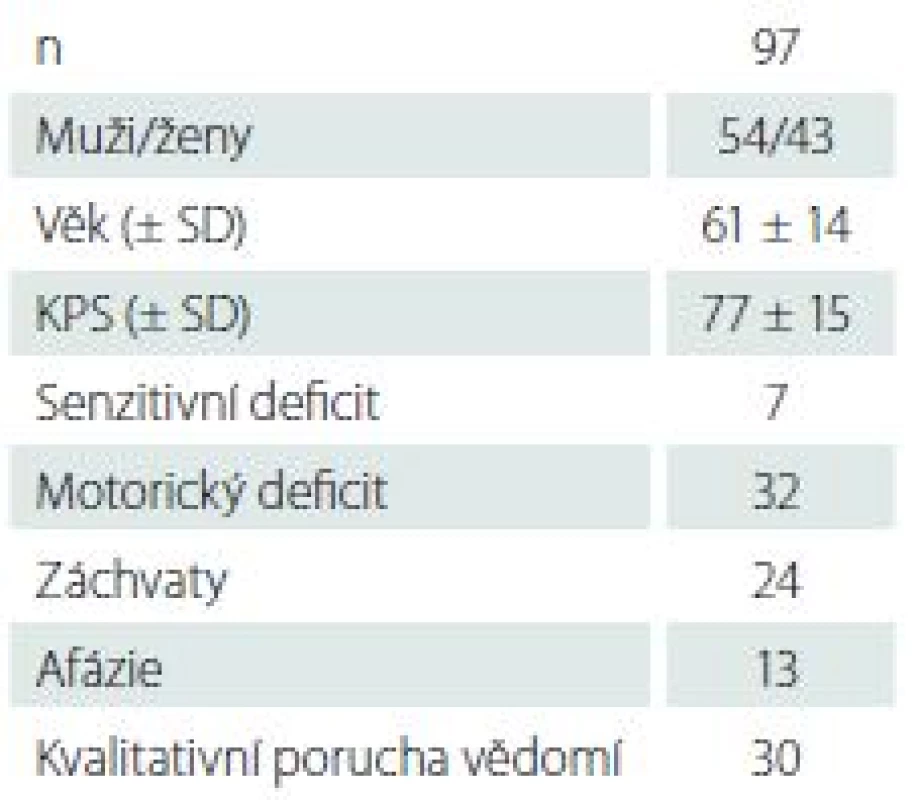
KPS – Karnofsky performance status. Diagnostický výtěžek
U čtyř pacientů byly provedeny dva výkony, celkem bylo tedy provedeno 101 biop-tických výkonů. U dvou pacientů se jednalo o suspektní upgrading dříve bioptovaného nízkostupňového gliomu, který byl opakovanou biopsií potvrzen (po jednom a dvou letech). U jednoho pacienta byla opakovaně bioptována suspektní recidiva chondrosarkomu baze prorůstající do mediálních struktur temporálního laloku, v obou případech však histologické vyšetření prokázalo pouze reaktivní změny, místo odběru bylo graficky ověřeno a MR obraz je již tři roky stabilní. U jednoho pacienta byl opakovaně bioptován suspektní lymfom, který byl prokázán až při druhém výkonu. Výsledky histologického vyšetření jsou uvedeny sumárně v tab. 2. U osmi pacientů nebyla v bioptickém vzorku zastižena patologická tkáň, u tří z nich byla biopsie opakována buď otevřenou cestou, či s rámem, jeden pacient se rozhodl opakovaný výkon podstoupit na jiném pracovišti, u jednoho pacienta byla opakována biopsie Varioguide, u dvou pacientů byla doporučena mezioborovým neuroonkologickým seminářem následná léčba i bez znalosti histologie, u poslední pacientky se suspektním lymfomem došlo k rychlé progresi neurologického stavu a další intervence nebyla indikována. Z 10 ložisek s objemem pod 1 cm3 byly bez známek patologie hodnoceny vzorky u tří případů, významně častěji než u ložisek s objemem nad 1 cm3 (5 z 91; p = 0,031).
Tab. 2. Výsledky histologických vyšetření. 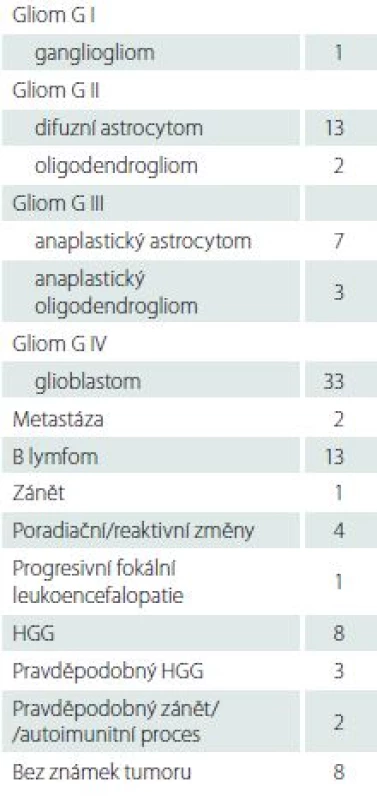
HGG – high-grade gliom. Komplikace
Souhrn všech pooperačních komplikací je uveden v tab. 3. Celkem se jakékoli komplikace vyskytly u 14 pacientů, z toho se o krvácivou komplikaci jednalo u osmi pacientů. Krvácivé komplikace byly stanoveny dle peroperační MR, v případě nové symptomatologie byla následně opakována grafická vyšetření – nejčastěji CT – ke zhodnocení event. progrese hematomu. Asymptomatické krvácivé komplikace byly zaznamenány ve čtyřech případech, vždy se jednalo o částečné prokrvácení tumoru v souvislosti s místem odběru. Symptomatické krvácivé komplikace byly zaznamenány ve čtyřech případech – ve dvou případech vedlo prokrvácení tumoru k těžkému neurologickému deficitu. V dalších dvou případech pacienti v průběhu hospitalizace zemřeli, vždy s již histologicky prokázaným glioblastomem. Ve všech čtyřech případech mělo symptomatické krvácení jasný vztah k místu odběru. U dvou pacientů došlo k prokrvácení tumorózního ložiska v centrální krajině s následným těžkým neurologickým deficitem, u dvou zemřelých pacientů byla zřejmá masivní extenze krvácení i mimo tumor s postupnou progresí perifokálního edému. U žádného z případů nedošlo ke krvácení do mozkového parenchymu čistě mimo tumor, které by mělo souvislost s bioptickou trajektorií. Taktéž nebyl zaznamenán případ subdurálního či epidurálního krvácení. Závažná morbidita a mortalita v naší sestavě dosáhla tedy 4 %. I přes tyto komplikace srovnání před - a pooperačních průměrných hodnot KPS však nevykázalo významný rozdíl (77 ± 15 vs. 75 ± 18; p = 0,163). V den výkonu byl nízkomolekulární heparin podáván v terapeutické dávce (aspoň 0,8 ml nadroparinu/24 hod v den operace) 10 pacientům, u třech došlo ke krvácivé komplikaci (p = 0,031). U všech pacientů byl nízkomolekulární heparin podáván z interní indikace – nejčastěji se jednalo o fibrilaci síní či stav po proběhlé hluboké žilní trombóze/plicní embolii.
Tab. 3. Přehled všech komplikací v sestavě. 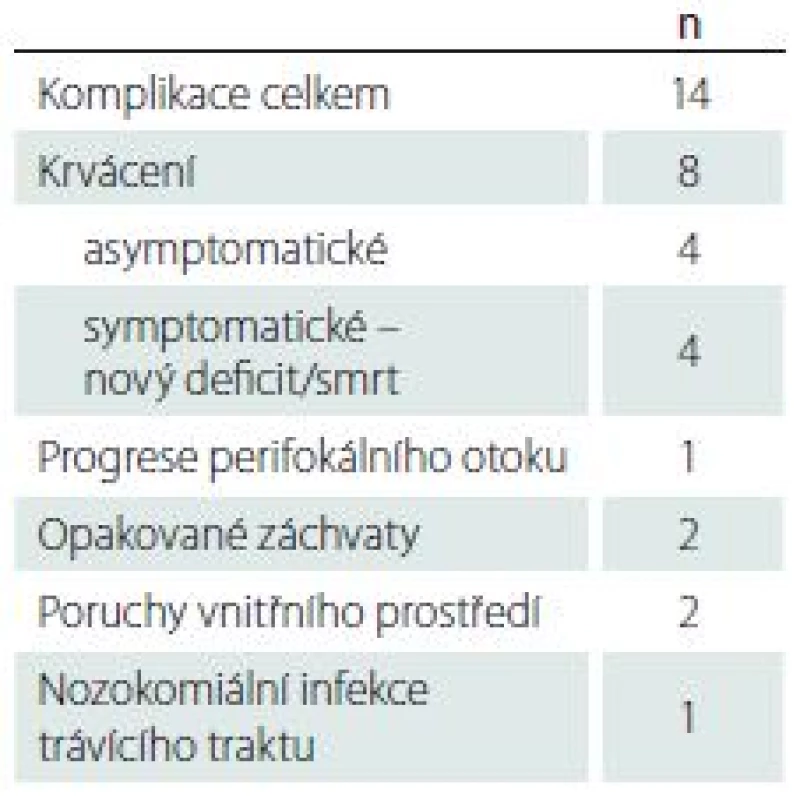
Diskuze
Definice diagnostického výtěžku
Diagnostický výtěžek je definován jako „pravděpodobnost, že dané vyšetření/procedura poskytne informaci potřebnou k ustanovení diagnózy“. Tato definice však nezohledňuje přesnost diagnózy. V případě biopsií mozkových procesů můžeme ve shodě s Khatabem rozdělit výsledky histologických vyšetření bioptických vzorků do tří skupin [8]:
- Konkluzivní, tedy takové, kde je v případě tumoru s jistotou určen typ i grade dle WHO klasifikace. V případě non-neoplastické léze je vyšetření diagnostické ve smyslu určení konkrétní diagnózy (infekce, autoimuntní proces).
- Inkonkluzivní, tedy takové, kde je v případě tumoru nejistý typ či grade a v případě non-neoplastické léze mohou být nálezy nejistě podporující konkrétní diagnózu.
- Nediagnostické, tedy bez známek tumoru, či non-neoplastické léze ve vzorku. Pravděpodobná je chyba v odběru.
Ve své práci Khatab uvádí přehled 16 prací zabývajících se bezrámovými stereobiopsiemi. Na základě analýzy celkem 1 628 pa - cientů získává průměrný referovaný diagnostický výtěžek 93,8 %, rozsah 87–100 %. Zároveň dodává, že ani jedna z prací neuvádí exaktní definici diagnostického výtěžku. Sám ve své sestavě 235 procedur uvádí konkluzivní histologické vyšetření v 72,8 %, inkonkluzivní potom v dalších 21,7 %. V naší sestavě jsme konkluzivní histologické vzorky získali u 79 % pacientů, inkonkluzivní ve 13 %. Tato výtěžnost je srovnatelná s Khatabovou sestavou a v součtu tedy i s ostatními publikovanými pracemi [9,10].
Objem cíleného ložiska pod 1 cm3 se ukázal být spojen se signifikantně nižší výtěžností (70 %) než u ložisek objemnějších. Tento fakt nepřekvapuje. Barnett et al identifikují v sestavě 218 pacientů menší objem bioptované léze jako rizikový faktor pro nevýtěžnou biopsii, společně s hlubokým umístěním léze [11]. Waters et al se ve své práci zaměřují na ložiska pod 1 cm3 a srovnávají výtěžek s ložisky většími [12]. Z celkové sestavy 267 případů identifikovali 21 pacientů s lézí pod 1 cm3. Výtěžek se významně lišil 76,2 vs. 94,8 %. Tato čísla opět vcelku dobře odpovídají naší sestavě, ať už co do zastoupení ložisek pod 1 cm3, tak co do diagnostického výtěžku. V českém písemnictví se problematice stereotaktických biopsií věnovali Chrastina et al, kteří pro menší léze v hlubokých strukturách mozku doporučují použití rámových stereotaktických přístrojů [13].
Metody zvýšení diagnostického výtěžku
Jednoduchý způsob, jak zvýšit diagnostický výtěžek je provedení peroperačního histologického vyšetření. Dammers et al srovnávali historickou sestavu bez peroperační histologie proti sestavě novější s peroperační histologií, jež prokazuje významné zvýšení diagnostického výtěžku [14]. Podobný postup s možným opakováním odběru v případě nediagnostického vzorku doporučují i Zoeller et al [15], Frati et al [16] či Shooman et al [17].
Intraoperační MR k ověření místa odběru a tedy vyloučení chybného odběru je doporučována Schulderem et al, kteří ve své práci hodnotí 39 případů s diagnostickým výtěžkem 97 % [18]. Tanaka et al radí provádět samotné navigační vyšetření jako součást operace s již polohovaným pacientem a dokazují zvýšení přesnosti navigačního systému [19]. V naší praxi používáme intraoperační MR k ověření místa odběru a vyloučení chirurgických komplikací (obr. 3). Pokud je peroperační obraz uspokojivý a kvalita získaných vzorků dostatečná, peroperační histologii rutinně neprovádíme.
Další metoda zvýšení diagnostického výtěžku biopsií mozkových patologií, zejména tumorů, je cílení biopsie nejen dle strukturálního vyšetření, ale dle fúze strukturálního a metabolického vyšetření. V naší sestavě peroperačně bioptovaných a následně resekovaných nízkostupňových gliomů se suspekcí na upgrading jsme prokázali přínos MR spektroskopického vyšetření [20]. Kombinací cílení biopsie dle spektroskopické MR s peroperačním histologickým vyšetřením dosáhli Frati et al v souboru 296 případů diagnostický výtěžek 99,7 % [16]. Jiní autoři doporučují fúzi s PET vyšetřením. Gempt et al kombinují tyrozinový PET s peroperační histologií [21]. Widhalm et al referují diagnostický výtěžek 100 % v sestavě 50 pacientů s gliomem, u kterých biopsii cílili na základě metioninového PET vyšetření [22]. Předoperačně podávali 5-ALA a peroperačně kontrolovali pozitivitu fluorescence společně s histologickým vyšetřením.
V současnosti se v mozkových bezrámových stereotaktických procedurách začíná prosazovat robotická chirurgie s cílem zlepšení diagnostického výtěžku a zpřesnění cílení biopsie [23]. Bekelis et al udávají diagnostický výtěžek 97,9 % při užití robotického SurgiScope systému [3]. Robotické systémy se prosazují i v případě zavedení elektrod pro hlubokou mozkovou stimulaci, vysokou přesnost zavedení prezentuje Li et al ve své práci z roku 2015 [24].
Komplikace
Celková těžká morbidita (2 %) a mortalita (2 %) je srovnatelná s ostatními publikovanými sestavami [10,14,17,25,26]. Grossmann et al [9] udávají frekvenci krvácivých komplikací 7 % (3,6 % symptomatických) v sestavě 355 případů [26]. Frati et al u 296 případů uvádějí frekvenci hemoragických komplikací 8,8 %, ovšem těžce symptomatických pouze 1 % [16]. Na druhé straně Ali et al [27] referují nový neurologický deficit u šesti (7,7 %) ze 78 pacientů a Khatab [8] morbiditu 7,9 % a mortalitu 1,1 % v sestavě 235 případů.
V naší sestavě byl naznačen významný efekt podání nízkomolekulárního heparinu v den operace v terapeutické dávce na frekvenci krvácivých komplikací. Tento logický fakt potvrzují články Niemiho et al, kteří doporučují u dříve antikoagulovaných pacientů operovat v momentě normalizace krevní koagulace a nízkomolekulární heparin opět nasadit odloženě po výkonu v redukované dávce [28,29]. Na druhé straně Salmaggi et al ve svém review článku zaměřeném na tromboprofylaxi u převážně neantikoagulovaných pacientů doporučují na základě analýzy 1 558 nemocných s mozkovým tumorem mechanické prostředky v průběhu operace s časným (první pooperační den) podáním nízkomolekulárního heparinu v profylaktické dávce [30]. Tento postup i přes vyšší frekvenci krvácivých komplikací vede k podstatnému snížení výskytu hluboké žilní trombózy. V současné době preferujeme u pacientů neantikoagulovaných podání poslední profylaktické dávky (nastavené adekvátně dle doporučení pro prevenci tromboembolické nemoci) min. 12 hod před samotným výkonem. Následující profylaktická dávka je podávána první pooperační den, minimálně však 12 hod po výkonu. U pacientů antikoagulovaných podáváme poslední terapeutickou dávku též 12 hod před operací, první pooperační den je aplikována dávka profylaktická a až od druhého pooperačního dne je podávána opět dávka terapeutická. Standardem je v celém pooperačním průběhu užití kompresivních bandáží dolních končetin u všech pacientů.
Závěry
Bezrámová stereobiopsie systémem Varioguide je bezpečná metoda odběru tkáňového vzorku při mozkové biopsii. Diagnostický výtěžek dosažený touto metodou je 79, resp. 92 %. Procento symptomatických krvácivých komplikací je přijatelné, v publikovaných mezích. Jediným identifikovaným prediktorem výtěžnosti biopsie je objem ložiska nad 1 cm3. Podávání nízkomolekulárního heparinu v antikoa
Podpořeno z programového projektu Ministerstva zdravotnictví ČR s reg. č. NT 12254-5. Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. RNDr. Ondřej Bradáč, Ph.D.
Neurochirurgická a neuroonkologická klinika
1. LF UK a ÚVN – VFN Praha
U Vojenské nemocnice 1200
169 02 Praha 6
e-mail: ondrej.bradac@uvn.cz
Přijato k recenzi: 13. 12. 2015
Přijato do tisku: 2. 6. 2016
Zdroje
1. Lobao CA, Nogueira J, Souto AA, et al. Cerebral biopsy: comparison between frame-based stereotaxy and neuronavigation in an oncology center. Arq Neuropsiquiatr 2009; 67 (3B): 876–81.
2. Amin DV, Lozanne K, Parry PV, et al. Image-guided frameless stereotactic needle biopsy in awake patients without the use of rigid head fixation. J Neurosurg 2011; 114 (5): 1414–20. doi: 10.3171/2010.7.JNS091493.
3. Bekelis K, Radwan TA, Desai A, et al. Frameless robotically targeted stereotactic brain biopsy: feasibility, diagnostic yield, and safety. J Neurosurg 2012; 116 (5): 1002–6. doi: 10.3171/2012.1.JNS111746.
4. Sutherland GR, Wolfsberger S, Lama S, et al. The evolution of neuroArm. Neurosurgery 2013; 72 (Suppl 1): 27–32. doi: 10.1227/NEU.0b013e318270da19.
5. Patil AA. A modified stereotactic frame as an instrument holder for frameless stereotaxis: technical note. Surg Neurol Int 2010; 1 : 62. doi: 10.4103/2152-7806.70957.
6. Fukaya C, Sumi K, Otaka T, et al. Nexframe frameless stereotaxy with multitract microrecording: accuracy evaluated by frame-based stereotactic X-ray. Stereotact Funct Neurosurg 2010; 88 (3): 163–8. doi: 10.1159/000313868.
7. Ringel F, Ingerl D, Ott S, et al. VarioGuide: a new frameless image-guided stereotactic system – accuracy study and clinical assessment. Neurosurgery 2009; 64 (5 Suppl 2): 365–71. doi: 10.1227/01.NEU.0000341532.15867.1C.
8. Khatab S, Spliet W, Woerdeman PA. Frameless image-guided stereotactic brain biopsies: emphasis on diagnostic yield. Acta Neurochir (Wien) 2014; 156 (8): 1441–50. doi: 10.1007/s00701-014-2145-2.
9. Grossman R, Sadetzki S, Spiegelmann R, et al. Haemorrhagic complications and the incidence of asymptomatic bleeding associated with stereotactic brain biop - sies. Acta Neurochir (Wien) 2005; 147 (6): 627–31.
10. Woodworth GF, McGirt MJ, Samdani A, et al. Frameless image-guided stereotactic brain biopsy procedure: diagnostic yield, surgical morbidity, and comparison with the frame-based technique. J Neurosurg 2006; 104 (2): 233–7.
11. Barnett GH, Miller DW, Weisenberger J. Frameless stereotaxy with scalp-applied fiducial markers for brain biop - sy procedures: experience in 218 cases. J Neurosurg 1999; 91 (4): 569–76.
12. Waters JD, Gonda DD, Reddy H, et al. Diagnostic yield of stereotactic needle-biopsies of sub-cubic centimeter intracranial lesions. Surg Neurol Int 2013; 4 (Suppl 3): S176–81. doi: 10.4103/2152-7806.110677.
13. Chrastina J, Novák Z, Jančálek R, et al. Úloha stereotaktické biopsie v diagnostice tumoru mozku. Onkologie 2011; 5 (1): 49–52.
14. Dammers R, Haitsma IK, Schouten JW, et al. Safety and efficacy of frameless and frame-based intracranial biop - sy techniques. Acta Neurochir (Wien) 2008; 150 (1): 23–9. doi: 10.1007/s00701-007-1473-x.
15. Zoeller GK, Benveniste RJ, Landy H, et al. Outcomes and management strategies after nondiagnostic stereotactic biopsies of brain lesions. Stereotact Funct Neurosurg 2009; 87 (3): 174–81. doi: 10.1159/000222661.
16. Frati A, Pichierri A, Bastianello S, et al. Frameless stereotactic cerebral biopsy: our experience in 296 cases. Stereotact Funct Neurosurg 2011; 89 (4): 234–45. doi: 10.1159/000325704.
17. Shooman D, Belli A, Grundy PL. Image-guided frameless stereotactic biopsy without intraoperative neuropathological examination. J Neurosurg 2010; 113 (2): 170–8. doi: 10.3171/2009.12.JNS09573.
18. Schulder M, Spiro D. Intraoperative MRI for stereotactic biopsy. Acta Neurochir Suppl 2011; 109 : 81–7. doi: 10.1007/978-3-211-99651-5_13.
19. Tanaka S, Puffer RC, Hoover JM, et al. Increased frameless stereotactic accuracy with high-field intraoperative magnetic resonance imaging. Neurosurgery 2012; 71 (2 Suppl): ons321–7. doi: 10.1227/NEU.0b013e31 826a88a9.
20. Bradac O, Vrana J, Jiru F, et al. Recognition of anaplastic foci within low-grade gliomas using MR spectroscopy. Br J Neurosurg 2014; 28 (5): 631–6. doi: 10.3109/02688697. 2013.872229.
21. Gempt J, Buchmann N, Ryang YM, et al. Frameless image-guided stereotaxy with real-time visual feedback for brain biopsy. Acta Neurochir (Wien) 2012; 154 (9): 1663–7. doi: 10.1007/s00701-012-1425-y.
22. Widhalm G, Minchev G, Woehrer A, et al. Strong 5-aminolevulinic acid-induced fluorescence is a novel intraoperative marker for representative tissue samples in stereotactic brain tumor biopsies. Neurosurg Rev 2012; 35 (3): 381–91. doi: 10.1007/s10143-012 - 0374-5.
23. Grimm F, Naros G, Gutenberg A, et al. Blurring the boundaries between frame-based and frameless stereotaxy: feasibility study for brain biopsies performed with the use of a head-mounted robot. J Neurosurg 2015; 123 (3): 737–42. doi: 10.3171/2014.12.JNS141 781.
24. Li G, Su H, Cole GA, et al. Robotic system for MRI-guided stereotactic neurosurgery. IEEE Trans Biomed Eng 2015; 62 (4): 1077–88.
25. Dorward NL, Paleologos TS, Alberti O, et al. The advantages of frameless stereotactic biopsy over frame-based biopsy. Br J Neurosurg 2002; 16 (2): 110–8.
26. Gralla J, Nimsky C, Buchfelder M, et al. Frameless stereotactic brain biopsy procedures using the Stealth Station: indications, accuracy and results. Zentralbl Neurochir 2003; 64 (4): 166–70.
27. Ali Z, Prabhakar H, Bithal PK, et al. A review of perioperative complications during frameless stereotactic surgery: our institutional experience. J Anesth 2009; 23 (3): 358–62. doi: 10.1007/s00540-009 - 0759-y.
28. Niemi T, Armstrong E. Thromboprophylactic management in the neurosurgical patient with high risk for both thrombosis and intracranial bleeding. Curr Opin Anaesthesiol 2010; 23 (5): 558–63. doi: 10.1097/ACO. 0b013e32833e1589.
29. Niemi T, Silvasti-Lundell M, Armstrong E, et al. The Janus face of thromboprophylaxis in patients with high risk for both thrombosis and bleeding during intracranial surgery: report of five exemplary cases. Acta Neurochir (Wien) 2009; 151 (10): 1289–94. doi: 10.1007/s00701-009-0419-x.
30. Salmaggi A, Simonetti G, Trevisan E, et al. Perioperative thromboprophylaxis in patients with craniotomy for brain tumours: a systematic review. J Neurooncol 2013; 113 (2): 293–303. doi: 10.1007/s11060-013-1115-5.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článek Rasmussenova encefalitídaČlánek Detekce pravolevých zkratů u mladých pacientů po ischemické cévní mozkové příhodě – pilotní studieČlánek Komentář k článku Pavlík et alBezpečnost karotického stentingu – srovnání protekčních systémůČlánek Komentář k článku Vaško et alNeurofyziologická vyšetření u traumatických lézí brachiálního plexuČlánek Webové okénko
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2016 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Rasmussenova encefalitída
- Jsou nemotorické projevy Parkinsonovy nemoci indikací k léčbě pomocí hluboké mozkové stimulace subthalamických jader?
- Jsou nemotorické projevy Parkinsonovy nemoci indikací k léčbě pomocí hluboké mozkové stimulace subthalamických jader?
-
Komentář ke kontroverzím
Hluboká mozková stimulace u Parkinsonovy nemoci – revize indikačních kritérií? - Léky navozená spánková endoskopie – cesta k lepším chirurgickým výsledkům při léčbě syndromu obstrukční spánkové apnoe
- Současná kortikoterapie u nádorů mozku
- Individualizovaný přístup k léčbě roztroušené sklerózy
- Aktuální pohled na management nízkostupňových gliových nádorů centrálního nervového systému
- Detekce pravolevých zkratů u mladých pacientů po ischemické cévní mozkové příhodě – pilotní studie
- Myxovirus resistance protein A v terapii interferony-β u pacientů s roztroušenou sklerózou a algoritmus sledování účinnosti léčby
- Myasténia gravis asociovaná s tymómom – súbor pacientov v Slovenskej republike (1978–2015)
- Bezpečnost karotického stentingu – srovnání protekčních systémů
-
Komentář k článku Pavlík et al
Bezpečnost karotického stentingu – srovnání protekčních systémů - Průkaz boreliové DNA u pacientů s neuroboreliózou
- Vztah likvorových hladin IL-6 ke změnám parciálního tlaku kyslíku v mozku a k rozvoji vazospazmů u pacientů po subarachnoidálním krvácení z ruptury aneuryzmatu mozkové tepny
- Stereotaktické biopsie mozkových patologií systémem Varioguide – zkušenosti ze 101 výkonů
- Myasthenia Gravis Composite – validace české verze
- Pilotní studie využití tenzometrické plošiny v domácí terapii poruch rovnováhy
- Neurofyziologická vyšetření u traumatických lézí brachiálního plexu
-
Komentář k článku Vaško et al
Neurofyziologická vyšetření u traumatických lézí brachiálního plexu - Paroxyzmálna kinezigénna dystónia ako primomanifestácia roztrúsenej sklerózy – kazuistika
- Idiopatická hypertrofická kraniální pachymeningitida – dvě kazuistiky
- Metodika stanovení smrti mozku pomocí transkraniální sonografie vypracovaná Neurosonologickou komisí a Cerebrovaskulární sekcí České neurologické společnosti ČLS JEP
- Webové okénko
-
Analýza dat v neurologii
LIX. Koncept atributivního rizika v analýze populačních studií – VI. Kauzalita vztahů
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Současná kortikoterapie u nádorů mozku
- Rasmussenova encefalitída
- Neurofyziologická vyšetření u traumatických lézí brachiálního plexu
- Průkaz boreliové DNA u pacientů s neuroboreliózou
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



