-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Myasténia gravis asociovaná s tymómom – súbor pacientov v Slovenskej republike (1978–2015)
Myasthenia Gravis Associated with Thymoma – a Cohort of Patients in the Slovak Republic (1978–2015)
Introduction:
Thymoma-associated myasthenia gravis (TAMG) differs from other forms of MG mainly by combined presence of intrathymic (thymus, thymoma) and extrathymic autoimmune mechanisms in their immunopathogenesis.Aims:
We present a retrospective longitudinal study of 123 patients with TAMG registered in the Slovak Centre for Neuromuscular Diseases between 1978 and 2015. The aim of the study was to analyse epidemiological and clinical data, laboratory findings and factors affecting prognosis of TAMG.Material and methods:
We analysed data from medical records of patients with TAMG. We examined the age at disease onset, gender, presence of autoantibodies against AChRs and MuSK and type of clinical symptomatology. We evaluated therapies used, clinical status at the last examination and prognosis of TAMG patients.Results:
Out of 2,074 MG patients, we found TAMG in 123 patients (5.9%), 46 men and 77 women. Median age at disease onset was 51 years. All patients, except one, had AChR seropositive MG. In 78 patients (63.4%) remission or significant improvement by immunotherapy and surgical treatment was achieved. The best results were obtained in patients with early TAMG diagnosis. MG has not been the primary cause of death in any patient for the last 20 years. 91 patients had benign and 32 malignant thymoma. Six patients with malignant thymoma died following thymoma dissemination, four of these had MG in remission.Conclusion:
TAMG was found in 5.9 % of 2,074 patients. TAMG is AChR-seropositive. Both, MG severity and biological characteristics of thymoma, determine TAMG prognosis. Early diagnosis and optimal treatment of TAMG are crucial for favourable prognosis.Key words:
myasthenia gravis – thymoma – immunopathogenesis – diagnosis – treatment – prognosis
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: I. Martinka 1; M. Fulová 2
; M. Schnorrer 3; F. Cibulčík 1; P. Špalek 1
Působiště autorů: Centrum pre neuromuskulárne ochorenia, Neurologická klinika SZU a UN Bratislava 1; Epidemiologický ústav, LF UK, Bratislava 2; III. chirurgická klinika LF UK a UN Milosrdní bratia, Bratislava 3
Vyšlo v časopise: Cesk Slov Neurol N 2016; 79/112(5): 552-559
Kategorie: Původní práce
Souhrn
Úvod:
Myasténia gravis asociovaná s tymómom (MGAT) sa od ostatných foriem MG líši najmä kombinovaným uplatňovaním intratýmusových (týmus, tymóm) a extratýmusových autoimunitných mechanizmov v imunopatogenéze.Ciele:
Prezentujeme retrospektívnu longitudinálnu štúdiu súboru 123 pacientov s MGAT evidovaných v slovenskom Centre pre neuromuskulárne ochorenia v rokoch 1978–2015. Cieľom práce bola analýza epidemiologických a klinických údajov, laboratórnych nálezov a faktorov ovplyvňujúcich prognózu MGAT.Materiál a metodika:
Metódou štúdia bol rozbor údajov a nálezov zdravotnej dokumentácie pacientov s MGAT. Zisťovali sme vek pri vzniku ochorenia, pohlavie, výskyt autoprotilátok proti acetylcholinovom receptore (AChR) a MuSK, typ klinickej symptomatológie. Hodnotili sme použité terapeutické postupy, klinický stav pri poslednej kontrole a prognózu pacientov s MGAT.Výsledky:
V súbore 2 074 pacientov s MG sme zistili MGAT u 123 pacientov (5,9 %), 46 mužov a 77 žien. Medián veku pri vzniku ochorenia bol 51 rokov. Všetci pacienti, okrem jedného, mali AChR séropozitívnu MG. U 78 pacientov (63,4 %) sme imunoterapiou a chirurgickou liečbou dosiahli remisiu alebo výrazné zlepšenie. Najlepšie výsledky sme dosiahli u pacientov s včasne diagnostikovanou MGAT. V posledných 20 rokoch MG nebola priamou príčinou úmrtia ani u jedného pacienta. Benígny tymóm malo 91 pacientov a malígny 32. Šiesti pacienti s malígnym tymómom exitovali na jeho disemináciu, štyria z nich mali MG v remisii.Záver:
MGAT sme zistili u 5,9 % z 2 074 pacientov. MGAT je AChR séropozitívna. Prognózu MGAT determinuje závažnosť MG a biologické vlastnosti tymómu. Pre priaznivú prognózu sú rozhodujúce včasné určenie diagnózy MGAT a adekvátna liečba MG a tymómu.Kľúčové slová:
myasténia gravis – tymóm – imunopatogenéza – diagnostika – liečba – prognózaÚvod
Myasténia gravis (MG) je imunopatologické a reakciou na rôzne terapeutické postupy heterogénne ochorenie. Myasténia gravis asociovaná s tymómom (MGAT) sa od ostatných foriem myasténie odlišuje kombinovaným uplatňovaním intratýmusových (týmus, tymóm) a extratýmusových autoimunitných mechanizmov v jej imunopatogenéze [1–3]. Má aj určité odlišnosti v klinickom obraze, priebehu a v responzivite na liečbu [1,4].
MGAT a MG asociovaná s hyperpláziou týmusu (Early Onset MG; EOMG) sú podmienené cirkulujúcimi protilátkami proti acetylcholínovým receptorom (AChR). Imunopatogenéza MGAT sa významne líši od imunopatogenézy EOMG [5]. V imunopatogenéze EOMG sa v rozhodujúcej miere uplatňujú intratýmusové autoimunitné mechanizmy [5]. V hyperplastickom týmuse pacientov s EOMG sú prítomné myoidné bunky nesúce antigénny terč – AChR. Profesionálne antigén-prezentujúce bunky (napr. dendritické bunky) vychytávajú fragmenty AChR uvoľnené myoidnými bunkami a prezentujú ich AChR-reaktívnym pomocným T-lymfocytom [5]. Následne sa spustí kaskáda pochodov, ktorej výsledkom je klonová proliferácia a maturácia AChR-reaktívnych B-lymfocytov v germinálnych centrách hyperplastického týmusu [5].
V imunopatogenéze MGAT sa uplatňujú aj intratýmusové mechanizmy, rozhodujúcu úlohu majú ale extratýmusové mechanizmy [1,2]. Tymómy sú nádory týmusu tvorené zo stromálnych epiteliálnych neoplastických buniek obklopených zrejúcimi T-lymfocytmi [1,6]. Epiteliálne bunky tymómov sú schopné exprimovať epitopy skrížene reagujúce s proteínmi svalových buniek, ako sú AChR, titín, ryanodínový receptor (RyR) [7,8]. Epiteliálne bunky v spolupráci s kostimulačnými molekulami prezentujú fragmenty AChR líniám nezrelých T-lymfocytov prítomných v tymóme, čo facilituje intratymickú imunizáciu [7]. Rozhodujúcim faktorom spôsobujúcim MGAT je schopnosť niektorých tymómov podporovať dozrievanie nezrelých autoreaktívnych CD4+ T-buniek a najmä exportovať zrelé naivné T-bunky do periférie [6]. Tieto potenciálne autoreaktívne T-bunky môžu postupne vytesniť normálne tolerantné T-lymfocyty. K iniciácii tvorby autoprotilátok proti AchR musia byť B-lymfocyty aktivované naivnými T-bunkami v miestach mimo tymóm. Tieto schopnosti majú len kortikálne tymómy, ktoré sa histologickou štruktúrou podobajú kôre týmusu (najmä tymómy typu AB a B) [1,6]. U tých tymómov, ktoré sú histologicky podobné dreni týmusu, sa vyskytuje MG len zriedka [6].
V našej práci prezentujeme longitudinálnu retrospektívnu štúdiu 123 pacientov s MGAT, ktorí sú evidovaní v registri slovenského Centra pre neuromuskulárne ochorenia, UN Bratislava-Ružinov od roku 1978 k 31. 12. 2015. Cieľom práce je analýza epidemiologických a klinických údajov, laboratórnych nálezov, terapeutických postupov a faktorov ovplyvňujúcich prognózu MGAT.
Materiál a metódy
V súbore 2 074 pacientov s MG registrovaných v našom Centre pre neuromuskulárne ochorenia sme hodnotili skupinu pacientov s MGAT. Pacienti s MG sú na našom pracovisku systematicky dispenzarizovaní s celoslovenskou pôsobnosťou od roku 1978. Osem pacientov s MGAT registrujeme zo skoršieho obdobia. Údaje o nich sme získali aktívnym vyhľadávaním pacientov s MG v archívoch neurologických a chirurgických kliník pred rokom 1978. Prvý zachytený pacient s MGAT v našom súbore je z roku 1971.
Metódou štúdia bol retrospektívny rozbor údajov a nálezov zdravotnej dokumentácie Centra pre neuromuskulárne ochorenia SR.
U všetkých pacientov bola MG stanovená na základe týchto diagnostických kritérií:
- Klinické kritériá (anamnéza, neurologické vyšetrenie, špecifické klinické testy na MG-Gorelickov príznak a Simpsonova skúška pri slabosti okohybných svalov, Seemanova skúška).
- Elektrofyziologické vyšetrenia (repetitívna stimulácia – signifikantný pokles amplitúdy a arey CMAP vo 4. odpovedi; SFEMG – predĺžený jitter, blokovanie; stapediová reflexometria – meranie akustickej impedancie blanky bubienka po kontrakcii m. stapedius vyvolanej reflexne akustickým podnetom nadprahovej intenzity [9]. Pri MG je patognomickým nálezom pokles intenzity reflexnej kontrakcie stapediového svalu [9]. Táto metodika sa však v praxi v diagnostike MG v posledných dvoch dekádach už nepoužíva.
- Pozitívny farmakologický reparačný test (hodnotenie a porovnanie klinického nálezu pred i.v. aplikáciou neostigminu a po nej).
- Vyšetrenie autoprotilátok proti AChR a MuSK.
- Potvrdený tymóm (histopatologická diagnóza; CT nález u pacientov, ktorí odmietli operáciu alebo bola operácia kontraindikovaná).
V súbore pacientov s MGAT sme zisťovali tieto údaje:
- rok vzniku prvých príznakov MG;
- pohlavie;
- vek pri vzniku ochorenia;
- charakter a lokalizáciu prvých príznakov;
- priebehové charakteristiky MG;
- výskyt asociovaných autoimunitných ochorení;
- štádium invazivity tymómu podľa Masaoku (tab. 1) [10];
- formy liečby MG (inhibítory acetylcholínesterázy, kortikoterapia, imunosupresívna liečba, plazmaferéza, intravenózny imunoglobulín);
- formy liečby tymómov (chirurgická liečba, rádioterapia, chemoterapia);
- klinický stav pacientov pri poslednej kontrole;
- výskyt myastenických kríz a exacerbácií MG;
- výskyt úmrtí, príčiny úmrtí.
Tab. 1. Klinicko-patologická klasifikácia štádií invazivity podľa Masaoku [10]. ![Klinicko-patologická klasifikácia štádií invazivity podľa Masaoku [10].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/b3fb350a2f50693b4ac4c2e1ff56c649.jpg)
Výsledky
V súbore 2 074 pacientov s potvrdenou MG sme zistili MGAT u 123 pacientov (5,9 %). MGAT sa v našom súbore častejšie vyskytuje u žien v pomere 1,7 : 1 (77 žien, 46 mužov). Zisťovali sme priemerný percentuálny podiel MGAT na všetkých prípadoch MG v troch časových obdobiach: 1978–1989 (7,4 %), 1990–1999 (5,5 %), 2000–2015 (5,7 %) (tab. 2). Najmladší pacient mal MGAT diagnostikovanú vo veku 18 rokov, najstarší vo veku 84 rokov. Priemerný vek pri vzniku ochorenia bol 50,7 roka (muži 52,4 roka; ženy 50,9 roka), medián 51 rokov (muži 52, ženy 49). Priemerná dĺžka sledovania pacientov s MGAT bola 9,6 rokov, medián 7,2 rokov.
Tab. 2. Percentuálny podiel pacientov s MGAT zo všetkých pacientov s MG za tri časové úseky. 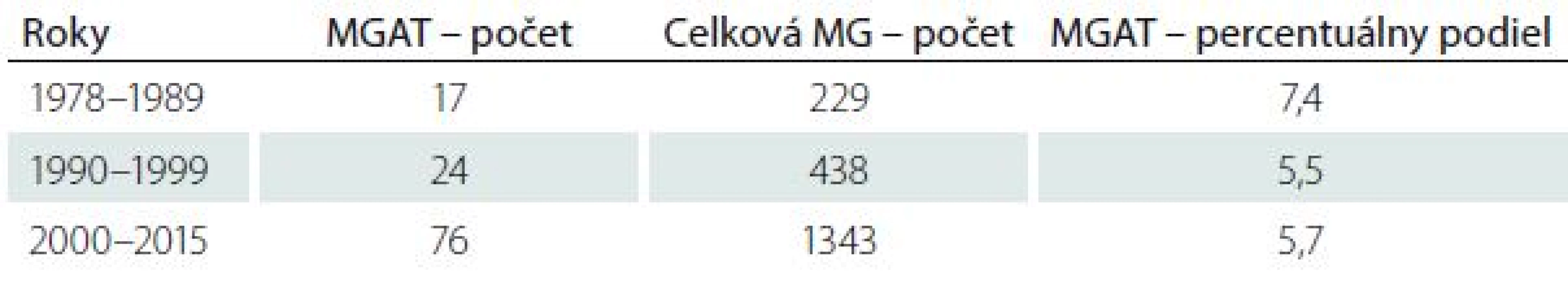
MG – myasténia gravis, MGAT – myasténia gravis asociovaná s tymómom. MGAT v našom súbore najčastejšie vznikla vo veku 40–70 rokov u 86 pacientov (69,9 %), s maximom v piatej dekáde u 32 pacientov. MGAT môže vzniknúť v akomkoľvek veku, veľmi vzácny je výskyt pred 20. rokom života a po 80. roku života. V týchto vekových obdobiach sme zaznamenali MGAT len u jedného pacienta (graf 1).
Graf 1. Zastúpenie pacientov s MGAT v Slovenskej republike podľa vekových kategórií a pohlavia. 
Prvá manifestácia MGAT je veľmi variabilná. MGAT sa iniciálne najčastejšie manifestuje generalizovanou myastenickou symptomatikou – 49 pacientov (39,8 %). Z nich bol u 23 pacientov vznik MG hyperakútny až fulminantný. Okulárne symptómy (ptóza mihalníc a/alebo diplopia) boli iniciálnym prejavom u 39 pacientov (31,7 %). U väčšiny pacientov s iniciálne okulárnymi príznakmi došlo neskôr ku generalizácii MG. Slabosť končatinového svalstva ako prvý príznak sa manifestovala u 17 pacientov (13,8 %). Bulbárnymi príznakmi sa MGAT v úvode manifestovala u 14 pacientov (11,4 %). Zriedkavým prvým príznakom MGAT bolo izolované postihnutie extenzorov šije u troch pacientov (2,4 %) a žuvacieho svalstva u jedného pacienta (0,8 %) (tab. 3).
Tab. 3. Iniciálne príznaky u pacientov s MGAT v Slovenskej republike. 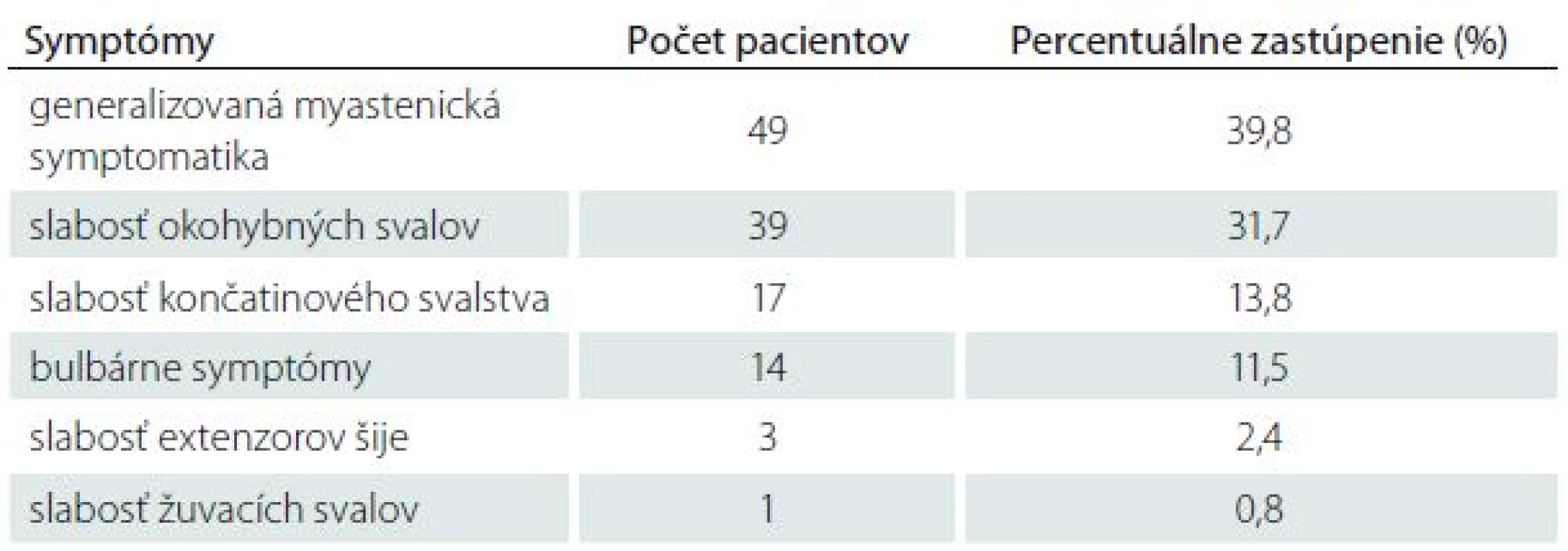
V čase určenia diagnózy MG dominovala generalizovaná forma s prevažujúcou bulbárnou symptomatikou, ktorá sa vyskytla u 99 pacientov (80,5 %). U 14 pacientov (11,4 %) sme zaznamenali generalizovanú formu s prevažujúcou končatinovou slabosťou.
U 10 pacientov (8,1 %) bol ako prvý diagnostikovaný tymóm, ktorý sa manifestoval lokálnymi príznakmi (kašeľ, bolesť na hrudi) alebo bol zistený náhodne pri RTG a CT vyšetrení hrudníka. U všetkých 10 pacientov bola realizovaná tymektómia. V rôznom časovom odstupe od operácie (jeden až šesť rokov) došlo k manifestácii MG.
Protilátky proti AChR sme vyšetrili u 101 pacientov, pozitívny titer sa zistil u 100 pacientov (99 %). U jedného pacienta s histologicky potvrdeným tymómom bol titer autoprotilátok proti AChR negatívny. Pozitívny titer anti-MuSK protilátok sme nezistili u žiadneho z 31 vyšetrených pacientov.
U 30 pacientov (24,4 %) s MGAT sme zaznamenali ďalšie asociované autoimunitné ochorenia. Autoimunitné ochorenie štítnej žľazy sme zaznamenali 23krát (M. Basedov alebo M. Hashimoto s eutyreózou alebo už rozvinutou hypotyreózou). Päťkrát sme zaznamenali asociáciu tymómu, MG, polymyozitídy. Dvaja z týchto pacientov mali aj myokarditídu. U troch pacientov sme zistili anémiu typu „pure red cell aplasia“. Zriedkavo sa vyskytli ďalšie diagnózy (reumatoidná artritída, psoriáza). Asociované autoimunitné ochorenia sa častejšie vyskytujú u žien – z celkového počtu 30 pacientov bolo 26 žien (86,7 %). Rozdiel je spôsobený častým výskytom autoimunitných ochorení štítnej žľazy u žien.
V úvode liečby sme pre závažnosť MG najčastejšie ordinovali u 94 pacientov (76,4 %) súčasne symptomatickú liečbu inhibítorom acetylcholínesterázy a kombinovanú imunosupresívnu liečbu prednizónom (≥ 1 mg/kg/deň) a azatioprínom (2–3 mg/kg/deň). U menej závažných foriem MG bol ordinovaný inhibítor acetylcholínesterázy a prednizón u 11 pacientov (8,9 %) alebo inhibítor acetylcholínesterázy a imunosupresívny preparát u deviatich pacientov (7,3 %). U deviatich pacientov (7,3 %) bol indikovaný len inhibítor acetylcholínesterázy. Išlo o pacientov zo 70. rokov minulého storočia, z obdobia pred érou imunosupresívnej liečby MG.
Samostatnú kapitolu liečby MG tvorí terapia akútnych stavov: akútne primomanifestácie MG, ťažké exacerbácie MG, myastenické krízy. U týchto pacientov bola indikovaná intenzívna kombinovaná imunosupresívna liečba (prednizón + azatioprín) a intervenčná imunoterapia – veľkoobjemové plazmaferézy (25 pacientov) alebo intravenózny imunoglobulín – IVIg (deväť pacientov).
Podozrenie na tymóm u našich pacientov s MGAT bolo vyslovené na základe zobrazovacích vyšetrení. V minulosti sa v diagnostike tymómov používalo pneumodiastinum. Od druhej polovice 80. rokov 20. storočia je metódou voľby CT mediastina s kontrastnou látkou. Na obr. 1 je CT nález opúzdreného tymómu, štádium I podľa Masaoku. Na obr. 2 je CT nález kombinovaného invazívneho tymómu štádium II podľa Masaoku. Tymóm bol kompletne excidovaný, následne bola ordinovaná rádioterapia.
Obr. 1. CT hrudníka s kontrastnou látkou – opúzdrený tymóm, štádium I podľa Masaoka. Tymóm bol chirurgicky kompletne excidovaný. Fig. 1. CT of the chest with a contrast medium – encapsulated thymoma, Masaoka stage I. Thymoma was completely surgically resected. 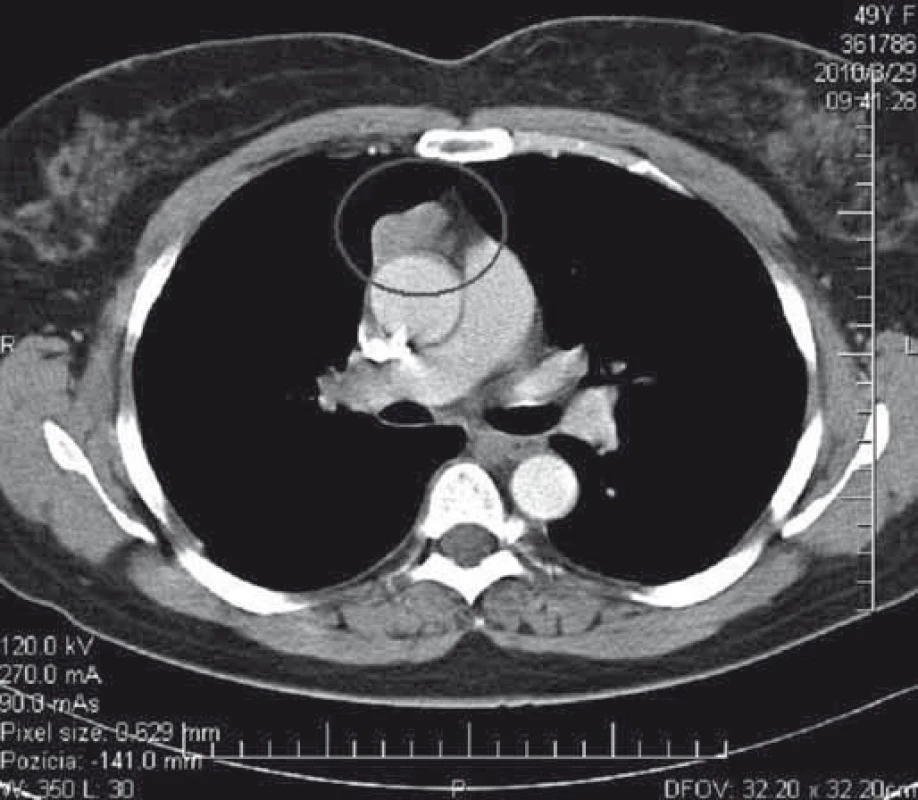
Obr. 2. CT hrudníka s kontrastnou látkou – kombinovaný invazívny tymóm, štádium II podľa Masaoka. Nádor bol kompletne excidovaný, následne bola ordinovaná rádioterapia. Fig. 2. CT of the chest with a contrast medium – combined invasive thymoma, Masaoka stage II. Complete tumour resection was followed by radiotherapy. 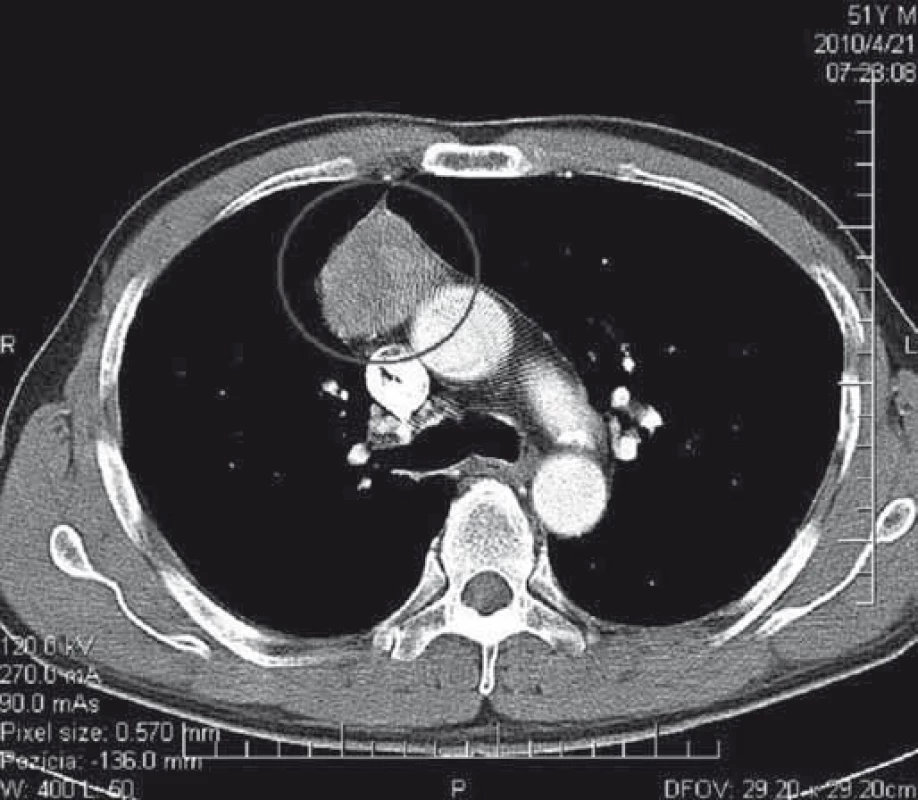
Diagnóza tymómu bola definitívne potvrdená histopatologickým vyšetrením. Podľa klinicko-patologickej klasifikácie štádií invazivity podľa Masaoku 92 pacienti (74,8 %) mali benígny tymóm (Masaoka I), 19 pacienti (15,4 %) mali tymóm s makroskopickou alebo mikroskopickou inváziou do kapsuly alebo mediastinálnej pleury (Masaoka II), u 12 pacientov (9,8 %) sme zistili malígny tymóm s inváziou do okolitých orgánov alebo s metastázami (Masaoka III + IV) (tab. 4). Vzhľadom na veľmi dlhé obdobie sledovania (1978–2015) nie je možné uviesť konkrétne histopatologické typy tymómov u našich pacientov, lebo v uvedenom období sa niekoľkokrát zásadne menila histopatologická klasifikácia tymómov.
Tab. 4. Zastúpenie tymómov podľa klinicko-patologickej klasifikácie podľa Masaoku u pacientov s MGAT v Slovenskej republike. 
Pri posudzovaní prognózy pacientov s MGAT sme hodnotili klinický stav pacientov pri poslednej kontrole, priebeh MG, výskyt exacerbácií MG, výskyt myastenických kríz a úmrtí v priamej súvislosti s MGAT. U 78 pacientov (63,3 %) sme dosiahli veľmi dobrý klinický stav: desať pacientov (8,1 %) dosiahlo klinickú remisiu (asymptomatickí pacienti bez liečby), 34 pacientov (27,6 %) dosiahlo farmakologickú remisiu (asymptomatickí pacienti na udržiavacej imunosupresívnej liečbe), u 34 pacientov (27,6 %) sme docielili výrazné zlepšenie (minimálne klinické príznaky neovplyvňujúce bežný život). U ďalšej skupiny pacientov bola účinnosť liečby menej výrazná. Klinické príznaky ovplyvňujúce bežný život pretrvávali v nezmenenej intenzite u 20 pacientov (16,3 %) alebo sa zlepšili len mierne u 21 pacientov (17,1 %). Štyria pacienti (3,3 %) zomreli v myastenickej kríze (tab. 5).
Tab. 5. Klinický stav pacientov s MGAT pri poslednej kontrole. 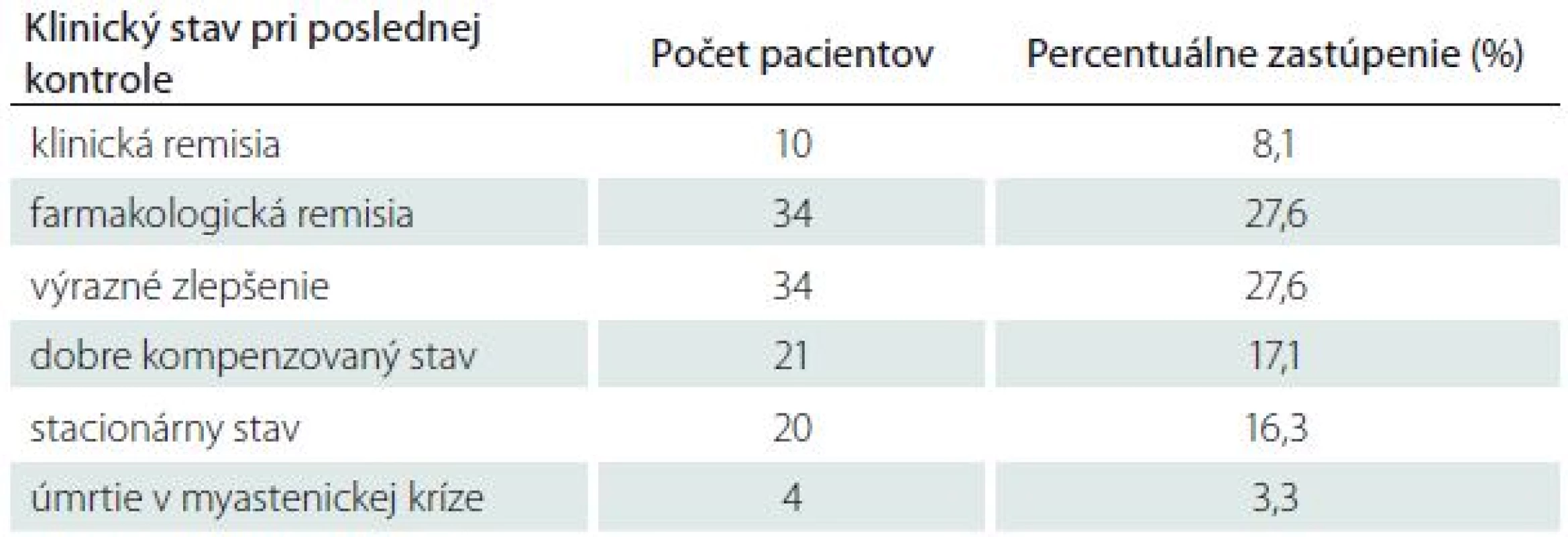
U pacientov s MGAT sme zaznamenali exacerbáciu MG u 57 pacientov (46,3 %), väčšinou v prvých troch rokoch od vzniku ochorenia. Zaznamenali sme skupinu pacientov, u ktorých sa exacerbácie MG vyskytli častejšie: dvakrát u 15 pacientov (12,2 %), trikrát u ôsmich pacientov (6,5 %), štyri a viac exacerbácií u dvoch pacientov (1,6 %). Ľahké exacerbácie boli zvládnuté zvýšením dávok inhibítoru acetylcholínesterázy (5,6 %). Väčšinu exacerbácií (58,5 %) sme zvládli zvýšením dávok imunosupresívnych preparátov a/alebo prednizónu. Pri ťažších exacerbáciách sme okrem zvýšenia dávok imunosupresívnej liečby ordinovali veľkoobjemové plazmaferézy (33,8 %). V troch prípadoch s hyperakútnou exacerbáciou MG bol pri súčasnej intenzívnej kombinovanej imunosupresívnej liečbe indikovaný IVIg.
Myastenické krízy alebo stavy hroziace myastenickou krízou sa vyskytli najmä v úvodných štádiách MG. Päťkrát sme zaznamenali hroziacu myastenickú krízu (dvakrát u jednej pacientky), 21krát rozvinutú myastenickú krízu s nutnosťou UPV (trikrát u jednej pacientky). Šesťkrát sa myastenická kríza vyskytla po tymektómii u pacientov zo 70. rokov 20. storočia. Išlo o obdobie pred érou imunosupresívnej liečby, kedy pacienti neboli na tymektómiu pripravovaní imunosupresívnou liečbou. V starších záznamoch zo 70. rokov sme u dvoch pacientok zistili údaje o striedajúcich sa myastenických a cholínergných krízach (tzv. brittle crisis). U šiestich pacientov s hroziacou alebo skutočnou myastenickou krízou sme v posledných desiatich rokoch indikovali kúry IVIg (0,4 g/kg/deň po dobu päť dní). V minulosti sme pri relatívnej nedostupnosti IVIg ordinovali opakované plazmaferézy. U všetkých pacientov bola súčasne ordinovaná intenzívna kombinovaná imunosupresívna liečba ako základ terapie MG. V posledných 15 rokoch (2000–2015) je výskyt myastenických kríz zriedkavý pre včasnú diagnostiku a efektívnu liečbu MG.
Tymektómiu podstúpilo 105 pacientov (85,4 %) z nášho súboru. V minulosti bola metódou voľby radikálna resekcia zo sternotómie, najčastejšie parciálnej. V poslednej dekáde sú u tymómov menších rozmerov a nižšieho stagingu (podľa CT) uprednostňované miniinvazívne techniky – najmä miniinvazívna maximálna tymektómia (MMIT). Na Klinike hrudníkovej chirurgie SZU a UN Bratislava bola MMIT realizovaná od roku 2008 u siedmich pacientov. U 18 pacientov sa z rôznych dôvodov tymektómia neuskutočnila (osemkrát kontraindikácie k výkonu v celkovej anestézii, osemkrát odmietnutie pacienta, dvakrát náhle úmrtie).
U malígnych tymómov je liečba multidisciplinárna. Liečbu malígnych tymómov riadil onkológ podľa stupňa malignity a invazivity tymómu. Rádioterapiu pre invazívny tymóm podstúpilo 31 pacientov (25,2 %), u desiatich pacientov (8,1 %) bola indikovaná rádioterapia aj chemoterapia z dôvodu invázie tymómu do okolitých orgánov alebo diseminácie nádoru.
Celková letalita (Case Fatality Rate; CFR) u pacientov s MGAT so všetkými príčinami úmrtia je 33,6 % (41 pacientov). Letalita v priamej súvislosti s MG je 3,3 %. Išlo o štyroch pacientov, ktorí zomreli v myastenickej kríze. Letalita v priamej súvislosti s malígnym tymómom je 4,9 %. Išlo o šesť pacientov, ktorí zomreli na disemináciu malígneho tymómu, štyria z nich mali MG v remisii. U ostatných 31 pacientov boli príčinou úmrtia rôzne závažné ochorenia (infarkt myokardu, srdcové zlyhanie, malígne nádorové ochorenia, embolizácia do a. pulmonalis, náhle cievne mozgové príhody). Od roku 1996 sme MG ako primárnu príčinu úmrtia nezaznamenali ani u jedného pacienta.
Diskusia
V rôznych štúdiách pomerný výskyt MGAT na celkovom počte pacientov s MG závisí najmä od faktu, či prácu publikovali neurológovia alebo chirurgovia. Výskyt MGAT v jednotlivých prácach je veľmi rozdielny (4,9–36 %) [11]. Tieto rozdiely sú dané charakteristikami jednotlivých súborov [12–19]. Vysoký výskyt MGAT je v súboroch z chirurgických pracovísk, kde pacienti s MGAT tvoria veľkú časť pacientov s MG, pretože asociácia s tymómom je u pacientov s MG najvýznamnejšou chirurgickou indikáciou k tymektómii [12,13,15,17,18].
V našom súbore 2 074 evidovaných pa - cientov s MG (1978–2015) sme zistili MGAT u 123 pacientov (5,9 %). Proporcia zastúpenia pacientov s MGAT bola v celom sledovanom období relatívne konštantná. V rokoch 1978–1989 bol výskyt mierne vyšší (7,4 %), v rokoch 1990–1999 a 2000–2015 sa pohyboval na úrovni 5,5, resp. 5,7 % (tab. 2). Najvyšší výskyt MG od roku 1978 sme zaznamenali v roku 2015 – 124 pacientov. Z nich sme MGAT diagnostikovali u šiestich pacientov (4,9 %).
MGAT sa podľa literárnych údajov vyskytuje rovnako často u oboch pohlaví [11]. V našom súbore prevažuje výskyt MGAT u žien: 77 žien, 46 mužov (1,7 : 1). Rozdielne zastúpenie výskytu MGAT u mužov a žien v našom súbore nedokážeme plauzibilne interpretovať.
Podľa literárnych údajov sa MGAT najčastejšie vyskytuje po 40. roku života [11]. Výsledky z nášho registra tieto pozorovania podporujú. Do veku 40 rokov sa MGAT v našom súbore manifestovala len u 22 pacientov (17,9 %). Medzi 40. a 70. rokom života sme zaznamenali maximum výskytu MGAT – vznikla u 86 pacientov (59,9 %). Po 70. roku života je výskyt MGAT menej častý, v našom súbore sme ju diagnostikovali u 14 pacientov (11,4 %).
Klinicky sa MGAT v SR manifestuje najčastejšie generalizovanými myastenickými príznakmi u 49 pacientov (39,8 %), čo je v súlade s literárnymi údajmi [20,21]. Okulárnou symptomatikou sa MGAT iniciálne manifestovala u 39 pacientov (31,7 %). V ďalšom priebehu sa u 28 pacientov pridružili iné myastenické príznaky. Lokalizovanú okulárnu formu MGAT sme zaznamenali u 11 pacientov (8,9 %), čo koreluje s literárnymi údajmi [22,23]. U každého pacienta s potvrdenou MG, vrátane okulárnej formy, je nutné realizovať CT mediastina s kontrastnou látkou na vylúčenie tymómu.
Asociácia MGAT s inými autoimunitnými ochoreniami je častá. U žien sa často vyskytuje kombinácia s autoimunitnými ochoreniami štítnej žľazy. Charakteristická, i keď zriedkavá, je asociácia tymómu, MG a polymyozitídy. U našich pacientov s MGAT sme túto kombináciu ochorení zaznamenali päťkrát. Dvaja z týchto pacientov mali pridruženú aj myokarditídu [24]. MGAT býva asociovaná aj s hematologickými ochoreniami – najčastejšie s anémiou typu „pure red cell aplasia“ [25].
Metódy diagnostiky MG v rámci MGAT sa nelíšia od diagnostiky ostatných foriem MG: detailná anamnéza, objektívne neurologické a myologické vyšetrenie vrátane špecifických testov na MG, reparačný farmakologický test, elektrofyziologické vyšetrenia (repetitívna stimulácia, SFEMG), stanovenie titra autoprotilátok proti AChR a MuSK v sére [20,21,26,27]. V diagnostike tymómu je metódou voľby CT mediastina s kontrastnou látkou [28]. MR hrudníka je tiež vysoko senzitívnou metódou, zatiaľ sa využíva najmä v špecifických prípadoch: alergia na jódovú kontrastnú látku, tyreotoxikóza, nejasný nález na CT neumožňujúci odlíšiť hyperpláziu týmusu od tymómu [28]. Vzhľadom na slabšiu dostupnosť a dlhšie čakacie lehoty sa MR hrudníka využíva v SR pri diagnostike tymómu len výnimočne.
U pacientov s MGAT sa zisťujú viaceré druhy cirkulujúcich protilátok s rôznym imunopatogenetickým významom: autoprotilátky proti AChR, proti titínu a ryanodínovému receptoru [7]. Epiteliálne bunky tymómov sú schopné exprimovať epitopy skrížene reagujúce s vyššie uvedenými proteínmi svalových buniek [7,8]. V spolupráci s kostimulačnými molekulami prezentujú epiteliálne bunky fragmenty týchto proteínov líniám nezrelých T-lymfocytov prítomných v tymóme, čo facilituje intratymickú imunizáciu [7]. Imunopatogeneticky najvýznamnejšie sú protilátky proti AChR. Podľa početných štúdií sa vyskytujú u 99–100 % pacientov s MGAT [1,2,6–8]. V literatúre bolo popísaných len niekoľko prípadov AChR séronegatívnej MGAT [29]. V našom súbore sme zaznamenali len jedného pacienta so séronegatívnou MGAT. Anti-MuSK protilátky sa pri MGAT nevyskytujú.
Liečbu MGAT možno rozdeliť na liečbu samotnej MG a liečbu tymómu. V rámci liečby MGAT je indikovaná ako metóda prvej voľby kombinovaná imunosupresívna liečba, vrátane okulárnych foriem, pre vysoké riziko progresie a generalizácie myasténie [20,21]. Pri hyperakútnych primomanifestáciách MG je obvykle potrebné kombinovať intenzívnu imunosupresívnu liečbu s jednou z foriem intervenčnej imunoterapie (plazmaferéza, IVIg) [20,21]. Pri akútnych exacerbáciách pristupujeme k zvýšeniu dávok imunosupresív a inhibítora acetylcholínesterázy. Pri ťažších exacerbáciách MGAT indikujeme aj veľkoobjemové plazmaferézy [20,21]. V prípade hroziacich a rozvinutých myastenických kríz je metódou voľby IVIg v dávkovaní 0,4 g/kg/deň po dobu päť dní [1,20,21]. Chirurgické odstránenie tymómu je indikované až vtedy, keď sa imunosupresívnou liečbou, prípadne ďalšou imunoterapiou (plazmaferézy, IVIg), docieli adekvátne zlepšenie MG [30,31]. Cieľom je farmakologická remisia alebo výrazné zlepšenie klinického stavu. V 70. rokoch 20. storočia, pred érou imunosupresívnej liečby, pacienti dostávali predoperačne len inhibítor acetylcholínesterázy. Z tohto obdobia sme u šiestich našich pacientov zaznamenali vznik posttymektomických myastenických kríz. Z prognostického hľadiska je tiež dôležité, aby časový interval medzi vznikom MGAT, ordináciou imunosupresívnej liečby a tymektómiou nebol zbytočne dlhý [32].
V niektorých prípadoch býva diagnostikovaný ako prvý tymóm, bez známok MG, ktorá sa manifestuje až po určitom časovom odstupe od tymektómie [33,34]. Príčinou tohto javu je skutočnosť, že sa na imunopatogenéze MGAT okrem týmusových autoimunitných mechanizmov zúčastňujú v rozhodujúcej miere extratýmusové autoimunitné mechanizmy [1,2]. V našom súbore sme zaznamenali 10 pacientov so vznikom MGAT až po určitom časovom odstupe od tymektómie indikovanej pre tymóm.
Pri liečbe tymómu je metódou voľby tymektómia [30,35,36]. Cieľom chirurgickej liečby je dosiahnuť čo možno najväčšiu extenzivitu výkonu pri čo možno najmenšej invazivite a riziku komplikácií. Tradičným a stále najčastejšie používaným prístupom k tymómom je sternotómia [36–38]. Podľa veľkosti nádoru možno zvoliť parciálnu alebo totálnu sternotómiu [36–38]. U väčšiny nádorov postačuje parciálna sternotómia, ktorá je spojená s menšou bolestivosťou a nižším percentom komplikácií [37,38]. Chirurgický postup spočíva v odstránení nielen tymómu, ale aj celého týmusu a relevantného mediastinálneho tukovo-lymfatického tkaniva [37,38]. V poslednom období sa dostávajú do popredia miniinvazívne metódy tymektómie pri non-tymomatóznej aj tymomatóznej MG [39]. Väčšina z množstva miniinvazívnych prístupov k tymektómii (transcervikálne, infrasternálne, jednostranné či obojstranné torakoskopické vrátane robotických) má svoje obmedzenia a napriek proklamovaným výsledkom treba k nim najmä z hľadiska extenzivity pristupovať s určitou rezervovanosťou [39]. Najsľubnejšou z miniinvazívnych techník je Zielińskeho miniinvazívna tymektómia (maximálna miniinvazívna tymektómia; MMIT), ktorá využíva kombinovaný torakoskopický, transcervikálny a subxifoidálny prístup s dvojitou trakciou sterna, čím umožňuje dodržanie princípu maximálnej extenzivity tymektómie [40,41]. Obmedzenie pre MMIT predstavuje tymóm väčších rozmerov (viac ako 6 cm) a pokročilejší staging tymómu [39–41]. Túto operačnú techniku používajú naši spolupracovníci na Klinike hrudnej chirurgie SZU a UN Bratislava [41].
U tymómov s vyšším stagingom riadi liečbu onkológ. U malígnych tymómov je indikovaná rádioterapia, pri diseminácii a metastázach aj chemoterapia.
Prognóza u väčšiny našich pacientov s MGAT je priaznivá. Prognózu najviac determinujú závažnosť MG, včasné určenie diagnózy MG, včasná ordinácia adekvátnej imunoterapie, biologické vlastnosti tymómu a komorbidita. U 78 pacientov (63,4 %) sme imunoterapiou a chirurgickou liečbou dosiahli remisiu alebo výrazné zlepšenie MGAT. Ťažkosti spôsobujú dve skupiny pacientov s MGAT. Prvú skupinu tvoria pacienti s vysoko malígnym tymómom. Šiesti z nich zomreli na disemináciu tymómu, pričom štyria z nich mali MG v remisii. Druhú skupinu tvoria pacienti s opakovanými exacerbáciami MG, ktoré sú v posledných rokoch zvládnuteľné ordináciou intervenčnej imunoterapie (plazmaferéza, IVIg) a kombinovanej imunosupresie. Dovoľujeme si zdôrazniť, že za posledných 20 rokov v SR žiadny pacient s MGAT nezomrel v priamej príčinnej súvislosti na MG.
Záver
Počas sledovaného obdobia (1978–2015) sme MGAT diagnostikovali u 123 (5,9 %) z celkového počtu 2 074 pacientov s MG. Prekvapujúco sme zaznamenali vyšší výskyt MGAT u žien v pomere 1,7 : 1 (77 žien, 46 mužov). Najčastejším iniciálnym prejavom MGAT je generalizovaná myastenická symptomatika u 49 pacientov (39,8 %). Okulárna symptomatika bola prvým príznakom MGAT u 39 pacientov (31,7 %), u väčšiny z nich došlo neskôr ku generalizácii MG. Preto je u každého pacienta s MG, vrátane okulárnych foriem, nutné realizovať CT mediastina s kontrastnou látkou, prípadne MR hrudníka. U 10 pacientov (8,1 %) bol ako prvý diagnostikovaný tymóm. U týchto pacientov vznikli príznaky MG v rôznom časovom odstupe po tymektómii, čo svedčí pre rozhodujúci význam extratýmusových mechanizmov v imunopatogenéze MGAT. Preto je potrebné pacientov s tymómom dispenzarizovať na pracovisku hrudnej chirurgie a pamätať na možnosť vzniku MGAT aj po rokoch po odstránení tymómu. MGAT je v takmer 100 % AChR séropozitívna forma. Negatívny titer autoprotilátok proti AChR sme zaznamenali len u jedného pacienta. Protilátky proti MuSK sa pri MGAT nevyskytujú. Vzhľadom na závažnosť MG je v úvode liečby MGAT indikovaná kombinovaná imunosupresívna liečba prednizónom (≥ 1 mg/kg/deň) a azatioprínom (2–3 mg/kg/deň) a symptomatická liečba inhibitorom acetylcholínesterázy. Pri hyperakútnych primomanifestáciách MG, ťažších exacerbáciách MG, hroziacich a rozvinutých myastenických krízach ordinujeme okrem intenzívnej kombinovanej imunosupresívnej liečby aj intervenčnú imunoterapiu (plazmaferéza, IVIg). Pri hroziacich a rozvinutých myastenických krízach preferujeme s výbornými výsledkami IVIg. U všetkých tymómov bez ohľadu na staging je indikovaná tymektómia. Ak sa jedná o malígny tymóm, ďalšiu liečbu (rádioterapia, chemoterapia) riadi onkológ podľa stupňa malignity a invazivity tymómu. Prognóza u väčšiny našich pacientov s MGAT je priaznivá. Prognózu najviac determinujú závažnosť MG, včasné určenie diagnózy MG, včasná ordinácia adekvátnej liečby, biologické vlastnosti tymómu a komorbidita.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. Peter Špalek, PhD.
Centrum pre neuromuskulárne ochorenia
Neurologická klinika
SZU a UN Bratislava
Ružinovská 6
826 06 Bratislava
e-mail: peter.spalek@seznam.cz
Prijato k recenzii: 21. 3. 2016
Prijato do tlače: 2. 5. 2016
Zdroje
1. Špalek P, Schnorrer M, Krajč T. Imunopatogenéza paraneoplastickej myasténie gravis asociovanej s tymómom. Neurológia 2010; 5 (1): 7–11.
2. Evoli A, Minisci C, Di Schino C, et al. Thymoma in patients with MG: characteristics and long-term outcome. Neurology 2002; 59 (12): 1844–50.
3. Marx A, Pfister F, Schalke B, et al. The different roles of the thymus in the pathogenesis of the various myasthenia gravis subtypes. Autoimmunity Reviews 2013; 12 (9): 875–84. doi: 10.1016/j.autrev.2013.03.007.
4. Špalek P. Tymómy a paraneoplastická imunita. Cesk Slov Neur N 2002; 65/98 (3): 367–73.
5. McCombe P, Meenakshi R, Henderson R, et al. A case series of patients with autoimmune myasthenia gravis in association with invasive thymoma. J Clin Neuromusc Dis 2016; 17 (3): 129–34. doi: 10.1097/CND.0000000000000 101.
6. Hohlfeld R, Wekerle H, Marx A. Immunopthogenesis of myasthenia gravis. In: Engel AG. Myasthenia gravis and other myasthenic disorders. Ney York. Oxford University Press 2012 : 70–4.
7. Romi F. Thymoma in myasthenia gravis: from diagnosis to treatment. Autoimmune Dis 2011; 2011 : 474512. doi: 10.4061/2011/474512.
8. Marx A, Kirchner T, Hoppe F. Proteins with epitopes of the acetylcholine receptor in epithelial cell cultures of thymomas in myasthenia gravis. Am J Pathol 1989; 134 (4): 865–77.
9. Romi F, Bo L, Skeie GO, et al. Titin and ryanodine receptor epitopes are expressed in cortical thymoma along with costimulatory molecules. J Neuroimmunol 2002; 128 (1–2): 82–9.
10. Špalek P. Myasthenia gravis – register a epidemiológia na Slovensku. Diagnostický význam stapediovej reflexometrie. Analýza účinnosti imunologických foriem liečby. Kandidátska dizertačná práca. Bratislava: LF Univerzity Komenského 1983.
11. Masaoka A, Yamakawa Y, Niwa H, et al. Extended thymectomy for myasthenia gravis patients: a 20-year review. Ann Thorac Surg 1996; 62 (3): 853–9.
12. Mao ZF, Mo XA, Qin C, et al. Incidence of thymoma in myasthenia gravis: a systematic review. J Clin Neurol 2012; 8 (3): 161–9. doi: 10.3988/jcn.2012.8.3.161.
13. Papatestas AE, Genkins G, Kornfeld P, et al. Effects of thymectomy in myasthenia gravis. Ann Surg 1987; 206 (1): 79–88.
14. Maggi G, Casadio C, Cavallo A, et al. Thymectomy in myasthenia gravis. Results of 662 cases operated upon in 15 years. Eur J Cardiothorac Surg 1989; 3 (6): 504–9.
15. Oosterhuis HJ. The natural course of myasthenia gravis: a long term follow up study. J Neurol Neurosurg Psychiatry 1989; 52 (10): 1121–7.
16. Budde JM, Morris CD, Gal AA, et al. Predictors of outcome in thymectomy for myasthenia gravis. Ann Thorac Surg 2001; 72 (1): 197–202.
17. de Perrot M, Liu J, Bril V, et al. Prognostic significance of thymomas in patients with myasthenia gravis. Ann Thorac Surg 2002; 74 (5): 1658–62.
18. Yasukawa Y, Yoshikawa H, Iwasa K, et al. Comparative study of pre-operative thymic imaging and pathology in patients with myasthenia gravis. J Clin Neurosci 2004; 11 (6): 610–3.
19. Kim HK, Park MS, Choi YS, et al. Neurologic outcomes of thymectomy in myasthenia gravis: comparative analysis of the effect of thymoma. J Thorac Cardiovasc Surg 2007; 34 (3): 601–7.
20. Tsinzerling N, Lefvert AK, Matell G, et al. Myasthenia gravis: a long term follow-up study of Swedish patients with specific reference to thymic histology. J Neurol Neurosurg Psychiatry 2007; 78 (10): 1109–12.
21. Špalek P, Schnorrer M, Krajč T. Diagnostika a liečba paraneoplastickej myasténie gravis asociovanej s tymómom. Neurológia 2010; 5 (2): 79–85.
22. Murai H, Masuda M, Utsugisawa K, et al. Clinical features and treatment status of adult myasthenia gravis in Japan. Clin Exper Neuroimm 2014; 5 : 84–9.
23. Romi F, Gilhus NE, Varhaug JE, et al. Disease severity and outcome in thymoma myasthenia gravis: a long term observation study. Eur J Neurol 2003; 10 (6): 701–6.
24. Kondo Y, Monden Y. Thymoma and myasthenia gravis: a clinical study of 1089 patients from Japan. Ann Thorac Surg 2005; 79 (1): 535–40.
25. Špalek P, Schnorrer M, Cibulčík F. Kombinovaný výskyt akútnej myasténie gravis a akútnej polymyozitídy u troch pacientov, u dvoch v asociácii s tymómom. Rozhl Chir 2000; 79 : 468–70.
26. Špalek P. Thymomy, myasthenia gravis a autoimunitní onemocnění – pohled klinika. In: Piťha J, ed. Myasthenia gravis a ostatní poruchy nervosvalového přenosu. Praha, Maxdorf Jesenius 2010 : 236–54.
27. Witoonpanich R, Dejthevaporn C, Sriphrapradang A, et al. Electrophysiological and immunological study in myasthenia gravis: diagnostic sensitivity and correlation. Clin Neurophysiol 2011; 122 (9): 1873–7. doi: 10.1016/j.clinph.2011.02.026.
28. Zisimopoulou P, Brenner T, Trakas N, et al. Serological diagnostics in myasthenia gravis based on novel assays and recently identified antigens. Autoimmun Rev 2013; 12 (9): 924–30. doi: 10.1016/j.autrev.2013.03. 002.
29. Priola AM, Priola SM. Imaging of thymus in myasthenia gravis: From thymic hyperplasia to thymic tumor. Clin Radiol 2014; 69 (5): e230–45. doi: 10.1016/j.crad.2014.01.005.
30. Rigamonti A, Lauria G, Piamarta F, et al. Thymoma - -associated myasthenia gravis without acetylcholine receptor antibodies. J Neurol Sci 2011; 302 (1–2): 112–3. doi: 10.1016/j.jns.2010.12.013.
31. Schnorrer M jr, Spalek P, Belacek J, et al. Thymom und Myasthenia gravis. Viszeralchirurgie 1998; 33 : 171–4.
32. Piťha J. Myasthenia gravis. Med Praxi 2015; 12 (3): 121–5.
33. Schnorrer M jr, Hraška V, Špalek P, et al. Stanovenie významu prognostických faktorov pri chirurgickej liečbe myasténie gravis. Rozhl Chir 1999; 78 : 223–7.
34. Špalek P. Vznik myasthenie gravis po tymektómii pre tymóm. Rozhl Chir 1995; 74 : 100–2.
35. Piťha J, Schutzner J, Šmat V. Manifestace myasthenia gravis po exstirpaci thymomu thotakotomií. Rozhl Chir 1998; 77 (6): 241–4.
36. Lindenmann J, Fink-Neuboeck N, Pichler M, et al. Stage-based treatment for thymoma in due to consideration of thymectomy: a single-center experience and comparison with the literature. World J Surg Oncol 2015; 303 (13): 1186. doi: 10.1186/s12957-015-0718-z.
37. Schutzner J. Surgical therapy of thymomas. Sborn Lék 1999; 100 (1): 27–31.
38. Schutzner J. Tvrdoň J. Chirurgická léčba tymomu. In: Schutzner J, Šmat V, eds. Myasthenia gravis. Komplexní pojetí a chirurgická léčba. Praha: Galén 2005 : 63–71.
39. Schnorrer M jr, Špalek P, Hraška V, et al. Parciálna mediálna sternotómia v chirurgickej liečbe myasthenia gravis. Lek Obz 1998; 47 (11–12): 311–3.
40. Krajč T, Špalek P, Lučenič M, et al. Tymómy a ich miniinvazívna chirurgická liečba. Onkológia 2011; 6 (6): 339–43.
41. Zielinski M, Kuzdzal J, Szlubowski A, et al. Transcervical-subxiphoid-videothoracoscopic „maximal“ thymectomy – operative technique and early results. Ann Thorac Surg 2004; 78 (2): 404–9.
42. Krajč T, Špalek P, Janík M, et al. Transcervikálna – subxifoidálna – bilaterálna VATS „maximálna“ tymektómia pre myasténiu alebo tymóm – iniciálne skúsenosti. Neurológia 2011; 6 (1): 24–30.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článek Rasmussenova encefalitídaČlánek Detekce pravolevých zkratů u mladých pacientů po ischemické cévní mozkové příhodě – pilotní studieČlánek Komentář k článku Vaško et alNeurofyziologická vyšetření u traumatických lézí brachiálního plexuČlánek Webové okénko
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2016 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Rasmussenova encefalitída
- Jsou nemotorické projevy Parkinsonovy nemoci indikací k léčbě pomocí hluboké mozkové stimulace subthalamických jader?
- Jsou nemotorické projevy Parkinsonovy nemoci indikací k léčbě pomocí hluboké mozkové stimulace subthalamických jader?
-
Komentář ke kontroverzím
Hluboká mozková stimulace u Parkinsonovy nemoci – revize indikačních kritérií? - Léky navozená spánková endoskopie – cesta k lepším chirurgickým výsledkům při léčbě syndromu obstrukční spánkové apnoe
- Současná kortikoterapie u nádorů mozku
- Individualizovaný přístup k léčbě roztroušené sklerózy
- Aktuální pohled na management nízkostupňových gliových nádorů centrálního nervového systému
- Detekce pravolevých zkratů u mladých pacientů po ischemické cévní mozkové příhodě – pilotní studie
- Myxovirus resistance protein A v terapii interferony-β u pacientů s roztroušenou sklerózou a algoritmus sledování účinnosti léčby
- Myasténia gravis asociovaná s tymómom – súbor pacientov v Slovenskej republike (1978–2015)
- Bezpečnost karotického stentingu – srovnání protekčních systémů
-
Komentář k článku Pavlík et al
Bezpečnost karotického stentingu – srovnání protekčních systémů - Průkaz boreliové DNA u pacientů s neuroboreliózou
- Vztah likvorových hladin IL-6 ke změnám parciálního tlaku kyslíku v mozku a k rozvoji vazospazmů u pacientů po subarachnoidálním krvácení z ruptury aneuryzmatu mozkové tepny
- Stereotaktické biopsie mozkových patologií systémem Varioguide – zkušenosti ze 101 výkonů
- Myasthenia Gravis Composite – validace české verze
- Pilotní studie využití tenzometrické plošiny v domácí terapii poruch rovnováhy
- Neurofyziologická vyšetření u traumatických lézí brachiálního plexu
-
Komentář k článku Vaško et al
Neurofyziologická vyšetření u traumatických lézí brachiálního plexu - Paroxyzmálna kinezigénna dystónia ako primomanifestácia roztrúsenej sklerózy – kazuistika
- Idiopatická hypertrofická kraniální pachymeningitida – dvě kazuistiky
- Metodika stanovení smrti mozku pomocí transkraniální sonografie vypracovaná Neurosonologickou komisí a Cerebrovaskulární sekcí České neurologické společnosti ČLS JEP
- Webové okénko
-
Analýza dat v neurologii
LIX. Koncept atributivního rizika v analýze populačních studií – VI. Kauzalita vztahů
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Současná kortikoterapie u nádorů mozku
- Rasmussenova encefalitída
- Neurofyziologická vyšetření u traumatických lézí brachiálního plexu
- Průkaz boreliové DNA u pacientů s neuroboreliózou
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



