Úloha pohybovej aktivity v liečbe pacientov s Parkinsonovou chorobou
The role of physical activity in the management of patients with Parkinson‘s disease
Parkinson‘s disease (PD) is the second most prevalent neurodegenerative disease. It is characterized by the progressive deterioration of motor as well as non-motor symptoms, including cognitive dysfunction, disorders of mood and sleep and gastrointenstinal symptoms. Physical activity is a modifiable well-established risk factor for PD and clinical intervention studies with regular exercise undoubtedly point to the beneficial effects of aerobic as well as strength exercise training in patients with PD. Physical training improves 1. motor state, balance and functional capacity of skeletal muscles, thus reducing the risk of falls; 2. physical fitness and general functional capacity of the patient; and 3. energy metabolism, reducing the risk of type 2 diabetes, which often accelerates progression of PD. Moreover, physical activity and physical training improve quality of life by ameliorating both motor and non-motor symptoms, thus slowing down disease progression. Regular physical activity and exercise, based on individualized prescription and performed under the supervision of an experienced physician or exercise physiologist, are recommended as an integral part in the management of a patient with PD.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
M. Schön1,2, I. Straka3, M. Sedliak4, J. Ukropec1, P. Valkovič3,5, B. Ukropcová1,2,4
1 Biomedicínske centrum, Slovenská akadémia vied, Bratislava, Slovensko
2 Ústav patologickej fyziológie, LF UK v Bratislave, Slovensko
3 II. neurologická klinika LF UK a UNB, Bratislava, Slovensko
4 Katedra športovej kinantropológie, Fakulta telesnej výchovy a športu UK v Bratislave, Slovensko
5 Ústav normálnej a patologickej fyziológie, Centrum experimentálnej medicíny, Slovenská akadémia vied, Bratislava, Slovensko
doc. MUDr. Barbara Ukropcová, Ph.D.
Biomedicínske centrum Ústav experimentálnej endokrinológie
Slovenská akadémia vied
Dúbravská cesta 9
845 05 Bratislava
Slovensko
e-mail: barbara.ukropcova@savba.sk
Přijato k recenzi: 4. 3. 2019
Přijato do tisku: 2. 9. 2019
Keywords:
Parkinson’s disease – exercise – Physical activity
Autori:
M. Schön 1,2; I. Straka 3; M. Sedliak 4; J. Ukropec 1; P. Valkovič 3,5; B. Ukropcová 1,2,4
Pôsobisko autorov:
Biomedicínske centrum, Slovenská, akadémia vied, Bratislava, Slovensko
1; Ústav patologickej fyziológie, LF UK, v Bratislave, Slovensko
2; II. neurologická klinika LF UK a UNB, Bratislava, Slovensko
3; Katedra športovej kinantropológie, Fakulta telesnej výchovy a športu UK, v Bratislave, Slovensko
4; Ústav normálnej a patologickej, fyziológie, Centrum experimentálnej, medicíny, Slovenská akadémia vied, Bratislava, Slovensko
5
Vyšlo v časopise:
Cesk Slov Neurol N 2019; 82(5): 496-504
Kategória:
Přehledný referát
doi:
https://doi.org/10.14735/amcsnn2019496
Súhrn
Parkinsonova choroba (PCh) je druhé najčastejšie neurodegeneratívne ochorenie charakterizované progresívne sa zhoršujúcimi motorickými ako aj nemotorickými príznakmi, ku ktorým patria pokles kognitívnych schopností, poruchy nálady a spánku či gastrointestinálne prejavy. Fyzická inaktivita predstavuje modifikovateľný rizikový faktor vzniku PCh a klinické intervenčné štúdie jednoznačne poukazujú na benefičné účinky vytrvalostného aj silového tréningu u pacientov s PCh. Fyzický tréning 1. prispieva k zlepšeniu motorických funkcií, rovnováhy a funkčnej kapacity kostrového svalstva, čím sa redukuje riziko pádov; 2. zvyšuje fyzickú zdatnosť a celkovú funkčnú kapacitu pacienta; 3. upravuje energetický metabolizmus, a znižuje tak riziko vzniku diabetu 2. typu, ktorý významne prispieva k progresii PCh. V neposlednom rade pravidelná dostatočne intenzívna pohybová aktivita zvyšuje kvalitu života prostredníctvom zlepšovania motorických aj nemotorických prejavov ochorenia a celkovo môže prispievať k spomaleniu jeho progresie. Pravidelná fyzická aktivita a cvičenie, optimálne na podklade individualizovanej preskripcie a pod dohľadom skúseného lekára alebo fyzioterapeuta, sú jednoznačne odporúčanou súčasťou komplexného manažmentu pacienta s Pch.
Klíčová slova:
Parkinsonova choroba – cvičenie – fyzická aktivita
Úvod
Parkinsonova choroba (PCh) je druhé najčastejšie neurodegeneratívne ochorenie, ktoré je charakteristické svojimi motorickými a nemotorickými príznakmi. K patogenéze a progresii ochorenia môže prispievať aj sedavý životný štýl, nadhmotnosť a obezita a s nimi asociované poruchy metabolizmu (prediabetes, diabetes 2. typu), ktorých výskyt je u pacientov s PCh podľa niektorých zdrojov zreteľne vyšší [1]. Fyzická aktivita predstavuje modifikovateľný faktor životného štýlu so značným potenciálom pozitívne ovplyvniť celkový klinický stav, motorické a kognitívne funkcie, metabolizmus ako aj kvalitu života a prognózu pacientov s PCh [2].
Prítomnosť motorických príznakov PCh ako rigidita, tremor, bradykinéza a posturálna instabilita môže významne obmedzovať pohybovú aktivitu, a byť tak jednou z príčin sedavého životného štýlu u pacientov s PCh. Súčasne však sedavý životný štýl prispieva k zhoršovaniu nielen motorických príznakov, ale aj kognitívnych funkcií a metabolizmu glukózy (zvýšenie rizika vzniku prediabetu/ diabetu 2. typu) a akceleruje progresiu ochorenia [3]. Navyše nedostatok pohybovej aktivity a nízka fyzická zdatnosť zvyšujú aj riziko vzniku kardiovaskulárnych ochorení [4] a poškodenie funkcie bazálnych ganglií, ktorého dôsledkom je neadekvátna stimulácia motorických centier v mozgovej kôre, vznik svalovej hypertónie a poruchy rovnováhy [2]. Strach z pádov taktiež znižuje motiváciu pacientov k intenzívnemu pohybu – športovému výkonu (u 70 % pacientov sa pády vyskytujú na ročnej a u 13 % na týždennej báze). Naopak nedostatok pohybu a nízka fyzická zdatnosť ďalej zvyšujú riziko pádov, fraktúr a mortality [5,6]. Nemotorické príznaky ako depresia, apatia, únava a pokles kognitívnych funkcií tiež nepriaznivo ovplyvňujú adherenciu pacientov k liečbe ako aj ku programom fyzickej aktivity [7]. Vzniká bludný kruh, v ktorom s ochorením súvisiaci pokles pohybovej aktivity vedie k zhoršovaniu motorickej aj nemotorickej symptomatológie s ďalším znižovaním kvality života a zhoršovaním prognózy ochorenia (obr. 1).
Fig. 1. Relationships between symptoms and complications of Parkinson´s disease and
sedentary lifestyle [3].
![Vzťah medzi príznakmi a komplikáciami Parkinsonovej choroby a sedavým životným
štýlom [3].<br>
Fig. 1. Relationships between symptoms and complications of Parkinson´s disease and
sedentary lifestyle [3].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/ddfddfc592141174209d248976a1ce9b.png)
Axiálne príznaky PCh (posturálna instabilita, poruchy reči) a pokles kognitívnych schopností zle odpovedajú na konvenčnú liečbu levodopou alebo na hlbokú mozgovú stimuláciu [8,9]. Neoddeliteľnou súčasťou manažmentu pacienta s PCh by teda mal byť popri farmakologickej/ chirurgickej liečbe komplexný prístup zahŕňajúci rehabilitáciu a individualizované, pravidelné cvičenie pod dohľadom skúseného fyzioterapeuta. Vzhľadom k veľmi nízkej preskripcii fyzioterapie je nutné reorganizovať aktuálny model starostlivosti u pacientov s PCh [10].
Faktory životného štýlu v etiopatogenéze Parkinsonovej choroby
Dôležitosť faktorov vonkajšieho prostredia v patogenéze PCh podporuje skutočnosť, že dedičné formy PCh predstavujú len 5– 10 % zo všetkých prípadov tohto ochorenia [11]. Prospektívna štúdia s populáciou viac ako 900 tisíc jedincov jednoznačne potvrdila asociáciu medzi fyzickou inaktivitou v strednom veku života a rizikom vzniku PCh. Jedinci, ktorí sa pravidelne venovali stredne intenzívnej fyzickej aktivite, mali až o 40 % nižšie riziko vzniku ochorenia [12]. Tento trend potvrdili aj závery ďalších longitudinálnych prospektívnych štúdií, pričom sa však fyzická aktivita nízkej intenzity (rýchla chôdza) nespájala so zníženým výskytom PCh [13,14]. Dá sa teda predpokladať, že nielen pravidelnosť, ale aj intenzita cvičenia patria medzi dôležité faktory ovplyvňujúce riziko vzniku PCh vo vyššom veku. Ďalším benefitom pravidelnej fyzickej aktivity u ľudí v strednom veku je aj pozitívny vplyv na tlak krvi a energetický metabolizmus prinášajúci pokles rizika hypertenzie, diabetu 2. typu ako aj rizika kognitívnych porúch a demencie, ktorá patrí medzi najzávažnejšie nemotorické príznaky PCh [15].
Sedavý spôsob života významne prispieva ku vzniku sarkopénie asociovanej s vekom, ktorej dôsledkom je atrofia svalových vlákien, ektopická akumulácia lipidov vo svale a poruchy funkčného stavu mitochondrií. Tento stav akceleruje rozvoj inzulínovej rezistencie a prispieva k chronickému subklinickému zápalu v periférnych tkanivách [16– 18]. Chronický subklinický systémový zápal môže následne spolu s oxidačným stresom akcelerovať neuroinflamáciu v mozgu. Podobne ako na periférii aj v CNS zápal negatívne ovplyvňuje signálnu funkciu mnohých bioaktívnych látok vrátane rastových faktorov. Post-mortem štúdie poukázali na znížené hladiny glutatiónu či iných významných antioxidantov [19], ako aj na poruchu respiračného reťazca na úrovni komplexu I [20] v substantia nigra v mozgu pacientov s PCh. V neuronálnych tkanivách jedincov s neurodegeneratívnym ochorením sa pozorovala porucha inzulínového postreceptorového signalingu, ktorá významne znižuje schopnosť ich odpovede na inzulín, a to aj bez prítomnosti periférnej inzulínovej rezistencie či diabetu 2. typu [21]. Tieto zistenia poukazujú na to, že ako starnutie, tak aj dlhodobý energetický nadbytok pri obezite či chronický nedostatok pohybovej aktivity pravdepodobne aktivujú veľmi podobné patofyziologické mechanizmy v periférnych tkanivách (kostrový sval, pečeň, tukové tkanivo či pankreas) ako aj v mozgu.
Na druhej strane viaceré experimentálne zvieracie ale aj klinické štúdie potvrdili pozitívny účinok cvičenia na mnohé systémové rizikové faktory poškodenia mozgu, ako sú hypertenzia, hyperglykémia, systémový subklinický zápal, ektopická akumulácia lipidov a lipotoxicita, inzulínová rezistencia či dyslipidémia [22]. Fyzická aktivita pozitívne ovplyvňuje množstvo a funkčný stav mitochondrií reguláciou kľúčového aktivátora mitochondriálnej biogenézy, ktorým je transkripčný kofaktor PGC-1α (peroxisome proliferator-activated receptor-gamma coactivator-1α) [23], a to ako u mladších, tak aj u starších jedincov.
Prítomnosť chronického subklinického zápalu, oxidačný stres, poruchy funkcie mitochondrií či inzulínového signalingu sa teda vyskytujú nielen na úrovni periférnych tkanív, ale aj v mozgu, kde sa môžu uplatniť ako faktory akcelerujúce neurodegeneratívny proces. Takže metabolická porucha na periférií môže výrazne zvýšiť riziko vzniku, resp. akcelerovať progresiu PCh. Ukazuje sa, že pravidelná fyzická aktivita má potenciál znížiť riziko vzniku alebo spomaliť progresiu PCh práve prostredníctvom priaznivého ovplyvnenia spomínaných rizikových faktorov.
Účinky cvičenia u pacientov s Parkinsonovou chorobou: prehľad intervenčných štúdií
V prierezových štúdiách fyzická aktivita priaznivo ovplyvnila dĺžku života pacientov s PCh [24] a fyzická zdatnosť ako parameter trénovanosti pozitívne korelovala s výsledkami motorických aj kognitívnych testov [25]. Vzhľadom na absenciu spoľahlivých a ľahko merateľných biomarkerov zohľadňujúcich progresiu a priebeh ochorenia je hodnotenie klinických štúdií skúmajúcich dlhodobý efekt cvičenia u pacientov s PCh pomerne komplikované. Napriek tomu, že v týchto štúdiách sa ako najčastejšia forma intervencie uplatňuje aeróbny tréning, pribúdajú práce, ktoré skúmajú efekt silového tréningu ako aj iných, alternatívnych foriem cvičenia na rôzne klinické prejavy PCh.
Ukázalo sa, že 18 týždňov aeróbneho tréningu vedie u myšieho modelu PCh k výraznej redukcii patológie v substantia nigra pars compacta, pričom mechanizmom by mohla byť indukcia neurotrofických faktorov BDNF (brain-derived neurotrophic factor) a GDNF (glial cell line-derived neurotrophic factor) v substancia nigra a v striate [26]. Pred niekoľkými rokmi boli publikované výsledky randomizovanej klinickej intervenčnej štúdie so 16-mesačným sledovaním u pacientov vo včasnom alebo mierne pokročilom štádiu PCh, ktorá mala za cieľ porovnať tréning flexibility, rovnováhy a svalovej sily s aeróbnym tréningom (bežecký pás/ bicykel/ eliptický trenažér), pričom v oboch prípadoch bola frekvencia cvičenia 3× týždenne počas prvých 4 mesiacov a neskôr sa tréning pod dohľadom trénera uskutočňoval len raz mesačne a dobrovoľníci boli inštruovaní dodržiavať protokol domáceho cvičenia (udržiavacia fáza). Kontrolná skupina cvičila v domácich podmienkach (využívala fitness program Americkej národnej nadácie pre PCh). Tréning flexibility, rovnováhy a svalovej sily viedol k celkovému funkčnému zlepšeniu motorického stavu pacientov na základe zjednotenej hodnotiacej škály pre Parkinsonovu chorobu (Unified Parkinson‘s Disease Rating Scale; UPDRS), kým aeróbne cvičenie zvýšilo aj rýchlosť, energetickú efektivitu a ekonomiku chôdze. Oba tréningové programy sa ukázali efektívnejšie v porovnaní s cvičením v domácich podmienkach [27]. Štyri týždne aeróbneho tréningu na bežeckom trenažéri s oporou, ktorá predstavovala menej ako 20 % telesnej hmotnosti (body weight–supported treadmill training), zlepšili na rozdiel od štandardnej fyzioterapeutickej liečby schopnosť pacientov vykonávať bežné denné aktivity, a to najmä vďaka zlepšeniu funkčných a silových parametrov kostrového svalstva dolných končatín, dokumentovaných zlepšeniami v UPDRS a v teste chôdze na 10 metrov [28]. Ďalšie sledovanie ukázalo pretrvávanie pozitívnych účinkov takéhoto typu tréningu na motoriku a chôdzu pacientov s PCh, a to aj 6 mesiacov po ukončení tréningovej intervencie [29].
Systematický prehľadový článok, ktorý hodnotil účinky silového tréningu v 13 klinických randomizovaných intervenčných štúdiách, ukázal, že silový tréning je pre pacientov s PCh bezpečný a popri zlepšení parametrov fyzickej zdatnosti môže viesť k zlepšeniu kvality života [30]. Účinky 2-ročnej intervencie zameranej na silový tréning u pacientov s PCh v porovnaní s kontrolnou skupinou (cvičenia zamerané na strečing a rovnováhu) sledovala štúdia PRET-PD. Obe skupiny mali okrem rovnakej dĺžky intervencie aj rovnakú frekvenciu tréningov (2× týždenne, 60– 90 min). Po 6 mesiacoch intervencie sa síce signifikantné rozdiely medzi skupinami nepozorovali, avšak po 2 rokoch dosiahla skupina so silovým tréningom oveľa výraznejšie zlepšenie motorických príznakov ochorenia podľa UPDRS-III (skóre nižšie priemerne o 7,3 bodu), ako aj väčší nárast svalovej sily. U oboch skupín sa pozorovalo zvýšenie rýchlosti chôdze a zlepšenie rovnováhy, pozornosti a pracovnej pamäte [31,32]. Autori štúdie vysvetľovali výraznejší efekt silového tréningu okrem iného aj progresívnym zvyšovaním záťaže, ktoré má potenciál významne stimulovať signálne dráhy v bazálnych gangliách a redukovať kortikomotorickú excitabilitu (tento jav bol popísaný pomocou transkraniálnej magnetickej stimulácie v inej štúdii zaoberajúcej sa efektom silového cvičenia u pacientov s PCh [33]). Silový tréning by teda mohol viesť k dosiahnutiu vyššej neuronálnej plasticity v oblastiach najviac postihnutých patológiou PCh.
Menšia pilotná štúdia porovnávala efekt 12 týždne trvajúceho silového tréningu veľkých svalových skupín s progresívnym zvyšovaním záťaže až do 80 % 1RM; aeróbneho tréningu s intenzitou 60 % VO2max, s progresívnym zvyšovaním rýchlosti chôdze a prevýšenia a štandardnej fyzioterapeutickej liečby (kalistenika/ strečing/ chôdza). Pacienti, ktorí absolvovali silový a aeróbny tréning sa v porovnaní so štandardne fyzioterapeuticky liečenou skupinou výraznejšie zlepšili v motorických parametroch (pokles skóre UPDRS-III; a to o 27,5 %, resp. 35 %), zlepšila sa aj funkčná kapacita meraná v 2-min teste chôdze s vysokým dvíhaním kolien a zaznamenalo sa tiež špecifické zvýšenie EEG aktivity špecifických kôrových oblastí mozgu. Účinky aeróbneho a silového tréningu boli porovnateľné [34].
Viaceré klinické štúdie sledovali účinky špecifických typov tréningu na rôzne klinické parametre pacientov s PCh. Jeden z najvhodnejších typov aeróbneho tréningu u pacientov s PCh bola severská chôdza (nordic walking), ktorá je nielen dobre tolerovaná (adherencia k tréningu až 90 %), ale prináša aj viaceré funkčné a klinické benefity [35]. V 6-mesačnej pilotnej tréningovej štúdii so severskou chôdzou (2× týždenne, 60 min) sa pozorovalo zlepšenie motorických parametrov a kvality života u 19 pacientov s PCh, ktoré pretrvávali aj 5 mesiacov po ukončení štúdie [36]. Combs et al porovnávali u 31 pacientov s PCh boxerský tréning ako alternatívnu formu silového tréningu (2– 3× týždenne, 12 týždňov, 90 min) so štandardným aeróbne-silovým tréningom rovnakého objemu a intenzity. Boxerský tréning zahŕňal strečingové, aeróbne aj silové typy cvičení. Štandardný aeróbne silový tréning síce viedol k výraznejšiemu zlepšeniu rovnováhy, bezkontaktný tréning boxu však výraznejšie ovplyvnil rýchlosť chôdze, aeróbnu zdatnosť a vytrvalosť. Obom tréningovým skupinám sa okrem celkovej mobility zvýšila tiež kvalita života [37]. Zaujímavým typom cvičenia u pacientov s PCh je argentínske tango, pri ktorom sú jedinci počas tanca okrem aeróbnej aktivity nútení k rýchlym zmenám pohybov a rotáciám a musia sa tiež naučiť rozličné krokové sekvencie. Dlhodobé intervencie s tanečnými lekciami tanga u pacientov s PCh viedli k zlepšeniu motorickej symptomatológie (UPDRS) [38] ako aj k zlepšeniu skóre Montrealského kognitívneho testu (MoCA) [39]. Intenzívny tréning tanga (5× týždenne) viedol už za 2 týždne k zlepšeniu motorických prejavov ochorenia (UPDRS) [40]. Metaanalýza ôsmych klinických štúdií (siedmych randomizovaných a jednej nerandomizovanej), v ktorých bolo u pacientov s PCh aplikované cvičenie tai chi ako forma tréningovej intervencie, poukázala na výrazný pozitívny efekt tohto cvičenia na rovnováhu a motorické prejavy ochorenia. Na parametre ako rýchlosť chôdze alebo vytrvalosť však účinok tai chi preukázaný nebol [41]. Ako následok zvýšenej rigidity flexorov vzniká pri PCh anteflekčné postavenie trupu, ktoré môže byť akcentované prítomnosťou kamptokormie (syndrómu ohnutého chrbta), prípadne strachom z pádov, pričom môže viesť aj ku vzniku deformít hrudníka v podobe kyfózy. Už po jednom mesiaci tréningu chôdze do kopca (3× 30 min týždenne, pričom počiatočné prevýšenie 3 % sa s tréningovými dávkami progresívne zvyšovalo) sa pozorovalo zlepšenie rýchlosti chôdze a dĺžky kroku, postoja ako aj zvýšenie sily svalov dolných končatín u 16 pacientov s PCh. Chôdza do kopca by teda mohla predstavovať spôsob, ako si udržať správny postoj tela, a prispieť tak k zlepšeniu rovnováhy [42].
Nemenej dôležitá je aj prevencia a včasná terapia nemotorických príznakov PCh, medzi ktoré patrí pokles kognitívnych funkcií s rizikom progresie do demencie. V čase diagnózy PCh má nejakú formu kognitívneho deficitu až 25– 30 % pacientov, v prvých 3– 5 rokoch po stanovení diagnózy je pokles kognitívnych funkcií prítomný až u polovice pacientov [43], a prevalencia demencie po viac ako 10 rokov od stanovenia diagnózy PCh dosahuje až 75 % [44]. Observačná štúdia, v ktorej sa viac ako 2 000 pacientov s PCh venovalo stredne intenzívnej pohybovej aktivite aspoň 150 min týždenne, poukázala na nižšie riziko poklesu kognitívnych schopností v porovnaní so sedavými pacientami [45]. Dve ďalšie štúdie s 3– 6 mesačnými intervenciami aeróbnym tréningom ukázali významné zlepšenie exekutívnych funkcií [46,47]. Da Silva et al zosumarizovali účinky rôznych tréningových intervencií (rýchla chôdza, tango, bicykel, tai chi, kombinácia kognitívneho a motorického tréningu, viacdoménová intervencia) na kogníciu. Išlo o systematický prehľad a metanalýzu 9 intervenčných štúdií, ktoré sa realizovali u pacientov s PCh (populácie jednotlivých štúdií tvorilo 17– 39 pacientov). Okrem celkového zlepšenia kognitívnych funkcií autori pozorovali predovšetkým zlepšenia reakčnej rýchlosti, pozornosti a mentálnej flexibility. Najvýraznejšie pozitívne zmeny pritom boli zaznamenané po 24 týždňoch aeróbneho tréningu (3× 60 min týždenne), ktorý má u pacientov s PCh potenciál priaznivo ovplyvniť aj exekutívne funkcie a slovnú plynulosť [48]. Úlohu fyzickej zdatnosti v mladom a strednom veku z hľadiska prevencie kognitívneho deficitu potvrdil aj rozsiahly výskum zameraný na švédskych brancov (1,2 milióna jedincov). Výsledky ukázali, že vyššie riziko vzniku demencie sa o štyri dekády neskôr pozorovalo u tých jedincov, ktorí mali pri nábore do armády nižšiu fyzickú zdatnosť [49]. Atrofia špecifických oblastí mozgu (predovšetkým hipokampu) bola ako sprievodný príznak demencie popísaná nielen u pacientov s Alzheimerovou chorobou, ale aj u pacientov s demenciou pri PCh [50]. Objem hipokampu pritom pozitívne koreloval s úrovňou fyzickej zdatnosti [51] a viaceré prospektívne štúdie popísali asociáciu medzi väčšími objemami mozgovej kôry a hipokampu u seniorov, ktorí podstúpili 6– 12 mesačnú tréningovú intervenciu oproti ich sedavým kontrolám [25].
Medzi ďalšie nemotorické príznaky PCh patria poruchy spánku, únava či depresia. V pilotnej štúdii bez kontrolnej skupiny viedlo 36 aeróbne-silových tréningov u 20 pacientov s PCh k zlepšeniu kvality spánku [52]. Pravidelnú únavu podľa observačných štúdií pociťuje 30– 50 % pacientov s PCh, pričom únava negatívne korelovala s mierou každodennej fyzickej aktivity [53]. Kým prevalencia depresie, ktorá vo významnej miere ovplyvňuje kvalitu života pacientov s PCh, je vo včasných štádiách ochorenia (I.– II. štádium podľa Hoehnovej a Yahra) len 15,6 %, v IV.– V. štádiu je to až 47,9 % [54]. Metaanalýza 23 štúdií zahŕňajúca takmer 1 000 jedincov popísala priaznivé účinky fyzickej aktivity na depresiu [55], pričom medzi pravdepodobné mechanizmy tohto efektu môže patriť stimulácia plasticity špecifických oblastí mozgu, pri depresii typicky postihnutých atrofiou [56,57]. Systematický prehľad 11 klinických štúdií potvrdil priaznivý účinok fyzickej aktivity na depresiu špecificky aj u jedincov s PCh, u ktorých je antidepresívny účinok cvičenia pravdepodobne spojený aj s benefičnými účinkami cvičenia na motorické prejavy ochorenia, ktoré môžu priaznivo ovplyvniť samostatnosť a celkovú kvalitu života pacientov [58].
V našej klinicko-intervenčnej štúdií sme už po 3-mesačnej aeróbne-silovej tréningovej intervencii pod dohľadom trénera (3 × 1 h/ týždeň) pozorovali klinické zlepšenie UPDRS [59]. Išlo o > 16 % zníženie celkového skóre, pričom najvýraznejšie zlepšenie sme pozorovali v motorickom subskóre MDS-UPDRS III. Zlepšili sa aj motorické parametre ako rovnováha, rýchlosť chôdze, zvýšila sa aeróbna zdatnosť (VO2max), bazálny výdaj energie aj metabolizmus glukózy, teda glykémia nalačno aj 2h glykémia pri orálnom glukozo-tolerančnom teste (oGTT). Tieto zmeny boli sprevádzané zvýšenou expresiou adenozínmonofosfátom-aktivovanej protein kinázy (AMPK), ktorá je akýmsi energetickým senzorom bunky regulujúcim mitochondriálnu biogenézu, vychytávanie glukózy a oxidáciu mastných kyselín v kostrovom svalstve. Ukázali sme teda, že zlepšenie klinického stavu pacientov s PCh sprevádzali aj zmeny systémového metabolizmu a metabolizmu kostrového svalstva, ako aj adaptačné zmeny na bunkovej a molekulárnej úrovni [59]. Pokojový energetický výdaj, úroveň habituálnej fyzickej aktivity a svalová sila pritom vysvetľovali 72,5 % variability v parametre bradykinézie, teda interindividuálne rozdiely jedného zo základných klinických príznakov ochorenia v rámci danej študovanej populácie [59].
Výsledky klinických intervenčných štúdií poukazujú na to, že cvičenie doma bez dohľadu fyzioterapeuta a motivačného tlaku tréningovej skupiny má podstatne menší efekt ako tréning pod vedením edukovaného odborníka (trénera/ fyzioterapeuta) [27,60]. Cieľom je samozrejme udržanie adherencie k fyzickej aktivite aj po skončení klinickej intervenčnej štúdie. Jedným z efektívnych riešení, ako zvýšiť denný objem chôdze a motivovať pacientov k pravidelnému cvičeniu, by mohlo byť využitie moderných technologických možností v podobe virtuálneho trénera [61].
Existuje teda množstvo vedeckých dôkazov o tom, že pravidelný tréning strednej intenzity má potenciál už v priebehu niekoľkých mesiacov pozitívne ovplyvniť nielen priebeh ochorenia a zlepšiť tak motorické i nemotorické príznaky PCh, ale zlepšiť aj kvalitu života a prognózu pacienta s PCh. U pacientov s PCh sa ako optimálna javí kombinácia aeróbneho a silového tréningu, pričom efektívny je tiež tréning využívajúci severskú chôdzu, boxerský tréning či argentínske tango.
Mechanizmy benefičných účinkov cvičenia u pacientov s Parkinsonovou chorobou
Mechanizmy, ktorými cvičenie ovplyvňuje patogenézu, symptomatológiu a progresiu PCh, sa skúmali predovšetkým na zvieracích modeloch [25]. Najlepšie popísaný mechanizmus sa spája s reguláciou procesov neuronálnej plasticity, ktorá vyjadruje schopnosť vytvárať nové funkčné synaptické spojenia, čo je nevyhnutným predpokladom zachovania motorických i kognitívnych schopností. Dlhodobý aeróbny tréning bol pritom asociovaný s dlhodobou potenciáciou a so stimuláciou neurogenézy v hipokampe, pri súčasnom zvýšení expresie mediátorov neuroplasticity v mozgu, ku ktorým patria neurotrofické faktory ako mozgový neurotrofický faktor (brain-derived neurotrophic factor; BDNF), neurotrofický faktor gliových buniek (glial cell line-derived neurotrophic factor; GDNF) a transkripčný faktor CREB (cAMP response element binding protein), ako aj so zvýšením expresie synaptických proteínov (synapsín 1, synaptofyzín) a génov priaznivo ovplyvňujúcich synaptickú plasticitu (napr. prostredníctvom zvýšenia expresie receptorov kyseliny N-metyl-D-asparágovej [N-Methyl-D-aspartic acid; NMDA] v hipokampe) [62]. V štúdiách na hlodavcoch sa zistilo, že rastový faktor GDNF stimuluje prežívanie a diferenciáciu dopamínergných neurónov a redukuje prejavy neurotoxínom-indukovanej PCh. Autori viacerých animálnych štúdií pozorovali cvičením navodenú stimuláciu syntézy tyrozín hydroxylázy (kľúčový enzým syntézy L-DOPA a dopamínu), samotného dopamínu a dopamínového transportéru, ako aj väzbu dopamínu na dopamínové receptory a zvýšenie aktivity dopamínergných synáps, čo naznačuje priamy pozitívny efekt cvičenia na dopamínergné neuróny [63].
Medzi kľúčové mechanizmy sprostredkujúce neuroplasticitu patria neurotrofické faktory, ktoré majú neuroprotektívny účinok aj na dopamínergné neuróny. U zvierat vykonávajúcich pravidelnú fyzickú aktivitu sa po experimentálnom podaní neurotoxickej látky (model Pch) významne zlepšilo prežívanie dopamínergných neurónov v substancia nigra pars compacta a oveľa menej bola rozvinutá aj symptomatológia PCh [64]. Neuroprotektívny účinok cvičenia v zmysle zastavenia úbytku dopamínergných neurónov bol pritom časovo závislý, s najvýraznejším efektom u najdlhšie (3 mesiace) cvičiacich zvierat [65]. Mechanizmom tohto účinku bola pravdepodobne cvičením navodená stimulácia produkcie neutrofických faktorov so schopnosťou ovplyvňovať prežívanie a diferenciáciu neurónov, neurogenézu a synaptogenézu [64]. Naopak u sedavých zvierat viedlo podanie neurotoxickej látky k výraznejšej redukcii dopamínergných neurónov v substancia nigra a k zníženiu expresie BDNF a GDNF [65]. Okrem toho krátkodobá (7 dní) imobilizácia jednej z končatín týchto zvierat viedla k exacerbácii príznakov PCh [66]. Medzi faktory s preukázateľne neuroprotektívnym účinkom patria BDNF, GDNF, inzulínu podobný rastový faktor (insulin-like growth factor; IGF-1) a vaskulárny endoteliálny rastový faktor (vascular endothelial growth factor; VEGF), pričom viaceré štúdie ukázali, že génová terapia s cieľom zvýšiť expresiu GDNF alebo neurturínu v bunkových a zvieracích modeloch Pch by mohla mať terapeutický potenciál [67]. Zvýšenie sérových hladín BDNF po jednorázovom ako aj pravidelnom cvičení bolo popísané aj u pacientov s PCh [68], efekt sa pozoroval už po mesiaci tréningu na bežeckom páse [69] či po 2 mesiacoch bicyklovania [70]. Keďže GDNF na rozdiel od BDNF neprechádza hematoencefalickou bariérou do mozgu, venuje sa tomuto rastovému faktoru oveľa menej pozornosti. Pritom oba, BDNF a GDNF, hrajú dôležitú úlohu v regulácii transkripcie génu pre tyrozín hydroxylázu, kľúčového enzýmu pre tvorbu L-DOPA a dopamínu, a ich expresia je výrazne znížená v substancia nigra pacientov s PCh [71]. BDNF tiež stimuluje tvorbu synapsínu I, čím priaznivo ovplyvňuje synaptickú aktivitu. Pridanie BDNF ku kultúre dopamínergných neurónov viedlo k zlepšeniu synaptického prenosu a k stimulácii arborizácie dendritov [72], kým pridanie GDNF zlepšilo prežívanie a diferenciačnú kapacitu neurónov [67]. To je v súlade so zistením, že neuroprotektívny účinok pravidelného cvičenia nebolo možné zaznamenať, ak sa neurotoxínom-navodené poškodenia spojené so symtomatológiou PCh vykonalo u myší s inaktivujúcu mutáciu génu pre BDNF [65]. Ukázalo sa, že okrem neuroprotektívneho pôsobenia stimuluje pravidelná fyzická aktivita aj proliferáciu endoteliálnych buniek v mozgu. Stimulácia angiogenézy vedie k zlepšeniu prekrvenia, zvýšenej dodávke kyslíka a nutrientov a zlepšuje energetický metabolizmus mozgu [73]. Tento efekt je sprostredkovaný rastovým faktorom VEGF, ktorý popri stimulácii angiogenézy tiež inhibuje tvorbu proapoptotických proteínov. Rastové faktory hrajú teda dôležitú úlohu v sprostredkovaní mnohých benefičných účinkov pohybovej aktivity u pacientov s PCh (obr. 2).
Fig. 2. Overview of the exercise effects on the brain in a patient with Parkinson´s disease
mediated by growth factors [69].
BDNF – brain-derived neurotrophic factor; GDNF – glial cell line-derived neurotrophic factor;
IGF-1 – insulin-like growth factor; VEGF – vascular endothelial growth factor
![Prehľad účinkov cvičenia na mozog pacienta s Parkinsonovou chorobou, ktoré sú
sprostredkované rastovými faktormi [69].
BDNF – mozgový neurotrofický faktor; GDNF – neurotrofický faktor gliových buniek; IGF-1 –
inzulínu podobný rastový faktor; VEGF – vaskulárny endoteliálny rastový faktor<br>
Fig. 2. Overview of the exercise effects on the brain in a patient with Parkinson´s disease
mediated by growth factors [69].
BDNF – brain-derived neurotrophic factor; GDNF – glial cell line-derived neurotrophic factor;
IGF-1 – insulin-like growth factor; VEGF – vascular endothelial growth factor](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/7937b192e669f4b8f1e4391af520eb95.png)
Poruchy funkčného stavu mitochondrií sú jedným z kľúčových faktorov v patogenéze neurodegeneratívnych ochorení [74]. Oxidatívna fosforylácia v mitochondriách predstavuje pre neuróny kľúčový zdroj energie pre zabezpečenie ATP-dependentných procesov ako transport iónov, funkciu receptorov, uvoľňovanie signálnych látok, tvorbu a uvoľňovanie exozómov či neurotransmiterov. Vzhľadom na vysokú mieru závislosti od procesov oxidatívnej fosforylácie v mitochondriách je mozgové tkanivo prirodzene citlivé na oxidačný stres. Počas starnutia pritom dochádza k zvýšenej produkcii voľných kyslíkových radikálov v bunkách, pričom oxidačný stres nepriaznivo ovplyvňuje de novo tvorbu, dynamiku spájania a rozpájania (fusion & fission) i funkčnú kapacitu mitochondrií, a to najmä vďaka s vekom súvisiacemu poklesu antioxidačných regulačných systémov. Nerovnováha medzi oxidačným stresom a antioxidačnými mechanizmami vedie k progresívnemu poškodzovaniu mitochondrií a môže končiť až apoptotickou smrťou nervovej bunky [74]. Porucha funkcie mitochondriálnych komplexov (I a IV) respiračného reťazca bola popísaná aj v patológii PCh [26]. Pravidelné cvičenie dokáže stimulovať mitochondriálnu biogenézu, čo spolu s aktiváciou procesov oxidatívnej fosforylácie, antioxidačných mechanizmov a so znížením oxidačného stresu zlepšuje funkčnú kapacitu mitochondrií a metabolizmus nielen vo svale, ale aj v mnohých tkanivách vrátane mozgu. Dynamika a rozsah zmien pritom závisia od objemu a intenzity cvičenia [74], pričom pozitívne účinky sa pozorujú už pri cvičení so strednou, avšak nie s nízkou intenzitou. Aeróbne cvičenie priaznivo ovplyvnilo aktivitu procesov oxidatívnej fosforylácie v mitochondriách spojených s tvorbou ATP v neurónoch modelu myší s PCh [26]. Fyzicky aktívni jedinci majú oproti sedavým kontrolám porovnateľného veku, pohlavia a BMI vyššie cirkulujúce hladiny glutatiónu, jedného z kľúčových antioxidantov [75] a fyzická aktivita dokáže významne potlačiť prejavy chronického subklinického zápalu, a to nielen na periférii, ale aj v mozgu. Vieme napr., že aeróbny tréning výrazne znižuje expresiu prozápalových cytokínov IL-1 a TNF-α v hipokampe myší [76]. Dá sa teda konštatovať, že podobné mechanizmy, akými cvičenie priaznivo ovplyvňuje periférne tkanivá (tukové tkanivo, kostrový sval, pečeň) teda, zlepšenie funkcie mitochondrií, zníženie oxidačného stresu a chronického subklinického zápalu, sa uplatňujú aj centrálne a môžu sa využiť pri prevencii a podpornej liečbe neurodegeneratívnych ochorení.
Niektoré štúdie naznačujú vplyv fyzickej aktivity aj na efektivitu terapie levodopou. Zdá sa, že cvičenie by mohlo akútne meniť farmakodynamiku levodopy u pacientov s PCh, a to zvýšením jej absorpcie z gastrointestinálneho traktu v dôsledku zvýšenia krvného prietoku črevnou stenou, ale aj stimuláciou prechodu levodopy cez hematoencefalickú bariéru do mozgu [77]. Ďalším potenciálne významným, ale doteraz neobjasneným mechanizmom, ktorým by fyzická aktivita spolu s úpravou stravovacích návykov mohla ovplyvniť biologickú dostupnosť levodopy, je zásah do zloženia a funkčnej kapacity. Niektoré črevné baktérie, ako Lactobacillus alebo Enterococcus, dokážu produkovať enzým tyrozín dekarboxylázu, ktorá rozkladá L-DOPU na tyrozín, a môže tak modulovať účinnosť liečby Pch a tiež znižovať výskyt nežiaducich účinkov farmakoterapie. Jej prítomnosť v stolici pacientov s PCh koreluje s efektívnou dávkou levodopy, ako aj s trvaním ochorenia [78]. Multimodálny rehabilitačný program zahŕňajúci fyzioterapiu a aeróbne cvičenie dokázal už po mesiaci priaznivo ovplyvniť prítomnosť dyskinéz, ktoré bývajú častým nežiaducim účinkom liečby levodopou. Okrem zvýšenia biologickej dostupnosti levodopy by teda fyzická aktivita mohla predstavovať aj doplnok liečby, ktorý dokáže efektívne znížiť výskyt nežiaducich účinkov farmakoterapie u pacientov s PCh [79].
Fyzická aktivita má potenciál priaznivo ovplyvniť nielen základné prejavy PCh, ale aj jej ďalšie komplikácie, ako napr. prejavy depresie [58], pokles kognitívnych funkcií [46] alebo poruchy energetického metabolizmu [59]. Na základe výsledkov mnohých zvieracích a niekoľkých klinických štúdií môžeme predpokladať priaznivé ovplyvnenie dopamínergného systému v mozgu, redukciu oxidačného stresu či zlepšenie funkčného stavu mitochondrií (tab. 1).
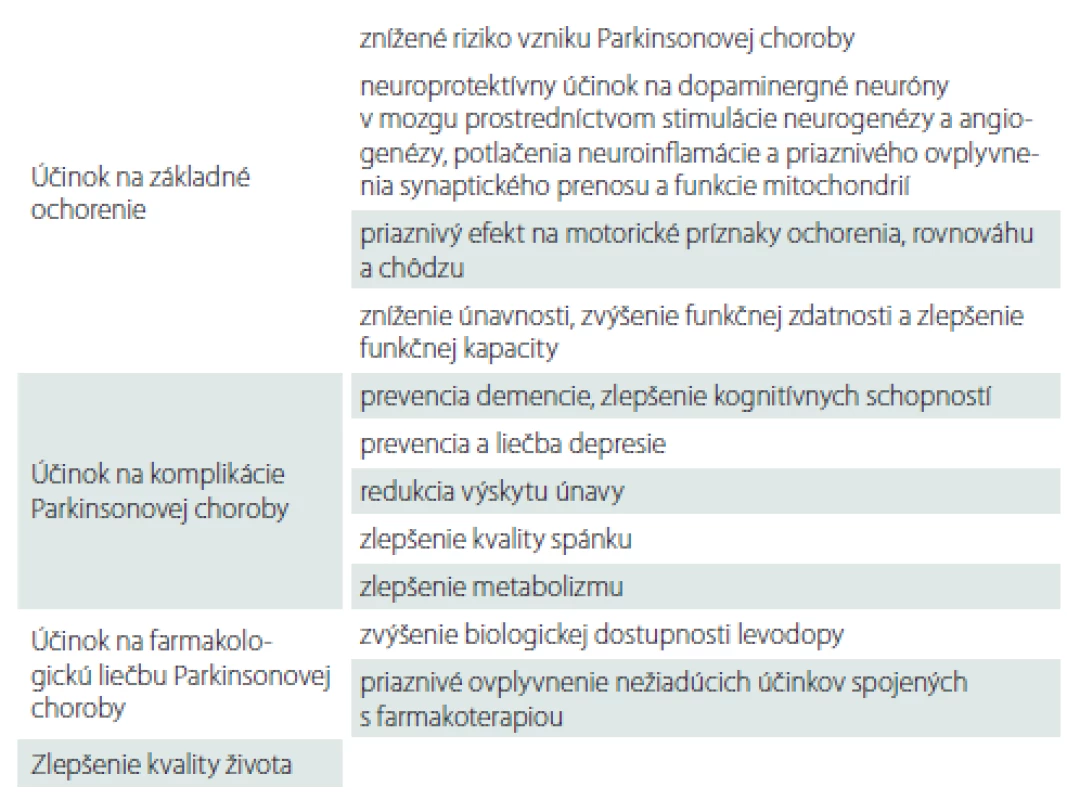
Odporúčania pohybovej aktivity u pacientov s Parkinsonovou chorobou
Existujú presvedčivé dôkazy o vzťahu medzi fyzickou zdatnosťou, ktorá sa zvyšuje aeróbnym a dostatočne intenzívnym cvičením, a markermi neurodegeneratívnych ochorení. Cielená, vhodne štrukturovaná, dostatočne intenzívna a na mieru šitá pohybová aktivita, ktorá zohľadňuje zdravotné riziká a obmedzenia pacienta, jednoznačne patrí do komplexného manažmentu terapie PCh. Takýto program by bolo treba aplikovať už v predklinických a včasných klinických štádiách ochorenia. Výhodou skorého začiatku je, že pacienti v počiatočných štádiách choroby sú približne rovnako fyzicky zdatní ako zdraví ľudia rovnakého veku a výsledok intervencie z hľadiska progresie ochorenia a celkovej prognózy pre pacienta býva najlepší.
Pedersen a Saltin v odporúčaniach fyzickej aktivity pre spektrum 26 chronických ochorení zdôrazňujú potrebu individualizácie tréningu pre pacientov s PCh so zohľadnením štádia ochorenia. Autori neuvádzajú žiadne všeobecné kontraindikácie tréningu u pacientov s PCh [80]. Na základe výsledkov klinických intervenčných štúdií, ako aj medzinárodných odporúčaní sa ako optimálna javí kombinácia aeróbneho a silového tréningu spolu s cvičeniami zameranými na rovnováhu a koordináciu pohybov. Redukcia motorických príznakov ochorenia sa zvyšovala so zvyšujúcou sa intenzitou tréningu a bola asociovaná aj so špecifickými zmenami na úrovni mozgovej kôry zachytenými transkraniálnou elektromagnetickou encefalografiou [81]. Aktuálne európske odporúčania fyzioterapie pre PCh zaraďujú medzi vhodné typy pohybovej aktivity pre pacientov s PCh tanec, tai chi, ale aj chôdzu či beh na bežeckom páse, s možnosťou opory [82], pri ktorom by ale pacient vzhľadom na zachovanie bezpečnosti mal byť pod neustálym dohľadom. Americké kolégium športovej medicíny taktiež odporúča kombináciu aeróbneho a silového tréningu so strečingom (odporúčania uvedené v tab. 2 [83]). Spoločným menovateľom rôznych odporúčaní je uskutočniť dôkladnú edukáciu pacientov o význame pohybovej aktivity z hľadiska prognózy ochorenia, ktoré zvýši motiváciu a adherenciu k programom pohybovej aktivity.
![Odporúčania fyzickej aktivity pre pacientov s Parkinsonovou chorobou [85].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/15ca4cb7b296e24f3c7ff1a8e6521c97.png)
Dôležitou súčasťou individualizovanej preskripcie je počiatočná diagnostika motorických a silových funkcií, ako aj aeróbnej fyzickej zdatnosti, na základe ktorej sa v súlade so zdravotným stavom pacienta definuje dizajn a ciele individualizovaného tréningového plánu. Dôležitou zásadou je, že aeróbny tréning by mal začať cvičeniami nižšej intenzity (< 40 % VO2max/ HRmax) a záťaž by sa mala postupne zvyšovať na úroveň strednej intenzity (40– 60 % VO2max/ HRmax). Užitočné môže byť zapojenie verbálnych či audiovizuálnych pomôcok (rytmický tréning), ako aj zaznamenávanie subjektívneho vnímania stupňa záťaže pacientom, napr. pomocou jednoduchej Borgovej škály. Pri používaní posilňovacích strojov je dôležité pri každom novom cviku pacientovi vysvetliť správnu techniku pohybu, ktorú by si mal najskôr odskúšať pri používaní nižších záťaží, resp. bez záťaže (familiarizácia). Pacientom sa pritom odporúča plánovať si cvičenie v období dňa, kedy sa subjektívne cítia najlepšie a majú najnižší výskyt motorických prejavov. Ďalším dôležitým aspektom plánovania tréningu je farmakokinetika základného liečiva. Cvičenie sa odporúča v čase 45– 60 min po podaní antiparkinsonickej medikácie, kedy by jeho hladina v cirkulácii mala dosiahnuť maximum. V rámci prevencie možných pádov by mali pacienti s PCh eliminovať pohyby a cviky vyžadujúce príliš časté vstávanie [84].
Záver
Pravidelná a dostatočne intenzívna fyzická aktivita má u pacientov s PCh potenciál priaznivo ovplyvniť patogenézu, klinickú symptomatológiu a progresiu ochorenia. Benefity cvičenia sú u pacientov s PCh sprevádzané priaznivými funkčnými a morfologickými zmenami na úrovni mozgu. Fyzická aktivita pozitívne ovplyvňuje aj nemotorické príznaky vrátane kognitívnych funkcií, únavy či porúch spánku, ale aj účinok a nežiadúce prejavy farmakoterapie. Zároveň je treba podotknúť, že najväčšiu šancu pozitívne ovplyvniť patogenézu neurodegeneratívnych ochorení pravidelným cvičením máme, ak intervenciu aplikujeme už v predklinických štádiách ochorenia, resp. v období prvých potenciálnych príznakov neurodegeneratívneho procesu. Napriek zdanlivo vyššiemu riziku pádov počas cvičenia je dlhodobé riziko pádov u pravidelne cvičiacich pacientov s PCh vďaka zlepšeniu motorických funkcií – chôdze, rovnováhy a sily dolných končatín – naopak nižšie.
Intervenčné tréningové štúdie u pacientov s PCh neuvádzali žiadne významné nežiaduce účinky, exacerbáciu príznakov alebo akcelerovanú progresiu ochorenia, ktoré by mohli byť v priamej súvislosti s implementáciou tréningu. Vzhľadom na progresívny charakter ochorenia by sa malo jednať o dlhodobý tréning s postupne sa zvyšujúcou záťažou vytvorený na základe individualizovanej preskripcie fyziatra/ rehabilitačného lekára a skúseného trénera alebo fyzioterapeuta a jednoznačne v spolupráci s neurológom. Fyzická aktivita a cvičenie by mali byť u pacientov s PCh implementované do štandardov liečby a pacient by sa mal s takýmto programom zoznámiť hneď pri stanovení diagnózy.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. Barbara Ukropcová, Ph.D.
Biomedicínske centrum Ústav experimentálnej endokrinológie
Slovenská akadémia vied
Dúbravská cesta 9
845 05 Bratislava
Slovensko
e-mail: barbara.ukropcova@savba.sk
Přijato k recenzi: 4. 3. 2019
Přijato do tisku: 2. 9. 2019
Zdroje
1. Cereda E, Barichella M, Pedrolli C et al. Diabetes and risk of Parkinson disease. Mov Disord 2013; 28(2): 2057. doi: 10.1002/ mds.25211.
2. Mantri S, Fullard ME, Duda JE et al. Physical activity in early Parkinson disease. J Parkinsons Dis 2018; 8(1): 107– 111. doi: 10.3233/ JPD-171218.
3. van Nimwegen M. Speelman AD, Hofman-van Rossum EJ et al. Physical inactivity in Parkinson disease. J Neurol 2011; 258(12): 2214– 2221. doi: 10.1007/ s00415-011-6097-7.
4. Müller J, Myers J. Association between physical fitness, cardiovascular risk factors, and Parkinson disease. Eur J Prevent Cardiol 2018; 25(13): 1409– 1415. doi: 10.1177/ 2047487318771168.
5. Canning CG, Sherrington C, Lord SR et al. Exercise for falls prevention in Parkinson disease: a randomized controlled trial. Neurology; 84(3): 304– 312. doi: 10.1212/ WNL.0000000000001155.
6. Qi Y, Takahashi N, Hileman SM et al. Adiponectin acts in the brain to decrease body weight. Nat Med 2004; 10(5): 524– 529. doi: 10.1038/ nm1029.
7. Iwabu M, Yamauchi T, Okada-Iwabu M et al. Adiponectin and AdipoR1 regulate PGC-1alpha and mitochondria by Ca(2+) and AMPK/ SIRT1. Nature 2010; 464(7293): 1313– 1319. doi: 10.1038/ nature08991.
8. Earhart GM, Falvo MJ. Parkinson disease and exercise. Compr Physiol 2013; 3(2): 833– 848. doi: 10.1002/ cphy.c100047.
9. Kusminski CM, McTernan PG, Schraw T et al. Adiponectin complexes in human cerebrospinal fluid: distinct complex distribution from serum. Diabetologia 2007; 50(3): 634– 642. doi: 10.1007/ s00125-006-0577-9.
10. Zhang D, Wang X, Lu XY. Adiponectin exerts neurotrophic effects on dendritic arborization, spinogenesis, and neurogenesis of the dentate gyrus of male mice. Endocrinology 2016; 157(7): 2853– 2869. doi: 10.1210/ en.2015-2078.
11. Biskup S, Gerlach M, Kupsch A et al. Genes associated with Parkinson syndrome. J Neurol 2008; 255 (Suppl 5): 8– 17. doi: 10.1007/ s00415-008-5005-2.
12. Xu Q, Park Y, Huang X et al. Physical activities and future risk of Parkinson disease. Neurology 2010; 75(4): 341– 348. doi: 10.1212/ WNL.0b013e3181ea1597.
13. Thacker EL, Chen H, Patel AV et al. Recreational physical activity and risk of Parkinson’s disease. Mov Disord 2008; 23(1): 69– 74. doi: 10.1002/ mds.21772.
14. Chen H, Zhang SM, Schwarzschild MA et al. Physical activity and the risk of Parkinson disease. Neurology 2005; 64(4): 664– 669. doi: 10.1212/ 01.WNL.0000151960.28687.93.
15. Yaffe K, Haan M, Blackwell T et al. Metabolic syndrome and cognitive decline in elderly latinos: findings from the Sacramento Area Latino Study of Aging Study. J Am Geriatr Soc 2007; 55(5): 758– 762. doi: 10.1111/ j.1532-5415.2007.01139.x.
16. Franceschi C. Inflammaging as a major characteristic of old people : can it be prevented or cured ? Nutr Rev 2007; 65 (12 Pt 2): S173– S176. doi: 10.1111/ j.1753-4887.2007.tb00358.x.
17. Kim TN, Choi KM. The implications of sarcopenia and sarcopenic obesity on cardiometabolic disease. J Cell Biochem 2015; 116(7): 1171– 1178. doi: 10.1002/ jcb.25077.
18. Kalinkovich A, Livshits G. Sarcopenic obesity or obese sarcopenie: a cross talk between age-associated adipose tissue and skeletal muscle inflammation as a main mechanism of the pathogenesis. Ageing Res Rev 2017; 35: 200– 221. doi: 10.1016/ j.arr.2016.09.008.
19. Sofic E, Lange KW, Jellinger K et al. Reduced and oxidized glutathione in the substantia nigra of patients with Parkinson disease. Neurosci Letters 1992; 142(2): 128– 130. doi: 10.1016/ 0304-3940(92)90355-b.
20. Banerjee R, Starkov AA, Beal MF et al. Biochimica et Biophysica Acta Mitochondrial dysfunction in the limelight of Parkinson disease pathogenesis. Biochim Biophys Acta 2009; 1792(7): 651– 663. doi: 10.1016/ j.bbadis.2008.11.007.
21. Biessels GJ, Reagan LP. Hippocampal insulin resistance and cognitive dysfunction. Nat Rev Neurosci 2015; 16(11): 660– 671. doi: 10.1038/ nrn4019.
22. Richter EA, Hargreaves M. Exercise, GLUT4 and skeletal muscle glucose uptake. Physiol Rev 2013; 93(3): 993– 1017. doi: 10.1152/ physrev.00038.2012.
23. Rowe GC, El-khoury R, Patten IS et al. PGC-1 a is Dispensable for exercise-induced mitochondrial biogenesis in skeletal muscle. PLOS One 2012; 7(7): e41817. doi: 10.1371/ journal.pone.0041817.
24. Kuroda K, Tatara K, Takatorige T et al. Effect of physical exercise on mortality in patients with Parkinson’s disease. Acta Neurol Scand 1992; 86(1): 55– 59. doi: 10.1111/ j.1600-0404.1992.tb08054.x.
25. Ahlskog JE. Does vigorous exercise have a neuroprotective effect in Parkinson disease? Neurology 2011; 77(3): 288– 294. doi: 10.1212/ WNL.0b013e318225ab66.
26. Lau YS, Patki G, Das’Panja K. Neuroprotective effects and mechanisms of exercise in a chronic mouse model of Parkinson’s disease with moderate neurodegeneration. Eur J Neurosci 2011; 33(7): 1264– 1274. doi: 10.1111/ j.1460-9568.2011.07626.x.
27. Schenkman M, Hall DA, Baron AE et al. Exercise for people in early- or mid-stage Parkinson disease: a 16-month randomized controlled trial. Phys Ther 2012; 92(11): 1395– 1410. doi: 10.2522/ ptj.20110472.
28. Miyai I, Fujimoto Y, Ueda Y et al. Treadmill training with body weight support: its effect on Parkinson’s disease. Arch Phys Med Rehabil 2000; 81(7): 849– 852. doi: 10.1053/ apmr.2000.4439.
29. Miyai I, Fujimoto Y, Yamamoto H et al. Long-term effect of body weight-supported treadmill training in Parkinson’s disease: a randomized controlled trial. Arch Phys Med Rehabil 2002; 83(10): 1370– 1373. doi: 10.1053/ apmr.2002.34603.
30. Ramazzina I, Bernazzoli B, Costantino C. Clinical interventions in aging dovepress systematic review on strength training in Parkinson’s disease: an unsolved question. Clin Interv Aging 2017; 12: 619– 628. doi: 10.2147/ CIA.S131903.
31. David FJ, Robichaud JA, Leurgans SE et al. Exercise improves cognition in Parkinson Disease: The PRET-PD randomized clinical trial. Mov Disord 2015; 30(12): 1657– 1663. doi: 10.1002/ mds.26291.
32. Prodoehl J, Rafferty M, David FJ et al. Two year exercise program improves physical function in Parkinson disease: the PRET-PD study. Neurorehabil Neural Repair 2015; 29(2): 112– 122. doi: 10.1177/ 1545968314539732.
33. Valls-Solé J, Pascual-Leone A, Brasil-Neto JP et al. Abnormal facilitation of the response to transcranial magnetic stimulation in patients with Parkinson’s disease. Neurology 1994; 44(4): 735– 741. doi: 10.1212/ wnl.44.4.735.
34. Carvalho A, Barbirato D, Araujo N et al. Comparison of strength training, aerobic training, and additional physical therapy as supplementary treatments for Parkinson’s disease: pilot study. Clin Interv Aging 2015; 10: 183– 191. doi: 10.2147/ CIA.S68779.
35. Cugusi L, Manca A, Dragone D et al. Nordic Walking for the management of people with Parkinson disease: a systematic review. PM R 2017; 9(11): 1157– 1166. doi: 10.1016/ j.pmrj.2017.06.021.
36. van Eijkeren FJ, Reijmers RS, Kleinveld MJ et al. Nordic walking improves mobility in Parkinson’s disease. Mov Disord 2008; 23(15): 2239– 2243. doi: 10.1002/ mds.22293.
37. Combs SA, Diehl MD, Chrzastowski C et al. Community-based group exercise for persons with Parkinson disease: a randomized controlled trial. NeuroRehabilitation 2013; 32(1): 117– 124. doi: 10.3233/ NRE-130828.
38. Duncan RP, Earhart GM. Randomized controlled trial of community-based dancing to modify disease progression in Parkinson disease. Neurorehabil Neural Repair 2012; 26(2): 132– 143. doi: 10.1177/ 1545968311421614.
39. McKee KE, Hackney ME. The effects of adapted tango on spatial cognition and disease severity in Parkinson’s disease. J Mot Behav 2013; 45(6): 519– 529. doi: 10.1080/ 00222895.2013.834288.
40. Hackney ME, Earhart GM. Effects of dance on movement control in Parkinson’s disease: a comparison of Argentine tango and American ballroom. J Rehabil Med 2009; 41(6): 475– 481. doi: 10.2340/ 16501977-0362.
41. Yang Y, Li X, Gong L et al. Tai Chi for improvement of motor function, balance and gait in Parkinson disease: a systematic review and meta-analyses. PLOS One 2014; 9(7): e102942. doi: 10.1371/ journal.pone.0102942.
42. Yang YR, Lee YY, Cheng SJ et al. Downhill walking training in individuals with Parkinson’s disease. Am J Phys Med Rehabil 2010; 89(9): 706– 714. doi: 10.1097/ PHM.0b013e3181e721c5.
43. Broeders M, Velseboer DC, de Bie R et al. Cognitive change in newly-diagnosed patients with Parkinson’s disease: a 5-year follow-up study. J Int Neuropsychol Soc 2013; 19(6): 695– 708. doi: 10.1017/ S1355617713000295.
44. Hely MA, Reid WG, Adena MA et al. The Sydney multicenter study of Parkinson’s disease: the inevitability of dementia at 20 years. Mov Disord 2008; 23(6): 837– 844. doi: 10.1002/ mds.21956.
45. Oguh O, Eisenstein A, Kwasny M et al. Back to the basics: regular exercise matters in Parkinson’s disease: results from the National Parkinson Foundation QII registry study. Park Relat Disord 2014; 20(11): 1221– 1225. doi: 10.1016/ j.parkreldis.2014.09.008.
46. Tanaka K, Quadros AC Jr, Santos RF et al. Benefits of physical exercise on executive functions in older people with Parkinson’s disease. Brain Cogn 2009; 69(2): 435– 441. doi: 10.1016/ j.bandc.2008.09.008.
47. Cruise KE, Bucks RS, Loftus AM et al. Exercise and Parkinson’s: benefits for cognition and quality of life. Acta Neurol Scand 2011; 123(1): 13– 19. doi: 10.1111/ j.1600-0404.2010.01338.x.
48. da Silva FC, Iop RD, de Oliveira LC et al. Effects of physical exercise programs on cognitive function in Parkinson’s disease patients: a systematic review of randomized controlled trials of the last 10 years. PLoS One 2018; 13(2): e0193113. doi: 10.1371/ journal.pone.0193113.
49. Nyberg J, Aberg MA, Schiöler L et al. Cardiovascular and cognitive fitness at age 18 and risk of early-onset dementia. Brain 2014; 137 (Pt 5): 1514– 1523. doi: 10.1093/ brain/ awu041.
50. Kandiah N, Zainal NH, Narasimhalu K et al. Hippocampal volume and white matter disease in the prediction of dementia in Parkinson’s disease. Parkinsonism Relat Disord 2014; 20(11): 1203– 1208. doi: 10.1016/ j.parkreldis.2014.08.024.
51. Erickson KI, Prakash RS, Voss MW et al. Aerobic fitness is associated with hippocampal volume in elderly humans. Hippocampus 2009; 19(10): 1030– 1039. doi: 10.1002/ hipo.20547, 10.1002/ hipo.20547.
52. Rodrigues de Paula F, Teixeira-Salmela LF, Coelho de Morais Faria CD et al. Impact of an exercise program on physical, emotional, and social aspects of quality of life of individuals with Parkinson’s disease. Mov Disord 2006; 21(8): 1073– 1077. doi: 10.1002/ mds.20763.
53. Elbers R, van Wegen EE, Rochester L et al. Is impact of fatigue an independent factor associated with physical activity in patients with idiopathic Parkinson’s disease? Mov Disord 2009; 24(10): 1512– 1518. doi: 10.1002/ mds.22664.
54. Riedel O, Klotsche J, Spottke A et al. Frequency of dementia, depression, and other neuropsychiatric symptoms in 1,449 outpatients with Parkinson’s disease. J Neurol 2010; 257(7): 1073– 1082. doi: 10.1007/ s00415-010-5465-z.
55. Kvam S, Kleppe CL, Nordhus IH et al. Exercise as a treatment for depression: a meta-analysis. J Affect Disord 2016; 202: 67– 86. doi: 10.1016/ j.jad.2016.03.063.
56. Gujral S, Aizenstein H, Reynolds CF et al. Exercise effects on depression: possible neural mechanisms. Gen Hosp Psychiatry 2017; 49: 2– 10. doi: 10.1016/ j.genhosppsych.2017.04.012.
57. Yuan TF, Paes F, Arias-Carrión O et al. Neural Mechanisms of exercise: anti-depression, neurogenesis, and serotonin signaling. CNS Neurol Disord Drug Targets 2015; 14(10): 1307– 1311. doi: 10.2174/ 1871527315666151111124402.
58. Wu P, Lee M, Huang T. Effectiveness of physical activity on patients with depression and Parkinson’ s disease : a systematic review. PLoS One 2017; 12(7): e0181515. doi: 10.1371/ journal.pone.0181515.
59. Krumpolec P, Vallova S, Slobodova L et al. Aerobic-strength exercise improves metabolism and clinical state in Parkinson’s disease patients. Front Neurol 2017; 8: 698. doi: 10.3389/ fneur.2017.00698.
60. Dereli EE, Yaliman A. Comparison of the effects of a physiotherapist- supervised exercise programme and a self-supervised exercise programme on quality of life in patients with Parkinson’ s disease. Clin Rehabil 2010; 24(4): 352– 362. doi: 10.1177/ 0269215509358933.
61. Ellis T, Latham NK, Deangelis TR et al. Feasibility of a virtual exercise coach to promote walking in community-dwelling persons with Parkinson Disease. Am J Phys Med Rehabil 2014; 92(6): 472– 485. doi: 10.1097/ PHM.0b013e31828cd466.
62. Ahlskog JE. Aerobic exercise: evidence for a direct brain effect to slow Parkinson disease progression. Mayo Clin Proc 2018; 93(3): 360– 372. doi: 10.1016/ j.mayocp.2017.12.015.
63. Alonso-Frech F, Sanahuja JJ, Rodriguez AM. Exercise and physical therapy in early management of Parkinson disease. Neurologist 2011; 17 (6 Suppl 1): S47– S53. doi: 10.1097/ NRL.0b013e31823968ec.
64. da Silva PG, Domingues DD, de Carvalho LA et al. Neurotrophic factors in Parkinson’s disease are regulated by exercise: evidence-based practice. J Neurol Sci 2016; 363: 5– 15. doi: 10.1016/ j.jns.2016.02.017.
65. Gerecke KM, Jiao Y, Pani A et al. Exercise protects against MPTP-induced neurotoxicity in mice. Brain Res 2010; 1341: 72– 83. doi: 10.1016/ j.brainres.2010.01.053.
66. Tillerson JL, Cohen AD, Caudle WM et al. Forced nonuse in unilateral parkinsonian rats exacerbates injury. J Neurosci 2002; 22(15): 6790– 6799. doi: 20026651.
67. Kordower JH, Bjorklund A. Trophic factor gene thera-py for Parkinson’s disease. Mov Disord 2013; 28(1): 96– 109. doi: 10.1002/ mds.25344.
68. Szuhany KL, Bugatti M, Otto MW. A meta-analytic review of the effects of exercise on brain-derived neurotrophic factor. J Psychiatr Res 2015; 60: 56– 64. doi: 10.1016/ j.jpsychires.2014.10.003.
69. Frazzitta G, Balbi P, Maestri R et al. The beneficial role of intensive exercise on Parkinson disease progression. Am J Phys Med Rehabil 2013; 92(6): 523– 532. doi: 10.1097/ PHM.0b013e31828cd254.
70. Marusiak J, Zeligowska E, Mencel J et al. Interval training-induced alleviation of rigidity and hypertonia in patients with Parkinson’s disease is accompanied by increased basal serum brain-derived neurotrophic factor: a repeated-measures, case series pilot study. J Rehabil Med 2015; 47(4): 372– 375. doi: 10.2340/ 16501977-1931.
71. Chauhan NB, Siegel GJ, Lee JM. Depletion of glial cell line-derived neurotrophic factor in substantia nigra neurons of Parkinson’s disease brain. J Chem Neuroanat 2001; 21(4): 277– 288. doi: 10.1016/ S0891-0618(01)00115-6.
72. Colcombe SJ, Kramer AF, Erickson KI et al. Cardiovascular fitness, cortical plasticity, and aging. Proc Natl Acad Sci 2004; 101(9): 3316– 3321. doi: 10.1073/ pnas.0400266101.
73. Cotman CW, Berchtold NC, Christie LA. Exercise builds brain health: key roles of growth factor cascades and inflammation. Trends Neurosci 2007; 30(9): 464– 472. doi: 10.1016/ j.tins.2007.06.011.
74. Marques-Aleixo I, Oliveira PJ, Moreira PI et al. Physical exercise as a possible strategy for brain protection: evidence from mitochondrial-mediated mechanisms. Prog Neurobiol 2012; 99(2): 149– 162. doi: 10.1016/ j.pneurobio.2012.08.002.
75. Difrancisco-Donoghue J, Lamberg EM, Rabin E et al. Effects of exercise and B vitamins on homocysteine and glutathione in Parkinson disease : a randomized trial. Neurodegenerative Dis 2012; 10(1– 4): 127– 134. doi: 10.1159/ 000333790.
76. Chennaoui M, Drogou C, Geoffroy H et al. Effects of exercise on brain and peripheral inflammatory biomarkers induced by total sleep deprivation in rats. J Inflamm 2015; 12: 56. doi: 10.1186/ s12950-015-0102-3.
77. Reuter I, Harder S, Engelhardt M et al. The effect of exercise on pharmacokinetics and pharmacodynamics of levodopa. Mov Disord 2000; 15(5): 862– 868. doi: 10.1002/ 1531.
78. van Kessel SP, Frye AK, El-Gendy AO et al. Gut bacterial tyrosine decarboxylases restrict levels of levodopa in the treatment of Parkinson disease. Nat Commun; 10(1): 310. doi: 10.1038/ s41467-019-08294-y.
79. Frazzitta G, Bertotti G, Morelli M et al. Rehabilitation improves dyskinesias in Parkinsonian patients : a pilot study comparing two different rehabilitative treatments. Neurorehabilitation 2012; 30(4): 295– 301. doi: 10.3233/ NRE-2012-0758.
80. Pedersen BK, Saltin B. Exercise as medicine – evidence for prescribing exercise as therapy in 26 different chronic diseases. Scand J Med Sci Sport 2015; 25 (Suppl 3): 1– 72. doi: 10.1111/ sms.12581.
81. Fisher BE, Wu AD, Salem GJ et al. The effect of exercise training in improving motor performance and corticomotor excitability in people with early Parkinson’s disease. Arch Phys Med Rehabil 2008; 89(7): 1221– 1229. doi: 10.1016/ j.apmr.2008.01.013.
82. Keus S, Munneke M, Graziano M et al. European Physiotherapy Guideline for Parkinson’ s Disease. Mov Disord 2013; 28 (Suppl 1): 1077
83. Matsumoto Y, Yanase D, Noguchi-Shinohara Met al. Blood-brain barrier permeability correlates with medial temporal lobe atrophy but not with amyloid-beta protein transport across the blood-brain barrier in Alzheimer’s disease. Dement Geriatr Cogn Disord 2007; 23(4): 241– 245. doi: 10.1159/ 000100019.
84. Gallo PM, Mendola NM. Exercise prescription recom-mendations for Parkinson’ s disease. Strength Cond J 2018; 40(5): 126– 133. doi: 10.1519/ SSC.0000000000000415.
85. American college of Sports Medicine. ACSM‘s guidelines for exercise testing and prescription. 9th ed. Philadelphia: Lippincott Williams & Wilkins 2014.
Štítky
Detská neurológia Neurochirurgia NeurológiaČlánok vyšiel v časopise
Česká a slovenská neurologie a neurochirurgie

2019 Číslo 5
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
Najčítanejšie v tomto čísle
- Léčba nespavosti při neuropatické bolesti
- Kompresivní neuropatie jako nemoc z povolání
- Změna struktury paraspinálních svalů u pacientů s chronickými nespecifickými bolestmi dolní části zad
- Endoskopické operace výhřezu bederních meziobratlových plotének – první zkušenosti
