-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Chirurgická léčba mozkových metastáz
Surgical treatment of brain metastases
Brain metastases are serious complication of cancer. Progress in brain imaging, intraoperative electrophysiological monitoring and neurosurgical equipment have increased the extent of the resection and safety of neurosurgical operations while reducing mortality and morbidity. Surgical resection is still the first considered therapeutic option. It is especially recommended for patients with solitary cerebral metastasis in accessible localization, in good clinical conditions and with favourable prognosis. It is relatively contraindicated in the case of uncontrolled cancer disease, poor clinical conditions, in the case of radiosensitive tumours, poor disease prognosis and presence of more than three cerebral metastases. Surgical therapy for two or three metastases is also possible, but its role may be questionable in some aspects. General recommendations are not clearly defined in the case of recurrent metastases as well, and individual assessment is preferred based on the evaluation of the number of prognostic factors.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Keywords:
resection – surgical treatment – Brain metastasis
Autori: V. Vybíhal 1
; M. Smrčka 1; I. Rošková 1; T. Kazda 2; A. Šprláková-Puková 3; J. Šána 4; O. Slabý 4; M. Večeřa 4; L. Křen 5; P. Fadrus 1
Pôsobisko autorov: Neurochirurgická klinika, LF MU a FN Brno ; Klinika radiační onkologie LF MU, a Masarykův onkologický ústav, Brno 2; Klinika radiologie a nukleární medicíny, LF MU a FN Brno 3; Středoevropský technologický institut, MU, Brno 4; Ústav patologie, LF MU a FN Brno 5
Vyšlo v časopise: Cesk Slov Neurol N 2020; 83(2): 156-165
Kategória: Přehledný referát
doi: https://doi.org/10.14735/amcsnn2020157Súhrn
Mozkové metastázy jsou závažnou komplikací nádorového onemocnění. Díky pokroku v zobrazovacích metodách mozku, peroperačním elektrofyziologickém monitorování a přístrojovém vybavení došlo ke zvýšení radikality a bezpečnosti jejich chirurgické resekce současně se snížením jejich mortality a morbidity. Chirurgická resekce je stále první zvažovanou terapeutickou možností. Je doporučována především pro pacienty se solitární mozkovou metastázou v přístupné lokalizaci, v dobrém klinickém stavu a příznivou prognózou. Relativně kontraindikována je v případě nekontrolovaného nádorového onemocnění, špatného klinického stavu, v případě radiosenzitivních nádorů, špatné prognózy onemocnění a přítomnosti více než tří mozkových metastáz. Chirurgická terapie u dvou nebo tří metastáz je také možná, ale její role může být v některých aspektech diskutabilní. Stejně tak je tomu v případě rekurentních metastáz, kde obecná doporučení nejsou jednoznačně definována a preferuje se individuální posouzení na základě řady prognostických faktorů.
Klíčová slova:
mozková metastáza – resekce – chirurgická terapie
Úvod
Mozkové metastázy (MM) jsou závažnou komplikací zhoubného nádorového onemocnění. Vyskytují se u 20–40 % pacientů s diagnostikovaným nádorovým onemocněním, z nichž asi 20 % kvůli MM umírá [1]. Jejich zvyšující se incidence je dána zdokonalováním diagnostiky a komplexní léčby nádorových onemocnění. Díky zlepšování onkologické terapie stouplo 5leté přežití u všech nádorů z 50 % v letech 1974–1976 na 70 % mezi lety 2000 a 2008 [2]. Biologická léčba se rovněž podílí na prodloužení přežití, ale tyto preparáty nejsou schopny penetrovat hematoencefalickou bariérou, což je příčinou vzniku mikrometastáz v mozku [3]. V 10 % jsou MM prvním projevem nádorového onemocnění [4].
V 70. letech 20. století bez jakékoli léčby přežívali pacienti s MM přibližně 1 měsíc [5,6] a při užívání steroidů 2 měsíce [7]. Zavedení radioterapie u těchto pacientů, nejčastěji ozářením celého mozku (whole-brain radiotherapy; WBRT) od poloviny 50. let 20. století prodloužilo přežití na 3–6 měsíců [5,6].
V 80. letech 20. století řada retrospektivních studií prokázala prodloužení přežití po neurochirurgické resekci, zejména u pacientů s jednou MM v anatomicky přístupné lokalizaci, v dobrém klinickém stavu a stabilním onkologickým onemocněním [8–10]. Významným mezníkem pak byly randomizované studie, které ukázaly lepší výsledky u pacientů po chirurgické resekci spolu s WBRT než po WBRT samotné [11,12].
Pokrok v moderních zobrazovacích metodách mozku, především MR (umožňující zobrazení nervových drah nebo funkčně důležitých oblastí mozku – obr. 1) vč. možnosti intraoperačního zobrazení (peroperační MR, peroperační UZ), stejně tak jako elektrofyziologické monitorování a přístrojové vybavení (zejména neuronavigace) pomohly zvýšit radikalitu a bezpečnost neurochirurgických operací a současně i snížit jejich morbiditu a mortalitu [4,13–16].
Obr. 1. MR traktografie zobrazující vztah optické (zelená) a pyramidové (modrá) dráhy k metastatickému ložisku při předoperačním plánování resekčního výkonu.
Fig. 1. MR tractography showing the relationship of the optic (green) and pyramidal (blue) tracts to the metastatic lesion during preoperative planning of resection.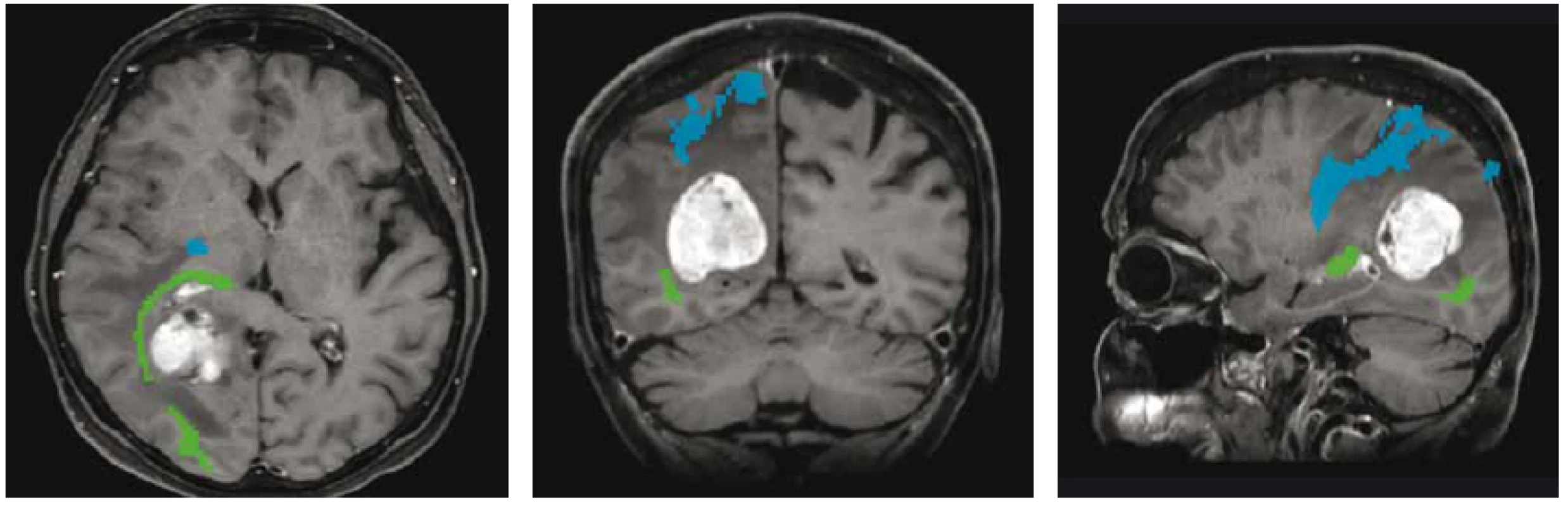
Patofyziologie
Do mozku nejčastěji metastázují nádory plic, prsu, maligní melanom anebo Grawitzův tumor. Tyto histologické typy představují asi tři čtvrtiny všech typů MM [17]. MM jako sekundární typ nádoru je vůbec nejčastějším nitrolebním nádorem. Tendence k metastazování do mozku je největší u maligního melanomu (50 %), karcinomu plic a prsu (obojí 25 %), ledvin (10 %) a u kolorektálního karcinomu (5 %). Metastatické buňky nejprve musí opustit primární tumor, dostat se do cévního systému a dále až do mozkových kapilár (nejčastěji v povodí arteria cerebri media), kde se zachytí a proliferací pak vytvoří vlastní metastázu [18,19]. V tomto procesu hraje zásadní roli tzv. nádorové mikroprostředí tvořené buněčnou i nebuněčnou složkou [20].
V typickém případě se tedy metastázy nacházejí subkortikálně, často mívají mezi sebou a povrchem mozku ještě několik milimetrů mozkové tkáně [21]. Další lokalizace MM jsou sice o něco méně časté (mozeček, středočárové struktury, mozkový kmen, hypofýza), ale také se vyskytují. Metastáza systémového onemocnění do mozku má obvykle jiný charakter než primární mozkové nádory. Má charakter té tkáně, ze které pochází, a v polovině případů, bývá ohraničená [22]. Nejasné hranice bývají v případech, kdy nádorové buňky infiltrují okolní tkáň nebo pronikají do okolí podél cév [23].
Indikace chirurgické léčby mozkových metastáz
Cílem chirurgické terapie je zlepšení kvality života (zejména neurologických funkcí), prodloužení přežití a snížení mortality vázané na postižení mozku. Jedná se sice o nejvíce invazivní metodu, ale dochází zde k bezprostřednímu odstranění nádorových hmot, redukci tlakového působení na okolní tkáň s uvolněním komprimovaných nervových struktur a funkčních oblastí mozku, obnovení fyziologické cirkulace mozkomíšního moku (především u MM v zadní jámě lební), snížení nitrolební hypertenze a mozkového edému (možnost redukce dávek dexametazonu) a také snížení epileptické aktivity mozku. Významným přínosem chirurgického řešení je i to, že získáme nádorovou tkáň k neuropatologickému vyšetření [4].
Indikace operace MM vychází z nálezu na zobrazovacích metodách – hlavně MR (počet, lokalizace a velikost MM), neurologického a celkového stavu pacienta a stavu základního onkologického onemocnění. Chirurgická resekce je doporučována především pro pacienty se solitární MM v přístupné lokalizaci, zejména pokud je velká a působí tlakem na okolní struktury nebo zapříčiňuje obstrukční hydrocefalus, pacient je v dobrém klinickém stavu, funkčně nezávislý (popřípadě je předpoklad úpravy neurologického deficitu po operaci) s nepřítomným nebo stabilním systémovým onemocněním, předpokládaným přežitím 3 a více měsíců a je schopen výkonu v celkové anestézii [24].
Resekce není obecně doporučována u relativně radiosenzitivních tumorů, jakými jsou malobuněčný karcinom plic, germinální tumory, leukémie nebo lymfomy [25]. Výjimečně lze o operačním řešení uvažovat v případě život ohrožující intrakraniální hypertenze. Naopak maligní melanom, Grawitzův tumor nebo sarkomy (ty však tvoří MM výjimečně) jsou výrazně chemo-i radiorezistentní a exstirpace MM je vlastně jediná efektivní možnost [4].
Kontraindikací chirurgické terapie je přítomnost progredujícího onkologického onemocnění a jeho špatná prognóza, přítomnost mnohočetných MM (4 a více lézí), špatný klinický stav bez předpokladu jeho zlepšení po operaci nebo nepříznivá anatomická lokalizace MM (mozkový kmen, bazální ganglia a talamus). V těchto lokalizacích při nejasném nálezu na zobrazovacích metodách může být indikována např. stereotaktická biopsie (např. z talamu) nebo i otevřená biopsie (např. z oblasti mozkového kmene) [26]. Existence extracerebrálních metastáz nemusí být jednoznačnou kontraindikací operace, pokud jejich přítomnost je známa před operačním řešením MM a jsou stabilní. Progredující neurologický deficit s poruchou vědomí nemusejí znamenat kontraindikaci operační léčby MM a jejich resekce může být v tomto případě život zachraňujícím výkonem. Akutní operace může být indikována pro progredující neurologický deficit vzniklý např. u intracerebrálního krvácení z MM, které se vyskytuje častěji u maligních melanomů nebo renálního karcinomu [27]. Bohužel některé studie ukazují na horší výsledky operací u pacientů, kteří měli před operací výraznější neurologický deficit [28]. V případě záchytu MM a primárního tumoru v krátkém časovém intervalu bývá většinou pacient akutně ohrožen mozkovou lézí. Operaci v těchto případech indikujeme za předpokladu, že bude následovat onkologická léčba. U pacientů s onkologickou anamnézou nemusí vždy zjištěná léze mozku být MM, ale může se jednat o primární mozkový nádor, popřípadě o neonkologickou diagnózu [29].
Radiochirurgii lze využít k terapii jak radiosenzitivních (např. germinom nebo malobuněčný karcinom), tak i radiorezistentních tumorů (např. maligní melanom, renální karcinom nebo sarkom), jejichž rozměry nepřesahují 3 cm a není zde výraznější edém mozku. Jedná se o neinvazivní metodu (pomineme-li nasazení stereotaktického rámu), a proto ji lze využít u pacientů, u kterých jsou operační zátěž a riziko příliš vysoké. Zvažováni jsou pacienti s chirurgicky nepřístupnou lézí, s aktivním systémovým onemocněním nebo s výraznými komorbiditami [30]. S výhodou ji lze využít u malých, hluboko lokalizovaných lézí nebo v elokventních (funkčně důležitých) oblastech. Preferována je také u vícečetných MM. Podle studie Yamamota et al bylo dosaženo stejných výsledků u pacientů se 2–4 a 5–10 MM v celkové době přežití stejně jako v lokální kontrole onemocnění [31]. Tento trend je vidět v pracích zabývajících se touto problematikou a dokonce někteří autoři doporučují i ošetření více než 10 metastáz, pokud jejich celkový objem nepřevyšuje 25 ml [32]. Nevýhodou je, že radiochirurgie neredukuje mass efect a indukuje regresivní změny, jako jsou hemoragie, perifokální edém a radionekróza. Rozlišení radionekrózy od recidivy může být někdy obtížné. Je zde nižší stupeň lokální kontroly než u resekcí [13,33]. Lokální kontrola je ovlivněna histologickým typem, aplikovanou dávkou a velikostí metastázy [34]. Udává se přibližně mezi 70–90 % [35]. Některé MM mohou mít i cystický charakter a zde radiochirurgická léčba není vhodná [36].
Při radiochirurgii je aplikována celá dávka jednorázově. V případě jejího rozdělení do několika frakcí pak hovoříme o stereotaktické radioterapii. Frakcionace snižuje nežádoucí účinky ozáření na normální tkáň při zachování kontroly nádorového onemocnění. Využívá se při větším rozsahu tumoru nebo pokud je MM v blízkosti funkčně důležitých struktur [37]. Lokální kontrola za 12 měsíců po ozáření se v literatuře uvádí 49–96 % [38].
Metoda WBRT je používána, když MM není vhodná pro chirurgii či radiochirurgii. Přežití v tomto případě bývá v průměru 3–6 měsíců. Rozdíly v dávkování, časování a frakcionaci nemají zásadní vliv na přežití [39,40]. Její nevýhodou je vysoká toxicita pro mozek, která způsobuje zhoršení kognice, učení a paměťových funkcí [41,42]. Více evidentní to bývá u déle přežívajících [43]. V prospektivní randomizované studii srovnávající samotnou resekci a resekci v kombinaci s WBRT byla rekurence menší u kombinované terapie než u resekce samotné v původním ložisku (10 vs. 46 %), ale i ve vzdálenějších oblastech (14 vs. 37 %) [11]. Rovněž ve skupině bez WBRT byly kratší čas rekurence a vyšší procento smrti z neurologických příčin (14 vs. 44 %). Slabou stránkou studie je fakt, že většina pacientů měla relativně radiosenzitivní nádory. Podobně bylo lepších výsledků dosaženo v kombinaci stereotaktické radiochirurgie a WBRT než WBRT samotné [44]. WBRT nesnižuje mortalitu, proto její rutinní použití v současnosti není doporučováno vzhledem k vysoké toxicitě pro mozkovou tkáň [29]. Samotná WBRT je indikována v případě čtyř a více lézí u pacientů ve špatném klinickém stavu a předpokladem krátkého přežití. V poslední době se do popředí dostávají i další metody radioterapie – WBRT a simultánní integrovaný boost (WBRT s navýšením dávky v oblasti metastázy), HA-WBRT (hipokampus šetřící WBRT) nebo kombinace těchto technik, tj. HA-WBRT a simultánní integrovaný boost. Možná je i cílená frakcionovaná terapie. Důvodem zavedení těchto moderních technik bylo omezení nežádoucích účinků spojených s použitím WBRT.
Chemoterapie u MM má význam pouze u určitých chemosenzitivních druhů primárních nádorů, jakými jsou např. malobuněčný karcinom plic, popřípadě karcinom prsu či nemalobuněčný karcinom plic (ty již reagují významně méně na terapii než malobuněčný karcinom plic) [45].
Cílená terapie je indikována za specifických okolností, např. u nemalobuněčného karcinomu plic v případě nadměrné exprese epiteliálního růstového faktoru potlačením jeho aktivity nebo u mutace anaplastické lymfomové kinázy její inhibicí [46]. U nádorů prsu s pozitivním nálezem receptoru 2 pro lidský epidermální růstový faktor je možná terapie humanizovanou monoklonální protilátkou [45].
Prognóza a prognostické faktory
Mozkové metastázy představují heterogenní skupinu s různou odpovědí na léčbu a délkou přežití. Střední přežití pacientů s MM je špatné a téměř polovina těchto pacientů umírá na systémové onemocnění [47]. Mezi pozitivní prognostické faktory patří dobrý celkový stav (Karnofsky Performance Status [KPS] > 70), dobrý neurologický stav, mladý věk, kontrolovaný primární nádor, absence extrakraniálních metastáz, přítomnost solitární MM, delší interval mezi diagnózou primárního nádoru a vzniku MM [48]. Je třeba brát v úvahu i fakt, že KPS předoperačně může být ovlivněno reverzibilními patologickými podmínkami (edém mozku, nitrolební hypertenze, neurologický deficit). S využitím těchto faktorů bylo stanoveno několik prognostických ukazatelů (tab. 1). K nnejznámějším prognostickým ukazatelům patří tzv. RPA (Recursive Partitioning Analysis) (tab. 2), GPA (Graded Prognostic Assesment) (tab. 3) nebo DS-GPA (Disease specific – Graded Prognostic Assesment) (tab. 4). Prognostické škály mají také důležitou roli v selekci, stratifikaci a též v případné randomizaci v rámci klinických studií [49].
Tab. 1. Prognostické skóre u mozkových metastáz. Upraveno podle [49]. RPA byla zavedena Gasparem et al v roce 1997. Pacienti byli rozděleni do tří skupin podle KPS, věku, kontrolovaného primárního onemocnění a extrakraniálních projevů nemoci. Pacienti s KPS ≥ 70, mladší 65 let, s kontrolovaným primárním onemocněním a bez dalších extrakraniálních metastáz byli ve skupině I a měli nejlepší prognózu (medián přežití 7,1 měsíce). Ve III. skupině byli pacienti s KPS < 70 (přežití 2,3 měsíce) a zbylí pacienti ve II. skupině (medián přežití 4,2 měsíce). RS bylo zavedeno na základě zkušeností jednoho centra Lagerwaardem et al v roce 1999. I když statisticky signifi kantní výsledky byly shledány u věku, KPS, kontrolovaného primárního onemocnění a extrakraniálních projevů nemoci, odpovědi na steroidy, hladiny laktátdehydrogenázy, pohlaví a lokalizace primárního nádoru, do skórovacího skóre byl použit pouze klinický stav pacienta podle ECOG, extrakraniální projev nemoci a odpověď na steroidy. Posledně jmenovaná položka byla pak limitem širšího použití této škály. SIR byl zaveden v roce 2000 Weltmanem et al. Pracuje se šesti proměnnými (věk, KPS, kontrolované primární onemocnění, přítomnost extrakraniálních metastáz, počet a objem mozkových metastáz). Podrobné zpracování potřebné k posouzení systémového onemocnění omezilo široké rozšíření tohoto prognostického indexu. Základní skóre pro mozkové metastázy BSBM bylo zavedeno v roce 2004 Lorenzonim et al. Používá stejné parametry jako RPA kromě věku. Je jednoduché s podobnou predikcí prognózy. GPA škála byla zavedena v roce 2007 Sperdutem et al. Kromě věku, KPS a přítomnosti extrakraniálních metastáz zahrnuje do výpočtu i počet metastáz. Jedná se o jednoduchou škálu, která je často používána. Vzhledem k tomu, že prognóza je závislá také na typu primárního nádoru, byla škála později rozšířena o tuto položku jako Ds-GPA. Skóre je možno spočítat na webových stránkách [69], kde je také uvedeno přibližné přežití pacienta. ![Prognostické skóre u mozkových metastáz. Upraveno podle [49].
RPA byla zavedena Gasparem et al v roce 1997. Pacienti byli rozděleni do tří skupin podle KPS, věku, kontrolovaného primárního onemocnění
a extrakraniálních projevů nemoci. Pacienti s KPS ≥ 70, mladší 65 let, s kontrolovaným primárním onemocněním a bez dalších extrakraniálních
metastáz byli ve skupině I a měli nejlepší prognózu (medián přežití 7,1 měsíce). Ve III. skupině byli pacienti s KPS < 70 (přežití
2,3 měsíce) a zbylí pacienti ve II. skupině (medián přežití 4,2 měsíce).
RS bylo zavedeno na základě zkušeností jednoho centra Lagerwaardem et al v roce 1999. I když statisticky signifi kantní výsledky byly shledány
u věku, KPS, kontrolovaného primárního onemocnění a extrakraniálních projevů nemoci, odpovědi na steroidy, hladiny laktátdehydrogenázy,
pohlaví a lokalizace primárního nádoru, do skórovacího skóre byl použit pouze klinický stav pacienta podle ECOG, extrakraniální
projev nemoci a odpověď na steroidy. Posledně jmenovaná položka byla pak limitem širšího použití této škály.
SIR byl zaveden v roce 2000 Weltmanem et al. Pracuje se šesti proměnnými (věk, KPS, kontrolované primární onemocnění, přítomnost extrakraniálních
metastáz, počet a objem mozkových metastáz). Podrobné zpracování potřebné k posouzení systémového onemocnění
omezilo široké rozšíření tohoto prognostického indexu.
Základní skóre pro mozkové metastázy BSBM bylo zavedeno v roce 2004 Lorenzonim et al. Používá stejné parametry jako RPA kromě věku.
Je jednoduché s podobnou predikcí prognózy.
GPA škála byla zavedena v roce 2007 Sperdutem et al. Kromě věku, KPS a přítomnosti extrakraniálních metastáz zahrnuje do výpočtu i počet
metastáz. Jedná se o jednoduchou škálu, která je často používána. Vzhledem k tomu, že prognóza je závislá také na typu primárního
nádoru, byla škála později rozšířena o tuto položku jako Ds-GPA.
Skóre je možno spočítat na webových stránkách [69], kde je také uvedeno přibližné přežití pacienta.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/dd1215b31b49ab424bcab0656eb2c6bc.png)
BSBM – Basic Score for Brain Metastases; Ds-GPA – disease specifi c GPA; ECOG – Eastern Cooperative Oncology Group; GPA – Graded Prognostic Assesment; KPS – Karnofsky Performance Status; RPA – Recursive Partitioning Analysis; RS – Rotterdam skóre; SIR – Score Index for Radiosurgery Tab. 2. Recursive Partitioning Analysis (RPA). Upraveno podle [70]. RPA škála rozděluje pacienty do tří skupin podle KPS, věku, stavu primárního nádorového onemocnění a přítomnosti extrakraniálních metastáz. ![Recursive Partitioning Analysis (RPA). Upraveno podle [70].
RPA škála rozděluje pacienty do tří skupin podle KPS, věku, stavu primárního nádorového onemocnění a přítomnosti extrakraniálních
metastáz.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/a4d1785fddcf13ae04200591d9e7be32.png)
KPS – Karnofsky Performance Status Tab. 3. Graded Prognostic Assesment (GPA). Upraveno podle [71]. GPA skóre využívající věk, KPS, počet metastáz a přítomnosti extrakraniálních metastáz ke stanovení 4 skupin pacientů s rozdílným mediánem přežití. ![Graded Prognostic Assesment (GPA). Upraveno podle [71].
GPA skóre využívající věk, KPS, počet metastáz a přítomnosti extrakraniálních metastáz ke stanovení 4 skupin pacientů s rozdílným mediánem
přežití.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/0dfadcdcfac1300fc650ad98bf103786.png)
KPS – Karnofsky Performance Status Tab. 4. Diagnosis-Specifi c Graded Prognostic Assesment score (DS-GPA). Upraveno podle [72]. DS-GPA skóre je závislé na typu primárního nádoru. Body jsou přidělovány podle věku, KPS, podtypu primárního nádoru (pouze u karciomu prsu), počtu metastáz a přítomnosti extrakraniálních metastáz. Prognostické faktory, se kterými se kalkuluje, jsou používané rozdílně u jednotlivých typů primárního nádoru. Přežití pacienta je závislé nejen na počtu bodů dosažených v GPA skóre, ale také na typu primárního nádoru. ![Diagnosis-Specifi c Graded Prognostic Assesment score (DS-GPA). Upraveno podle [72].
DS-GPA skóre je závislé na typu primárního nádoru. Body jsou přidělovány podle věku, KPS, podtypu primárního nádoru (pouze u karciomu
prsu), počtu metastáz a přítomnosti extrakraniálních metastáz. Prognostické faktory, se kterými se kalkuluje, jsou používané rozdílně
u jednotlivých typů primárního nádoru. Přežití pacienta je závislé nejen na počtu bodů dosažených v GPA skóre, ale také na typu
primárního nádoru.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/3f3a2c83c0b425c99cd56db7bf7209a5.png)
GIT – gastrointestinální trakt; KPS – Karnofsky Performance Status; NSCLC – nemalobuněční karcinom plic; SCLC – malobuněčný karcinom plic Specifický index pro chirurgické pacienty neexistuje. Slabinou prognostických skórovacích systémů je, že nejsou brány v potaz neurologický stav pacienta a výsledek histologie (kromě DS-GPA). Neurologickým stavem po operaci metastáz se zabývali Schödel et al. U většiny pacientů došlo k signifikantnímu zlepšení neurologického stavu nezávisle na RPA klasifikaci při nízké mortalitě a morbiditě [50]. Leptomeningeální diseminace má velmi špatnou prognózu pro nedostatek léčebných možností [51].
Solitární metastáza
Pacienti se solitární MM jsou nejlepší kandidáti chirurgického řešení (tab. 5). Typickou indikací jsou operace pacientů mladšího věku s objemnou solitární MM (> 3 cm průměru na vyšetření MR) se stabilní nemocí nebo neznámým primárním zdrojem [11,12]. U malé solitární MM lze uvažovat i o radiochirurgickém řešení, zvláště u starších pacientů a u těch, kde je primární origo známo [29,52,53]. Pokud jsou ale doprovázeny velkým kolaterálním edémem a expanzivitou, je vhodnější operační řešení.
Tab. 5. Management nově diagnostikované solitární mozkové metastázy. Upraveno podle [40]. Management nově diagnostikované mozkové metastázy závisí na předpokládané době přežití. U pacientů s dobrou prognózou (přežití ≥ 3 měsíce) je možné zvažovat resekční výkon u metastáz > 3–4 cm nebo v případě menších ložisek radiochirurgii. Tyto výkony je možné doplnit o radioterapii, která může být použita také jako samostatná léčebná modalita v případě nemožnosti provedení resekčního výkonu. V radioterapii je možno použít WBRT nebo některou z moderních technik, např. radioterapie s modulovanou intenzitou šetřící oblast hipokampu nebo simultánní integrovaný boost. U pacientů se špatnou prognózou je indikována WBRT nebo pouze paliativní terapie. ![Management nově diagnostikované solitární mozkové metastázy. Upraveno podle [40].
Management nově diagnostikované mozkové metastázy závisí na předpokládané době přežití. U pacientů s dobrou prognózou (přežití
≥ 3 měsíce) je možné zvažovat resekční výkon u metastáz > 3–4 cm nebo v případě menších ložisek radiochirurgii. Tyto výkony je
možné doplnit o radioterapii, která může být použita také jako samostatná léčebná modalita v případě nemožnosti provedení resekčního
výkonu. V radioterapii je možno použít WBRT nebo některou z moderních technik, např. radioterapie s modulovanou intenzitou
šetřící oblast hipokampu nebo simultánní integrovaný boost. U pacientů se špatnou prognózou je indikována WBRT nebo pouze paliativní
terapie.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/fc874d1760b3043e646af18cb50441b6.png)
RT – radioterapie; WBRT – radioterapie celého mozku Mnohočetné metastázy
Role chirurgické terapie u vícečetných MM je kontroverzní a neexistují dosud žádné randomizované studie (tab. 6) [4]. Podle Paeka et al chirurgická resekce dominantní léze při celkovém počtu dvou nebo tří MM společně s WBRT má srovnatelnou dobu přežití, jakou vídáme u solitární MM [54]. K podobným výsledkům dospěla i studie Bindala et al, kde bylo stejné přežití v délce 14 měsíců u pacientů s odstraněním všech lézí (maximem byly tři ložiska) a u resekce solitární léze [13]. Rozdíl ve výsledcích u pacientů se solitární a vícečetnými MM nebyl shledán také v dalších studiích [55,56].
Tab. 6. Management nově diagnostikovaných vícečetných mozkových metastáz. Upraveno podle [40]. Management nově diagnostikovaných vícečetných mozkových metastáz závisí na předpokládané době přežití. U pacientů s dobrou prognózou (přežití ≥ 3 měsíce) je možné zvažovat resekční výkon u metastáz > než 3–4 cm nebo v případě menších ložisek radiochirurgii. Tyto výkony je možné doplnit o radioterapii, která může být použita také jako samostatná léčebná modalita. V radioterapii je možno použít WBRT nebo některou z moderních technik, např. radioterapie s modulovanou intenzitou šetřící oblast hipokampu nebo simultánní integrovaný boost. U pacientů se špatnou prognózou je indikována WBRT nebo pouze paliativní terapie. ![Management nově diagnostikovaných vícečetných mozkových metastáz. Upraveno podle [40].
Management nově diagnostikovaných vícečetných mozkových metastáz závisí na předpokládané době přežití. U pacientů s dobrou
prognózou (přežití ≥ 3 měsíce) je možné zvažovat resekční výkon u metastáz > než 3–4 cm nebo v případě menších ložisek radiochirurgii.
Tyto výkony je možné doplnit o radioterapii, která může být použita také jako samostatná léčebná modalita. V radioterapii je možno
použít WBRT nebo některou z moderních technik, např. radioterapie s modulovanou intenzitou šetřící oblast hipokampu nebo simultánní
integrovaný boost. U pacientů se špatnou prognózou je indikována WBRT nebo pouze paliativní terapie.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/bff2f0b62b2a5da599f51aa086965a83.png)
RT – radioterapie; WBRT – radioterapie celého mozku Mezi pacienty se dvěma nebo třemi MM mají pacienti s totální resekcí všech přítomných MM stejnou prognózu a dokonce stejné množství komplikací jako pacienti po resekci solitární MM [13]. Při rozhodování hrají roli také uložení MM, jejich dosažitelnost v rámci jednoho operačního přístupu nebo naopak nutnost provést dvě nebo tři kraniotomie. Pokud se rozhodneme odstranit např. dvě od sebe vzdálené MM ze dvou kraniotomií, musíme také naplánovat, zda výkony provedeme v jedné narkóze nebo s určitým časovým odstupem. Pak je otázkou, zda v některých případech není namístě dvoudobá operace. To v mezidobí umožní posoudit klinický stav pacienta a ubezpečit se o správnosti indikace další operace nebo naopak rezignovat na chirurgické řešení a volit radiochirurgický výkon [57]. Vždy musíme zvažovat nejen technické aspekty exstirpace, ale také celkový stav pacienta. Možný je také kombinovaný přístup, kdy některou MM odstraníme chirurgicky a další (např. malou, hluboko nebo elokventně uloženou) ozáříme radiochirurgicky [58]. Tyto spíše výjimečné indikace jsou rezervovány hlavně pro mladší pacienty se stabilní nebo neznámou primární nemocí. Vícečetné léze (> 3) nejsou považovány za chirurgicky léčitelné [31].
Rekurentní metastázy
Doporučení ohledně chirurgické terapie rekurentních MM nejsou v literatuře přesněji formulována. Preferuje se individualizovaná léčba na základě funkčního stavu pacienta, rozsahu onkologického onemocnění, objemu a počtu MM, zda je recidiva v resekované oblasti nebo na jiném místě, typu primárního nádoru, popřípadě zařazení do klinické studie. Obecně je reoperace zvažována u pacientů s přístupnou lézí, mladšího věku, v dobrém klinickém stavu, stabilním extrakraniálním onemocněním a s recidivou po více jak 6 měsících [59]. U pacientů, kteří podstoupili chirurgickou resekci u recidivujících nebo progredujících MM, bylo přežití 8,9–11,5 měsíců [13].
Ve studii týkající se rekurentních MM u plicních nádorů bylo prokázáno signifikantní funkční zlepšení a lepší kvalita života i přes očekávané krátké přežití. Interval mezi diagnózou primárního tumoru a MM a interval mezi první a recidivující MM byly signifikantně asociovány s přežitím [14].
Operační technika
Z chirurgického hlediska je u MM výhodou jejich relativní ohraničenost. Přístup k MM musí především respektovat její anatomické uložení. Standardně je využívána neuronavigace k přesnému zacílení ložiska. Intraoperačně lze MM zobrazit pomocí UZ nebo podle MR. K rozlišení MM od mozkové tkáně v případě invazivního charakteru během operace lze využít i fluorescenční zobrazení (fluorescein), které má dle jedné studie senzitivitu až 90 % [60], u další studie až 95 % [61]. Při použití 5-aminolevulové kyseliny se rozlišovalo již menší procento MM (62 %) [62].
Elektrofyziologický intraoperační monitoring a předoperační funkční MR nebo traktografie umožňují relativně bezpečnou exstirpaci MM i v tzv. elokventních oblastech mozku, v blízkosti motorického nebo řečového centra [63]. Někteří autoři doporučují v těchto oblastech provedení tzv. awake kraniotomie (operace s bdělou fází) [64].
Vlastní exstirpaci MM provádíme pokud možno metodou „en bloc“ disekce s využitím gliální pseudokapsuly. Tento postup jednak umožňuje dosažení kompletní resekce a jednak minimalizuje riziko sekundární diseminace nádorových buněk – 13,8 vs. 5–6 % [65,66]. Ovšem zejména u hluboko uložených tumorů a v blízkosti elokventních zón nelze tento typ resekce použít a jsme nuceni provést vnitřní dekompresi tumoru metodou tzv. piecemeal resekce (po částech). S výhodou lze využít UZ aspirátor (CUSA).
Komplikace
Chirurgická mortalita je 2 % a méně [54]. Chirurgická morbidita se dělí na neurologické komplikace (např. hemiparéza, fatická porucha apod.), regionální komplikace (hematom v ráně, infekce, likvorová píštěl aj.) a systémové komplikace (pneumonie, sepse, hluboká žilní trombóza, plicní embolie aj.). V komplexní práci Sawaya et al jsou tyto komplikace označovány jako závažné, pokud trvají déle než 30 dní nebo vyžadují agresivní léčbu z důvodu život ohrožujícího stavu. Závažné neurologické, regionální a systémové komplikace se v práci objevily v 6, resp. 3 % případů. Neurologických komplikací bylo tím více, čím blíže se MM nacházela elokventní oblasti, nicméně závažných neurologických komplikací i v těchto oblastech bylo relativně málo (10 %). Výskyt komplikací jakéhokoliv typu se zvyšoval s vyšším věkem, nižším KPS a s blízkostí elokventní oblasti. Pacienti nad 65 let, KPS pod 50 a s tumorem v elokventní oblasti měli riziko komplikací 23 % [67].
Standardně se pooperačně provádí vyšetření zobrazovací metodou k určení rozsahu resekce a vyloučení případných pooperačních komplikací. Kamp et al preferují provedení MR, která v jejich studii prokázala reziduum až ve 20 % případů [68].
Závěr
Chirurgická léčba MM v rámci komplexní onkologické terapie má svoji nezastupitelnou roli a patří mezi terapeutické možnosti první volby. Jejím hlavním cílem je mimo odstranění nádoru i zlepšení kvality života se zlepšením celkového přežití a snížením mortality související s onemocněním mozku. Předpokladem dobrého výsledku operační léčby je dodržení současných indikačních kritérií. Využití moderních neuroradiologických zobrazovacích metod a nových peroperačních technologií umožňuje provést bezpečné chirurgické resekce MM i v elokventních oblastech. Nejčastěji jsou k operační léčbě indikováni pacienti se solitární MM, v případě vícečetných a rekurentních MM je postupováno individuálně.
Grantová podpora
Podpořeno z programového projektu Ministerstva zdravotnictví ČR s reg. č. NV18-03-00398. Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena.
Podpořeno MZ ČR – RVO (FNBr, 65269705).
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Pavel Fadrus, Ph.D.
Neurochirurgická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: fadrus.pavel@fnbrno.czPřijato k recenzi: 3. 11. 2019
Přijato do tisku: 4. 3. 2020
Zdroje
1. Mehta MP, Tsao MN, Whelan TJ et al. The American Society for Therapeutic Radiology and Oncology (ASTRO) evidence-based review of the role of radiosurgery for brain metastases. Int J Radiat Oncol Biol Phys 2005; 63 (1): 37–46. doi: 10.1016/j.ijrobp.2005.05.023.
2. Jemal A, Siegel R, Xu J et al. Cancer statistics 2010. CA Cancer J Clin 2010; 60 (5): 277–300. doi: 10.3322/caac. 20073.
3. Scoccianti S, Ricardi U. Treatment of brain metastases: review of phase III randomized controlled trials. Radiother Oncol 2012; 102 (2): 168–179. doi: 10.1016/j.radonc.2011.08.041.
4. Hatiboglu MA, Wildrick DM, Sawaya R. The role of surgical resection in patients with brain metastases. Ecancermedicalscience 2013; 7 : 308. doi: 10.3332/ecancer.2013.308.
5. Markesbery WR, Brooks WH, Gupta GD et al. Treatment for patients with cerebral metastases. Arch Neurol 1978; 35 (11): 754–756. doi: 10.1001/archneur.1978.00500350058 012.
6. Horton J, Baxter DH, Olson KB. The management of metastases to the brain by irradiation and corticosteroids. Am J Roentgenol Radium Ther Nucl Med 1971; 111 (2): 334–336. doi: 10.2214/ajr.111.2.334.
7. Ruderman NB, Hall TC. Use of glucocorticoids in the palliative treatment of metastatic brain tumors. Cancer 1965; 18 : 298–306. doi: 10.1002/1097-0142 (196503) 18 : 3<298:: aid-cncr2820180306>3.0.co; 2-h.
8. Sundaresan N, Galicich JH. Surgical treatment of brain metastases. Clinical and computerized tomography evaluation of the results of treatment. Cancer 1985; 55 (6): 1382–1388. doi: 10.1002/1097-0142 (19850315) 55 : 6<; 1382:: AID-CNCR2820550637>; 3.0.CO; 2-Z.
9. Mandell L, Hilaris B, Sullivan M et al. The treatment of single brain metastasis from non-oat cell lung carcinoma. Surgery and radiation versus radiation therapy alone. Cancer 1986; 58 (3): 641–649.
10. Barker FG 2nd. Craniotomy for the resection of metastatic brain tumors in the U.S., 1988-2000: decreasing mortality and the effect of provider caseload. Cancer 2004; 100 (5): 999–1007. doi: 10.1002/cncr.20058.
11. Patchell RA, Tibbs PA, Walsh JW et al. A randomized trial of surgery in the treatment of single metastases to the brain. N Engl J Med 1990; 322 (8): 494–500. doi: 10.1056/ NEJM199002223220802.
12. Vecht CJ, Haaxma-Reiche H, Noordijk EM et al. Treatment of single brain metastasis: radiotherapy alone or combined with neurosurgery? Ann Neurol 1993; 33 (6): 583–590. doi: 10.1002/ana.410330605.
13. Bindal AK, Bindal RK, Hess KR et al. Surgery versus radiosurgery in the treatment of brain metastasis. J Neurosurg 1996; 84 (5): 748–754. doi: 10.3171/jns.1996.84.5.0748.
14. Al-Zabin M, Ullrich WO, Brawanski A et al. Recurrent brain metastases from lung cancer: the impact of reoperation. Acta Neurochir (Wien) 2010; 152 (11): 1887–1892. doi: 10.1007/s00701-010-0721-7.
15. Sawaya R, Hammoud M, Schoppa D et al. Neurosurgical outcomes in a modern series of 400 craniotomies for treatment of parenchymal tumors. Neurosurgery 1998; 42 (5): 1044–1055. doi: 10.1097/00006123-199805000-00054.
16. Schödel P, Schebesch KM, Brawanski A et al. Surgical resection of brain metastases-impact on neurological outcome. Int J Mol Sci 2013; 14 (5): 8708–8718. doi: 10.3390/ijms14058708.
17. Norden AD, Wen PY, Kesari S. Brain metastases. Curr Opin Neurol 2005; 18 (6): 654–661. doi: 10.1097/ 00006123-199805000-00054.
18. Delattre JY, Krol G, Thaler HT et al. Distribution of brain metastases. Arch Neurol 1988; 45 (7): 741–744. doi: 10.1001/archneur.1988.00520310047016.
19. Svokos KA, Salhia B, Toms SA. Molecular biology of brain metastasis. Int J Mol Sci 2014; 15 (6): 9519–9530. doi: 10.3390/ijms15069519.
20. Schulz M, Salamero-Boix, Niesel K et al. Microenvironmental regulation of tumor progression and therapeutic response in brain metastasis. Front Immunol 2019; 10 : 1713. doi: 10.3389/fimmu.2019.01713.
21. Hwang TL, Close TP, Grego JM et al. Predilection of brain metastasis in grey and white matter junction and vascular border zones. Cancer 1996; 77 (8): 1551–1555. doi: 10.1002/ (SICI) 1097-0142 (19960415) 77 : 8<1551:: AID-CNCR19>3.0.CO; 2-Z.
22. Wesseling P, von Deimling A, Aldape K. Metastatic tumours of the CNS. 4th ed. Lyons, France: IARC Press 2007.
23. Berghoff AS, Rajky O, Winkler F et al. Invasion patterns in brain metastases of solid cancers. Neuro Oncol 2013; 15 (12): 1664–1672. doi: 10.1093/neuonc/not112.
24. Tsao MN, Xu W, Wong RK et al. Whole brain radiotherapy for the treatment of newly diagnosed multiple brain metastases. Cochrane Database Syst Rev 2018; 1: CD003869. doi: 10.1002/14651858.CD003869.pub4.
25. Kalkanis SN, Kondziolka D, Gaspar LE et al. The role of surgical resection in the management of newly diag-nosed brain metastases: a systematic review and evidence-based clinical practice guideline. J Neurooncol 2010; 96 (1): 33–43. doi: 10.1007/s11060-009-0061-8.
26. Krieger MD, Chandrasoma PT, Zee CS et al. Role of stereotactic biopsy in the diagnosis and management of brain tumors. Semin Surg Oncol 1998; 14 (1): 13–25. doi: 10.1002/ (sici) 1098-2388 (199801/02) 14 : 1<13:: aid-ssu3>3.0.co; 2-5.
27. Donato J, Campigotto F, Uhlmann EJ et al. Intracranial hemorrhage in patients with brain metastases treated with therapeutic enoxaparin: a matched cohort study. Blood 2015; 126 (4): 494–499. doi: 10.1182/blood-2015-02-626788.
28. Sundaresan N, Galicich JH. Surgical treatment of brain metastases. Clinical and computerized tomography evaluation of the results of treatment. Cancer 1985; 55 (6): 1382–1388. doi: 10.1002/1097-0142 (19850315) 55 : 6<1382:: aid-cncr2820550637>3.0.co; 2-z.
29. Soffietti R, Kocher M, Abacioglu UM et al. A European Organisation for Research and Treatment of Cancer phase III trial of adjuvant whole-brain radiotherapy versus observation in patients with one to three brain metastases from solid tumors after surgical resection or radiosurgery: quality-of-life results. J Clin Oncol 2013; 31 (1): 65–72. doi: 10.1200/JCO.2011.41.0639.
30. Hatiboglu MA, Chang EL, Suki D et al. Outcomes and prognostic factors for patients with brainstem metastases undergoing stereotactic radiosurgery. Neurosurgery 2011; 69 (4): 796–806. doi: 10.1227/NEU.0b013e31821d31de.
31. Yamamoto M, Serizawa T, Shuto T et al. Stereotactic radiosurgery for patients with multiple brain metastases (JLGK0901): a multi-institutional prospective observational study. Lancet Oncol 2014; 15 (4): 387–395. doi: 10.1016/S1470-2045 (14) 70061-0.
32. Niranjan A, Lunsford LD, Kano H. Guidelines for multiple brain metastases. Prog Neurol Surg 2019; 34 : 100–109. doi: 10.1159/000493055.
33. Al-Shamy G, Sawaya R. Management of brain metastases: the indispensable role of surgery. J Neurooncol 2009; 92 (3): 275–282. doi: 10.1007/s11060-009-9839-y.
34. Hughes RT, Black PJ, Page BR et al. Local control of brain metastases after stereotactic radiosurgery: the impact of whole brain radiotherapy and treatment paradigm. J Radiosurg SBRT 2016; 4 (2): 89–96.
35. Bilger A, Frenzel F, Oehlke O et al. Local control and overall survival after frameless radiosurgery: a single center experience. Clin Transl Radiat Oncol 2017; 7 : 55–61. doi: 10.1016/j.ctro.2017.09.007.
36. Muacevic A, Kufeld M, Wowra B et al. Feasibility, safety, and outcome of frameless image-guided robotic radiosurgery for brain metastases. J Neurooncol 2010; 97 (2): 267–274. doi: 10.1007/s11060-009-0023-1.
37. Lecomte DD, Lequesne J, Geffrelot J et al. Hypofractionated stereotactic radiotherapy for challenging brain metastases using 36 Gy in six fractions. Cancer Radiother 2019; 23 (8): 860–866. doi: 10.1016/j.canrad.2019.06.012.
38. O‘Beirn M, Benghiat H, Meade S et al. The expanding role of radiosurgery for brain metastases. Medicines (Basel) 2018; 5 (3). pii: E90. doi: 10.3390/medicines5030090.
39. Rades D, Haatanen T, Schild SE et al. Dose escalation beyond 30 grays in 10 fractions for patients with multiple brain metastases. Cancer 2007; 110 (6): 1345–1350. doi: 10.1002/cncr.22906.
40. Tsao MN, Rades D, Wirth A et al. Radiotherapeutic and surgical management for newly diagnosed brain metastasis (es): an American Society for Radiation Oncology evidence-based guideline. Pract Radiat Oncol 2012; 2 (3): 210 -225. doi: 10.1016/j.prro.2011.12.004.
41. Chang EL, Wefel JS, Hess KR et al. Neurocognition in patients with brain metastases treated with radiosurgery or radiosurgery plus whole-brain irradiation: a randomised controlled trial. Lancet Oncol 2009; 10 (11): 1037–1044. doi: 10.1016/S1470-2045 (09) 70263-3.
42. Kocher M, Soffietti R, Abacioglu U et al. Adjuvant wholebrain radiotherapy versus observation after radiosurgery or surgical resection of one to three cerebralmetastases: results of the eortc 22952-26001 study. J Clin Oncol 2011; 29 (2): 134–141. doi: 10.1200/JCO.2010.30.1655.
43. Conill C, Gimferrer JM, Marruecos J et al. Clinical outcome after surgical resection of lung metastases from melanoma. Clin Transl Oncol 2007; 9 (1): 48–52. doi: 10.1007/s12094-007-0009-4.
44. Andrews DW, Scott CB, Sperduto PW et al. Whole brain radiation therapy with or without stereotactic radiosurgery boost for patients with one to three brain metastases: phase III results of the RTOG 9508 randomised trial. Lancet 2004; 363 (9422): 1665–1672. doi: 10.1016/S0140-6736 (04) 16250-8.
45. Soffietti R, Rudà R, Trevisan E. Brain metastases: current management and new developments. Curr Opin Oncol 2008; 20 (6): 676–684. doi: 10.1097/CCO.0b013e32831186fe.
46. Zimmermann S, Dziadziuszko R, Peters S. Indications and limitations of chemotherapy and targeted agents in non-small cell lung cancer brain metastases. Cancer Treat Rev 2014; 40 (6): 716–722. doi: 10.1016/j.ctrv.2014.03.005.
47. Thomas AJ, Rock JP, Johnson CC et al. Survival of patients with synchronous brain metastases: an epidemiological study in southeastern Michigan. J Neurosurg 2000; 93 (6): 927–931. doi: 10.3171/jns.2000.93.6.0927.
48. Lagerwaard FJ, Levendag PC, Nowak PJ et al. Identification of prognostic factors in patients with brain metastases: a review of 1292 patients. Int J Radiat Oncol Biol Phys 1999; 43 (4): 795–803. doi: 10.1016/S0360-3016 (98) 00 442-8.
49. Venur VA, Ahluwalia MS. Prognostic scores for brain metastasis patients: use in clinical practice and trial design. Chin Clin Oncol 2015; 4 (2): 18. doi: 10.3978/j.issn.2304-3865.2015.06.01.
50. Schödel P, Schebesch KM, Brawanski A et al. Surgical resection of brain metastases – impact on neurological outcome. Int J Mol Sci 2013; 14 (5): 8708–8718. doi: 10.3390/ijms14058708.
51. Beauchesne P. Intrathecal chemotherapy for treatment of leptomeningeal dissemination of metastatic tumours. Lancet Oncol 2011; 11 (9): 871–879. doi: 10.1016/S1470-2045 (10) 70034-6.
52. Manon R, O’Neill A, Knisely J et al. Phase II trial of radiosurgery for one to three newly diagnosed brain metastases from renal cell carcinoma, melanoma, and sarcoma: an Eastern Cooperative Oncology Group study (E 6397). J Clin Oncol 2005; 23) 34): 8870–8876. doi: 10.1200/JCO.2005.01.8747.
53. Fuentes S, Delsanti C, Metellus P et al. Brainstem metastases: management using gamma knife radiosurgery. Neurosurgery 2006; 58 (1): 37–42. doi: 10.1227/01.neu.0000190655.95669.5c.
54. Paek SH, Audu PB, Sperling MR et al. Reevaluation of surgery for the treatment of brain metastases: review of 208 patients with single or multiple brain metastases treated at one institution with modern neurosurgical techniques. Neurosurgery 2005; 56 (5): 1021–1034.
55. Wronski M, Arbit E, McCormick B. Surgical treatment of 70 patients with brain metastases from breast carcinoma. Cancer 1997; 80 (9): 1746–1754. doi: 10.1002/ (sici) 1097-0142 (19971101) 80 : 9<1746:: aid-cncr8>3.0.co; 2-c.
56. Iwadate Y, Namba H, Yamaura A. Significance of surgical resection for the treatment of multiple brain metastases. Anticancer Res 2000; 20 (1B): 573–577.
57. Auslands K, Apškalne D, Bicāns K et al. Postoperative survival in patients with multiple brain metastases. Medicina (Kaunas) 2012; 48 (6): 281–285.
58. Boehling NS, Chang EL, Ma L et al. J Stereotactic radiosurgery for brain metastases: current status and future directions. Radiat Oncol 2012; 1 : 245. doi: 10.1007/s13566-012-0043-x.
59. Vogelbaum MA, Suh JH. Resectable brain metastases. J Clin Oncol 2006; 24 (8): 1289–1994. doi: 10.1200/JCO.2005.04.6235.
60. Schebesch KM, Hoehne J, Hohenberger C et al. Fluorescein sodium-guided resection of cerebral metastases – experience with the first 30 patients. Acta Neurochir (Wien) 2015; 157 (6): 899–904. doi: 10.1007/s00701-015-2395-7.
61. Höhne J, Hohenberger C, Proescholdt M et al. Fluorescein sodium-guided resection of cerebral metastases-an update. Acta Neurochir (Wien) 2017; 159 (2): 363–367. doi: 10.1007/s00701-016-3054-3.
62. Kamp MA, Grosser P, Felsberg J et al. 5-aminolevulinic acid (5-ALA) -induced fluorescence in intracerebral metastases: a retrospective study. Acta Neurochir (Wien) 2012; 154 (2): 223–228. doi: 10.1007/s00701-011-1200-5.
63. Wadley J, Dorward N, Kitchen N et al. Pre-operative planning and intra-operative guidance in modern neurosurgery: a review of 300 cases. Ann R Coll Surg Engl 1999; 81 (4): 217–225.
64. Chua TH, See AA, Ang BT et al. Awake Craniotomy for resection of brain metastases: a systematic review. World Neurosurg 2018; 120: e1128–e1135. doi: 10.1016/j.wneu.2018.08.243.
65. Suki D, Abouassi H, Patel AJ et al. Comparative risk of leptomeningeal disease after resection or stereotactic radiosurgery for solid tumor metastasis to the posterior fossa. J Neurosurg 2008; 108 (2): 248–257. doi: 10.3171/JNS/2008/108/2/0248.
66. Patel AJ, Suki D, Hatiboglu MA et al. Factors influencing the risk of local recurrence after resection of a single brain metastasis. J Neurosurg 2010; 113 (2): 181–189. doi: 10.3171/2009.11.JNS09659.
67. Sawaya R, Hammoud M, Schoppa D et al. Neurosurgical outcomes in a modern series of 400 craniotomies for treatment of parenchymal tumors. Neurosurgery 1998; 42 (5): 1044–1055. doi: 10.1097/00006123-199805000-00054.
68. Kamp MA, Rapp M, Bühner J et al. Early postoperative magnet resonance tomography after resection of cerebral metastases. Acta Neurochir (Wien) 2015; 157 (9): 1573–1580. doi: 10.1007/s00701-015-2479-4.
69. GPA Index. [online]. Available from URL: http: //brainmetgpa.com/.
70. Gaspar L, Scott C, Rotman M et al. Recursive partitioning analysis (RPA) of prognostic factors in three Radiation Therapy Oncology Group (RTOG) brain metastases trials. Int J Radiat Oncol Biol Phys 1997; 37 (4): 745–751.
71. Sperduto PW, Berkey B, Gaspar LE et al. A new prognostic index and comparison to three other indices for patients with brain metastases: an analysis of 1,960 patients in the RTOG database. Int J Radiat Oncol Biol Phys 2008; 70 (2): 510–514. doi: 10.1016/j.ijrobp.2007.06.074.
72. Sperduto PW, Kased N, Roberge D et al. Summary report on the graded prognostic assessment: an accurate and facile diagnosis-specific tool to estimate survival for patients with brain metastases. J Clin Oncol 2011; 30 (4): 419–425. doi: 10.1200/JCO.2011.38.0527.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článek Poměr fosforylovaného tau proteinu k beta amyloidu v likvoru predikuje pozitivitu amyloidové PETČlánek Chirurgická léčba benigních neurogenních tumorů mediastina – analýza 7letého souboru pacientůČlánek Dopis redakciČlánek Komentář redakceČlánek Prof. Mraček oslavil 90 letČlánek Odešla MUDr. Olga Baudyšová
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2020 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Naděje budí časná diagnostika Parkinsonovy choroby založená na pachu kůže
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
-
Všetky články tohto čísla
- Cévní morfologie, symptomy, diagnostika a léčba ischemických příhod mozkového kmene
- Je koncept vaskulární demence trvale udržitelný?
- Je koncept vaskulární demence trvale udržitelný? NE
- Je koncept vaskulární demence trvale udržitelný? Komenář
- Mezinárodní klasifikace bolestí hlavy (ICHD-3) – oficiální český překlad
- Schwannóm extrakraniálnej časti trojklanného nervu
- Chirurgická léčba mozkových metastáz
- Cavum septi pellucidi, cavum vergae a cavum veli interpositi
- Poměr fosforylovaného tau proteinu k beta amyloidu v likvoru predikuje pozitivitu amyloidové PET
- Provocative factors and treatment response in juvenile myoclonic epilepsy – experience from a tertiary epilepsy center
- Chirurgická léčba benigních neurogenních tumorů mediastina – analýza 7letého souboru pacientů
- Transkraniální sonografie mediotemporálního laloku u pacientů s Alzheimerovou demencí
- Endarterektomie zevní karotické tepny
- Vestibulární funkce u pacientů s kochleárním implantátem
- Cystická hydatidóza mozečku – vzácná kazuistika
- A case of late brachial plexopathy after chemotherapy and radiotherapy
- Spontaneous vaginal extrusion of the distal catheter of a ventriculoperitoneal shunt
- Opakovaná trombektómia u pacienta so zriedkavou kombináciou etiologických faktorov
- Dopis redakci
- Komentář redakce
- Prof. Mraček oslavil 90 let
- Odešla MUDr. Olga Baudyšová
- K jubileu profesorky Soni Nevšímalové
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Cavum septi pellucidi, cavum vergae a cavum veli interpositi
- Cévní morfologie, symptomy, diagnostika a léčba ischemických příhod mozkového kmene
- Mezinárodní klasifikace bolestí hlavy (ICHD-3) – oficiální český překlad
- Chirurgická léčba mozkových metastáz
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



