-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Cévní morfologie, symptomy, diagnostika a léčba ischemických příhod mozkového kmene
Vascular morphology, symptoms, diagnostics and treatment of brainstem ischemic stroke
The knowledge of the microanatomy of brain stem perforating arteries can aid in the correct identification of ischemic stroke lesions, explain and provide a proper anatomic description of syndromes associated with the brain stem lesions. The importance of such detailed knowledge is growing when considering the possibilities of acute reperfusion therapy and growing incidence of active treatment of ischemic strokes in posterior circulation. Of course, such knowledge is also vital for neurosurgeons operating in this area. The aim of this work is to present the current knowledge on the anatomy of arteries of the brain stem, brain stem syndromes and present the possibilities of imaging and reperfusion therapy in the vertebrobasilar territory.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Keywords:
ischemic stroke – vertebrobasilar territory – perforating arteries – brain stem syndromes – reperfusion therapy
Autori: D. Ospalík 1; R. Bartoš 2,3; V. Němcová 3; Š. Brušáková 1; D. Černík 1; F. Cihlář 4; A. Hejčl 2; H. Zítek 2; M. Sameš 2
Pôsobisko autorov: Neurologické oddělení, Masarykova nemocnice, Krajská zdravotní, a. s., Ústí nad Labem 1; Neurochirurgická klinika Univerzity J. E. Purkyně, Masarykova nemocnice, Krajská zdravotní, a. s., Ústí nad Labem 2; Anatomický ústav, 1. LF UK, Praha 3; Radiologická klinika Univerzity J. E. Purkyně, Masarykova nemocnice, Krajská zdravotní, a. s., Ústí nad Labem 4
Vyšlo v časopise: Cesk Slov Neurol N 2020; 83(2): 127-139
Kategória: Minimonografie
doi: https://doi.org/10.14735/amcsnn2020127Súhrn
Znalost mikroanatomie kmenových perforujících arterií nám může pomoci správně lokalizovat ischemické léze, vysvětlit a správně anatomicky popsat syndromy kmenových lézí. Význam jejich detailní znalosti roste s možnostmi akutní reperfuzní terapie a zvyšující se frekvencí aktivní léčby ischemických mozkových příhod v zadním povodí. Samozřejmě se bez ní neobejde neurochirurg při operacích v této oblasti. Cílem této práce je prezentovat aktuální pohled na anatomii arterií mozkového kmene, kmenové syndromy, možnosti zobrazení a reperfuzní terapii vertebrobazilárního povodí.
Klíčová slova:
vertebrobazilární povodí – perforující arterie – ischemická cévní mozková příhoda – kmenové syndromy – reperfuzní terapie
Úvod do vaskulární anatomie mozkového kmene
Koncept arterií mozkového kmene můžeme ve všech jeho etážích rozdělit podle místa vstupu do hloubky mozkového kmene na přední (paramediánní), laterální (krátké cirkumflexní) a zadní (dlouhé cirkumflexní) perforující větve (obr. 1). Ty mohou vystupovat jak z magistrálních tepen, tedy z vertebrálních arterií (arteria vertebralis; AV) a arteria basilaris (AB), tak z jejich větví, tedy z a. cerebelli inferior posterior (PICA), a. cerebelli inferior anterior (AICA), a. cerebelli superior (SCA) a dále z P1 a P2 úseku a. cerebri posterior (ACP). Z ACP odstupují další samostatné větve a. collicularis (a. quadrigemina) a a. choroidea posterior medialis (MPChA). Obecně lze říci, že zadní povodí zásobuje prodlouženou míchu (medulla oblongata), pons, mezencefalon, mozeček a částečně talamus. Za rozvodí směrem k přední cirkulaci z a. cerebri interna považujeme a. communicans posterior (AComP) (obr. 2).
Obr. 1. Obecné schéma perforujících arterií na úrovni oblongaty, pontu a mezencefala, tzn. rozdělení na anteromediální, anterolaterální, laterální skupiny a v oblasti mesencefala a pontu i posteriorní skupinu (z PICA, MPChA, CollA). (a) medulla oblongata – 1. pyramis medullae oblongatae; 2. ncl. olivaris inferior; 3. ncl. olivaris dosrsalis accessorius; 4. ncl. reticularis lateralis; 5. tr. spino-thalamicus (anterolaterální systém) a spinocerebellaris ant.; 6. ncl. et tr. spinalis nervi trigemini; 7. pedunculus cerebellaris inferior (corpus restiforme); 8. ncl. cuneatus accessorius; 9. ncl. vestibularis inferior et medialis; 10. ncl. dorsalis n. vagi; 11 ncl. nervi hypoglossi; 12. fasciculus longitudinalis medialis; 13. tr. tecto-spinalis; 14. lemniscus medialis; 15. ncl. ambiguus; 16 tr. et ncl. solitarius (b) pons – 1. fasciculus longitudinalis medialis; 2. tr. tecto-spinalis a tr. reticulo-spinalis; 3. lemniscus medialis; 4. ncl. pontis; 5. tr. corticospinalis (roztříštěné svazky pyramid); 6. tr. centralis tegmenti; 7. tr. rubrospinalis; 8. ncl. vestibularis superior; 9. pedunculus cerebellaris superior (brachium conjunctivum); 10. tr. et ncl. mesencephalicus CN V.; 11. ncl. motorius et pontinus CN V.; 12. tr. spino-thalamicus (anterolaterální systém); 13. tr. spinocerebellaris anterior; 14. peduncullus cerebellaris medius (brachium pontis) (c) mezencefalon – 1. ncl. mesencephalicus CN V.; 2. substantia grisea centralis; 3. colliculus superior; 4. ncl. ruber; 5. lemniscus medialis; 6. tr. spino-thalamicus (anterolaterální systém); 7. tr. cerebellothalamicus; 8. susbstnatia nigra (reticularis et compacta); 9. pedunculus (crus cerebri); 10. ncl. nervi oculomotorii (CN III.); 11. ncl. interpeduncularis; 12. ncl. spinotectalis; 13. tr. occipito-, temporo-, parieto-pontinnus; 14. tr. corticospinalis; 15. tr. corticonuclearis; 16. tr. fronto-pontinnus; 17. tr. centralis tegmenti; 18. fasciculus longitudinalis medialis AICA – arteria cerebelli inferior anterior; AL – anterolaterální skupina; AM – anteromediální skupina; ASA – arteria spinalis anterior; BA – arteria basiliaris; CN – hlavový nerv; CollA – arteria collicularis; L – laterální skupina; LPA – laterální pontinní arterie; MPChA – arteria choroidea posterior medialis; PCA – arteria cerebri posterior; PICA – arteria cerebelli inferior posterior; VA – arteria vertebralis
Fig. 1. General scheme of perforators in the medulla oblongata, pons and mesencephalon with division into the anteromedial, anterolateral, lateral group and in the area of mesecephalon and pons and also in the posterior group (from PICA, MPChA, CollA). (a) medulla oblongata – 1. pyramis medullae oblongatae; 2. ncl. olivaris inferior; 3. ncl. olivaris dorsalis accessorius; 4. ncl. reticularis lateralis; 5. tr. spino-thalamicus (anterolateral system) et spinocerebellaris ant.; 6. ncl. et tr. spinalis nervi trigemini; 7. pedunculus cerebellaris inferior (corpus restiforme); 8. ncl. cuneatus accessorius; 9. ncl. vestibularis inferior et medialis; 10. ncl. dorsalis n. vagi; 11. ncl. nervi hypoglossi; 12. fasciculus longitudinalis medialis; 13. tr. tecto-spinalis; 14. lemniscus medialis; 15. ncl. ambiguus; 16. tr. et ncl. solitarius (b) pons – 1. fasciculus longitudinalis medialis; 2. tr. tecto-spinalis et tr. reticulo-spinalis; 3. lemniscus medialis; 4. ncl. pontis; 5. tr. corticospinalis (crashed pyramidal columns); 6. tr. centralis tegmenti; 7. tr. rubrospinalis; 8. ncl. vestibularis superior; 9. pedunculus cerebellaris superior (brachium conjunctivum); 10. tr. et ncl. mesencephalicus CN V.; 11. ncl. motorius et pontinus CN V.; 12. tr. spino-thalamicus (anterolateral system); 13. tr. spinocerebellaris anterior; 14. peduncullus cerebellaris medius (brachium pontis) (c) mesencephalon – 1. ncl. mesencephalicus CN V.; 2. substantia grisea centralis; 3. colliculus superior; 4. ncl. ruber; 5. lemniscus medialis; 6. tr. spino-thalamicus (anterolateral system); 7. tr. cerebellothalamicus; 8. substantia nigra (reticularis et compacta); 9. pedunculus (crus cerebri); 10. ncl. nervi oculomotorii (CN III.); 11. ncl. interpeduncularis; 12. ncl. spinotectalis; 13. tr. occipito-, temporo-, parieto-pontinnus; 14. tr. corticospinalis; 15. tr. corticonuclearis; 16. tr. fronto-pontinnus; 17. tr. centralis tegmenti; 18. fasciculus longitudinalis medialis AICA – anterior inferior cerebellar artery; AL – anterolateral group; AM – anteromedial group; ASA – arteria spinalis anterior; BA – basilar artery; CN – cranial nerve; CollA – collicular artery; L – laterar group; LPA – lateral pontine artery; MPChA – medial posterior choroidal artery; PCA – posterior cerebral artery; PICA – posterior inferior cerebellar artery; VA – vertebral artery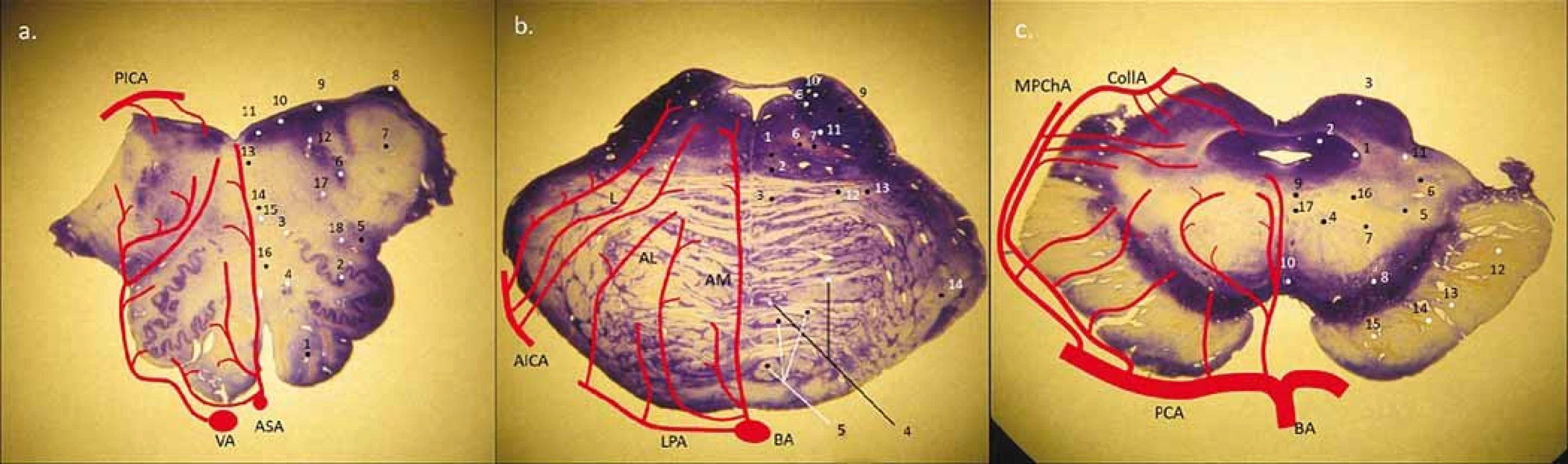
Obr. 2. Celkový pohled na vertebrobazillární povodí a jeho odstupující magistrální větve. Barevný preparát daný injekcí červeného latexu do pravé vertebrální arterie. Šipkami jsou v kaudokraniálním pořadí označeny spinální arterie anterior vlevo, pontomedullární arterie vpravo, inferolaterální pontinní arterie vlevo, superolaterální pontinní arterie vlevo a posterolaterální pontinní arterie oboustranně.
Fig. 2. General picture of vertebrobasilar circulation with its marginal branches. Specimen colored with red latex administered into the right vertebral artery. Arrows showing caudocranially left anterior spinal artery, right pontomedullary artery, left inferolateral pontine artery, left superolateral pontine artery and posterolateral pontine arteries bilaterally.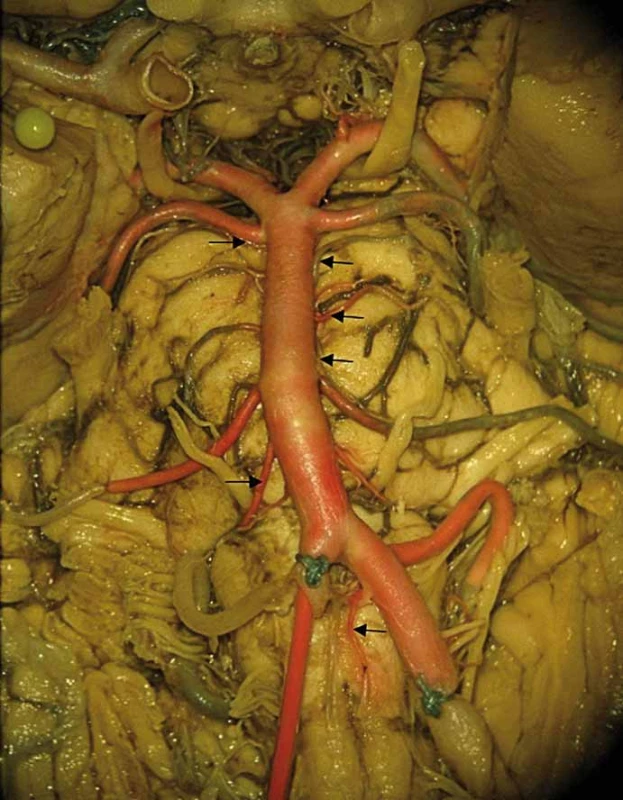
Vývoj vertebrobazilárního povodí
Primitivní arteria carotis interna (ACI) začíná být rozlišitelná u embrya ve stadiu 10 dle Carnegieho škály (definující jednotlivá morfologická stadia lidského embrya), tzn. u embrya velkého 3 mm ve věku 28 dní po oplodnění vajíčka [1]. Je tvořena 3. aortálním obloukem a kraniální částí dorzální aorty. Mezencefalon a metencefalon (budoucí pons a mozeček) zásobuje v tomto embryonálním období nejprve AComP vznikající v stadiu 14 (5 – 7 mm, 33 dní) a její anastomotické větve se až následně napojují na 2 longitudinální arterie (cefalické plexy) vznikající z dorzálních aort, resp. až sekundárním propojováním jejich dorzálních intersegmentálních větví. Tyto plexy se postupně v 16. stadiu (8 – 11 mm, 38 dní) z ventrolaterálního aspektu metencefala přesouvají mediálně a spojují se v AB. Tyto 2 longitudinální arterie a poté AB jsou přechodně propojeny s ACI cestou a. trigemina primitiva (ATP), a. otica, a. hypoglossea a a. proatlantica, tok krve směřuje rostrokaudálním směrem. Tyto anastomózy se časně po vzniku AB uzavírají, definitivně jsou uzavřeny ve stadiu 18 (13 – 17 mm, 44 dní), přičemž ATP jen výjimečně zůstává perzistující karotidobazilární anastomózou s incidencí 0,1 – 1,0 %. Byla popsána i persistence ostatních anastomóz. Vertebrální arterie se objevují ve stadiu 15 (9 mm, 36 dní), vznikají ze subokcipitálních (proatlantálních) a dalších 6 cervikálních segmentálních arterií. Od AB jsou v časném embryonálním stadiu zcela odděleny. Na AB se napojují až v době uzávěru karotidobazilárních anastomóz (stadium 18). První vzniklou cévou odstupující ze zadního povodí je SCA ve stadiu 15, PICA a AICA se objevují až ve stadiu 19 (18 mm, 46 dní). Embryonální vývoj PCA není zcela jasný, objevuje se ve stejné době jako SCA, mezi ní a mezencefalickými větvemi z primitivní AComP, která tvoří segment P1, distální úsek tvoří diencefalická větev, PCA má tedy smíšený karotidobazilární či spíše jen karotický původ. Všechny cévy jsou podobně vyvinuté jako v postnatálním období a jsou přítomny zhruba 52. den u plodu velkého 40 mm [2,3].
Tepny mozkového kmene
Podle místa vstupu do hloubky mozkového kmene se kmenové perforátory dělí na přední (paramediánní), laterální (krátké cirkumflexní) a zadní skupinu (dlouhé cirkumflexní) [4,5]. Přední skupina je ještě rozdělena na ventromediální a ventrolaterální skupinu. Každá z těchto čtyř skupin zásobuje určitou část kmene.
Prodloužená mícha
Prodlouženou míchu zásobují 3 skupiny perforujících arterií, jsou to přední medulární větve z distální AV a a. spinalis anterior (ASA) dále laterální medulární větve z AV, PICA, kraniálněji z AB a AICA, a konečně zadní medulární větve z a. spinalis posterior a PICA (obr. 1A).
Přední medulární větve se dělí na anteromediální (paramediální) a anterolaterální. Anteromediální větve z ASA směřují do fissura medullaris anterior, z distální AV do foramen caecum, dělí se na krátké a dlouhé perforátory. Krátké zásobují mediální část pyramidové dráhy, část lemniscus medialis (LM), ncl. olivaris accessorius medialis a přilehlou retikulární formaci (RF), dlouhé dosahují až ke spodině IV. komory a zásobují LM, ncl. olivaris accessorius dorsalis, fasciculus longitudinalis medialis (FLM), rafeální jádra, paramediální RF a ncl. n. hypoglossi. Anterolaterální větve jsou často sekundárními větvemi paramediálních perforátorů, jedná se o krátké medulární cévy běžící napříč skrze pyramidy, dosahují do preolivárního sulku. Jsou extrémně důležité, protože zásobují pyramidovou dráhu a mediální část ncl. olivaris inferior.
Laterální medulární arterie jsou dlouhé perforátory zásobující sulcus retroolivaris (laterální medulární fossu [LMF]) a olivu (obr. 3A). Laterální medulární arterie dělíme dle výšky odstupu na kaudální, střední, rostrální a zvláštní skupinu dorzálních perforátorů. Kaudální odstupují pod olivou a zásobují tractus spino-thalamicus a tractus spino-cerebellaris ventralis. Střední odstupují v sulcus retroolivaris v oblasti odstupu kořenů n. IX. a n. X. a jsou mediolaterálně uspořádány, zásobují laterální část ncl. olivaris inferior, ncl. olivaris accessorius dorsalis, ncl. ambiguus, spodinu IV. komory vč. ncl. n. hypoglossi, ncl. dorsalis n. vagi a ncl. solitarius, někdy vestibulární jádra a dále tractus spinalis a ncl. nervi trigemini. Rostrální větve již zásobují také pons a větev z AB, která se nazývá pontomedulární arterií, vstupuje do sulcus bulbopontinus a zásobuje stejné anatomické struktury jako předchozí střední skupina. Dorzální perforátory odstupují z PICA v oblasti pedunculus cerebellaris inferior (corpus restiforme [CR]) a vstupují do prodlužené míchy posterolaterálně od výstupu kořenů n. X. Dělí se na dolní, jež zásobují jádro zadních provazců ncl. cuneatus (Burdachi), a horní, které se dále dělí na mediální a laterální. Mediální větve zásobují CR a vestibulární jádra, laterální větve laterální část CR, kochleární jádra, mediální a dolní vestibulární jádra.
Zadní medulární arterie dělíme na kaudální a rostrální. Kaudální zásobují ncl. gracillis (Golli) a ncl. cuneatus, kaudální část ncl. solitarius, jádra n. X, a někdy spinální trigeminální jádro. Rostrální jdou skrze tenii IV. komory a zásobují area postrema a kraniální části výše uvedených struktur (obr. 3B).
Obr. 3. (A) Anteriorní a laterální perforátory pro medulla oblongata. Šipky označují kaudokraniálně – laterální medullární perforátory z arteria vertebralis, arteria spinalis anterior, laterální medullární perforátory z arteria cerebelli inferior posterior v oblasti retroolivární fossy, pontomedullární arterie vstupující do sulcus bulbopontinus. (B) Tonsillomedullární a telovelotonsillární segment arteria cerebelli inferior posterior; kraniální šipky – rostrální zadní medullární arterie vč. choroidální větve (vlevo) a větévky ke corpus restiforme; kaudální šipky vlevo – dorzální perforátory z arteria cerebelli inferior posterior (ve skupině laterálních perforátorů).
Fig. 3. (A) Anterior and lateral perforators of the medulla oblongata. Arrows showing caudocranially lateral medullary perforators arising from the vertebral artery, anterior spinal artery, lateral medullary perforators arising from the posterior inferior cerebellar artery in the retroolivary fossa, and pontomedullary arteries entering the bulbopontine sulcus. (B) Tonsillomedullary and telovelotonsillary segment of the posterior inferior cerebellar artery; upper arrows showing the rostral dorsal medullary artery including the choroidal branch (left) and small branches for corpus restiforme, and lower arrows on the left showing dorsal perforators arising from the posterior inferior cerebellar artery (in the group of lateral perforators).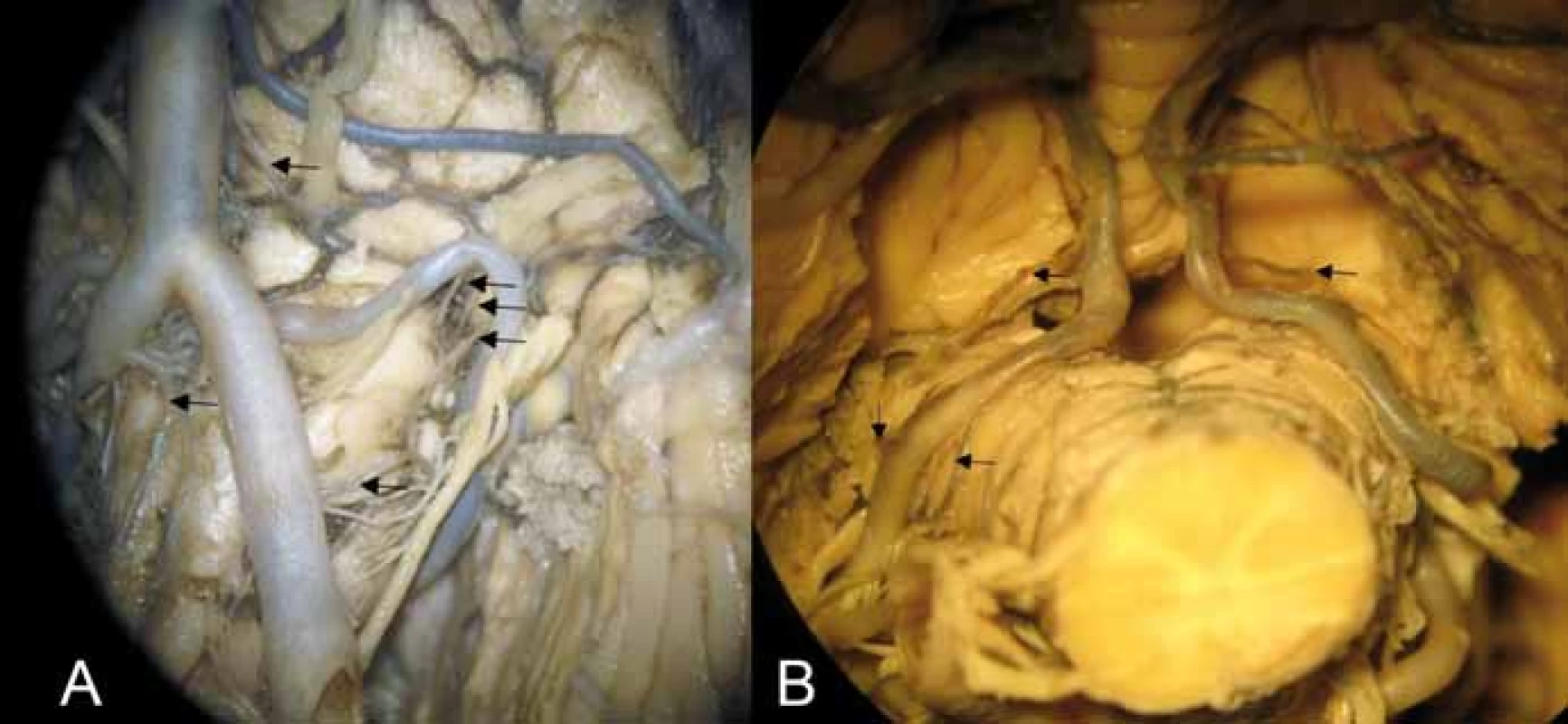
Varolův most
Varolův most zásobují perforátory z AB, AICA, SCA a z pontinních tepen. Zde koncept obkružujících arterií platí jen částečně (obr. 1B). Vzhledem k tomu, že je dorzální část pontu široce otevřena do IV. komory, je přítomno jen minimum zadních pontinních perforátorů. Ty vycházejí zejména z mediální terminální větve SCA a zásobují brachium pontis, locus coeruleus a mezencefalické jádro n. V. Pons tedy zásobují převážně přední pontinní arterie a laterální (dlouhé) pontinní arterie (obr. 2).
Přední pontinní arterie vycházejí ze zadní stěny AB a dělíme je na anteromediální a anterolaterální. Anteromediální dělíme dále na kaudální, střední a rostrální skupinu. Kaudální perforátory odstupují z rostrální části AV a junkční části AB až k AICA, ze které mohou též odstupovat. Dále mohou odstupovat i z pontomedulární arterie, vstupují do foramen caecum a některé vydávají kolaterály k pyramidám a kořenům n. XII. Střední skupina odstupuje mezi AICA a posterolaterální pontinní arterií, některé perforátory mohou opět odstupovat i z AICA a inferolaterálních a superolaterálních pontinních arterií. Běží vzestupně a sestupně podél bazilárního sulku. Rostrální začínají z terminální části AB i SCA a posterolaterální arterie a vstupují do nejkaudálnější části interpedunkulární fossy. Všechny dělíme na krátké a dlouhé větve, přičemž dlouhé větve se nacházejí paramediálně, blízko raphe pontis, a dosahují prakticky až ke spodině IV. komory. Zásobují ncl. n. abducentis, FLM, rafeální jádra, paramediální část RF. Krátké jsou laterálněji od dlouhých, zásobují mediální část pyramidové, kortikobulbární a kortikopontinní dráhy, mediální části pontinních jader a někdy část LM. Anterolaterální (neboli krátké pontinní arterie) odstupují nejčastěji z předchozích anteromediálních arterií (mohou i z AB, AICA a PICA) a zásobují laterální a ventrální pyramidové svazky a laterální části drah a jader, jejichž mediální části zásobují anteromediální perforátory.
Čtyři laterální pontinní arterie (neboli dlouhé pontinní arterie) jsou zdroji důležitých laterálních pontinních perforátorů. Jsou to: pontomedulární, inferolaterální pontinní, superolaterální pontinní a posterolaterální pontinní arterie (obr. 2). Pontomedulární arterie byla již zmíněna u tepen prodloužené míchy. Odstupuje z AB, AICA nebo PICA a směřuje do LMF. Inferolaterální a superolaterální pontinní arterie (nejčastěji po jedné, ale v 25 % duplikované) odstupují nejčastěji z AB, výjimečně z AICA. Inferolaterální arterie končí pod odstupem n. V, a superolaterální arterie končí v oblasti výstupu n. V. Posterolaterální pontinní arterie odstupuje z terminální části AB těsně pod odstupem SCA a končí nad výstupem n. V.
Laterální pontinní perforátory se dělí na kaudolaterální, ventrolaterální a rostrolaterální skupinu. Kaudolaterální perforátory odstupují z AICA a z pontomedulární arterie. Jejich mediální větve zásobují laterální část ncl. n. VI., jádro n. VII., ncl. olivaris superior, tractus spinothalamicus, lemniscus lateralis a tractus tegmenti centralis. Jejich laterální větve zásobují brachium pontis, spinální a principální jádro n. V. a horní vestibulární jádro. Ventrolaterální perforátory odstupují z inferolaterální a superolaterální pontinní arterie, vstupují do pontu okolo výstupu n. V., zásobují laterální pyramidová vlákna, pontinní jádra, motorické jádro trigeminu, LM a tractus centralis tegmenti. Rostrolaterální perforátory odstupují ze SCA a z posterolaterální pontinní arterie. Procházejí do kmene skrze brachium conjunctivum, zásobují jej a dále locus coeruleus, přilehlou RF, lemniscus lateralis a tractus spino-thalamicus.
Mezencefalon
Cévní zásobení mezencephala má již klasický koncept penetrujících a obkružujících arterií (obr. 1C). Jedná se o perforátory odstupující z PCA, SCA, a. collicularis, a. collicularis accessoria a MPChA (obr. 4A). Dělíme je na přední mezencefalické, laterální mezencefalické a zadní mezencefalické tepny. Přední mezencefalické tepny se dále dělí na anteromediální a anterolaterální. Anteromediální se dále dělí na mediální mezencefalické perforátory (interpedunkulární, talamoperforující) a laterální mezencefalické perforátory. Interpedunkulární talamoperforující arterie odstupují z úseku P1 ACP (obr. 4B). Kaudorostrálně je dělíme na mezencefalickou, pretektální a diencefalickou skupinu. Tato poslední skupina může být silnější a mohou z ní sekundárně odstupovat mezencefalické a pretektální větévky. Krátké mediální mezencefalické perforátory zásobují decussatio pedunculorum cerebellarium superiorum a mediální část ncl. ruber. Dlouhé mediální mezencefalické perforátory dosahují až k substantia grisea centralis (PAG) a zásobují FLM, jádro n. IV., n. III., dorzální rafeální jádra, ventrální polovinu PAG a někdy pronikají až do nejhlubší vrstvy horního colliculu. Laterální mezencefalické perforátory odstupují nejčastěji z úseku P1, někdy z pedunkulárních větví, colikulární arterie nebo MPChA v laterálních částech cisterny interpeduncularis a vstupují do kmene v sulcus nervi oculomotorii, mediálně od crus cerebri, často okolo vláken n. III. Běží skrze mediální část substantia nigra a ncl. paranigralis, poté probíhají laterodorzálně a poté dorzomediálně mediálně a zásobují laterální část decussatio pedunculorum cerebellarium superiorum a ncl. ruber a mediální okraj LM. Anterolaterální (pedunkulární) perforátory jsou krátké, prostupují do crura cerebri a zásobují kortikopontinní, pyramidovou a kortikobulbární dráhu a většinu substantia nigra, některé mohou dosahovat až k LM. Pedunkulární větévky pro crus cerebri, substantia nigra a LM mohou odstupovat i z tepen předního povodí, z AComP a a. choroidea anterior.
Obr. 4. (A) Oblast bifurkace arteria basilaris, odstup arteria choroidea posterior medialis a arteria collicularis z P1 (kraniální 2 šipky), zdvojení arteria cerebelli superior a mezi nimi posterolaterální pontinní arterie. (B) Interpedunkulární perforátory (mediálně oboustranně) a anterolaterální (pedunkulární) větévka (šipka vlevo).
Fig. 4. (A) Area of basilar artery bifurcation with the medial posterior choroidal artery and collicular artery branching from P1 (2 upper arrows), double superior cerebellar arteries with the posterolateral pontine artery between them. (B) Interpeduncular perforators (medially bilaterally) and anterolateral – (peduncular) branch (left arrow).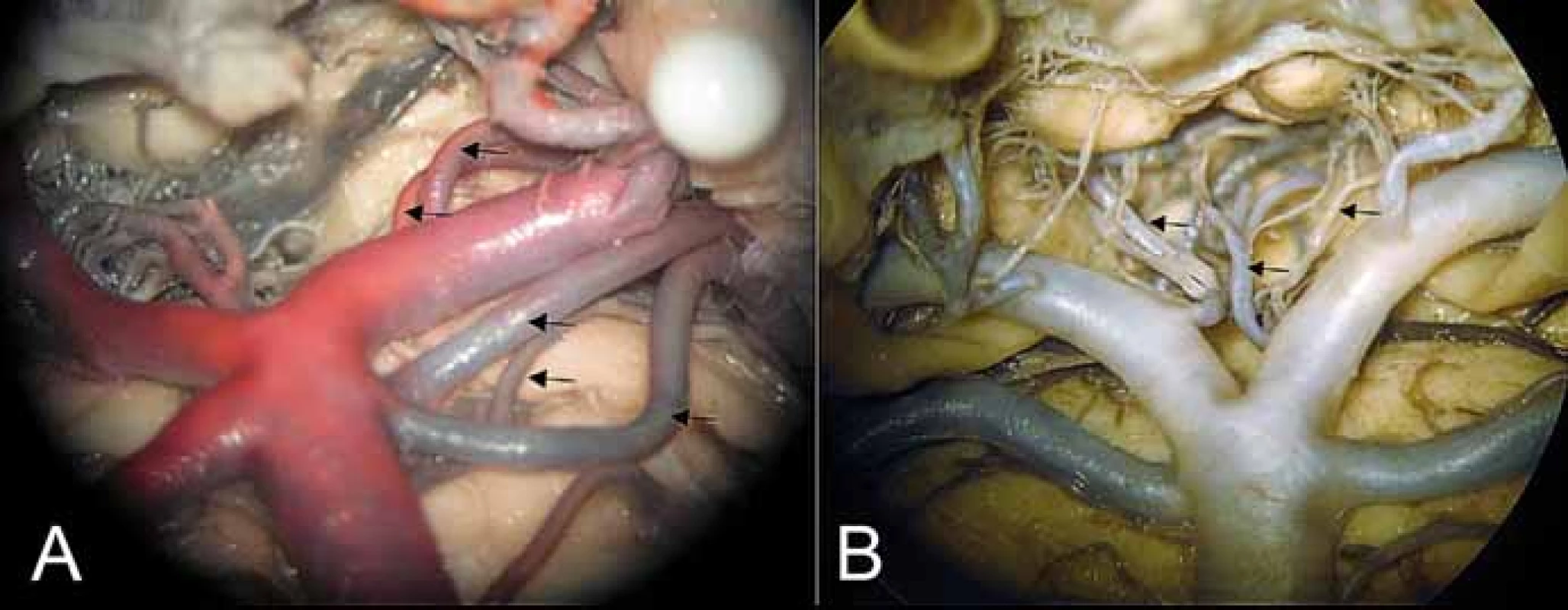
Laterální mezencefalické arterie jsou tenoučké s často vzájemně propojené. Dělíme je na arterie sulcus mesencephalicus lateralis a arterie brachium colliculi. Arterie sulcus mesencephalicus lateralis odstupují z SCA, a. collicularis, a. collicularis accessoria a z MPChA a zásobují spinotalamickou dráhu, lemniscus lateralis, RF v laterální části tegmenta, tractus centralis tegmenti a laterální část dolního colliculu. Arterie brachium colliculi odstupují stejně a směřují k brachium colliculi inferioris a superioris.
Mezi zadní mezencefalické arterie řadíme arteriální síť colliculi inferiores a arteriální síť colliculi superiores (obr. 5). Perforující větve pro colliculi inferiores odstupují z mediálního terminálního kmene SCA nebo z a. collicularis. Větve pro colliculi superiores odstupují z a. collicularis a jsou stejně jako větve pro dolní hrbolky oboustranně propojeny. Rostrální část colliculus superior je někdy zásobena z MPChA nebo mezencefalotalamické arterie. Rozlišují se krátké a dlouhé zadní mezencefalické perforátory. Krátké zasahují jen do střední části hrbolků, dlouhé pokračují až k dorzolaterální části PAG.
Obr. 5. (A) Perforující větvička (šipka) pro dolní colliculus vlevo odstupují z mediálního terminálního trunku arteria cerebelli superior vlevo, vpravo ekvivalent z rete collicullare inferius (šipka) z arteria choroidea posterior medialis (šipka kraniálně). (B) Arteriální síť colliculus superior vlevo z a. collicularis (šipka dole) a z arteria choroidea posterior medialis, ze které odstupuje i talamický perforátor (2 šipky nahoře).
Fig. 5. (A) Perforating branch (arrow) for the left inferior colliculus arising from the medial terminal segment of the left superior cerebellar artery, on the right side similar to the branch of the rete colliculare inferius (arrow) from the medial posterior choroidal artery (upper arrow). (B) Arterial plexus of the left superior colliculus arising from the collicular artery (lower arrow) and the from medial posterior choroidal artery. Two thalamic perforators are also visible arising from the medial posterior choroidal artery (2 upper arrows).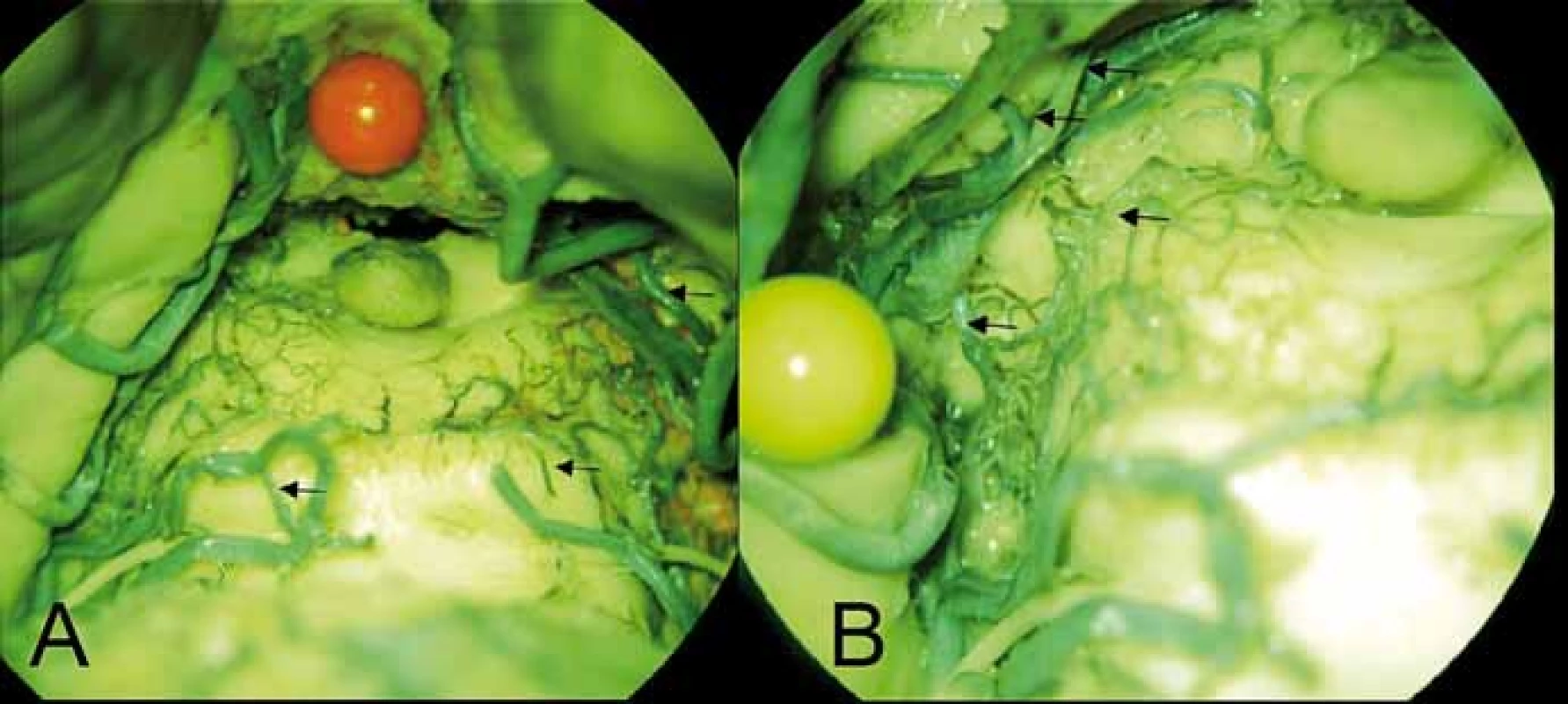
Při oftalmoplegii a parézách pohledu je klinicky důležitá znalost cévního zásobení pretektální oblasti, tedy oblastí Edinger-Westphalova jádra, FLM, Darkševičova jádra, ncl. interstitialis Cajali a pretektálních jader odpovědných za pupilární reflex a akomodaci. Schéma zásobení je obdobné výše zmíněnému, tedy přední perforátory z P1 a diencefalických perforátorů, laterální perforátory z MPChA a konečně zadní odstupující z MPChA, někdy z mezencefalotalamické arterie. Tyto penetrují do pretektální oblasti rostrálně od colliculus superior.
Ischemie kmene a její etiologie
Ischemie vertebrobazilárního povodí tvoří přibližně 20 % veškerých ischemických CMP (iCMP) [6]. Klasifikace TOAST (Trial of Org 10172 in Acute Stroke Treatment) definuje subtypy iCMP podle jejich příčiny, přičemž hlavními jsou ateroskleróza velkých tepen, nemoc malých tepen a kardioembolizace. Ischemická CMP jiných příčin a iCMP nejasné etiologie jsou méně časté. Ukazuje se, že mnohé kryptogenní infarkty jsou způsobeny nediagnostikovanou kardioembolizací [7,8]. Nouh et al udávají, že ateroskleróza velkých tepen byla příčinou 35 % iktů vertebrobazilárního povodí, nemoc malých tepen 13 % a kardioembolizmus 24 % [9]. V návaznosti na tradiční dělení TOAST byly vytvořeny klasifikace CCS (Causative Classification of Stroke System) a ASCO (A – atherosclerosis, S – small vessel disease, C – cardiac pathology, O – other causes), které se snaží dále specifikovat jednotlivé subtypy iCMP [10,11]. Výhoda klasifikace ASCO je v možnosti vyjádřit míru pravděpodobnosti příčinné souvislosti patologického procesu na vzniku iCMP v několika stupních. S ohledem na četnost disekcí jako příčiny iCMP zejména u mladší populace, u které tvoří až čtvrtinu iCMP, byla klasifikace modifikována na ASCOD (navíc D – dissection) [10]. Britt et al udávají, že vertebrální disekce je příčinou 2 % všech iCMP [12]. V současnosti se diskutuje o problematice embolizací nejasného zdroje (embolic stroke of undetermined source; ESUS). Jako ESUS je definována nelakunární příhoda (> 1,5 cm na CT nebo > 2 cm na MR) při absenci významné ipsilaterální stenózy velké tepny (> 50 %), srdečního onemocnění s vysokým rizikem embolizace či jiných specifických příčin. Zdrojem ESUS může být kromě nediagnostikované fibrilace síní i foramen ovale patens, aortální nebo nestabilní karotický aterosklerotický plát, onemocnění srdečních chlopní či koagulopatie při neoplaziích [13]. Specifickou, vzácnou a obtížně řešitelnou příčinou ischemie zadní jámy je vertebrobazilární dolichoektázie, která je charakterizována významným rozšířením, prodloužením a tortuozitou vertebrobazilárních tepen [14]. Opakem předešlého je hypoplazie AV, vrozená varieta, jejíž klinický význam je předmětem diskuzí. Usuzuje se, že pacienti s hypoplazií AV jsou více vulnerabilní k ischemii v zadním povodí, zejména v koincidenci s dalšími rizikovými faktory iCMP [15]. Z dalších méně častých příčin uvádíme vertebrální steal syndrom, vaskulitidy, syndrom zadní reverzibilní encefalopatie (posterior reversible encephalopathy syndrome; PRES), syndrom reverzibilní mozkové vazokonstrikce (reversible cerebral vasoconstriction syndrome; RCVS), střádavá onemocnění (Fabryho nemoc), případně další [9].
Patofyziologickým podkladem iCMP je snížení cerebrální perfuze s rizikem rozvoje ischemické nekrózy, přičemž stále je uznáván koncept penumbry [16,17]. Jádro ischemické tkáně v okludovaném povodí a perfuzí nižší než 10 ml/ 100 g/ min podléhá ischemické nekróze. Okolí jádra s perfuzí 10 – 18 ml/ 100 g/ min je oblastí penumbry (ischemického polostínu), elektricky a funkčně inaktivní tkáně. Oblast penumbry podléhá nekróze, pokud se včas neobnoví krevní průtok. Vnější část ischemické tkáně tvoří zóna benigní oligemie, oblast s nižší perfuzí 20 – 50 ml/ 100 g/ min, však funkčně zachovalá [17]. Promptní obnovení perfuze zóny penumbry by mělo být hlavním cílem reperfuzní terapie [18].
Syndromy lézí mozkového kmene a jejich anatomické souvislosti
Symptomatika postižení zadní jámy je typická a sestává z projevů poruch funkce mozkového kmene a mozečku. Jedná se o závrať, nauzeu, poruchu rovnováhy, nystagmus, ataxie, poruchy vědomí či specifická postižení vyplývající z poruchy funkce jednotlivých jader či drah [19]. Mozkový kmen má ve svém průřezu na malé ploše uloženo velké množství struktur, a proto i malé postižení může způsobit výrazné klinické obtíže. Symptomy jsou závislé na lokalizaci postižení v mozkovém kmeni, ať již na úrovni vertikální (medulla, pons, mezencefalon), tak na úrovni horizontální (motorická jádra jsou uložena spíše mediálně, senzitivní laterálně). Charakteristický klinický obraz postižení různých etáží mozkového kmene vedl k popsání kmenových alternujících syndromů. Historicky bylo popsáno množství kmenových syndromů, které byly pojmenovány po jejich objevitelích [20]. V praxi má největší význam Wallenbergův syndrom. Ostatní eponyma kmenových syndromů mají spornou klinickou relevanci, klinický obraz je často modifikován či jsou zachyceny jen velmi zřídka [21,22]. Více než užívání eponym je preferováno členění morfologicko-funkční [23]. Dle anatomické lokalizace uvádíme následující syndromy vč. vaskulárního teritoria a klinické manifestace, jejich přehled obsahuje tab. 1.
Tab. 1. Vaskulární kmenové syndromy. 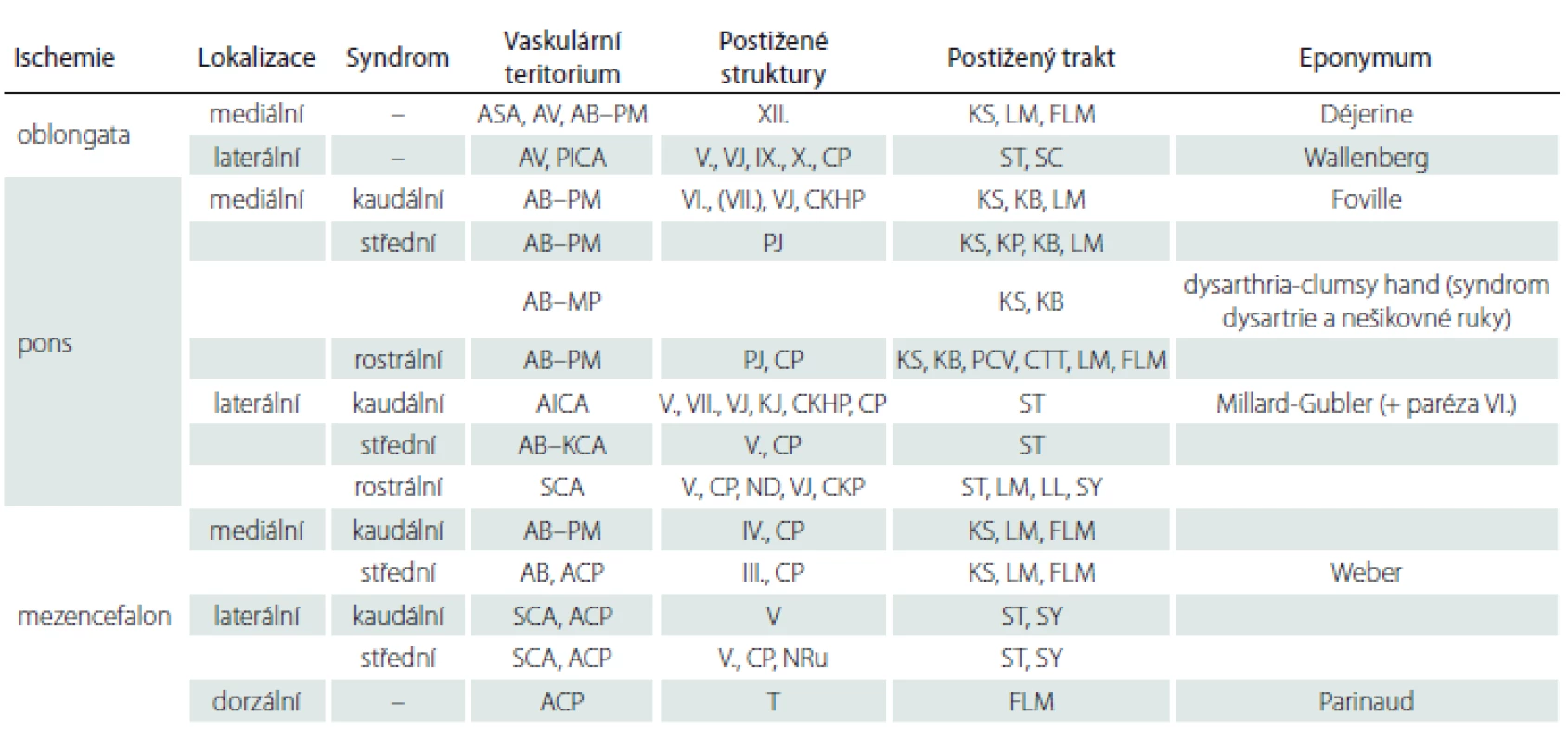
AB – arteria basilaris; ACP – arteria cerebri posterior; AICA – arteria cerebelli inferior anterior; ASA – arteria spinalis anterior; AV – arteria vertebralis; CKHP – centrum konjugovaného horizontálního pohledu (PPRF); CKP – centrum kontralaterální pohledu; CP – cerebelární pedunkl; CTT – centrální tegmentální trakt; FLM – fasciculus longitudinalis medialis; KB – kortikobulbární trakt; KCA – krátké cirkumferenční arterie; KJ – kochleární jádro; KP – kortikopontinní trakt; KS – kortikospinální trakt; LL – lemniscus lateralis; LM – lemniscus medialis; MP – mediální perforátory; ND – nucleus dentatus cerebella; NRu – nucleus ruber; PCV – pontocerebelární vlákna; PICA – arteria cerebelli inferior posterior; PJ – pontinní jádra; PM – paramediánní větve; SC – spinocerebelární trakt; SCA – arteria cerebelli superior; ST – spinothalamický trakt; SY – sympatická vlákna; T – tectum; VJ – vestibulární jádra Mediální medulární syndrom (Dejerinův syndrom)
Mediální medulární syndrom je způsoben uzávěrem anteromediálních větví ASA a AV (PICA je intaktní) [4]. Jsou poškozeny motorické jádro n. XII., kortikospinální trakt, LM, případně FLM. Syndrom je charakterizován ipsilaterální parézou jazyka jádrového typu, kontralaterální hemiparézou a kontralaterální poruchou propriocepce [20,24,25] (obr. 6A).
Obr. 6. (A) Obraz mediálního bulbárního syndromu dle Dejerina a (B) laterálního medullárního syndromu dle Wallenberga na difuzí vážených obrazech MR.
Fig. 6. (A) Image of the medial medullary syndrome (Dejerine syndrome) and (B) lateral medullary syndrome (Wallenberg syndrome) on diff usion weighted MRI.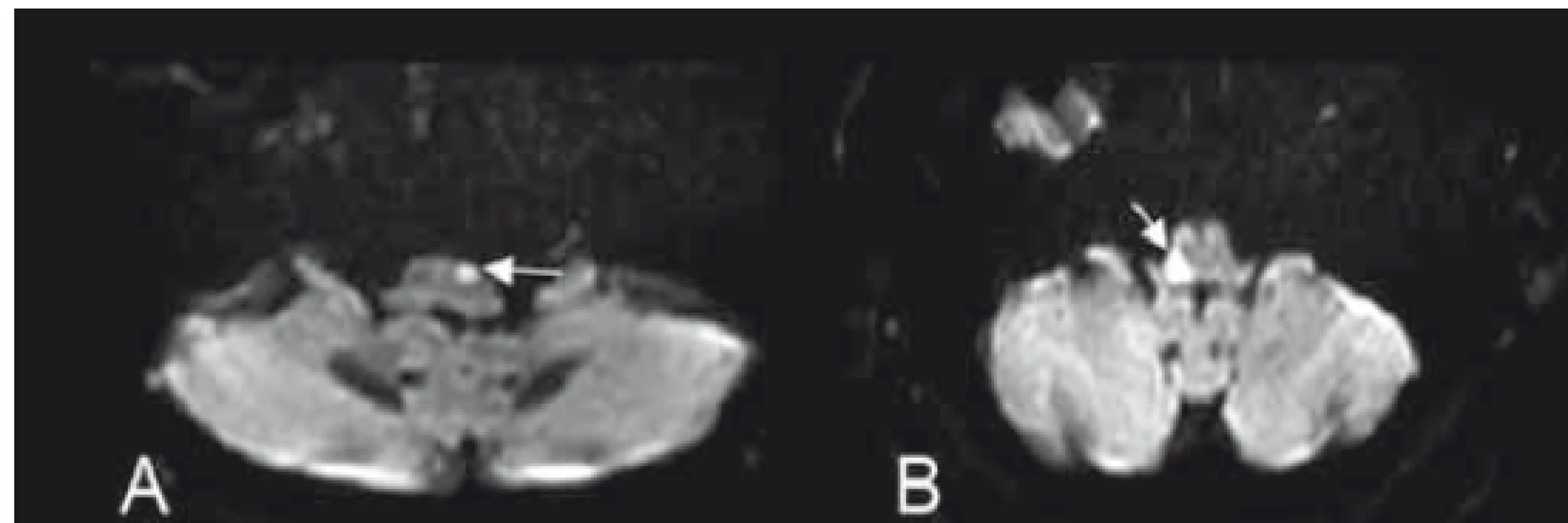
Laterální medulární syndrom (Wallenbergův syndrom)
Laterální medulární syndrom může být následkem uzávěru perforátorů z AV nebo PICA [4]. Syndrom zahrnuje poškození jader n. V. (ncl. spinalis nervi trigemini), n. IX. a n. X. (ncl. ambiguus), pedunculus cerebellaris inferior (CR) spinotalamického traktu, spinocerebelárního traktu a descendentních drah sympatiku [20,24]. Klinickou manifestací jsou dysfagie při paréze měkkého patra, ipsilaterální hemiataxie (léze CR), hypalgezie a ztráta tepelného čití obličeje ipsilaterálně a končetin kontralaterálně. Bývají přítomny nystagmus a ipsilaterální Hornerův syndrom [20]. Vertigo, nauzea a vomitus vychází z léze vestibulárních jader. Někdy se objevuje singultus jako následek léze respiračního centra v medulla oblongata [4] (obr. 6B).
Laterální pontomedulární syndrom
Je variantou laterálního medulárního syndromu při uzávěru aberantní rostrolaterální větve z AV zásobující komplex vestibulokochleárního nervu. Syndrom je kromě příznaků laterálního medulárního syndromu navíc spojen s lézí n. VII. centrálního typu, tinitem a poruchou sluchu [4].
Mediální dolní pontinní syndrom (Fovilleův syndrom)
Mediální dolní pontinní syndrom je způsoben poškozením kaudálních anteromediálních perforátorů z AB [4]. Léze postihuje jádro n. VI. (někdy n. VII.), vestibulární jádra, centrum konjugovaného horizontálního pohledu, kortikospinální a kortikobulbární trakt, LM. Vznikají ipsilaterální paralýza konjugovaného pohledu, ipsilaterální hemiataxie (léze středního cerebelárního pedunkulu), kontralaterální hemiparéza a porucha taktilního čití a propriocepce [20,24,25].
Mediální střední pontinní syndrom
Léze perforátorů ze střední části AB, ze kterých odstupují i anterolaterální arterie, způsobují poškození pontinních jader, LM, kortikospinálního, kortikobulbárního a kortikopontinního traktu. Klinicky se projevuje parézou horizontální pohledu, ipsilaterální hemiataxií, kontralaterální hemiparézou a poruchou taktilního čití a propriocepce [4,20,24]. Variantou postižení v této lokalitě je syndrom dysartrie a nešikovné ruky (dysartria-clumsy hand). Je způsoben lézí středních perforátorů z AB bez poškození anterolaterálních arterií, je řazen mezi lakunární syndromy [4,26]. Dochází k poruše převážně kortikobulbárních vláken a částečně kortikospinálních vláken, která způsobuje kontralaterální lézi lícního nervu a monoparézu ruky. Bývá přítomna dysfagie [4].
Mediální horní pontinní syndrom
Syndrom vzniká při postižení rostrálních perforátorů z AB a jejich anterolaterálních větví. Dochází k lézi pontinních jader, struktur cerebelárního pedunkulu, kortikospinálního a kortikobulbárního traktu, pontocerebelárních vláken, centrálního tegmentálního traktu a k lézi LM a FLM. Výsledkem jsou internukleární oftalmoparéza, kontralaterální hemiparéza, léze lícního nervu a hemiataxie, vzácně i porucha citlivosti pro dotyk a vibrace. Postižení v této oblasti může způsobit myoklonický syndrom patra, faryngu a hlasivek. Přesný generátor je však nejasný, uvažuje se o centrálním tegmentálním traktu, projekcích do ncl. dentatus či ncl. olivaris inferior [4,20,24].
Laterální dolní pontinní syndrom
Syndrom je důsledkem léze kaudolaterálních perforátorů z AICA [4]. Ischemií v tomto teritoriu jsou poškozena jádra n. V., n. VII., vestibulární a kochleární jádra, centrum konjugovaného horizontálního pohledu, pedunculus cerebellaris medius. Dochází k poškození spinotalamického traktu, případně k lézi descendentních drah sympatiku. Klinicky dominují ipsilaterální faciální paréza, porucha čití obličeje, hemiataxie a porucha horizontálního pohledu. Kontralaterálně se projevuje poruchou algického a termického čití. Z dalších příznaků mohou být přítomny závrať, nauzea, nystagmus, tinitus a hluchota [4,20,24]. Variantou tohoto syndromu je tradiční alternující hemisyndrom Millard-Gublerův (hemiplegia alternans media). Navíc k ipsilaterální lézi nervus facialis a kontralaterální hemiparéze je u tohoto syndromu přítomna ipsilaterální léze nervus abducens [25,27,28] (obr. 7A).
Obr. 7. (A) Millard-Gublerův syndrom a (B) laterální střední pontinní syndrom na difuzí vážených obrazech MR.
Fig. 7. Diff usion weighted MRI showing images of Millard-Gubler syndrome (A) and lateral middle pontine syndrome (B).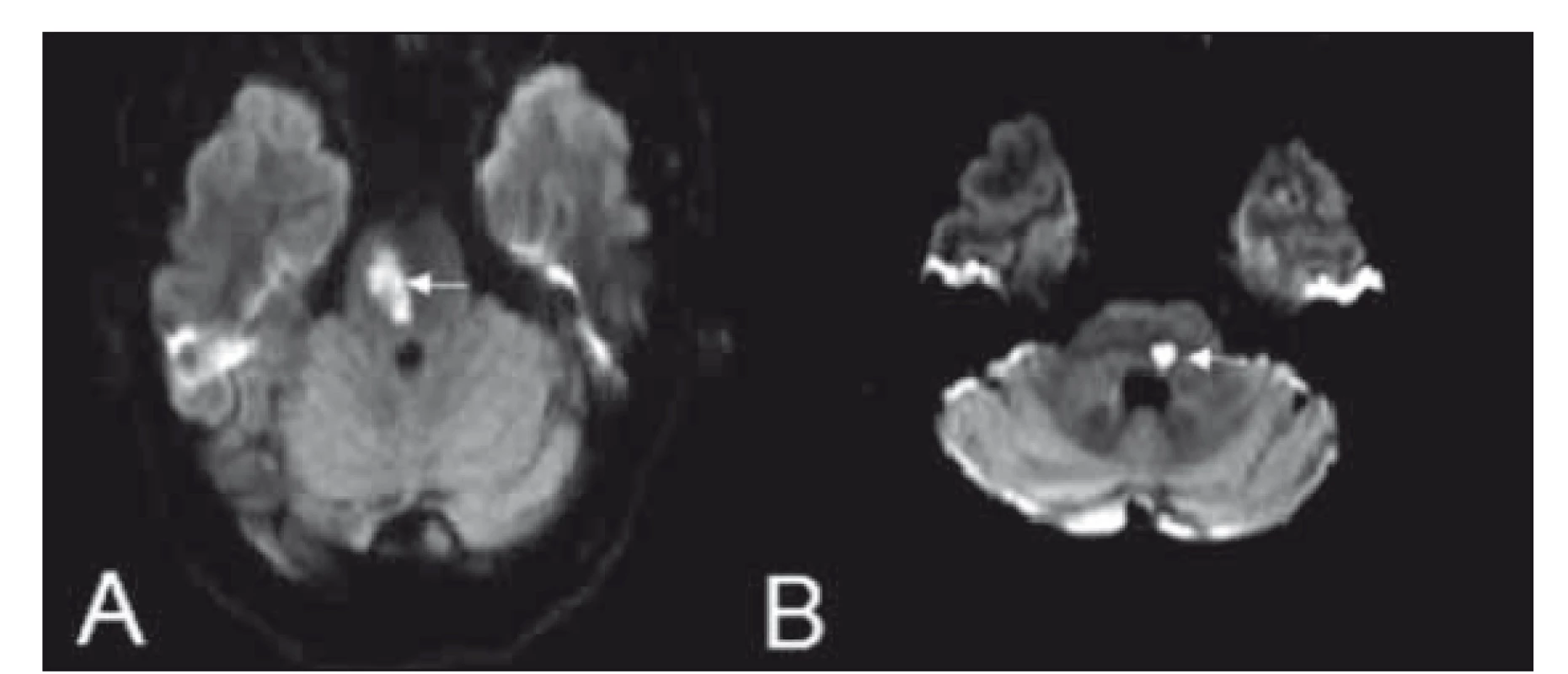
Laterální střední pontinní syndrom
Syndrom vzniká z okluze superolaterální arterie (krátká cirkumflexní arterie). Léze postihuje jádro n. V., cerebelární pedunkl, spinotalamický trakt pod obrazem parézy žvýkacích svalů (inervovaných n. V.), ipsilaterální hemiataxií a poruchou čití obličeje, kontralaterální končetinovou poruchou algického a termického čití [4,24] (obr. 7B).
Laterální horní pontinní syndrom
Vzniká při poškození rostrolaterální penetrující větve nebo její mateřské tepny (SCA) vyživující jádro n. V., ncl. dentatus cerebella, vestibulární jádra, cerebelární pedunkl a centrum konjugovaného pohledu [4,20,24]. Lokálně mohou být postiženy dráhy LM a lemniscus lateralis, dráhy sympatiku a spinotalamický trakt. Klinický obraz je rozmanitý a zahrnuje ipsilaterální parézu žvýkacích svalů (inervovaných n. V.), ipsilaterální hemiataxii, poruchu čití obličeje, parézu konjugovaného pohledu, tremor a kontralaterální poruchu čití končetin jak algického a termického, tak i hlubokého. Může být přítomen Hornerův syndrom [20,24].
Mediální dolní mezencefalický syndrom
Syndrom je následkem poruchy cirkulace v povodí paramediánních větví AB, které zásobují zejména n. IV., horní cerebelární pedunkl. Oblastí prochází kortikospinální trakt, LM a FLM. Postižení vychází z výše uvedeného – kontralaterální porucha n. IV., internukleární oftalmoparéza, ataxie a kontralaterální hemiparéza a porucha algické a vibrační citlivosti [4,20].
Mediální střední mezencefalický syndrom
Jeho vaskulární teritorium kromě perforátorů AB zahrnuje i větve zadní mozkové tepny. Postiženými strukturami jsou jádro n. III., horní cerebelární pedunkl, kortikospinální trakt, LM a FLM. Klinicky se syndrom manifestuje lézí n. III., ataxií, internukleární oftalmoparézou, kontralaterání hemiparézou a poruchou hluboké citlivosti [4,20]. Tradiční název lézí n. III. spolu s kontralaterální hemiparézou je syndrom Weberův [29] (obr. 8). Jinou variantou syndromu při poruše supranukleární regulace horizontálního pohledu a kontralaterální pohledovou parézou je syndrom Fovilleův. Podobně jako syndrom Weberův je dáván do souvislosti s uzávěrem pedunkulárního perforátoru [4,20].
Obr. 8. (A, B) Difuzí vážené obrazy MR – Weberův syndrom kombinovaný s talamickou ischemií a (C) mediodorzální mezencefalický syndrom, spojený s okohybnou poruchou - pravý bulbus deviován laterálně, levý bulbus s parézou mediálního pohledu, přítomen dyskonjugovaný pohyb bulbů, nystagmus při vertikálním pohledu vzhůru, kvadruataxie akcentovaná vpravo a dysartrie.
Fig. 8. (A, B) Diff usion weighted MRIshowing an image of Weber syndrome in combination with thalamic ischemia. (C) Mediodorsal mesencephalic syndrome involving ophthalmoparesis – right eyeball deviated laterally, paresis of the medial movement of the left eyeball, disconjugated eye movement, vertical upper gaze nystagmus, quadriataxia and dysarthria.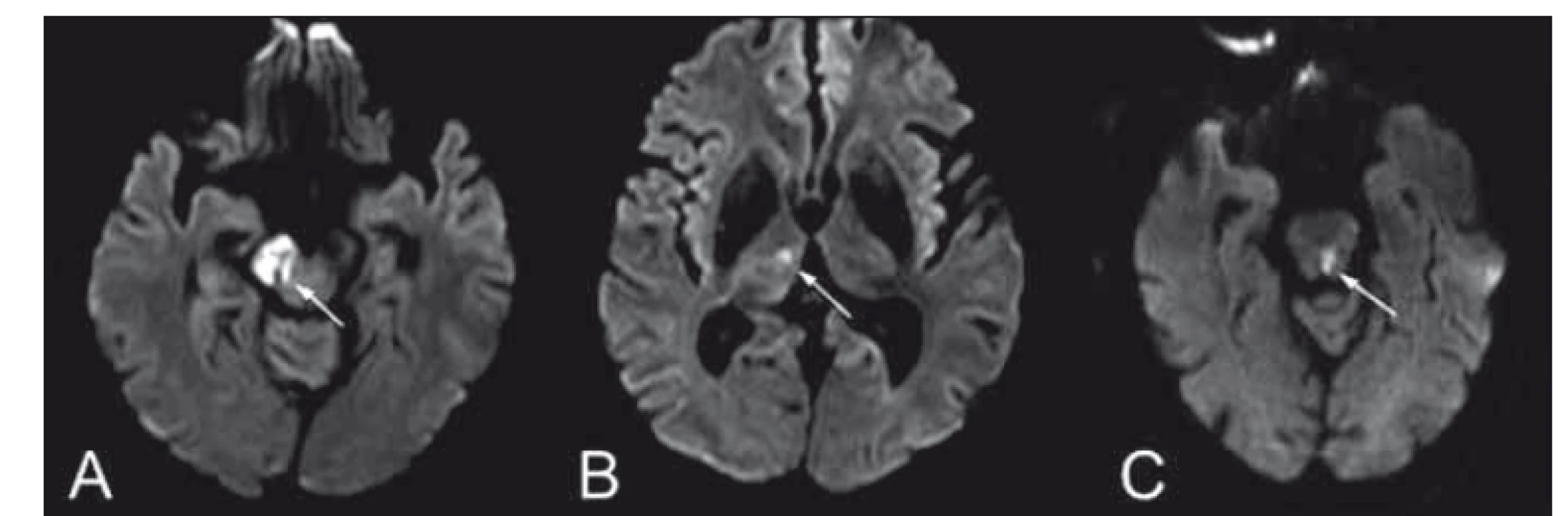
Laterální dolní mezencefalický syndrom
Laterální mezencefalon je vaskularizováno z povodí SCA a ACP [4]. Porucha perfuze v dolním laterálním mezencefalu se projevuje ipsilaterální poruchou citlivosti obličeje a kontralaterální končetinovou poruchou algického a termického čití při poruše jádra n. V. a spinotalamického traktu. Bývá přítomen Hornerův syndrom při poškození drah sympatiku [20].
Laterální střední mezencefalický syndrom
Syndrom vzniká stejně jako předešlý syndrom při poruše perfuze větví SCA a ACP [4,24]. I klinický obraz je podobný, oproti předešlému syndromu bývají však přítomny tremor (při poruše ncl. ruber) a hemiataxie (při lézi cerebelárního pedunklu), někdy chorea [20].
Dorzální mezencefalický syndrom (Parinaudův syndrom)
Dorzální mezencefalický syndrom je důsledkem poruchy tegmenta mezencefala (ncl. interstitialis Cajali nebo rostrálního intersticiálního jádra pro pohled vzhůru), může být postižen i FLM. Jedná se o narušení pretektálních interpedunkulárních perforátorů nebo dorzální penetrující větve MPChA z vaskulárního teritoria zadní mozkové tepny. Pro vznik poruchy pohledu vzhůru stačí léze na jedné straně nebo léze commissura posterior. Porucha pohledu dolů vzniká při oboustranné lézi. Bývají přítomny obraz Argyll Robertsonovy zornice, někdy retrakce horního víčka a nystagmus [4,20] (obr. 8).
Další kmenové syndromy
Locked in syndrom vzniká při oboustranné okluzi anterolaterálních arterií na úrovni horního pontu (případně oblongaty, capsula interna, případně vzácně crus cerebri – tzv. mezencefalický locked in syndrom při okluzi interpedunkulárních perforátorů z povodí ACP). Dochází k lézi obou pyramidových drah, a tedy ke kvadruplegii, k lézi kortiko-bulbárních vláken zejména inervujících ncl. ambiguus, dochází k anartrii (afonii). Funkce RF je zachována, pacient je plně při vědomí. Je zachováno otevírání oči a vertikální pohled jako jediná možnost komunikace [4,20].
Lakunární syndromy. Je popisováno pět hlavních lakunárních syndromů, z nichž čtyři se vyskytují v mozkovém kmeni (kromě čistě senzitivního iktu) [30]. Čistě motorická hemiparéza může vzniknout jako důsledek lakunárního infarktu baze pontu nebo medulární pyramidové dráhy jako důsledek poruchy perfuze ASA, AV a anterolaterálních perforátorů. Projevuje se hemiparézou kontralaterálně [4,30]. Podobně ataktická hemiparéza může být důsledkem lakuny v pontu, klinicky se projevuje ataxií dominantně na dolní končetině. Senzomotorický lakunární iktus vzniká vzácně při lézi paramediánního pontu. A konečně syndrom dysartrie a nemotorné ruky, který byl uveden výše. Kromě těchto pěti bylo popsáno mnoho jiných lakunárních iktů (izolovaná dysartrie, izolovaná léze lícního nervu, izolovaná ataxie, hemichorea – hemibalismus, čistá hemiparéza s internukleární oftalmoparézou a jiné) [30].
Zobrazovací metody v diagnostice ischemií mozkového kmene
Moderní zobrazovací metody umožňují rychle získat informace o viabilitě mozkové tkáně, mozkové perfuzi a stavu cév.
Nekontrastní CT mozku (NCCT) je doporučována jako modalita první volby při diagnostice akutní mozkové příhody [31]. V managementu mozkové příhody pomáhá rozhodnout o indikaci intravenózní trombolýzy [32]. Nicméně senzitivita vyšetření NCCT pro zobrazení kmenové ischemie je nízká [33].
Výpočetně tomografická angiografie (CTA) je doporučovanou modalitou u všech pacientů s klinickými příznaky mozkové příhody či tranzitorní ischemické ataky. CTA je rychlou a jednoduchou zobrazovací metodou v detekci intra - a extrakraniálních stenóz a okluzí [34].
Alberta Stroke Programme Early CT Score (ASPECT) umožňuje kvantitativní hodnocení mozkového infarktu karotického povodí pomocí CT. Jedná se o škálu o 10 bodech, přičemž hodnoty 7 a méně predikují horší klinický výsledek [35]. Pro zadní povodí byla vytvořena analogická škála o 10 bodech – posterior circulation Acute Stroke Prognosis Early CT Score (pc-ASPECTS), která hodnotí časné ischemické změny pomocí CT a pro zlepšení senzitivity i dle zdrojových snímků CTA (CTA Source Images; CTASI). Časné ischemické změny v pontu a mezencefalu jsou hodnoceny 2 body, 1 bodem jsou hodnoceny ischemie talamu, okcipitálního laloku a mozečku pro každou stranu. Hodnoty pc-ASPECTS pod 8 jsou spojeny s horší prognózou [36]. Ke správné evaluaci časných ischemických změn na obraze NCCT je doporučován opakovaný trénink [37]. Pc-ASPECTS lze hodnotit i pomocí MR. Dle výsledků klinických studií je pc-ASPECTS hodnocený pomocí difuzí vážených skenů (diffusion weighted imaging; DWI) MR silným prediktorem klinického výsledku u pacientů s ischemií zadního povodí [38]. Skóre ASPECTS je využíváno k indikaci mechanické trombektomie. Dle doporučení Cerebrovaskulární sekce České neurologické společnosti (CVS ČNS) jsou indikačními kritérii hodnoty ASPECTS ≥ 6 na CT (případně ≥ 5 na MR), trombektomie však může být prospěšná i u pacientů s nižšími hodnotami ASPECTS [39,40]. Pro definitivní hodnocení efektu mechanické trombektomie u pacientů s nižším skóre ASPECTS je třeba vyčkat výsledků randomizovaných studií [41,42].
S ohledem na vyšší senzitivitu je pro diagnostiku ischemií zadní jámy preferovaným zobrazením MR [33,43]. Senzitivita MR v diagnostice akutního ischemického iktu je oproti vyšetření CT přibližně 4× vyšší [44]. V protokolu zobrazení akutního iktu jsou nejčastěji užívány sekvence DWI, fluid attenuated inversion recovery (FLAIR), MRA, perfussion-weighted imaging (PWI) a T2* zobrazení. Sekvence DWI jsou velmi senzitivní pro cerebrální ischemii [45]. Nicméně standardní axiální zobrazení DWI má své limitace zejména pro zobrazení malých infarktů v mozkovém kmeni, kdy může být výsledek falešně negativní. Byly publikovány studie, které doporučují ke zvýšení senzitivity doplnění tenkých sagitálních řezů DWI [46]. DWI spolu se zobrazením FLAIR dokážou odlišit léze akutní, subakutní a chronické. V detekci cévních stenóz a okluzí lze užít MRA, avšak s nižší senzitivitou oproti zlatému standardu – DSA. Jsou dvě základní modality MRA. Třídimenzionální time-on-flight angiografie (3DTOF) pro zobrazení intrakraniálních tepen a postkontrastní MRA (CE-MRA) za použití paramagnetické látky (např. gadolinia) pro zobrazení extra - a intrakraniálních cév. Obě metody se vzájemně doplňují. Zobrazení PWI využívá paramagnetické kontrastní látky a spolu se sekvencemi DWI umožňuje lépe posoudit prokrvení tkáně postižené ischemií. Rozdílných magnetických vlastností oxygenovaného a deoxygenovaného hemoglobinu je využíváno v T2* vážených obrazech. Deoxygenovaný hemoglobin je paramagnetický, jeho akumulace ve tkáni se projevuje hypointenzními změnami v T2* zobrazení. Takto mohou být detekovány intrakraniální krvácení či hemoragická transformace ischemie. Technika susceptibility weighted imaging (SWI) umožnila rozšíření možností T2* zobrazení [45]. SWI má vyšší senzitivitu pro zobrazení cerebrálních hemoragií oproti T2* i vyšetření CT [47]. Mezi neinvazivní metody MR u pacientů s iktem v zadním povodí lze zařadit stanovení průtoku krve mozkovými cévami pomocí kvantitativní MRA (qMRA) spojené s komerčně dostupným softwarovým programem Non-invasive Optimal Vessel Analysis (NOVA). Toto vyšetření je indikováno u pacientů s alespoň 50% symptomatickou stenózou velkých cév (AB a AV), kteří jsou s odstupem kandidáty k endovaskulární intervenci nebo chirurgické transpozici vertebrální tepny [48 – 50].
Ultrazvukové vyšetření poskytuje možnost rychlého a neinvazivního zobrazení krčních a intrakraniálních tepen. Tak jako je UZ vyšetření metodou první volby u pacientů s podezřením na karotickou stenózu, v detekci stenóz AV má své limitace [51,52]. V zadním povodí umožňuje zobrazení a detekci stenóz obou AV, transforaminálním přístupem lze vyšetřit proximální AB a transtemporálním přístupem distální úsek AB. UZ je cenným nástrojem v detekci vertebrálního steal syndromu [51].
Reperfuzní terapie
Hlavním cílem v terapii akutní iCMP je obnovení perfuze infarktem ohrožené mozkové tkáně. V současnosti dominují dva přístupy obnovení cerebrální perfuze, farmakologická rekanalizace prostřednictvím intravenózní trombolýzy (rekombinantní technikou vyrobeného tkáňového aktivátoru plazminogenu – IV-rtPA) a endovaskulární intervence. Oba přístupy mají své limitace a vzájemně se doplňují [39,53]. Dle doporučeného postupu pro intravenózní trombolýzu (IVT) CVS ČNS (2014) i dle doporučení American Heart Association/American Stroke Association (AHA/ ASA) pro časný management pacientů s iCMP (2018) je IVT indikována do 4,5 h od počátku příznaků [32,54]. Dle CVS ČNS je v případě akutní okluze AB akceptováno podání IVT i po standardním časovém okně [32]. AHA/ ASA ve svých doporučeních nespecifikuje trombolytickou terapii při infarktu zadního povodí [54]. Některé zdroje uvádí, že terapie trombolýzou při ischemii zadního povodí je bezpečnější než při ischemii povodí karotického [55] a je spojena s nižším výskytem symptomatického intrakraniálního krvácení [56]. Dorňák et al udávají, že IVT v zadní cirkulaci může být přínosná i po 4,5 h od vzniku příznaků [55]. V případě uzávěru AB hraje významnou roli kvalita kolaterální cirkulace. Za nejsilnější prediktor špatného klinického výsledku je považováno jedno - nebo oboustranné chybění zadní komunikanty [57].
Zhruba 1 % akutních iCMP tvoří okluze AB, která je řešitelná endovaskulárně. Tito pacienti, kteří se prezentují obvykle závažnou klinickou symptomatologií, mají špatnou prognózu při porovnání s okluzí velké tepny v karotickém povodí [58]. Účinnost mechanické trombektomie v karotickém povodí byla ověřena řadou randomizovaných studií a je při splnění indikačních kritérií doporučeným postupem [54,59,60]. U okluzí AB a ostatních velkých větví v zadním povodí tyto důkazy založené na randomizovaných studiích chybí. Nicméně analogicky k přednímu povodí a s přihlédnutím k velmi nepříznivému přirozenému průběhu onemocnění je mechanická trombektomie v ČR doporučeným postupem [59]. Dle doporučení AHA a ESO-ESMINT by měla vždy být zvažována tato terapeutická možnost [54,60]. Mechanická rekanalizace může být provedena pomocí stent-retrieveru či s použitím aspiračního katetru. V retrospektivní multicentrické studii BEYOND-SWIFT (NCT03496064) byla technická úspěšnost rekanalizace 90,3 %. Klinický efekt intervence byl obdobný ve srovnání s karotickým povodím s nesignifikantním trendem k nižší úspěšnosti (modifikovaná Rankinova škála [mRS] 0 – 2, 36,2 vs. 42,9 %; p = 0,12) a signifikantně vyšší mortalitě (36,2 vs. 24,4 %; p = 0,002). Prediktory marné rekanalizace byly věk, horší klinický stav a implantace intrakraniálního stentu [61]. Baik et al porovnávali okluze AB na podkladě embolizace a aterosklerotické stenózy s nasedající trombózou (24 %). Pacienti s embolií do AB měli vyšší stupeň rekanalizace (85 vs. 55 %; p = 0,01) a dosahovali signifikantně lepšího klinického stavu (53 vs. 20 %; p = 0,02) [62]. Multicentrická, randomizovaná čínská studie BEST srovnávající intervenční a medikamentózní léčbu okluzí AB byla předčasně ukončena. Důvody byly pomalý náběr pacientů a vysoký počet případů (22 %), kdy po randomizaci do medikamentózní větve rodiny pacientů odmítly konzervativní léčbu a pacienti byli léčeni endovaskulárně. Při analýze obou větví nebyl rozdíl v dosažené hodnotě mRS 0 – 3 v 90 dnech. Při sekundární analýze pacienti, kteří byli opravdu léčeni intervenčně, signifikantně častěji dosáhli soběstačnosti (mRS 0 – 2) 39 vs. 19 %. Tento výsledek může být ovlivněn nerovnováhou mezi oběma léčenými skupinami [63].
Další významnou příčinou ischemie v zadním povodí jsou aterosklerotické stenózy. Symptomatická intrakraniální stenóza má 2leté riziko recidivy iktu 14 – 19 %, přičemž většina příhod nastane v prvním roce. Naopak asymptomatická stenóza léčená medikamentózně má roční riziko iktu < 2 % [64]. Kontroverzní multicentrická randomizovaná studie Stenting and Aggressive Medical Management for Preventing Recurrent Stroke (SAMMPRIS) byla předčasně ukončena. Recidiva iktu ve 30 dnech dosáhla v intervenční skupině 14,7 % a byla signifikantně vyšší než v konzervativně léčené skupině s 5,8 % [65]. Obdobně multicentrická studie Vitesse Intracranial Stent Study for Ischaemic Stroke Therapy (VISSIT) byla předčasně ukončena pro signifikantně vyšší počet komplikací v intervenčně léčené skupině (36,2 vs. 15,1 % v medikamentózně léčené skupině) [66]. Nejvyšší riziko komplikací mají stenózy na tepnách s vysokým výskytem perforátorů, tedy úsek M1 střední mozkové tepny (ACM) a zejména AB. V monocentrické retrospektivní studii byly srovnány intervence v úseku M1 ACM a AB. V zadním povodí byl výskyt periprocedurálních komplikací a iktu během sledování významně vyšší (25 vs. 11,4 %; p = 0,024). Periprocedurální ikty byly způsobeny většinou (73,3 %) okluzí perforujících tepen. Ikty během dalšího sledování byly zapříčiněny distálními embolizacemi (57,1 %) či okluzí stentů (42,1 %) [67]. Studie WEAVE byla zaměřena na periprocedurální bezpečnost stentu Wingspan při léčení intrakraniálních stenóz. Počet periprocedurálních iktů, krvácení a úmrtí do 72 h od intervence dosáhl 2,6 %. Takto nízké procento komplikací bylo ovlivněno výběrem velmi zkušených operatérů, striktními indikacemi a léčebným protokolem. Hlavní limitací této studie je velmi krátká doba sledování, která činila pouze 72 h [68]. V současné době tedy nelze považovat intrakraniální angioplastiku či implantaci stentu za doporučený postup. Není evidence identifikující podskupinu pacientů, která by profitovala z intervence ve srovnání s maximální medikamentózní léčbou. Nicméně za specifických situací může být zvažována, pokud je provedena zkušeným lékařem [69]. Americký Úřad pro kontrolu potravin a léčiv (Food and Drug Administration; FDA) připouští použití stentu za splnění všech níže uvedených podmínek: 70 – 99 % aterosklerotická stenóza s recidivujícími ikty, dobrý funkční stav s mRS 0 – 3, dva a více iktů při agresivní medikamentózní terapii, intervence nejdříve 7 dní po posledním iktu [70].
Závěr
Mozkový kmen je složitá anatomická struktura s množstvím jader a drah na poměrně malé ploše. Ischemie kmene se tak může projevovat komplexní symptomatikou často s významným funkčním neurologickým deficitem. Z tohoto důvodu nabývá na významu znalost tepen vertebrobazilárního povodí a jeho, byť malých, kmenových perforujících arterií. Současné možnosti zobrazení jak mozkové tkáně, tak angiografie umožňují pomoci volbě adekvátní a rychlé léčebné reperfuzní strategie.
Grantová podpora
Podpořeno granty IGA-KZ-217112005, IGA-KZ-2018-2-8 a IGA-KZ-2018-2-9.
Poděkování Anatomickému ústavu 1. LF UK za poskytnutí mikroskopických řezů mozkového kmene a laboratorního zázemí.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Robert Bartoš, Ph.D.
Neurochirurgická klinika
Univerzity J. E. Purkyně
Masarykova nemocnice
Krajská zdravotní a.s.
Sociální péče 3316/12A
400 11 Ústí nad Labem
e-mail: robert.bartos@kzcr.eu
Přijato k recenzi: 28. 11. 2019
Přijato do tisku: 4. 2. 2020
Zdroje
1. O’Rahilly R, Müller F. Developmental stages in human embryos: revised and new measurements. Cells Tissues Organs 2010; 192(2): 73 – 84. doi: 10.1159/ 000289817.
2. Hill MA. Embryology carnegie stages. [online]. Available from URL: https:/ / embryology.med.unsw.edu.au/ embryology/ index.php/ Carnegie_Stages.
3. ten Donkelaar H, Lammens M, Hori A. Clinical neuroembryology. Berlin, Germany: Springer 2014.
4. Marinković S, de Divitiis O, Nikodijević I. Arteries of the brain and spinal cord: anatomic features and clinical significance. Avellino, Italy: De Angelis 1997.
5. Rhoton A. Cranial anatomy and surgical approaches. Lippincot, USA: Williams & Wilkins 2003.
6. Mehndiratta M, Pandey S, Nayak R et al. Posterior circulation ischemic stroke-clinical characteristics, risk factors, and subtypes in a north Indian population. Neurohospitalist 2012; 2(2): 46 – 50. doi: 10.1177/ 1941874412438902.
7. Adams HP Jr, Bendixen BH, Kappelle LJ et al. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in acute stroke treatment. Stroke 1993; 24(1): 35 – 41. doi: 10.1161/ 01.STR.24.1.35.
8. Šaňák D, Hutyra M, Král M et al. The twilight of cryptogenic ischaemic stroke – cardio-embolism is the most frequent cause. Cesk Slov Neurol N 2018; 81/ 114(3): 290 – 277. doi: 10.14735/ amcsnn2018290.
9. Nouh A, Remke J, Ruland S. Ischemic Posterior circulation stroke: a review of anatomy, clinical presentations, diagnosis, and current management. Front Neurol 2014; 5 : 30. doi: 10.3389/ fneur.2014.00030.
10. Arsava EM, Ballabio E, Benner T et al. The causative classification of stroke system. Neurology 2010; 75(14): 1277 – 1284. doi: 10.1212/ WNL.0b013e3181f612ce.
11. Amarenco P, Bogousslavsky J, Caplan LR et al. The ASCOD Phenotyping of ischemic stroke (Updated ASCO Phenotyping). Cerebrovasc Dis 2013; 36(1): 1 – 5. doi: 10.1159/ 000352050.
12. Britt TB, Agarwal S. Vertebral artery dissection. In: StatPearls. [online]. Available from URL: https:/ / www.ncbi.nlm.nih.gov/ books/ NBK441827/ .
13. Tsivgoulis G, Katsanos AH, Köhrmann M et al. Embolic strokes of undetermined source: theoretical construct or useful clinical tool? Ther Adv Neurol Disord 2019; 12 : 1756286419851381. doi: 10.1177/ 1756286419851381.
14. Yuan YJ, Xu K, Luo Q et al. Research progress on vertebrobasilar dolichoectasia. Int J Med Sci 2014; 11(10): 1039 – 1048. doi: 10.7150/ ijms.8566.
15. Katsanos AH, Kosmidou M, Kyritsis AP et al. Is vertebral artery hypoplasia a predisposing factor for posterior circulation cerebral ischemic events? A comprehensive review. Eur Neurol 2013; 70(1 – 2): 78 – 83. doi: 10.1159/ 000351786.
16. Kaushal V, Schlichter LC. Mechanisms of microglia-mediated neurotoxicity in a new model of the stroke penumbra. J Neurosci 2008; 28(9): 2221 – 2230. doi: 10.1523/ JNEUROSCI.5643-07.2008.
17. Tomek A. Neurointenzivní péče. 3. vyd. Praha: Mladá fronta 2018.
18. Manning NW, Campbell BCV, Oxley TJ et al. Acute ischemic stroke: time, penumbra, and reperfusion. Stroke 2014; 45(2): 640 – 644. doi: 10.1161/ STROKEAHA.113.003798.
19. Bednařík J, Ambler Z, Růžička E. Klinická neurologie – část speciální I. Praha: Triton 2010 : 25 – 26.
20. Ambler Z, Bednařík J, Růžička E. Klinická neurologie – část obecná. Praha: Triton 2008 : 507 – 523.
21. Marx JJ, Thömke F. Classical crossed brain stem syndromes: myth or reality? J Neurol 2009; 256(6): 898 – 903. doi: 10.1007/ s00415-009-5037-2.
22. Hurley RA, Flashman LA, Chow TW et al. The brainstem: anatomy, assessment, and clinical syndromes. J Neuropsychiatry Clin Neurosci 2010; 22(1): iv, 1 – 7. doi: 10.1176/ jnp.2010.22.1.iv.
23. Duque Parra JE, Llano Idárraga JO, DuqueParra CA. Reflections on eponyms in neuroscience terminology. Anat Rec B New Anat 2006; 289(6): 219 – 224. doi: 10. 1002/ ar.b.20121.
24. Harrison TR, Hauser SL, Josephson SA. Harrison’s neurology in clinical medicine. New York, USA: McGraw-Hill Medical 2013.
25. Cuoco J, Hitscherich K, Hoehmann C. Brainstem vascular syndromes: a practical guide for medical students. Edorium J Neurol 2016; 3 : 4 – 16. doi: 10.5348/ N06-2016-8-RA-2.
26. Arboix A, Bell Y, Garcia-Eroles L et al. Clinical study of 35 patients with dysarthria-clumsy hand syndrome. J Neurol Neurosurg Psychiatry 2004; 75(2): 231 – 234.
27. Sakuru R, Bollu PC. Millard-Gubler syndrome. In: StatPearls. [online]. Available from URL: https:/ / www.ncbi.nlm.nih.gov/ books/ NBK532907/ .
29. Vokurka M, Hugo J. Velký lékařský slovník. Praha: Maxdorf 2006 : 344.
29. Silverman IE, Liu GT, Volpe NJ et al. The crossed paralyses: the original brain-stem syndromes of Millard-Gubler, Foville, Weber, and Raymond-Cestan. Arch Neurol 1995; 52(6): 635 – 638. doi: 10.1001/ archneur.1995.00540300117021.
30. Brainin M, Tabernig S, Heiss WD. Textbook of stroke medicine. Cambridge, UK: Cambridge University Press 2014.
31. Lin MP, Liebeskind DS. Imaging of ischemic stroke. Continuum (Minneap Minn) 2016; 22(5): 1399 – 1423. doi: 10.1212/ CON.0000000000000376.
32. Neumann J, Tomek A, Škoda O et al. Doporučený postup pro intravenózní trombolýzu v léčbě akutního mozkového infarktu – verze 2014. Cesk Slov Neurol N 2014; 77/ 110(3): 381 – 385.
33. Merwick A, Werring D. Posterior circulation ischaemic stroke. BMJ 2014; 348: g3175. doi: 10.1136/ bmj.g3175.
34. Menon BK, Demchuk AM. Computed tomography angiography in the assessment of patients with stroke/ TIA. Neurohospitalist 2011; 1(4): 187 – 199. doi: 10.1177/ 1941874411418523.
35. Pexman JH, Barber PA, Hill MD et al. Use of the Alberta Stroke Program Early CT Score (ASPECTS) for assessing CT scans in patients with acute stroke. AJNR Am J Neuroradiol 2001; 22(8): 1534 – 1542.
36. Puetz V, Sylaja PN, Coutts SB et al. Extent of hypoattenuation on CT angiography source images predicts functional outcome in patients with basilar artery occlusion. Stroke 2008; 39(9): 2485 – 2490. doi: 10.1161/ STROKEAHA.107.511162.
37. Král J, Jonszta T, Marcián V et al. Congruence in evaluating early ischemic changes using the ASPECT score between the neurologist and the interventional neuroradiologist in patients with acute cerebral ischemia. Cesk Slov Neurol N 2018; 81/ 114(3): 304 – 307. doi: 10.14735/ amcsnn2018304.
38. Tei H, Uchiyama S, Usui T et al. Posterior circulation ASPECTS on diffusion-weighted MRI can be a powerful marker for predicting functional outcome. J Neurol 2010; 257(5): 767 – 773. doi: 10.1007/ s00415-009-5406-x.
39. Šaňák D, Mikulík R, Tomek A et al. Doporučení pro mechanickou trombektomii akutního mozkového infarktu – verze 2019 Cesk Slov Neurol N 2019; 82/ 115(6): 700 – 705. doi: 10.14735/ amcsnn2019700.
40. Tomek A. Pacient s rozsáhlými časnými změnami (ASPECT < 5) – rekanalizace – ANO. Cesk Slov Neurol N 2018; 81/ 114(6): 644.
41. Bar M. Pacient s rozsáhlými časnými změnami (ASPECT < 5) – rekanalizace – NE. Cesk Slov Neurol N 2018; 81/ 114(6): 645.
42. Zeleňák K. Pacient s rozsiahlymi skorými zmenami (ASPECTS < 5) – rekanalizácia – komentár ku kontroverziám. Cesk Slov Neurol N 2018; 81/ 114(6): 646.
43. Hwang DY, Silva GS, Furie KL et al. Comparative sensitivity of computed tomography vs. magnetic resonance imaging for detecting acute posterior fossa infarct. J Emerg Med 2012; 42(5): 559 – 565. doi: 10.1016/ j.jemermed.2011.05.101.
44. Chalela JA, Kidwell CS, Nentwich LM et al. Magnetic resonance imaging and computed tomography in emergency assessment of patients with suspected acute stroke: a prospective comparison. Lancet 2007; 369(9558): 293 – 298. doi: 10.1016/ S0140-6736(07)60151-2.
45. Macintosh BJ, Graham SJ. Magnetic resonance imaging to visualize stroke and characterize stroke recovery: a review. Front Neurol 2013; 4 : 60. doi: 10.3389/ fneur.2013.00060.
46. Schönfeld MH, Ritzel RM, Kemmling A et al. Improved detectability of acute and subacute brainstem infarctions by combining standard axial and thin-sliced sagittal DWI. PLoS One 2018; 13(7): e0200092. doi: 10.1371/ journal.pone.0200092.
47. Halefoglu AM, Yousem DM. Susceptibility weighted imaging: clinical applications and future directions. World J Radiol 2018; 10(4): 30 – 45. doi: 10.4329/ wjr.v10.i4.30.
48. Amin-Hanjani S, Du X, Zhao M et al. Use of quantitative magnetic resonance angiography to stratify stroke risk in symptomatic vertebrobasilar disease. Stroke 2005; 36(6): 1140 – 1145. doi: 10.1161/ 01.STR.0000166195.63276.7c.
49. Amin-Hanjani S, Pandey DK, Rose-Finnell L et al. Effect of hemodynamics on stroke risk in symptomatic atherosclerotic vertebrobasilar occlusive disease. JAMA Neurol 2016; 73(2): 178 – 185. doi: 10.1001/ jamaneurol.2015.3772.
50. Amin-Hanjani S, Du X, Rose-Finnell L et al. Hemodynamic features of symptomatic vertebrobasilar disease. Stroke 2015; 46(7): 1850 – 1856. doi: 10.1161/ STROKEAHA.115.009215.
51. Školoudík D. Neurosonologie. Praha: Galén 2003.
52. Rozeman AD, Hund H, Westein M et al. Duplex ultrasonography for the detection of vertebral artery stenosis. Brain Behav 2017; 7(8): e00750. doi: 10.1002/ brb3.750.
53. Bhaskar S, Stanwell P, Cordato D et al. Reperfusion therapy in acute ischemic stroke: dawn of a new era? BMC Neurology 2018; 18(1): 8. doi: 10.1186/ s12883-017-1007-y.
54. Powers WJ, Rabinstein AA, Ackerson T et al. 2018 Guidelines for the early management of patients with acute ischemic stroke: a guideline for healthcare professionals from the American Heart Association/ American Stroke Association. Stroke 2018; 49(3): e46 – e110. doi: 10.1161/ STR.0000000000000158.
55. Dorňák T, Král M, Šaňák D et al. Intravenous thrombolysis in posterior circulation stroke. Front Neurol 2019; 10 : 417. doi: 10.3389/ fneur.2019.00417.
56. Sarikaya H, Arnold M, Engelter ST. et al. Outcomes of intravenous thrombolysis in posterior versus anterior circulation stroke. Stroke 2011; 42(9): 2498 – 2502. doi: 10.1161/ STROKEAHA.110.607614.
57. Tinková M, Malý P, Parobková H et al. Význam kolaterální cirkulace u akutní okluze arteria basilaris. Cesk Slov Neurol N 2019; 82/ 115(5): 518 – 525. doi: 10.14735/ amcsnn2019518.
58. Meinel TR, Kaesmacher J, Chaloulos-Iakovidis P et al. Mechanical thrombectomy for basilar artery occlusion: efficacy, outcomes, and futile recanalization in comparison with the anterior circulation. J Neurointerv Surg 2019; 11(12): 1174 – 1180. doi: 10.1136/ neurintsurg-2018-014516.
59. Šaňák D, Neumann J, Tomek A et al. Doporučení pro rekanalizační léčbu akutního mozkového infarktu – verze 2016. Cesk Slov Neurol N 2016; 79/ 112(2): 231 – 234.
60. Turc G, Bhogal P, Fischer U et al. European StrokeOrganisation (ESO) – European Society for Minimally Invasive Neurological Therapy (ESMINT) guidelines on mechanical thrombectomy in acute ischemic stroke. J NeuroIntervent Surg 2019. pii: neurintsurg-2018-014569. doi: 10.1136/ neurintsurg-2018-014569.
61. Meinel TR, Kaesmacher J, Chaloulos-Iakovidis P et al. Mechanical thrombectomy for basilar artery occlusion: efficacy, outcomes, and futile recanalization in comparison with the anterior circulation. J NeuroIntervent Surg 2019; 11(12): 1174 – 1180. doi: 10.1136/ neurintsurg-2018-014516.
62. Baik SH, Park HJ, Kim JH et al. Mechanical thrombectomy in subtypes of basilar artery occlusion: relationship to recanalization rate and clinical outcome. Radiology 2019; 291(3): 730 – 737. doi: 10.1148/ radiol.2019181924.
63. Liu X, Dai Q, Ye R et al. BEST Trial Investigators. Endovascular treatment versus standard medical treatment for vertebrobasilar artery occlusion (BEST): an open-label, randomised controlled trial. Lancet Neurol 2019; 19(2): 115 – 122. doi: 10.1016/ S1474-4422(19)30395-3.
64. Nordmeyer H, Chapot R, Haage P et al. Endovascular treatment of intracranial atherosclerotic stenosis. Fortschr Röntgenstr 2019; 191(7): 643 – 652. doi: 10.1055/ a-0855-4298.
65. Chimowitz MI, Lynn MJ, Derdeyn CP et al. Stenting versus aggressive medical therapy for intracranial arterial stenosis. N Engl J Med 2011; 365(11): 993 – 1003. doi: 10.1056/ NEJMoa1105335.
66. Zaidat OO, Fitzsimmons BF, Woodward BK et al. Effect of a balloon-expandable intracranial stent vs medical therapy on risk of stroke in patients with symptomatic intracranial stenosis: the VISSIT randomized clinical trial. JAMA 2015; 313(12): 1240 – 1248. doi: 10.1001/ jama.2015. 1693.
67. Nordmeyer H, Chapot R, Aycil A et al. Angioplasty and stenting of intracranial arterial stenosis in perforator-bearing segments: a comparison between the anterior and the posterior circulation. Front Neurol 2018 9 : 533. doi: 10.3389/ fneur.2018.00533.
68. Alexander MJ, Zauner A, Chaloupka JC et al. WEAVE Trial Sites and Interventionalists. WEAVE Trial: final results in 152 on-label patients. Stroke 2019; 50(4): 889 – 894. doi: 10.1161/ STROKEAHA.118.023996.
69. Ahmed N, Steiner T, Caso V et al. Recommen-dations from the ESO-Karolinska Stroke Update Con-ference, Stockholm 13 – 15 November 2016. Eur Stroke J 2017; 2(2): 95 – 102. doi: 10.1177/ 2396987317699144.
70. FDA. Food and Drug Administration. FDA safety communication: narrowed indications for use for the Wingspan Stent System.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článek Poměr fosforylovaného tau proteinu k beta amyloidu v likvoru predikuje pozitivitu amyloidové PETČlánek Chirurgická léčba benigních neurogenních tumorů mediastina – analýza 7letého souboru pacientůČlánek Dopis redakciČlánek Komentář redakceČlánek Prof. Mraček oslavil 90 letČlánek Odešla MUDr. Olga Baudyšová
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2020 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- CIDP: epidemiológia, klinický obraz a diagnostika v kocke
-
Všetky články tohto čísla
- Cévní morfologie, symptomy, diagnostika a léčba ischemických příhod mozkového kmene
- Je koncept vaskulární demence trvale udržitelný?
- Je koncept vaskulární demence trvale udržitelný? NE
- Je koncept vaskulární demence trvale udržitelný? Komenář
- Mezinárodní klasifikace bolestí hlavy (ICHD-3) – oficiální český překlad
- Schwannóm extrakraniálnej časti trojklanného nervu
- Chirurgická léčba mozkových metastáz
- Cavum septi pellucidi, cavum vergae a cavum veli interpositi
- Poměr fosforylovaného tau proteinu k beta amyloidu v likvoru predikuje pozitivitu amyloidové PET
- Provocative factors and treatment response in juvenile myoclonic epilepsy – experience from a tertiary epilepsy center
- Chirurgická léčba benigních neurogenních tumorů mediastina – analýza 7letého souboru pacientů
- Transkraniální sonografie mediotemporálního laloku u pacientů s Alzheimerovou demencí
- Endarterektomie zevní karotické tepny
- Vestibulární funkce u pacientů s kochleárním implantátem
- Cystická hydatidóza mozečku – vzácná kazuistika
- A case of late brachial plexopathy after chemotherapy and radiotherapy
- Spontaneous vaginal extrusion of the distal catheter of a ventriculoperitoneal shunt
- Opakovaná trombektómia u pacienta so zriedkavou kombináciou etiologických faktorov
- Dopis redakci
- Komentář redakce
- Prof. Mraček oslavil 90 let
- Odešla MUDr. Olga Baudyšová
- K jubileu profesorky Soni Nevšímalové
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Cavum septi pellucidi, cavum vergae a cavum veli interpositi
- Cévní morfologie, symptomy, diagnostika a léčba ischemických příhod mozkového kmene
- Mezinárodní klasifikace bolestí hlavy (ICHD-3) – oficiální český překlad
- Chirurgická léčba mozkových metastáz
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



