-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Dechová rehabilitace u pacientů s amyotrofickou laterální sklerózou
Respiratory rehabilitation in patients with amyotrophic lateral sclerosis
Amyotrophic lateral sclerosis (ALS) is a serious neurodegenerative disease, which belongs to a group of conditions affecting the motor neuron system, called motor neuron disease. During the course of the disease, a reduction in the voluntary muscle strength occurs, along with the loss of strength in muscles of respiration. This results in ineffective cough, restrictive changes in ventilation along with dyspnoea. Respiratory muscle weakness progressively leads to respiratory insufficiency, which is the major cause of death in this disease. That is why it is important to monitor respiratory and motor functions in patients with ALS from the moment the diagnosis is given. Functional vital capacity and maximal inspiratory pressure are regarded as the main determinants of respiratory symptomatology and respiratory insufficiency predicting also the life longevity in patients with ALS. Respiratory physiotherapy provides patients with a wide spectrum of techniques, which have a potential to slow down the progress and the severity of respiratory symptoms in case the exercise program is initiated early enough, before the onset of more serious respiratory involvement. The program consists mainly of methods focused on inspiratory and expiratory muscle training, for which special respiratory devices are used. Later in the course of the disease, patients are being provided with techniques which may decrease shortness of breath and which increase effectivity of cough by aiding the manoeuvres. This palliative symptomatic care aims to increase the quality of life in patients with ALS, while being helpful right from the onset as well as during the whole course of the disease.
Keywords:
motor neuron disease – respiratory insuffi ciency – dyspnea – muscle weakness – respiratory muscles – cough – physiotherapy techniques
Autori: D. Botiková- 1 3; E. Vlčková 2,3; S. Voháňka 2,3
Pôsobisko autorov: Rehabilitační oddělení, FN Brno 1; Neurologická klinika, ERN-EURO NMD, Centrum, FN Brno 2; LF MU, Brno 3
Vyšlo v časopise: Cesk Slov Neurol N 2020; 83/116(5): 491-498
Kategória: Přehledný referát
doi: https://doi.org/10.14735/amcsnn2020491Súhrn
Amyotrofická laterální skleróza (ALS) je závažné neurodegenerativní onemocnění, které řadíme mezi onemocnění motoneuronu (motor neuron disease). V průběhu progrese nemoci dochází postupně k poklesu síly příčně pruhovaných svalů vč. svalů respiračních. To má za následek snížení účinnosti kašle a vznik restrikční ventilační poruchy s rozvojem dušnosti. Slabost dechových svalů vede postupně k dechovému selhání, které je nejčastější příčinou úmrtí na toto onemocnění. U pacientů s ALS je proto vhodné monitorovat stav dechových a pohybových funkcí nejlépe již od stanovení diagnózy. Funkční vitální kapacita a síla nádechových svalů jsou považované za hlavní determinanty respirační symptomatiky a selhání dechových funkcí, které predikují také délku dožití pacientů s ALS. Respirační fyzioterapie nabízí pacientům široké spektrum technik, které mají potenciál snížit rychlost a závažnost progrese respiračních obtíží v případě, že se s cvičením začne dostatečně včas před nástupem závažnějších klinických respiračních potíží. Jedná se především o metody zaměřené na posílení nádechových a výdechových svalů nejčastěji s použitím tzv. dechových trenažérů. V pozdějších fázích onemocnění rehabilitace nabízí podpůrné techniky snižující dušnost a zvyšující účinnost kašle. Tato paliativní symptomatická léčba má potenciál zlepšit kvalitu života pacientů s ALS od nástupu respiračních potíží po celou dobu dalšího průběhu onemocnění.
Klíčová slova:
onemocnění motoneuronu – dechové svaly – svalová slabost – respirační insufi cience – kašel – dušnost – rehabilitační techniky
Úvod
Amyotrofická laterální skleróza (ALS) je progresivní neurodegenerativní onemocnění motoneuronů mozkové kůry a předních rohů míšních, které vede ke slabosti a atrofii příčně pruhovaných kosterních svalů vč. svalů dechových [1–3]. Výskyt respiračních obtíží výrazně snižuje kvalitu života pacientů s tímto onemocněním a spolu s bulbární symptomatikou je nejvýznamnějším prediktorem očekávané doby jejich přežití [4]. Respirační insuficience se v průběhu nemoci dříve či později rozvíjí u všech pacientů. Vzácně (asi v 3–5 %) může být dokonce iniciálním symptomem onemocnění [4–6]. U většiny pacientů se však symptomy spojené s klinicky manifestní respirační slabostí objevují až po 12 a více měsících od stanovení diagnózy, i když iniciální známky určitého oslabení dechových svalů bývají obvykle přítomny již dříve [4–6]. Za poslední tři dekády se zlepšením ošetřovatelské péče a managementu polykacích a respiračních komplikací prodloužila doba přežití a zvýšila kvalita života pacientů s ALS. Možnosti rehabilitace jako klíčové součásti péče o respirační funkce u těchto pacientů jsou však v odborné veřejnosti nadále poměrně málo známé a využívané navzdory skutečnosti, že zapojení těchto technik již od časných stadií onemocnění je pro pacienty významným přínosem. Optimální respirační péče má větší dopad na délku přežití než riluzol [7].
Respirační svaly
Respirační svaly můžeme rozdělit na svaly nádechové, výdechové a pomocné. Z funkčního hlediska se k dýchacím svalům často řadí i svaly horních dýchacích cest, tedy glotické svaly, které udržují průchodnost horních dýchacích cest během dechového cyklu a umožňují proudění vzduchu do plic a ven z plic bez přerušení [8,9].
Hlavním nádechovým svalem je bránice, která u zdravého jedince vykazuje přibližně 70 % práce při klidném nadechnutí plného objemu vzduchu. Mezižeberní svaly, v závislosti na svém postavení vůči směru žeber, svojí kontrakcí zvětšují nebo zmenšují obvod hrudního koše a pomáhají tak nádechu nebo výdechu [10]. Břišní svaly slouží během dechového cyklu k několika účelům. Jejich zásadním úkolem je však aktivní, svalově podpořený výdech [11].
Pomocné dechové svaly (zejména m. trapezius, m. pectoralis major a minor, m. latissimus dorzi, m. serratus anterior a posterior superior, mm. scaleni a m. sternocleidomastoideus) umožňují rozšířit a pozvednout hrudní koš. Tímto způsobem napomáhají při nádechu v situaci zvýšených ventilačních nároků vyvolaných fyzickou či psychickou námahou nebo v případě onemocnění primárních dechových svalů [8,12].
Respirační potíže u pacientů s ALS
Poruchy dýchání, s nimiž se setkáváme u pacientů s neuromuskulárními onemocněními vč. ALS, vznikají v důsledku poklesu síly dechových svalů. To vede k rozvoji restrikční ventilační poruchy s postupnou progresí dušnosti a snižující se účinností kašle [2,4,12]. Snížení síly bulbárního svalstva způsobuje problémy s polykáním, což může dále zhoršovat uvedenou poruchu ventilace. Pacient s dysfagií je totiž ohrožen aspiracemi a tichými aspiracemi (t.j. vdechnutím sousta nebo slin, které není následováno obranným reflexem, tedy kašlem), které mohou dlouhodobě způsobovat záněty dýchacích cest a plic. Rezidua slin a hlenů, které pacient nedokáže polknout, a samotná aspirace představují přidruženou obstrukční složku ventilační poruchy. Snížení tonu bulbárního svalstva může navíc obstruovat dýchací cesty zejména v poloze vleže na zádech [8].
Dušnost lze definovat jako subjektivní prožitek obtížného dýchání. Jedná se o klinický symptom, který může být důsledkem širokého spektra různých příčin. Jednou z těchto příčin je i výše uvedená slabost dechových svalů (zejména nádechových skupin). Ta má za následek sníženou kapacitu nádechových svalů překonat elastickou retrakční sílu měkkých tkání plic a hrudní stěny [13,14]. V průběhu rozvoje respirační slabosti udávají pacienti dušnost postupně při méně a méně fyzicky náročných pohybových aktivitách a později i v klidu [7].
Jedním z prvních příznaků oslabení dechových svalů bývá porucha dýchání během spánku (resp. v poloze vleže), označovaná jako ortopnoe. Příčinou jejího rozvoje je skutečnost, že v poloze na zádech je téměř celá dechová práce zprostředkovaná pouze bránicí, zatímco v jiných polohách těla dochází ke snadnějšímu zapojení pomocných dechových svalů [4,7]. Pacienti obvykle postupně navyšují počet polštářů pod hlavou, v pozdních stadiích onemocnění jsou pak schopni spát pouze vsedě.
Snížení účinnosti kašle může být způsobeno jak poklesem síly nádechových a výdechových svalů, tak bulbární dysfunkcí. Pokles síly nádechových svalů vede ke snížení objemu nadechnutého vzduchu, který je následně při kašli vytlačen ven z dýchacích cest. Čím větší objem vzduchu je k dispozici, tím rychleji při výdechu proudí přes dýchací cesty a tím účinněji odstraňuje sekret z dýchacích cest. Pokles síly výdechových svalů významně snižuje možnost účinné komprese vzduchu v dýchacích cestách, tedy snižuje explozivní exspirační sílu kašle. K neúčinnosti kašle vede i dysfunkce hlasivek, které se při kašli za fyziologických podmínek prudce uzavírají a otevírají. Pohyb hlasivek umožňuje vytvoření silného proudu vzduchu, který dokáže strhnout sekret ze stěn dýchacích cest a přenést jej až do dutiny ústní [8,15].
Vyšetření respiračních funkcí
Hodnocení dechových funkcí s navazující edukací o možnostech respirační fyzioterapie by mělo být provedeno u každého pacienta s ALS optimálně již po stanovení diagnózy a následně opakováno každé 3 měsíce. Tento postup je důležitý zejména v časných fázích onemocnění, kdy může pacient nejvíce profitovat z používaných rehabilitačních technik [7].
Vyšetření kvality dýchání je založeno na anamnestických datech a objektivním klinickém vyšetření mechaniky dýchání. Anamnesticky zjišťujeme přítomnost klinických projevů dechových obtíží, k nimž patří:
- dušnost při malé námaze a v klidu;
- ortopnoe (dechová tíseň vázaná na polohu vleže) se slabým a nedostatečným spánkem;
- ranní bolesti hlavy;
- denní únava a spavost;
- neúčinný kašel s častými záněty dýchacích cest.
Objektivně hodnotíme mechaniku dýchání z hlediska dechového stereotypu, rozvíjení hrudníku během dechového cyklu, zapojení pomocných dechových svalů a dechovou vlnu, případně přítomnost paradoxního dýchání (tedy poruchy koordinace dechových pohybů, kdy se při nádechu břišní stěna vtahuje a při výdechu vyklenuje) [7,14].
Objektivní kvantitativní vyšetření respiračních parametrů a síly dechových svalů zahrnuje nejčastěji neinvazivní měření následujících parametrů [7,16–18]:
- usilovná vitální kapacita (forced vital capacity; FVC);
- vrcholový průtok při usilovném výdechu (peak expiratory flow; PEF);
- vrcholový průtok při kašli (peak cough flow; PCF);
- maximální nádechový tlak (maximal inspiratory pressure; MIP);
- maximální výdechový tlak (maximal expiratory pressure; MEP);
- maximální nosní nádechový tlak (sniff nasal inspiratory pressure; SNIP);
- pulzní oxymetrie.
Spirometrií získaná hodnota FVC je vůbec nejužívanějším testem pro vyšetření plicních funkcí u neuromuskulárních onemocnění [17]. Je měřítkem globální síly dechových svalů, protože při tomto manévru jsou použity obě skupiny dechových svalů, nádechové i výdechové [8]. Hodnota FVC dle mnoha studií predikuje délku dožití pacientů s ALS. Měření FVC v poloze vleže na zádech se jeví jakožto senzitivní metoda odhalující slabost bránice, přičemž pokles naměřené hodnoty o více než 25 % oproti měření ve vzpřímeném postavení indikuje závažné oslabení bránice dříve než samotné měření FVC ve vzpřímeném postavení [4,8,17,19].
Tradičně používané parametry odrážející sílu nádechových a výdechových svalů jsou MIP a MEP [8]. Oslabení nádechových svalů je hlavní determinantou respirační symptomatiky a dechového selhání u pacientů s ALS [7]. Pro vyšetření síly nádechových svalů můžeme využít i měření SNIP. To je přínosné zejména u pacientů se závažnou bulbární symptomatikou, kteří nejsou schopni ústy pevně obejmout spirometrický náustek [16]. Hodnota SNIP je u pacientů s ALS asociována s mírou restrikční ventilační poruchy a obecně závažností onemocnění [4].
Vyšetření poruch expektorace je indikováno v případě, že pacient popisuje potíže s přesunem sekretu z dolních dýchacích cest do dutiny ústní při kašli, nebo když v anamnéze figurují časté respirační infekce. Hodnoty běžně sledovaných respiračních parametrů indikujících účinnost kašle shrnuje tab. 1. Nejvýznamnějšími parametry jsou PEF a PCF, které lze změřit tzv. peak flow metrem („výdechoměrem“) nebo spirometrem s použitím náustku, případně obličejové masky [7,20]. Fyziologické hodnoty PCF se pohybují v rozmezí 360 l/min až 960 l/min. Pacienti, u nichž hodnota PCF nedosahuje ani 160 l/min, jsou vystavení riziku nedostatečného kašle a závislosti na umělé plicní ventilaci. Hodnoty PCF mohou výrazně klesat v průběhu respirační infekce: hodnoty nižší než 270 l/min v období bez respiračního zánětu mohou při infekci klesat až pod 160 l/min [8].
Tab. 1. Hodnoty respiračních parametrů indikující dostatečnou účinnost kašle. Na nutnost mechanické asistence kašlacího manévru poukazuje nesplnění 4 a více parametrů současně s opakujícími se aspiracemi a výskytem únavy dýchacích svalů znemožňující účinný kašel. Modifi kováno z Neumannová et al [44]. ![Hodnoty respiračních parametrů indikující dostatečnou účinnost kašle. Na
nutnost mechanické asistence kašlacího manévru poukazuje nesplnění 4 a více parametrů současně s opakujícími se aspiracemi a výskytem únavy dýchacích svalů
znemožňující účinný kašel. Modifi kováno z Neumannová et al [44].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/0b74d2f6f1815a73699173edbf8eadc8.png)
FVC – usilovná vitální kapacita; MEP – maximální výdechový tlak; MIP – maximální nádechový tlak; PCF – vrcholový průtok při kašli; PEF – vrcholový průtok při usilovném výdechu; SNIP – maximální nosní nádechový tlak; spO2 – saturace krvi kyslíkem Možnosti rehabilitační léčby respiračních funkcí
Posilování dechových svalů jako preventivní krok k oddálení rozvoje dušnosti
Trénink dechových svalů používá stejné principy jako obecný trénink jiných kosterních svalů. Intenzita cvičení by měla být vyšší než běžně využívaná kapacita svalů, protože účelem cvičení je tuto kapacitu navýšit. V delším časovém horizontu je proto nutné intenzitu cvičení průběžně modifikovat. Doba trvání zátěže a frekvence cvičení jsou parametry nejvýrazněji určujícími trvání účinků pohybové léčby. Ukončením pravidelného cvičení se postupně ztrácejí jeho přínosy (princip dekondice) [7,21]. U pacientů s neuromuskulárním onemocněním je potřebné přistupovat k indikaci fyzické aktivity s určitou opatrností. Jakékoli cvičení by mělo být doporučováno v lehké až střední intenzitě v případě vytrvalostního zatížení a v lehké intenzitě u zatížení silového. Zátěž je nutno navyšovat pozvolna a plynule. Její intenzita se naopak ihned snižuje v případě jakýchkoliv projevů přetížení, jako jsou např. protrahovaná únava nebo bolesti zapojených svalů, resp. u dechových svalů dušnost či pocit omezené možnosti uspokojivého plného nádechu [22,23].
Posílení dechových svalů můžeme dosáhnout pomocí specifického nebo nespecifického odporu kladeného vdechovanému nebo vydechovanému proudu vzduchu. Jinou možností je zamezit dechovým pohybům hrudníku (např. pomocí pružného tahu gumových pásků), čímž lze stimulovat a posilovat primární nádechové svaly a také zlepšovat pružnost a rozvíjení hrudníku [24–27]. Vždy je nutné důsledně kontrolovat, jakým způsobem je cvičení prováděno [21].
V našem prostředí jsou nejpoužívanějšími pomůckami k cílenému specifickému tréninku dechových svalů nádechový a výdechový rehabilitační ventil (threshold inspiratory muscle trainer [IMT] a threshold positive expiratory pressure [PEP]) (obr. 1–3). Na těchto dechových trenažérech je možné nastavit intenzitu zátěže prostřednictvím posuvné stupnice odporu v jednotkách cm H2O. Zátěž se dávkuje dle předem vyšetřených maximálních ústních tlaků (MIP a MEP) a také dle aktuálního zdravotního stavu, případně podle subjektivních pocitů pacienta. Důležité je, aby byl pacient schopen udržet správný dechový stereotyp i proti odporu trenažéru [14,28]. Pro vytrvalostní trénink volíme delší dobu dýchání proti nižšímu odporu trenažéru, pro silový trénink cvičení naopak trvá kratší dobu proti vyššímu odporu. Nikdy však nezačínáme s vyšším odporem, než jaký odpovídá úrovni 30 % hodnot MIP, resp. MEP zjištěných u pacienta [29]. Součástí pomůcky jsou náustek a nosní klip (obr. 1). V případě významnější bulbární symptomatiky lze ke cvičení využít obličejovou masku (obr. 2).
Obr. 1. Dechové trenažéry threshold positive expiratory pressure, vlevo a threshold inspiratory muscle trainer, vpravo s příslušenstvím, tj. nosním klipem a náustkem.
Fig. 1. Respiratory devices threshold positive expiratory pressure (left) and threshold inspiratory muscle trainer (right) with accessories such as a nose clip and a mouthpiece.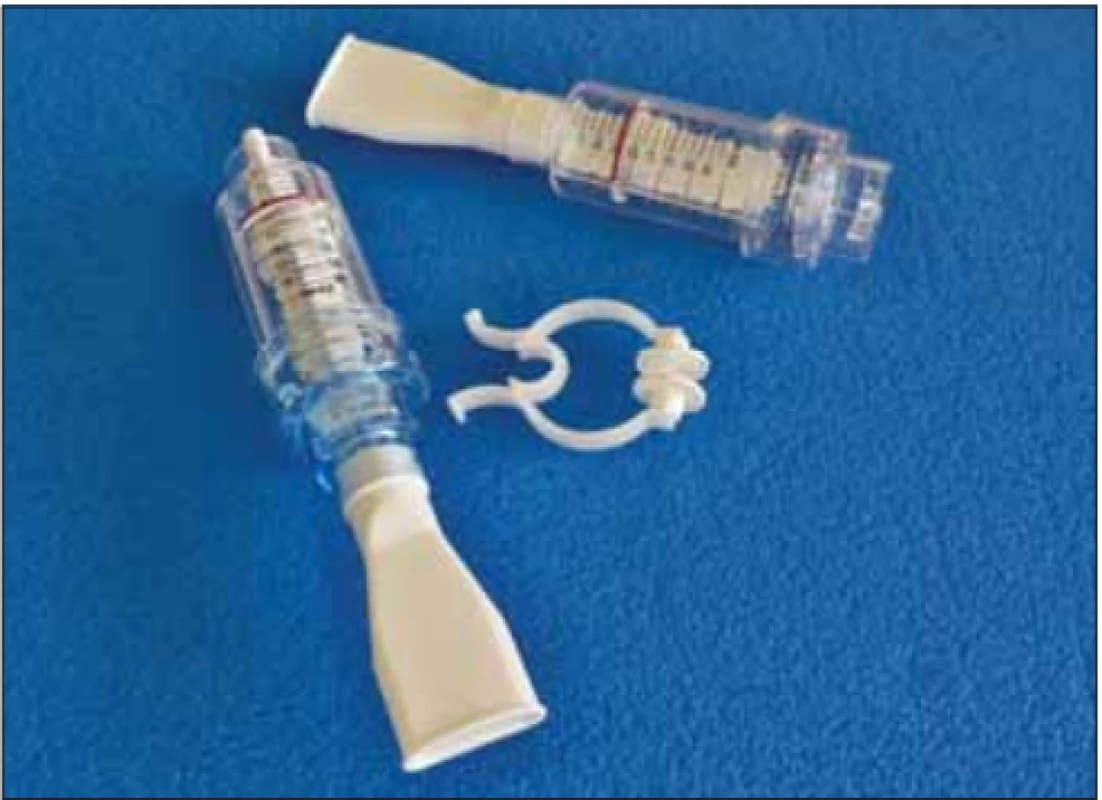
Obr. 2. Trenažér threshold positive expiratory pressure pro použití s obličejovou maskou.
Fig. 2. Threshold positive expiratory pressure device ready for use with a facial mask.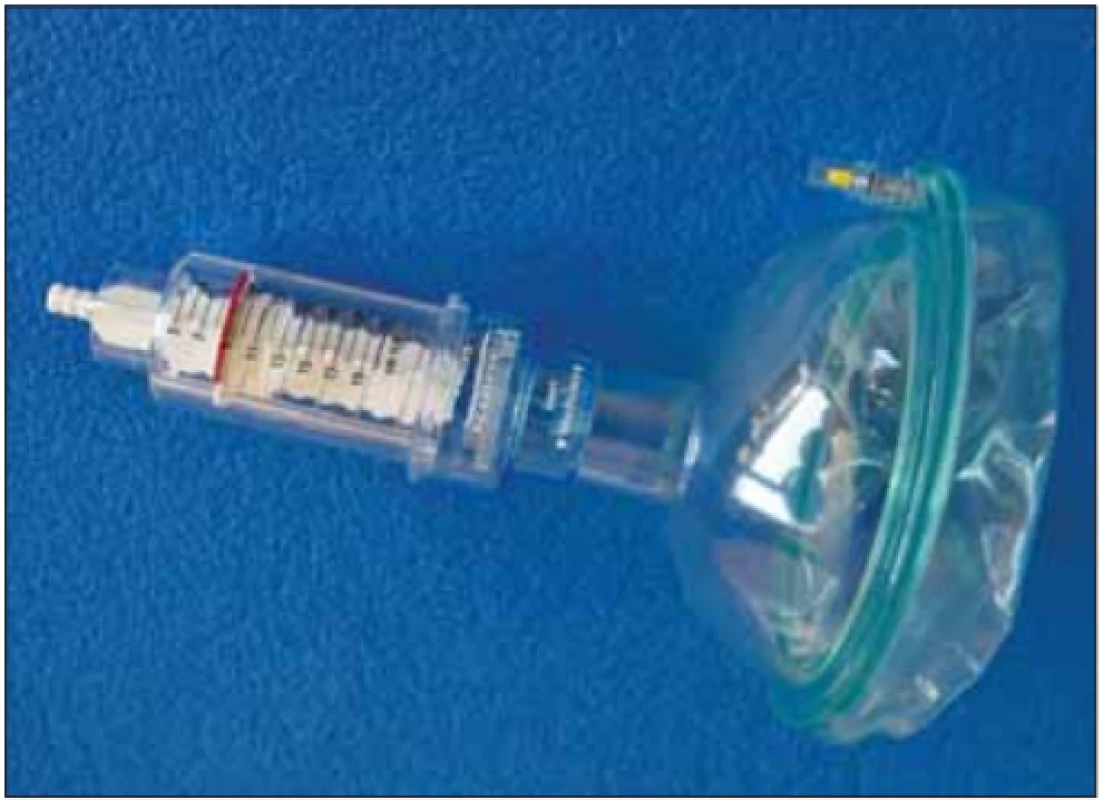
Obr. 3. Pacientka dýchá proti odporu dechového trenažéru threshold positive expiratory pressure a snaží se u toho držet co nejlepší posturální nastavení. Fotografi e byla pořízena s informovaným souhlasem pacientky.
Fig. 3. Patient breathes against the resistance of the threshold positive expiratory pressure device, trying to remain in the best postural position. The picture was taken with informed consent from the patient.
Rehabilitaci dechových svalů je vhodné začít co nejdříve v průběhu onemocnění, tedy u pacientů bez významných symptomů respirační dysfunkce. Posilování nádechových svalů v časných stadiích onemocnění může oddálit rozvoj námahové i klidové dušnosti prostřednictvím zlepšení dynamiky dýchání a ekonomiky dechového stereotypu [7,24]. Posilování výdechových svalů je zásadní pro účinnou mobilizaci sekretu z dýchacích cest, tedy expektoraci [8,30,31]. Trénink je vhodné zaměřit také na nácvik koaktivace (současného zapojení) těchto svalů, což může zlepšit koordinaci a snížit energetickou náročnost kašle [32].
Posilování dechových svalů obecně sice není schopné zamezit postupnému poklesu dechových funkcí u pacientů s ALS, má však potenciál oddálit jejich nástup [18]. Zapojení respirační fyzioterapie do komplexního managementu péče o toto neuromuskulární onemocnění je proto aktuálně doporučováno, jeví se jako bezpečná metoda, která může mít pozitivní dopad na kvalitu života a délku dožití pacientů s ALS [7,24]. Pro přesnější potvrzení tohoto předpokladu jsou však potřebné další studie [33].
Zvládání dušnosti
Fyzioterapie může pomoci i ve fázi již vzniklých dechových potíží, kdy lze využít úlevové techniky a polohy a v pozdních fázích onemocnění také vhodné polohování pacientů. Jednoduchá úlevová technika respirační fyzioterapie, která má za úkol snížit dušnost a zmírnit dechové potíže, je dýchání přes sešpulené rty, tedy tzv. technika ústní brzdy (pursed lip therapy). V případě závažnější bulbární symptomatiky, kdy mimické svaly nejsou schopny této kontrakce, lze využít i dýchání přes štěrbinu vytvořenu pěstí ruky. Kontrolovaný výdech přes úzký obvod štěrbiny slouží k docílení svalově podpořeného a prodlouženého výdechu, a tím i ke zklidnění dechového vzoru a snížení dechové frekvence při rozvinuté dušnosti [14,25,32,34]. Další možností je technika kontrolovaného bráničního dýchání, která využívá uvolněný nádech a pasivní prodloužený výdech, a tak snižuje dechovou frekvenci a únavu dechových svalů [32]. Pacient se při této technice soustředí na rozvíjení hrudníku a plný rozsah dechové vlny probíhající abdomino-kraniálním směrem při nádechu i výdechu. Eliminuje tak horní typ dýchání, které bývá mělké, s vyšší dechovou frekvencí a probíhá za nadměrného zapojení pomocných dechových svalů, čímž se stává energeticky náročnější.
Později v průběhu onemocnění, když primární dechové svaly nejsou schopny zastat veškerou dechovou práci při fyzicky méně náročných aktivitách nebo v klidu, učíme pacienty zklidnit dechový vzor v úlevových polohách. V nich využíváme oporu o horní končetiny, které slouží jako pevný bod (tzv. punctum fixum) pro pomocné dechové svaly, které se upínají na horní končetiny a současně na hrudník. Při fixované poloze horních končetin pak svojí kontrakcí zvedají hrudní koš a tím ulehčují práci bránice a mezižeberních svalů, usnadňují a zklidňují dechový vzor [14]. Příklady úlevových poloh jsou zobrazeny na obr. 4 a 5.
Obr. 4. Úlevová poloha vsedě na židli s oporou horních končetin o stůl pro vytvoření punctum fixum pomocných dechových svalů na pletencích ramen a k snazšímu rozvíjení hrudníku během dechových pohybů. Fotografi e byla pořízená s informovaným souhlasem pacientky.
Fig. 4. Breath relief sitting position on a chair, with upper limbs supported by a table, which creates a punctum fi xum for accessory respiratory muscles on the shoulder girdle. This posture facilitates excursions of thorax movement while breathing. The picture was taken with informed consent from the patient.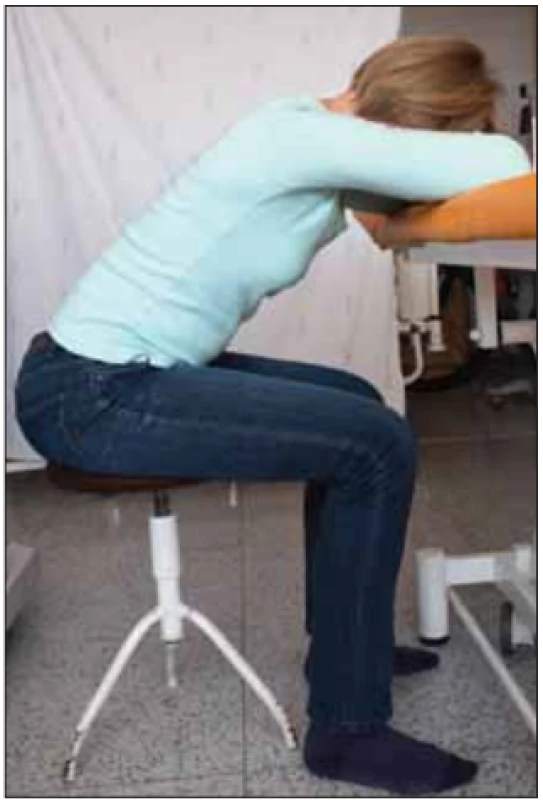
Obr. 5. Úlevová poloha ve stoji s oporou horních končetin o zeď. Fotografi e byla pořízená s informovaným souhlasem pacientky.
Fig. 5. Breath relief standing position with upper limbs supported by a wall. The picture was taken with informed consent from the patient.
V pozdních fázích onemocnění je nutno zabezpečit co nejvhodnější polohování pacienta s ohledem na dechové obtíže a častou ortopnoi. Proto volíme polohy, ve kterých má pacient zvýšenou polohu hlavy, resp. celého trupu. Pokrčené a podložené dolní končetiny umožní lepší zapojení abdominální muskulatury do dechového cyklu. Krční páteř musí zůstat v napřímení pro zachování průchodnosti horních dýchacích cest. Horní končetiny nastavujeme do poloh, které usnadňují využití pomocných dechových svalů, tedy do mírného upažení (přibližně 45° abdukce) se zevní rotací v ramenních kloubech, s vypodloženým neutrálním nastavením předloktí a zápěstí [35,36].
Účinnost kašle
V rámci přípravy na možné zhoršení účinnosti kašlacího manévru v důsledku zvýšené svalové únavy při infektech je vhodné v období, kdy nejsou zřetelně vyjádřeny příznaky respirační dysfunkce nebo jsou jen mírné a málo časté, nacvičit s pacientem kontrolovaný a koordinovaný kašel. Jde o potlačení reflexu kašle s krátce zadrženým dechem pro následné zvýšení výdechového průtoku. Výdech by pak měl být uvědomělý a dlouhý, provedený skrz povolené horní cesty dýchací. To lze nacvičit s použitím širší trubičky vložené do úst, přes kterou má pacient za úkol vydechnout. Pootevřená ústa způsobují uvolnění svalů kolem hlasivek, což umožňuje vydechnutí většího množství vzduchu bez zvýšeného svalového úsilí [13,32]. Další technika snižující námahu při expektoraci je v anglosaské literatuře označovaná jako huffing. Jde o krátký, prudký, svalově podpořený výdech po preexspirační pauze provedený přes otevřená ústa, uvolněnou glottis a horní cesty dýchací. Manévr připomíná pokus o zamlžení sklíčka nebo zrcátka prudce vydechnutým dechem. Pro prevenci svalové únavy je vhodné jej provést nejvýše 1–2× za sebou [14,32].
Pro zvýšení účinnosti expektorace lze využít i další techniky respirační fyzioterapie, jako např. autogenní drenáž a ostatní prvky aktivního cyklu dechových technik, případně dechové trenažéry vytvářející oscilace při aktivním výdechu [14]. Jsou to ale poměrně náročné techniky, které vyžadují spolupráci a plnou koncentraci pacienta a také určitou sílu a vytrvalost dechových svalů. Jejich využití proto může být omezené zejména v pozdějších stadiích nemoci, kdy dominuje slabost a rychlá unavitelnost dechových svalů spolu s dušností [37].
V případě, že pacient není schopen vlastní sílou vyvinout při kašli dostatečně vysoký průtok vzduchu, lze použít některé z technik mechanicky asistovaného kašle [38]. Nejjednodušší technikou, která nevyžaduje žádnou technickou podporu, je manuálně asistovaný kašel (tzv. abdominal thrust). Tento manévr mohou provádět příbuzní pacienta nebo ošetřující personál, je ale nutná určitá motorická zručnost a velmi dobrá koordinace osoby provádějící manévr s pacientovým dechovým cyklem. Při výdechu nebo pokusu o kašel terapeut nebo pečovatel zvýší manuálně vyvíjený tlak na hrudník sevřením oblasti dolních žeber a nadbřišku tak, aby zvýšil průtok vzduchu při kašli. Pod touto technikou si lze lehce představit Heimlichův manévr, dá se však provádět i v jiných polohách pacienta, jako např. v poloze vleže na zádech, na boku, nebo vsedě na vozíku [39,40].
Technika lung volume recruitment (LVR) kombinuje zvýšení objemu vdechnutého vzduch prostřednictvím mechanické insuflace ambuvakem s následným kontrolovaným kašlem (po předchozím krátkém zadržení dechu). Průběh manévru je následující: pacient zadrží dech po vlastním maximálním spontánním nádechu a při uzavřené glottis. Objem vzduchu v dechových cestách pacienta je následně navýšen pomocí ambuvaku spojeného s chlopní pro stejnosměrné vedení vzduchu a obličejovou maskou až do maximálního pacientem tolerovaného objemu. Po další preexspirační pauze pacient volně vydechne stejným způsobem jako při kontrolovaném kašli, tedy přes uvolněnou glottis a povolené horní cesty dýchací. S větším nadechnutým objemem vzduchu a s delší preexspirační pauzou se zvětší průtok vzduchu při kašli a zvýší se tak jeho účinnost [7,41]. Příslušenství k LVR je zobrazeno na obr. 6.
Obr. 6. Příslušenství k technice lung volume recruitment: ambuvak (který vzhledem k jednocestné chlopni není současně využitelný pro ev. resuscitaci), jednocestně usměrněná chlopeň, bakteriální fi ltr, hadice. Na její konec lze pak nasadit náustek (při jeho použití je vhodné použít nosní klip) nebo obličejovou masku.
Fig. 6. The lung volume recruitment equipment: adapted resuscitation bag (which must be clearly labeled „not for resuscitation“due to one way valve), one way valve, bacterial fi lter, and a tube ending with either mouthpiece (using nose clip at the same time) or face mask.
Mechanická insuflace – exsuflace (MIE) (obr. 7, 8) je další z metod mechanicky asistovaného kašle. Je prováděna pomocí přístroje označovaného jako kašlací asistent. V ČR se pro tyto účely již 10 let používá přístroj CoughAssist (Philips, Amsterdam, Nizozemsko) a posledních 7 let jeho verze Cough Assist E70. Podstatou metody je dodání pozitivního tlaku při nádechu (insuflace) následované náhlou změnou tlaku do negativních hodnot při výdechu nebo kašli (exsuflace). Právě tato prudká změna pozitivního tlaku v negativní způsobí vysoký výdechový průtok podobně jako při přirozeném kašli [30]. Pro zvýšenou podporu sekretolýzy lze současně využít i tlakové oscilace přiváděného nebo odváděného proudu vzduchu zprostředkované identickým přístrojem [4,42]. MIE tedy napomáhá pacientům při uvolnění sekretů z dolních dýchacích cest, jejich uvedení do pohybu a posun až do dutiny ústní a usnadňuje i expektoraci při aspiraci potravy. Podporuje také zachování potřebné pružnosti hrudní stěny, a tím přispívá k udržení compliance měkkých tkání hrudníku a plic, což představuje prevenci vzniku atelektáz a podporu obnovy adekvátní dechové dynamiky [7,43]. MIE může být prováděna přes obličejovou masku nebo tracheostomickou kanylu, ve druhém případě je účinnější. Podle provedených studií MIE signifikantně snižuje počet hospitalizací a finanční náročnost pacientů s neuromuskulárními chorobami [44]. Přístroj lze získat i k domácímu použití, pacient však musí splňovat recentně publikovaná indikační kritéria objektivizující poruchu expektorace [45].
Obr. 7. Mechanická insufl ace – exsufl ace pomocí přístroje CoughAssist, aplikovaná terapeutem. Fotografi e byla pořízená s informovaným souhlasem pacienta.
Fig. 7. Mechanical insuffl ation – exsuffl ation performed by a therapist using the CoughAssist device. The picture was taken with informed consent from the patient.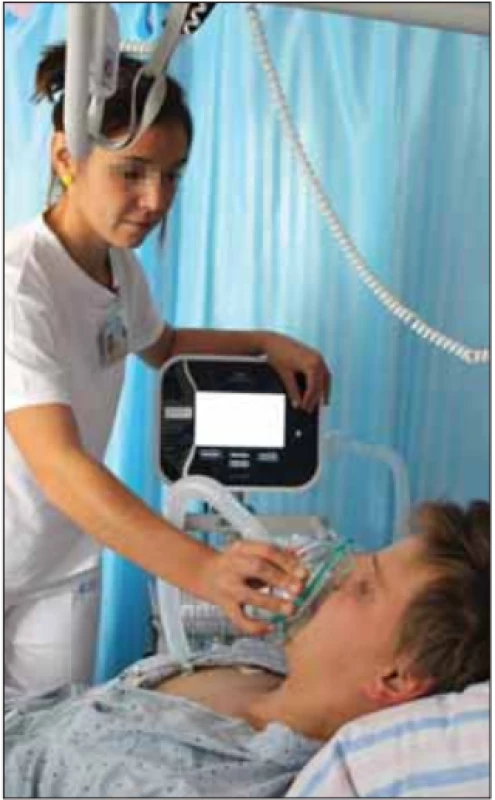
Obr. 8. Pacientka na jednotce intenzivní péče po zaškolení samostatně používá přístroj CoughAssist. Fotografi e byla pořízená s informovaným souhlasem pacientky.
Fig. 8. Patient in the intensive care unit, after being tutored, uses the CoughAssist device on her own. The picture was taken with informed consent from the patient.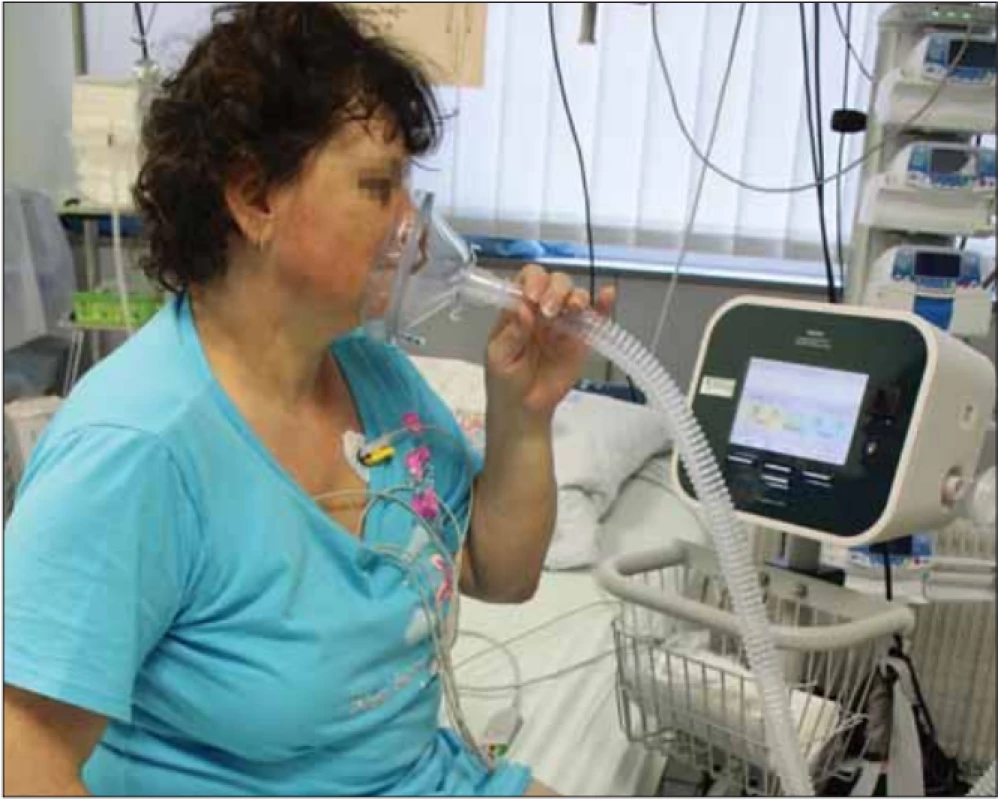
U dospělého pacienta jsou pro exsuflaci využívány tlaky v rozmezí –40 až –60 cm H2O, pro insuflaci pak mezi 40 a 60 cm H2O. MIE zvyšuje vrcholový průtok vzduchu u pacientů s bulbárním postižením o 26 %, bez bulbárního postižení dokonce o 28 %. Účinnost LVR je ve srovnání s MIE méně než poloviční [46]. Manuálně asistovaný kašel při samostatném použití neumožní zvýšit hodnoty PCF nad 270 l/min. Při potřebě dosažení vyšších hodnot je proto nutná jeho kombinace s jinou z uvedených technik [39,47].
Nejvhodnější techniku podpory kašle je nutné zvolit zejména dle preferencí pacienta (tedy tu, kterou pacient nejlépe toleruje a která mu s expektorací napomáhá nejúčinněji) [40,48,49].
Závěr
Rehabilitace dechových funkcí může u pacientů s ALS (ale i s jinými neuromuskulárními onemocněními) oddálit a zpomalit rychlost nástupu respiračních obtíží a symptomaticky působit na již vzniklé projevy dechové nedostatečnosti. Účinné rehabilitaci pomáhá podrobné iniciální vyšetření dechových funkcí umožňující objektivizovat míru restrikční, případně obstrukční ventilační poruchy. Nejvýznamnějším hodnoceným parametrem je FVC, které je také obecně uznávaným prediktorem očekávané délky dožití pacientů s ALS. Dle objektivního nálezu a dle udávaných obtíží pacienta volíme techniku, která v daném stadiu nemoci nejlépe podpoří oslabené funkce, a tak zmírní diskomfort a vnímaní dušnosti či poruchy expektorace. Znovuzískáním (obnovením) pocitu dobrého fyzického a psychického ladění lze zvýšit kvalitu života pacientů s ALS v průběhu progrese onemocnění.
Grantová podpora
Práce byla podpořena z prostředků MZ ČR – RVO (FNBr, 65269705) a projektem specifického výzkumu č. MUNI/A/1325/2019 z programu podpory studentských projektů na Masarykově univerzitě.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem práce nemají žádný konflikt zájmů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
doc. MUDr. Eva Vlčková, Ph.D.
Neurologická klinika ERN-EURO NMD Centrum
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: evlckova@email.cz
Přijato k recenzi: 17. 5. 2020
Přijato do tisku: 8. 10. 2020
Zdroje
1. Štětkářová I, Matěj R, Ehler E. Nové poznatky v diagnostice a léčbě amyotrofické laterální sklerózy. Cesk Slov Neurol N 2018; 81/114 (5): 546–554. doi: 10.14735/amcsnn2018546
2. Pasparaki E, Bibaki E, Meletis Y et al. Neuromuscular diseases and respiratory system. Pneumon 2017; 30 (3): 176–187. doi: 10.1097/MOP.0000000000000498.
3. Logroscino G, Traynor BJ, Hardiman O et al. Incidence of amyotrophic lateral sclerosis in Europe. J Neurol Neurosurg Psychiatry 2010; 81 (4): 385–390. doi: 10.1136/jnnp.2009.183525.
4. Boentert M, Wenninger S, Sansone VA. Respiratory involvement in neuromuscular disorders. Curr Opin Neurol 2017; 30 (5): 529–537. doi: 10.1097/WCO.0000000000000470.
5. Shoesmith CL, Findlater K, Rowe A et al. Prognosis of amyotrophic lateral sclerosis with respiratory onset. J Neurol Neurosurg Psychiatry 2007; 78 (6): 629–631. doi: 10.1136/jnnp.2006.103564.
6. Hardiman O. Management of respiratory symptoms in ALS. J Neurol 2011; 258 (3): 359–365. doi: 10.1007/s00415-010-5830-y.
7. Pinto S, Carvalho M. Breathing new life into treatment advances for respiratory failure in amyotrophic lateral sclerosis patients. Neurodegener Dis Manag 2014; 4 (1): 83–102. doi: 10.2217/nmt.13.74.
8. Benditt JO. Pathophysiology of neuromuscular respiratory diseases. Clin Chest Med 2018; 39 (2): 297–308. doi: 10.1016/j. ccm.2018.01.011.
9. Bergofsky EH. Respiratory failure in disorders of the thoracic cage. Am Rev Respir Dis 1979; 119 (4): 643–669. doi: 10.1164/arrd.1979.119.4.643.
10. Kapandji IA. The physiology of the joints. Edinburgh: Churchill Livingstone 2007.
11. Troyer AD, Kelly S, Zin WA. Mechanical action of the intercostal muscles on the ribs. Science 1983; 220 (4592): 87–88. doi: 10.1126/science.6828883.
12. Benditt JO. The neuromuscular respiratory system: physiology, pathophysiology, and a respiratory care approach to patients. Respir Care 2006; 51 (8): 829–837. doi: 10.1126/science.6828883.
13. Vondra V. Dušnost: problém mnoha oborů. Praha: Mladá fronta 2017.
14. Neumannová K, Kolek V. Asthma bronchiale a chronická obstrukční plicní nemoc Možnosti komplexní léčby z pohledu fyzioterapeuta. Praha: Mladá fronta 2012.
15. Ayvazian LF. Handbook of physiology: Section 3, The respiratory system, Volume III: Mechanics of breathing, Parts 1 and 2. Am Rev Respir Dis 1987; 136 (3): 796–796. doi: 10.1164/ajrccm/136.3.796c.
16. Park KH, Kim RB, Yang J et al. Reference range of respiratory muscle strength and its clinical application in amyotrophic lateral sclerosis: a single-center study. J Clin Neurol Seoul Korea 2016; 12 (3): 361–367. doi: 10.3988/jcn.2016.12.3.361.
17. Žurková P, Shudeiwa A. Vyšetření funkce plic a respiračních svalů u pacientů s neuromuskulárním onemocněním. Neurol Praxi 2012; 13 (6): 336–340. doi: 10.nnnn/neu.2012.085.
18. Pinto S, Swash M, de Carvalho M. Respiratory exercise in amyotrophic lateral sclerosis. Amyotroph Lateral Scler 2012; 13 (1): 33–43. doi: 10.3109/17482968.2011.626052.
19. Sharma R, Wolfe L. Use of non-invasive ventilation in neuromuscular disease. Curr Sleep Med Rep 2017; 3 (4): 290–298. doi: 10.1007/s40675-017-0097-9.
20. Suarez A, Augusto Pessolano F, Monteiro S et al. Peak flow and peak cough flow in the evaluation of expiratory muscle weakness and bulbar impairment in patients with neuromuscular disease. Am J Phys Med Rehabil 2002; 81 : 506–511. doi: 10.1097/00002060-200207000-00007.
21. Walterspacher S, Pietsch F, Walker DJ et al. Activation of respiratory muscles during respiratory muscle training. Respir Physiol Neurobiol 2018; 247 : 126–132. doi: 10.1016/j.resp.2017.10.004.
22. Reffin J, Dewar L, Di Marco M et al. Exercise advice for adults with muscle-wasting conditions. Muscular dystrophy campaign support resour hub. [online]. Available from URL: http: //hub.muscular-dystrophy.org/wp-content/uploads/2014/12/Exercise-advice-for-adults-final-051214.pdf.
23. Eagle M. Report on the muscular dystrophy campaign workshop: exercise in neuromuscular diseases Newcastle, January 2002. Neuromuscul Disord 2002; 12 (10): 975–983. doi: 10.1016/s0960-8966 (02) 00136-0.
24. Pinto S, de Carvalho M. Can inspiratory muscle training increase survival in early-affected amyotrophic lateral sclerosis patients? Amyotroph Lateral Scler Front Degener 2013; 14 (2): 124–126. doi: 10.3109/17482968.2012.726227.
25. Seo K, Hwan PS, Park K. The effects of inspiratory diaphragm breathing exercise and expiratory pursed-lip breathing exercise on chronic stroke patients’ respiratory muscle activation. J Phys Ther Sci 2017; 29 (3): 465–469. doi: 10.1589/jpts.29.465.
26. Ramsook AH, Koo R, Molgat-Seon Y et al. Diaphragm recruitment increases during a bout of targeted inspiratory muscle training. Med Sci Sports Exerc 2016; 48 (6): 1179–1186. doi: 10.1249/MSS.0000000000000881.
27. Nardin R, O’Donnell C, Loring SH et al. Diaphragm training in amyotrophic lateral sclerosis. J Clin Neuromuscul Dis 2008; 10 (2): 56–60. doi: 10.1097/CND.0b013e31818cf6df.
28. Neumannova K. Možnosti využití technik plicní rehabilitace pro léčbu snížené síly dýchacích svalů. Čas Lék čes 2015; 154 : 72–78.
29. Neumannová K, Vladimír Koblížek. Doporučený postup plicní rehabilitace 2019. [online]. Dostupné z URL: https: //docplayer.cz/8779489-Standard-plicni-rehabilitace-zakladni-verze-katerina-neumannova-jakub-zatloukal-vladimir-koblizek.html.
30. Lahrmann H, Wild M, Zdrahal F et al. Expiratory muscle weakness and assisted cough in ALS. Amyotroph Lateral Scler Other Motor Neuron Disord 2003; 4 (1): 49–51. doi: 10.1080/14660820310006733.
31. Plowman EK, Tabor-Gray L, Rosado KM et al. Impact of expiratory strength training in amyotrophic lateral sclerosis: results of a randomized, sham-controlled trial. Muscle Nerve 2019; 59 (1): 40–46. doi: 10.1002/mus.26292.
32. Smolíková L, Máček M. Respirační fyzioterapie a plicní rehabilitace. Brno: Národní centrum ošetřovatelství a nelékařských zdravotnických oborů 2010.
33. Ng L, Khan F, Young CA et al. Symptomatic treatments for amyotrophic lateral sclerosis/motor neuron disease. Cochrane Database Syst Rev 2017; 1: CD011776. doi: 10.1002/14651858.CD011776.pub2.
34. Mesquita Montes A, Maia J, Crasto C et al. Abdominal muscle activity during breathing in different postures in COPD ‘Stage 0’ and healthy subjects. Respir Physiol Neurobiol 2017; 238 : 14–22. doi: 10.1016/j.resp.2017.01.001.
35. Katz S, Arish N, Rokach A et al. The effect of body position on pulmonary function: a systematic review. BMC Pulm Med 2018; 18 (1): 159. doi: 10.1186/s12890-018-0723-4.
36. Kolář P et al. Rehabilitace v klinické praxi. Praha: Galén 2009.
37. Žurková P, Skřičková J. Přehled dechových pomůcek pro hygienu dýchacích cest v praxi. Medicína Praxi 2012; 9 (5): 250–255. doi: 10.nnnn/med.2012.058.
38. Reid WD, Brown JA, Konnyu KJ et al. Physiotherapy secretion removal techniques in people with spinal cord injury: a systematic review. J Spinal Cord Med 2010; 33 (4): 353–370. doi: 10.1080/10790268.2010.11689714.
39. Bach J. Don’t forget the abdominal thrust. Chest 2004; 126 : 1388–1389. doi: 10.1378/chest.126.4.1388-a.
40. Senent C, Golmard JL, Salachas F et al. A comparison of assisted cough techniques in stable patients with severe respiratory insufficiency due to amyotrophic lateral sclerosis. Amyotroph Lateral Scler 2011; 12 (1): 26–32. doi: 10.3109/17482968.2010.535541.
41. Bach JR, Mahajan K, Lipa B et al. Lung insufflation capacity in neuromuscular disease. Am J Phys Med Rehabil 2008; 87 (9): 720–725. doi: 10.1097/PHM.0b013e31817fb26f.
42. Lechtzin N, Wolfe LF, Frick KD. The impact of high-frequency chest wall oscillation on healthcare use in patients with neuromuscular diseases. Ann Am Thorac Soc 2016; 13 (6): 904–909. doi: 10.1513/AnnalsATS.201509-597OC.
43. Stehling F, Bouikidis A, Schara U et al. Mechanical insufflation/exsufflation improves vital capacity in neuromuscular disorders. Chron Respir Dis 2015; 12 (1): 31–35. doi: 10.1177/1479972314562209.
44. Vitacca M, Paneroni M, Trainini D et al. At home and on demand mechanical cough assistance program for patients with amyotrophic lateral sclerosis. Am J Phys Med Rehabil 2010; 89 (5): 401–406. doi: 10.1097/PHM.0b013e3181d89760.
45. Neumannová K, Doušová T, Sedlák V et al. Doporučený postup České pneumologické a ftizeologické společnosti a České společnosti dětské pneumologie pro dlouhodobou domácí léčbu poruch expektorace pomocí přístroje CoughAssist. Cesk Slov Neurol N 2017; 80/113 (4): 480–484. doi: 10.14735/amcsnn2017480.
46. Mustfa N, Aiello M, Lyall RA et al. Cough augmentation in amyotrophic lateral sclerosis. Neurology 2003; 61 (9): 1285–1287. doi: 10.1212/01.wnl.0000092018.56823.02.
47. Bach JR. Mechanical insufflation-exsufflation. Comparison of peak expiratory flows with manually assisted and unassisted coughing techniques. Chest 1993; 104 (5): 1553–1562. doi: 10.1378/chest.104.5.1553.
48. Rafiq MK, Bradburn M, Proctor AR et al. A preliminary randomized trial of the mechanical insufflator-exsufflator versus breath-stacking technique in patients with amyotrophic lateral sclerosis. Amyotroph Lateral Scler Front Degener 2015; 16 (7–8): 448–455. doi: 10.3109/21678421.2015.1051992.
49. Desnuelle C, Bruno M, Soriani MH et al. [What physical therapy techniques can be used to improve airway freedom in amyotrophic lateral sclerosis?] Rev Neurol (Paris) 2006; 162 (Spec No 2): 4S244–4S252.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2020 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Difuzní nízkostupňové gliomy
- Dechová rehabilitace u pacientů s amyotrofickou laterální sklerózou
- Socioekonomické dopady bolestí hlavy – příčiny a možnosti ovlivnění
- Neurorehabilitácia u pacientov s amyotrofickou laterálnou sklerózou
- Chirurgická liečba degeneratívnej skoliózy
- Funkční a strukturální změny na kortikální úrovni u pacientů s nespecifickými bolestmi zad v bederním úseku páteře
- Kognitivně-motorická interference po cévní mozkové příhodě
- Sonografické hodnocení nervus ischiadicus u jedinců s radikulární symptomatikou S1
- Taste strips – metoda samovyšetření chuti
- Test Amnesia Light and Brief Assessment (ALBA) – druhá verze a opakovaná vyšetření
- Účinnost mikrovaskulární dekomprese v porovnání s mikrovaskulární dekompresí s parciální senzorickou rhizotomií při klasické neuralgii trojklanného nervu – retrospektivní analýza 58 pacientů
- Pacient s Parkinsonovou nemocí v datových zdrojích Národního zdravotnického informačního systému
- Léčba intravenózní trombolýzou mimo iktové centrum
- Dekompresivní kraniektomie u maligního hemisferálního infarktu – monoinstitucionální retrospektivní analýza souboru 33 pacientů
- Dvoudobý nízkoprůtokový a vysokoprůtokový EC-IC bypass v prevenci ischemie při obětování vnitřní karotidy u intrakavernózního aneuryzmatu
- Stentování durálních splavů u idiopatické intrakraniální hypertenze
- Posterior reversible encephalopathy syndrome associated with Neisseria elongata meningitis
- Hyperbarická oxygenoterapie & mozek; přehled z výroční konference EUBS 2019
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Difuzní nízkostupňové gliomy
- Dechová rehabilitace u pacientů s amyotrofickou laterální sklerózou
- Test Amnesia Light and Brief Assessment (ALBA) – druhá verze a opakovaná vyšetření
- Neurorehabilitácia u pacientov s amyotrofickou laterálnou sklerózou
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



