-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Doporučené postupy pro nutriční podporu u cévních mozkových příhod
Guidelines for nutritional support in stroke
Stroke is one of the most frequent acute events in neurology and it is associated with severe disability and high mortality. Advances in current diagnostic and therapeutic guidelines reflect the advances in a multidisciplinary approach. Malnutrition or a risk of malnutrition in stroke patients is common and systematic nutrition screening at admission is important. Acute illness and hospitalization can contribute to worsening of nutritional status. Appropriate timing of nutritional support, early capture and rehabilitation of speech and swallowing disorders together with physiotherapy may reduce incidence of complications, improve patient’s clinical outcome, prognosis and quality of life. The presented summary is in agreement with consensus of the European Society for Clinical Nutrition and Metabolism and recommended best practice expert consensus in the Czech Republic.
Keywords:
stroke – malnutrition – nutrition risk screening – dysphagia – enteral nutrition – percutaneous endoscopic gastrostomy – hydration – texture-modified diet – Physiotherapy – speech therapy
Autori: J. Klempíř 1; I. Šarbochová 2; L. Růžičková 3; E. Bezuchová 1; O. Gál 1; M. Srp 1; F. Novák 4
Pôsobisko autorov: Neurologická klinika a Centrum klinických neurověd, 1. LF UK a VFN v Praze 1; Neurologická klinika 2. LF UK a FN Motol, Praha 2; Oddělení nutričních terapeutů, VFN v Praze 3; IV. interní klinika 1. LF UK a VFN v Praze 4
Vyšlo v časopise: Cesk Slov Neurol N 2020; 83/116(6): 667-673
Kategória: Doporučené postupy
doi: https://doi.org/10.48095/cccsnn2020667Súhrn
Cévní mozková příhoda patří k nejčastějším akutním stavům v neurologii a je spojena se závažnou disabilitou a vysokou mortalitou. Doporučení pro diagnostiku a léčbu CMP se rychle rozvíjejí zejména díky možnosti mezioborové spolupráce. Mnozí pacienti jsou malnutriční nebo v riziku rozvoje malnutrice ještě před vznikem CMP, proto je důležitý pravidelný nutriční skríning již při přijetí do nemocnice. Zhoršení nutričních parametrů často souvisí se základním onemocněním a hospitalizací. Včasná a přiměřená nutriční podpora, cílená diagnostika a rehabilitace poruch řeči a polykání společně s fyzioterapií mohou přispět ke stabilizaci pacienta, příznivě ovlivnit vývoj komplikací, zlepšit prognózu a kvalitu života. Předkládaný text vychází z doporučení schválených Evropskou společností pro klinickou výživu a metabolizmus a ze zkušeností v ČR.
Klíčová slova:
cévní mozková příhoda – malnutrice – nutriční skríning – dysfagie – enterální výživa – perkutánní endoskopická gastrostomie – hydratace – dieta s upravenou texturou stravy – fyzioterapie – klinická logopedie
Úvod
Cévní mozkové příhody náleží k nejčastějším akutním stavům v neurologii. V posledních letech došlo ke značnému pokroku v léčbě ischemických CMP díky intravenózní trombolýze a endovaskulárním intervencím. Přesto však stále mají mnozí pacienti po CMP trvalé nebo fatální následky [1]. Mezi faktory, které negativně ovlivňují vysokou morbiditu a mortalitu u CMP, patří poruchy polykání a malnutrice. Jejich kvalitní včasná diagnostika a účinná opatření vyžadují mezioborovou spolupráci. Evropská společnost pro klinickou výživu a metabolizmus (The European Society for Clinical Nutrition and Metabolism; ESPEN) jmenovala pracovní skupinu odborníků z různých zemí, ve které byli zastoupeni specialisté v oborech klinická výživa, neurologie, geriatrie, dietologie a intenzivní péče. Tato pracovní skupina vytvořila doporučené postupy pro diagnostiku, prevenci a terapii dysfagie a malnutrice u vybraných neurologických onemocnění (amyotrofická laterální skleróza, RS, Parkinsonova nemoc, orofaryngeální dysfagie a CMP) [2]. Po schválení výborem ESPEN v roce 2018 byly doporučené postupy publikovány v časopise Clinical Nutrition a na internetových stránkách ESPEN [2,3]. Pod záštitou ESPEN, Společnosti pro klinickou výživu a intenzivní metabolickou péči (SKVIMP) [4] a se souhlasem České neurologické společnosti České lékařské společnosti Jana Evangelisty Purkyně (ČSN ČLS JEP) [5] jsou doporučené postupy týkající se nutričních opatření u CMP v českém překladu dostupné v elektronické verzi na webových stránkách SKVIMP a ČSN ČLS JEP. Protože jsou tato doporučení ESPEN velmi obsáhlá, vytvořila skupina odborníků, která zajistila český překlad, také prakticky orientovaný komentář s přihlédnutím k zavedeným postupům v ČR. Text vychází i z aktuálních doporučení ESPEN pro výživu a hydrataci geriatrických pacientů [6], interně polymorbidních pacientů [7] a výživu v intenzivní péči [8]. Finální verze tohoto textu vznikla na základě oponentury odborníků jmenovaných výborem SKVIMP, Cerebrovaskulární sekce ČNS ČLS JEP a Neurointenzivistické sekce ČNS ČLS JEP.
Definice malnutrice
Pojem malnutrice znamená špatný stav výživy, a proto se týká osob podvyživených, obézních a s neadekvátním příjmem některých složek potravy (tab. 1).
Tab. 1. Spektrum nutričně podmíněných poruch. 
Malnutrice vznikající z různých příčin není vzácným jevem ani v civilizovaných zemích (tab. 2). Zvýšené riziko je u dětí, seniorů a při výskytu jednoho nebo více chronických onemocnění. U nemocných, kteří jsou přijati do nemocnice, se malnutrice vyskytuje přibližně ve třetině případů a u dlouhodobě hospitalizovaných malnutrice postihuje až polovinu nemocných.
Tab. 2. Potenciální příčiny malnutrice. 
Diagnostika malnutrice
Rizika a závažnost malnutrice nejprve zjišťujeme nutričním skríningem, který může provádět kterýkoli zaškolený zdravotník. Pro skríning lze použít jednoduché dotazníky, např. Malnutrition Universal Screening (MUST), Mini Nutrition Assesment (MNA), Nutrition Risk Score (NRS) 2002 nebo Short Nutritional Assessment Questionaire (SNAQ) (obr. 1, 2) [9,10]. V případě zjištění rizika malnutrice posuzujeme malnutrici podle fenotypových a etiologických kritérií (tab. 3, obr. 1) [11]. Pro terapii je rozhodující, zda je malnutrice doprovázena zánětlivou aktivitou (tab. 4, obr. 2). Výrazná zánětlivá aktivita podmiňuje anabolickou rezistenci.
Tab. 3. Mezní hodnoty pro fenotypová kritéria diagnostiky podvýživy. 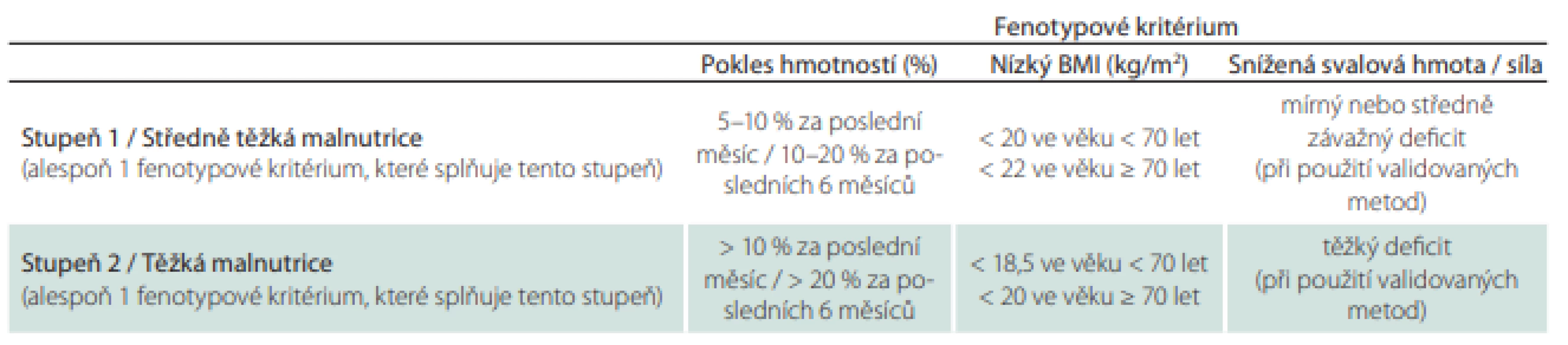
BMI – index tělesné hmotnosti; validovaná metoda – měření obvodu paže, lýtka nebo kožních řas, měření svalové síly a funkce dynamometrem a testy chůze, měření množství svalové hmoty a tuku bioelektrickou impedancí, CT, MR, duální rentgenovou absorpciometrií Obr. 1. Doporučovaný postup pro nutriční péči v průběhu hospitalizace.
Fig. 1. Recommended procedure for nutritional care during hospitalization.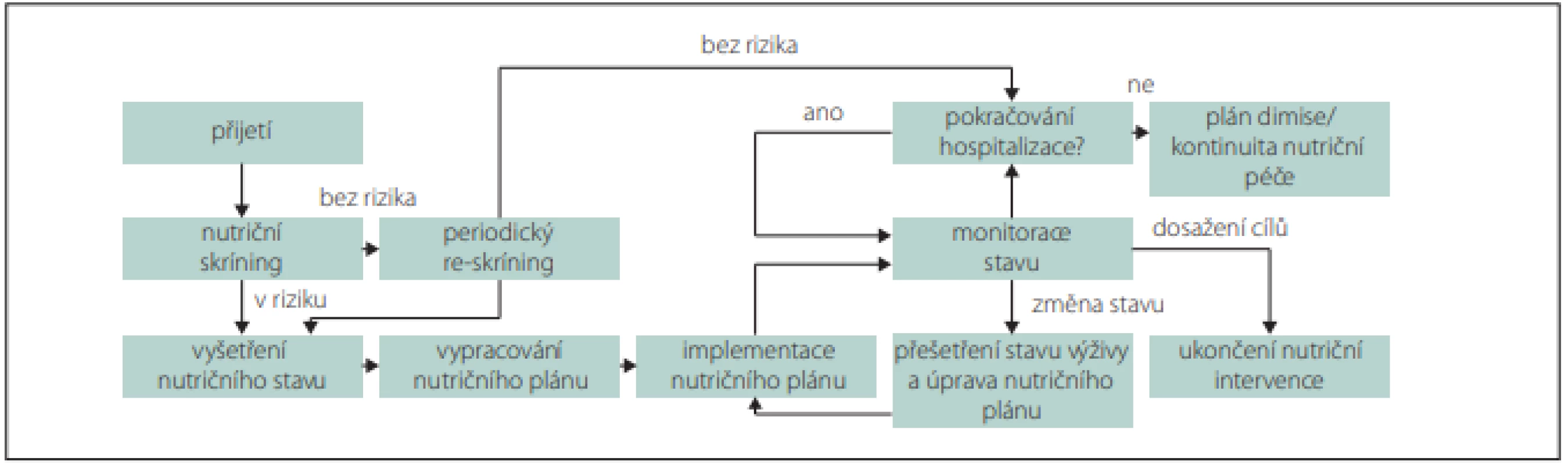
Tab. 4. Klasifikace malnutrice podle vyvolávající příčiny 
Obr. 2. Globální konsensus pro diagnostiku malnutrice u dospělých. Fig. 2. Global consensus for the diagnosis of malnutrition in adults. 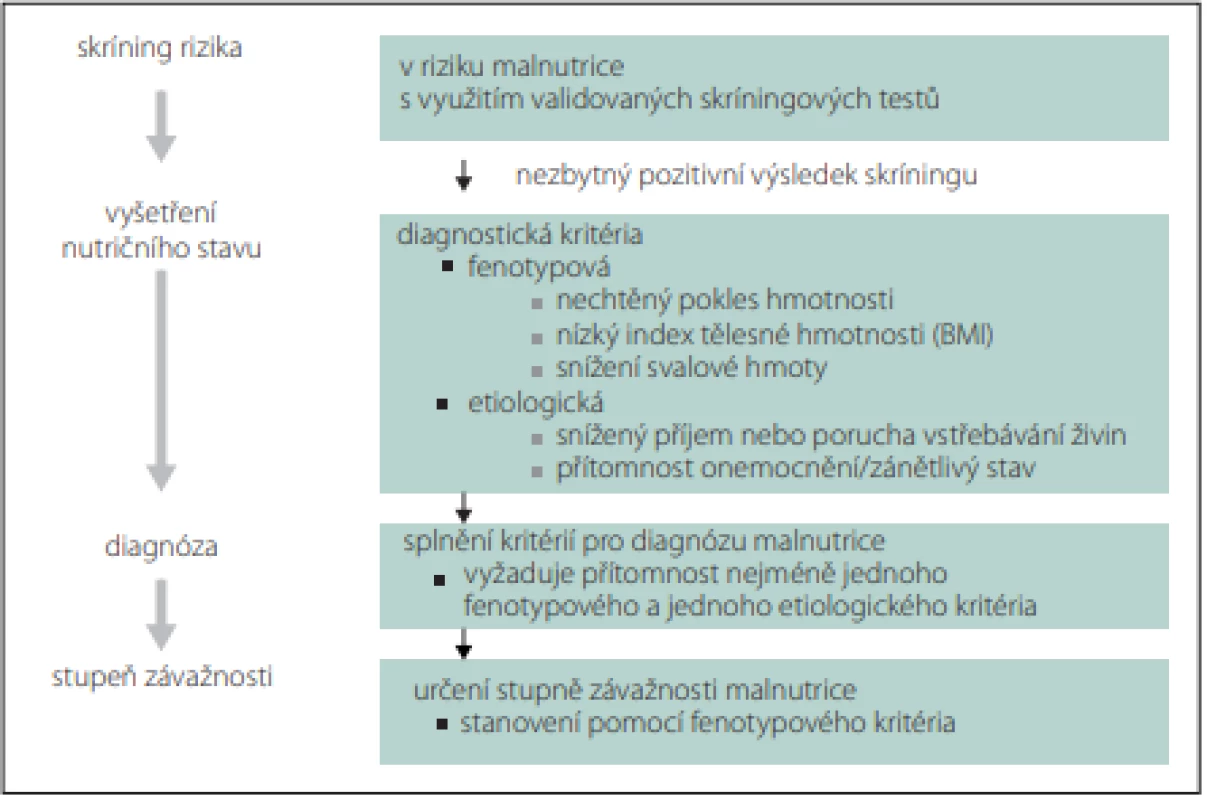
Pacient, který je v riziku malnutrice nebo již je v malnutrici, musí být vyšetřen nutričním terapeutem. Při vyšetření nutričního stavu se zjišťují schopnost příjmu perorální stravy a funkčnost trávicího traktu, stanovují se tělesné zásoby. Nutriční terapeut potřebuje informace o skutečném příjmu potravy, případně druhu a množství zkonzumované klinické výživy (sipping, sondová výživa). Na základě těchto informací provádí nutriční bilanci. Pokud tato bilance neodpovídá nutričním potřebám pacienta, doporučuje úpravu nutričních opatření. Nutriční terapeut informuje ošetřujícího lékaře o plánu nutriční péče a spolupodílí se na řešení stavu výživy pacienta. V případě komplikovaných stavů výživy je vhodná spolupráce s nutricionistou, klinickým logopedem i s dalšími specialisty. Nutricionista je lékař, který má nástavbovou specializaci v oboru Klinická výživa a intenzivní metabolická péče.
Nutriční podpora v intenzivní péči
V akutní fázi onemocnění anebo při probíhajícím zánětu se prodlužuje katabolická fáze a organizmus není schopen efektivně využívat případnou nutriční podporu. Potřebné živiny jsou získávány proteolýzou z kosterní svaloviny. Až třetina pacientů s CMP v akutní fázi se nachází v riziku malnutrice nebo je již malnutričních [12]. Podvýživa je spojena s únavou, svalovou slabostí a úbytkem svalové hmoty. Malnutrice vede k imunosupresi, poškození funkce střeva a nozokomiálním infekcím. Malnutrice tak prodlužuje akutní stavy i rekonvalescenci a zvyšuje rizika dalších komplikací a recidivy základního i přidružených onemocnění [13]. Proto je nutné co nejdříve identifikovat nejen pacienty v riziku malnutrice nebo s malnutricí, ale také jedince, kteří budou z adekvátní nutriční podpory v dané fázi nemoci profitovat.
Jestliže je pacient v akutním stavu schopen bezpečného perorálního příjmu, podáváme běžnou stravu s doplňky podle potřeby (nejčastěji základní dieta nebo dieta s modifikovanou texturou, příp. sipping). Pokud není možný perorální příjem a zároveň nejsou přítomny kontraindikace enterální výživy, zahájíme do 48 h časnou enterální výživu pomocí sondy. U kriticky nemocných s kvantitativní poruchou vědomí a nutnou umělou plicní ventilací by sondová enterální výživa měla být zavedena do 72 h. Nazogastrická sonda není překážkou v komunikaci, rehabilitaci poruch řeči, artikulaci a polykání. Lépe jsou pacienty tolerovány měkké a tenké sondy z polyuretanu než tlusté sondy z polyvinylchloridu. Za předpokladu, že nebude možné obnovit plný příjem per os ani po 28 dnech, je žádoucí zavést perkutánní gastrostomii ve stabilizovaném stavu mezi 14. a 28. dnem. V závažných případech u pacientů, kteří jsou ventilovaní déle než 48 h, je možné indikovat časné zavedení perkutánní gastrostomie již v prvním týdnu po CMP. Perkutánní gastrostomie může také časně nahradit nazogastrickou sondu, pokud ji pacient netoleruje anebo opakovaně extrahuje. U pacientů s kontraindikací podávání enterální výživy nebo její intolerancí zahajujeme parenterální výživu. Parenterální nutriční podporu u pacientů s kontraindikací enterální výživy lze podat podle naléhavosti již v prvních 24 h a u pacientů s nedostatečnou tolerancí enterální výživy, pokud trvá > 72 h.
Potřebu energie a živin lze odhadovat pomocí prediktivních rovnic. K nejčastěji používaným patří Harris-Benedictova rovnice pro hodnocení bazálního energetického výdeje (basal energy expenditure; BEE) za fyziologických podmínek v kilokaloriích; 1 kcal = 4,18 kJ (1 kJ = 0,239 kcal) (tab. 5).
Tab. 5. Výpočet bazálního energetického výdeje. 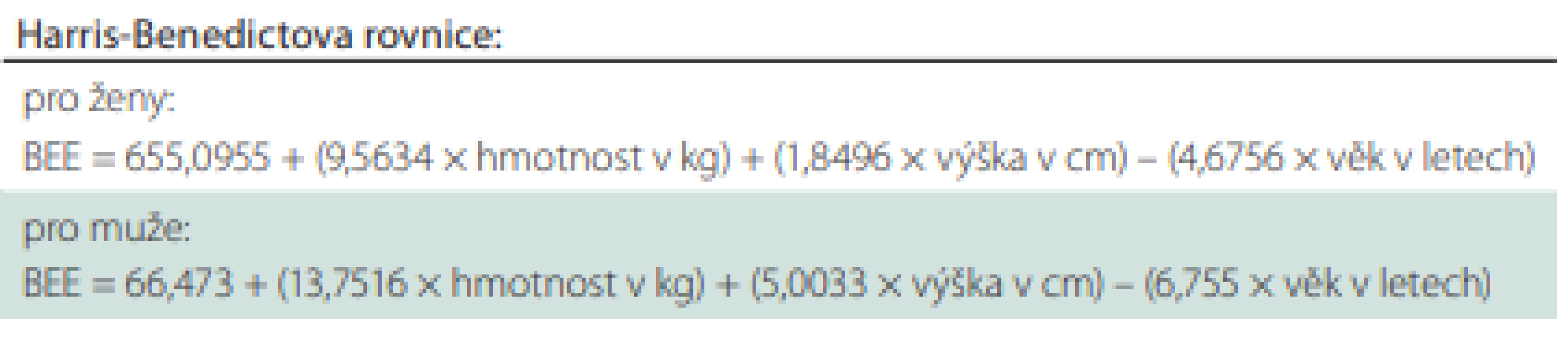
BEE – bazální energetický výdej v kcal/den V klinické praxi je skutečná hodnota aktuálního energetického výdeje (actual energy expenditure; AEE) ovlivněna řadou faktorů. Stanovení orientační hodnoty AEE se v klinické praxi provádí např. podle vzorce uvedeného v tab. 6.
Tab. 6. Výpočet aktuálního energetického výdeje. 
AEE – aktuální energetický výdej; AF – faktor aktivity; BEE – bazální energetický výdej; IF – faktor poškození; TF – faktor teploty V kritických stavech a/nebo u pacientů s oběma extrémy indexu tělesné hmotnosti (body mass index; BMI), kdy je využití prediktivních rovnic velmi zavádějící, je vhodné stanovení energetického výdeje provádět pomocí nepřímé kalorimetrie na principu měření spotřeby O2 a výdeje CO2. Moderní ventilátory umožňují měření hodnot produkce CO2, které je rovněž možné využít k poměrně přesnému odhadu energetického výdeje zejména na pracovištích, kde není kalorimetr k dispozici.
V akutním stadiu nemoci podáváme nejprve hypokalorickou výživu, která pokrývá maximálně 70 % denní energetické spotřeby. Při dobré toleranci organizmu je možné po 3 dnech, s ohledem na individuální potřebu, výživu navýšit až na 100 %. V případech preexistující malnutrice s rizikem realimentace zahajujeme nutriční podporu přibližně třetinou odhadované denní spotřeby energie a dávky navyšujeme jen pozvolna s pravidelnou monitorací sérových hladin draslíku, hořčíku, fosfátů, glukózy a zánětlivých parametrů.
U oběhově nestabilních pacientů, při závažné hypoxemii, hyperkapnii nebo acidóze nepodáváme nutriční podporu ani ve formě parenterální výživy. Výživu zahajujeme vždy po stabilizaci stavu za pečlivé monitorace metabolických parametrů. Preferovaná enterální výživa se nepodává při krvácení do horní části gastrointestinálního traktu, při podezření na ischemii střeva a/nebo ve stavech s vysokými odpady z nazogastrické sondy (> 500 ml/6 h) i přes zpomalení rychlosti aplikace. Při absenci kontraindikací se podává časná enterální výživa, a to i v případech, kdy nemusí být slyšitelná peristaltika [8,14]. U pacientů bez závažné dysfagie preferujeme orální výživu.
Kritické stavy zvyšují patologickými mechanizmy (sepse, hypoxie) degradaci intracelulárních proteinů (autofagie) v kosterní svalovině, v plicním parenchymu a v dalších tkáních. Potřebnou autofagii může inhibovat parenterální výživa obsahující především aminokyseliny. Nadměrný útlum autofagie způsobuje kumulaci autofagického substrátu v buňkách a může přispívat k poruchám intracelulárních procesů [15]. Časná parenterální výživa v prvním týdnu kritického stavu nezabrání úbytku kosterní svaloviny a naopak zvyšuje míru steatózy ve svalech [16]. Cílem je do určité míry omezit katabolizmus svalových bílkovin bez nepříznivého vlivu na autofagii, a proto se u kriticky nemocných pacientů doporučuje přiměřeně zvýšit dávku proteinů na 1,3 g/kg/den s hypokalorickým přívodem energie (< 20 kcal/kg/den) [15,17].
Nutriční podpora u geriatrických a interně polymorbidních pacientů
Výskyt CMP narůstá s věkem a s počtem přidružených chorob. Za interně polymorbidní jsou považováni jedinci, kteří mají současně nejméně dvě onemocnění. Vysoký výskyt nutričního rizika, častá přítomnost malnutrice, která předchází vzniku CMP, může významně zhoršit její průběh a prognózu. Snížený příjem energie a živin spolu s poklesem tělesné aktivity mají za následek nechtěný hmotnostní úbytek, ztrátu kosterní svaloviny, nižší rezistenci vůči infekcím, protrahované hojení ran a rekonvalescenci při akutních a chronických onemocněních. U seniorů a polymorbidních osob jsou regenerační schopnosti a funkční rezervy snížené. Pokud pacient nemá dostatečné tělesné zásoby, musí energetický příjem a množství živin pokrývat nejen potřebný metabolický obrat k překonání nemoci, ale také zvýšené nároky spojené s obnovou svalové hmoty a tukových zásob. Dostatečný přívod živin a tolerance stravy jsou u těchto pacientů často limitovány i sníženou schopností příjmu per os a kapacitou trávení nebo vstřebávání. Za těchto okolností není možné indikovat restriktivní diety (neslaná, nízkobílkovinná nebo diabetická), které vedou k nežádoucímu snížení nutričního příjmu [18]. Proto se v akutním stadiu CMP doporučuje příjem energie 20–30 kcal/kg/den a po stabilizaci 30–35 kcal/kg/den, který potom v rekonvalescenci při intenzivní fyzické zátěži může dosáhnout až 45 kcal/kg/den [6]. Minimální doporučovaný příjem bílkovin je 1 g/kg/den, ale k dosažení jejich optimálního přívodu pro tvorbu kosterní svaloviny v průběhu rekonvalescence jsou potřebné dávky v rozmezí 1,2–2,0 g/kg/den [6,7]. Výživa by měla obsahovat minimálně 25 g/den rozpustné i nerozpustné vlákniny pro zlepšení funkce střeva [6]. V praxi je množství vlákniny v dietě obvykle nižší (10–15 g) a dávkování se řídí především funkcí a tolerancí trávicího traktu. Pokud jedinec nemá prokázanou specifickou karenci, je vhodné podávat minerály, stopové prvky a vitaminy v doporučovaných denních dávkách pro zdravou populaci [6,7]. U hospitalizovaných pacientů v nutričním riziku nebo přímo v malnutrici je nezbytné dosáhnout alespoň 75 % optimálního množství energie a živin [7]. U pacientů se doporučuje dlouhodobě pokračovat v nutričním skríningu a podle potřeby intervenovat i po zlepšení zdravotního stavu (obr. 1) [10].
Hydratace
I mírný stupeň dehydratace (deficit 0,5–2,0 litry) může u predisponovaných jedinců způsobit významné zhoršení klinického stavu (apatie, únava, snížená schopnost spolupráce, dezorientace, tranzitorní ischemická ataka). Závažnější dehydratace se může dokonce na vzniku ischemické CMP podílet a v akutním stadiu CMP negativně ovlivňuje její prognózu. Dehydratací jsou ohroženi především senioři, interně polymorbidní pacienti, osoby závislé na péči druhých osob a jedinci s dysfagií, inkontinencí moči, průjmy, infekcemi nebo zvýšenou teplotou, příp. kognitivním deficitem a poruchami chování. Dehydrataci může způsobit i medikace s nežádoucími diuretickými nebo emetogenními účinky. Zvýšenou pozornost vyžadují pacienti se zahušťováním tekutin a stravy, které může vést ke snížení palatability, předčasnému pocitu sytosti, podvýživě a zejména dehydrataci. Kromě klinických příznaků dehydratace (suchost sliznic, snížený turgor) je nutné sledovat příjem a výdej tekutin, případně laboratorní parametry (natremie, osmolarita séra) [6,19]. Pro parenterální hydrataci se používají krystaloidní roztoky, případně v kombinaci s roztoky glukózy. V akutním stadiu CMP v prvních 24 h je použití zejména bolusového podání roztoků glukózy nevhodné. V případě glykemie > 10 mmol/l je doporučena léčba inzulínem.
Dysfagie
Při dysfagii jsou nemocní podle závažnosti poruchy vystaveni různé míře rizika zdravotních komplikací: dehydratace, malnutrice, aspirační pneumonie nebo pneumonitis, případně asfyxie. Manifestní nebo latentní dysfagie postihuje až 78 % pacientů s CMP [20]. Skríning dysfagie je proto standardní součástí vstupního neurologického vyšetření u CMP, dále se provádí za 24 h, při změně klinického stavu a periodicky až do její stabilizace nebo kompletní úpravy. V případě záchytu klinicky významné dysfagie je nutná úprava orálního příjmu nebo jeho nahrazení sondovou nebo parenterální cestou. Skríning na přítomnost dysfagie vstupně provádí lékař nebo zaškolený sesterský personál. Doporučovaný je validizovaný test polykání s více konzistencemi (Gugging Swalloving Screen) [21]. Specialistou na dysfagii je vyškolený klinický logoped, který samostatně provádí její diagnostiku, indikuje a spolupracuje při instrumentální objektivizaci dysfagie pomocí videofluoroskopie nebo vyšetření polykání flexibilním endoskopem (flexible endoscopic evaluation of swalloving; FEES). Logoped navrhuje léčebný plán a provádí rehabilitaci. Dále se podílí na rozhodování o dietách s upravenou texturou stravy a zahušťování tekutin, které sice mohou zvýšit orální a faryngeální rezidua, ale prokazatelně snižují riziko aspirace. Pro zahušťování se přednostně používají zahušťovadla na bázi přírodní gumy, která relativně méně mění chuťové vlastnosti tekutin i stravy a jejich konzistence je stabilnější. Při vzniku rizika dehydratace je vedle příjmu zahuštěných tekutin vhodné ke zlepšení hydratace vyzkoušet v nezbytné míře i popíjení vody bez zahušťovadla. U pacientů s tzv. predeglutivní aspirací, kteří trpí předčasným únikem sousta do hltanu, se doporučuje polykání s bradou dolů. U osob s faryngeálními reziduy je možné vyzkoušet sycené tekutiny, které mohou na rozdíl od zahuštěných tekutin tato rezidua zmenšovat. Zvedání hlavy (tzv. Shaker cvičení) zlepšuje sílu suprahyoidního svalstva a zlepšuje otevírání horního jícnového svěrače. Také posilování exspiračního svalstva cvičením s pomůckami pro expektoraci (výdechový trenažér a tzv. cough assist) zlepšuje polykání a plicní toaletu. Předpokladem úspěšné léčby poruch polykání je dostatečně časté opakování individuálně vybraného souboru vhodných cvičení. Zvýšení efektivity rehabilitace polykacích funkcí lze dosáhnout při kombinaci cvičení s neuromuskulární elektrickou stimulací [22,23]. Léčebný standard pro dysfagii po CMP v ČR byl publikován v roce 2015 [24].
Prevence a léčba komplikací klinické výživy
Při aplikaci enterální výživy se může objevit řada komplikací, které jsou však ve většině případů přechodné a relativně méně závažné (tab. 7). Nejzávažnější následky může mít aspirace. Účinnou prevencí zvracení a aspirace je především elevace horní poloviny těla. Riziko aspirace může snížit i podávání výživy do jejuna. Enterální výživu navyšujeme vždy postupně podle tolerance. Při bolusové aplikaci výživy začínáme menšími objemy s vyšší frekvencí 50–100 ml à 3 h. Rychlá aplikace velkých dávek výživy, kombinace výživy s větším množstvím tekutin a nevhodná teplota výživy mohou způsobit gastrointestinální obtíže a zhoršit toleranci.
Tab. 7. Komplikace u enterální výživy. 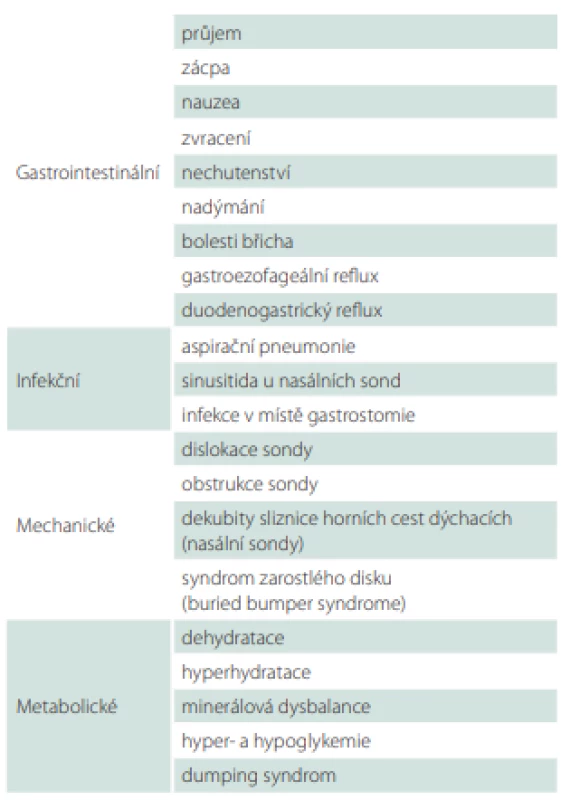
Poměrně vzácnou, ale velmi nepříjemnou komplikací nutritivní gastrostomie je tzv. syndrom zarostlého disku (buried bumper syndrome), kdy při nadměrném dotažení zevního fixátoru a absenci zanořování dochází k nekróze žaludeční sliznice pod tlakem vnitřního disku. Přerůstající žaludeční sliznice může způsobit až neprůchodnost sondy. Prevencí je pravidelné zanořování sondy do žaludku o 5–7 cm a její otáčení o 360° od začátku druhého týdne po implantaci [25].
Komplikace parenterální výživy jsou uvedeny v tab. 8. Vhodnější je podávání parenterální výživy do centrálního žilního katetru. Periferní parenterální výživu používáme pouze krátkodobě a často jako doplněk k enterální výživě. Dlouhodobé podávání výživy do periferního žilního systému (> 7–10 dní) neúměrně zvyšuje riziko vzniku bolestivých flebitid především kvůli vyšší osmolaritě roztoků. Při parenterální výživě u pacientů s vyšším rizikem vzniku trombofilních stavů je indikována profylaktická antikoagulace.
Tab. 8. Komplikace u parenterální výživy. 
Pacienti s těžkou podvýživou jsou po zahájení intenzivní nutriční podpory ohrožení rozvojem tzv. realimentačního (z angl. refeeding) syndromu s minerálovým a metabolickým rozvratem. Jedná se o hormonální a metabolickou odezvu na obnovený přívod živin, především glukózy, který doprovází pokles minerálů (kalium, magnézium, fosfáty) a retence tekutin v extracelulárním prostředí s poruchami čití, nervosvalového přenosu a křečovými stavy. V závažných případech může vyústit v život ohrožující srdeční a respirační selhání.
Fyzioterapie
Zahájení fyzioterapie v časné fázi, ihned po stabilizaci pacienta, má zásadní význam pro další průběh onemocnění, urychluje vertikalizaci a lokomoci vč. eliminace sekundárních změn v důsledku imobilizace. Správně vedená fyzioterapie příznivě ovlivňuje metabolické změny indukované CMP a imobilizací.
V pseudochabém stadiu je zásadní zajistit prevenci senzorické deprivace. Vzhledem k úbytku aferentních podnětů při imobilizaci pacienta se snižuje stimulace CNS a rychle dochází k metabolickým a strukturálním změnám. Proto se používá tzv. multisenzorický přístup s využitím stimulace v oblasti vizuální, taktilní, proprioceptivní, kinestetické, vestibulární, auditivní, ale i olfaktorické a orofaciální.
Paréza, imobilizace a později také spastická dystonie vedou k nevýhodnému postavení některých svalů a jejich zkrácení. Podle recentních studií je imobilizace ať už v důsledku parézy nebo prosté inaktivity nejvýznamnější příčinou deplece proteinů, ztráty svaloviny a snížení kontraktilních schopností [26–29]. Při pravidelném protahování svalů lze těmto změnám předejít. Při remobilizaci již zkrácených svalů opět dochází k normalizaci syntézy proteinů [30]. Pro stimulaci syntézy svalových proteinů je vedle výživy s dostatečným přívodem esenciálních aminokyselin nutné rovněž aktivně cvičit, ideálně formou rezistentního cvičení do selhání [28,31,32], případně též v kombinaci s aerobním cvičením [33].
Bylo prokázáno, že při rezistentním tréninku výdechového svalstva dochází také k posílení svalstva, které se podílí na orální [34,35] a faryngeální fázi [36] polykacího aktu. Takto lze efektivně ovlivnit dysfagii u pacientů již v akutní fázi CMP [37,38] a předcházet vzniku aspirační pneumonie [39].
Pacienti ve spastickém stadiu jsou ohroženi rozvojem fixních kontraktur. Proto je klíčový každodenní statický prolongovaný strečink v délce trvání 10–30 min na každou svalovou skupinu až do dosazení rozsahu plného pohybu [40]. Zařazení aerobně-rezistentního tréninku je vhodné s ohledem na progresi ztráty svalové hmoty v chronické fázi po iktu [41]. U pacientů se spastickou parézou může být energetický výdej několikanásobně vyšší a koreluje s rozsahem a tíží spasticity [42]. Fokální aplikace botulotoxinu může nejen oslabit hyperaktivitu spastických svalů, ale také snížit celkový energetický výdej, a proto je nutné podle účinku léčby a míry fyzické zátěže individuálně upravovat jídelníček [43,44].
Etické aspekty
Klinická výživa je z právního i medicínského hlediska považována za potraviny pro zvláštní lékařské účely a jako taková by měla být součástí integrální péče o pacienta. U CMP s nepříznivým průběhem, kdy hydratace a výživa již nemohou přispět ke zlepšení prognózy, je žádoucí řídit se klinickou zkušeností a principy paliativní medicíny a péče o nemocné v terminálních stadiích [19,45].
Grantová podpora
Podpořeno grantem Univerzity Karlovy z programu Progres Q27/1LF.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
doc. MUDr. Jiří Klempíř, Ph.D.
Neurologická klinika a Centrum klinických neurověd 1. LF UK a VFN v Praze
Kateřinská 30
120 00 Praha
e-mail jiri.klempir@vfn.cz
Přijato k recenzi: 15. 10. 2020
Přijato do tisku: 22. 10. 2020
Zdroje
1. Ntaios G, Bornstein NM, Caso V et al. The European Stroke Organisation Guidelines: a standard operating procedure. Int J Stroke 2015; 10 (Suppl A100): 128–135. doi: 10.1111/ijs.12583.
2. Burgos R, Breton I, Cereda E et al. ESPEN guideline clinical nutrition in neurology. Clin Nutr 2018; 37 (1): 354–396. doi: 10.1016/j.clnu.2017.09.003.
3. ESPEN guideline clinical nutrition in neurology. [online]. Available from URL: https: //www.espen.org/files/ESPEN-Guidelines/ESPEN-guideline_clinical_nutrition_in_neurology.pdf.
4. Doporučené postupy ESPEN pro klinickou výživu v neurologii. [online]. Dostupné z URL: http: //www.skvimp.cz/soubory/Doporucene-postupy-ESPEN-pro-klinickou-vyzivu-v-neurologii_Cevni-mozkova-prihoda_FINAL.pdf.
5. Česká neurologická společnost. [online]. Dostupné z URL: https: //www.czech-neuro.cz/.
6. Volkert D, Beck AM, Cederholm T et al. ESPEN guideline on clinical nutrition and hydration in geriatrics. Clin Nutr 2019; 38 (1): 10–47. doi: 10.1016/j.clnu.2018.05.024.
7. Gomes F, Schuetz P, Bounoure L et al. ESPEN guidelines on nutritional support for polymorbid internal medicine patients. Clin Nutr 2018; 37 (1): 336–353. doi: 10.1016/j.clnu.2017.06.025.
8. Singer P, Blaser AR, Berger MM et al. ESPEN guideline on clinical nutrition in the intensive care unit. Clin Nutr 2019; 38 (1): 48–79. doi: 10.1016/j.clnu.2018.08.037.
9. van Bokhorst-de van der Schueren MA, Guaitoli PR, Jansma EP et al. Nutrition screening tools: does one size fit all? A systematic review of screening tools for the hospital setting. Clin Nutr 2014; 33 (1): 39–58. doi: 10.1016/j.clnu.2013.04.008.
10. Mueller C, Compher C, Ellen DM. a. s.P.E.N. clinical guidelines: nutrition screening, assessment, and intervention in adults. JPEN J Parenter Enteral Nutr 2011; 35 (1): 16–24. doi: 10.1177/0148607110389335.
11. Cederholm T, Jensen GL, Correia M et al. GLIM criteria for the diagnosis of malnutrition – A consensus report from the global clinical nutrition community. Clin Nutr 2019; 38 (1): 1–9. doi: 10.1016/j.clnu.2018.08.002.
12. Prosser-Loose EJ, Paterson PG. The FOOD Trial Collaboration: nutritional supplementation strategies and acute stroke outcome. Nutr Rev 2006; 64 (6): 289–294. doi: 10.1111/j.1753-4887.2006.tb00212.x.
13. Bally MR, Blaser Yildirim PZ, Bounoure L et al. Nutritional support and outcomes in malnourished medical inpatients: a systematic review and meta-analysis. JAMA Intern Med 2016; 176 (1): 43–53. doi: 10.1001/jamainternmed.2015.6587.
14. Reintam Blaser A, Starkopf J, Alhazzani W et al. Early enteral nutrition in critically ill patients: ESICM clinical practice guidelines. Intensive Care Med 2017; 43 (3): 380–398. doi: 10.1007/s00134-016-4665-0.
15. Van Dyck L, Casaer MP, Gunst J. Autophagy and its implications against early full nutrition support in critical illness. Nutr Clin Pract 2018; 33 (3): 339–347. doi: 10.1002/ncp.10084.
16. Casaer MP, Langouche L, Coudyzer W et al. Impact of early parenteral nutrition on muscle and adipose tissue compartments during critical illness. Crit Care Med 2013; 41 (10): 2298–2309. doi: 10.1097/CCM.0b013e31828cef02.
17. Rosenthal MD, Carrott P, Moore FA. Autophagy: should it play a role in ICU management? Curr Opin Crit Care 2018; 24 (2): 112–117. doi: 10.1097/MCC.0000000000000486.
18. Niedert KC. Position of the American Dietetic Association: liberalization of the diet prescription improves quality of life for older adults in long-term care. J Am Diet Assoc 2005; 105 (12): 1955–1965. doi: 10.1016/j.jada.2005.10.004.
19. Druml C, Ballmer PE, Druml W et al. ESPEN guideline on ethical aspects of artificial nutrition and hydration. Clin Nutr 2016; 35 (3): 545–556. doi: 10.1016/j.clnu.2016.02.006.
20. Martino R, Foley N, Bhogal S et al. Dysphagia after stroke: incidence, diagnosis, and pulmonary complications. Stroke 2005; 36 (12): 2756–2763. doi: 10.1161/01.STR.0000190056.76543.eb.
21. Trapl M, Enderle P, Nowotny M et al. Dysphagia bedside screening for acute-stroke patients: the Gugging Swallowing Screen. Stroke 2007; 38 (11): 2948–2952. doi: 10.1161/STROKEAHA.107.483933.
22. Park JS, Oh DH, Hwang NK et al. Effects of neuromuscular electrical stimulation combined with effortful swallowing on post-stroke oropharyngeal dysphagia: a randomised controlled trial. J Oral Rehabil 2016; 43 (6): 426–434. doi: 10.1111/joor.12390.
23. Terre R, Mearin F. A randomized controlled study of neuromuscular electrical stimulation in oropharyngeal dysphagia secondary to acquired brain injury. Eur J Neurol 2015; 22 (4): 687-e44. doi: 10.1111/ene.12631.
24. Václavík D, Solná G, Lasotová N et al. Péče o pacienty s dysfagií po cévní mozkové příhodě: Standard léčebného plánu. Cesk Slov Neurol N 2015; 78/111 (6): 721–727. doi: 10.14735/amcsnn2015721.
25. Kroupa R, Kohout P, Cyrany J et al. Perkutánní endoskopická gastrostomie – doporučený postupČeské gastroenterologické společnosti ČLS JEP. Gastroent Hepatol 2019; 73 (3): 195–207. doi: 10.14735/amgh2019195.
26. Kelleher AR, Kimball SR, Dennis MD et al. The mTORC1 signaling repressors REDD1/2 are rapidly induced and activation of p70S6K1 by leucine is defective in skeletal muscle of an immobilized rat hindlimb. Am J Physiol Endocrinol Metab 2013; 304 (2): E229–E236. doi: 10.1152/ajpendo.00409.2012.
27. Klaer J, Mahler A, Scherbakov N et al. Longer-term impact of hemiparetic stroke on skeletal muscle metabolism – a pilot study. Int J Cardiol 2017; 230 : 241–247. doi: 10.1016/j.ijcard.2016.12.143.
28. Scherbakov N, Ebner N, Sandek A et al. Influence of essential amino acids on muscle mass and muscle strength in patients with cerebral stroke during early rehabilitation: protocol and rationale of a randomized clinical trial (AMINO-Stroke Study). BMC Neurol 2016; 16 : 10. doi: 10.1186/s12883-016-0531-5.
29. Jalal N, Gracies JM, Zidi M. Mechanical and microstructural changes of skeletal muscle following immobilization and/or stroke. Biomech Model Mechanobiol 2020; 19 (1): 61–80. doi: 10.1007/s10237-019-01196-4.
30. Kelleher AR, Pereira SL, Jefferson LS et al. REDD2 expression in rat skeletal muscle correlates with nutrient-induced activation of mTORC1: responses to aging, immobilization, and remobilization. Am J Physiol Endocrinol Metab 2015; 308 (2): E122–E129. doi: 10.1152/ajpendo.00341.2014.
31. Antoniak AE, Greig CA. The effect of combined resistance exercise training and vitamin D3 supplementation on musculoskeletal health and function in older adults: a systematic review and meta-analysis. BMJ Open 2017; 7 (7): e014619. doi: 10.1136/bmjopen-2016-014619.
32. Rondanelli M, Klersy C, Terracol G et al. Whey protein, amino acids, and vitamin D supplementation with physical activity increases fat-free mass and strength, functionality, and quality of life and decreases inflammation in sarcopenic elderly. Am J Clin Nutr 2016; 103 (3): 830–840. doi: 10.3945/ajcn.115.113357.
33. Hafer-Macko CE, Ryan AS, Ivey FM et al. Skeletal muscle changes after hemiparetic stroke and potential beneficial effects of exercise intervention strategies. J Rehabil Res Dev 2008; 45 (2): 261–272. doi: 10.1682/jrrd.2007.02.0040.
34. Yanagisawa Y, Matsuo Y, Shuntoh H et al. Change in tongue morphology in response to expiratory resistance loading investigated by magnetic resonance imaging. J Phys Ther Sci 2013; 25 (6): 667–669. doi: 10.1589/jpts.25.667.
35. Park JS, Oh DH, Chang MY. Effect of expiratory muscle strength training on swallowing-related muscle strength in community-dwelling elderly individuals: a randomized controlled trial. Gerodontology 2017; 34 (1): 121–128. doi: 10.1111/ger.12234.
36. Hutcheson KA, Hammer MJ, Rosen SP et al. Expiratory muscle strength training evaluated with simultaneous high-resolution manometry and electromyography. Laryngoscope 2017; 127 (4): 797–804. doi: 10.1002/lary.26397.
37. Park JS, Oh DH, Chang MY et al. Effects of expiratory muscle strength training on oropharyngeal dysphagia in subacute stroke patients: a randomised controlled trial. J Oral Rehabil 2016; 43 (5): 364–372. doi: 10.1111/joor.12382.
38. Moon JH, Jung JH, Won YS et al. Effects of expiratory muscle strength training on swallowing function in acute stroke patients with dysphagia. J Phys Ther Sci 2017; 29 (4): 609–612. doi: 10.1589/jpts.29.609.
39. Matz K, Seyfang L, Dachenhausen A et al. Post-stroke pneumonia at the stroke unit – a registry based analysis of contributing and protective factors. BMC Neurol 2016; 16 : 107. doi: 10.1186/s12883-016-0627-y.
40. Devier D, Harnar J, Lopez L et al. Rehabilitation plus onabotulinumtoxinA improves motor function over onabotulinumtoxinA alone in post-stroke upper limb spasticity: a single-blind, randomized trial. Toxins (Basel) 2017; 9 (7): 216. doi: 10.3390/toxins9070216.
41. Hunnicutt JL, Gregory CM. Skeletal muscle changes following stroke: a systematic review and comparison to healthy individuals. Top Stroke Rehabil 2017; 24 (6): 463–471. doi: 10.1080/10749357.2017.1292720.
42. Pradon D, Roche N, Enette L et al. Relationship between lower limb muscle strength and 6-minute walk test performance in stroke patients. J Rehabil Med 2013; 45 (1): 105–108. doi: 10.2340/16501977-1059.
43. Hemingway C, McGrogan J, Freeman JM. Energy requirements of spasticity. Dev Med Child Neurol 2001; 43 (4): 277–278. doi: 10.1017/s0012162201000524.
44. Roberts A, Stewart C, Cole G et al. Energy consumption in spasticity. Dev Med Child Neurol 2002; 44 (4): 284. doi: 10.1017/s0012162201222075.
45. Loser C, Aschl G, Hebuterne X et al. ESPEN guidelines on artificial enteral nutrition – percutaneous endoscopic gastrostomy (PEG). Clin Nutr 2005; 24 (5): 848–861. doi: 10.1016/j.clnu.2005.06.013.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článek Supraskapulární neuropatie
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2020 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Progresivní supranukleární obrna
- Mezinárodní klasifikace orofaciální bolesti (ICOP) – oficiální český překlad prvního vydání
- Supraskapulární neuropatie
- Endoskopické vs. skríninkové vyšetření polykání a jejich vliv na výsledný stav u pacientů po akutní cévní mozkové příhodě
- Hemodynamic changes in four aneurysms leading to their rupture at follow-up periods
- Srovnání měření průtokových parametrů v oblastikarotické stenózy in vivo a in vitro – pilotní výsledky testování hemodynamického fantomu
- Clinical characteristics of newly diagnosed Parkinson’s disease patients included in the longitudinal BIO-PD study
- Encefalopatie při infekci COVID-19 s odezvou na léčbu intravenózními imunoglobuliny
- Nemocný s pomalu progredující symptomatikou cervikokraniálního přechodu
- Syndrom neadekvátní sekrece antidiuretického hormonu jako první příznak estezioneuroblastomu
- Koincidence roztroušené sklerózy a myasthenia gravis
- Časná revaskularizace po kombinovaném výkonu u nemoci moyamoya
- Endoskopická laváž intraventrikulárního krvácení nezralých novorozenců
- Stanovisko České neurologické společnosti ČLS JEP k organizaci péče o pacienty s akutní bolestí zad v bederní úrovni u dospělých
- Doporučené postupy pro nutriční podporu u cévních mozkových příhod
- Odešel doc. MUDr. Roman Schröder, CSc.
- Zemřel doc. MUDr. Edgar Lukáš, DrSc. (1932–2020)
- MUDr. Michal Králik, CSc. Spomienka na vzácneho človeka.
- Prof. MUDr. Ľubomír Lisý, DrSc.
- Rozloučení s prof. MUDr. Valentinou Stýblovou, DrSc. (1922–2020)
- MUDr. Hanuš Baš, CSc., devadesátiletý
- Prof. MUDr. Peter Kukumberg, PhD. – 75-ročný
- Léčba aktivní sekundárně progresivní roztroušené sklerózy selektivním modulátorem receptoru pro sfingosin-1-fosfát
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Progresivní supranukleární obrna
- Supraskapulární neuropatie
- Endoskopické vs. skríninkové vyšetření polykání a jejich vliv na výsledný stav u pacientů po akutní cévní mozkové příhodě
- Encefalopatie při infekci COVID-19 s odezvou na léčbu intravenózními imunoglobuliny
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



