-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vztah sérové koncentrace D-serinu a psychopatologie u schizofrenie
D-serine Serum Levels in Schizophrenia: Relation to Psychopathology
The hypofunction of glutamatergic NMDA (N-methyl-D-aspartate) receptor is involved in pathophysiology of schizophrenia. Amino acid D-serine acts as endogenous co-agonist at the glycine modulatory site of the NMDA receptor. Significantly decreased D-serine serum levels were reported in patients with schizophrenia in comparison to healthy control subjects. Positive clinical effect of peripherally administered D-serine was demonstrated. D-serine improved positive and negative symptoms in patients with schizophrenia treated with first and second generation antipsychotics in the clinical studies. We did not find any significant association between D-serine serum level and the PANSS (The Positive and Negative Syndrome Scale) and the SANS (The Scale for the Assessment of Negative Symptoms) total and subscales scores in the population of fifty patients with schizophrenia enrolled into the study. D-serine serum level had a strong trend to be lower among female as compared to male patients with schizophrenia. In the context of this finding, the role of gender in the glutamatergic dysfunction associated with schizophrenia deserves further attention.
Key words:
D-serine, NMDA receptor, schizophrenia, excitatory amino acids, glutamatergic neurotransmission.
Autori: J. Hons 1; R. Žirko 1; M. Ulrychová 2; Eva Čermáková 3
; J. Libiger 1
Pôsobisko autorov: Psychiatrická klinika, LF UK a FN, Hradec Králové ; přednosta prof. MUDr. J. Libiger, CSc. Ústav klinické biochemie a diagnostiky, FN, Hradec Králové 1; přednosta prof. MUDr. V. Palička, CSc. Ústav lékařské biofyziky LF UK, Hradec Králové 2; přednosta doc. Ing. J. Hanuš, CSc. 3
Vyšlo v časopise: Čes. a slov. Psychiat., 104, 2008, No. 6, pp. 281-288.
Kategória: Původní práce
Súhrn
Hypofunkce glutamátergního NMDA (N-methyl-D-aspartát) receptoru se podílí na patofyziologii schizofrenního onemocnění. Aminokyselina D-serin účinkuje jako endogenní koagonista na glycinovém modulačním místě NMDA receptoru. U nemocných schizofrenií byly ve srovnání se zdravými kontrolními subjekty prokázány snížené koncentrace D-serinu v krevním séru. D-serin v klinických studiích zlepšoval u nemocných schizofrenií v augmentaci léčby antipsychotiky 1. a 2. generace pozitivní a negativní příznaky. V populaci 50 nemocných schizofrenií zařazených do klinické studie jsme neprokázali vztah mezi sérovou koncentrací D-serinu a celkovými skóry a skóry subškál PANSS (The Positive and Negative Syndrome Scale) a SANS (The Scale for the Assessment of Negative Symptoms). U nemocných žen jsme ve srovnání s muži zaznamenali nevýznamně nižší sérové koncentrace D-serinu. Pohlavní rozdíly v glutamátergní dysfunkci spojené se schizofrenií si v souvislosti s tímto nálezem zaslouží další pozornost.
Klíčová slova:
D-serin, NMDA receptor, schizofrenie, excitační aminokyseliny, glutamátergní neurotransmise.ÚVOD
Na patofyziologii schizofrenie se podílí dysfunkce glutamátergní neurotransmise v prefrontální kůře a limbickém systému [25]. Na souvislost glutamátergní dysfunkce se sníženou aktivitou NMDA (N-methyl-D-aspartát) receptorů u schizofrenie poukazují účinky kompetitivních antagonistů NMDA receptoru fencyklidinu a ketaminu, které u zdravých lidí způsobují rozvoj příznaků podobných schizofrenii, včetně negativních příznaků a kognitivního deficitu [13, 17]. Pro hypofunkci NMDA receptorů u schizofrenie svědčí i výsledky adjuvantní léčby jejich agonisty D-cykloserinem [4, 5, 10], glycinem [11, 14, 15] a D-serinem [12, 28].
D-serin svým koagonistickým účinkem na glycinovém modulačním místě NMDA receptoru za fyziologických podmínek moduluje glutamátergní neurotransmisi [26]. NMDA receptor je asociovaný s napěťově řízeným iontovým kanálem, jehož propustnost pro ionty závisí na vazbě ligandů na receptor. K aktivaci NMDA receptoru, otevření iontového kanálu pro sodíkové a vápníkové ionty a následné depolarizaci postsynaptického neuronu vede vazba D-serinu nebo glycinu na glycinové místo současně s vazbou glutamátu na primární vazebné místo NMDA receptoru. Ve srovnání s glycinem je vazebná potence D-serinu pro aktivaci všech podjednotek NMDA receptoru třikrát vyšší [21] a byla prokázána také až stokrát vyšší funkční účinnost D-serinu v potenciaci NMDA receptorem zprostředkované spontánní synaptické aktivity [33]. D-serin je pravděpodobně efektivnější při aktivaci kanálu spojeného s NMDA receptorem v souvislosti s rozdílným metabolismem a mechanismy transportu. Transportní systémy D-serinu jsou nízkoafinitní [25] a v porovnání s glycinem a dalšími typickými neurotransmitéry tak může D-serin zůstávat v extracelulárním prostoru v oblasti synapse delší dobu. Synaptickou koncentraci D-serinu se zatím nepodařilo stanovit [33], ale je zřejmé, že koncentrace D-serinu na synapsi je ovlivněna hlavně jeho syntézou a difuzí [25].
D-serin je v CNS syntetizován výlučně v cytosolové matrix astrocytů šedé mozkové hmoty [23, 24, 32] sekvenční konverzí z L-serinu za účasti enzymu D-serinracemázy [25, 32]. Přítomnost vyšší koncentrace D-serinu koreluje velmi úzce s distribucí NMDA receptorů v prefrontální, parietální a temporální kůře, hipokampu a striatu [6]. D-serin je metabolizován enzymem D-aminooxidázou (D-amino acid oxidase, DAAO). DAAO je peroxisomální flavoprotein, který selektivně katalyzuje oxidativní deaminaci neutrálních D-aminokyselin [23]. Přestože metabolizuje více než 90 % celkového D-serinu bez vlivu na koncentrace jiných aminokyselin, selektivně snižuje odpověď NMDA receptoru jen o 50-70 % [33].
Bendiková prokázala u nemocných schizofrenií 25% snížení koncentrace D-serinu v mozkomíšním moku a snížení poměru D-serin/L-serin [3]. Nízká koncentrace D-serinu v mozkomíšním moku u nemocných schizofrenií by mohla přímo souviset s nálezy snížené koncentrace proteinu serinracemázy ve frontální kůře a hipokampu a zvýšené koncentrace proteinu DAAO v hipokampu [3]. U nemocných schizofrenií byla prokázána také významně nižší koncentrace D-serinu v krevním séru [7, 34]. K úvahám o snížené aktivitě serinracemázy u schizofrenie vedl nález vyšší koncentrace L-serinu a celkového serinu a nižšího procentuálního zastoupení D-serinu v celkovém serinu u nemocných schizofrenií [7]. Nižší procentuální zastoupení D-serinu v celkovém serinu bylo prokázáno také v mozkomíšním moku u neléčených pacientů s první epizodou schizofrenie [9].
V adjuvantní léčbě D-serin u nemocných schizofrenií léčených antipsychotiky 2. generace zlepšoval negativní, pozitivní, kognitivní [12, 28] a depresivní příznaky [12]. Výraznější zlepšení negativních, pozitivních a kognitivních příznaků bylo spojeno se zvýšením sérové koncentrace D-serinu [28]. Klinické účinky D-serinu shrnují výsledky metaanalýzy 18 krátkodobých studií, která neprokázala jeho účinek na pozitivní příznaky a kognitivní deficit. D-serin u nemocných schizofrenií jen mírně a statisticky nevýznamně zlepšoval negativní příznaky [30].
Nálezy odlišné sérové koncentrace a specifických klinických účinků D-serinu nás vedou k předpokladu možnosti klinické a laboratorní diferenciace schizofrenních psychóz. Cílem naší studie je popis vztahu sérových koncentrací D-serinu a intenzity negativních a pozitivních příznaků hodnocených posuzovacími stupnicemi psychopatologie PANSS a SANS. Na základě výsledků výše zmíněných klinických studií jsme formulovali hypotézu negativní asociace intenzity negativních příznaků s koncentrací D-serinu v krevním séru u nemocných schizofrenií.
METODIKA
Subjekty klinické studie
Do klinické studie byli zařazeni nemocní schizofrenií starší 18 let ambulantně léčení na Psychiatrické klinice FN v Hradci Králové. U nemocných byla diagnostikována schizofrenie dle kritérií 10. revize MKN. Nejčastěji byl diagnostikován paranoidní typ schizofrenie (n=35), dále reziduální (n=7), nediferencovaný (n=5), hebefrenní (n=2) a simplexní typ (n=1). Nemocní během účasti ve studii pokračovali v léčbě indikované v rámci ambulantní péče, včetně užívání nasazených psychofarmak. 49 nemocných bylo léčeno antipsychotiky. Jedna nemocná neužívala žádná psychofarmaka, délka trvání její nemoci byla 2 roky a v době své účasti ve studii byla v klinicky stabilním stavu. Čtyři nemocní byli léčeni monoterapií antipsychotikem 1. generace, 36 nemocných užívalo v monoterapii antipsychotikum 2. generace. 5 nemocných bylo léčeno kombinací antipsychotika 1. a 2. generace, 4 nemocní kombinací dvou antipsychotik 2. generace. Charakteristiky souboru nemocných jsou shrnuty v tabulce 1. Do studie nebyli zařazeni nemocní, kteří byli v posledních 5 měsících léčeni elektrokonvulzemi, těhotné nemocné a nemocní s pozitivním nálezem v toxikologickém vyšetření moči nebo přítomností abúzu psychoaktivních látek v posledních 6 měsících. Demografické a anamnestické údaje byly získány od nemocných nebo z jejich lékařské dokumentace. Do studie nebyli zařazeni nemocní, u kterých bylo podle anamnestických údajů, podle výsledků somatického vyšetření nebo výsledků laboratorních vyšetření prokázáno neurologické nebo kardiovaskulární onemocnění nebo poruchy ledvinných funkcí.
Stanovení sérové koncentrace D-serinu
Nemocným byl ráno mezi 8.00 a 9.30 hod. po 12hodinovém lačnění proveden odběr žilní krve (cca 20 ml) k laboratornímu stanovení koncentrace D-serinu v krevním séru metodou kapalinové chromatografie (high-performance liquid chromatography, HPLC). Pro přípravu mobilní fáze byl použit metanol, kyselina octová (Penta, ČR), octan sodný bezvodý (Sigma-Aldrich, Německo) a NaOH (Kulich, ČR). Derivatizační činidla byla připravena z N-acetyl-L-cysteinu (NAC), 3-merkaptopropionové kyseliny (MPA), o-ftaldialdehydu (OPA) (Sigma-Aldrich, Německo), kyseliny borité a metanolu (Penta, ČR). Po deproteinaci metodou ultrafiltrace pomocí kolonek Microcon – 10 kDa, 0,5 ml (Millipore, USA) byly vzorky uchovávány při teplotě -20 °C. Chromatografická analýza byla realizována na systému HPLC typ LC-10A vp (Shimadzu, Japonsko). Chromatografická separace byla provedena v režimu gradientové eluce v systému reverzní fáze. Pro stanovení D-serinu bylo jako mobilní fáze použito 0,21 μmol/l octanového pufru o hodnotě pH 5,6 (A) a metanol (B) [36]. Separace byla prováděna na dvou sériově zapojených kolonách 250x4 mm Lichrospher RP-18e o velikosti částic náplně 5 μm (Merck, Německo). Signál byl detekován pomocí fluorescenčního detektoru (emisní vlnová délka 454 nm a excitační vlnová délka 337 nm) [19, 31, 36]. Reprodukovatelnost byla 4,54%, bias 1,58%, limit detekce byl stanoven na 0,27 μmol/l .
Vyšetření psychopatologie
Nemocní byli psychiatricky vyšetřeni do 4 hodin po odběru krevního vzorku na stanovení sérové koncentrace D-serinu. Psychopatologie byla hodnocena pomocí posuzovacích stupnic PANSS (The Positive and Negative Syndrome Scale; 30 položek, skór 1-7) [16] a SANS (The Scale for the Assessment of Negative Symptoms; 30 položek, skór 0-5) [1]. Vyšetření klinického stavu nemocných a hodnocení psychopatologie bylo provedeno jedním specializovaným psychiatrem se zkušeností s aplikací hodnotících škál.
Statistické hodnocení
Pro jednotlivé soubory dat a skórů byl stanoven průměr, směrodatná odchylka, medián a rozpětí hodnot. Vzhledem k nenormálnímu rozložení dat byly ke stanovení asociací jednotlivých proměnných použity neparametrické Spearmanovy korelační koeficienty. Ke stanovení rozdílů hodnot proměnných mezi oběma pohlavími byl použit t-test a v případě nenormálního rozložení dat neparametrický Mann-Whitney U test. Zvolená hladina významnosti byla α = 0,05. Asociace hodnot sérových koncentrací D-serinu s hodnotami skórů posuzovacích stupnic psychopatologie u obou pohlaví jsou prezentovány pomocí bodových grafů (scatter plot) s regresními přímkami (obr. 1, obr. 2).
Obr. 1. Vztah sérové koncentrace D-serinu a celkového skóru PANSS – pohlavní rozdíly (bodový graf s regresivními přímkami; p, hladina významnosti. 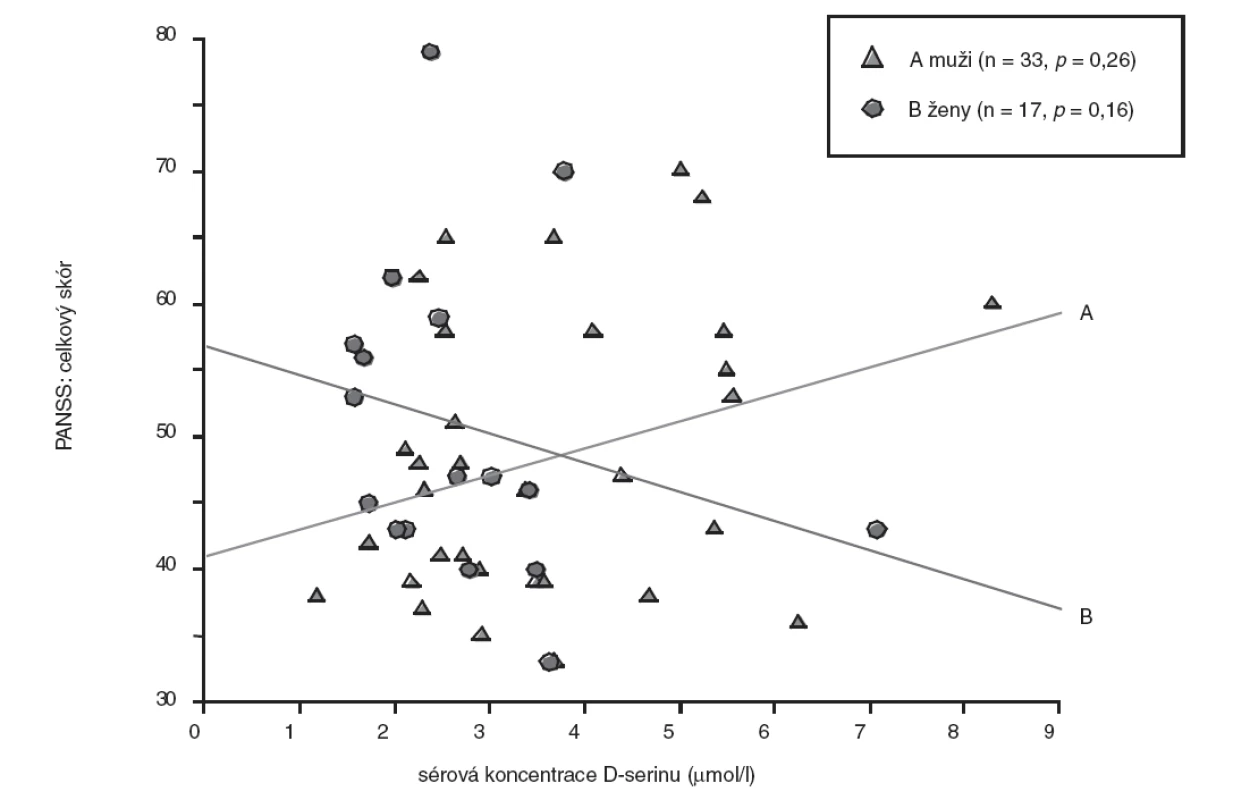
Obr. 2. Vztah sérové koncentrace D-serinu a celkového skóru SANS - pohlavní rozdíly (bodový graf s regresními přímkami; p, hladina významnosti). 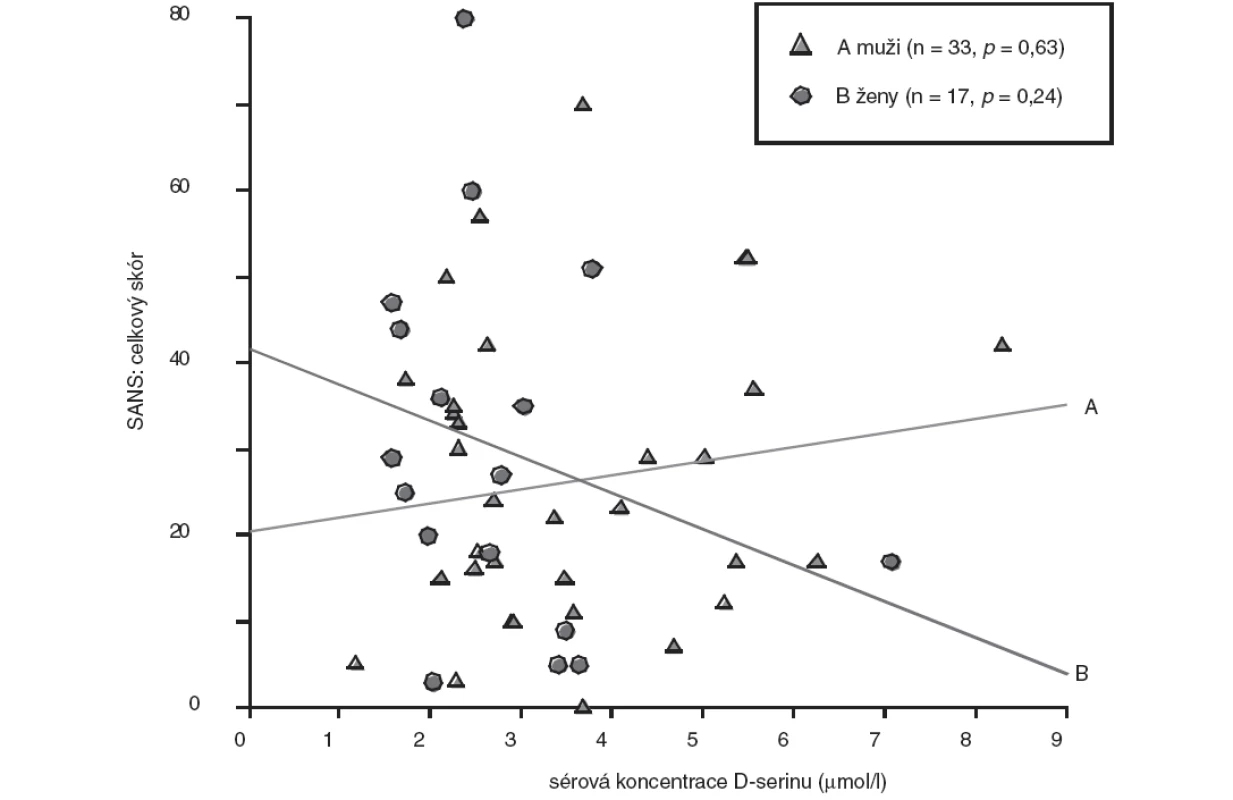
Etické aspekty
Nemocní byli seznámeni na úrovni odpovídající jejich vzdělání a rozumové úrovni s obsahem a záměrem výzkumu a podepsali informovaný souhlas se vstupem do klinické studie. Informovaný souhlas a protokol studie byly schváleny Etickou komisí Fakultní nemocnice Hradec Králové, Lékařské fakulty v Hradci Králové a Vojenské lékařské akademie JEP v Hradci Králové.
VÝSLEDKY
Do klinické studie bylo zařazeno 50 nemocných trpících schizofrenií (průměr ± SD věk, 35,1 ± 11,1 roků; 33 mužů a 17 žen) (tab. 1). Metodou HPLC jsme u nemocných stanovili koncentrace D-serinu v krevním séru (průměr ± SD, 3,30 ± 1,53 μmol/l). Výsledky klinického hodnocení, včetně hodnocení psychopatologie pomocí posuzovacích stupnic PANSS a SANS u nemocných schizofrenií, jsou shrnuty v tabulce 2.
Tab. 1. Deskriptivní charakteristiky souboru nemocných schizofrenií (n = 50). 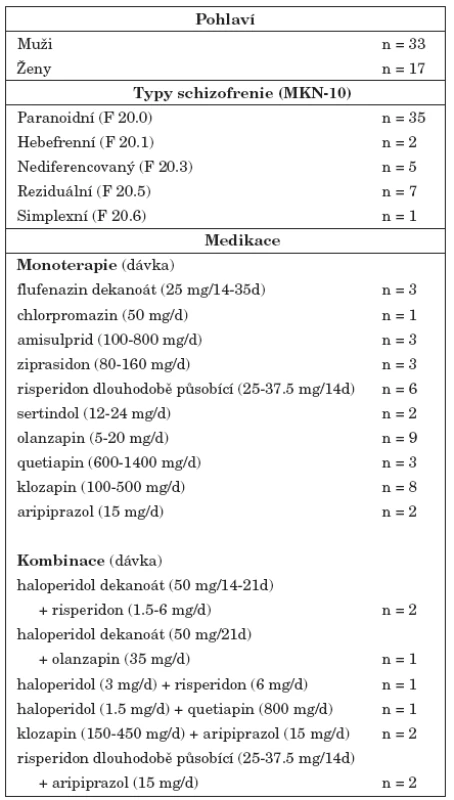
Tab. 2. Výsledky souboru nemocných schizofrenií (r, korelace proměnné s hodnotou sérové koncentrace D-serinu: Spearmanův korelační koeficient; p, hladina významnosti; PANSS, The Positive and Negative Syndrome Scale; SANS, The Scale for the Assessment of Negative Symptoms; Min-Max, Minimum-Maximum; N.A., not applicable). 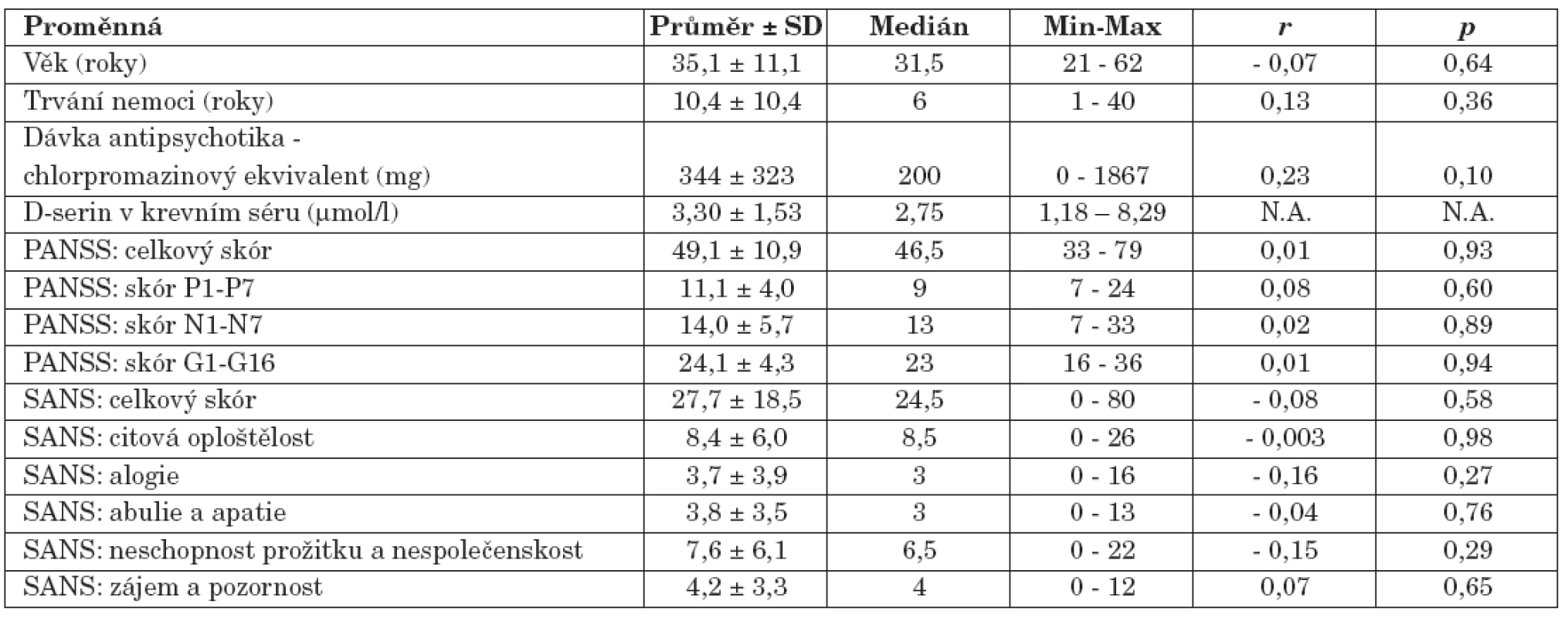
Hodnota sérové koncentrace D-serinu (medián, 2,75 μmol/l) nesouvisela s věkem nemocných (medián, 31,5 roků) (r = - 0,07, p = 0,64, Spearmanův korelační koeficient), dobou trvání jejich nemoci (medián, 6 roků) (r = 0,13, p = 0,36) ani s dávkou užívaných antipsychotik vyjádřenou chlorpromazinovým ekvivalentem (medián, 200 mg) (r = 0,23, p = 0,10).
U nemocných jsme neprokázali vztah mezi hodnotou koncentrace D-serinu v séru a hodnotami celkového skóru PANSS (r = 0,01, p = 0,93), skóru subškály pozitivních příznaků PANSS (P1-P7) (r = 0,08, p = 0,60), skóru subškály negativních příznaků PANSS (N1-N7) (r = 0,02, p = 0,89) a skóru subškály všeobecné psychopatologie PANSS (G1-G16) (r = 0,01, p = 0,94). S koncentrací D-serinu v séru neasociovala intenzita negativní symptomatiky hodnocená celkovým skórem škály SANS (r = - 0,08, p = 0,58), neprokázali jsme ani souvislost s hodnotami skórů subškál citové oploštělosti (r = - 0,003, p = 0,98), alogie (r = - 0,16, p = 0,27), abulie a apatie (r = - 0,04, p = 0,76), neschopnosti prožitku a nespolečenskosti (r = - 0,15, p = 0,29) a skóru subškály zájmu a pozornosti (r = 0,07, p= 0,65).
U skupiny nemocných žen jsme prokázali statisticky nevýznamně (p>0,05, Mann-Whitney U test) nižší koncentrace D-serinu (medián, 2,46 μmol/l) ve srovnání se skupinou mužů (medián, 2,91 μmol/l). Rozdíly hodnot mezi skupinami nemocných mužů a žen jsou shrnuty v tabulce 3. U nemocných mužů jsme zaznamenali jen nevýznamnou lineární souvislost mezi hodnotou sérové koncentrace D-serinu a hodnotou celkového skóru PANSS (r = 0,20, p = 0,26) (obr. 1), u žen nevýznamnou inverzní korelaci hodnoty koncentrace D-serinu v séru s hodnotou celkového skóru PANSS (r = -0,35, p = 0,16) (obr. 1) a celkového skóru SANS (r = -0,30, p = 0,24) (obr. 2). Hodnoty sérových koncentrací D-serinu u skupiny mužů a skupiny žen nekorelovaly s hodnotami skórů subškál stupnic PANSS a SANS.
Tab. 3. Výsledky souboru nemocných schizofrenií: pohlavní rozdíly (1Mann-Whitney U test; 2 t-test; p, hladina významnosti; PANSS, The Positive and Negative Syndrome Scale; SANS, The Scale for the Assessment of Negative Symptoms). 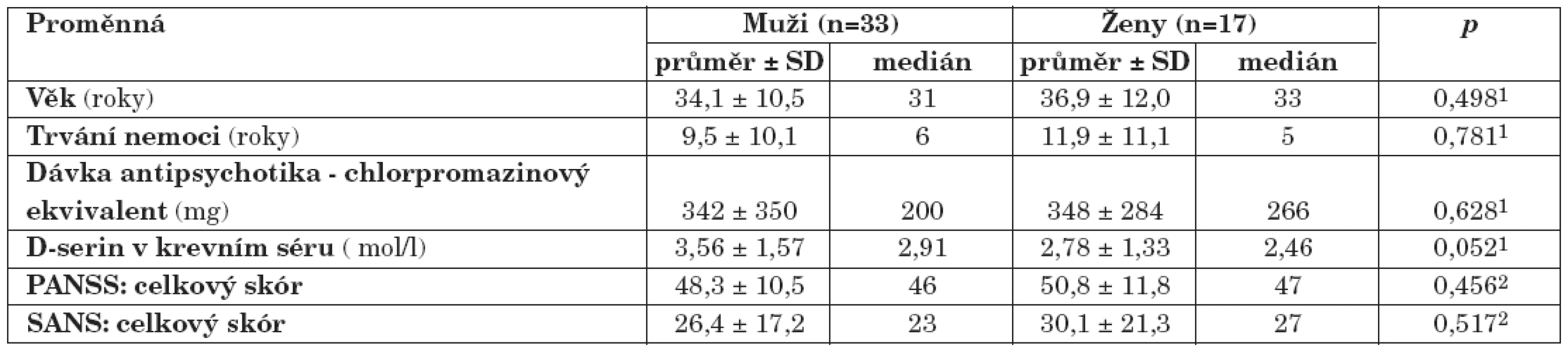
DISKUSE
V klinické studii se nám u souboru 50 nemocných schizofrenií nepodařilo prokázat vztah mezi sérovou koncentrací D-serinu a intenzitou negativních příznaků. Sérová koncentrace D-serinu neasociovala ani s intenzitou pozitivních příznaků. V hodnotách sérových koncentrací D-serinu jsme zaznamenali určité pohlavní rozdíly. U nemocných žen, které měly ve srovnání s muži nevýznamně nižší sérovou koncentraci D-serinu, jsme zjistili negativní asociaci hodnoty sérové koncentrace D-serinu s intenzitou psychopatologie hodnocené celkovým skórem škály PANSS a intenzitou negativních příznaků hodnocených celkovým skórem SANS. Asociace těchto proměnných byly ale jen mírné a statisticky nevýznamné, stejně tak jako vztah sérové koncentrace D-serinu a intenzity psychopatologie hodnocené celkovým skórem škály PANSS u mužů (obr. 1, obr. 2). Rozdíly sérových koncentrací D-serinu ve vztahu k pohlaví nebyly zatím v klinických studiích u nemocných schizofrenií testovány. Tomiya prokázal u mužů nemocných schizofrenií významně zvýšené sérové koncentrace celkového serinu [27]. Koncentrace D-serinu nebyly u nemocných v této studii stanovovány. Rozdíly sérových koncentrací aminokyselin u mužů a žen nemocných schizofrenií mohou být způsobeny pohlavními odlišnostmi hormonálních profilů. Pohlavní rozdíly v dysfunkci glutamátergní neurotransmise spojené se schizofrenií jsou tak zajímavým tématem pro další výzkum.
Hypotézu negativní asociace hodnoty sérové koncentrace D-serinu a intenzity negativní symptomatiky jsme formulovali na základě nálezů snížených koncentrací D-serinu v krevním séru [7, 34] a v mozkomíšním moku [3, 9] u nemocných schizofrenií a klinického účinku adjuvantní léčby D-serinem na negativní příznaky [30]. Tuto hypotézu jsme nepotvrdili a je otázkou, zdali je sérová koncentrace D-serinu vhodným biochemickým markerem funkční úrovně glutamátergního systému v CNS. V CNS je endogenní D-serin syntetizován výlučně v astrocytech šedé mozkové hmoty [23, 24, 32], ale kromě CNS se ve velmi nízkých koncentracích vyskytuje i v krevním séru, slinách a moči. Syntéza D-serinu může u savců probíhat i v periferních tkáních [6]. Pravděpodobným zdrojem D-serinu jsou játra, protože jen hepatocyty jako další buňky vedle astrocytů exprimují významné koncentrace serinracemázy [25]. Některé periferní tkáně (např. magakaryocyty, osteoklasty) exprimují NR1 podjednotku NMDA receptoru, se kterou D-serin interaguje. Transport D-serinu v periferních tkáních probíhá prostřednictvím exchangerů nebo transportérů a z organismu se odstraňuje ledvinami [25]. Vztah mezi sérovou koncentrací D-serinu a dysfunkcí glutamátergní neurotransmise jako patogenetického faktoru schizofrenie předpokládá souvislost mezi poolem D-serinu v CNS a v periferních tkáních. Také klinický účinek adjuvantní léčby D-serinem na negativní a pozitivní příznaky u nemocných schizofrenií léčených antipsychotiky [12, 28, 30] závisí na průchodu periferně podaného D-serinu přes hematoencefalickou bariéru (HEB). Mechanismy transportu D-serinu přes HEB nebyly dosud zcela objasněny. Transport přes HEB je u neutrálních AMK limitován [6]. D-serin prochází HEB lépe než glycin [22, 28, 33] a ve větším množství proniká do CNS i ve srovnání s L-serinem. Hlavní transportní mechanismus D - a L-serinu v HEB je zajišťován na Na+ nezávislým transportním systémem [35], ale u D-serinu byl prokázán i preferenční stereoselektivní transport [2]. Souvislost mezi poolem D-serinu v periferii a CNS a možnost transportu přes HEB prokazují výsledky studií na hlodavcích. Po intraperitoneálním podání D-serinu dochází u krys ke změnám koncentrací D-serinu ve všech periferních tkáních a ve všech oblastech CNS [8]. Je tedy velmi pravděpodobné, že existuje vztah mezi koncentrací D-serinu v krevním séru a v CNS. Sérová koncentrace D-serinu by tak mohla být vhodným markerem funkční úrovně glutamátergní neurotransmise v CNS.
Zdrojem naší hypotézy byly důkazy pozitivního klinického účinku adjuvantní léčby D-serinem v některých klinických studiích [12, 28, 30]. Výsledky studií testujících účinky D-serinu ale nejsou jednotné [20, 29, 30] a jejich rozdíly mohou být způsobeny odlišnostmi v délce trvání jednotlivých studií, malými soubory nebo zařazováním nemocných s rezistentní schizofrenií. Přestože augmentace D-serinem vedla ke zvýšení jeho sérových koncentrací i u nemocných schizofrenií léčených klozapinem [29] a risperidonem [20], nedošlo u nich ke zlepšení schizofrenní symptomatiky. Neúčinnost D-serinu u nemocných léčených klozapinem může souviset s parciálně agonistickým nebo agonistickým účinkem klozapinu na NMDA receptorech.
Výsledky naší studie mohou být vzhledem k velmi nízké fyziologické koncentraci D-serinu v krevním séru ovlivněny senzitivitou metody jeho stanovení. Metoda stanovení D-serinu použitá v naší studii (HPLC) byla stejná a také velikost našeho souboru nemocných byla podobná ve srovnání s použitou metodou a velikostí souborů testovaných v klinických studiích, které byly zdrojem naší hypotézy [7, 34]. Negativní výsledky naší studie mohou tak být ovlivněny odlišnými charakteristikami populace nemocných, účinky antipsychotické medikace nebo dietními návyky. Do naší studie byli zařazeni nemocní v ambulantní péči, kteří byli léčeni převážně antipsychotiky 2. generace a z klinického hlediska byli ve stabilním stavu nevyžadujícím hospitalizaci. Hashimoto do své studie zařadil nemocné, jejichž stav vyžadoval hospitalizaci [7]. Rozdíly v sérových koncentracích D-serinu mezi skupinou antipsychotiky léčených a neléčených nemocných schizofrenií nezjistil a v souhlase s našimi výsledky také nenalezl souvislost sérové koncentrace D-serinu s dávkou antipsychotika vyjádřenou chlopromazinovým ekvivalentem [7]. Vliv farmakoterapie na naše výsledky ale přesto nelze vyloučit. Koncentrace aminokyselin v krevním séru by mohla být ovlivněna jejich příjmem v potravě. Stejně tak jako v klinických studiích, ve kterých odběru nalačno žádná dietní opatření nepředcházela [7, 34], jsme v naší studii vzorek krve odebírali ráno po nočním 12hodinovém lačnění. Průměrné sérové koncentrace D-serinu se u nemocných v naší studii pohybovaly v mezích laboratorních referenčních hodnot a byly ve srovnání s hodnotami zjištěnými stejnou metodou (HPLC) bez předchozí speciální diety a v podobně velkém souboru nemocných [7] nižší.
Objasnění rozdílů v nálezech sérových koncentrací D-serinu má u nemocných schizofrenií velký praktický význam vzhledem k perspektivě léčby agonisty NMDA receptorů. Pro poznání role dysfunkce glutamátergního systému v patogenezi schizofrenie je důležité stanovení biochemických markerů funkční úrovně tohoto systému v CNS. Hledání vztahu sérových koncentrací excitačních aminokyselin ke specifickým psychopatologickým dimenzím umožní laboratorní a klinickou diferenciaci schizofrenních psychóz. Předpokládáme, že stanovení biochemických a klinických profilů povede k identifikaci specifických subtypů schizofrenie. Formulování takové typologie umožní cílenou léčbu na ovlivnění glutamátergní dysfunkce v CNS.
Klinická studie je realizována za finanční podpory výzkumného záměru MSM 0021620816.
MUDr. Jaromír Hons
Psychiatrická klinika LF UK a FN
Sokolská 581
500 05 Hradec Králové
e-mail: honsj@lfhk.cuni.cz
Zdroje
1. Andreasen, N. C.: The Scale for the Assessment of Negative Symptoms (SANS): conceptual and theoretical foundations. Br. J. Psychiat. Suppl., 7, 1989, pp. 49-58.
2. Bauer, D., Hamacher, K., Bröer, S., Pauleit, D., Palm, C., Zilles, K., Coenen, H. H., Langen, K. J.: Preferred stereoselective brain uptake of D-serine – a modulator of glutamatergic neurotransmission. Nucl. Med. Biol., 32, 2005, 8, pp. 793-797.
3. Bendikov, I., Nadri, C., Amar, S., Panizzutti, R., De Miranda, J., Wolosker, H., Agam, G.: A CSF and postmortem brain study of D-serine metabolic parameters in schizophrenia. Schizophr. Res., 90, 2007, 1-3, pp. 41-51.
4. Evins, A. E., Amico, E., Posever, T. A., Toker, R., Goff, D. C.: D-cycloserine added to risperidone in patients with primary negative symptoms of schizophrenia. Schizophr. Res., 56, 2002, 1-2, pp. 19-23.
5. Goff, D. C., Tsai, G., Manoach, D. S., Coyle, J. T.: A dose-finding trial of D-cycloserine added to neuroleptic for negative symptoms in schizophrenia. Am. J. Psychiat., 152, 1995, pp. 1213-1215.
6. Hashimoto, A., Oka, T.: Free D-aspatate and D-serine in the mammalian brain and periphery. Prog. in Neurobiol., 52, 1997, pp. 325-353.
7. Hashimoto, K., Fukushima, T., Shimizu, E., Komatsu, N., Watanabe, H., Shinoda, N., Nakazato, M., Kumakiri, C., Okada, S., Hasegawa, H., Imai, K., Iyo, M.: Decreased serum levels of D-serine in patients with schizophrenia: evidence in support of the N-methyl-D-aspartate receptor hypofunction hypothesis of schizophrenia. Arch. Gen. Psychiat., 60, 2003, 6, pp. 572-576.
8. Hashimoto, A., Chiba, Y.: Effect of systemic administration of D-serine on the levels of D - and L-serine in several brain areas and periphery of rat. Eur. J. Pharmacol., 495, 2004, 2-3, pp. 153-158.
9. Hashimoto, K., Engberg, G., Shimizu, E., Nordin, C., Lindstrom, L. H., Iyo, M.: Reduced D-serine to total serine ratio in the cerebrospinal fluid of drug naive schizophrenic patients. Prog. Neuropsychopharmacol. Biol. Psychiat., 29m 2005, 5, pp. 767-769.
10. Heresco-Levy, U., Ermilov, M., Shimoni, J., Shapira, B., Silipo, G., Javitt, D. C.: Placebo-controlled trial of D-cycloserin added to conventional neuroleptics, olanzapine, or risperidone in schizophrenia. Am. J. Psychiat., 159, 2002, 3, pp. 480-482.
11. Heresco-Levy, U., Javitt, D. C.: Comparative effects of glycine and D-cycloserine on persistent negative symptoms in schizophenia: a retrospective analysis. Schizophr. Res., 66, 2004, 2-3, pp. 89-96.
12. Heresco-Levy, U., Javitt, D. C., Ebstein, R., Vass, A., Lichtenberg, P., Bar, G., Catinari, S., Ermilov, M.: D-serine efficacy as add-on pharmacotherapy to risperidone and olanzapine for treatment-refractory schizophrenia. Biol. Psychiat., 57, 2005, 6, pp. 577-585.
13. Javitt, D. C., Zukin, S. R.: Recent advances in the phencyclidine model of schizophrenia. Am. J. Psychiat,. 148, 1991, pp. 1301-1308.
14. Javitt, D. C., Zylberman, I., Zukin, S. R., Heresco-Levy, U., Lindenmayer, J. P.: Amelioration of negative symptoms in schizophrenia by glycine. Am. J. Psychiat., 151, 1994, pp. 1234-1236.
15. Javitt, D. C., Silipo, G., Cienfuegos, A., Shelley, A. M., Bark, N., Park, M., Lindenmayer, J. P., Suckow, R., Zukin, S. R.: Adjunctive high-dose glycine in the treatment of schizophrenia. Int. J. Neuropsychopharmacol., 4, 2001, 4, pp. 385-391.
16. Kay, S. R., Fiszbein, A., Opler, L. A.: The positive and negative syndrome scale (PANSS) for schizophrenia. Schizophr. Bull., 13, 1987, 2, pp. 261-276.
17. Krystal, J. H., Karper, L. P., Seibyl, J. P., Freeman, G. K., Delaney, R., Bremner, J. D., Heninger, G. R., Bowers, M. B., Charney, D. S.: Subanesthetic effects of the noncompetitive NMDA antagonist, ketamine, in humans. Psychotomimetic, perceptual, cognitive, and neuroendocrine responses. Arch. Gen. Psychiat., 51, 1994, pp. 199-214.
18. Krystal, J. H., Pery, E. B., Gueorguieva, R., Belger, A., Madonick, S. H., Abi-Dargham, A., Cooper, T. B., MacDougall, L., Abi-Saab, W., D´Souza, D. C.: Comparative and interactive human psychopharmacologic effects of ketamine and amphetamine: implications for glutamatergic and dopaminergic model psychoses and cognitive function. Arch. Gen. Psychiat., 62, 2005, pp. 985-995.
19. Kutlan, D., Presits, P., Molnar-Perl, I.: Behavior and characteristics of amine derivatives obtained with o-phthaldialdehyde/3-mercaptopropionic acid and with o-phthaldialdehyde/N-acetyl-cysteine reagents. J. Chromatogr. A., 949, 2002, pp. 235-248.
20. Lane, H., Chang, Y., Liu, Y., Chiu, Ch., Tsai, G.: Sarcosine or D-serine add-on treatment for acute exacerbation of schizophrenia. Arch. Gen. Psychiat., 62, 2005, pp. 1196-1204.
21. Matsui, T., Sekiguchi, M., Hashimoto, A., Tomita, U., Nishikawa, T., Wada, K.: Functional comparison of D-serine and glycine in rodents: the effect on cloned NMDA receptors and the extracellular concentration J. Neurochem., 65, 1995, pp. 454-458.
22. Oldendorph, W. M.: Brain uptake of radio labeled amino acids, amines and hexoses after arterial injection. Am. J. Physiol., 221, 1971, pp. 1629-1639.
23. Schell, M. J., Molliver, M. E., Snyder, S. H.: D-serine, an endogenous synaptic modulator: localization to astrocytes and glutamate-stimulated release. Proc. Natl. Acad. Sci. USA., 92, 1995, 9, pp. 3948-3952.
24. Schell, M. J., Brady, R. O., Molliver, M. E., Snyder, S. H.: D-serine as a neuromodulator: regional and developmental localizations in rat brain glia resemble NMDA receptors. J. Neurosci., 17, 1997, pp. 1604-1615.
25. Schell, M. J.: The N-methyl-D-aspartate receptor glycine site and D-serine metabolism: an evolutionary perspective. Phil. Trans. R. Soc. Lond. B., 359, 2004, pp. 943-964.
26. Scolari, M. J., Acosta, G. B.: D-serine: a new word in the glutamatergic neuro-glial language. Amino Acids., 33, 2007, pp. 563-574.
27. Tomiya, M., Fukushima, T., Watanabe, H., Fukami, G., Fujisaki, M., Iyo, M., Hashimoto, K., Mitsuhashi, S., Toyo´oka, T.: Alterations in serum amino acid concentrations in male and female schizophrenic patients. Clin. Chim. Act., 380, 2007, pp. 186-190.
28. Tsai, G., Yang, P., Chung, L., Lange, N., Coyle, J. T.: D-serine added to antipsychotics for treatment of schizophrenia. Biol. Psychiat., 44, 1998, 11, pp. 1081-1089.
29. Tsai, G., Yang, P., Chung, L., Tsai, I., Tsai, Ch., Coyle, J. T.: D-serine added to clozapine for the treatment of schizophrenia. Am. J. Psychiat., 156, 1999, pp. 1822-1825.
30. Tuominen, H. J., Tiihonen, J., Wahlbeck, K.: Glutamatergic drugs for schizophrenia: a systematic review and meta-analysis. Schizophr. Res., 72, 2005, pp. 225-234.
31. Vasanits, A., Kutlan, D., Sass, P., Molnar-Perl, I.: Retention/quantification properties of the o-phthaldialdehyde-3-mercaptopropionic acid and the o-phthaldialdehyde-N-acetyl-L-cysteine amino acid derivatives in reversed-phase high-performance liquid chromatography. J. Chromatogr. A., 870, 2000, pp. 271-287.
32. Wolosker, H., Blackshaw, S., Snyder, S. H.: Serine racemase: a glial enzyme synthesizing D-serine to regulate glutamate-N-methyl-D-aspartate neurotransmission. Proc. Natl. Acad. Sci.. 96, 1999, pp. 13409-13414.
33. Wolosker, H., Panizzutti, R., De Miranda, J.: Neurobiology through the looking-glass: D-serine s a new glial-derived transmitter. Neurochem. Internat., 41, 2002, 5, pp. 327-332.
34. Yamada, K., Ohnishi, T., Hashimoto, K., Ohba, H., Iwayama-Shigeno, Y., Toyoshima, M., Okuno, A., Takao, H., Toyota, T., Minabe, Y., Nakamura, K., Shimizu, E., Itokawa, M., Mori, N., Iyo, M., Yoshikawa, T.: Identification of multiple serine racemase (SRR) mRNA isoforms and genetic analyses of SRR and DAO in schizophrenia and D-serine levels. Biol. Psychiat., 57, 2005, pp. 1493-1503.
35. Yamamoto, N., Tomita, U., Umino, A., Nishikawa, T.: Uptake of D-serine by synaptosomal P2 fraction isolated from rat brain. Synapse, 42, 2001, 2, pp. 84-86.
36. Zhao, M., Bada, J. L.: Determination of α-dialkylamino acids and their enantiomers in geological samples by high-performance liquid chromatography after derivatization with chiral adduct of o-phthaldialdehyde. J. Chromatogr. A., 690, 1995, pp. 55-63.
Štítky
Adiktológia Detská psychiatria Psychiatria
Článek Recenze knihyČlánek Referát z písemnictví
Článok vyšiel v časopiseČeská a slovenská psychiatrie
Najčítanejšie tento týždeň
2008 Číslo 6- Naděje budí časná diagnostika Parkinsonovy choroby založená na pachu kůže
- Hluboká stimulace globus pallidus zlepšila klinické příznaky u pacientky s refrakterním parkinsonismem a genetickou mutací
-
Všetky články tohto čísla
- Co nám dal a vzal nový pojem deprese?
- Vztah sérové koncentrace D-serinu a psychopatologie u schizofrenie
- Disociace a kognitivní funkce u obsedantně-kompulzivní poruchy – průřezová studie
- Kanabinoidy a duševní poruchy
- Jak porozumět výsledkům klinických studií a přeložit je do klinické praxe s pomocí NNT
- Vliv duševních chorob na pracovní výkonnost
- Jean Jacques Rousseau a jeho „Vyznání“ (1. část)
- Z jednání výboru Psychiatrické společnosti 3. září 2008
- Z jednání výboru Psychiatrické společnosti 1. října 2008
- Recenze knihy
- Referát z písemnictví
- Česká a slovenská psychiatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Kanabinoidy a duševní poruchy
- Disociace a kognitivní funkce u obsedantně-kompulzivní poruchy – průřezová studie
- Jak porozumět výsledkům klinických studií a přeložit je do klinické praxe s pomocí NNT
- Vliv duševních chorob na pracovní výkonnost
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



