-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Biofyzikální mechanismy určující biokompatibilitu dentálních implantátů a podmiňující jejich oseointegraci
Biophysical Mechanism Determining Dental Implants Biocompatibility and Conditioning their Osseointegration
Adsorption of biopolymers at the titanium and titanium carbide surface increases the optical roughness as well as the thickness and refractive index of the surface layer. Fibrinogen is better adsorbed at the titanium surface which is treated by polishing and etching than at the surface treated only by polishing. The best adsorption of fibrinogen was observed at the titanium carbide surface prepared by plasma-enhanced chemical vapour deposition, the optimal ratio was Ti0,38 - C0,62 a Ti0,09 - C0,91. The surface of dental implants treated by this way should speed up their osseointegration and healing. The single stranded pyrimidine oligodeoxynucleotides (TTC)12 are better adsorbed at the titanium surface than the purine oligodeoxynucleotides (AAG)12. The double-helical duplex (TTC)12. (AAG)12 has no effect on the optical properties of the titanium surface and probably is not adsorbed there.
Key words:
titanium implants - fibrinogen adsorption - oligodeoxynucleotide adsorption - diffractive optical element - ellipsometry
Autoři: S. Bartáková 1; P. Prachár 1; S. Hasoň 1,2; R. Silvennoinen 3; L. Cvrček 4; L. Strašák 1,2; L. Fojt 1,2; A. Avranas 5; V. Vetterl 1,2
Působiště autorů: Stomatologické výzkumné centrum LF MU, Brno 1; Biofyzikální ústav AV ČR, v. v. i., Brno 2; University of Joensuu, Department of Physics and Mathematics, Joensuu, Finsko 3; HVM Plasma, spol. s r. o., Praha 4; Laboratory of Physical Chemistry, Department of Chemistry, Aristotle University of Thessaloniki, Thessaloniki, Řecko 5
Vyšlo v časopise: Česká stomatologie / Praktické zubní lékařství, ročník 109, 2009, 3, s. 48-53
Souhrn
Adsorpcí biopolymerů na povrch titanu a titanem dopovaných uhlovodíkových povlaků se zvyšuje optická drsnost, tloušťka a index lomu povrchové vrstvy. Fibrinogen se lépe adsorbuje na povrchu titanu, který je upraven leštěním a leptáním, nežli na povrchu pouze leštěném. Nejlépe se adsorbuje na povrch uhlovodíkových povlaků dopovaným titanem, které byly deponované reaktivním magnetronovým naprašováním v optimálním poměru Ti0,38 - C0,62 a Ti0,09 - C0,91. Takto upravené povrchy dentálních implantátů by měly urychlit jejich oseointegraci a vhojení. Na povrch titanu se lépe adsorbují jednořetězové pyrimidinové oligodeoxynukleotidy (TTC)12, nežli purinové (AAG)12. Dvojšroubovicový duplex (TTC)12. (AAG)12 neovlivňuje optické vlastnosti povrchu titanu a patrně se na povrch neadsorbuje.
Klíčová slova:
titanové implantáty - adsorpce fibrinogenu - adsorpce oligodeoxynukleotidů - difrakční optický element - elipsometrieÚvod
U implantačních materiálů je vedle mechanicko-fyzikálních a chemických vlastností důležitý účinek biologický, tj. reakce organismu od molekulární po makroskopickou úroveň. V mnohém tento biologický účinek s mechanicko-fyzikálními a chemickými vlastnostmi materiálu souvisí, v mnohém je specifický pro určitou tkáň a její funkční začlenění v organismu. Vzájemnou reakci mezi alogenním materiálem a vitální biologickou tkaní nazýváme biokompatibilita. Má celou škálu projevů znamenajících pozitiva nebo negativa pro výsledek implantace. Negativní účinky mohou být toxické, mutagenní, karcinogenní, hemolytické, případně vyvolají senzibilizaci a imunologické procesy. Jindy jde o dráždivý efekt z mechanicko-fyzikálních nebo chemických příčin. Reakce jsou lokální nebo vzdálené i systémové.
Titan je často používán jako „biomateriál“ k náhradě různých tvrdých tkání, například ve stomatologii a ortopedii. Vysokou biokompatibilitu titanových těles zaručuje vrstva oxidů běžně přítomných na jakémkoliv titanovém povrchu. Morfologie povrchu implantátu, která může být modifikována různými postupy, ovlivňuje značnou měrou interakce implantátu s okolním prostředím [1, 4, 11].
Brzy po implantaci je během několika sekund povrch implantátu pokryt filmem adsorbovaných proteinů, které zprostředkují vzájemné interakce mezi implantátem a vnitřním prostředím organismu. Později migrují k implantátu různé buňky, ty snadněji interagují s proteinovým filmem než s holým kovovým povrchem. Protože většina implantátů přijde během zavádění do styku s krví, je prvotní film tvořen převážně proteiny krevní plazmy. Adsorbovaná proteinová vrstva, pokrývající povrch implantátu, hraje pravděpodobně důležitou roli v pozitivní reakci organismu na titanový implantát. Základní mechanismus vynikající biokompatibility titanu není ještě zcela znám.
Lidský plazmatický fibrinogen (LPF) je jeden z nejvýznamnějších proteinů, které jsou adsorbovány na povrch „biomateriálu“. LPF je součástí hemokoagulační kaskády, zvyšuje adhezi a agregaci trombocytů, je důležitým článkem nejen v hemostáze, ale i v rozvoji trombotických stavů [2, 3].
Struktura a složení proteinového filmu ovlivňuje typ a rozsah následujících biologických reakcí jako aktivaci hemokoagulace a imunitní odpovědi stejně jako oseointegraci [16]. Prvotní adsorbovaná proteinová vrstva ovlivňuje biokompatibilitu [8, 17], podporuje žádaný růst kosti na povrchu implantátu. Mechanismus a faktory důležité k adsorpci a desorpci proteinů jsou stále předmětem výzkumu a zůstávají zatím z větší části nepochopeny [12, 13]. Proto je důležité zjistit, jak různé titanové povrchy ovlivňují tvorbu a vlastnosti adsorbované proteinové vrstvy.
Interakce mezi povrchem titanu a molekulami LPF je způsobena kombinací elektrostatických a van der Waalsových sil. Elektrický náboj na povrchu titanu a LPF lze experimentálně měnit. Elektrický náboj LPF závisí na pH, izoelektrický bod LPF je 5,1 až 6,3 [23]. Povrch titanu je hydrofilní a polární, proto přitahuje molekuly vody a ve vodě rozpustné molekuly. LPF je amfifilní s hydrofilními částmi soustředěnými v C konci alfa řetězce, který také nese kladný náboj [3]. Jestliže jsou jak povrch titanu tak i LPF molekula negativně nabity, vzájemně se odpuzují. Tloušťka difuzních vrstev sousedících molekul je ovlivňována iontovou sílou okolního prostředí. Vysoká iontová síla zmenšuje tloušťku difuzní vrstvy. V prostředí o vysoké iontové síle nejsou proto záporně nabité molekuly LPF od povrchu titanu tak silně odpuzovány jako v prostředí o nízké iontové síle a mohou se dostat do jeho blízkosti.
Optické metody a moderní zobrazovací metody, jako je mikroskop atomárních sil (AFM - Atomic Force Microscope), mohou přinést nový a podrobnější pohled na adsorpci biopolymerů [9, 14, 19]. Mnoho významných studií tenkých organických filmů bylo provedeno pomocí elipsometrie [9, 14]. Elipsometrické techniky zaznamenaly během posledních dvaceti let značný rozvoj. Rozšíření této techniky do infračervené oblasti bylo možné ve spojení s Fourier-transformačním infračerveným spektrofotometrem. Tato kombinace přinesla značný pokrok při studiu struktury složitých tenkých organických filmů (vysokoteplotní supravodivost nebo anizotropie materiálu) [9]. Při studiu adsorpce DNA elipsometrii použili poprvé Humphreys a Parsons [10].
V tomto sdělení se věnujeme vlivu úpravy fyzikálních vlastností povrchu titanu mechanickým broušením a leptáním v kyselinách a dopováním uhlovodíkových povlaků titanem na adsorpci LPF. Adsorpci LPF jsme sledovali pomocí laserového difrakčního senzoru (diffractive optical element - DOE) a elipsometrie [5, 6, 19-21]. Předpokládáme, že nalezení optimálních podmínek povrchové úpravy a cílené adsorpce proteinového biomateriálu na registrované či nově vyvíjené dentální implantáty pomůže zlepšit průběh oseointegrace a vhojení aplikovaného implantátu. Ukazujeme, jak lze těmito optickými metodami studovat také adsorpci jednořetězových a dvoušroubovicových oligodeoxynukleotidů (DDN) na povrch titanu a jak ovlivňuje adsorpci jejich konformace.
Materiál a metoda
Vzorky titanu a chemikálie
Adsorpce oligonukleotidů a fibrinogenu byla sledována na vzorcích z technicky čistého titanu (12 válcových a 12 plochých vzorků po 30 kusech), titanové slitiny Ti6Al4V (12 válcových a 12 plochých vzorků po 30 kusech), Timetal 550 (12 válcových vzorků po 25 kusech) a Timetal 21SR (12 válcových vzorků po 25 kusech), jejichž povrch je buď leštěný nebo pískovaný brusivem o zrnitosti 22, 60 a 120. Všechny 4 typy povrchů byly pak ještě upraveny leptáním bez povrchové ztráty materiálu a s povrchovou ztrátou materiálu 0,03 mm. Dále jsme sledovali adsorpci fibrinogenu na vzorcích uhlovodíkových povlaků dopovaných titanem pomocí plazmového napařování (plasma - enhanced chemical vapour deposition) [15, 20, 22]. Ukázány jsou výsledky optických měření na vzorcích z technicky čistého titanu, jejichž povrch byl upraven leštěním (vzorek II/1) a následným leptáním s povrchovou ztrátou 0,03 mm (vzorek II/3) a na uhlovodíkových povlacích dopovaných titanem. Drsnost povrchu byla měřena pomocí AFM mikroskopu Explorer III (Veeco, Santa Barbara, Kalifornie, USA) v Českém metrologickém ústavu v Brně (Dr. Petr Klapetek).
Lidský plazmatický fibrinogen, frakce I, typ III, byl zakoupen od firmy Sigma a rozpuštěn ve fosfátovém pufru s 0,136 M citrátem sodným, výsledná koncentrace LPF byla 500 nM.
Oligodeoxynukleotidy–homopurinový (AAG)12a homopyridinový (TTC)12 (36 mery, ve kterých se 12krát opakuje sekvence AAG, případně TTC), byly získány od firmy Thermo Electron (Ulm, Německo) a rozpuštěny v 0,3 M NaCl + 50mM Na2HPO4 (pH 8,3). Koncentrace oligodeoxynukleotidů byla 5 µM. K přípravě dvoušroubovicového duplexu (AAG)12.(TTC)12 byla směs obou jednořetězových 36 merů o koncentraci 5 μμM zahřáta ve vodní lázni na 95 °C a po 1 minutě byla ponechána zvolna chladnout až na pokojovou teplotu.
Optická měření
Princip měření pomocí DOE je znázorněn na obrázku 1. Paprsek z laseru o vlnové délce λ = 632,8 nm je čočkami L1 a L2 zaostřen na kyvetu se studovaným roztokem (základní elektrolyt, roztok fibrinogenu nebo roztok ODN), do kterého je ponořen vzorek titanu. Jako Ni jsou označeny komplexní indexy lomu N = n + iκ jednotlivých prostředí kyvety (n – reálný index lomu, κκ – index absorpce, extinkční koeficient). N1 – okénko kyvety, N2 – studovaný roztok, N3 – povrchová adsorbovaná vrstva, N4 – titan. Paprsek odražený zpět z povrchu dopadá na hranol BS (beam splitter), interferuje s dopadajícím paprskem a je veden na holografickou mřížku DOE. Po průchodu mřížkou vzniká interferenční obrazec snímaný CCD kamerou a analyzovaný počítačem PC. Je-li povrch vzorku zcela hladký a nedochází na něm k absorpci nebo rozptylu laserového paprsku, je interferenčním obrazcem 16 (= 4x4) jasných ostrých bodů, jak je znázorněno na obrázku 1. Čím jsou tyto body méně intenzivní a méně ostré, tím je povrch vzorku drsnější a více absorbuje dopadající paprsek. Analýzou interferenčního obrazce (koherentní výstup DOE) počítač vypočte tzv. optickou drsnost povrchu Ropt. [18-21]. Nekoherentní výstup DOE se zobrazí vně interferenčního obrazce a závisí na komplexní permitivitě povrchové vrstvy ε = ε’ + iε’’ = (n + iκ)2. Mezi permitivitou, indexem lomu a indexem absorpce platí vztahy ε’ – n2 – κ2, ε’’ = 2nκ.
Obr. 1. Princip měření pomocí DOE. L1, L2–čočky zaostřující paprsek z laseru na kyvetu se studovaným roztokem; kyveta, komplexní indexy lomu: N<sub>1</sub>–okénko kyvety,N<sub>2</sub>–studovaný roztok,N<sub>3</sub>–povrchová adsorbovaná vrstva, N<sub>4</sub>–titan, BS–beam splitter, DOE–difrakční optický element, holografická mřížka, CCD–snímací kamera 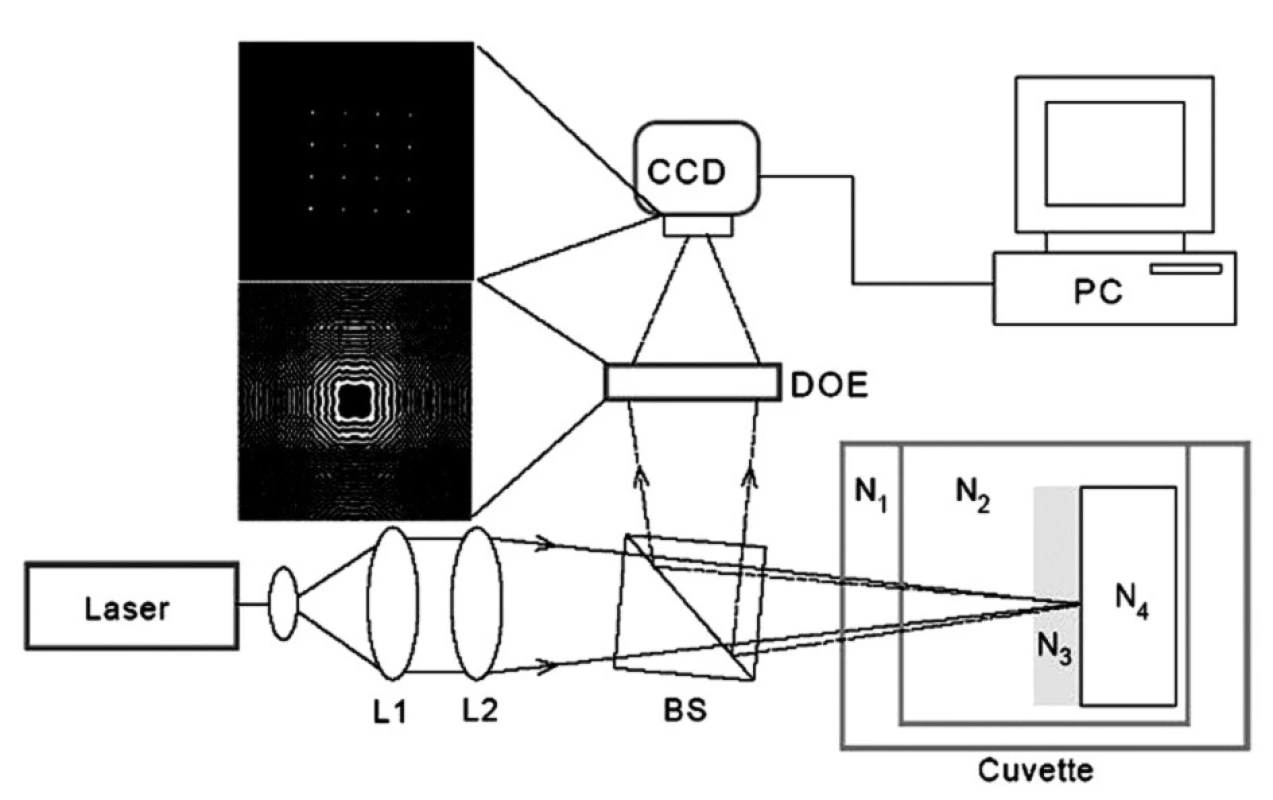
Elipsometrická měření byla uskutečněna na spektroelipsometru Woollam v suchém stavu po vytažení vzorku z roztoku. Z těchto měření byl stanoven komplexní index lomu N povrchu titanového vzorku a odrazivost (reflektance) R =/(1-N)/(1+N)│I2. Tloušťku adsorbované vrstvy h lze vypočítat z naměřeného extinkčního koeficientu κ pomocí Lambert-Beerova zákona:
h = –log (I/I)λ/4πκ.
V tomto vztahu I a I jsou intenzity paprsku odraženého z povrchu titanu pokrytého adsorbovanou vrstvou fibrinogenu a z čistého povrchu titanu. Optická měření byla uskutečněna v Ústavu fyziky univerzity v Joensuu ve Finsku.
Výsledky a diskuse
Měření drsnosti povrchu pomocí AFM
Jak povrchová úprava vzorku ovlivňuje drsnost povrchu, je ukázáno na obrázku 2 a obrázku 3. Jedná se o vzorky II/3 (povrch byl upraven leštěním a následným leptáním s povrchovou ztrátou 0,03 mm) a II/6 (povrch byl pískovaný zrnitostí 120 a leptaný s povrchovou ztrátou materiálu 0,03 mm). Byl stanoven profil povrchu ve směru úhlopříčky vyznačené na AFM snímku. Rozptyl nerovností u vzorku II/3 je přibližně 600 nm (osa z na obrázcích profilu), zatímco u vzorku II/6 je to téměř desetkrát více, přibližne 5000 nm.
Obr. 2. AFM vzorku II/3 (leštěný a leptaný s povrchovou ztrátou 0,03 mm). Snímek povrchu a jeho profil ve směru úhlopříčky, naznačené ve snímku, byl měřen pomocí AFMmikroskopu Explorer III (Veeco, Santa Barbara, Kalifornie,USA). 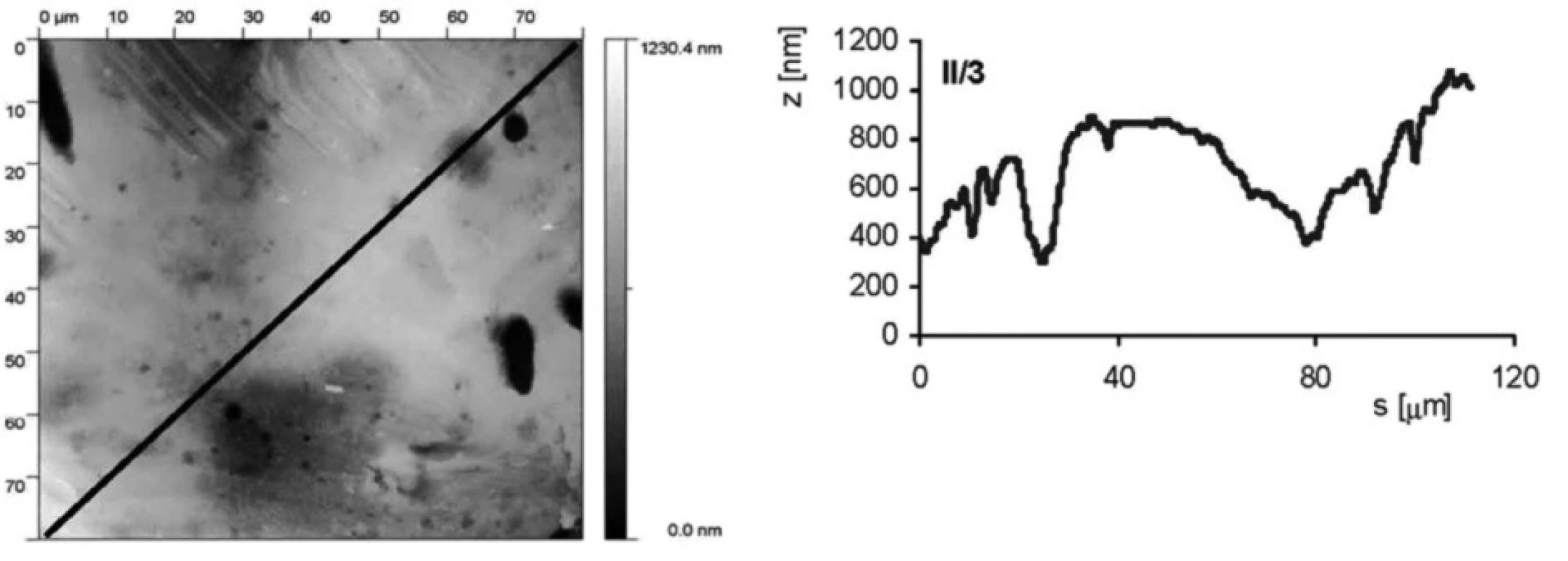
Obr. 3. AFM vzorku II/6 (pískovaný zrnitostí 120 a leptaný s povrchovou ztrátou materiálu 0,03 mm). Snímek povrchu a jeho profil ve směru úhlopříčky, naznačené ve snímku, byl měřen pomocí AFMmikroskopu Explorer III (Veeco, Santa Barbara, Kalifornie,USA). 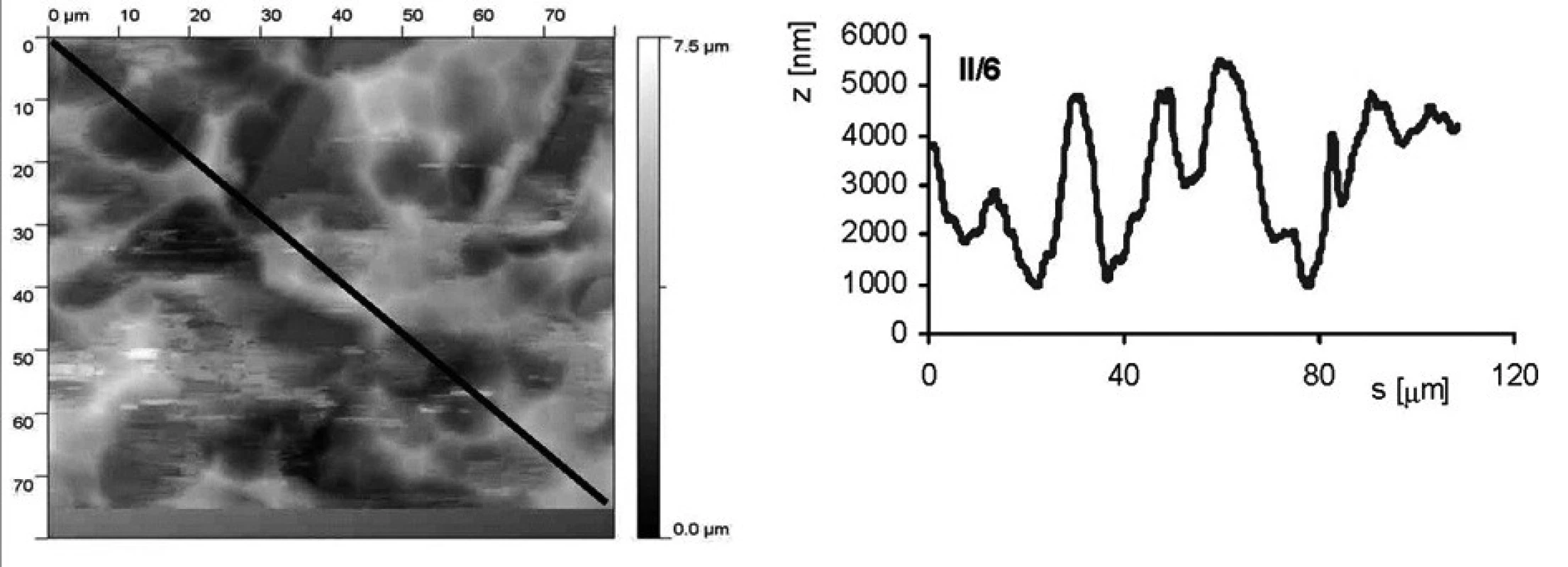
Adsorpce fibrinogenu na povrch titanu a titanem dopovaných uhlovodíkových povlaků
V tabulce 1 jsou ukázány výsledky měření adsorpce fibrinogenu lidské krevní plazmy na vzorek z technicky čistého titanu, jehož povrch byl upraven leštěním (vzorek II/1). V prvním sloupci (Buffer–interface) jsou výsledky měření difrakčním optickým elementem DOE a elipsometrem se vzorkem ponořeným jen v pufru. Druhý sloupec (HPF–interface) ukazuje, jak se hodnoty změnily po přidání LPF do pufru. Nekoherentní signál DOE, odpovídající změně komplexní permitivity, případně komplexního indexu lomu povrchové vrstvy, se zvýšil, optická drsnost Ropt se prakticky nezměnila (pozorovaná změna je v mezích experimentálních chyb). Tloušťka vrstvy se zvětšila asi o 1 nm (poslední řádek v tabulce). V tabulce 2 je totéž ukázáno pro vzorek II/3, jehož povrch byl upraven leštěním a následným leptáním. Je vidět, že po adsorpci fibrinogenu dochází zde k mnohem větším změnám optických parametrů. Optická drsnosti Ropt se zvýšila asi o 17 nm, tloušťka vrstvy h vzrostla na 15–25 nm. Z toho lze usoudit, že fibrinogen se lépe adsorbuje na povrchu leptaném a leštěném nežli na povrchu pouze leštěném. Proto lze také předpokládat, že leptaný povrch bude z hlediska oseointegrace titanových implantátů vhodnější nežli povrch pouze leštěný.
Tab. 1. Měření difrakčním optickým elementem DOE a elipsometrem se vzorkem II/1 (leštěný povrch). 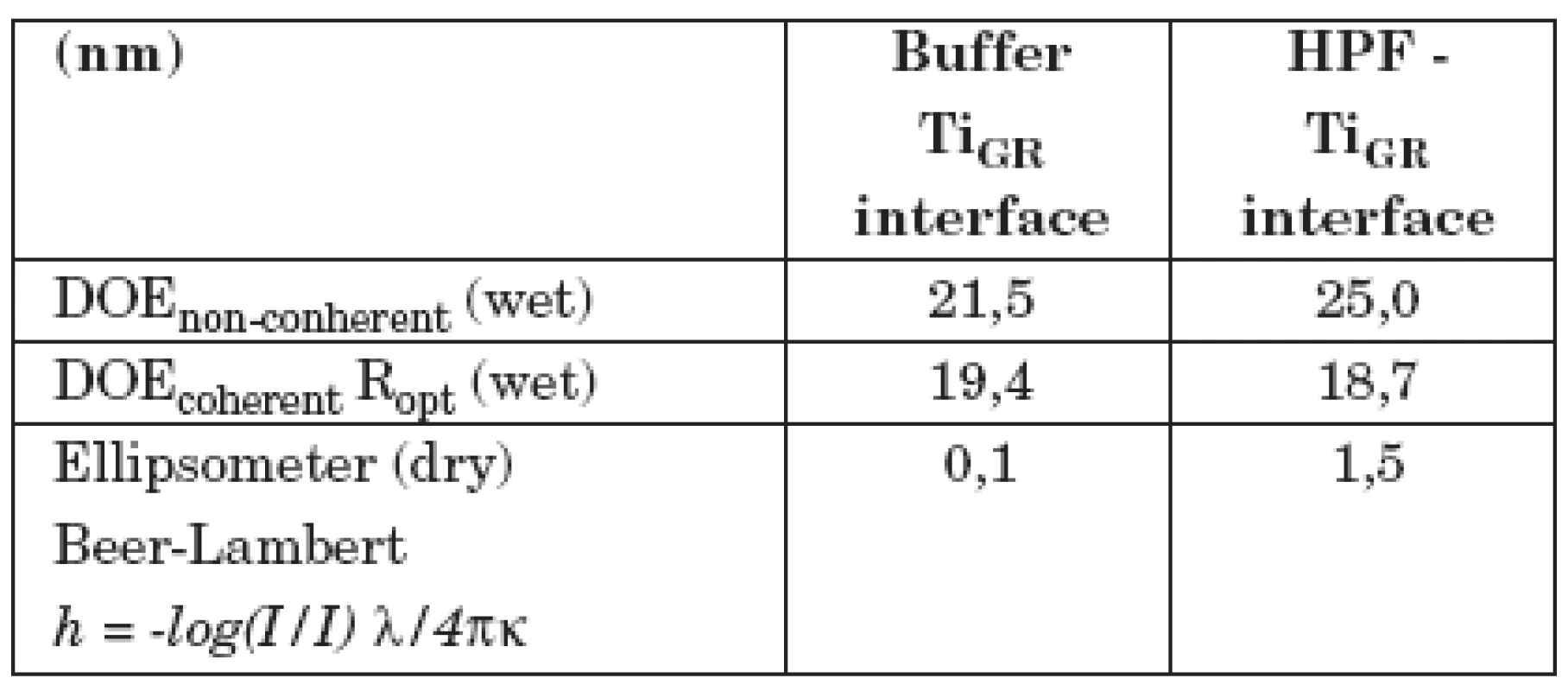
DOE non-coherent podává informace o komplexním indexu lomu povrchu vzorku, DOE coherent je optická drsnost povrchu. Ellipsometer (dry): tloušťka povrchové vrstvy vypočtená z Lambert-Beerova zákona. Číselné hodnoty všech veličin jsou uváděny v nm. Tab. 2. Měření difrakčním optickým elementem DOE a elipsometrem se vzorkem II/3 (leštěný a leptaný povrch). 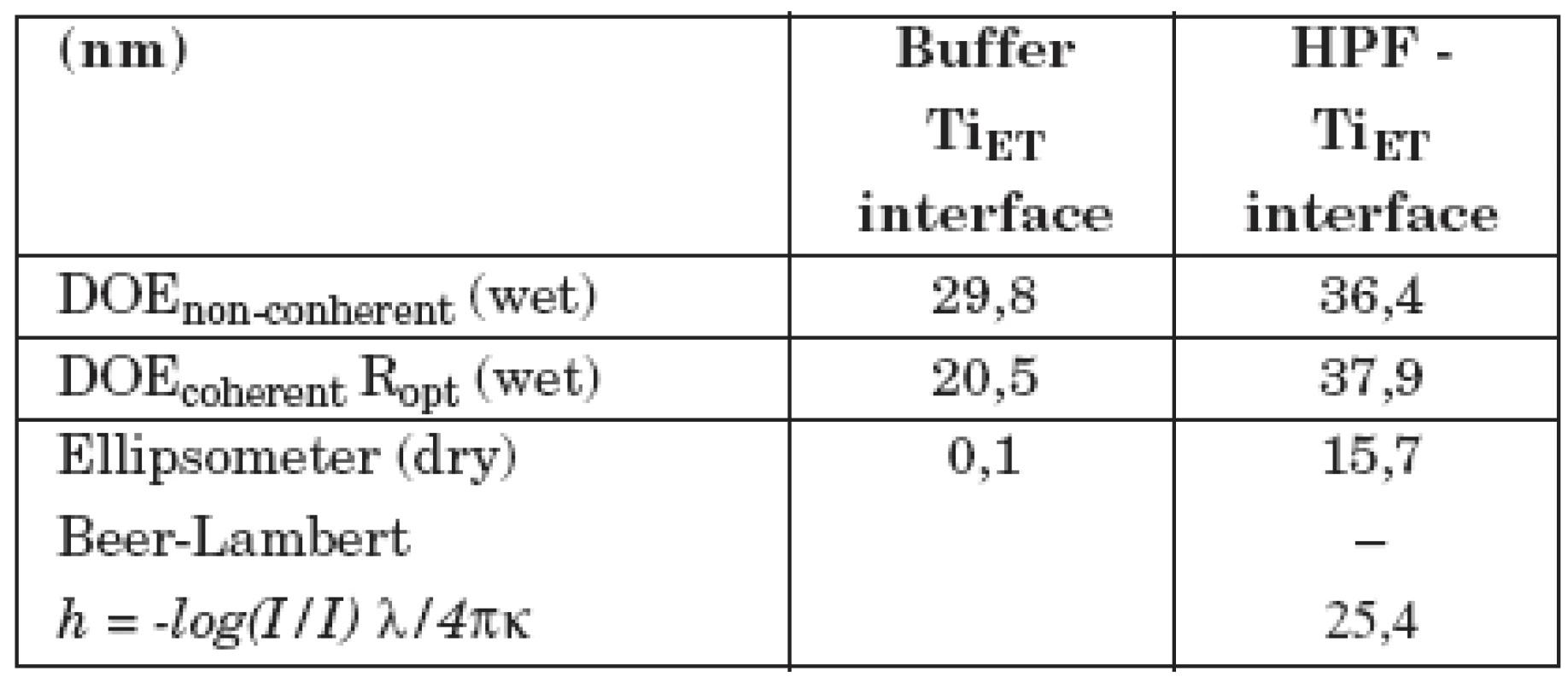
DOE non-coherent podává informace o komplexním indexu lomu povrchu vzorku, DOE coherent je optická drsnost povrchu. Ellipsometer (dry): tloušťka povrchové vrstvy, vypočtená z Lambert-Beerova zákona. Číselné hodnoty všech veličin jsou uváděny v nm. Dále byly studovány 4 vzorky uhlovodíkových povlaků bez dopování a dopované titanem (Ti–C:H) v různém poměru Tix–C1-x, které byly připraveny na pracovišti HVM Plasma, spol. s r. o., metodou reaktivního magnetronového naprašování, kde reaktivním plynem byl acetylén. K největším změnám optických parametrů po adsorpci fibrinogenu docházelo na vzorcích dopovaných v poměru Ti0,09–C0,91 a Ti0,38–C0,62. Takto upravené povrchy by měly být nejvhodnější z hlediska oseointegrace povrchu implantátů. Na vzorcích bez dopování Ti0,00–C1,00 (povrch odpovídá struktuře diamantu) a s velkým obsahem titanu Ti0,82–C 0,18 byly optické změny po adsorpci fibrinogenu velmi malé. Na grafu 1 jsou porovnány výsledky měření změn optické drsnosti po adsorpci LPF různě upravených povrchů. Nejlepších výsledků bylo dosaženo na uhlovodíkovém povlaku dopovaném titanem (vzorek NIF=3).
Graf 1. Změny optické drsnosti různě upravených povrchů titanu a uhlovodíkového povlaku dopovaného titanem po adsorpci fibrinogenu. N<sub>IF</sub> =1 leštěný povrch N<sub>IF</sub> =2 leštěný a leptaný povrch N<sub>IF</sub> = 3 uhlovodíkový povlak dopovaný titanem v poměru Ti<sub>0,09</sub>–C<sub>0,91</sub>. Hodnoty optické drsnosti na svislé ose jsou uváděny v desítkách nanometrů (1=10 nm). 
Růst osteoblastů na titanovém povrchu
Sledovali jsme růst lidských osteoblastů na titanových destičkách, vzorek II/1 a II/3. Buněčné linie lidských osteoblastů hFOB 1.19, použité v experimentu, byly získány z kolekce American Type Culture Collection (ATCC). Zkoumané titanové destičky byly vysterilizovány a umístěny do živného média s buňkami osteoblastů. Kultivace probíhala 6 dnů při 37 °C a 5% CO2. Zjistili jsme, že osteoblasty rostly lépe na povrchu II/3, který byl upraven leštěním a leptáním, nežli na povrchu pouze leštěném II/1. Poměr buněk (leštěný/leštěný a leptaný)=66,8 ± 3,6. Tyto výsledky podpořily náš předpoklad, že úprava povrchu zvýhodňující adsorpci fibrinogenu bude také zvýhodňovat růst osteoblastů a urychlí oseointegraci implantátu.
Adsorpce deoxyoligonukleotidů na povrch titanu
- a) Optická drsnost a tloušťka adsorbované vrstvy
Pomocí optického difrakčního senzoru (DOE) a elipsometrie jsme sledovali vliv morfologie a drsnosti povrchů titanových vzorků na adsorpci purinového (AAG)12 a pyrimidinového (TTC)12 oligodeoxynukleotidu. Měřením koherentního výstupu DOE bylo zjištěno, že k největšímu zvýšení optické drsnosti Ropt (na hodnotu přibližně 35 nm) došlo po adsorpci jednořetězového pyrimidinového oligodeoxynukleotidu (TTC)12. Elipsometrická měření v suchém stavu ukázala zvýšení tloušťky povrchové vrstvy h na přibližně 44 nm. Po adsorpci jednořetězového purinového deoxynukleotidu (AAG)12 došlo k mnohem menšímu zvýšení optické drsnosti (na hodnotu asi 27 nm), z elipsometrie vyplynula tloušťka povrchové vrstvy h asi 25 nm. Adsorpce dvoušroubovicového oligodeoxynukleotidu (AAG.TTC)12 nevyvolala téměř žádné změny optické drsnosti a tloušťka vrstvy se blížila hodnotám naměřeným v pufru (Ropt=23 nm, h=18–20 nm). Z těchto výsledku plyne, že na povrch titanu se nejlépe adsorbují jednořetězové pyrimidinové ODN. Dvojšroubovicové ODN se pravděpodobně na titanovém povrchu za daných experimentálních podmínek buď vůbec neadsorbují, anebo jen v malé míře, která neovlivní optické vlastnosti povrchu.
Zvýšení drsnosti povrchu Ti po adsorpci jednořetězových oligonukleotidů lze připsat tomu, že tyto poměrně flexibilní oligonukleotidy (o šířce přibližně 1 nm a délce 36x0,34=12,24 nm), adsorbované na Ti, kopírují nerovnosti povrchu a mohou tam vytvářet chaoticky neuspořádané „roští” zvyšující drsnost povrchu. Bez aplikace elektrického pole se jednořetězové oligonukleotidy váží na hydrofobní povrch Ti přednostně hydrofobními bazemi. Z naších měření adsorpce oligodeoxynukleotidů (ODN) na Hg plyne, že pyrimidinové ODN se adsobují více nežli purinové ODN [7]. Podobně lze očekávat, že i na hydrofobní povrch Ti se budou pyrimidinové ODN adsorbovat více nežli purinové a budou více zvyšovat drsnost povrchu nežli purinové ODN, což bylo experimentálně potvrzeno.
Aplikace elektrického pole způsobí, že se jednořetězové ODN adsorbují na povrch Ti také elektrostaticky negativními náboji na fosfátových skupinách. Elektrostatická adsorpce je silnější nežli adsorpce van der Waalsovými interakcemi uplatňujícími se bez pole. Proto jsme pozorovali zvýšení optické drsnosti po vložení potenciálu + 0,3 V na titanový vzorek.
Malé snížení drsnosti pozorované po adsorpci dvoušroubovicových oligonukleotidů (AAG.TTC)12, představujících rigidní tyčky (o průměru přibližně 2 nm a délce 12 nm), lze vysvětlit tím, že tyto „klády” překlenou nerovnosti v povrchu a vyhladí jej.
- b) Změny indexu lomu
Z výsledků analýzy nekoherentního výstupu DOE bylo zjištěno, že po adsorpci jednořetězových purinových nebo pyrimidinových ODN se zvýšil index lomu n.
Zvýšení n bylo větší u purinového oligonukleotidu (AAG)12 nežli u pyrimidinového (TTC)12.
Zvýšení n bylo větší po aplikaci elektrického potenciálu + 0,3 V. Po adsorpci dvoušroubovicového oligonukleotidu (AAG.TTC)12 se index lomu n nezměnil, po aplikaci elektrického potenciálu + 0,3 V se index lomu zvýšil. Index lomu, případně permitivita povrchové vrstvy, jsou dány polarizovatelností adsorbovaných molekul. Ta je u oligonukleotidů vyšší nežli u vody. Puriny mají vyšší polarizovatelnost než pyrimidiny (molekuly purinů jsou větší), proto při adsorpci purinových ODN se index lomu zvýší více nežli při adsorpci pyrimidinových ODN. Elektrické pole zvýší adsorpci ODN, jak bylo uvedeno v předchozím odstavci, a pozorované změny indexu lomu jsou proto po aplikaci elektrického potenciálu na měřený vzorek větší.
Závěr
Adsorpci biomakromolekul na povrchy titanových implantátů a uhlovodíkových povlaků, dopovaných titanem, lze citlivě detekovat měřením optických vlastností povrchu pomocí difrakčního optického elementu a elipsometrie. Úprava fyzikálních vlastností povrchu může zvýšit adsorpci fibrinogenu na implantát, a tím urychlit jeho oseointegraci. Popsanými optickými metodami lze stanovit také vliv konformace oligodeoxynukleotidů na jejich adsorpci na povrch titanu. Hodnota optické drsnosti vrstvy Ropt, stanovená difrakčním optickým elementem, je přímo úměrná tloušťce vrstvy h stanovené elipsometricky.
Věnováno k významnému životnímu jubileu prof. MUDr. Jiřího Vaňka, CSc.,
přednosty Stomatologické kliniky FN u sv. Anny v Brně
a ředitele Stomatologického výzkumného centra LF MU
Poděkování
Článek vznikl za podpory grantového projektu MŠMT číslo 1M0528 Stomatologické výzkumné centrum, GAČR 202/08/1688 a GA AV ČR KAN 200040651. Za technickou pomoc při přípravě rukopisu autoři děkují paní Ludmile Markové a RNDr. Libuši Gandelové.
Prof. RNDr. Vladimír Vetterl, DrSc.
Biofyzikální ústav AV ČR, v.v.i.
Královopolská 135
612 65 Brno
e-mail: vetterl@ibp.cz
Zdroje
1. Brett, P. M., Harle, J., Salih, V., Mihoc, R., Olsen, I., Jones, F. H., Tonetti, M.: Roughness response genes in osteoblasts, Bone, 35, 2004, s. 124-133.
2. Cacciafesta, P., Hallam, K. R., Watkinson, A. C., Allen, G. C., Miles, M. J., Jandt, K. D.: Visualisation of human plasma fibrinogen adsorbed on titanium implant surfaces with different roughness. Surf. Sci., 491, 2001, s. 405-420.
3. Cacciafesta, P., Humphris, A. D. L., Jandt, K. D., Miles, M. J.: Human plasma fibrinogen adsorption on ultraflat titanium oxide surfaces studied with atomic force microscopy. Langmuir, 16, 2000, s. 8167-8175.
4. Cochran, D. L.: A comparison of endosseous dental implant surfaces. J. Periodontol., 70, 2000, s. 1523-1539.
5. Hasoň, S., Simonaho, S. P. Silvennoinen, R.,Vetterl, V.: On the adsorption and kinetics of phase transients of adenosine at the different carbon electrodes modified with a mercury layer. Electrochimica Acta, 48, 2003, s. 651-668.
6. Hasoň, S., Simonaho, S. P., Silvennoinen, R., Vetterl, V.: Detection of phase transients in two-dimensional adlayers of adenosine at the solid amalgam electrode surfaces. J. Electroanal. Chem., 568, 2004, s. 65-77.
7. Hasoň, S., Vetterl, V., Fojta, M.: Two-dimensional condensation of pyrimidine oligonucleotides during their self-assemblies at mercury based surfaces. Electrochimica Acta, 53, 2008, s. 2818-2824.
8. Hemmersam, A. G., Foss, M., Chevallier, J., Besenbacher, F.: Adsorption of fibrinogen on tantalum oxide, titanium oxide and gold studied by the QCM-D technique. Colloid Surf. B, 43, 2005, s. 208-215.
9. Humlíček, J. C. Bernard, C.: Diffraction effects in infrared ellipsometry of conducting samples. Thin Solid Films, 455-456, 2004, s. 177-182.
10. Humphreys, M. W., Parsons, R.: Ellipsometry of DNA adsorbed at mercury electrodes: A preliminary study. J. Electroanal. Chem., 75, 1977, s. 427-436.
11. Jansoon, E., Tengvall, P.: Adsorption of albumin and IgG to porous and smooth titanium. Colloid Surf. B, 35, 2004, s. 45-51.
12. Jones, M. I., McColl, I. R., Grant, D. M., Parker, K. G., Parker, T. L.: Protein adsorption and platelet attachment and activation on TiN, TiC, and DLC coatings on titanium for cardiovascular applications. J. Biomed. Mater.Res., 52, 2000, s. 413-421.
13. Juany, N., Yang, P., Leng, Y. X., Chen, J. Y., Sun, H., Wang, G. J., Ding, P. D., Xi, T. F., Leng, Y.: Hemocompatibility of titanium oxide films. Biomaterials, 24, 2003, s. 2177-2187.
14. Karagkiozaki, V., Logothetidis, S., Kalfagiannis, N., Lousinian, S., Giannoglou, G.: Atomic force microscopy probing platelet activation behavior on titanium nitride nanocoatings for biomedical applications. Nanomedicine: Nanotechnology, Biology and Medicíně, 5, 2009, s. 64-72.
15. Kulikovsky, V., Kuzmichev, A., Bohaca, P., Hubicka, Z., Jurek, K., Jastrabik, L.: Composition of Ti-C:H films obtained by pulsed and continuous magnetron sputtering. Surf. Coat. Technol., 200, 2005, s. 620-624.
16. Nygren, H., Tengvall, H. P., Lundstrom, I.: The initial reactions of TiO2 with blood. J. Biomater. Res., 34, 1997, s. 487-492.
17. Rouahi, M., Champion, E., Gallet, O., Jada, A., Anselme, K.: Physico-chemical characteristics and protein adsorption potential of hydroxyapatite particles: Influence on in vitro biocompatibility of ceramics after sintering. Colloid Surf. B, 47, 2006, s. 10-19.
18. Silvennoinen, R., Hasoň, S., Vetterl, V.: Organization of nano-scale synthetic oligonucleotides on immersed electrode surface: an optical study. In Peiponen, K.-E., Hernberg, R., Yatagai, T.(editors): Technical digest of the Seventh Finnish-Japanese joint symposium on optics in engineering, (8-10 August, Tampere, Finland, 2007), s. 101-102.
19. Silvennoinen, R., Peiponen, K. E., Myller, K.: Specular gloss . Amsterdam, Elsevier, Amsterdam, 2007.
20. Silvennoinen, R.,Vetterl, V., Hasoň, S., Tuononen, H., Silvennoinen, M., Myller, K., Cvrček, L., Vaněk, J., Prachár, P.: Sensing of human plasma fibrinogen on polished, chemically etched and carbon treated titanium surfaces by diffractive optical element based sensor. Optics Express, 16, 2008, č. 14/10130.
21. Vetterl, V., Hasoň, S., Tuononen, H., Silvennoinen, M., Myller, K.,Vaněk, J., Silvennoinen, R.: Diffractive optical element spectroscopy of biomaterial surface. Proc. of SPIE, 7022, 2008, 702203. (Advanced Laser Technologies 2007, edited by Ivan A. Shcherbakov.)
22. Vitu, T., Polcar, T., Cvrček, L., Novák, R., Macák, J., Vyskočil, J., Cavaleiro, A.: Structure and tribology of biocompatible Ti-C:H Coatings. Surf. Coat. Technol., 202, 2008, s. 5790-5793. (Sixth Asian-European International Conference on Plasma Surface Engineering.)
23. http://www.haemtech.com/Platelet_Proteins/Fibrinogen. htm.
Štítky
Chirurgia maxilofaciálna Ortodoncia Stomatológia
Článok vyšiel v časopiseČeská stomatologie / Praktické zubní lékařství
Najčítanejšie tento týždeň
2009 Číslo 3
-
Všetky články tohto čísla
- Papillon-Lefevre syndrom (Kazuistika)
- Binární titan-tantalové slitiny a jejich biokompatibilita
- Autotransplantace zubů Systematický přehled
- Slinné markery pro onemocnění parodontu a dalších orgánů
- Biofyzikální mechanismy určující biokompatibilitu dentálních implantátů a podmiňující jejich oseointegraci
- Hojení patologických kostních dutin čelistí po augmentaci
- Vliv délky implantátu na jeho primární stabilitu
- Česká stomatologie / Praktické zubní lékařství
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Papillon-Lefevre syndrom (Kazuistika)
- Hojení patologických kostních dutin čelistí po augmentaci
- Autotransplantace zubů Systematický přehled
- Slinné markery pro onemocnění parodontu a dalších orgánů
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



