-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Papillon-Lefevre syndrom (Kazuistika)
Papillon-Lefevre Syndrome
Papillon-Lefevre syndrome (PLS) is a rare autosomal recessive disorder characterized by severe early-onset periodontal destruction involving both the deciduous and permanent dentition and skin lesions of palmoplantar hyperkeratosis. Recently it was found that PLS patients carry loss-of-function mutations in the gene encoding cathepsin C (CTSC). The aim of this study was analyzed the CTST gene in one Czech family with PLS. Peripheral blood samples were obtained from individuals belonging to this family for DNA isolation. Mutations were identified by direct sequencing of genomic DNA amplified for selected regions of the cathepsin C gene. 12-old year patient and his grandfather had a classic PLS phenotype. We analyzed all exons of the CTSC gene and identified a mutation in intron 1 (rs217077). Both affected individuals were homozygous for T allele; our child’s mother and unaffected brother carried a heterozygote combination of this mutation. Dipeptidyl-peptidase I encoded by the CTSC gene play an immune and inflammatory role. Many different mutations in this gene have been reported in patients with PLS from several ethnic groups. This is the first genetic study of Papillon-Lefevre syndrome in the Czech population.
Key words:
Papillon-Lefevre syndrome - hyperkeratosis - periodontitis - gene - mutation - cathepsin C
Autoři: L. Izakovičová Hollá 1,2; A. Fassmann 1; M. Kukletová 1; V. Sazmová 1
Působiště autorů: Stomatologická klinika LF MU a FN u sv. Anny, Brno 1; Ústav patologické fyziologie LF MU, Brno 2
Vyšlo v časopise: Česká stomatologie / Praktické zubní lékařství, ročník 109, 2009, 3, s. 31-36
Kategorie: Kazuistika
Souhrn
Papillon-Lefevre syndrom (PLS) je vzácné, autozomálně recesivní onemocnění, u kterého nalézáme závažnou destrukci parodontálních tkání, postihující jak dočasnou, tak i stálou dentici, spolu s kožními změnami charakteru palmoplantární hyperkeratózy. V patogenezi PLS se předpokládá důležitá úloha mutací v genu pro katepsin C (CTSC). Cílem naší práce bylo analyzovat tento gen u českého pacienta s podezřením na onemocnění PLS a dalších členů jeho rodiny. Od jednotlivých osob byly odebrány vzorky periferní krve, z nichž byla izolována DNA, a následně sekvencovány vybrané oblasti genu pro katepsin C. 12letý pacient a jeho dědeček vykazovali klasické známky PLS fenotypu. Analýza CTSC genu u nich prokázala mutaci v 1. intronu spojenou se záměnou T za A (rs217077). Oba nemocní nesli homozygotní kombinaci alely T, matka dítěte i nepostižený bratr byli pro tuto mutaci heterozygoty. CTSC gen kóduje enzym dipeptidyl-peptidázu I, která hraje důležitou úlohu v imunitní a zánětlivé odpovědi. Mutace v genu pro katepsin C byly u pacientů s PLS popsány v různých etnických skupinách. Naše práce je první genetickou studií Papillon-Lefevrova syndromu v české populaci.
Klíčová slova:
Papillon-Lefevre syndrom - hyperkeratóza - parodontitida - gen - mutace - katepsin CÚVOD
Papillon-Lefevre syndrom (PLS, MIM#245000) je vzácným, autozomálně-recesivním (AR) onemocněním, které bylo v literatuře poprvé popsáno Papillonem a Lefevrem v roce 1924 [19]. Prevalence je odhadována na 1-4/milion obyvatel; dosud je známo více než 200 zdokumentovaných případů [7]. Pro onemocnění je typická závažná destrukce parodontálních tkání vedoucí k předčasné ztrátě zubů jak v dočasné, tak i ve stálé dentici, spolu s přítomností hyperkeratóz postihujících dlaně a plosky nohou, ale vyskytujících se také v oblasti kolen, loktů a v jiných lokalitách. Přítomny mohou být i další symptomy: zhoršení až ztráta sluchu, kalcifikace dura mater, folikulární hyperkeratóza, hyperhidróza, abnormality nehtů a u asi 25 % pacientů také zvýšená náchylnost k infekcím [2, 8, 27].
Postižení parodontu nastupuje u pacientů časně po prořezání dočasných zubů, gingiva bývá edematózní a zarudlá. Postupně dochází k akumulaci plaku, zejména v hlubokých „chobotech“, častým příznakem bývá halitóza. Nejdříve jsou postiženy střední řezáky, které mohou být výrazně pohyblivé již ve věku kolem tří let. Kolem čtvrtého až pátého roku dochází k exfoliaci dočasných zubů. Poté může nastat dočasné zlepšení stavu měkkých tkání - gingivy, které přetrvává do doby začátku erupce zubů stálé dentice. V typických případech po určité době od prořezání stálých zubů do ústní dutiny dochází k destrukci alveolární kosti a ztrátě chrupu do 20 let věku [8, 28]. Pacienti, u nichž se rozvíjí PLS, se tak stávají bezzubými v rané dospělosti.
Léčba tohoto onemocnění je vzhledem k přítomnosti genetického defektu velmi obtížná. I když byla v literatuře popsána řada doporučených postupů, definitivní terapeutické protokoly dosud nejsou k dispozici. V léčbě se využívá časných extrakcí dočasných zubů; předpokládá se, že tím dojde ke snížení množství přítomných parodontálních patogenů, a tedy k navození situace, kdy stálé zuby prořezávají do prostředí „bez infekce“ [27]. Dále se používá kombinovaná systémová i lokální antimikrobiální terapie spolu s konzervativní i chirurgickou parodontologickou léčbou. K nejčastěji doporučované strategii léčby kožních lézí patří podávání retinoidů [6, 22, 23, 28].
KAZUISTIKA
Na oddělení dětské stomatologie bylo v říjnu 2004 doporučeno k vyšetření dítě – chlapec – ve věku 12 let pro pokročilou destrukci parodontálních tkání, výraznou pohyblivost zubů a malhygienu (obr. 1). Z anamnestických údajů jsme zjistili, že šlo o první dítě nepříbuzných rodičů bez pozoruhodné anamnézy rodičů stran onemocnění parodontu. Chlapec býval od malička často nemocný, prodělal opakované angíny, faryngitidy i zápal plic, opakovaně bral antibiotika. Dle údajů matky došlo u pacienta k předčasné (bez přesnější specifikace věku) ztrátě dočasných zubů. Jeho mladší bratr je ve věku 4 let dosud zdráv. Při odběru podrobnější rodinné anamnézy byla nápadná koincidence příznaků staršího syna se stejně postiženým dědečkem z matčiny strany.
Obr. 1. Klinický obraz u 12letého pacienta se suspektním Papillon-Lefevre syndromem. 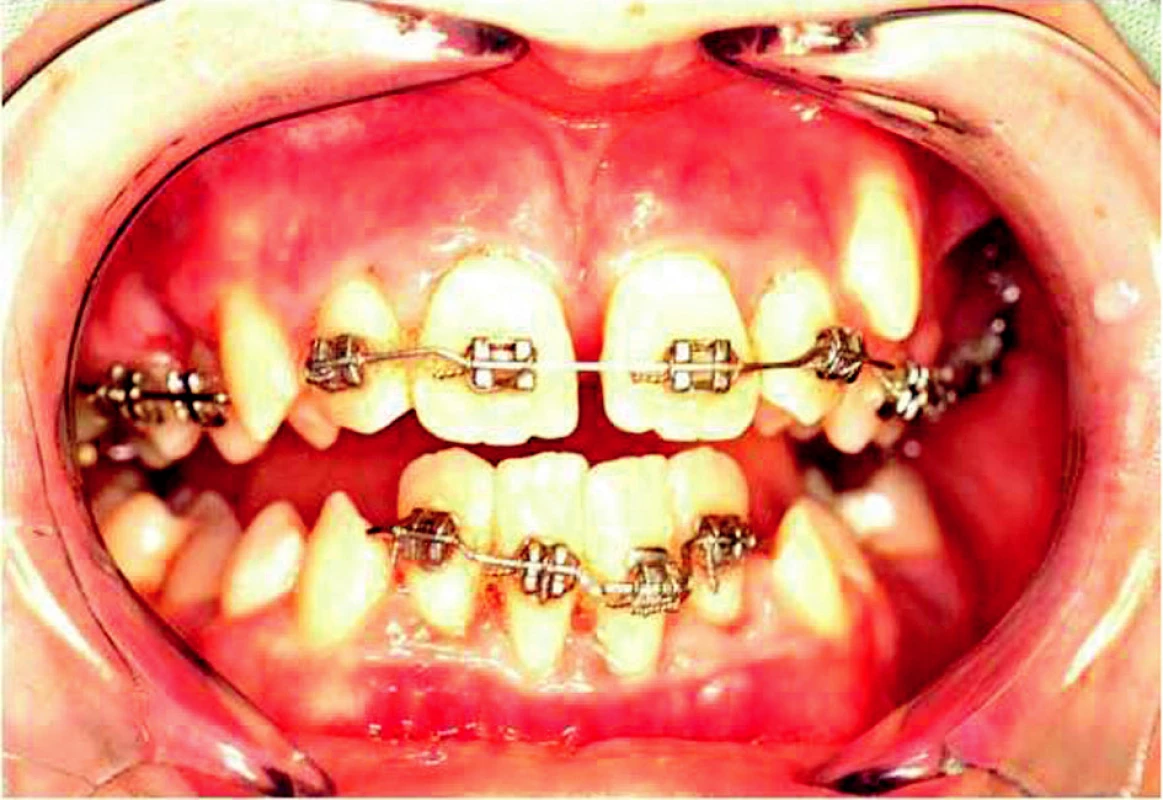
Při klinickém intraorálním vyšetření byly nalezeny prořezané všechny stálé zuby (s výjimkou třetích molárů). Hygiena ústní dutiny byla velmi špatná s významnou akumulací plaku. Byla přítomna závažná gingivitida s generalizovanými recesy, parodontálními „choboty“ a výraznou pohyblivostí většiny zubů. Provedené rentgenové vyšetření (OPG a intraorální rtg 2-2) potvrdilo přítomnost generalizované destrukce alveolární kosti s maximem resorpce v krajině řezáků a prvních molárů (obr. 2, obr. 3).
Obr. 2. Ortopantomogram téhož pacienta. 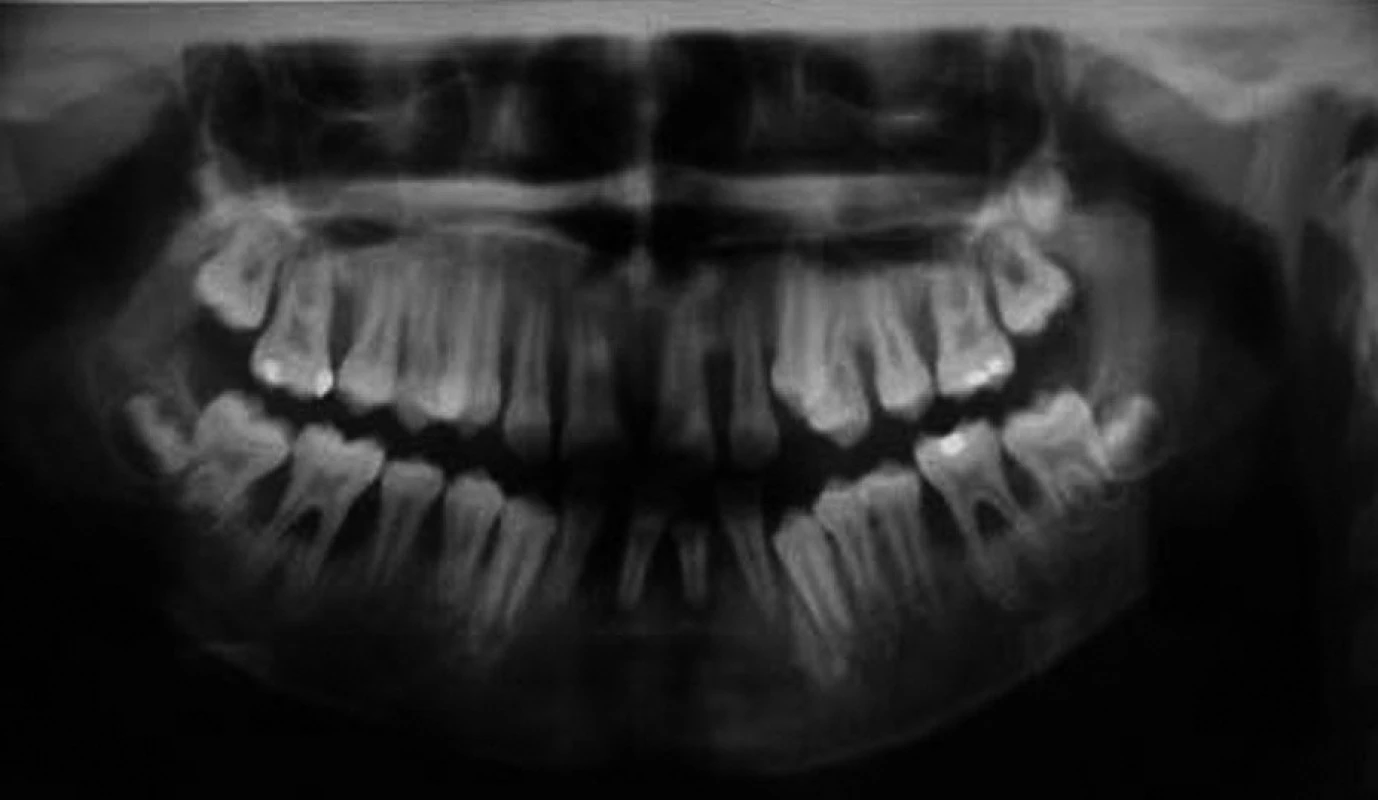
Obr. 3. Intraorální rtg 2-2 ukazuje extenzivní ztrátu alveolární kosti. 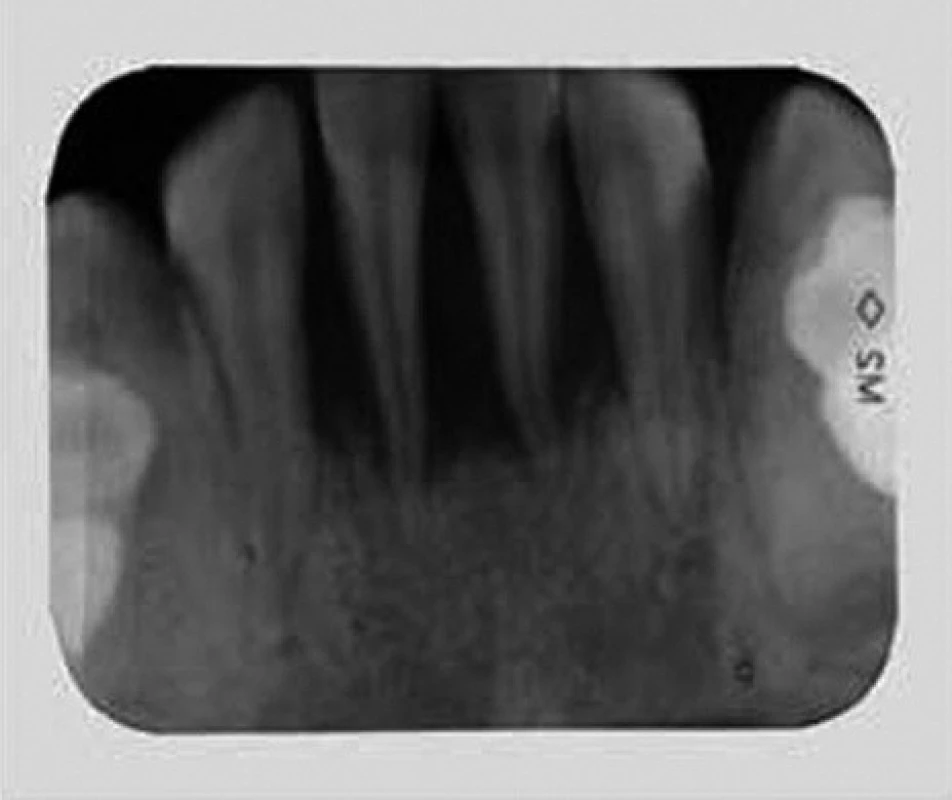
Další provedená vyšetření (krevní obraz, hladina alkalické fosfatázy, imunologické a alergologické testy, základní biochemie) byly v rozmezí normálních hodnot. Kromě nálezu v ústní dutině byly jak u pacienta, tak také u jeho dědečka, přítomny nápadné kožní změny na dlaních a ploskách nohou, které měly charakter hyperkeratóz (obr. 4, obr. 5).
Obr. 4a. Palmární hyperkeratóza u: a) chlapce 
Obr. 4b. Palmární hyperkeratóza u: b) jeho dědečka. 
Obr. 5a. Plantární hyperkeratóza u: a) chlapce 
Obr. 5b. Plantární hyperkeratóza u: b) jeho dědečka. 
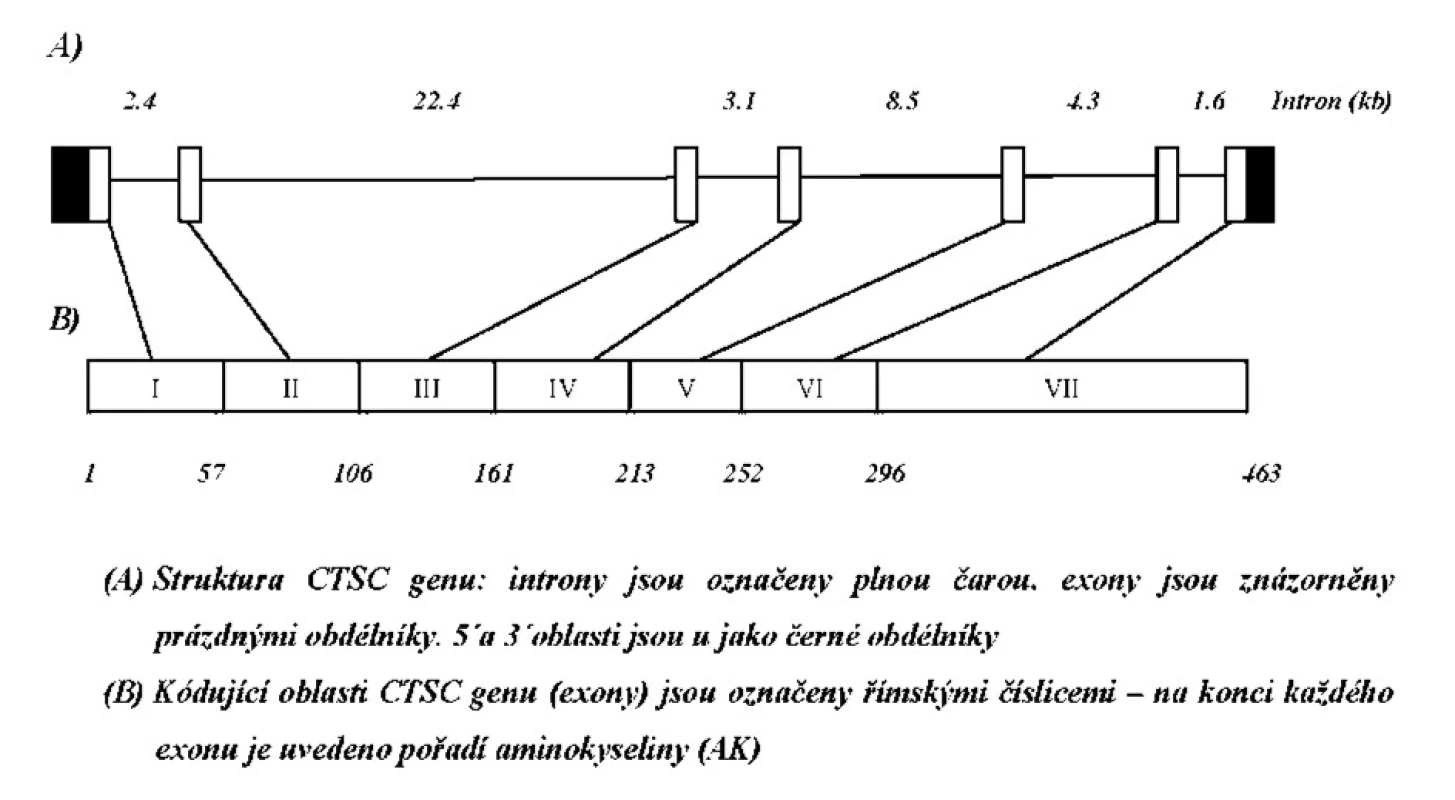
Vzhledem ke koincidenci závažné parodontitidy a kožních palmoplantárních hyperkeratóz jsme pojali podezření na Papillon-Lefevre syndrom. Ačkoliv etiologie tohoto syndromu není dosud zcela objasněna, u pacientů s PLS se předpokládá defekt v genu pro katepsin C [cathepsin C (CTSC, MIM# 602365)]. Katepsin C (Dipeptidylpeptidáza I, (DPP I); EC 3.4.14.1) je 200 kDa proteináza, patřící do papainové rodiny endopeptidáz. Gen pro tento enzym (CTSC) je dlouhý více než 46 kb, tvoří jej 7 exonů (obr. 6) a je lokalizován na chromozomu 11q14-q21 [14]. Dosud bylo popsáno více než 60 různých mutací u pacientů s PLS v různých etnických skupinách (shrnutí v Selvaraju a kol., 2003) [24]. Naším cílem bylo analyzovat všechny exonové (a přilehlé intronové) úseky genu pro CTSC u chlapce s podezřením na PLS a dostupných členů rodiny a potvrdit nebo naopak vyvrátit výše uvedenou diagnózu.
Všem osobám bylo (po podepsání informovaného souhlasu s vyšetřením) odebráno 5 ml periferní venózní krve, z níž byla izolována DNA standardní technikou s použitím proteinázy K. Po amplifikaci jednotlivých úseků s použitím sady primerů dle Toomese a kol. [26] a Noacka a kol. [17] (tab. 1) pomocí metody polymerázové řetězové reakce (PCR) a po přečištění produktů, jsme vzorky sekvencovali Sangerovou metodou dle návodu ke kitu (Thermo Sequenase Radiolabeled Terminator Cycle Sequencing Kit, Terminátor Cycle Sequencing Kit + 33P Labelled Terminátor Pack). Po analýze všech sedmi exonových a přilehlých intronových oblastí u 4 členů zmiňované rodiny (matky, postiženého chlapce, jeho mladšího sourozence a dědečka z matčiny strany) jsme našli mutaci v 1. intronu CTSC genu spojenou se záměnou nukleotidu A za T (rs217077) (obr. 7).
Obr. 5. Sekvenční analýza části 1. intronu u 3 členů rodiny pacienta s PLS. 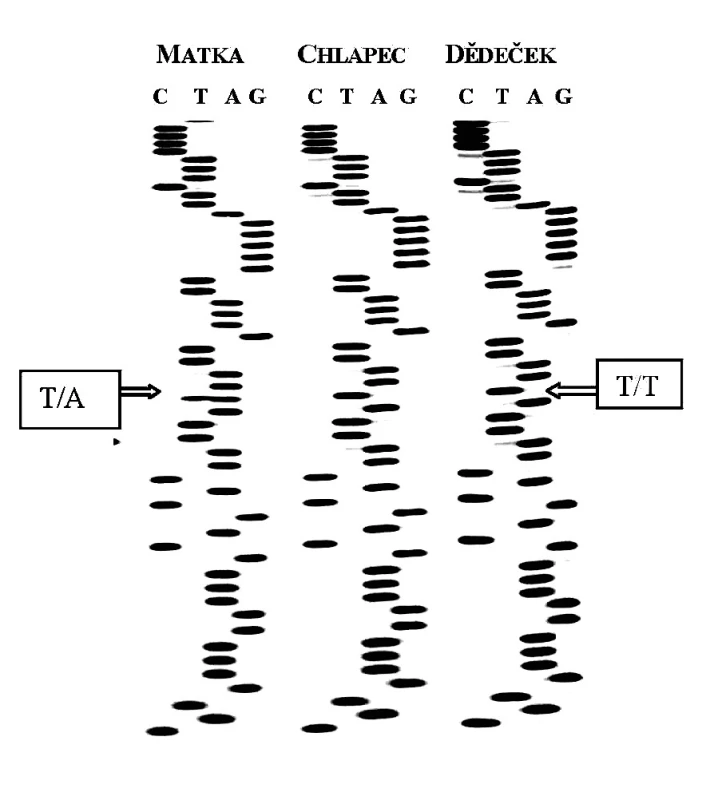
Tab. 1. Primery použité pro amplifikaci jednotlivých úseků CTSC genu. 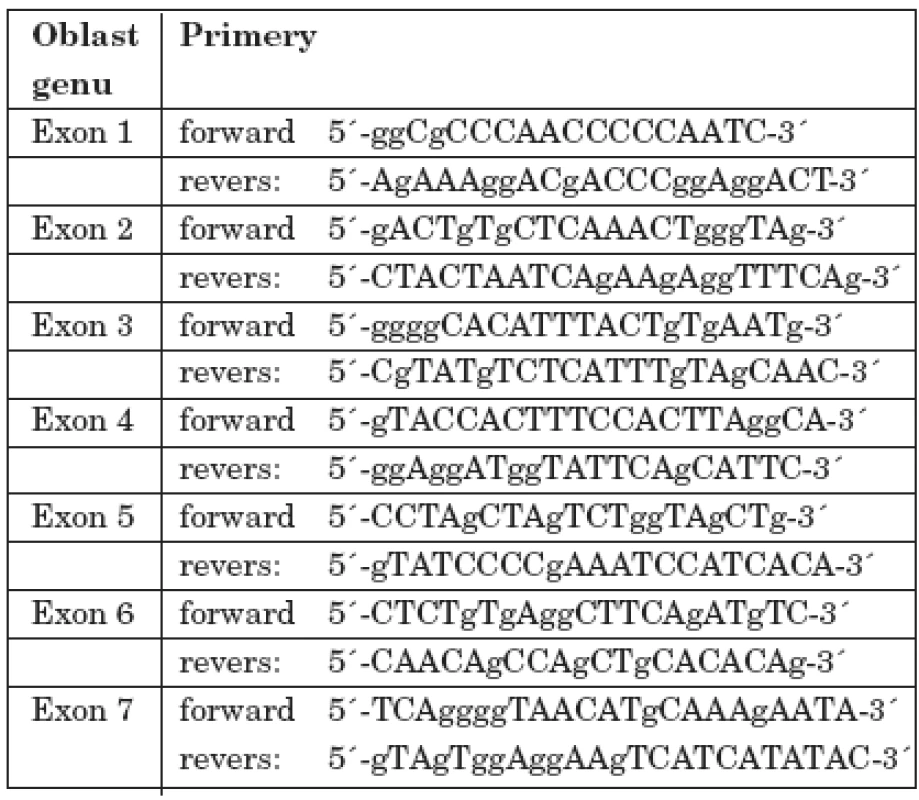
Postižený chlapec i jeho dědeček se stejnými klinickými příznaky palmoplantární hyperkeratózy (který měl dle anamnestických údajů časně totální protézy - pravděpodobně v důsledku ztráty zubů pro parodontitidu) byli homozygoty pro uvedenou mutaci v 1. intronu; oproti tomu matka bez klinických příznaků i mladší bratr byli pro tuto mutaci heterozygoty, což je v souladu s koncepcí AR dědičnosti u monogenních chorob. Vzhledem k tomu, že dosud neznáme funkční význam uvedené intronové varianty, je těžké se vyjádřit k „příčinnosti“ dané alely při rozvoji PLS u našeho pacienta. Provedené genetické vyšetření s nálezem mutace v genu pro CTSC při charakteristických klinických projevech onemocnění však podporuje diagnózu PLS u postiženého chlapce; naopak vzhledem k AR dědičnosti můžeme vyloučit rozvoj onemocnění u jeho mladšího bratra.
DISKUSE
V literatuře bylo dosud popsáno více než 200 případů onemocnění Papillon-Lefevre syndromem. Etiologie onemocnění není zcela pochopena, předpokládá se defekt genu pro katepsin C (CTSC, MIM# 602365) ležící v oblasti chromozomu 11q14-q21, jehož mutace (dosud popsáno více než 60 různých variant) byly u pacientů s PLS nalezeny v řadě populací [9-10, 26]. Mutace v CTSC genu byly identifikovány také u dvou úzce příbuzných chorob: Haim-Munkova syndromu (HMS) [11] a prepubertální agresivní parodontitidy (PAP) [3, 12-13, 17]. Běžným klinickým projevem všech těchto tří chorob je závažná, časně se rozvíjející parodontitida. HMS je však etnicky specifickým onemocněním vyskytujícím se pouze u Židů původem z Jižní Indie. Fenotyp HMS kromě parodontitidy zahrnuje vrozenou palmoplantární keratózu, onychogrypózu, pes planus, arachnodaktylii a akroosteolýzu. PAP je vzácnou formou agresivní parodontitidy postihující primární dentici, avšak s možným přechodem i na stálý chrup, která je spojena s předčasnou ztrátou zubů u dětí a mladých dospělých. Nejčastěji se manifestuje v rámci systémového onemocnění, vzácněji se může vyskytovat izolovaně a postihovat osoby jinak zdravé [25]. Nález mutací v genu pro CTSC u některých pacientů s PAP podporuje hypotézu, že část těchto nemocných může být fenotypovou variantou PLS.
Katepsin C patří do rodiny papainových endopeptidáz, podrodiny C1A. Je výrazně exprimován v buňkách imunitního systému, zejména polymorfonukleárních leukocytech a jejich prekurzorech, a dále v řadě epitelových tkání [21]. Gen pro katepsin (CTSC) je dlouhý více než 46 kb, je tvořen 7 exony a u osob s PLS jsou prokazovány mutace v přepisovaných i nepřepisovaných oblastech. Databáze OMIM (Online Mendelian Inheritance in Man) uvádí, že největší část těchto mutací jsou varianty pozměňující smysl (missens/non-sense mutation, v 71 % u pacientů s PLS), delece (20 %), inzerce (6 %) a změny ovlivňující sestřih (splicing mutation 3 %). Kauzální úloha CTSC mutací u Papillon-Lefevre syndromu byla potvrzena u většiny (přibližně 80 %), i když ne u všech případů onemocnění. Varianty spojené s PLS dramaticky redukují enzymovou aktivitu katepsinu C. Heterozygotní nosiči uvedených záměn mají přibližně 50% enzymatickou aktivitu oproti zdravým osobám, pacienti s oběma mutovanými alelami vykazují typicky méně než 10 % normální aktivity katepsinu C [26]. Mutace v CTSC genu mohou snižovat produkci serinových proteáz, např. katepsinu G (CTSG) a neutrofilní elastázy (NE) [1, 4, 20]. Tyto proteázy hrají významnou úlohu při regulaci vrozené imunitní odpovědi proti parodontálním patogenům [5, 20]. Recentní studie analyzující úlohu deficience CTSC u parodontitidy prokázaly, že kapacita polymorfonukleárních leukocytů neutralizovat leukotoxin a eliminovat Aggregatibacter actinomycetemcomitans (A.a.) byla u pacientů redukována [5]. Mikrobiologické studie potvrdily vyšší prevalenci A.a. u pacientů s PLS a naznačily významnou úlohu této bakterie pro rychlost progrese ztráty parodontálních tkání [27, 28]. Další práce potvrdily důležitou roli CTSC variant také pro funkci NK buněk (natural killer cells). Nižší cytotoxicita přirozených zabíječů byla zjištěna u parodontitidy spojené s PLS [15-16].
Tato práce je první genetickou studií Papillon-Lefevrova syndromu v české populaci. Analýza CTSC genu u pacienta i jeho dědečka s typickými klinickými projevy PLS prokázala záměnu T za A (rs217077) v 1. intronu, matka dítěte i nepostižený bratr byli pro tuto mutaci heterozygoty, což je v souladu s AR typem dědičnosti tohoto onemocnění. Naše výsledky tak potvrzují nálezy jiných autorů o významné úloze variant v genu pro CTSC u většiny pacientů s PLS, což svědčí pro nízkou genetickou heterogenitu tohoto onemocnění, spojenou naopak s vysokou alelickou heterogenitou [13, 18]. Oproti tomu jsou mutace v CTSC genu prokazatelné pouze u některých případů prepubertální agresivní parodontitidy, což potvrzuje hypotézu, že PAP je heterogenním onemocněním a jen někteří z pacientů mohou být fenotypovou variantou neúplně vyjádřeného PLS syndromu [18]. Mutační analýza genu pro CTSC by proto měla být provedena u všech dětí s agresivní formou parodontitidy pro upřesnění diagnózy onemocnění PLS.
ZÁVĚR
Závěrem lze říci, že výsledky většiny dosud publikovaných studií potvrzují důležitost analýzy genu pro CTSC pro diferenciální diagnostiku pacientů se suspektním PLS, zejména u nemocných s atypickým klinickým obrazem (např. izolovanou hyperkeratózou nebo parodontitidou – PAP, s pozdním nástupem či nezvykle mírným průběhem choroby apod.). PLS by měl být vyloučen u dětí/mladistvých s projevy závažné agresivní parodontitidy, postihující zejména dočasnou dentici, i přes to, že nález určitého typu mutace nebo její lokalizace v CTSC genu nelze využít pro predikci závažnosti progrese nebo úspěšnosti terapie tohoto onemocnění. To naznačuje možnou roli dalších přídatných genetických či environmentálních faktorů modifikujících fenotypovou variabilitu Papillon-Lefevre syndromu.
Práce je věnována k životnímu jubileu prof. MUDr. Jiřího Vaňka, CSc.
Poděkování
Práce vznikla za podpory grantu IGA MZ ČR č. NR9129-3/2006 a Stomatologického výzkumného centra 1M0528.
Prof. MUDr. Lydie Izakovičová Hollá, Ph.D.
Stomatologická klinika LF MU
a FN usv. Anny
Pekařská 53
656 91 Brno
e-mail: holla@med.muni.cz
Zdroje
1. Adkison, A. M., Raptis, S. Z., Kelley, D. G., Pham, C. T.: Dipeptidyl peptidase I activates neutrophil-derived serine proteases and regulates the development of acute experimental arthritis. J. Clin. Invest, 109, 2002, 3, s. 363-371.
2. Almuneef, M., Khenaizan, S., Al Ajaji, S., Al Anazi, A.: Pyogenic liver abscess and Papillon-Lefèvre syndrome: not a rare association. Pediatrics, 111, 2003, 1, s. e85-e88.
3. Cury, V. F., Gomez, R. S., Costa, J. E., Friedman, E., Boson, W., De Marco, L.: A homozygous cathepsin C mutation associated with Haim-Munk syndrome. Br. J. Dermatol, 152, 2005, 2, s. 353-356.
4. De Haar, S. F., Jansen, D. C., Schoenmaker, T., De Vree, H., Everts, V., Beertsen, W.: Loss-of-function mutations in cathepsin C in two families with Papillon-Lefevre syndrome are associated with deficiency of serine proteinases in PMNs. Hum Mutat, 23, 2004, 5, s. 524.
5. De Haar, S. F., Hiemstra, P. S., van Steenbergen, M. T., Everts, V., Beertsen, W.: Role of polymorphonuclear leukocyte-derived serine proteinases in defense against Actinobacillus actinomycetemcomitans. Infect Immun, 74, 2006, 9, s. 5284-5291.
6. De Vree, H., Steenackers, K., De Boever, J. A.: Periodontal treatment of rapid progressive periodontitis in 2 siblings with Papillon-Lefevre syndrome: 15-year follow-up. J. Clin. Periodontol, 27, 2000, 5, s. 354-360.
7. Gorlin, R. J., Sedano, H., Anderson, V. F.: The syndrome of palmar-plantar hyperkeratosis and premature periodontal destruction of the teeth. J. Pediatr., 65, 1964, s. 895-908.
8. Gorlin, R. J., Cohen, M. M., Levin, L. S.: Syndromes of the head and neck. Third edition. Oxford University Press, 1990, s. 853-855.
9. Hart, T. C., Hart, P. S., Bowden, D. W., Michalec, M. D., Callison, S. A., Walker, S. J., Zhang, Y., Firatli, E.: Mutation of the cathepsin C gene are responsible for Papillon-Lefèvre syndrome. J. Med. Genet., 36, 1999, 12, s. 881-887.
10. Hart, P. S., Zhang, Y., Firatli, E., Uygur, C., Lotfazar, M., Michalec, M. D., Marks, J. J., Lu, X., Coates, B. J., Seow, W. K., Marshall, R., Williams, D., Reed, J. B., Wright, J. T., Hart, T.C.: Identification of cathepsin C mutations in ethnically diverse Papillon-Lefevre syndrome patients. J. Med. Genet., 37, 2000, 12, s. 927-932.
11. Hart, T. C., Hart, P. S., Michalec, M. D., Zhang, Y., Firatli, E., Van Dyke, T. E., Stabholz, A., Zlatogorski, A., Shapira, L., Soskolne, W. A.: Haim-Munk syndrome and Papillon-Lefevre syndrome are allelic mutations in cathepsin C. J. Med. Genet., 37, 2000, 2, s. 88-94.
12. Hart, T. C., Hart, P. S., Michalec, M. D., Zhang, Y., Marazita, M. L., Cooper, M., Yassin, O. M., Nusier, M., Walker, S.: Localisation of a gene for prepubertal periodontitis to chromosome 11q14 and identification of a cathepsin C gene mutation. J. Med. Genet., 37, 2000, 2, s. 95-101.
13. Hewitt, C., McCormick, D., Linden, G., Turk, D., Stern, I., Wallace, I., Southern, L., Zhang, L., Howard, R., Bullon, P., Wong, M., Widmer, R., Gaffar, K. A., Awawdeh, L., Briqqs, J., Yaghmai, R., Jabs, E. W., Hoeger, P., Bleck, O., Rüdiger, S. G., Petersilka, G., Battino, M., Brett, P., Hattab, F., Al-Hamed, M., Sloan, P., Toomes, C., Dixon, M., James, J., Read, A. P., Thakker, N.: The role of cathepsin C in Papillon-Lefevre syndrome, prepubertal periodontitis, and aggressive periodontitis. Hum. Mutation, 23, 2004, 3, s. 222-228.
14. Laass, M. W., Hennies, H. C., Preis, S., Stevens, H. P., Jung, M., Leigh, I. M., Wienker, T. F., Reis, A.: Mapping of Papillon-Lefèvre syndrome to chromosome 11q14-q21 by homozygosity mapping. Hum. Genet., 101, 1997, 3, s. 376-382.
15. Lundgren, T., Parhar, R. S., Renvert, S., Tatakis, D. N.: Impaired cytotoxicity in Papillon-Lefèvre syndrome. J. Dent. Res., 84, 2005, 5, s. 414-417.
16. Meade, J. L., de Wynter, E. A., Brett, P., Sharif, S. M., Woods, C. G., Markham, A. F., Cook, G. P.: A family with Papillon-Lefevre syndrome reveals a requirement for cathepsin C in granzyme B activation and NK cell cytolytic activity. Blood, 107, 2006, s. 9, s. 3665-3668.
17. Noack, B., Görgens, H., Hoffmann T., Fanghänel, J., Kocher, T., Eickholz, P., Schackert, H. K.: Novel mutations in the cathepsin C gene in patients with pre-pubertal aggressive periodontitis and Papillon-Lefèvre syndrome. J. Dent. Res., 83, 2004, s. 5, s. 368-370.
18. Noack, B., Görgens, H., Schacher, B., Puklo, M., Eickholz, P., Hoffmann, T., Schackert, H. K.: Functional Cathepsin C mutations cause different Papillon-Lefèvre syndrome phenotypes. J. Clin. Periodontol, 35, 2008, 4, s. 311-316.
19. Papillon, M. M., Lefevre, P.: Deux cas de keratodermie palmaire et plantaire symetrique familiale (Maladie de Meleda) chez le frere et la soeur. Coexistence dans les deux cas d´alterations dentaires graves. Bull. Soc. Fr. Dermatos Syph., 31, 1924, s. 82-87.
20. Pham, C. T., Ivanovich, J. L., Raptis, S. Z., Zehnbauer, B., Ley, T. J.: Papillon-Lefevre syndrome: correlating the molecular, cellular, and clinical consequences of cathepsin C/dipeptidyl peptidase I deficiency in humans. J. Immunol., 173, 2004, 12, s. 7277-7281.
21. Rao, N. V., Rao, G. V., Hoidal. J. R.: Human dipeptidyl-peptidase I. Gene characterization, localization, and expression. J. Biol. Chem., 272, 1997, 15, s. 10260-10265.
22. Rüdiger, S., Petersilka, G., Flemmig, T. F.: Combined systemic and local antimicrobial therapy of periodontal disease in Papillon-Lefevre syndrome. J. Clin. Periodontol., 26, 1999, 12, s. 847-854.
23. Schacher, B., Baron, F., Ludwig, B., Valesky, E., Noack, B., Eickholz, P.: Periodontal therapy in siblings with Papillon-Lefevre syndrome and tinea capitis: a report of two cases. J. Clin. Periodontol., 33, 2006, 11, s. 829-836.
24. Selvaraju, V., Markandaya, M., Prasad, P. V., Sathyan, P., Sethuraman, G., Srivastava, S. C., Thakker, N., Kumar, A.: Mutation analysis of the cathepsin C gene in Indian families with Papillon-Lefèvre syndrome. BMC Med. Genet., 4, 2003, s. 5.
25. Tonetti, M. S., Mombelli, A.: Early-onset periodontitis. Ann. Periodontol., 4, 1999; 1, s. 39-53.
26. Toomes, C., James, J., Wood, A. J., Wu, C. L., McCormick, D., Lench, N., Hewitt, C., Moynihan, L., Roberts, E., Woods, S. G., Markham, A., Wong, M., Widmer, R., Ghaffar, K. A., Pemberton, M., Hussein, I. R., Temtamy, S. A., Davies, R., Read, A. P., Sloan, P., Dixon, M. J., Thakker, N. S.: Loss of function mutations in the cathepsin C gene result in periodontal disease and palmoplantar keratosis. Nat. Genet., 23, 1999, 4, s. 421-424.
27. Wara-Aswapati, N., Lertsirivorakul, J., Nagasawa, T., Kawashima, Y., Ishikawa, I.: Papillon-Lefèvre syndrome: serum immunoglobulins G (IgG) subclass antibody response to periodontopathic bacteria. A case-report. J. Periodontol., 72, 2001, 12, s. 1747-1754.
28. Wiebe, C. B., Häkkinen, L., Putnins, E. E., Walsh, P., Larjava, H. S.: Successful periodontal maintenance of a case with Papillon-Lefevre syndrome: 12-year follow-up and review of the literature. J. Periodontol., 72, 2001, 6, s. 824-830.
Štítky
Chirurgia maxilofaciálna Ortodoncia Stomatológia
Článok vyšiel v časopiseČeská stomatologie / Praktické zubní lékařství
Najčítanejšie tento týždeň
2009 Číslo 3
-
Všetky články tohto čísla
- Papillon-Lefevre syndrom (Kazuistika)
- Binární titan-tantalové slitiny a jejich biokompatibilita
- Autotransplantace zubů Systematický přehled
- Slinné markery pro onemocnění parodontu a dalších orgánů
- Biofyzikální mechanismy určující biokompatibilitu dentálních implantátů a podmiňující jejich oseointegraci
- Hojení patologických kostních dutin čelistí po augmentaci
- Vliv délky implantátu na jeho primární stabilitu
- Česká stomatologie / Praktické zubní lékařství
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Papillon-Lefevre syndrom (Kazuistika)
- Hojení patologických kostních dutin čelistí po augmentaci
- Autotransplantace zubů Systematický přehled
- Slinné markery pro onemocnění parodontu a dalších orgánů
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy