-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Exprese DD3PCA3 (Differential Display Code 3) mRNA ve tkáni prostaty u pacientů s karcinomem prostaty a benigní hyperplazií prostaty
Expresion of DD3PCA3 (Differential Display Code 3) mRNA in tissue of patients with prostate cancer and benign prostatic hyperplasia
Aim:
Early diagnosis of prostate cancer (PCa) in organ confined stage with following radical treatment are only potential currative approach in PCa. Prostatic specific antigen (PSA) is very helpful in early diagnosis, but the main disadvantage is a low positive predictive value, which results in a high number of uselless biopsies. For that reason we need new tests with better parameters. One promising is DD3PCA3, which is a prostate-specific non-coding mRNA that is highly over-expressed in prostate tumor cells. The aim of study was to evaluate diagnostic potential of DD3PCA3 for PCa diagnostic.Material and methods:
We examined altogether 186 patients. In group of patients with suspicion of PCa we collected one tissue specimen core for PCA3 espression in tissue. According to the histologically verification 100 patients with benign prostatic hyperplasia (BPH), and 86 patients with prostate cancer (12 patients from them had prostatic intraepithelial neoplasia (PIN)). Total RNA were isolated, PCA3 and PSA expression quantified using Q RT PCR method. The PCA3/PSA m RNA ratio distribution was determined for both subject groups.Results:
It was found that levels of mRNA expressions of DD3PCA3 (Ct) were significantly higher (p < 0.045) in patients with prostate cancer than in patients with benign prostatic hyperplasia. We found no statistically diferencies in patients with prostate cancer in levels of mRNA expressions of DD3PCA3 (Ct) between patients with organe confined and advanced (metastatic) dissease and according to Gleason score.Conclusion:
The specificity of mRNA DD3PCA3 detection seems to be perspective for early differential diagnosis between patients with BPH and patients with prostate cancer.Key words:
prostate cancer (CaP), benign prostatic hyperplasia (BPH), DD3PCA3, mRNA, RT PCR
Autoři: Jiří Klečka 1; Milan Hora 1; Luboš Holubec 3; Martin Pešta 2; Ondřej Topolčan 2; Viktor Eret 1; Magdalena Chottová-Dvořáková 4; Marko Babjuk 5; Květoslav Novák 5; Josef Stolz 5
Působiště autorů: Urologická klinika LF UK a FN, Plzeň 1; Centrální radioizotopová laboratoř LF UK, Plzeň 2; Radioterapeutické oddělení FN a LF UK Plzeň 3; Ústav fyziologie LF UK, Plzeň 4; Urologická klinika 1. LF UK a VFN, Praha 5
Vyšlo v časopise: Ces Urol 2010; 14(1): 39-47
Kategorie: Původní práce
Souhrn
Cíl:
Včasná diagnostika karcinomu prostaty (CaP) je zcela zásadní pro záchyt karcinomu omezeného jen na žlázu s možností následné kurabilní léčby. Prostatický specifický antigen (PSA) je velice dobrý prostředek pro včasnou diagnostiku, ale jeho nevýhodou je nízká pozitivní prediktivní hodnota, jejíž následkem je velké množství zbytečných biopsií. Z tohoto důvodu je potřeba vývoje nových specifičtějších detekčních testů. Jedním ze slibných testů je DD3PCA3, což je gen kódující pro prostatickou tkáň specifickou mRNA, která je výrazně exprimována ve tkáni CaP. Cílem prezentované práce je vyhodnocení diagnostického potenciálu DD3PCA3 v detekci CaP stanovením exprese mRNA tohoto genu ve tkáni prostaty u mužů s karcinomem prostaty a benigní hyperplazií prostaty.Materiál a metoda:
Celkem bylo vyšetřeno 186 pacientů. Ve skupině pacientů s podezřením na karcinom prostaty jsme v rámci biopsie prostaty odebrali vždy jeden vzorek na expresi DD3PCA3. Na základě histologického vyšetření byli pacienti rozděleni do skupiny s benigní hyperplazií prostaty, celkem 100 pacientů a 86 pacientů s prokázaným karcinomem prostaty (z tohoto počtu byla u 12 pacientů stanovena diagnóza prostatické intraepiteliální neoplazie (PIN)). Byla stanovena celková mRNA a kvantifikována celková exprese DD3PCA3 a PSA s užitím Q RT PCR metodiky. Poměr PCA3/PSA mRNA byl stanoven u obou skupin pacientů.Výsledky:
V rámci předložené studie bylo prokázáno, že hladiny exprese mRNA genu DD3PCA3 (Ct) (hodnoty Ct cyklu), ve kterém dojde ke křížení s přímkou nejnižšího prahu detekce tzv. thresholdu. Čím je hodnota nižší, tím vyšší je množství kopií) ve tkáni prostaty byly signifikantně vyšší (p < 0,045) u pacientů s CaP ve srovnání s pacienty s BPH. Nebyly prokázány signifikantní rozdíly v expresi mRNA pro gen DD3PCA3 (Ct) mezi skupinami pacientů v závislosti na pokročilosti onemocnění (lokální vs. lokálně pokročilý a metastatický CaP) a v závislosti na Gleasonově skóre (dobře až středně diferencovaný CaP vs. špatně diferencovaný karcinom).Závěr:
Specificita detekce mRNA DD3PCA3 ve tkáni je perspektivní metodikou pro detekci CaP a rozlišení pacientů s CaP a BPH.Klíčová slova:
karcinom prostaty (CaP), benigní hyperplazie prostaty (BPH), DD3PCA3, mRNA, RT PCR.Úvod
Karcinom prostaty (CaP) je druhou nejčastější příčinou úmrtí mužů na maligní onemocnění v západních zemích (l). Incidence CaP roste úměrně tomu, jak se zvyšuje průměrný věk obyvatel. V USA je CaP dokonce na prvním místě v četnosti karcinomů (vyjma skvamózního karcinomu kůže). V roce 2006 bylo v USA diagnostikováno 234 460 nových případů CaP a 27 350 amerických mužů zemřelo v přímé souvislosti s tímto onemocněním. V Evropě v roce 2005 bylo nově objeveno 225 227 pacientů s CaP a 83 066 nemocných na CaP zemřelo (2). V České republice bylo v roce 2005 diagnostikováno 4846 nových případů a 1430 mužů na tuto diagnózu zemřelo. Incidence CaP v tomto roce dosáhla 47,8 nových případů 100 000 osob a mortalita byla 13,95 úmrtí v přímé souvislosti na CaP na 100 000 osob. V roce 2005 se stal CaP i v České republice nejčastějším zhoubným nádorem (17 %) u mužů, když předstihl dříve vedoucí nádory plic (16 %) – viz obrázek a tabulka 1 (3).
Obr. a tab. 1. C61 – ZN předstojné žlázy – prostaty, muži (časový vývoj, incidence, mortalita) Fig. and Table 1. Prostate cancer – mens. Incidence in time, number of new cases 
Časná detekce CaP je založena na měření hladiny PSA (tPSA), digitálním rektálním vyšetření (DRE) s eventuální následnou biopsií prostaty v případě podezření na přítomnost CaP.
Specifický laboratorní test pro detekci CaP není dodnes k dispozici. Sérová hladina prostatického specifického antigenu je v klinické praxi používána již více jak 25 let. Nevýhodou stále zůstává relativně nezanedbatelná míra falešné negativity i pozitivity. Thompson a kolektiv ve své práci (4) konstatují, že neexistuje jasná hladina rozlišující pacienty s BPH od nemocných s CaP, a tudíž je CaP možné detekovat bez ohledu na hladinu PSA včetně hodnot pod 1 ng/ml. S rostoucím PSA se pouze zvyšuje pravděpodobnost zachycení CaP. Na druhou stranu existuje stále velká skupina mužů s vyšší hladinou PSA z jiných důvodů, než je CaP. Tito muži jsou ohroženi vznikem CaP stejně jako jejich vrstevníci v dané věkové skupině, ale tyto nemocné je třeba pečlivě monitorovat pomocí aditivních metodik, jako je PSA velocita (vývoj PSA v čase) nebo stanovení poměru volného k celkovému PSA (f/t PSA), nověji i PSA doubling time. Velká většina mužů s elevovaným PSA podstupuje další rebiopsie prostaty právě z důvodu diagnostické nepřesnosti interpretace hladin PSA (5). V případě, že snížíme horní hranici PSA 2,5 ng/ml, výrazně zvýšíme senzitivitu PSA až na 90 %, ale na druhé straně snížíme specificitu v oblasti „šedé zóny“ pod 25 % (6). Výsledkem je pak poměr 4/5, resp. pouze jeden pacient z pěti bioptovaný pro elevované PSA má pozitivní výsledek histologie. Jinými slovy, 80 % podstoupí biopsii zbytečně. Použití různých forem PSA, zavedení PSA denzity a PSA velocity sice vylepšilo specificitu, ale ne tak ideálně, jak bychom si přáli (7). To je důvod, proč současná lékařská věda hledá další markery detekce CaP. Jedná se jak o klasické biochemické markery, tak nově genově založené markery. Jedná se například PSMA, PC-GEM-1, HK-1 (Human Kalikrein-1), PDEF, prostáza, NKX3.1 nebo právě genově založený DD3PCA3 (differential displaycode 3) či stanovení exprese specifických mikro RNA.
DD3PCA3 je zkratka pro (Prostate Cancer Antigene 3, resp. Differential Display Code 3). Jedná se o gen, který je těsně a specificky svázán se vznikem CaP. Jeho funkce není dodnes objasněna a taktéž nebyl nalezen jeho proteinový produkt. Orgánová a nádorová specifičnost jej předurčují jako specifický marker pro CaP. Poprvé byl popsán Bussemarkersem et al. v roce 1999 (8). DD3PCA3 kóduje pro tkáň prostaty specifickou mRNA, která je zvýšeně exprimována právě v případě CaP (9). První zmínka o potenciálním využití DD3PCA3 jako možného markeru detekce CaP pochází z roku 2002 z práce publikované de Kokem et al. (10). Další práce hodnotící test mRNA pro DD3PCA3 gen využívají první generaci semikvantitativních esejí (9, 11, 12). První pro praxi v širším měřítku využitelná assay byla popsána Groskopfem. Tato DD3PCA3 assay vykazuje kvantifikaci kopií mRNA, dobrou senzitivitu a relativní rychlost a jednoduchost provedení laboratorního testu (13).
Exprese mRNA pro DD3PCA3 byla v prvních publikacích hodnocena především na tkáňové úrovni (10) a posléze v močovém sedimentu (9, 12), který se ukázal jako vhodný pro širokou klinickou praxi (13). Limitovaný je počet prací zkoumajících expresi DD3PCA3 v cirkulujících buňkách periferní krve (14). Výsledky těchto studií jsou v protikladu s orgánovou a pro karcinom prostaty specifickou expresí tohoto genu. Není vyloučeno, že do budoucna bude tato metodika vylepšena a bude sloužit k detekci cirkulujících karcinomových buněk v těle pacienta.
RT-PCR (Reverse transcription – Polymerase Chain Reaction) je nejlepší z různých metodik určených k detekci exprese různých genů v biologickém materiálu. Základem kvalitní a výpovědní RT-PCR je dostatek materiálu pro reakci, resp. dostatek tkáně nebo buněk z močového sedimentu. Během testovacího období daných metodik byl hledán tzv. „housekeeping“ gen, který slouží k normalizaci metodiky (housekeeping gen lze vysvětlit jak gen, který kontroluje původ buněk určených pro zpracování v rámci RT-PCR). Pro detekci exprese mRNA pro DD3PCA3 se používá jako „housekeeping“ genu gen pro PSA (15). Jednou z dalších možných metod kontroly je arteficiální přidání interní exogenní kontroly vzorku se pozornou a postupnou kontrolou RNA extrakce (12).
Přestože dodnes nebyl identifikován žádný gen jako iniciátor časné progrese, v současnosti pro detekci časných stadií nádorů prostaty se zdá být nejvhodnější gen DD3PCA3.
Materiál a metoda
Charakteristika souboru pacientů a způsob odběru tkáně
Celkem bylo vyšetřeno na Urologické klinice FN v Plzni a na Urologické klinice VFN v Praze 186 pacientů. Náběr biologického materiálu byl proveden v období květen 2006 až září 2008. Materiál byl odebírán u mužů podstupujících biopsii prostaty. Důvodem biopsie byla buď elevovaná hladina PSA, či patologický nález při DRE nebo obojí. Pacienti podstoupili transrektální biopsii prostaty s odběrem minimálně šesti vzorků.
Studie byla schválena lokální etickou komisí FN Plzeň a všichni pacienti podepsali informovaný souhlas. Pacienti po transuretrálních manipulacích, radioterapii prostaty, hormonálně léčení pacienti či pacienti s infekcí močových cest a zavedeným permanentním katétrem nebyli zařazeni do studie. Biopsie prostaty v minulosti nebyla vylučujícím faktorem. Průměrný věk pacientů byl 69,5 let (44 až 88 let). Hodnota tPSA se pohybovala od 4,1 do 580 ng/ml. Celkem 34 ze 186 pacientů mělo suspektní nález při DRE, 125 ze 186 pacientů podstoupilo svoji první biopsii.
Rozložení do skupin bylo následující: 86 pacientů s karcinomem prostaty, resp. průkazem prekancerózy (PIN) a 100 pacientů s histologicky prokázanou benigní hyperplazií prostaty. V rámci skupiny CaP bylo vyděleno 74 pacientů s prokázaným CaP a 12 pacientů s PIN. Ve skupině pacientů CaP mělo 44 nemocných tumor lokalizovaný jen na prostatickou žlázu a zbylých 30 pacientů vykazovalo známky lokálně pokročilého či metastatického postižení.
Ve skupině pacientů CaP mělo 44 nemocných tumor lokalizovaný jen na prostatickou žlázu a zbylých 30 pacientů vykazovalo známky lokálně pokročilého či metastatického postižení. Ve skupině pacientů CaP mělo 45 pacientů dobře až středně diferencovaný karcinom prostaty (Gleasonovo skóre do 6) a 29 pacientů bylo nositeli špatně diferencovaného agresivního CaP (Gleasonovo skóre 7–10).
Metodika zpracování
Metodika stanovení exprese genů DD3PCA3 a PSA v bioptických vzorcích tkáně prostaty
Pro získání informací o chování exprese genu DD3PCA3 při vývoji onemocnění karcinomem prostaty jsme se rozhodli stanovit hladiny exprese genů DD3PCA3 a PSA ve tkáňových vzorcích biopsie prostaty (jeden vzorek od každého pacienta) a následně porovnat hladiny exprese s klinickým stavem pacientů. Pro co nejpřesnější stanovení hladiny mRNA bylo důležité co nejrychlejší zamrazení vzorku po jeho odebrání. Vzorek tkáně pro stanovení exprese mRNA DD3PCA3 byl po odběru zmražen (bez jakékoliv chemické fixace) pokud možno v co nejkratším časovém intervalu minimálně na teplotu -20 °C, a to do doby transportu na místo definitivního zpracování (pracoviště Plzeň), kde byly vzorky uchovány při teplotě -70 °C. Transport vzorků z pražského pracoviště probíhal při teplotě -70 °C na suchém ledu. U většiny vzorků stanovení hladiny mRNA DD3PCA3 a PSA bylo možné.
Izolace RNA z bioptických vzorků tkáně prostaty
Izolace celkové RNA z bioptických vzorků probíhala tak, aby se zabránilo případné kontaminaci vzorků.
„Step by step metodika“:
- Ke vzoru tkáně cca. 5 mg bylo přidáno 0,5 ml RNA proTM Solution, MP Biomedicals, promíchali jsme po dobu 15 s.
- Dále bylo přidáno 0,1 ml chloroformu, promíchali jsme 15 s.
- Centrifugace 15 minut 14 000 otáček při teplotě 4 °C.
- Přenesli jsme vodní fázi do zkumavky eppendorfky.
- Přidali jsme 0,25 ml izopropanolu a zamíchali.
- Nechali 10 minut stát při pokojové teplotě.
- Následuje centrifugace 8 minut 14 000 otáček 4 °C a odebrání supernatantu.
- Přidali jsme 0,5 ml 75% etanolu a lehce vortexovali.
- Cenrifugovali jsme 5 minut 10 000 otáček 4 °C, slili a 10 minut sušili.
- Přidali 24 μl DPEC H2O a zamrazili na -70 °C.
Stanovení hladiny genů DD3PCA3 a PSA metodou real time PCR m RNA v tkáni prostaty
Použili jsme 12 μl vzorku celkové RNA do reverzní transkripce (RT). Reverzní transkripci jsme provedli pomocí enzymu Superscript III Reverse Transcriptase (Life Technologies, USA) Superscript III pracuje při vyšší teplotě (55 °C) než Superscript II, který jsme používali dříve, což je lepší pro vyšší výtěžnost reakce. Jako primer pro RT jsme použili oligo d(T)21. Sekvenci primerů pro DD3PCA3 a PSA jsme převzali z publikace Bussemakerse et al., Amplifikace pro DD3PCA3 však neprobíhala specificky, nezískali jsme produkt požadované délky 390 bp, proto jsme primery upravili a PCR již amplifikovala správný úsek – 390 bp. Sekvence upravených primerů pro DD3PCA3: forward primer: 5’-TGGTGGGAAGGACCTGATGATACAG - 3’ a reverse primer: 5’-TCTCCCAGGGATCTCTGTGCTTCC - 3’. Fragmenty získané PCR jsme inzertovali do vektoru pGEM (Promega Corporation, USA) a klonovali. Klonované fragmenty DD3PCA3 a PSA jsme použili jako standardy o známém počtu molekul. 1 μl cDNA každého vzorku jsme použili pro real-time PCR na přístroji Rotorgene (Corbet Research, Australia). Stanovení na tomto přístroji však neprobíhalo optimálně. Amplifikace proběhla pouze u malého počtu vzorků. Proto jsme přešli na novější přístroj na Ústavu fyziologie LF UK v Plzni, a to i Cycler od firmy BioRad. Metodika zde již fungovala správně. Stanovení DD3PCA3 jsme prováděli pomocí firemního mastermixu: SuperMix Biorad, stanovení PSA fungovalo lépe s mastermixem, jenž jsme připravili z jednotlivých chemikálií, s polymerázou Hot Star od firmy ABgene. Všem stanovením předcházeli optimalizace všech kroků, které máme spolu s protokoly jednotlivých stanovení uloženy.
Pro stanovení amplifikace DNA jsme použili barvu SYBR Green I. Specifitu reakce jsme ověřili pomocí teplotní křivky tání a elektroforézy. Stanovení jsme provedli jako absolutní (počet molekul cDNA) a jako standardy jsme použili klonované fragmenty cDNA.
Výsledky jsou uváděny jako:
- Hodnoty Ct – hodnoty cyklu, ve kterém dojde ke křížení s přímkou threshholdu (spodního prahu), čím je hodnota nižší, tím vyšší je množství kopií. Výsledky jsme hodnotili zvlášť pro DD3PCA3 (Ct) a PSA (Ct).
- Normalizované hodnoty – výsledky jsou uváděny jako poměr sledovaného genu a PSA (DD3PCA3/PSA).
Výsledky
Deskriptivní statistika souboru pacientů s karcinomem prostaty spolu s PIN a pacientů s pacientů s BPH je uvedena v tabulkách 2 a 3.
Tab. 1. Naměřené hodnoty exprese mRNA ve tkáni, skupina CaP a PIN Table 2. The values of DD3PCA3 and PSA mRNA expression in PCa and PIN 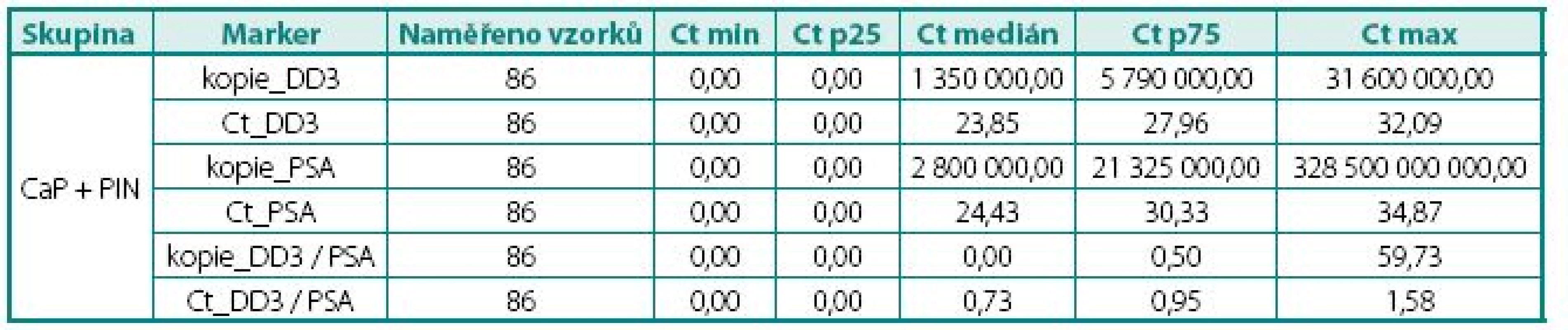
Ct – cross treshold, cyklus PCR, ve kterém došlo k měření exprese; čím menší hodnota, tím větší množství mRNA stanoveného genu Ct – value crossing threshold (Ct, lower Ct = higher number of copies) Tab. 2. Naměřené hodnoty exprese mRNA ve tkáni, skupina s BPH Table 3. The values of DD3PCA3 mRNA expression in BPH tissue 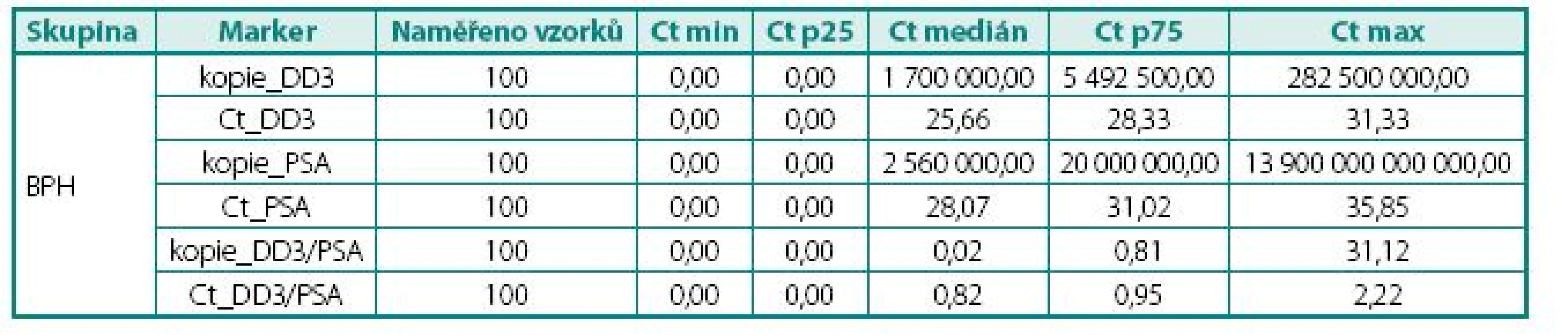
Prokázali jsme, že hladiny exprese mRNA pro DD3PCA3 (Ct) byly signifikantně vyšší (p < 0,045) v prostatické tkáni u pacientů s karcinomem prostaty než u pacientů s BPH (tab. 4). Při hodnocení výsledků jsme se zaměřili na míru exprese DD3PCA3 a PSA mRNA ve skupině pacientů s CaP ve vztahu k rozsahu onemocnění resp. TNM klasifikaci (na žlázu ohraničený CaP vs. pokročilý, resp. metastatický CaP). Zde jsme nenalezli statisticky významný rozdíl mezi těmito dvěma klinickými skupinami (tab. 5.) Zcela analogický závěr, tj. bez nálezu významného rozdílu, jsme učinili při porovnání dobře a středně diferencovaných karcinomů (Gleasonovo skóre do 6) vůči špatně diferencovaným (Gleasonovo skóre 7–10) (tab. 6.). Posledním hodnocením byl vztah míry exprese DD3PCA3 a PSA mRNA ve tkáni BPH a tkáni prostaty postižené PIN. Zde jsme zaznamenali statistickou signifikanci (p < 0,0141) mezi danými skupinami, ale překvapivě byla míra exprese mRNA pro DD3PCA3 (Ct) vyšší u pacientů s BPH oproti prekanceroze – PIN (tab. 7).
Tab. 3. Hodnoty DD3PCA3 a PSA mRNA exprese u pacientů s CaP a BPH Table 4. The values of DD3PCA3 and PSA mRNA expression in PCa and BPH tissue 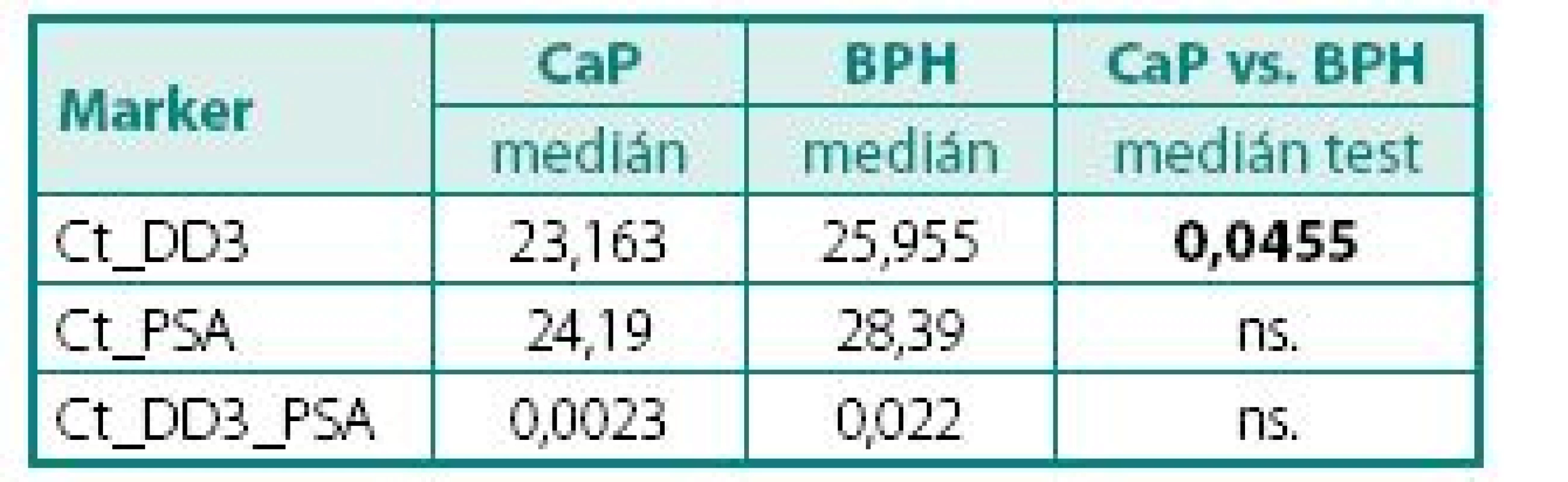
ns. – nesignifikantní Tab. 4. Hodnoty DD3PCA3 a PSA mRNA exprese ve skupině pacientů s CaP ve vztahu k TNM klasifikaci (orgánově lokalizovaný vs. orgánově pokročilý nebo metastatický karcinom) Table 5. The values of DD3PCA3 and PSA mRNA expression in group PCa according to TNM classification (organ confined vs. local advanced and metastatic PCa 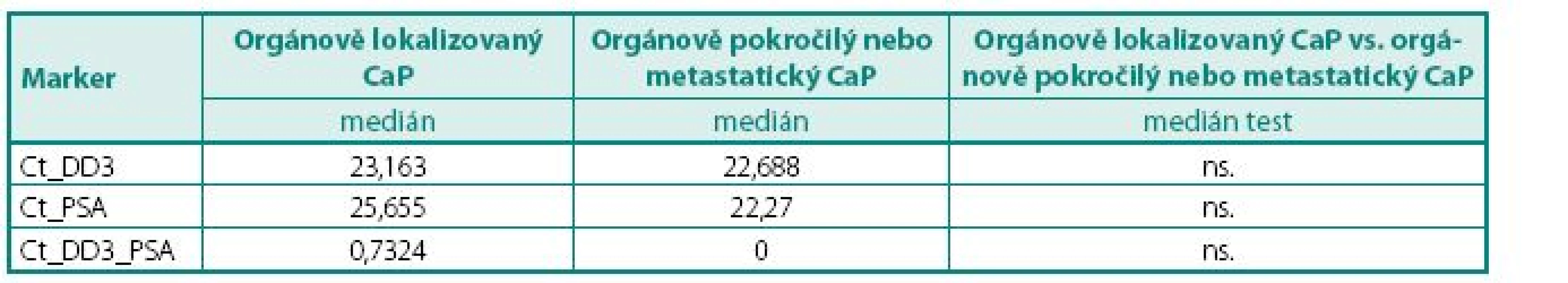
ns. – nesignifikantní Tab. 5. Hodnoty DD3PCA3 a PSA mRNA exprese ve skupině pacientů s CaP ve vztahu ke Gleasonovo skóre (nízce rizikový vs. vysoce rizikový CaP) Table 6. The values of DD3PCA3 and PSA mRNA expression in group PCa according to Gleason score (low risk vr. high risk) 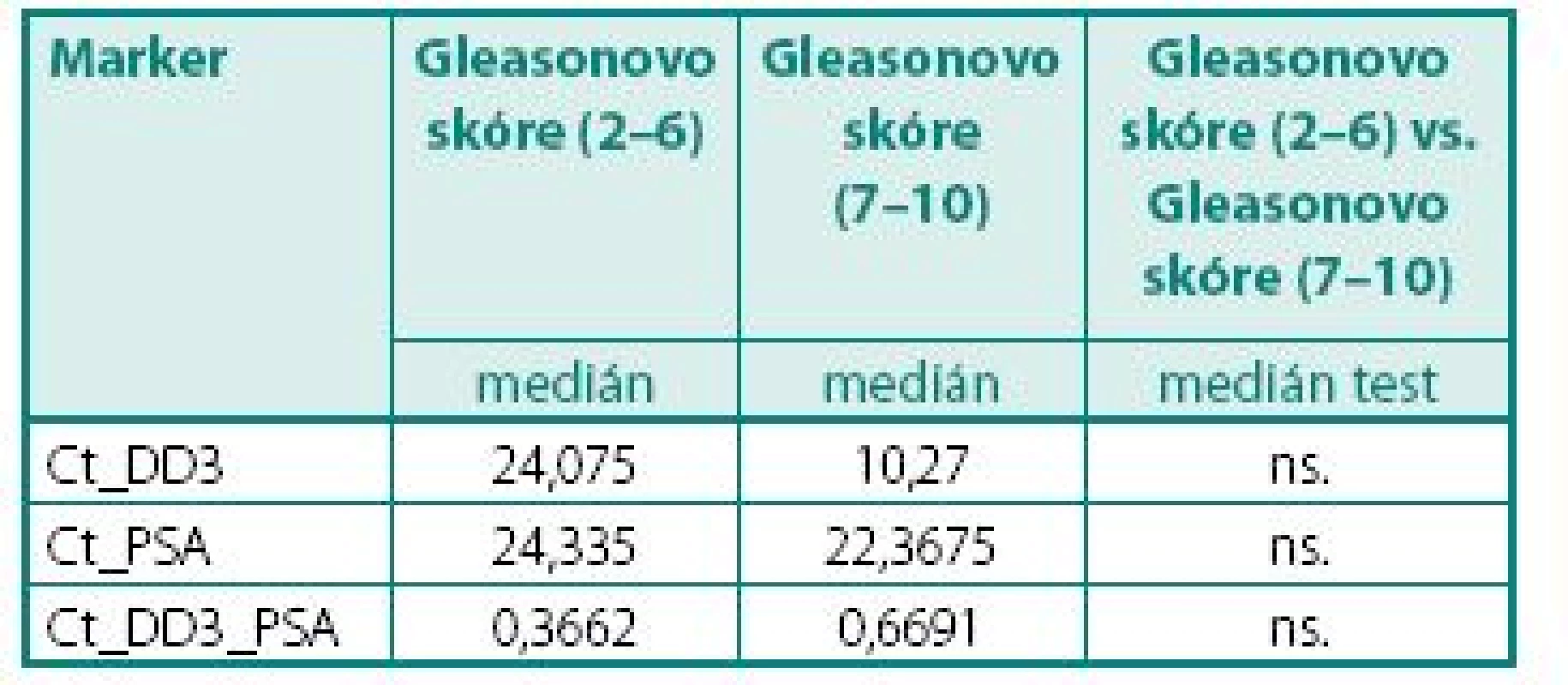
ns. – nesignifikantní Tab. 6. Hodnoty DD3PCA3 a PSA mRNA exprese u pacientů s BPH a PIN Table 7. The values of DD3PCA3 and PSA mRNA expression in BPH and PIN tissue 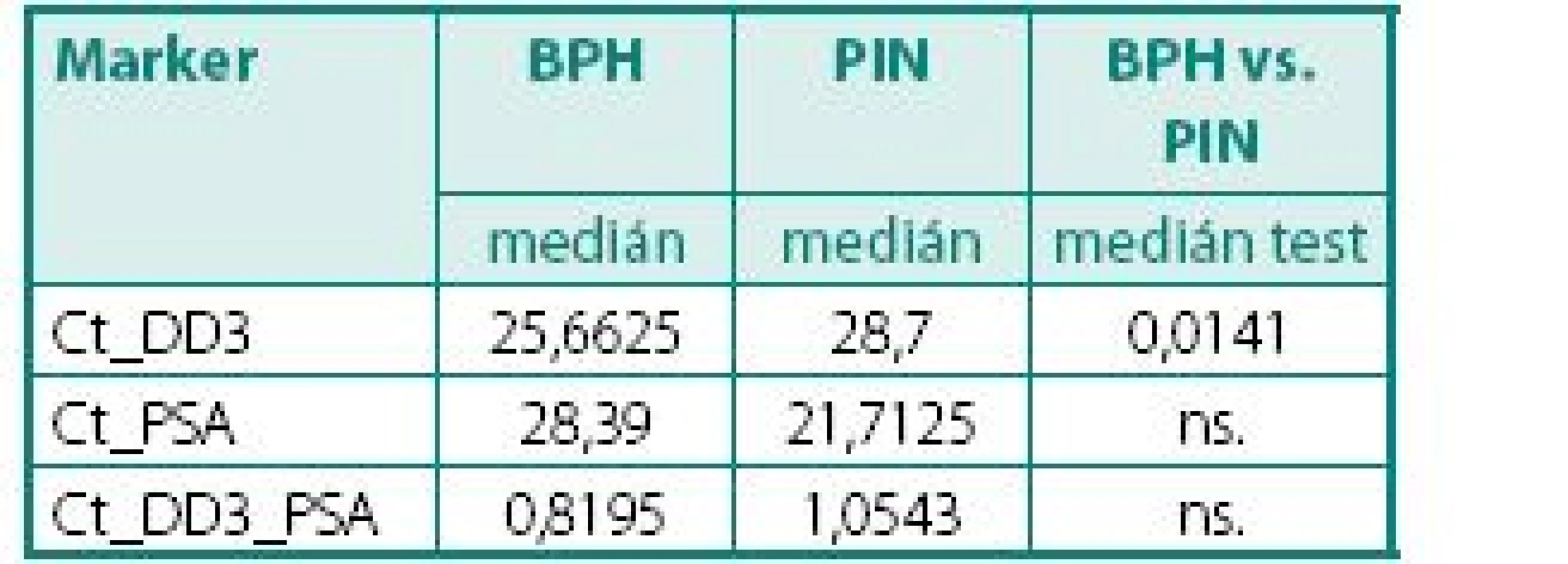
ns. – nesignifikantní Diskuse
Za účelem snížení mortality na karcinom prostaty bylo vyvinuto mnoho pomocných metodik, především z oblasti nádorových markerů. Tyto by měly vést k časné diagnostice karcinomu a jeho záchytu v kurabilních stadiích. Zhruba před dvaceti lety bylo do klinické praxe uvedeno stanovení PSA, které je doposud považováno za účinný nástroj pro detekci CaP a monitorování léčby (16). PSA je sice orgánově specifický marker, ale není specifický pro daná onemocnění. Elevace PSA může být dána jak přítomností CaP ve žláze, ale stejně také může být vyšší u pacientů s BPH či zánětem prostaty. Právě toto je limitujícím faktorem pro přesnou detekci CaP. CaP byl v roce 2006 diagnostikován zhruba u 230 000 amerických mužů (2). Většina těchto mužů byla indikována k biopsii ne pro suspektní per rectum nález či patologický sonografický obraz, ale především pro vyšší hladinu PSA. Podle závěrů Americké urologické asociace (AUA) (17) dosahuje PSA u mužů v sedmém deceniu při cut off 4,0 ng/ml 24% pozitivní prediktivní hodnotu (18). Jinými slovy, v roce 2006 podstoupilo v USA biopsii prostaty cca jeden milion mužů, ale karcinom prostaty byl diagnostikován jen u jedné čtvrtiny z nich. Dalším neopominutelným faktem je, že pacienti s negativní biopsií prostaty a přetrvávající elevací PSA mají stále 25% pravděpodobnost, že CaP nebyl v biopsii zachycen a oni zůstali nediagnostikováni a budou muset podstoupit další biopsii (19). Tento fakt se samozřejmě týká i skupiny našich pacientů. I zde ve skupině pacientů zařazených jako benigní hyperplazie prostaty se budou nacházet nemocní s nediagnostikovaným CaP. Jediný způsob jak tuto „nepřesnost“ vyloučit je stanovování exprese mRNA DD3PCA3 ze vzorků tkáně prostaty po radikální prostatektomii. Toto však v rámci designu naší studie nebylo proveditelné.
Nové postupy a objevy v molekulárních technologiích se snaží obejít právě tato zmíněná úskalí PSA a zlepšit časnou diagnostiku CaP. Jako biologický materiál se používá jak krevní sérum, tak v poslední době i moč, která obsahuje prostatické buňky uvolněné do moči po masáži prostaty (20–21). Další možností je použití tkáňových vzorků. Namátkou dovolte jmenovat (vyjma dále zmíněného DD3PCA3) GSTP1 hypermetylaci, která dosahuje specificity 98% a senzitivity 73%. Patologická telomerázová aktivita je vyjádřena minimálně u 90 % CaP (22–23).
Metodika stanovení DD3PCA3, jak byla popsána v naší i ostatních publikacích, podléhá vývoji. Vzhledem k tomu, že prostatické buňky pocházející z normální žlázy či prostaty postižené BPH vykazují nízkou expresi DD3PCA3, používáme pro prezentaci výsledků počet kopií DD3PCA3 s přepočtem na počet kopií mRNA pro PSA. Stejně jako u prostatických buněk získaných z moči postupujeme u tkáňových vzorků, které sice již pocházejí z biopsií prostat, ale je zde prakticky anulováno riziko nedostatku buněčného materiálu, jak se setkáváme u vzorků moče.
RT-PCR (Real Time – Polymerase Chain Reaction) pro DD3PCA3 je kvantitativní assay, vyvinuta na základě principů té samé metodiky jako pro PSA mRNA tak, jak ji popsali Ylikosky et al. (24). Výsledky přesné kvantifikace pro DD3PCA3 transkripty v normálních vzorcích tkáně vykazují striktní orgánovou specifitu, tj., exprese DD3PCA3 je možná jen v tkáni prostaty. Toto je v souladu s dříve publikovanými daty a přesná kvantifikace poukazuje na zvýšenou regulaci v tkáni karcinomu prostaty. Ve vzorcích prostat po radikálních prostatektomiích byla srovnávána exprese DD3PCA3 ve tkáni tumoru a přilehlé „normální“ tkáni prostaty s nálezem 6 až 1500násobné zvýšené regulace DD3PCA3 ve tkáni postižené tumorem. Taktéž výsledky získané Northern blotovou analýzou (8) vykazují medián 66násobné zvýšené regulace DD3PCA3 ve tkáni postižené karcinomem. Tato data zcela korespondují s námi dosaženými výsledky. V naší skupině čítající 186 pacientů jsme prokázali statisticky vyšší míru exprese mRNA pro DD3PCA3 ve skupině pacientů s CaP oproti skupině pacientů s BPH. Dalším pozorováním a měřením jsme zjistili statisticky vyšší míru exprese mRNA pro DD3PCA3 ve skupině pacientů s CaP oproti skupině nemocných s prekancerózou (PIN). Paradoxní nález vyšší exprese mRNA pro DD3PCA3 jsme zjistili u pacientů s BPH ve srovnání nemocných s PIN (viz výsledky). Jedním z vysvětlení těchto nálezů by mohla být disproporce ve velikosti skupin pacientů s BPH a PIN. Skupina pacientů s PIN se sestávala jen ze 12 pacientů. S ohledem na biologicky neobjasněnou funkci DD3 genu je těžké odhadnout, zda-li existuje vztah mezi mírou exprese mRNA pro DD3PCA3 a rozsahem a biologickým charakterem CaP. Na základě našich závěrů nemůžeme toto potvrdit. Ve skupině našich pacientů jsme neprokázali statisticky významné rozdíly.
Velice často je v literatuře zmiňované stanovení exprese mRNA DD3 genu z prostatických buněk uvolněných do moče, byť toto nebylo náplní našeho sdělení. Na tomto místě je vhodné zmínit v literatuře publikovaná data týkající se senzitivity, specificity a prediktivní hodnoty. Meid et al. ve své práci na souboru 108 pacientů demonstruje 100% specificitu testu (25). Hessels et al. docílil 67% senzitivity při 83% specificitě (9).
Fraded et al. vyhodnotil 517 vzorků moče z pěti center v Kanadě a dospěl k 66% senzitivitě při 89% specificitě s 75% pozitivní prediktivní hodnotou (26). Žádná z dosud publikovaných prací hlouběji nehodnotí vztah exprese mRNA DD3PCA3 vůči rozsahu tumoru a jeho biologické aktivitě. Fraded et al. (26) se ve své práci zabývá preanalytickým hodnocením vzorků a dochází k závěru, že až 86 % všech vzorků moče má ovlivněnou kvalitu díky dlouhodobému skladování a opožděnému transportu do laboratoře. Výsledky lze zlepšit nejen urychlením procesu zpracování, ale také použitím speciálních zkumavek s nesmáčivým povrchem. Tyto jsme bohužel neměli k dispozici. Opomenout nelze ani techniku masáže prostaty, kterou jsme taktéž prodloužili, což vedlo ke zlepšení výtěžnosti prostatických buněk z moče. K ovlivnění výsledku může dojít kontaminací moče erytrocyty či seminální tekutinou.
Vzhledem k těmto limitacím bylo uvažováno o „agresivnějších“ metodách získávání biologického materiálu jako detekce prostatických buněk z ejakulátu či po výplachu močové trubice (26), ale ani toto nepřineslo zlepšení v objemu detekovaných buněk a jako optimální metoda je dnes doporučen odběr prvních 20–50 ml moče po masáži prostaty. Poslední teorií byla teze, že malé tumory uvolňují menší počet buněk. Ani pro tento předpoklad nebyla nalezena opora, což ve své práci publikuje Meid et al. (25), kde srovnává T1c tumory s T3 tumory bez nálezu signifikantního rozdílu.
Závěr
V rámci publikované studie podpořené grantem IGA NR/8918-3 a výzkumným záměrem MSM 0021620819 jsme zjistili, že exprese genu DD3PCA3 ve tkáni prostaty odebrané při biopsii je statisticky signifikantně vyšší u tkáně postižené karcinomem než u pacientů s BPH. Tento nález s ohledem na orgánovou specificitu DD3PCA3 v kombinaci se stanovením hladiny PSA může zpřesnit indikaci, časnou diagnostiku karcinomu prostaty a v neposlední řadě pomoci v rozhodovacím algorytmu rebiopsií prostaty. V současnosti je v praxi již zavedena standardní komerční metodika detekce mRNA DD3PCA3 z prostatických buněk uvolněných do moči (GenProbe®). Detekce DD3PCA3 z moče je samozřejmě méně invazivní metodika ve srovnání s tkáňovým stanovením, ale naráží na problematiku nedostatečného množství biologického materiálu k RT PCR. Jak již bylo zmíněno, korelace mezi hladinou PSA a expresí DD3PCA3 je potenciálně využitelná k časné indikace rebiopsií u pacientů s histologicky negativním nálezem a zvýšenou expresí DD3PCA3 ve tkáni odebraného vzorku při přetrvávající elevaci PSA a naopak.
Došlo: 4. 4. 2009.
Přijato: 20. 10. 2009.
Kontaktní adresa
MUDr. Jiří Klečka, Ph.D.
Urologická klinika FN a LF UK
E. Beneše 13,
305 99 Plzeň
e-mail: kleckaj@fnplzen.cz
Tato práce byla podpořena grantem IGA NR/8918-3 a výzkumným záměrem MSM 0021620819 náhrada a podpora funkce některých životně důležitých orgánů.
Zdroje
1. Landis SH, Murray T, Bolden S, Wingo PA. Cancer statistics, 1999. CA Cancer J Clin 1999; 49(1): 8–31.
2. Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2006. CA Cancer J Clin 2006; 56 : 106–130.
3. SVOD (System for Visualization of Oncological Dates version 6); http: //www.svod. cz/analyse.php?modul=incmor#
4. Thompson IM, Ankerst DP, Chi C, et al. Operating characteristics of prostate–specific antigen in men with an initiai PSA level of 3.0 ng/ml or lower. JAMA 294 : 66–70, 2005.
5. Stamey TA, Caldwell M, McNeal JE, et al. The prostate specitic antigen era in the United States is over for prostate cancer: what happened in the last 20 years? J Urol 2004; 172 : 1297–1301.
6. Karazanashivili G, Abrahamsson PA. Prostate specific antigen and human glandular kallikrein 2 in early detection of prostate cancer. J Urol 2003; 169 : 445–457.
7. Punglia RS, D’Amico AV, Catalona WJ, Roehl KA, Kuntz KM. Effect of verification bias on screening for prostate cancer by measurement of prostate-specific antigen. N Engl J Med 2003; 46 : 307–310.
8. Bussemakers MJ, van Bokhoven A, Verhaegh GW, et al. DD3: a new prostate-specific gene, highly overexpressed in prostate cancer. Cancer Res 1999; 59 : 5975–5979.
9. Hessels D, Klein Gunnewiek JM, et al: DD3(PCA3)-based molecular urine analysis for the diagnosis of prostate cancer. Eur Urol 2003; 44 : 8–16.
10. de Kok JB, Verhaegh GW, Roelofs RW, et al. DD3(PCA3), a very sensitive and specific marker to detect prostate tumors. Cancer Res 2002; 62 : 2695–2698.
11. Fradet Y, Saad F, Aprikian A, et al. uPM3, a new molecular urine test for the detection of prostate cancer. Urology 2004; 64 : 311–316.
12. Tinzl M, Marberger M, Horvath S, et al. DD3/PCA3 RNA analysis in urine a new perspective for detecting prostate cancer. Eur Urol 2004; 46 : 182–187.
13. Groskopf J, Auhin SMJ, Deras IL, et al. APTIMA PCA3 molecular urine test: development of a method to aid in the diagnosis of prostate cancer. Clin Chem 2006; 52 : 1089–1095.
14. Marangoni K, Neves AF, Cardoso AM, Santos WK, Faria PC, Goulart LR. The endothelial nitric oxide synthase Glu-298-Asp polymorphism and its mRNA expression in the peripheral blood of patients with prostate cancer and benign prostatic hyperplasia. Cancer Detect Prev 2006; 30 : 7–13.
15. Huggett J, Dheda K, Bustin S, Zumla A. Real time RT-PCR normalisation; strategics and considerations. Genes Immun 2005; 6 : 279–284.
16. Polascik TJ, Oesterling JE, Partin AW, et al. Prostate specific antigen: a decade of discovery what we have learned and where we are gomg. J Urol 1999; 162(2): 293–306.
17. Thompson IM, Carroll P, Coley C, et al. Prostate-specific antigen (PSA) best pracrice policy. Oncology 2000; 14 : 267–286.
18. Vollmer RT. Predictive probability of serum prostate specific antigen for prostate cancer: an approach using Bayes rule. Am J Clin Pathol 2006; 125 : 336–342.
19. Roehl KA, Antenor JA and Catalona WJ. Serial biopsy results in prostate cancer screening study. J Urol 2002; 167 : 2435–2439.
20. Clements JA, Rhode P, Allen V, Hyland VJ, Samaratunga ML. Tillev WD, et al. Molecular detection of prostate cells in ejaculate and urethral washings of men with suspected prostate cancer. J Urol 1999; 161 : 1337–1342.
21. Muller M, Goessl C, Krause H, Miller K. Molecular diagnostics in urologie oncology. Detection of nucleic acids in urine samples. Urologe A 2003; 42 : 660–668.
22. Goessl C, Muller M, Heicappell R, Krause H, Straub B. Schrader M, et al. DNA-based detection of prostate cancer in urine after prostatic massage. Urology 2001; 58 : 335–338.
23. Cairns P, Esteller M, Hermann JG, Schoenberg M, Jeronimo C. Sanchez-Cespedes M, et al. Molecular detection of prostate cancer in urine by GSTP1 hypermethylation. Clin Cancer Res 2001; 7 : 2727–2730.
24. Ylikoski A, Karp M, Lilja H, Lovgren T. Dual-label detection of amplified products in quantitative RT-PCR assay using lanthanide-labeled probes. Biotechniques 2001; 30(4): 832–836.
25. Meid FH, Gygi CM, Leisingcr HJ, Bosman FT, Benhattar J. The use of telomerase activity for the detection of prostatic cancer cel1s after prostatic massage. J Urol 2001; 165 : 1802–1805.
26. Fradet Y. Saad F, Aprikian A, Dessureault J. Elhilali M. Trudel C, Masse B, Piche L, Chypre C. uPM3, a new molecular urine test for the detection of prostate cancer. Urology 2006; 21 : 560–564.
Štítky
Detská urológia Nefrológia Urológia
Článek Editorial
Článok vyšiel v časopiseČeská urologie
Najčítanejšie tento týždeň
2010 Číslo 1- Aktuálne európske odporúčania pre liečbu renálnej koliky v dôsledku urolitiázy
- MUDr. Šimon Kozák: V algeziológii nič nefunguje zázračne cez noc! Je dôležité nechať si poradiť od špecialistov
- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Incidence, diagnostika a léčba karcinomu prostaty u HIV pozitivních pacientů
- Evoluce operační techniky laparoskopické resekce nádorů ledvin
- Editorial
- Laparoskopická nefropexe – technika pomocí tří nevstřebatelných stehů
- Exprese DD3PCA3 (Differential Display Code 3) mRNA ve tkáni prostaty u pacientů s karcinomem prostaty a benigní hyperplazií prostaty
- Agresivní karcinom prostaty u pacientů s nízkým PSA
- Pheochromocytoma and paraganglioma syndromes: going on 2010
- Anatomické aspekty chirurgické konverze pohlaví u pacientek s male-to-female transsexualismem – výsledky hodnocené tři měsíce po výkonu
- Doc. MUDr. Ivan Kawaciuk, CSc. – laudace k udělení Medaile prof. MUDr. Eduarda Hradce, DrSc.
- Prof. MUDr. Eduard Hradec, DrSc. – zakladatel moderní české urologie
- Slovo na závěr 55. konference ČUS
- Česká urologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Agresivní karcinom prostaty u pacientů s nízkým PSA
- Anatomické aspekty chirurgické konverze pohlaví u pacientek s male-to-female transsexualismem – výsledky hodnocené tři měsíce po výkonu
- Laparoskopická nefropexe – technika pomocí tří nevstřebatelných stehů
- Prof. MUDr. Eduard Hradec, DrSc. – zakladatel moderní české urologie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




