-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Řešení urolitiázy v transplantované ledvině perkutánní nefrolitotrypsí
Percutaneous nephrolithotomy in transplanted kidney – a case report
We present a case report of a patient with an asymptomatic kidney stone, which was diagnosed postoperatively after cadaveric kidney transplantation due to chronic renal failure. Intervention became necessary when dislocation of the stone into the pelviureteral junction caused anuria due to kidney obstruction. A DJ stent was inserted cystoscopically followed by percutaneous stone extraction. Perioperatively and postoperatively there were no complications. Post procedure the patient was in good health and laboratory test had normalized. In addition to shock-wave lithotrypsy and ureteroscopy, percutaneous treatment of concrements in a transplanted kidney is an effective and save treatment option.
Key words:
kidney transplantation, urolithiasis, complication, treatment.
Autori: Král 1; David Hradil 1; Břetislav Brázda 1; Jaroslav Pernička 1; Karel Krejčí 2; Josef Zadražil 2; Vladimír Študent 1
Pôsobisko autorov: Urologická klinika LF UP a FN, Olomouc 1; III. interní klinika LF UP a FN, Olomouc 2
Vyšlo v časopise: Ces Urol 2012; 16(3): 180-183
Kategória: Kazuistika
Súhrn
Prezentujeme případ pacienta po transplantaci kadaverózní ledviny pro chronické renální selhání, u kterého byla pooperačně diagnostikována klidová nefrolitiáza štěpu. Důvodem intervence byla náhle vzniklá obstrukční anurie při dislokaci konkrementu do pelviureterální junkce. Přechodně byla derivace moči řešena retrográdně zavedeným DJ stentem a následně byl pacient indikován k perkutánní extrakci kamene. Peroperační i pooperační průběh byl bez komplikací, s příznivým biochemickým i klinickým nálezem. Perkutánní řešení urolitiázy u transplantovaných ledvin je vedle extrakorporální litotrypse a ureteroskopie účinnou a šetrnou možností léčby.
Klíčová slova:
transplantace ledviny, urolitiáza, komplikace, léčba.Kazuistika
V předkládané kazuistice prezentujeme případ mladého muže, který byl v roce 1996 ve svých 22 letech kompletně urologicky vyšetřen pro mikrohematurii (USG a cystoskopie s negativním nálezem) a následně byl předán do péče nefrologům, kam však na kontroly nedocházel. Nově byl vyšetřen až po dalších 3 letech, kdy již byla diagnostikována pokročilá chronická renální insuficience (CHRI). Biopsie prokázala chronickou proliferativní glomerulonefritidu ve stadiu end stage kidney. I přes následnou léčbu kortikoidy při současné renoparenchymové hypertenzi došlo k progresi CHRI do terminálního selhání, které bylo řešeno pravidelnými hemodialýzami. V červenci 2004 byla provedena transplantace kadaverózní ledviny do pravé jámy kyčelní (technikou Lich-Gregoir), s nekomplikovaným pooperačním průběhem a s okamžitým nástupem funkce štěpu. Již časně po výkonu v rámci běžné sonografické kontroly byl diagnostikován 8 mm velký konkrement v pánvičce tranplantované ledviny. S ohledem na velikost nefrolitiázy byl doporučen konzervativní postup s plánem extrakorporální litotrypse (LERV) s odstupem. Diuréza byla 3000 ml/den, přičemž kreatinin kolísal mezi 230–280 µmol/l.
Na naše pracoviště byl pacient odeslán po více než 6 letech od transplantace z důvodu řešení náhle vzniklé anurie při jinak zcela normálním klinickém nálezu, kdy došlo k progresi kreatininémie na 660 µmol/l. Na USG byla prokázána významná dilatace kalichopánvičkového systému transplantované ledviny s nálezem litiázy v pelviureterální junkci. Nativní spirální CT potvrdilo konkrement 13 mm jako jedinou příčinu obstrukce ledviny, bez další litiázy v ureteru, který měl v proximálním úseku významný kinking (obr. 1). Indikovaná drenáž tranplantované ledviny se podařila retrográdně zavedením DJ stentu (6 charr, 12 cm). Inzercí stentu byla litiáza relokována do ledviny a následně došlo k promptní úpravě renálních funkcí i diurézy (po stabilizaci byla kreatininémie 239 µmol/l). Po probrání léčebných možností (LERV, flexibilní ureterorenoskopie a perkutánní extrakce kamene – PEK) jsme indikovali perkutánní operační řešení.
Obr. 1. Nativní spirální CT transplantované ledviny s litiázou v pelviureterální junkci Fig. 1. Native spiral CT scan of tranplanted kidney with stone in ureteropelvic junction 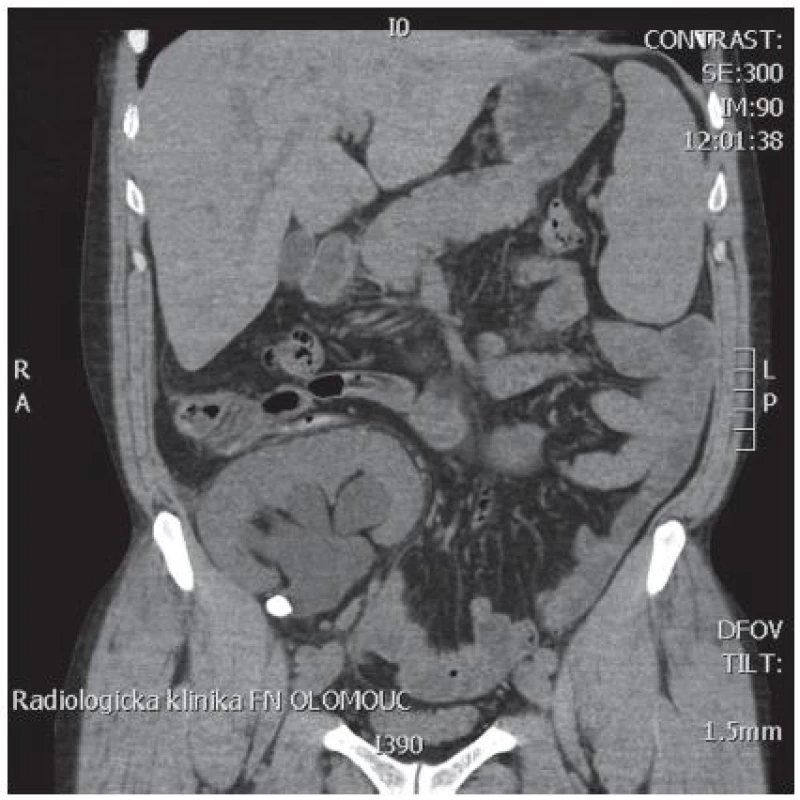
V celkové anestezii byla provedena nejprve extrakce DJ stentu a do reimplantovaného močovodu byla zavedena ureterální cévka. Následně byla pod sonografickou a skiaskopickou kontrolou provedena zvykle punkce dolním kalichem a dilatace punkčního kanálu teleskopickými dilatátory do 24 charr. Nefroskopicky byl nalezen oválný, šedožlutavý kámen, sonotrodou fragmentován a extrahován (měkký obal a tvrdé jádro konkrementu). Doplněná flexibilní nefroskopie neprokázala případnou reziduální nefrolitiázu. Výkon byl ukončen založením pigtailové nefrostomie 18 charr a infiltrační anestezií okolí punkčního kanálu 0,5 % bupivacainem. Pooperační nefrostomogram (obr. 2) potvrdil kompletní odstranění litiázy s volným odtokem kontrastní látky do měchýře. Následně byla nefrostomie uzavřena a extrahována. Rána po nefrostomii se zhojila primárně, pooperační renální funkce zůstaly na předoperační úrovni (kreatinin 238 µmol/l) při diuréze 2500–3000 ml. Rozbor kamene prokázal 95 % whewellit, 5 % apatit. Pacient je dále sledován na nefrologii se stabilní funkcí štěpu.
Obr. 2. Pooperační nefrostomogram Fig. 2. Postoperative nephrostomogram 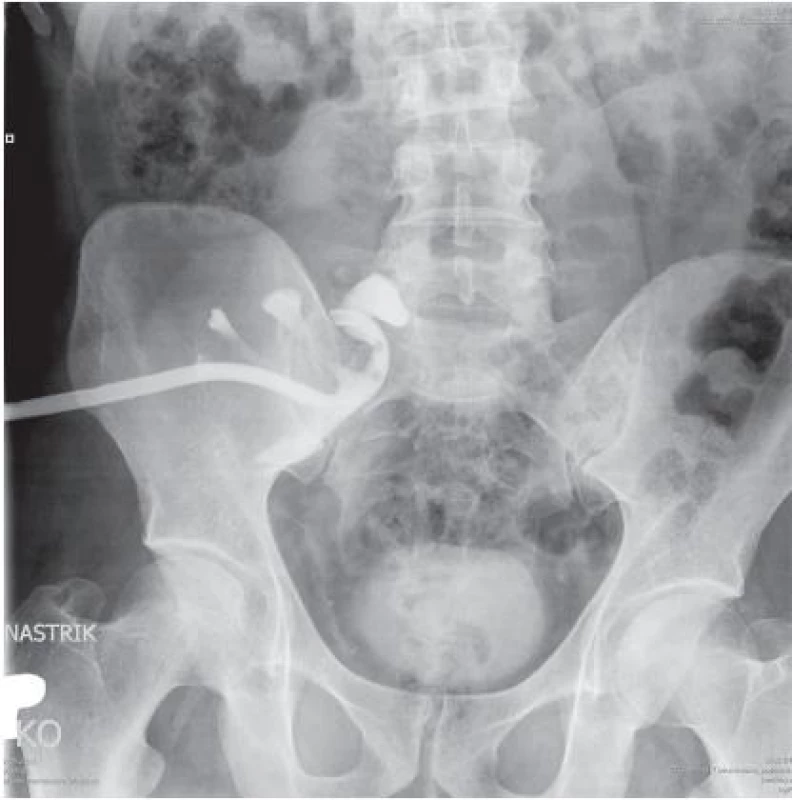
Diskuse
Incidence urologických komplikací po transplantaci ledviny kolísá dle literárních zdrojů mezi 3–14 %, přičemž mezi nejčastější patří urinózní fistuly, striktury močovodů a lymfokély (1). Urolitiáza v transplantované ledvině je poměrně vzácně se vyskytující komplikací postihující méně než 1–3 % všech štěpů (2). Litiáza může vzniknout de novo nebo může být transplantována ledvina s již přítomnou litiázou (tzv. donor-gifted allograft lithiasis). První případy urolitiázy ve štěpech byly popsány již v roce 1975 (3) a perkutánní řešení litiázy po transplantaci bylo prezentováno s desetiletým odstupem (4). Zatímco chemické složení litiázy přítomné ve štěpu již v době transplantace se neliší od běžných typů litiázy, při vzniku ve štěpu až po transplantaci bývá častěji urátová či magnézium-amonium fosfátová.
Funkčnost a viabilita štěpů se výrazně zlepšuje zavedením různých imunosupresivních režimů, čímž dochází k vyšší pravděpodobnosti vzniku/záchytu urolitiázy. Na etiopatogenezi se podílejí snížená diuréza, resp. koncentrovanější moč, vyšší pH moči, hyperurikémie s hyperurikosurií, hyperparatyreóza, renální tubulární acidóza a ascendentní močová infekce často ve spojitosti s dlouhodobě zavedeným DJ stentem. Vzhledem k chybění inervace, a tedy absenci typických projevů renální koliky zahrnují symptomatologii urolitiázy ve štěpu hematurie, postupná alterace renálních funkcí až obstrukční anurie a při vzniku obstrukční pyelonefritidy i celkové příznaky (urosepse). Zatímco menší konkrementy mohou odejít spontánně (velikost 3–4 mm), větší litiázu je třeba řešit aktivně. Důvodem je fakt, že již přítomná urolitiáza v transplantované ledvině představuje vyšší riziko dalšího růstu a případných druhotných komplikací.
V průběhu let se změnil přístup k transplantaci ledviny s přítomnou urolitiázou. Zatímco dříve se jednalo (v případě kadaverózní ledviny) o kontraindikaci transplantace, v rámci precizního vyšetřování před přenosy od živých dárců (MRI, CT angiografie) se zvyšuje záchytnost i velmi drobných konkrementů (méně než 4 mm), které by za jiných okolností unikly pozornosti. Studie posuzující riziko pozdních komplikací z důvodu litiázy v takto transplantované ledvině vyznívají poměrně optimisticky, kdy řada takto detekovaných drobných konkrementů je spontánně vymočena či je dlouhodobě bez progrese velikosti. Pacienti však musí být poučeni o případných komplikacích a důsledné sledování litiázy je nezbytné (5).
Vzhledem k tomu, že i na specializovaných pracovištích dispenzarizujících pacienty po transplantaci ledvin jsou popisovány jen ojedinělé případy komplikující urolitiázy, neexistuje jednotný přístup a způsob řešení. S rozvojem minimálně invazivních technik je vlastní léčba litiázy zahajována s různým odstupem od provedení transplantace. Většina pracovišť upřednostňuje odložení výkonu do stabilizace funkce štěpu, mimo jiné i z důvodu lepšího hojení a nižšího rizika pooperačních infekčních komplikací vlivem imunosuprese. Na druhou stranu jsou pracoviště prezentující posttransplantační řešení litiázy časně, tj. s odstupem 1–2 měsíců (6). Konkrementy je možné s ohledem na velikost a lokalizaci řešit extrakorporální litotrypsí (konkrementy 5–15 mm) či perkutánní extrakcí (konkrementy nad 15 mm), případně flexibilní ureteroskopií (7). Otevřený přístup je indikován zcela výjimečně. Ačkoli je LERV minimálně invazivní, nese s sebou jistá omezení. Jsou to jednak poloha ledviny v pánvi a obtížnější zaměřitelnost na skiaskopii při LERV, dále to bývá zhoršený odchod konkrementů po fragmentaci primární litiázy – dle některých prací je popisována reziduální litiáza až 25–40 %, zpravidla v dolních kališích (8). Ačkoliv je perkutánní přístup ve srovnání s LERV invazivnější, výhodou je ve většině případů jednorázové a kompletní řešení. Před vlastním operačním zákrokem je vhodné provést nativní spirální CT k přesnému posouzení nejen velikosti a lokalizace litiázy, ale také ke zhodnocení průběhu renálních cév a vztahu okolních orgánů. Technicky vzato, je vlastní zajištění perkutánního přístupu identické jako při operaci nativních ledvin. Výhodou je samozřejmě kratší vzdálenost kůže-kalich, je nutné také počítat s perirenální fibrózou, která sice může vést k obtížnější dilataci punkčního kanálu, na druhou stranu však fixuje ledvinu in situ, a zamezuje tak její přílišné mobilitě.
Zvláštní kapitolu tvoří řešení litiázy v ledvině před vlastním provedení transplantace. Z léčebných možností se nabízí ex vivo ureterorenoskopie (ExURS). Její provedení spočívá v použití flexibilního či tenčího rigidního ureterorenoskopu. Ledvina je umístěna v chladném fyziologickém roztoku, který je současně použit i k irigaci. Provedení ex vivo ureteroskopie je udáváno jako technicky snazší pro kratší délku močovodu, vyhnutí se nutnosti dilatace intramurálního úseku a pro možnost polohování ledviny k usnadnění dostupnosti všech kalichů (9, 10).
V případně alterace renálních parametrů je vždy potřeba vyloučit prerenální příčiny (dehydrataci, hypotenzi, užívání léků snižujících glomerulární filtraci) a dále vlastní poškození štěpu např. při akutní rejekci, toxickém poškození při podávání imunosupresiv ze skupiny kalcineurinů či při infekci štěpu. Při průkazu postrenální příčiny zhoršené funkce štěpu (např. při obstrukci štěpu konkrementem) je indikována drenáž – retrográdně endoskopicky inzercí DJ stentu či punkční nefrostomií; vlastní způsob je spíše dán zkušenostmi pracoviště než všeobecně platnými doporučeními, ačkoliv lze předpokládat technicky snazší perkutánní přístup. Základním vyšetřením je zde vždy USG vyšetření štěpu případně nativní spirální CT. Před jakoukoliv intervencí je samozřejmostí kultivační vyšetření moči a cílená ATB terapie (typ a délka ATB terapie vychází z citlivosti v moči a stavu renálních funkcí).
Závěr
Urolitiáza v transplantované ledvině je ojedinělou komplikací, jejíž řešení by mělo být směřováno do specializovaných center. Vlastní perkutánní řešení litiázy je pak zejména u větších konkrementů jednou z možností volby s minimální morbiditou a vlivem na renální funkce štěpu.
Došlo: 22. 3. 2012.
Přijato: 7. 8. 2012.
Kontaktní adresa
MUDr. Milan Král, Ph.D.
Urologická klinika LF UP a FN
I. P. Pavlova 6, 775 20 Olomouc
e-mail: kral.milan@seznam.cz
Střet zájmů: žádný.
Zdroje
1. Pernička J, Šmakal O, Bachleda P, Vidlář A. Časné urologické komplikace po transplantacích ledvin. Ces Urol 2004; 8(1): 5–7.
2. Challacombe B, Dasgupta P, Tiptaft R, et al. Multimodal management of urolithiasis in renal transplantation. BJU Int 2005; 96(3): 385–389.
3. Rattiazzi LC, Simmons RL, Markland C, et al. Calculi complicating renal transplantation into ileal conduits.Urology 1975; 5 : 29–31.
4. Hulbert JC, Reddy P, Young AT et al. The percutaneous removal of calculi from transplanted kidneys. J Urol 1985; 134(2): 324–326.
5. Strang AM, Lockhart ME, Amling CL, Kolettis PN, Burns JR. Living renal donor allograft lithiasis: a review of stone related morbidity in donors and recipients. J Urol 2008; 179(3): 832–836.
6. Lu HF, Shekariiz B, Stoller ML. Donor-gifted allograft urolithiasis: early percutaneous management. Urology 2002; 59(1): 25–27.
7. Klingler HC, Kramer G, Lodde M, Marberger M. Urolithiasis in allograft kidneys. Urology 2002; 59(3): 344–348.
8. Bhadauria RP, Ahlawat R, Kumar RV, et al. Donor-gifted allograft lithiasis: extracorporeal shockwave lithotripsy with over table module using the Lithostar Plus. Urol Int 1995; 55(1): 51–55.
9. Trivedi A, Patel S, Devra A, et al. Management of calculi in a donor kidney. Transplant Proc 2007; 39(3): 761–762.
10. Schade GR, Wolf JS, Faerber GJ. Ex-vivo ureteroscopy at the time of live donor nephrectomy. J Endourol 2011; 25(9): 1405–1409. Epub 2011 Jun 28.
Štítky
Detská urológia Nefrológia Urológia
Článek Editorial
Článok vyšiel v časopiseČeská urologie
Najčítanejšie tento týždeň
2012 Číslo 3- Aktuálne európske odporúčania pre liečbu renálnej koliky v dôsledku urolitiázy
- MUDr. Šimon Kozák: V algeziológii nič nefunguje zázračne cez noc! Je dôležité nechať si poradiť od špecialistov
- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Editorial
- Role vložkových testů v diagnostice inkontinence moči
- Jednoportová laparoskopie v urologii (laparoendoscopic single-site surgery, LESS) – nová hranice miniinvazivity?
- První zkušenosti s novým jednostranně ostnatým stehem V-Loc při laparoskopické radikální prostatektomii
- Prediktivní parametry záchytu karcinomu prostaty v saturační biopsii prostaty
- Parametry spermiogeneze a jejich vývoj u hemodialyzovaných pacientů do 49 let zařazených na čekací listinu k transplantaci ledviny
- Řešení urolitiázy v transplantované ledvině perkutánní nefrolitotrypsí
- Fungálny bezoár ako zriedkavá príčina stenózy distálneho močovodu: popis kazuistiky z pohľadu chirurgickej liečby
- Germinální tumor varlete u nespolupracujícího pacienta
- Zpráva z III. ročníku workshopu „Pokroky v urogynekologii“
- Česká urologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Prediktivní parametry záchytu karcinomu prostaty v saturační biopsii prostaty
- Role vložkových testů v diagnostice inkontinence moči
- Germinální tumor varlete u nespolupracujícího pacienta
- První zkušenosti s novým jednostranně ostnatým stehem V-Loc při laparoskopické radikální prostatektomii
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



