-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
BUNĚČNÉ MODELY CHEMOREZISTENCE UROTELIÁLNÍHO KARCINOMU
CELL CULTURE MODELS OF UROTHELIAL CARCINOMA CHEMORESISTANCE
Major statement:
Cancer cell lines and progression series thereof represent a crucial experimental tool to unravel basic biological mechanisms of carcinogenesis, including therapeutic response. The article gives an overview of current cell culture models of urothelial carcinoma, focusing on chemoresistance mechanisms.
Urothelial bladder carcinoma is the seventh most frequent tumor type in our population. From both biological and clinical points of view, it represents a very heterogeneous group of cancers, from non-muscle-invasive superficial papillary carcinoma to muscle-invasive carcinoma as the two major subtypes. Cell culture of urothelial carcinoma is relatively feasible, with more than 50 established tumor cell lines. Most of them were derived from late stage muscle-invasive tumors. In contrast, cell lines derived from early stages and/or papillary superficial tumors are relatively scarce. Studying tumor progression is largely facilitated by use of progression cell line series – an array of several cell lines established on the same genetic background with gradually increasing transformation status. All available progression series of urothelial carcinoma cell lines have been experimentally established either by various in vitro manipulations or in vivo, following a spontaneous progression of an original cancer cell line after its introduction into a suitable host animal. An important variant of cancer cell line progression series is provided by derivation of chemoresistant daughter cell lines after administration of cytostatics to a chemosensitive parental cell line. This specific variant can substantially contribute to our understanding of various biological mechanisms of chemoresistance. An important new finding in this respect is the fact that in many if not all chemoresistant daughter cell lines, several biologically distinct chemoresistance mechanisms seem to be co-expressed. In addition to these entirely experimental applications, such chemoresistant cancer cell lines can provide valuable preclinical models to test new therapeutic options aimed at recovery of chemosensitivity.KEY WORDS:
Cancer cell lines, chemoresistance, chemotherapy, urothelial carcinoma.
Autori: Michaela Kripnerová; Jiří Hatina
Pôsobisko autorov: Ústav biologie, Lékařská fakulta UK v Plzni
Vyšlo v časopise: Ces Urol 2015; 19(4): 270-280
Kategória: Přehledový článek
Súhrn
Hlavní stanovisko práce:
Nádorové buněčné linie a na jejich základě odvozené progresivní série představují jeden z klíčových experimentálních nástrojů k objasnění základních biologických mechanizmů karcinogeneze, včetně terapeutické odpovědi. Článek poskytuje podrobný přehled aplikačních možností nádorových buněčných kultur ve studiu uroteliálního karcinomu, s důrazem na mechanizmy chemorezistence.
Karcinom močového měchýře představuje v naší populaci sedmý nejčastější nádor. Jedná se o biologicky i klinicky velmi heterogenní skupinu onemocnění, se dvěma základními skupinami představovanými povrchovými papilárními karcinomy na jedné straně a svalově invadujícími nádory na druhé straně. Karcinom močového měchýře patří mezi relativně dobře in vitro kultivovatelné typy nádorů, s více než 50 dostupnými etablovanými nádorovými buněčnými liniemi, většina z nich byla nicméně odvozena od nádorů pozdního stadia progrese, zatímco buněčných linií odvozených z časných karcinomů je pouze několik. Studium nádorové progrese v experimentálních modelových systémech buněčných kultur probíhá často s využitím tzv. progresivních sérií buněčných linií, kdy studujeme současně několik buněčných linií totožného genetického pozadí, z nichž každá odpovídá jinému stadiu progrese nádoru. Prakticky všechny progresivní série uroteliálního karcinomu mají experimentální charakter, kdy z klinického nádoru je odvozena pouze tzv. mateřská buněčná linie, a dceřiné buněčné linie odpovídající pokročilejším stadiím progrese jsou odvozeny experimentálně, ať už in vitro (tj. postupy buněčné kultivace) nebo in vivo (tj. spontánní progresí po transplantaci do vhodného zvířecího hostitele). Důležitou variantou takových progresivních sérií buněčných linií je odvození chemorezistentních dceřiných linií selekcí rezistentních klonů po aplikaci studovaného cytostatika dané mateřské buněčné linii. Tato specifická varianta progresivních sérií nádorových buněčných linií může podstatně přispět k našemu pochopení různých biologických mechanizmů terapeutické rezistence nádorů. Důležitým poznatkem v této oblasti je, že u většiny chemorezistentních sérií nádorových buněčných linií dochází k paralelnímu vývoji několika mechanizmů chemorezistence současně. Vedle této experimentální roviny poskytují chemorezistentní nádorové buněčné linie i významné preklinické modely testování nových terapeutických možností zaměřených na obnovení chemosenzitivity.KLÍČOVÁ SLOVA:
Chemorezistence, chemoterapie, nádorové buněčné linie, uroteliální karcinom.ÚVOD
Karcinom močového měchýře patří mezi relativně častá nádorová onemocnění, s celosvětovou incidencí blížící se 430 000 a mortalitou přesahující 165 000 (1, 2). V České republice je situace obdobná, v r. 2007 činila celková incidence 2 487 a mortalita 697 případů (3). Většina nádorů je zachycena v časném stadiu; období 2003–2007 činil záchyt nádorů ve stadiu I téměř 60 % (3), což se odráží ve vysoké prevalenci. Postulované hodnoty prevalence pro rok 2020 činí 25 067 případů, což bude z uroteliálního karcinomu činit celkově 7. nejčastější nádor (4). Dlouhodobě přitom platí, že mužská část populace je postižena signifikantně více, a to přibližně třikrát (1, 2).
Většina karcinomů močového měchýře představuje uroteliální karcinomy, u nichž lze z hlediska patologie, molekulární biologie i klinického průběhu rozlišit dvě velké skupiny, podle toho, jestli došlo k invazi do svalové vrstvy močového měchýře či ne. Neinvadující nádory (NMIBC – non-muscle-invasive bladder cancer; stádia pTa a pT1) mají obecně dobrou prognózu, s pětiletým přežitím přesahujícím 80 %, ovšem s vysokou tendencí k lokálním recidivám, což si vynucuje soustavné a pravidelné sledování nemocných. Samostatnou skupinou mezi neinvadujícími nádory zaujímá karcinom in situ (CIS – carcinoma in situ), jež s sebou nese vysoké riziko další progrese. U svalově invadujících nádorů (MIBC – muscle-invasive bladder cancer, stadia pT2–pT4) klesá přežití pacientů úměrně pokročilosti onemocnění, v případě metastatického rozsevu nepřesahuje pětileté přežití 5% (5, 6, 7).
MOLEKULÁRNÍ BIOLOGIE UROTELIÁLNÍHO KARCINOMU
Již více než před deseti lety byla formulována hypotéza, podle které probíhá vývoj povrchových (NMIBC) a svalově invadujících (MIBC) karcinomů z větší části nezávisle a podle odlišných molekulárních scénářů (tzv. dual track hypothesis) (7, 8). To už je patrné na histopatologicky odlišných prekancerózních stavech; zatímco povrchovým karcinomům zpravidla předchází hyperplazie urotelu, svalově invazivní nádory se vyvíjejí většinou z plochých dysplastických lézí posléze přecházejících v karcinom in situ. Tyto nezávislé dráhy tumorigeneze se ovšem mohou křížit – zhruba 15 % původně povrchových nádorů nakonec progreduje do invazivního fenotypu.
Molekulární biologie obou drah karcinogeneze (obrázek 1) je také značně odlišná (9, 10, 11). Klíčové onkogeny aktivované u povrchových nádorů způsobují především dysregulaci buněčného cyklu a hyperproliferaci. Mutace jsou nejčastěji nacházeny buď v systému receptorů fibroblastových růstových faktorů (především FGFR3) anebo v onkogenech rodiny ras, čistým výstupem je v obou případech konstitutivní aktivace jedné z nejdůležitějších signálních drah, tzv. mitogen - aktivované protein kinázové (MAPK) kaskády. Ty jsou doprovázeny ztrátami (buď na úrovni genu nebo jeho exprese) klíčových inhibitorů buněčného cyklu p16INK4a a p15INK4b v oblasti chromozómu 9p21, tato změna je ovšem nacházena i u převážné většiny svalově invadujících nádorů a představuje ve většině případů tudíž zřejmě první mutaci celé tumorigenní dráhy.
Obr. 1. Současný model vývoje a progrese různých typů uroteliálního karcinomu a klíčových genů mutovaných v jednotlivých stadiích (9, 10, 11) Fig. 1. Current model of development and progression of principal types of urothelial carcinoma, together with crucial mutated genes (9, 10, 11) 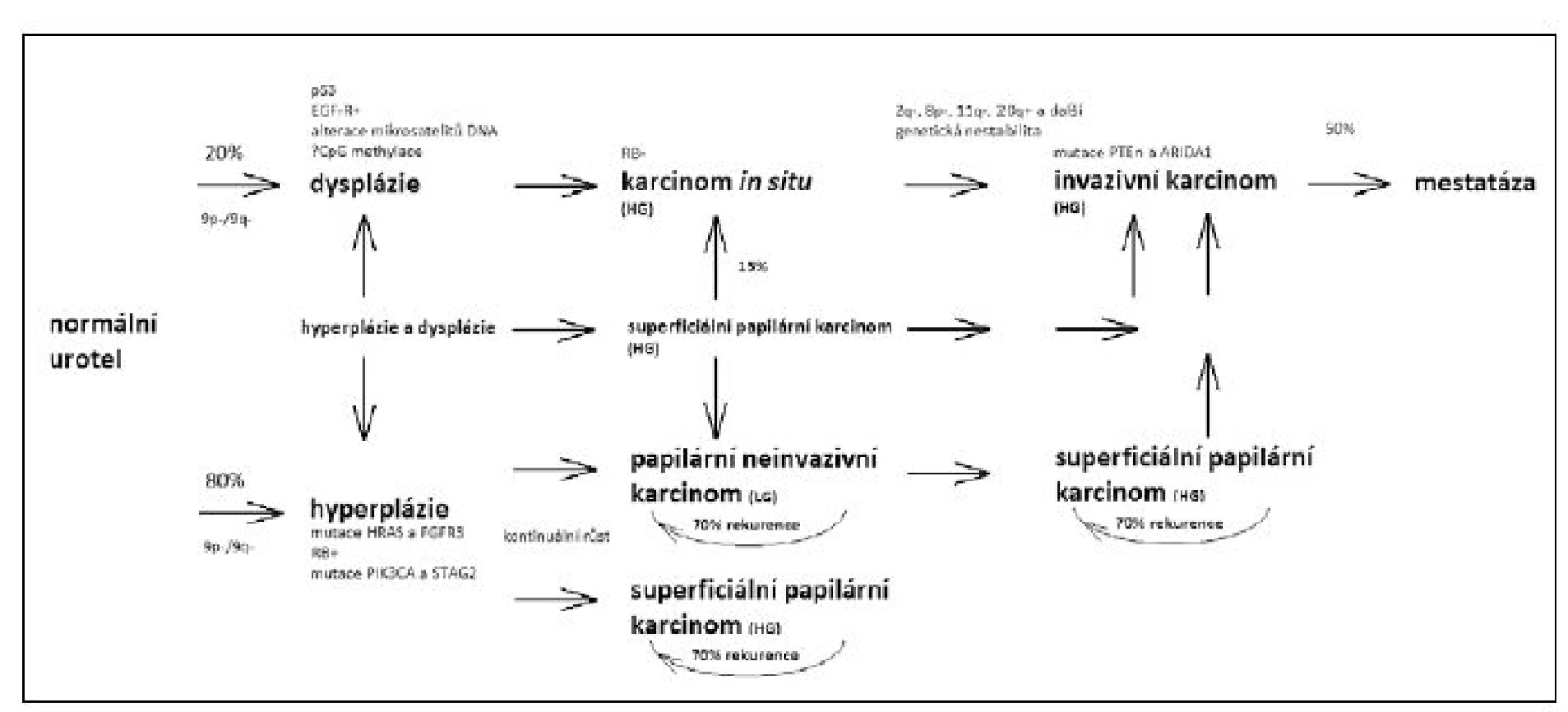
Zásadní molekulární změnu představuje u svalově invazivních nádorů destabilizace genomu; svalově invadující nádory zaujímají třetí příčku mezi nádory z hlediska průměrného celkového počtu mutací, překonávají je pouze karcinomy plic a melanom (12). Podkladem bývá často mutační vyřazení klasického tumorového supresoru p53, anebo rovněž nadměrná exprese genu APOBEC-3. Proteiny rodiny APOBEC kódují enzymy s cytidin desaminázovou aktivitou a způsobují charakteristický mutační vzor (C:G ⟶ T:A); jejich fyziologickou funkcí je mutageneze a následná inaktivace retrovirů a retrotranspozónů. Časté jsou rovněž mutace genu pRb a rovněž genů, kódujících součásti komplexních enzymatických systémů organizace a remodelace chromatinu (např. ARID1A, MLL, EP300 a KDM6A) (11).
Z uvedeného vyplývá, že svalově invadující nádory jsou velmi heterogenní skupinou. Bylo publikováno několik analýz, jejichž cílem byla molekulární klasifikace nádorů na základě společného profilu exprimovaných genů (metodika tzv. „expresních čipů“). Jejich průnikem je definování dvou základních velkých skupin nádorů, svým fenotypem i názvoslovím trochu připomínajících obdobnou analýzu provedenou u karcinomu prsu, a to nádory bazální, jimž je společná exprese cytokeratinů bazálních buněk urotelu (CK-5, CK-6, CK-14), a nádory luminální, pro něž je typická exprese cytokeratinu-20 a dalších genů spojených s diferenciací urotelu (GATA-3, FOXA1, uroplakin 3A, PPARγ). Kromě toho byl definován specifický expresní vzor, označený jako „p53-like“ a charakterizovaný expresí genů regulovaných tumorovým supresorem p53 (a to bez ohledu na expresi či mutaci samotného p53 genu). Většina této skupiny nádorů vykazuje také expresní charakteristiky vysoké infiltrace stromálními buňkami (tento typ byl nezávisle označený také jako „infiltrated“). Podstatné přitom je, že uvedené molekulární subtypy se výrazně liší klinicky, bazální nádory mají podstatně horší prognózu než nádory luminální. Důležitou vlastností p53-like–nádorů je primární chemorezistence (13).
POSTAVENÍ CHEMOTERAPIE V LÉČBĚ UROTELIÁLNÍHO KARCINOMU
Z předchozího textu je jasné, že uroteliální karcinom představuje heterogenní skupinu onemocnění se značnými rozdíly v kapacitě k další progresi, a tím i v celkové prognóze. Většina povrchových karcinomů se léčí transuretrální resekcí následovanou buď adjuvantní intravezikulární chemoterapií (zpravidla mitomycinem C, popř. doxorubicinem, epirubicinem či gemcitabinem, v České republice se nejčastěji používá kombinace mitomycinu C a epirubicinu) nebo adjuvantní intravezikulární imunoterapií v podobě BCG vakcinace (14, 15). U nádorů invadujících do svalové vrstvy močového měchýře se obvykle postupuje cestou cystektomie, popř. rovněž transuretrální resekce, která bývá doplněna radioterapií popř. adjuvantní systémovou chemoterapií obvykle charakteru polychemoterapie; byla publikována celá řada schémat chemoterapie, např. MCV (metotrexát, cisplatina, vinblastin). Pro léčbu metastatického onemocnění se uplatňují dva další široce používané polychemoterapeutické přístupy, a to M-VAC (metotrexát, vinblastin, doxorubicin – adriamycin a cisplatina) a GC (gemcitabin a cisplatina). Oba režimy mají v podstatě totožnou klinickou účinnost (klinická odpověď je zaznamenána zhruba u poloviny pacientů), GC kombinace vykazuje ovšem příznivější profil toxických vedlejších účinků (16, 17). Velkým klinickým problémem obou těchto kombinačních chemoterapeutických režimů je vývoj multilékové rezistence, takže podíl pacientů s lokálně pokročilým nebo metastatickým uroteliálním karcinomem, kteří byli léčeni jednou z těchto dvou kombinačních chemoterapií a dosáhli pětiletého přežití, nepřesahuje 15 % (18).
MODELY BUNĚČNÝCH KULTUR A JEJICH POSTAVENÍ V BIOLOGICKÉ ANALÝZE UROTELIÁLNÍHO KARCINOMU
Historie lidských buněčných kultur sahá do 50. let minulého století (19, 20). Od té doby stály modely buněčných a tkáňových kultur za řadou objevů, bez kterých by současná medicína a biovědy nemohly existovat tak, jak je známe. Buněčné kultury představují velice atraktivní model, jenž nám umožňuje v částečně arteficiálních podmínkách mapovat a odhalovat řadu biologických zákonitostí, které můžeme následně aplikovat do klinické praxe, a to obzvláště v nádorové biologii. Základní využití nádorových buněčných linií v porozumění tumorigenezi tkví v zásadě ve dvou přístupech. První z nich spočívá v tom, že z dobře patologicky definovaných klinických (popř. experimentálních) nádorů jsou odvozeny permanentní buněčné linie, které tak představují v principu nevyčerpatelný zdroj biologického materiálu pro dešifrování genetických a epigenetických změn příslušného nádoru. Různé typy nádorů se přitom značně liší v teoretické úspěšnosti tohoto přístupu, tj. v úspěšnosti odvození stabilních buněčných linií. Karcinom močového měchýře patří v tomto ohledu mezi experimentálně poměrně přístupné typy nádorů a dosud se podařilo ustanovit více než pět desítek permanentních buněčných linií (21), i když je nutno podotknout, že většina dostupných buněčných linií byla ustavena z invazivních či dokonce už metastatických karcinomů a ustavení permanentních buněčných linií z povrchových papilárních karcinomů představuje stále experimentální výzvu. Úspěch je u těchto nádorů často vykoupen zdlouhavou optimalizací kultivačních podmínek, zejména médií, a i tak zůstává úspěšnost odvození relativně nízká (22). Těmito modifikacemi kultivačních technik se nám podařilo odvodit dvě nové buněčné linie povrchového neinvazivního karcinomu buněčného měchýře a molekulárně je charakterizovat, zejména s ohledem na funkční stav signálních drah DNA reparace a obzvláště tumorového supresorového genu p53 (23). V případě jednoho konkrétního nádoru se nám dokonce podařilo ustavit jak příslušnou karcinomovou buněčnou linii, tak stromální buněčnou linii (tj. buněčnou linii s karcinomem asociovaných fibroblastů) (24).
Druhou, široce používanou strategií využití modelů buněčných kultur v experimentální onkologii, je odvození a analýza tzv. progresivních sérií nádorových buněčných linií, tedy série dvou nebo více klonálně příbuzných nádorových buněčných linií odrážejících jednotlivá stadia progrese nádorového onemocnění (obrázek 2).
Obr. 2. Různé strategie odvození progresivní sérií nádorových buněčných linií. <b>A</b> Klinická progrese nádoru umožňuje odvodit nádorovou buněčnou linii jak z primárního nádoru, tak z jeho metastázy. <b>B</b> Koncepčně totožný výsledek umožňuje experimentální progrese, např. po xenotransplantaci či in vitro selekci progredujících nádorových buněk. <b>C</b> Zvláštní skupinou progresivních sérií je odvození chemorezistentních dceřiných linií po kultivaci v médiu se zvýšenou koncentrací cytostatik Fig. 2. Various strategies used to establish cancer cell lines progression series. <b>A</b> Clinical cancer progression makes it possible to establish cell lines from a primary tumour and from its metastasis, respectivelly. <b>B</b> Conceptually the same result might be achieved after an experimental progression, e.g. after xenotransplantation or in vitro selection of progressing cancer cells. <b>C</b> Establishment of chemoresistant daughter cell lines after culture in media containing high concentrations of cytostatics represents a special type of a progression series. 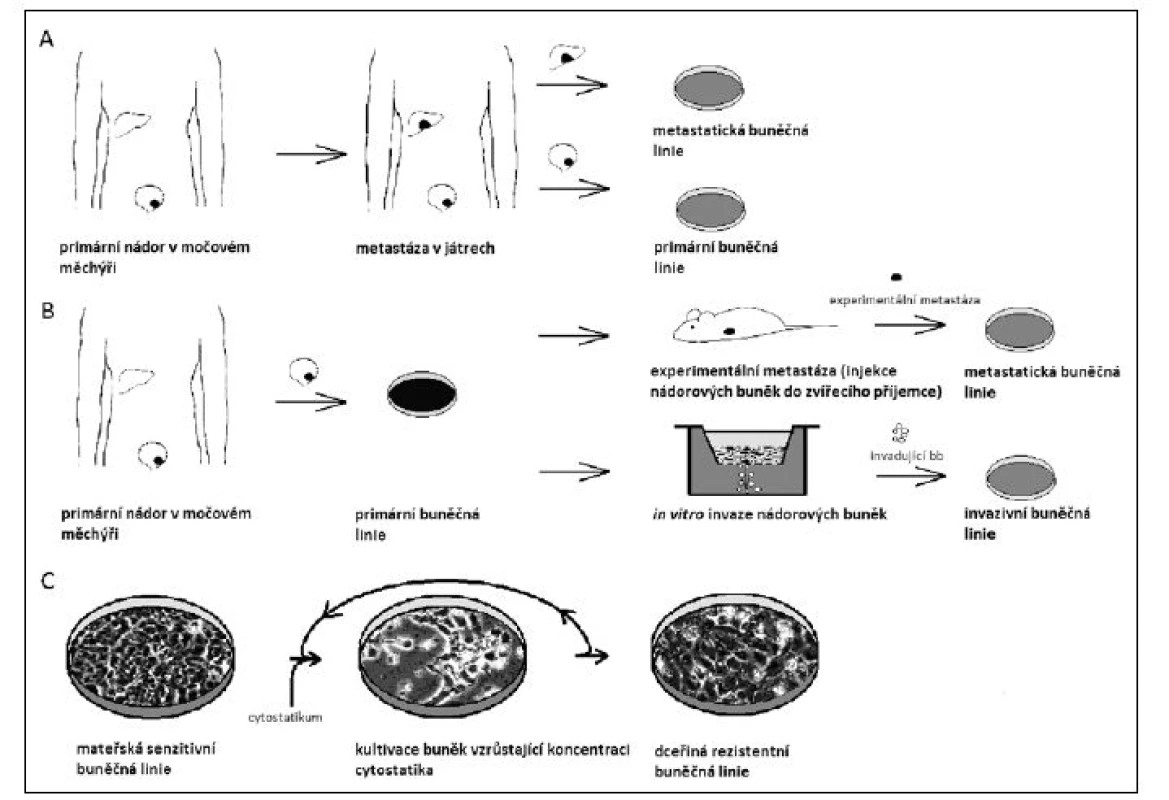
Lze přitom využít jak klinickou progresi nádoru, kdy např. současně odvodíme buněčné linie z primárního nádoru a metastázy, tak progresi experimentální. V tom případě vycházíme z fenotypicky a molekulárně geneticky dobře definované mateřské buněčné linie, kterou experimentálně vystavíme specifickému selekčnímu tlaku či jiné in vitro manipulaci, a tak odvodíme dceřinou buněčnou linii, jejíž stupeň transformace a progrese je vyšší. Tento přístup simuluje neustálý selekční tlak všudypřítomný in vivo během nádorové progrese. Následné porovnání genetických a epigenetických změn mezi jednotlivými buněčnými liniemi progresivní série pak otevírá cestu k pochopení biologie studovaného aspektu nádorové progrese. S velkou pravděpodobností lze předpokládat, že nacházené změny v jednotlivých genech, jejich expresi a zapojení do onkogenních signálních drah jsou přímo zodpovědné za pozorovanou fenotypickou změnu.
Progresivní série buněčných linií odvozených z nádorů různého stadia progrese u jednoho pacienta jsou velmi dobře etablovaným experimentálním systémem např. u maligního melanomu (25), u uroteliálního karcinomu je ovšem dosud známa pouze jediná takto derivovaná progresivní série, a to TCC 97–18-I (etablovaná z resekce primárního tumoru) a TCC 97–21-M (odvozená z biopsie metastatického ložiska) (26). Co se týče experimentálních progresivních sérií, strategie odvození mohou být velmi různé. Experimentálně poměrně jednoduchou možností je využít např. morfologické odlišnosti izolovaně rostoucí kolonie buněk – takto se nám podařilo odvodit vysoce klonogenní dceřinou linii BFTC-905-DM z výchozí relativně nízko transformované buněčné linie BFTC-905 (27). Složitější experimentální systémy jsou založené na zavedení mateřské buněčné linie do vhodného experimentálního hostitele (většinou imunodeficientní myš genotypu nu/nu nebo SCID) a selekci in vivo progredovaných, např. metastatických dceřiných linií. Velmi často používanou mateřskou buněčnou linií se stala vůbec jedna z prvních nádorových buněčných linií karcinomu močového měchýře – T24 (28). Na počátku jedné T24 – založené progresivní série stálo šťastné pozorování, že jedna z náhodně odvozených dceřiných buněčných linií vykazovala výrazně vyšší schopnost růstu v polotekutých médiích bez nutnosti adheze k pevnému substrátu. Tato dceřiná linie známá jako T24T následně poskytla jeden z klíčových pohledů do karcinogeneze a speciálně do metastatického procesu karcinomu močového měchýře (29, 30). Experimentální progrese v imunodeficientní myši byla s buněčnou linií T24 rovněž provedena, dokonce opakovaně v několika laboratořích (31–33). Komparativní molekulárně biologickou či proteomickou analýzou jednotlivých buněčných linií těchto progresivních sérií byla identifikována celá řada genů a proteinů, které dozajista hrají klíčové role v jednotlivých aspektech nádorové progrese a které s vysokou pravděpodobností v blízké budoucnosti najdou své uplatnění v klinické praxi, ať už jako vhodné prognostické markery, tak jako potenciální cíle protinádorové terapie.
MODELOVÁNÍ TERAPEUTICKÉ REZISTENCE UROTELIÁLNÍHO KARCINOMU V BUNĚČNÝCH KULTURÁCH
Chemoterapeutická rezistence nádoru může být přítomna buď už na začátku chemoterapie, takže daný nádor je primárně rezistentní a nedochází ke klinické odpovědi, nebo se vyvine až v průběhu léčby, kdy je buď např. dosaženo jen částečné klinické odpovědi následované obnovením růstu nádoru v průběhu chemoterapie, nebo může dojít k úplné klinické odpovědi následované relapsem onemocnění po různě dlouhé době remise, přičemž recidivující nádor už nevykazuje stejnou chemoterapeutickou citlivost jako nádor původní (34). Současný stav poznání ukazuje, že problém chemoterapeutické rezistence nádorů je značně komplexní, s velkou škálou možných molekulárních mechanizmů pro každé jednotlivé cytostatikum (35). Nádorové buněčné kultury mohou v tomto ohledu poskytnout velmi užitečné modely pro následnou molekulární analýzu. Speciální skupinu progresivních sérií nádorových buněčných linií představují systémy, kdy na mateřskou nádorovou buněčnou linii vyvineme selekční tlak prostřednictvím aplikace studovaného cytostatika ve vzrůstající koncentraci, a odvodíme tak dceřinou chemorezistentní buněčnou linii. V posledních dvaceti letech se tímto způsobem v oblasti nádorových buněčných linií karcinomu močového měchýře podařilo ustanovit a molekulárně charakterizovat řadu modelových systémů. Tuto molekulární analýzu mechanizmů chemorezistence můžeme v zásadě rozdělit do dvou skupin. V první skupině byla na základě znalostí biologického mechanizmu působení jednotlivých cytostatik formulována určitá racionální hypotéza mechanizmu chemorezistence, a ta pak byla testována v příslušném modelovém systému mateřské chemosenzitivní a dceřiné chemorezistentní nádorové buněčné linie. U doxorubicin – rezistentní varianty buněčné linie RT112 (RT112/D21) stojí za rezistentním fenotypem zřejmě nadměrná exprese efluxních pump, zejména P-glykoproteinu (36), podobný mechanizmus byl navržen i pro doxorubicin – rezistentní dceřinou linii odvozenou z UM-UC-6 (UM-UC-6-dox), i když tady je situace pravděpodobně komplexnejší a kromě zvýšeného efluxu cytostatika zřejmě zahrnuje i aktivaci antiapoptotických signálních drah, zejména klíčové proteinové kinázy Akt (37, 38). Podobný biologický mechanizmus byl navržen i pro progresivní sérii na bázi shora zmíněné buněčné linie T24 modelující rezistenci vůči cisplatině (rezistentní dceřiné buněčné linie T24R1 a T24R2), kdy za pozorovanou rezistencí stojí pravděpodobně zvýšená exprese antiapoptotického proteinu Bcl-2 (39), či v případě rezistence vůči gemcitabinu (progresivní série buněčných linií UM-UC-3 a UM-UC-3R), kdy pravděpodobným biologickým mechanizmem je zvýšená exprese antiapoptotického proteinu clusterinu (40). Další racionální hypotézou chemorezistence je aktivace enzymatických detoxifikačních mechanizmů – cisplatinová rezistence u progresivní série RT112–RT112/K1, RT112/K2 a RT112/CP3) tak mohla být korelována se zvýšenou expresí metalothioneinů (41), a u výše uvedené cisplatina-rezistentní dceřiné buněčné linie T24R2 plní podobnou detoxifikační úlohu enzymatické systémy na bázi glutathionu (42), což, podobně jako u progresivní série buněčných linií UM-UC-6 a UM-UC-6-dox, ukazuje na komplexní mechanizmus rezistence. Dalšími kandidáty pro zprostředkování chemorezistence jsou regulační proteiny, např. typu transkripčních faktorů. Za cisplatinovou rezistenci u progresivní buněčné série NTUB1–NTUB1/P byl takto shledán odpovědný transkripční faktor C/EPBδ (NF-IL6β), jehož zvýšená exprese byla prokázána u rezistentní dceřiné buněčné linie (43).
Druhou skupinu modelových systémů chemorezistence charakterizuje záměrná absence apriorní hypotézy mechanizmu chemorezistence. Klíčem k dešifrování pozorované chemorezistence je pak nějaká forma systematické expresní analýzy, ať už na úrovni transkripčního výstupu genů, nebo na úrovni celkového proteomu, tj. celkového souboru translatovaných proteinů, a to komparativně u mateřské chemosenzitivní a dceřiné chemorezistentní buněčné linie. Taková systematická komparativní analýza může dále obohatit a doplnit vysvětlení mechanizmu chemorezistence načrtnuté analýzou kandidátního mechanizmu založeného na racionální hypotéze. Např. analýzou specifického transkripčního profilu výše uvedené chemorezistentní buněčné linie T24R2 se prokázalo, že za pozorovanou rezistencí vůči cisplatině stojí ještě v daleko větší míře než Bcl-2 (39) jiný člen Bcl-2 – rodiny antiapoptotických mediátorů, Bfl-1 (44), a nejnovější analýza tohoto modelového systému prostřednictvím expresních čipů poskytla mnohem komplexnější obraz dysregulace apoptózy u chemorezistentní buněčné linie (45). Podobně recentní systematická farmakologická a expresní analýza výše uvedeného modelového systému cisplatinové rezistence NTUB1–NTUB1/P potvrdila klíčovou úlohu kyslíkových radikálů v toxicitě cisplatiny, ovšem vedle výše uvedeného transkripčního faktoru C/EPBδ (NF-IL6β) a jím aktivované Cu/Zn superoxid dismutázy (43) se na rezistenci podílí ještě další detoxifikační enzym – hem oxygenáza. Cisplatin-rezistentní dceřiná linie NTUB1/P rovněž akumuluje signifikantně nižší intrabuněčné koncentrace cisplatiny a podobně jako u výše popsané modelové série T24–T24R2 dochází i u NTUB1/P buněk k dysregulaci apoptózy v důsledku zvýšené exprese antiapoptotického regulátoru Bcl-2 (46). Oba výše uvedené modelové systémy jasně ukazují multifaktoriální charakter chemorezistence, kdy rezistentní buněčné linie aktivují několik různých, komplementárních či paralelních mechanizmů.
Takové systematické srovnávací analýzy nám mohou rovněž otevřít cestu k nalezení nových, dosud nepředpokládaných mechanismů chemorezistence. Několik nezávislých studií například přineslo důkazy či indicie pro významnou roli signálních drah regulovaných vápenatými kationty. První z nich byla expresní analýza dvou dvojic parentální chemosenzitivní a dceřiné cisplatina - rezistentní buněčné linie (T24 a T24DDP10, KK47 a KK47DDP20) cDNA expresními čipy, která prokázala zvýšení exprese receptoru pro inositoltrifosfát (IP3R1) u obou dceřiných chemorezistentních linií (47). Další dvě nezávislé proteomické analýzy přinesly rovněž důkaz významné funkce kalcium-regulovaného proteinu v mechanizmu chemorezistence. U dalšího modelu cisplatinové rezistence (dvojice mateřské chemosenzitivní a dceřiné chemorezistentní buněčné linie HT1376 a HT1376-CisR) se jednalo o protein adseverin (48), u modelu doxorubicinové rezistence (dvojice mateřské chemosenzitivní a dceřiné chemorezistentní buněčné linie pumc-91 a pumc-91/ADM) o protein annexin 2 (49). Další výhodou těchto komplexních expresních profilů je možnost analyzovat jejich překryv. Např. letmý pohled do tabulek diferenciálně exprimovaných proteinů u obou výše uvedených dvojic chemorezistentních modelových systémů prozradí, že annexin-2 patří mezi zvýšeně exprimované proteiny i u cisplatinové rezistence buněčných linií HT1376 a HT1376-CisR. Dá se předpokládat, že takové in silico přístupy, založené zcela na bioinformatické analýze, budou do budoucna stále častější.
Naše nejnovější studie (50) by mohla naznačit, jak by bylo možné využít analýzy experimentálně odvozených sérií mateřské senzitivní a dceřiné chemorezistentní buněčné linie k získání potenciálně klinicky využitelných výsledků. Naším výchozím modelem byla buněčná linie BFTC-905, kterou jsme vystavili zvyšujícím se koncentracím doxorubicinu (od výchozí koncentrace 100 nM do konečné koncentrace 300 nM v rozsahu dvou měsíců) a takto z ní odvodili dceřinou chemorezistentní linii BFTC-905-DOXO-II. Molekulární analýza mechanizmu chemorezistence vyloučila možnost zvýšeného efluxu doxorubicinu, odhalila ovšem konstitutivní aktivaci exprese souboru genů, kódujících enzymy tzv. mevalonátové syntetické dráhy (51). Vstupem do této syntetické dráhy je hydroxymetylglutaryl-koenzym A (HMG CoA) a na jejím konci je řada biologicky aktivních molekul, především cholesterol, dále pak steroidy a dolicholy, jakož i biologicky velmi významné posttranslační modifikace proteinů farnesylace a geranylgeranylací, což jim umožňuje zakotvení do biomembrán. Limitním enzymem celé mevalonátové syntetické dráhy je hned její samotný začátek, tj. přeměna HMG CoA na mevalonát, katalyzovaná HMG CoA reduktázou. Farmakologická inhibice mevalonátové syntetické dráhy vede k vnitrobuněčnému nedostatku zejména cholesterolu, na což buňky reagují jeho zvýšeným příjmem. Inhibitory HMG CoA reduktázy – statiny – jsou jedny z nejúčinnějších a nejrozšířenějších léků používaných za účelem snížení hladiny cholesterolu v krvi (51). Využití statinů pro protinádorovou terapii je zatím intenzivně diskutováno (51, 52), popř. ve stadium časných klinických studií v oblasti akutní myeloidní leukémie (53). Analýza našeho experimentálního systému prokázala, že aplikace simvastatinu byla schopna úplně inhibovat chemorezistentní fenotyp dceřiné buněčné linie a obnovit původní chemosenzitivitu (50).Vzhledem k tomu, že statiny představují široce používané léky s velmi dobře charakterizovanými farmakologickými parametry, jejich začlenění do schémat protinádorové chemoterapie by mohlo být relativně přímočaré a pro určité typy chemorezistence, ať už primární, nebo, tak jako v našem experimentálním systému, sekundární, by mohlo představovat velmi důležité obohacení stávajících terapeutických schémat.
Došlo: 28. 8. 2015
Přijato: 21. 10. 2015
Kontaktní adresa:
doc. Ing. Jiří Hatina, CSc.
Ústav biologie, Lékařská fakulta UK v Plzni,
Alej Svobody 76,
323 00 Plzeň
e-mail: jiri.hatina@lfp.cuni.cz
Střet zájmů: žádný
Prohlášení o podpoře:
Tato práce byla podpořena grantem Univerzity Karlovy SVV-2015-260 173.
Zdroje
1. Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012. CA Cancer J Clin 2015 Mar; 65(2): 87–108.
2. Burger M, Catto JW, Dalbagni G, et al. Epidemiology and risk factors of urothelial bladder cancer. Eur Urol 2013 Feb; 63(2): 234–241.
3. Dušek L, Mužík J, Gelnarová E, et al. Cancer Incidence and Mortality in the Czech Republic. Klin Onkol 2010; 23(5): 311–324.
4. Dušek L, Pavlik T, Majek O, et al. Estimating Cancer Incidence, Prevalence, and the Number of Cancer Patients Treated with Anti-tumor Therapy in 2015 and 2020 – Analysis of the Czech National Cancer Registry. Klin Onkol 2015; 28(1): 30–43.
5. Soukup V, Pešl M. Karcinom močového měchýře. Postgraduální medicína 2001; 13(1): 42–47.
6. Pešl M, Soukup V, Babjuk M, et al. Hodnocení významu klinicko-patologických prognostických faktorů u nádorů močového měchýře neinfiltrujících svalovinu. Ces Urol 2011; 15(4): 222–228.
7. Raghavan MD, Stein JP, Cote D, Jones JS. Bladder Cancer. In: Holland JF, Frei E, eds. Cancer Medicine. 8. ed. Shelton: PMPH-USA; 2009 : 1219–1227.
8. Dinney CP, McConkey DJ, Millikan RE, et al. Focus on bladder cancer. Cancer Cell 2004 Aug; 6(2): 111–6.
9. Luis NM, López-Knowles E, Real FX. Molecular biology of bladder cancer. Clin Transl Oncol 2007 Jan; 9(1): 5–12.
10. Knüchel-Clarke R, Hartman A. Pathogenese und Tumorklassifikation des Harnblasenkarzinoms. Der Onkologe 2012 Nov; 18(11): 961–970.
11. Knowles MA, Hurst CD. Molecular biology of bladder cancer: new insights into pathogenesis and clinical diversity. Nature Reviews Cancer 2015; 15 : 25–41.
12. Lawrence MS, Stojanov P, Polak P, et al. Mutational heterogeneity in cancer and the search for new cancer-associated genes. Nature 2016 July; 499 : 214–218.
13. Choi W, Porten S, Kim S, et al. Identification of distinct basal and luminal subtypes of muscle-invasive bladder cancer with different sensitivities to frontline chemotherapy. Cancer Cell 2014 Feb; 25(2): 152–165.
14. Babjuk M, Soukup V. Intravezikální léčba povrchových nádorů močového měchýře. Urologie pro praxi 2004; 3 : 116–120.
15. Kyselová M. BCG imunoterapie nádorů močového měchýře. Urologie pro praxi 2009; 10 (5): 302–304.
16. Dvořáček J, Babjuk M, et al. Onkourologie. 1. Vydání, Praha: Galén; 2005.
17. Meran JG, Kudlacek S, Beke D. Onkologische Therapie des Harnblasenkarzinoms. Wien Med Wochenschr 2007; 157(7–8): 157–161.
18. Von der Maase H, Sengelov L, Roberts JT, et al. Long-term survival results of a randomized trial comparing gemcitabine plus cisplatin, with methotrexate, vinblastine, doxorubicin, plus cisplatin in patients with bladder cancer. J Clin Oncol 2005 Jul; 23(21): 4602–4608.
19. Hatina J, Kripnerová M. Obecné základy kultivace buněk v tkáňové kultuře. Výukový portál Lékařské fakulty v Plzni [online] 28.3.2014, poslední aktualizace 9. 9. 2014 [cit. 2015-06-30] Dostupný z WWW: <http://mefanet.lfp.cuni.cz/clanky.php?aid=332>. ISSN 1804-4409
20. Hatina J, Kripnerová M, Matoušková E. Orgánové, organotypické a trojrozměrné kultury. Výukový portál Lékařské fakulty v Plzni [online] 28.1.2015, poslední aktualizace 9. 3. 2015 [cit. 2015-06-30] Dostupný z WWW: <http://mefanet.lfp.cuni.cz/clanky.php?aid=441>. ISSN 1804-4409.
21. Earl J, Rico D, Carrillo-de-Santa-Pau E, et al. The UBC-40 Urothelial Bladder Cancer cell line index: a genomic resource for functional studies. BMC Genomics 2015 May; 16(1): 403.
22. Seifert HH, Meyer A, Cronauer MV, et al. A new and reliable culture system for superficial low-grade urothelial carcinoma of the bladder. World J Urol. 2007 Jun; 25(3): 297–302.
23. Koch A, Hatina J, Rieder H, et al. Discovery of TP53 splice variants in two novel papillary urothelial cancer cell lines. Cell Oncol (Dordr) 2012 Aug; 35(4): 243–257.
24. Hatina J, Kripnerova M, Tukova J, et al. Tumor-Stroma Interaktionen im Harnblasenkarzinom. Urologe 2015; 54 : 516–525.
25. Hatina J, Ruzicka T. Stellenwert der Zellkulturmodelle in kutaner Tumorbiologie. Teil I: Zelllinien tumorigen transformierter Zellen. Hautarzt. 2008 Jan; 59(1): 36–45.
26. Sarkar S, Jülicher KP, Burger MS, et al. Different combinations of genetic/epigenetic alterations inactivate the p53 and pRb pathways in invasive human bladder cancers. Cancer Res 2000 Jul 15; 60(14): 3862–3871.
27. Hatina J, Huckenbeck W, Rieder H, Seifert HH, Schulz WA. Harnblasenkarzinomzelllinien als Modellsysteme zur Pathobiologie des Harnblasenkarzinoms. Überblick und Etablierung einer neuen Progressionsserie. Urologe A 2008 Jun; 47(6): 724–734.
28. Bubenik J, Baresova M, Viklicky V, et al. Established cell line of urinary bladder carcinoma (T24) containing tumour-specific antigen. Int J Cancer 1973 May; 11(3): 765–773.
29. Gildea JJ, Golden WL, Harding MA, Theodorescu D. Genetic and phenotypic changes associated with the acquisition of tumorigenicity in human bladder cancer. Genes Chromosomes Cancer 2000 Mar; 27(3): 252–63.
30. Wu Y, McRoberts K, Berr SS, et al. Neuromedin U is regulated by the metastasis suppressor RhoGDI2 and is a novel promoter of tumor formation, lung metastasis and cancer cachexia. Oncogene 2007 Feb 1; 26(5): 765–773.
31. Chaffer CL, Brennan JP, Slavin JL, et al. Mesenchymal-to-epithelial transition facilitates bladder cancer metastasis: role of fibroblast growth factor receptor-2. Cancer Res 2006 Dec; 66(23): 11271–11278.
32. Makridakis M, Gagos S, Petrolekas A, et al. Chromosomal and proteome analysis of a new T24-based cell line model for aggressive bladder cancer. Proteomics 2009 Jan; 97–98.
33. Karam JA, Huang S, Fan J, et al. Upregulation of TRAG3 gene in urothelial carcinoma of the bladder. Int J Cancer 2011 Jun; 128(12): 2823–2832.
34. Moscow JA, Schneider E, Sikic BI, Morrow CS, Cowan KH. Drug resistance and its clinical circumvention. In: Holland JF, Frei E, eds. Cancer Medicine. 8. ed. Shelton: PMPH-USA; 2010 : 597–610.
35. Bambury RM, Rosenberg JE. Advanced urothelial carcinoma: overcoming treatment resistance through novel treatment approaches. Front Pharmacol 2013 Feb; 4 : 1–7.
36. Seemann O, Muscheck M, Siegsmund M, et al. Establishnent and characterization of a multidrug - resistant human bladder carcinoma cell line RT112/D21. Urol Res 1995; 22 : 353–360.
37. Usansky JI, Liebert M, Wedemeyer G, Grossman HB, Wagner JG. The uptake and efflux of doxorubicin by a sensitive human bladder cancer cell line and its doxorubicin-resistant subline. Sel Cancer Ther 1991 Winter; 7(4): 139–150.
38. Tanaka M, Grossman HB. In vivo gene therapy of human bladder cancer with PTEN suppresses tumor growth, downregulates phosphorylated Akt, and increases sensitivity to doxorubicin. Gene Ther 2003 Sep; 10(19): 1636–1642.
39. Hong JH, Lee E, Hong J, Shin YJ, Ahn H. Antisense Bcl2 oligonucleotide in cisplatin-resistant bladder cancer cell lines. BJU Int 2002 Jul; 90(1): 113–117
40. Muramaki M, So A, Hayashi N, et al. Chemosensitization of gemcitabine-resistant human bladder cancer cell line both in vitro and in vivo using antisense oligonucleotide targeting the anti-apoptotic gene, clusterin. BJU Int 2009 Feb; 103(3): 384–390.
41. Siegsmund MJ, Marx C, Seemann O, et al. Cisplatin-resistant bladder carcinoma cells: enhanced expression of metallothioneins. Urol Res 1999 Jun; 27(3): 157–163.
42. Byun SS, Kim SW, Choi H, Lee C, Lee E. Augmentation of cisplatin sensitivity in cisplatin-resistant human bladder cancer cells by modulating glutathione concentrations and glutathione-related enzyme activities. BJU Int 2005 May; 95(7): 1086–1090.
43. Hour TC, Lai YL, Kuan CI, et al. Transcriptional up-regulation of SOD1 by CEBPδ: a potential target for cisplatin resistant human urothelial carcinoma cells. Biochem Pharmacol 2010 Aug 1; 80(3): 325–334.
44. Kim JK, Kim KD, Lee E, et al. Up-regulation of Bfl-1/A1 via NF-kappaB activation in cisplatin-resistant human bladder cancer cell line. Cancer Lett 2004 Aug 20; 212(1): 61–70.
45. Lee S, Yoon CY, Byun SS, Lee E, Lee SE. The role of c-FLIP in cisplatin resistance of human bladder cancer cells. J Urol 2013 Jun; 189(6): 2327–2334.
46. Yu HM, Wang TC. Mechanism of cisplatin resistance in human urothelial carcinoma cells. Food Chem Toxicol 2012 May; 50(5): 1226–1237.
47. Tsunoda T, Koga H, Yokomizo A, et al. Inositol 1,4,5-trisphosphate (IP3) receptor type1 (IP3R1) modulates the acquisition of cisplatin resistance in bladder cancer cell lines. Oncogene 2005 Feb; 24(8): 1396–1402.
48. Miura N, Takemori N, Kikugawa T, et al. Adseverin: a novel cisplatin-resistant marker in the human bladder cancer cell line HT1376 identified by quantitative proteomic analysis. Mol Oncol 2012 Jun; 6(3): 311–322.
49. Meng Q, Lei T, Zhang M, et al. Identification of proteins differentially expressed in adriamycin-resistant (pumc-91/ADM) and parental (pumc-91) human bladder cancer cell lines by proteome analysis. J Cancer Res Clin Oncol 2013 Mar; 139(3): 509–519.
50. Greife A, Tukova J, Steinhoff C, et al. Establishment and characterization of a bladder cancer cell line with enhanced doxorubicin resistance by mevalonate pathway activation. Tumour Biol. 2015 May; 36(5): 3293–3300.
51. Yeganeh B, Wiechec E, Ande SR. Targeting the mevalonate cascade as a new therapeutic approach in heart disease, cancer and pulmonary disease. Pharmacol Ther 2014 Jul; 143(1): 87–110.
52. Clendening JW, Penn LZ. Targeting tumor cell metabolism with statins. Oncogene 2012 Nov; 31(48): 4967–4978.
53. Kornblau SM, Banker DE, Stirewalt D, et al. Blockade of adaptive defensive changes in cholesterol uptake and synthesis in AML by the addition of pravastatin to idarubicin + high-dose Ara-C: a phase 1 study. Blood 2007 Apr; 109(7): 2999–3006.
Štítky
Detská urológia Nefrológia Urológia
Článok vyšiel v časopiseČeská urologie
Najčítanejšie tento týždeň
2015 Číslo 4- Aktuálne európske odporúčania pre liečbu renálnej koliky v dôsledku urolitiázy
- MUDr. Šimon Kozák: V algeziológii nič nefunguje zázračne cez noc! Je dôležité nechať si poradiť od špecialistov
- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- ROK 2015 PRINIESOL ĎALŠÍ ROZVOJ EDUKAČNÝCH AKTIVÍT ČUS A SUS
- LAPAROSKOPICKÁ RESEKCE LEIOMYOMU TRIGONA MOČOVÉHO MĚCHÝŘE
- LÉČBA LOKALIZOVANÉHO A LOKÁLNĚ POKROČILÉHO KARCINOMU PROSTATY Z POHLEDU UROLOGA A RADIAČNÍHO ONKOLOGA
- BUNĚČNÉ MODELY CHEMOREZISTENCE UROTELIÁLNÍHO KARCINOMU
- ODVOZENÍ A CHARAKTERIZACE BUNĚČNÉHO MODELU MULTILÉKOVÉ REZISTENCE UROTELIÁLNÍHO KARCINOMU
- RADIAČNÍ ZÁTĚŽ PACIENTŮ PODSTUPUJÍCÍCH PERKUTÁNNÍ NEFROLITOTRYPSI NA UROLOGICKÉM ODDĚLENÍ NEMOCNICE ČESKÉ BUDĚJOVICE
- SEDMILETÉ ZKUŠENOSTI S APLIKACÍ RÁZOVÝCH VLN U MUŽŮ S INDURATIO PENIS PLASTICA (IPP)
- SYNCHRONNÍ BILATERÁLNÍ SEMINOM VARLETE
- INFIKOVANÁ CYSTA ZPŮSOBUJÍCÍ MECHANICKÝ SYNDROM JAKO KOMPLIKACE RENÁLNÍHO KARCINOMU
- SOUTĚŽ ČUS O NEJLEPŠÍ VĚDECKOU PUBLIKACI ZA ROK 2014
- WORKSHOP „MÍSTO BOTULINUMTOXINU V TERAPII DYSFUNKCÍ DOLNÍCH CEST MOČOVÝCH“
- TISKOVÁ KONFERENCE ČESKÉ UROLOGICKÉ SPOLEČNOSTI NA TÉMA RAKOVINA PROSTATY
- ANDROLOGIE V UROLOGICKÉ PRAXI – ZPRÁVA O PRŮBĚHU SYMPOZIA
- Česká urologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- SEDMILETÉ ZKUŠENOSTI S APLIKACÍ RÁZOVÝCH VLN U MUŽŮ S INDURATIO PENIS PLASTICA (IPP)
- SYNCHRONNÍ BILATERÁLNÍ SEMINOM VARLETE
- INFIKOVANÁ CYSTA ZPŮSOBUJÍCÍ MECHANICKÝ SYNDROM JAKO KOMPLIKACE RENÁLNÍHO KARCINOMU
- LÉČBA LOKALIZOVANÉHO A LOKÁLNĚ POKROČILÉHO KARCINOMU PROSTATY Z POHLEDU UROLOGA A RADIAČNÍHO ONKOLOGA
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



