-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Diagnostika karcinomu prostaty pomocí fúzní biopsie
MRI ultrasound fusion biopsy in the diagnosis of prostate cancer
A literature review of techniques, results and the current role of MRI/US fusion biopsy in the diagnosis of prostate cancer
The detection of prostate cancer still requires histological proof, usually obtained through pros ‑ tate biopsy While standard systematic biopsy has a low detection rate and carries a risk of serious adverse events, MRI ultrasound fusion biopsy tech ‑ nology offers to overcome these shortcommings In recent years, many studies concerning magnetic resonance of the prostate were published, often with conflicting outcomes
In this paper we present a literature review pertaining to the limitations of current prostate biopsy methods, magnetic resonance imaging of the prostate and its use in targeting prostate biopsies with the goal to assess MRI’s role in the current diagnostic algorithm of prostate cancer
Based on pubished studies a conclusion can be made that MRI‑guided prostate biopsy detects more clinically significant cancer than systematic biopsy using fewer cores, particularly in the repeat biopsy subgroup Some prostate cancer is not de ‑ tected by MRI, as such systematic biopsies should still be obtained when performing an MRI‑guided biopsy Given the heterogeneity of available studies further investigation is needed with large multi ‑ institutional trials
KEY WORDS:
Prostate, cancer, biopsy, MRI, fusion
Autori: Jiří Stejskal 1; Vanda Jašková 1; Adam Pavličko 2; Jana Votrubová 2; Radoslav Matěj 3; Miroslav Záleský 1,4; Roman Zachoval 1,4,5
Pôsobisko autorov: Urologické oddělení, Thomayerova nemocnice, Praha 1; Radiodiagnostické oddělení, Thomayerova nemocnice, Praha 2; Oddělení patologie, Thomayerova nemocnice, Praha 3; 1. lékařská fakulta, Univerzita Karlova, Praha 4; 3. lékařská fakulta, Univerzita Karlova, Praha 5
Vyšlo v časopise: Ces Urol 2018; 22(2): 87-98
Kategória: Přehledový článek
Súhrn
Přehled literatury popisující techniky, výsledky a aktuální roli MRI/US fúzní biopsie prostaty v dia ‑ gnostice karcinomu prostaty
Detekce karcinomu prostaty je stále závislá na jeho histologickém průkazu pomocí punkční
biopsie prostaty Standardní systematická biopsie má dlouhodobě nízkou frekvenci záchytu karci ‑ nomu a jako invazivní zákrok je zatížena rizikem komplikací Obejít tyto nevýhody by mohlo přes ‑ nější cílení biopsie pomocí magnetické rezonan ‑ ce O využití magnetické rezonance při biopsiích prostaty bylo publikováno mnoho prací, často s odlišnými závěry
V následujícím textu nabízíme přehled literatury pojednávající o nedostatcích biopsie prostaty, vy ‑ užití magnetické rezonance při zobrazení prostaty a navádění biopsií prostaty s cílem nastínit roli MRI naváděných biopsií v současném algoritmu diagnostiky karcinomu prostaty
Z množství prací publikovaných na téma MRI naváděné biopsie prostaty lze usoudit, že MRI cí ‑ lená biopsie prostaty dosahuje vyššího záchytu klinicky signifikantního karcinomu než systematická biopsie pomocí menšího množství vzorků, což je zvláště patrné u pacientů po předchozí negativní biopsii Pro riziko přítomnosti karcinomu prostaty, který není patrný na magnetické rezonanci, je po odběru cílené biopsie stále třeba provést i biopsii systematickou Pro výraznou heterogenitu dostup ‑ ných prací trvá potřeba velkých multicentrických studií.
KLÍČOVÁ SLOVA:
Prostata, karcinom, biopsie, MRI, fúze
ÚVOD
Karcinom prostaty (PCa) je zhoubné nádorové onemocnění specifické četným výskytem jeho klinicky insignifikantní varianty a častým výrazným ovlivněním kvality života pacienta aktivní léčbou. Diagnostika onemocnění a rozhodnutí o jeho terapii či sledování je závislá na histologickém průkazu PCa ve tkáni prostaty.
Standardem získání vzorků k histologickému průkazu PCa je již více než 30 let transrektálním ultrazvukem (TRUS) naváděná punkční biopsie (Bx) prostaty. Většina pacientů je k Bx prostaty indikována na základě elevace prostatického specifického antigenu (PSA), která upozorňuje na riziko přítomnosti PCa, nehovoří však o jeho lokalizaci. Při následné Bx prostaty většinou nejsou ložiska možného výskytu PCa na ultrazvuku patrná, odběr vzorků tedy nemůže být zaměřen na tato konkrétní ložiska a nezbývá než provést systematický odběr s cílem co nejlepšího pokrytí prostaty. Systematická Bx prostaty nicméně může ložisko PCa prostaty zcela minout nebo zachytit pouze jeho méně agresivní oblast. Dále může dojít k náhodnému záchytu klinicky insignifikantního onemocnění. Jako diagnostická metoda má tedy TRUS Bx mnohé nedostatky, z nichž hlavním je její nízká frekvence detekce PCa (u 12vzorkové první Bx 30–50 %), metoda je rovněž zatížena rizikem infekčních či krvácivých komplikací a diskomfortem pacienta (1).
Jako slibný nástroj ke zvýšení záchytu klinicky signifikantního PCa a následného snížení počtu opakovaných Bx se jeví použití zobrazení prostaty pomocí magnetické rezonance při navádění punkčních Bx. Cílem článku je upozornit na trvající nedostatky standardně prováděné systematické Bx prostaty, popsat přínos multiparametrické magnetické rezonance (mpMRI) prostaty a následně přiblížit jednotlivé metody použití mpMRI prostaty při cílených Bx a jejich přínos na základě dat publikovaných v databázi PubMed.EAU.
SOUČASNÁ METODIKA BIOPSIE PROSTATY
Dle současných doporučení Evropské urologické společnosti (EAU) je indikací k Bx prostaty opakovaná elevace PSA či suspekce na přítomnost PCa při vyšetření per rectum. Standardem odběru vzorků je následně transrektální či (méně často) transperineální, TRUS naváděná Bx s odběrem 10–12 vzorků (2).
Transrektální ultrasonografie sice dokáže dobře zobrazit anatomii prostaty, stran zobrazení suspektních ložisek v prostatě však není dostatečně senzitivní (pouze 43 % lézí popsaných na mpMRI je patrných na TRUS, v případě PIRADS 5 ložisek je to 62 %) (3). Dosud tedy nebylo možné Bx prostaty přesně cílit a bylo nutné provést náhodný odběr dle různých schémat (4, 5). Při systematické 12vzorkové Bx je PCa zachycen ve 30–50 % indikovaných prvních Bx, u druhé a třetí Bx je to cca 10–35 % a 10 % respektive. Rozšířená (saturační) Bx (odběr více než 20 vzorků (6)), prováděná v celkové anestezii zachytí PCa v 13–46 % (1, 6). Další nevýhodou je riziko falešně negativního výsledku či záchyt klinicky insignifikantního PCa.
KOMPLIKACE BIOPSIE PROSTATY
Jako invazivní vyšetření je Bx prostaty zatížena riziky komplikací. Nejčastějšími komplikacemi jsou přechodná hematurie, hemospermie či rektoragie (2, 7). Tyto jsou obvykle jen přechodné a pacienta na životě neohrozí, ve vzácných případech (<1 %) se však může jednat o závažné krvácení s nutností hospitalizace (8).
Další možnou komplikací po Bx prostaty jsou mikční obtíže. Riziko močové retence je < 2 %, nicméně až 25 % pacientů pozoruje po Bx přechodné zhoršení mikčního proudu (8).
Závažnějším rizikem Bx prostaty jsou i přes antibiotickou profylaxi infekční komplikace, jejichž výskyt se navíc vinou vrůstajících bakteriálních rezistencí zvyšuje (9). Mezi obvyklé infekční komplikace patří prostatitida či akutní epididymitida, které mohou vyústit až v život ohrožující septický stav (8). Riziko infekčních komplikací je u první Bx i reBx stejné, nicméně s počtem Bx se zvyšuje kumulativní riziko (10).
Z pohledu pacienta Bx často představuje vyšetření nepříjemné až bolestivé. Někteří pacienti uvádějí před či po Bx zhoršení celkového psychického stavu, úzkost, deprese či přechodné poruchy erekce (11, 12). Část těchto obtíží lze přisoudit nejistotě z výsledku Bx, to je však jen další motivací k co nejdůkladnějšímu vyšetření před vlastní indikací k Bx prostaty. Zastoupení komplikací po Bx prostaty shrnuje tabulka 1.
Tab. 1. Komplikace po biopsii prostaty (EAU guidelines) (2)
Tab. 1. Prostate biopsy complications (EAU guidelines) (2)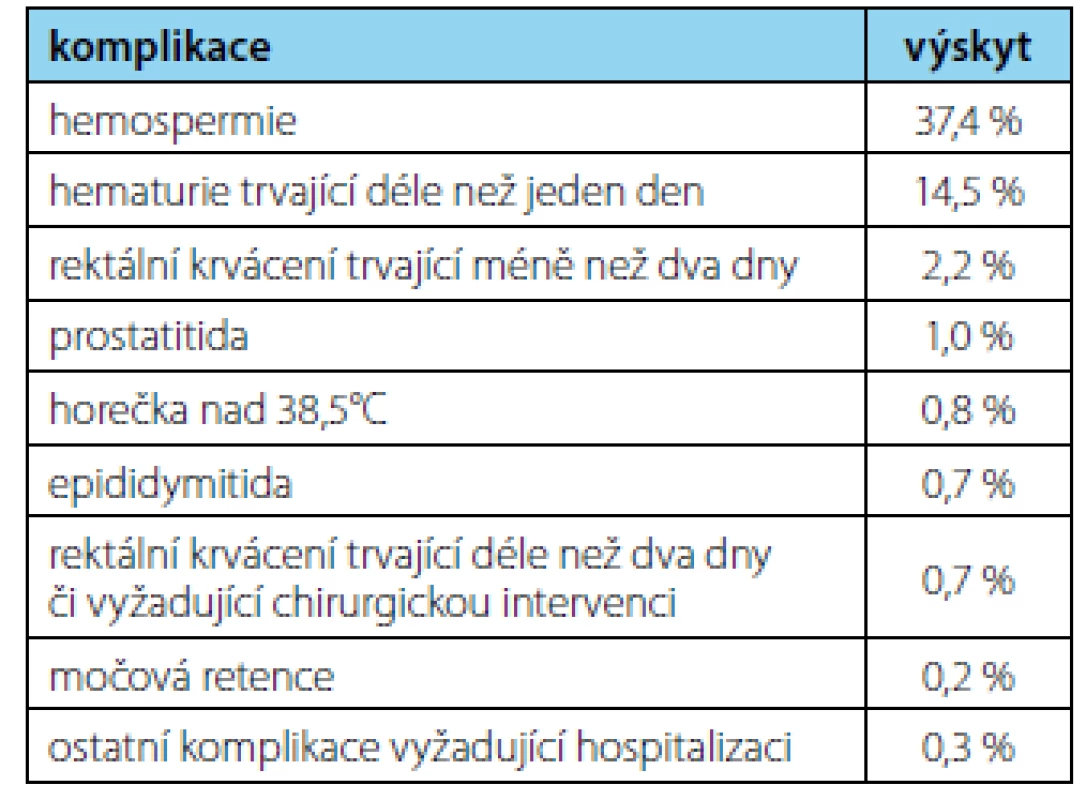
MULTIPARAMETRICKÁ MAGNETICKÁ REZONANCE
Zobrazovací metodou s nejvyšší senzitivitou záchytu PCa je aktuálně magnetická rezonance. Při detekci a hodnocení podezřelých ložisek prostaty je klíčové její multiparametrické provedení.
Při mpMRI je nejprve provedena nativní T2 vážená sekvence (T2WI), která zobrazí anatomii prostaty s vysokým rozlišením, ložiska PCa se jeví jako oblasti nízké intenzity signálu (13), je dobře patrná kapsula prostaty a eventuální extraprostatická extenze tumoru. Dále jsou doplněny další sekvence představující funkční zobrazení. Difúzně vážené zobrazení (difusion weighted imaging, DWI), při kterém je měřena difuze molekul vody (13). Při DWI má ložisko PCa vyšší buněčnou hustotu a tudíž umožňuje nižší difuzi, molekuly vody jsou stabilní a ložisko se zobrazí jako oblast vyšší intenzity. Na základě měření difuze je stanoven tzv. difuzní koeficient (apparent diffusion coefficient, ADC). Do multiparametrického MRI zobrazení prostaty patří též sekvence s použitím MRI kontrastní látky (dynamic contrast enhancement, DCE), na kterém je pro ložiska PCa charakteristické rychlé sycení a následné vyplavení kontrastu. Dále může být doplněna MR spektroskopie (MRS) (13), při které je měřena koncentrace metabolitů, zejména cholinu, kreatininu a citrátu ve vyšetřované oblasti, PCa je typický vyšším zastoupením cholinu a kreatininu. Výše uvedené sekvence multiparametrického MR zobrazení prostaty zvyšují senzitivitu vyšetření v porovnání se samotným T2W zobrazením (14, 15).
Zobrazení prostaty magnetickou rezonancí může být provedeno pomocí povrchové či kombinací povrchové a endorektální cívky. Endorektální cívka sice lehce zvyšuje dyskomfort pacienta při mpMRI a cenu vyšetření, zvyšuje však kvalitu zobrazení z pohledu hodnotícího radiologa (16) a korelaci se stagingem preparátu radikální prostatektomie (17). Toto je s výhodou zejména při horší dostupnosti 3 T MRI techniky, neboť použitím endorektální cívky dosahuje 1,5 T MRI kvality zobrazení srovnatelné s povrchovým 3 T MRI (16, 18). Použití endorektální cívky při 3 T vyšetření dále zlepšuje detekci menších ložisek PCa (19).
Použitím multiparametrického MR vyšetření lze dosáhnout zejména vysoké senzitivity a negativní prediktivní hodnoty (obojí přes 90 %). Specificita mpMRI se pohybuje mezi 22–41 % a pozitivní prediktivní hodnota mezi 47–52 % (20, 21, 22, 23). Senzitivita mpMRI se zvyšuje s velikostí léze, hodnotou Gleasonova skóre a extraprostatickou expanzí ložiska (24, 25) (tabulka 2). Pro nízkou specificitu mpMRI nicméně trvá potřeba histologické verifikace nálezu.
Tab. 2. Záchyt karcinomu prostaty pomocí mpMRI (52)
Tab. 2. Detection of prostate cancer using mpMRI (52)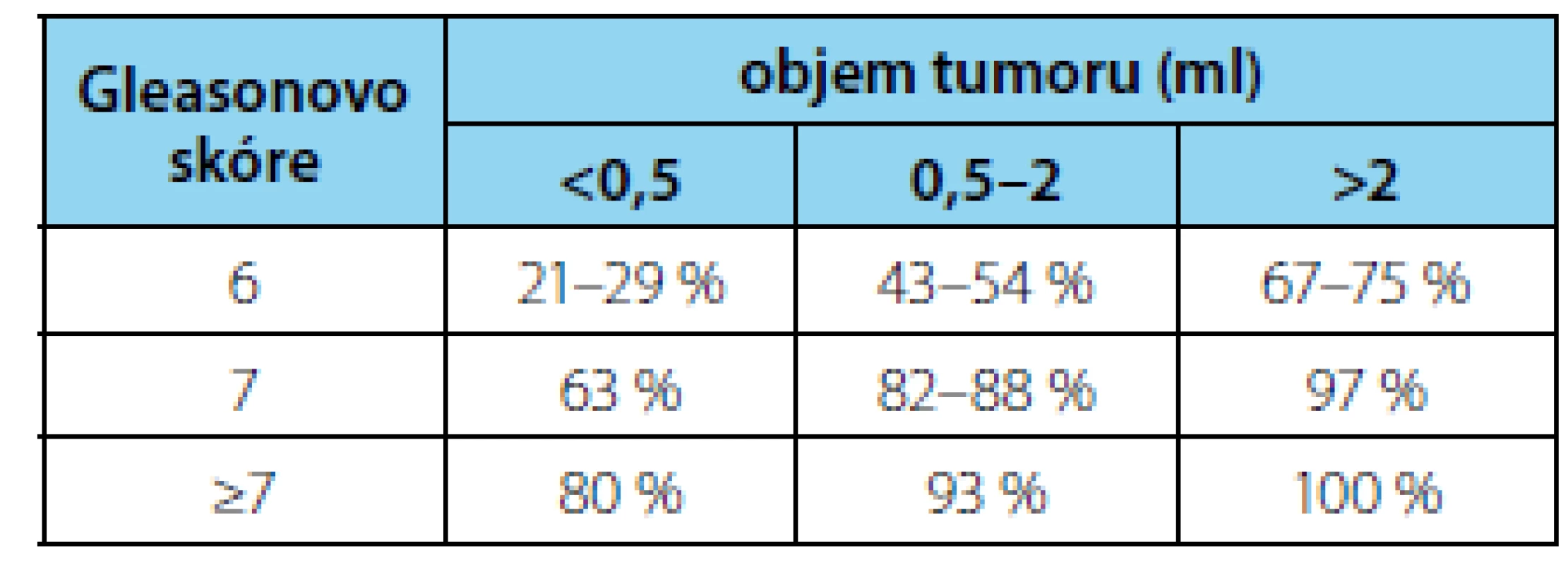
Hodnocení multiparametrického MR vyšetření má vysoké nároky na zkušenosti radiologa a její interpretace je subjektivní. Ke snížení variability hodnocení mezi jednotlivými radiology byl proto v roce 2012 vypracován standardizovaný systém hodnocení PI‑RADS (Prostate Imaging and Reporting Archiving Data System). Jednotlivým modalitám MR zobrazení (T2WI, DCE, DWI, MRSI) je přidělena hodnota od 1 (přítomnost klinicky signifikantního PCa je nepravděpodobná) do 5 (pravděpodobně klinicky signifikantní PCa) a nakonec je stanovena souhrnná hodnota PIRADS pro každou lézi zvlášť (14, 15).
Původní systém PIRADS měl však, jak se ukázalo později, své nedostatky a nepřinesl očekávané snížení variability hodnocení mpMRI mezi jednotlivými radiology. Proto byla v roce 2015 vytvořena verze 2 systému PI‑RADS (18), ve které byla stanovena dominantní sekvence zobrazení pro periferní (DWI) a přechodnou (T2WI) zónu. DCE má nyní pouze doplňkovou úlohu (hodnocena pouze jako pozitivní či negativní při hodnocení periferní zóny). Pro vyšší nároky na technické vybavení a čas při nevýrazném přínosu bylo upuštěno od MRS. Celkové PIRADS 2 skóre léze potom není součtem dílčích známek, ale je samostatně hodnoceno na stupnici 1–5. Dále bylo upraveno schematické rozdělení prostaty (26). V současné době je pro snížení nároků na techniku a čas a zpřesnění popisu MRI stále více upřednostňován systém PIRADS 2 (obr. 1).
Obr. 1. Hodnocení PIRADS zvlášť pro periferní a centrální zónu a rozdělení prostaty podle systému PI-RADS verze 2 (18)
Pic. 1. The PIRADS version 2 charts for peripheral and transition zones with an updated diagram of prostate zones (18)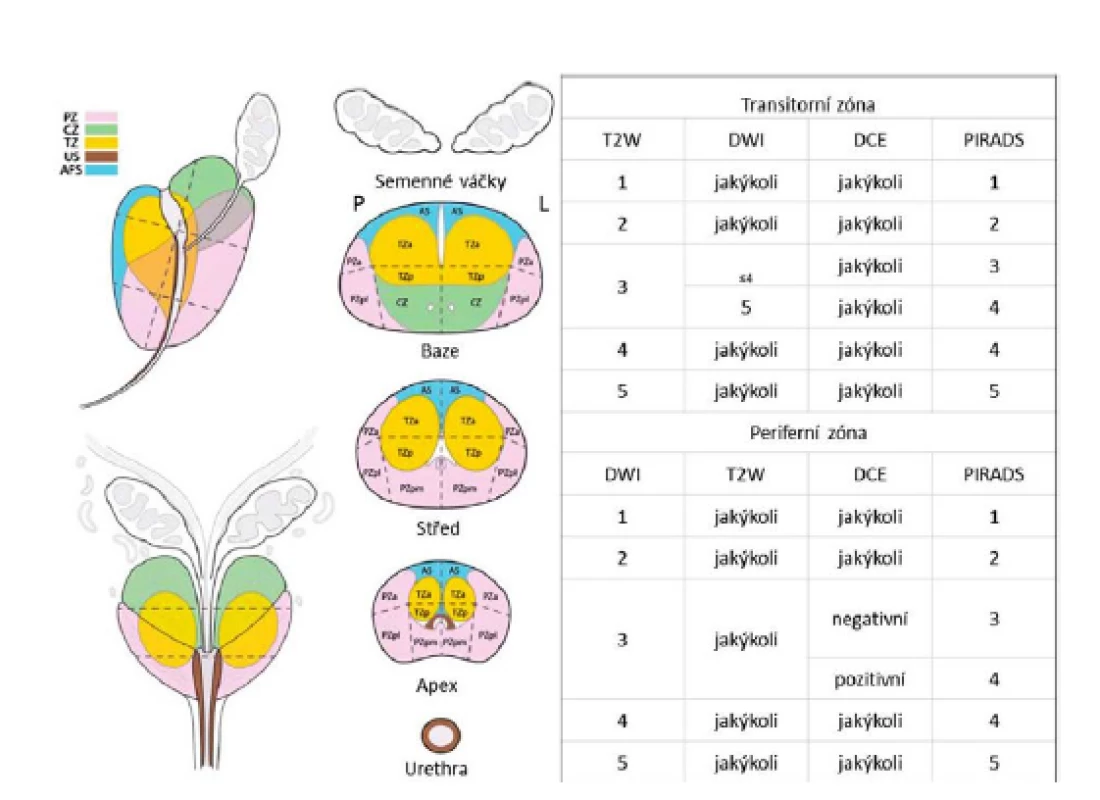
PZ – periferní zóna (peripheral zone), CZ – centrální zóna (central zone), TZ – tranzitorní zóna (transitional zone), US – uretrální svěrač (urethral sphincter), AFS – přední fibromuskulární stroma (anterior fibromuscular stroma), T2W – T2 vážené zobrazení (T2 weighted imaging), DWI – difuzně vážené zobrazení (diffusion-weighted imaging), DCE – zobrazení s pomocí kontrastní látky (dynamic contrast enhanced imaging). Výše uvedené výhody zobrazení prostaty pomocí mpMRI by bylo vhodné využít při cílení Bx prostaty a překonat tak nedostatky zobrazení prostaty ultrazvukem. K navádění Bx prostaty lze použít jak samotnou mpMRI, tak kombinaci (fúzi) TRUS a mpMRI. Dle použité metodiky fúze potom hovoříme o kognitivní či softwarové fúzi.
BIOPSIE PROSTATY NAVÁDĚNÁ POMOCÍ OBRAZU MULTIPARAMETRICKÉ MAGNETICKÉ REZONANCE ČI JEHO FÚZE TRANSREKTÁLNÍM ULTRAZVUKEM
In‑bore biopsie
Multiparametrická magnetická rezonance může být k navádění Bx prostaty použita přímo. Při této tzv. in‑bore Bx prostaty je pacient v průběhu vyšetření v gantry MR přístroje a speciální nemagnetická sonda vodící jehlu je naváděna pouze pomocí MR zobrazení. Vzorky mohou být odebírány transrektálně i transperineálně. Tato metoda není fúzní Bx, neboť je k odběru vzorků použita pouze jedna zobrazovací metoda. Ve srovnání s klasickou či fúzní Bx prostaty je in‑bore Bx náročnější na čas a technické vybavení. Anestezie je obvykle provedena pomocí instilace lokálního anestetika do rekta.
Obr. 2. Softwarová mpMRI/US fúzní biopsie. Archiv autora
Pic. 2. Software mpMRI guided fusion biopsy. Author’s archive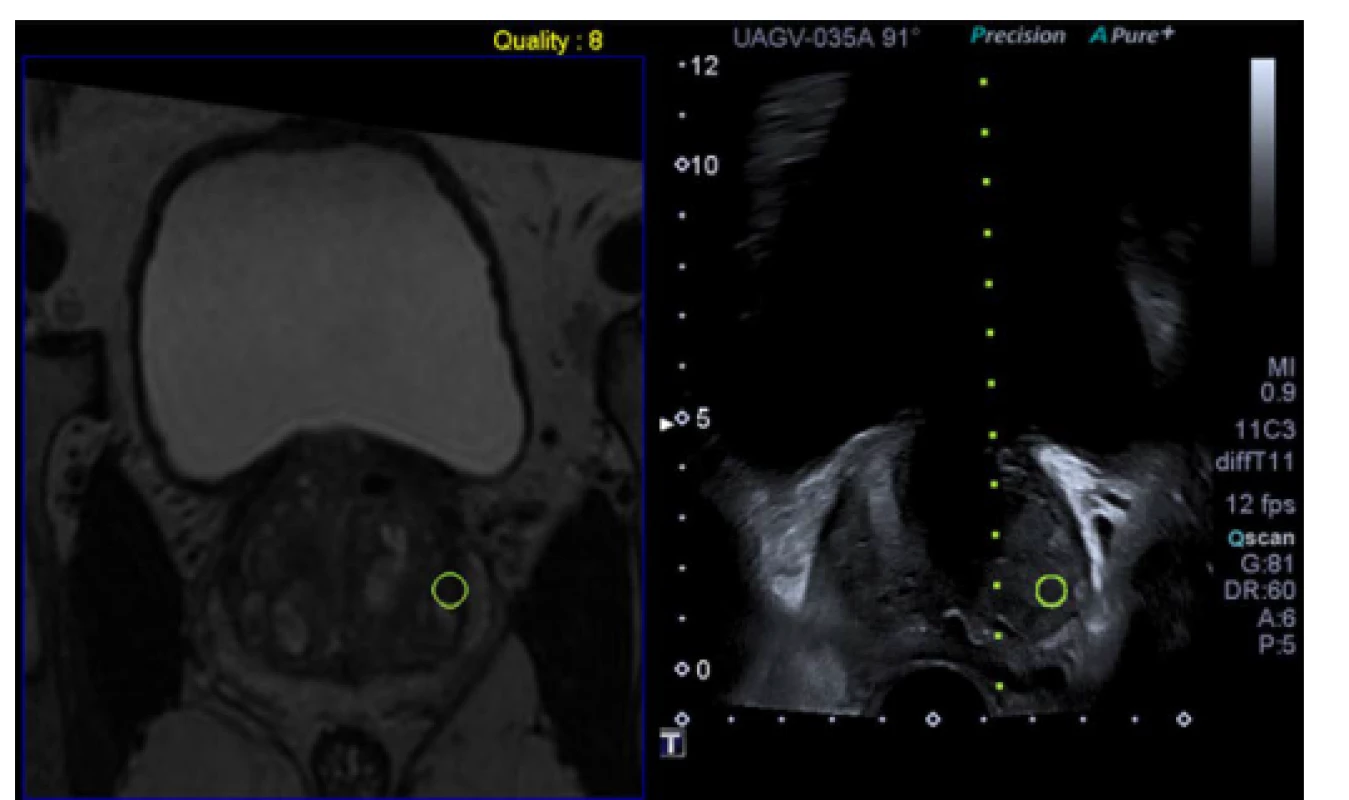
Synchronizované zobrazení prostaty v koronární rovině, vlevo obraz mp MRI, vpravo transrektálního ultrazvuku. Synchronized visualization of the prostate with the mpMRI on the left side and transrectal ultrasound on the right. Coronar aspect V práci z roku 2014 Quentin a kolektiv srovnali efektivitu záchytu PCa ve skupině 128 pacientů při primoBx prostaty pomocí in‑bore techniky (dva vzorky z každého ložiska, maximálně tři ložiska na pacienta) a systematické 12vzorkové Bx. Záchyt PCa byl u obou technik 53,1 %. Zastoupení klinicky signifikantního onemocnění byl též obdobný (systematická 79,4 %, in‑bore Bx 85,3 %). In‑bore Bx však výsledku dosáhla pomocí menšího množství vzorků a v pozitivních vzorcích byl PCa přítomen ve větším rozsahu (27). Felker a kol. hodnotili záchyt PCa pomocí in‑bore Bx u celkem 461 pacientů k první Bx a v aktivním sledování. Záchyt PCa byl v případě primoBx 47 % a u pacientů v aktivním sledování 69 %. Výskyt komplikací (urosepse, hematurie, retence) byl 1 % (28). Schimmöller a kol. srovnali záchyt PCa pomocí transrektální in‑bore Bx prostaty (dva vzorky z každého ložiska) u pacientů podstupujících první a opakovanou Bx v práci z roku 2016 (29). U celkem 297 (160 primoBx a 137 reBx) pacientů byl PCa zachycen v 55,6 % při primoBx a 43,1 % u reBx.
Dyskomfort pacienta při in‑bore Bx prostaty ve srovnání s fúzní Bx (fúzní vzorky + 12 systematických) prostaty popisuje na skupině 210 pacientů Arsov. Při in‑bore Bx byla lokální anestezie provedena pomocí gelu s Lidocainem, při fúzní Bx periprostatickým blokem. I přes celkově větší množství vzorků snášeli pacienti fúzní a následnou systematickou Bx lépe než in‑bore Bx, která navíc trvala podstatně déle (28 vs. 42 min) (30).
Obr. 3. Softwarová mpMRI/US fúzní biopsie. Archiv autora
Pic. 3. Software mpMRI guided fusion biopsy. Author’s archive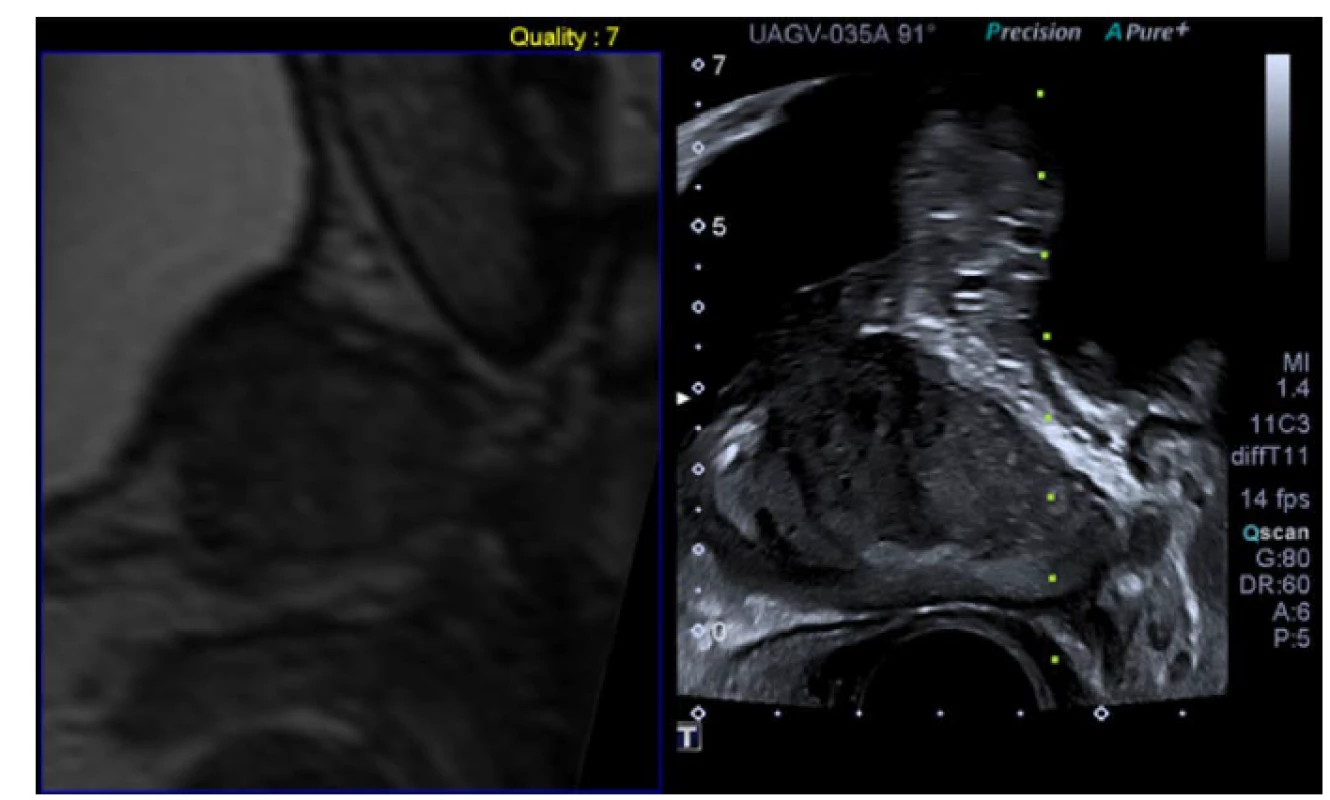
Synchronizované zobrazení prostaty v sagitální rovině, vlevo obraz mp MRI, vpravo transrektálního ultrazvuku. Synchronized visualization of the prostate with the mpMRI on the left side and transrectal ultrasound on the right. Sagittal aspect Fúzní biopsie prostaty
Kognitivní fúze
Kognitivní (cognitive či visual based) fúze je technika nevyžadující kromě mpMRI specializované vybavení. Při tomto typu Bx urolog nejprve zhodnotí výsledky mpMRI předložené radiologem a při následné TRUS naváděné Bx se zaměří na podezřelé oblasti, které ale na TRUS při vyšetření nejsou patrné. Ve srovnání se systematickou Bx prostaty, dosahuje kognitivní fúzní Bx obvykle stejného či vyššího záchytu PCa (31–35), nižší záchyt udává Delongchamps a kol. (36). Ve srovnání se softwarovou fúzní Bx dosahovala v některých studiích kognitivní fúzní Bx stejného záchytu jako softwarová fúzní Bx (32, 33, 37). Jiné studie však popisují signifikantně vyšší záchyt PCa pomocí softwarové fúzní Bx (34, 35). Kognitivní fúze se tedy aktuálně jeví jako metoda dosahujících lepších výsledků v záchytu PCa než systematická Bx, má ale vysoké nároky na zkušenosti vyšetřujícího (interpretace MRI nálezů, orientaci v USG obrazu prostaty, atd.) (38, 39). Obejít tyto nároky může použití softwarové fúze, která tak může snížit variabilitu výsledků kognitivní Bx prostaty v případě méně zkušených lékařů (37).
Softwarová fúze
K navádění Bx byly vytvořeny systémy, které umožňují zobrazit současně jak ultrazvukové vyšetření, tak výsledek předem provedené mpMRI. Základe této tzv. softwarové fúze je synchronizace obou zobrazení (obr. 2 a 3), jejíž provedení se liší dle použitého technického vybavení. Po synchronizaci umožňují systémy softwarové fúze zobrazit jednak aktuální ultrazvukový obraz a dále obraz mpMRI, který je v reálném čase upravován dle pozice ultrazvukové sondy a zobrazuje tedy prostatu ve stejné rovině jako aktuální ultrazvuk se všemi zmíněnými výhodami mpMRI zobrazení. Ložiska podezřelá z přítomnosti PCa jsou radiologem zaznačena (tzv. konturování ložisek) přímo do MRI snímků a tím je cílení vzorků pro vyšetřujícího dále usnadněno. Fúzního zobrazení prostaty lze využít při provedení transrektálních i transperineálních Bx. Takto popsaná metodika softwarové fúze US a mpMRI obrazů je obvykle nazývána rigidní, neboť nezohledňuje deformaci prostaty TRUS sodnou, což musí vyšetřující vzít při odběru vzorků v úvahu. Při tzv. elastické softwarové fúzní Bx je kromě trojrozměrného otočení MR obrazu prostaty dle pohybů ultrazvukové sondy dopočítána i jeho předpokládaná deformace a výsledné zobrazení teoreticky přesněji odpovídá aktuální situaci, na záchyt klinicky signifikantního PCa však toto nemá vliv (40).
První práce popisující techniku fúzní Bx pocházejí z přelomu tisíciletí. V roce 2002 Kaplan popsal u dvou pacientů se vzestupem PSA po radioterapii Bx pomocí fúze TRUS a magnetické rezonance v reálném čase. Karcinom byl zachycen ve třech ze čtyř vzorků (41). V další práci z roku 2008 popsal Singh první zkušenosti se softwarovou fúzní Bx, provedenou při plánovaném zavedení zrn před radioterapií. Pozitivních bylo osm z 11 vzorků (pět z pěti pacientů) (42).
Záchyt PCa pomocí fúzní Bx dobře koreluje se zvyšujícím se PIRADS skóre při primoBx i reBx (43). Je‑li Bx provedena cíleně z ložiska PCa, pravděpodobnost, že následná histologie bude lépe odpovídat charakteru onemocnění je vyšší než při náhodném záchytu tumoru. Dle srovnání s definitivní histologií po radikální prostatektomii umožňuje softwarová fúzní Bx přesnější stanovení Gleasonova skóre ve vzorcích než systematická Bx (44–46).
V první metaanalýze z roku 2013 Moore a kolektiv (47) hodnotil výsledky fúzní (kognitivní i softwarové) Bx při záchytu PCa. Karcinom byl zachycen ve 36 % (z toho 40 % klinicky signifikantních) pacientů pomocí systematické a u 48 % (z toho 70 % klinicky signifikantních) pomocí fúzní Bx. Fúzní Bx byla hodnocena jako přínosná pro záchyt klinicky signifikantního PCa. Vzhledem k heterogenitě hodnocených dat však nebylo možné stanovit jednoznačná doporučení.
Další metaanalýza z téhož roku hodnotila pouze pacienty po předchozí negativní Bx podstupující transperineální, saturační transrektální či fúzní Bx (48). Záchyt PCa byl pro transrektální saturační Bx 30,0 %, pro transperineální 36,8 %, a 37,6 % pro fúzní Bx. Rozdíl v záchytu PCa (včetně klinicky signifikantního) mezi hodnocenými bioptickými technikami nebyl signifikantní, MRI navigovaná Bx ale výsledku dosáhla pomocí menšího počtu vzorků.
In‑bore, kognitivní a softwarová fúze byly hodnoceny zvlášť v metaanalýze z roku 2015. Cílené Bx v této analýze dosáhly vyššího záchytu signifikantního PCa než systematické. Provádění pouze cílených Bx s vynecháním systematického odběru však dle této meta analýzy není bezpečné vzhledem k cca 5–15 % výskytu klinicky signifikantního PCa, který není patrný na mpMRI. Softwarová fúze a In‑bore Bx dosahovaly vyššího záchytu PCa než kognitivní fúze (39).
V jiné metaanalýze z téhož roku byl PCa prostaty opět častěji zachycen pomocí fúzní Bx prostaty než pomocí systematické Bx (49). Záchyt PCa prostaty zde byl 14,3–59,0 % (medián 43,4 %) u systematické a 23,7–82,1 % (medián 50,5 %) u softwarové fúzní Bx. Záchyt klinicky signifikantního PCa byl 4,8–52,0 % (medián 23,6 %) pro systematickou Bx a 13,2–50,0 % (medián 33,3 %) pro softwarovou fúzi.
Obdobné výsledky měla metaanalýza 16 studií z roku 2015 (50) porovnávající (kognitivní i softwarové) fúzní Bx a jednu studii s in‑bore Bx proti systematické Bx. Zjištěná senzitivita vyšetření byla pro cílenou i systematickou Bx obdobná, konkrétně 0,85 pro fúzní Bx a 0,81 pro systematickou Bx (fúzní Bx tedy neodhalila 15 % ze všech zjištěných PCa, systematická Bx 19 %). Klinicky signifikantní PCa byl ale zachycen častěji pomocí fúzní Bx (senzitivita 0,91 vs. 0,76 u systematické). Při analýze podskupin byl záchyt klinicky signifikantního PCa pomocí fúzní Bx vyšší zejména ve skupině pacientů po předchozí negativní Bx. Frekvence záchytu PCa mezi jednotlivými metodami (in‑bore, kognitivní, softwarová fúze) byla obdobná. V metaanalýze byly hodnoceni pouze pacienti s pozitivním nálezem na mpMRI. Vzhledem k riziku přítomnosti klinicky signifikantního PCa, který není na MRI patrný, nebylo na základě této metaanalýzy možno doporučit odběr poze cílených vzorků.
Výsledky in‑bore Bx, softwarové a kognitivní fúze srovnává též Wegelin v metaanalýze z roku 2016 (51). V celkovém záchytu PCa nebyl mezi metodami fúzní Bx ani systematické Bx rozdíl. MRI cílená Bx však zachytila více signifikantního a méně insignifikantního PCa než systematická. Mezi jednotlivými technikami MRI naváděné Bx (in‑bore Bx, softwarová a kognitivní fúze), není v záchytu klinicky signifikantního PCa rozdíl.
Výsledky technik rigidní a elastické softwarové fúze porovnává v metaanalýze 21 studií Venderink. Rozdíl mezi technikami softwarové fúze v záchytu klinicky signifikantního PCa nebyl signifikantní, obě metody však překonaly Bx systematickou (40).
Systematické srovnání publikovaných výsledků softwarové fúzní Bx prostaty je dle autorů nalezených meta‑analýz obtížné, neboť publikované práce se liší použitou metodikou, zejména technikou (přístrojové vybavení, software), bioptickým přístupem (transrektální či transperineální), počtem odebraných vzorků (systematických i fúzních), definicí klinicky signifikantního PCa a mnohdy jsou slučovány skupiny pacientů k první Bx a reBx. Protože dosud neexistuje zlatý standard v provedení fúzní Bx, jsou jednotlivé studie často zaměřeny na srovnání pouze několika konkrétních faktorů (kognitivní versus softwarová fúze…). V mnohých studiích není uveden výskyt komplikací při fúzní Bx, je‑li uveden, je obvykle obdobný systematické Bx, tedy kolem 1 % pro závažné komplikace.
Přínos fúzní Bx prostaty byl tedy v metaanalýzách zatím potvrzen pouze ve skupině pacientů po předchozí negativní Bx, hodnocení bylo ale obtížné pro výraznou heterogenitu jednotlivých studií. Na základě výše uvedených nálezů by dle doporučení EAU měla být u pacientů indikovaných k reBx provedena mpMRI naváděná Bx, preferovaná technika ale není stanovena (2).
U primoBx tedy zatím nebyl přínos fúzní Bx prostaty při záchytu klinicky signifikantního PCa potvrzen. Recentně publikované práce však nabízejí nový náhled na využití mpMRI při první Bx prostaty. Ve studii PROMIS (23) byla mpMRI hodnocena z hlediska schopnosti indikace pacientů k první Bx respektive jejímu odložení. Pacienti (celkem 576) podstoupili nejprve mpMRI, následně systematickou TRUS Bx (10–12 vzorků) a transperineální mapovací Bx (TPM‑Bx, vzorky s odstupem 5 mm pokrývající celou prostatu) zajištující histologickou kontrolu. Senzitivita mpMRI vzhledem k záchytu klinicky signifikantního PCa byla 93 % s negativní prediktivní hodnotou 89 %. Systematická TRUS Bx měla senzitivitu 48 % a negativní prediktivní hodnotu 74 %. Negativní mpMRI mělo 158 (27 %) pacientů, při TPM‑Bx byl u této skupiny klinicky signifikantní PCa zachycen v 17 případech (10,8 %), ve všech případech se jednalo o PCa s Gleasonovým skóre 7 (3+4) a nižším. Soubor pacientů byl následně hodnocen za hypotetické situace, při které by byla Bx prostaty provedena pouze v případe podezřelého nálezu na mpMRI (PIRADS ≥3). Pomocí této mpMRI triáže by se Bx vyhnulo 27 % pacientů, nebylo by však diagnostikováno cca 11 % PCa. Tyto diagnostice uniklé PCa by však byly klinicky nesignifikantní či na hranici klinické signifikance.
ZÁVĚR
Hlavními nedostatky standardní metodiky punkční Bx prostaty jsou nízká frekvence záchytu PCa a častý záchyt klinicky nesignifikantního onemocnění. Použití mpMRI k navádění Bx prostaty zvyšuje záchyt klinicky signifikantního PCa, zejména u pacientů po předchozí negativní Bx. Mezi jednotlivými metodami použití mpMRI v Bx prostaty není při záchytu signifikantního PCa rozdíl, každá z těchto metod však má svá specifika.
Použití mpMRI při odběru cílených vzorků u pacientů po předchozí negativní Bx prostaty je nyní doporučeno EAU jako standardní postup v diagnostice PCa. Pro riziko přítomnosti klinicky signifikantního onemocnění, které není patrné na mpMRI, zatím není provádění pouze cíleného odběru s vynecháním systematické Bx hodnoceno jako bezpečné.
Pro výraznou heterogenitu dostupných studií trvá potřeba velkých multicentrických studií, na základě kterých může být role mpMRI prostaty a při indikaci a cílení Bx prostaty dále upřesněna.
Došlo: 6. 2. 2018
Přijato: 15. 3. 2018
Kontaktní adresa: MUDr. Jiří Stejskal
Urologické oddělení,
Thomayerova nemocnice
Vídeňská 800, 140 59 Praha 4
e‑mail: jiri.stejskal@ftn.cz
Střet zájmů: žádný
Prohlášení o podpoře: Podpořeno z programového projektu Ministerstva zdravotnictví ČR s reg. č. 15–27047 A. Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena.
Zdroje
1. Shariat SF, Roehrborn CG. Using biopsy to detect prostate cancer. Rev Urol 2008; 10(4): 262–280.
2. Mottet N, Bellmunt J, Bolla M, et al. EAU‑ESTRO‑SIOG Guidelines on prostate cancer. Part 1: screening, diagnosis, and local treatment with curative intent. Eur Urol 2017; 71(4): 618–629.
3. van de Ven WJM, Sedelaar JPM, van der Leest MMG, et al. Visibility of prostate cancer on transrectal ultrasound during fusion with multiparametric magnetic resonance imaging for biopsy. Clin Imaging 2016; 40(4): 745–750.
4. Sedelaar JP, Vijverberg PL, De Reijke TM, et al. Transrectal ultrasound in the diagnosis of prostate cancer: state of the art and perspectives. Eur Urol 2001; 40(3): 275–284.
5. Smeenge M, Barentsz J, Cosgrove D, et al. Role of transrectal ultrasonography (TRUS) in focal therapy of prostate cancer: report from a consensus panel. BJU Int 2012; 110(7): 942–948.
6. Čapoun O, Sobotka R, Macek P, Hanuš T. Prediktivní parametry záchytu karcinomu prostaty v saturační biopsii prostaty. Ces Urol 2012; 16(3): 163–170.
7. Morgan E, Drummond FJ, Coyle C, Sharp L, Gavin A. Original article: physical after effects in men undergoing prostate biopsy in routine clinical practice: results from the PiCTure study. Urologic Oncology Seminars and Original Investigations (Internet) 2017;Available from: http://search.ebscohost.com/login. aspx?authtype=shib & custid=s1240919 & profile=eds
8. Loeb S, Vellekoop A, Ahmed HU, et al. Systematic review of complications of prostate biopsy. Eur Urol 2013; 64(6): 876–892.
9. Loeb S, Carter HB, Berndt SI, Ricker W, Schaeffer EM. Complications after prostate biopsy: data from SEER‑Medicare. J Urol 2011; 186(5): 1830–1834.
10. Loeb S, Carter HB, Berndt SI, Ricker W, Schaeffer EM. Is repeat prostate biopsy associated with a greater risk of hospitalization? Data from SEER‑Medicare. J Urol 2013; 189(3): 867–870.
11. Zisman A, Leibovici D, Kleinmann J, Siegel YI, Lindner A. The impact of prostate biopsy on patient well‑being: a prospective study of pain, anxiety and erectile dysfunction. J Urol 2001; 165(2): 445–454.
12. Wade J, Rosario DJ, Macefield RC, et al. Psychological impact of prostate biopsy: physical symptoms, anxiety, and depression. J Clin Oncol 2013; 31(33): 4235–4241.
13. Bárta J, Rýznarová Z, Klézl P, et al. Postavení magnetické rezonance a magnetické rezonanční spektroskopie při detekci karcinomu prostaty. Ces Uro 2010; 14(3): 186–196.
14. Yoo S, Kim JK, Jeong IG. Multiparametric magnetic resonance imaging for prostate cancer: a review and update for urologists. Korean J Urol 2015; 56(7): 487–497.
15. Bomers JGR, Barentsz JO. Standardization of multiparametric prostate MR imaging using PI‑RADS. Biomed Res Int 2014; 2014 : 431680.
16. Shah ZK, Elias SN, Abaza R, et al. Performance comparison of 1.5-T endorectal coil MRI with 3.0-T nonendorectal coil MRI in patients with prostate cancer. Acad Radiol 2015; 22(4): 467–474.
17. Park BK, Kim B, Kim CK, Lee HM, Kwon GY. Comparison of phased‑array 3.0-T and endorectal 1.5-T magnetic resonance imaging in the evaluation of local staging accuracy for prostate cancer. J Comput Assist Tomogr 2007; 31(4): 534–538.
18. Weinreb JC, Barentsz JO, Choyke PL, et al. PI‑RADS Prostate Imaging – Reporting and Data System: 2015, Version 2. Eur Urol 2016; 69(1): 16–40.
19. Turkbey B, Merino MJ, Gallardo EC, et al. Comparison of endorectal coil and nonendorectal coil T2W and diffusion‑weighted MRI at 3 Tesla for localizing prostate cancer: correlation with whole‑mount histopathology. J Magn Reson Imaging 2014; 39(6): 1443–1448.
20. Thompson JE, van Leeuwen PJ, Moses D, et al. The diagnostic performance of multiparametric magnetic resonance imaging to detect significant prostate cancer. J Urol 2016; 195(5): 1428–1435.
21. Fütterer JJ, Briganti A, De Visschere P, et al. Can clinically significant prostate cancer be detected with multiparametric magnetic resonance imaging? a systematic review of the literature. Eur Urol 2015; 68(6): 1045–1053.
22. Simmons LAM, Kanthabalan A, Arya M, et al. The PICTURE study: diagnostic accuracy of multiparametric MRI in men requiring a repeat prostate biopsy. Br J Cancer 2017; 116(9): 1159–1165.
23. Ahmed HU, El‑Shater Bosaily A, et al. Diagnostic accuracy of multi‑parametric MRI and TRUS biopsy in prostate cancer (PROMIS): a paired validating confirmatory study. Lancet 2017; 389(10071): 815–822.
24. Turkbey B, Pinto PA, Mani H, et al. Prostate cancer: value of multiparametric MR imaging at 3 T for detection- - histopathologic correlation. Radiology 2010; 255(1): 89–99.
25. Feng TS, Sharif‑Afshar AR, Smith SC, et al. Multiparametric magnetic resonance imaging localizes established extracapsular extension of prostate cancer. Urol Oncol 2015; 33(3): 109.e15–22.
26. Turkbey B, Choyke PL. PIRADS 2.0: what is new? Diagn Interv Radiol 2015; 21(5): 382–384.
27. Quentin M, Blondin D, Arsov C, et al. Prospective evaluation of magnetic resonance imaging guided in‑bore prostate biopsy versus systematic transrectal ultrasound guided prostate biopsy in biopsy naïve men with elevated prostate specific antigen. J Urol 2014; 192(5): 1374–1379.
28. Felker ER, Lee‑Felker SA, Feller J, et al. In‑bore magnetic resonance‑guided transrectal biopsy for the detection of clinically significant prostate cancer. Abdom Radiol (NY) 2016; 41(5): 954–962.
29. Schimmöller L, Blondin D, Arsov C, et al. MRI‑guided in‑bore biopsy: differences between prostate cancer detection and localization in primary and secondary biopsy settings. AJR Am J Roentgenol 2016; 206(1): 92–99.
30. Arsov C, Rabenalt R, Quentin M, et al. Comparison of patient comfort between MR‑guided in‑bore and MRI/ultrasound fusion‑guided prostate biopsies within a prospective randomized trial. World J Urol 2016; 34(2): 215–220.
31. Haffner J, Lemaitre L, Puech P, et al. Role of magnetic resonance imaging before initial biopsy: comparison of magnetic resonance imaging‑targeted and systematic biopsy for significant prostate cancer detection. BJU Int 2011; 108(8 Pt 2): E171–178.
32. Puech P, Rouvière O, Renard‑Penna R, et al. Prostate cancer diagnosis: multiparametric MR‑targeted biopsy with cognitive and transrectal US‑MR fusion guidance versus systematic biopsy – prospective multicenter study. Radiology 2013; 268(2): 461–469.
33. Lee DJ, Recabal P, Sjoberg DD, et al. Comparative effectiveness of targeted prostate biopsy using magnetic resonance imaging ultrasound fusion software and visual targeting: a prospective study. J Urol 2016; 196(3): 697–702.
34. Oberlin DT, Casalino DD, Miller FH, et al. Diagnostic value of guided biopsies: fusion and cognitive‑registration magnetic resonance imaging versus conventional ultrasound biopsy of the prostate. Urology 2016; 92 : 75–79.
35. Oderda M, Faletti R, Battisti G, et al. Prostate cancer detection rate with koelis fusion biopsies versus cognitive biopsies: a comparative study. Urol Int 2016; 97(2): 230–237.
36. Delongchamps NB, Peyromaure M, Schull A, et al. Prebiopsy magnetic resonance imaging and prostate cancer detection: comparison of random and targeted biopsies. J Urol 2013; 189(2): 493–499.
37. Wysock JS, Rosenkrantz AB, Huang WC, et al. A prospective, blinded comparison of magnetic resonance (MR) imaging‑ultrasound fusion and visual estimation in the performance of MR‑targeted prostate biopsy: the PROFUS trial. Eur Urol 2014; 66(2): 343–351.
38. Kwak JT, Hong CW, Pinto PA, et al. Is visual registration equivalent to semiautomated registration in prostate biopsy? Biomed Res Int 2015; 2015 : 394742.
39. Radtke JP, Teber D, Hohenfellner M, Hadaschik BA. The current and future role of magnetic resonance imaging in prostate cancer detection and management. Transl Androl Urol 2015; 4(3): 326–341.
40. Venderink W, de Rooij M, Sedelaar JPM, Huisman HJ, Fütterer JJ. Elastic versus rigid image registration in magnetic resonance imaging‑transrectal ultrasound fusion prostate biopsy: a systematic review and meta‑analysis. Eur Urol Focus. 2016, S2405–4569(16)30101–8.
41. Kaplan I, Oldenburg NE, Meskell P, et al. Real time MRI‑ultrasound image guided stereotactic prostate biopsy. Magn Reson Imaging 2002; 20(3): 295–299.
42. Singh AK, Kruecker J, Xu S, et al. Initial clinical experience with real‑time transrectal ultrasonography‑magnetic resonance imaging fusion‑guided prostate biopsy. BJU Int 2008; 101(7): 841–845.
43. Cash H, Maxeiner A, Stephan C, et al. The detection of significant prostate cancer is correlated with the Prostate Imaging Reporting and Data System (PI‑RADS) in MRI/transrectal ultrasound fusion biopsy. World J Urol 2016; 34(4): 525–532.
44. Le JD, Stephenson S, Brugger M, et al. Magnetic resonance imaging‑ultrasound fusion biopsy for prediction of final prostate pathology. J Urol 2014; 192(5): 1367–1373. 45. Porpiglia F, DE Luca S, Passera R, et al. Multiparametric‑magnetic resonance/ultrasound fusion targeted prostate biopsy improves agreement between biopsy and radical prostatectomy Gleason score. Anticancer Res 2016; 36(9): 4833–4839.
46. Borkowetz A, Platzek I, Toma M, et al. Direct comparison of multiparametric magnetic resonance imaging (MRI) results with final histopathology in patients with proven prostate cancer in MRI/ultrasonography‑fusion biopsy. BJU Int 2016; 118(2): 213–220.
47. Moore CM, Robertson NL, Arsanious N, et al. Image‑guided prostate biopsy using magnetic resonance imaging‑derived targets: a systematic review. Eur Urol 2013; 63(1): 125–140.
48. Nelson AW, Harvey RC, Parker RA, et al. Repeat prostate biopsy strategies after initial negative biopsy: meta‑regression comparing cancer detection of transperineal, transrectal saturation and MRI guided biopsy. PLoS One 2013; 8(2): e57480.
49. Valerio M, Donaldson I, Emberton M, et al. Detection of clinically significant prostate cancer using magnetic resonance imaging‑ultrasound fusion targeted biopsy: a systematic review. Eur Urol 2015; 68(1): 8–19.
50. Schoots IG, Roobol MJ, Nieboer D, et al. Magnetic resonance imaging‑targeted biopsy may enhance the diagnostic accuracy of significant prostate cancer detection compared to standard transrectal ultrasound‑guided biopsy: a systematic review and meta‑analysis. Eur Urol 2015; 68(3): 438–450.
51. Wegelin O, van Melick HHE, Hooft L, et al. Comparing three different techniques for magnetic resonance imaging‑targeted prostate biopsies: a systematic review of in‑bore versus magnetic resonance imaging‑transrectal ultrasound fusion versus cognitive registration. Is there a preferred technique? Eur Urol (Internet) 2016; Available from: http://dx.doi.org/10.1016/j.eururo.2016. 07. 041
52. Bratan F, Niaf E, Melodelima C, et al. Influence of imaging and histological factors on prostate cancer detection and localisation on multiparametric MRI: a prospective study. Eur Radiol 2013; 23(7): 2019–2029.
53. Puech P, Villers A, Ouzzane A, Lemaitre L. Prostate cancer: diagnosis, parametric imaging and standardized report. Diagn Interv Imaging (Internet). 2014 Jul; 95(7–8): 743–752. Available from: http://dx.doi. org/10.1016/j.diii.2014. 06. 012
Štítky
Detská urológia Nefrológia Urológia
Článok vyšiel v časopiseČeská urologie
Najčítanejšie tento týždeň
2018 Číslo 2- Aktuálne európske odporúčania pre liečbu renálnej koliky v dôsledku urolitiázy
- MUDr. Šimon Kozák: V algeziológii nič nefunguje zázračne cez noc! Je dôležité nechať si poradiť od špecialistov
- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Dopady změny antimuskarinika na kvalitu života u pacientů s hyperaktivním měchýřem - výsledky studie VEST
- Porovnání detekce signifikantního a nesignifikantního karcinomu pomocí systematické a cílené fúzní MRI/TRUS biopsie prostaty
- Mondorova choroba penisu - naše zkušenosti
- Vzácný případ eosinofilní funikulitidy
- Jarní edukační urologické sympózium 13.-14. duben 2018, Seč
- 3. ročník KNOU, opět po roce na pražském Andělu
- EAU Kodaň aneb výchova rezidentů v Čechách
- A report from the 5th workshop on advances in urogynaecology and urinary incontinence treatment
- Editorial
- Extraperitoneální robotická radikální prostatektomie s bilaterálním šetřením nervově‑cévních svazků
- Diagnostika karcinomu prostaty pomocí fúzní biopsie
- Využití indocyaninové zeleně při robotických výkonech v urologii
- Česká urologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Mondorova choroba penisu - naše zkušenosti
- Diagnostika karcinomu prostaty pomocí fúzní biopsie
- Využití indocyaninové zeleně při robotických výkonech v urologii
- Vzácný případ eosinofilní funikulitidy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



