-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Aktuální pohled na močovou cytologii: Co by měl urolog vědět?
Current status of urine cytology: what should the urologist know?
Major statement:
Review dealing with urine cytology, actual classification system, and basic rules in collection and storage of the urine specimen. Urine cytology is a non-invasive examination, which is used for detection of neoplastic cells in urine. A new classification for reporting urinary cytology was published in 2016 (so called The Paris System for Reporting Urine Cytology). Implementation of The Paris System will lead to global standardization and uniformity of urine cytology reports. It is important to get to know the new nomenclature and to remember basic rules of urine cytology. Reliable results in urine cytology can be reached only by close cooperation and understanding between urologist and pathologist.
KEY WORDS
Urine cytology, urothelial carcinoma, Paris classification, liquid based cytology
Autori: Kristýna Pivovarčíková 1,2; Tomáš Pitra 3; Milan Hora 3; Marián Švajdler 1,2; Ondřej Hes 1,2
Pôsobisko autorov: Šiklův ústav patologie LF UK a FN Plzeň 1; Bioptická laboratoř, s. r. o., Plzeň 2; Urologická klinika LF UK a FN Plzeň 3
Vyšlo v časopise: Ces Urol 2018; 22(4): 242-250
Kategória: Přehledový článek
Súhrn
Hlavní stanovisko práce:
Přehledový článek zabývající se močovou cytologií, její aktuální klasifikací a připomínající bazální zásady odběru a skladování moče určené pro cytologické vyšetření. Močová cytologie je neinvazivní vyšetření sloužící k detekci nádorových buněk v moči. V roce 2016 byla publikována tzv. Pařížská klasifikace pro hodnocení močových cytologií, která je prvním krokem ke globální standardizaci popisování močových cytologií. Je tedy nutné obeznámit se se základní nomenklaturou této klasifikace a zopakovat hlavní stanoviska a bazální zásady související s močovou cytologií, neboť důvěryhodného výsledku v močové cytologii lze dosáhnout jen úzkou spoluprací a porozuměním mezi odečítajícím patologem a indikujícím urologem.
KLÍČOVÁ SLOVA
Močová cytologie, uroteliální karcinom, Pařížská klasifikace, liquid based cytology.
ÚVOD
Močová cytologie je neinvazivní, relativně snadné a nenákladné vyšetření vzorku moči mikroskopicky (cytologicky), sloužící k detekci buněk uroteliální neoplazie. Vyšetření může dobře sloužit při záchytu a monitoraci pacientů se suspektní uroteliální lézí.
Relativně recentně došlo k velké změně v reportování močových cytologií – byla zavedena nová klasifikace (tzv. Pařížská klasifikace pro hodnocení močových cytologií – The Paris System for Reporting Urinary Cytology (1)). Tato klasifikace vede ke globální standardizaci v hodnocení močových nálezů a postupně proniká do všech patologií napříč republikou. Je tedy nutné obeznámit se se základní nomenklaturou a zopakovat hlavní stanoviska a bazální zásady související s močovou cytologií, neboť důvěryhodného výsledku v močové cytologii lze dosáhnout jen úzkou spoluprací a porozuměním mezi odečítajícím patologem a indikujícím urologem.
PAŘÍŽSKÁ KLASIFIKACE PRO HODNOCENÍ MOČOVÝCH CYTOLOGIÍ
Klasifikace vyšla v roce 2016 a rozeznává celkem sedm kategorií (tab. 1). Každá kategorie má jasně definovaná morfologická (cytologická) kritéria. Vymezení jasných diagnostických kritérií pak má vést ke snížení interobservační variability při odečítání cytologického nálezu různými patology (1).
Tab. 1. Pařížská klasifikace pro hodnocení močových cytologii (diagnostické kategorie)
Tab. 1. The Paris system for reporting urinary cytology (diagnostic categories)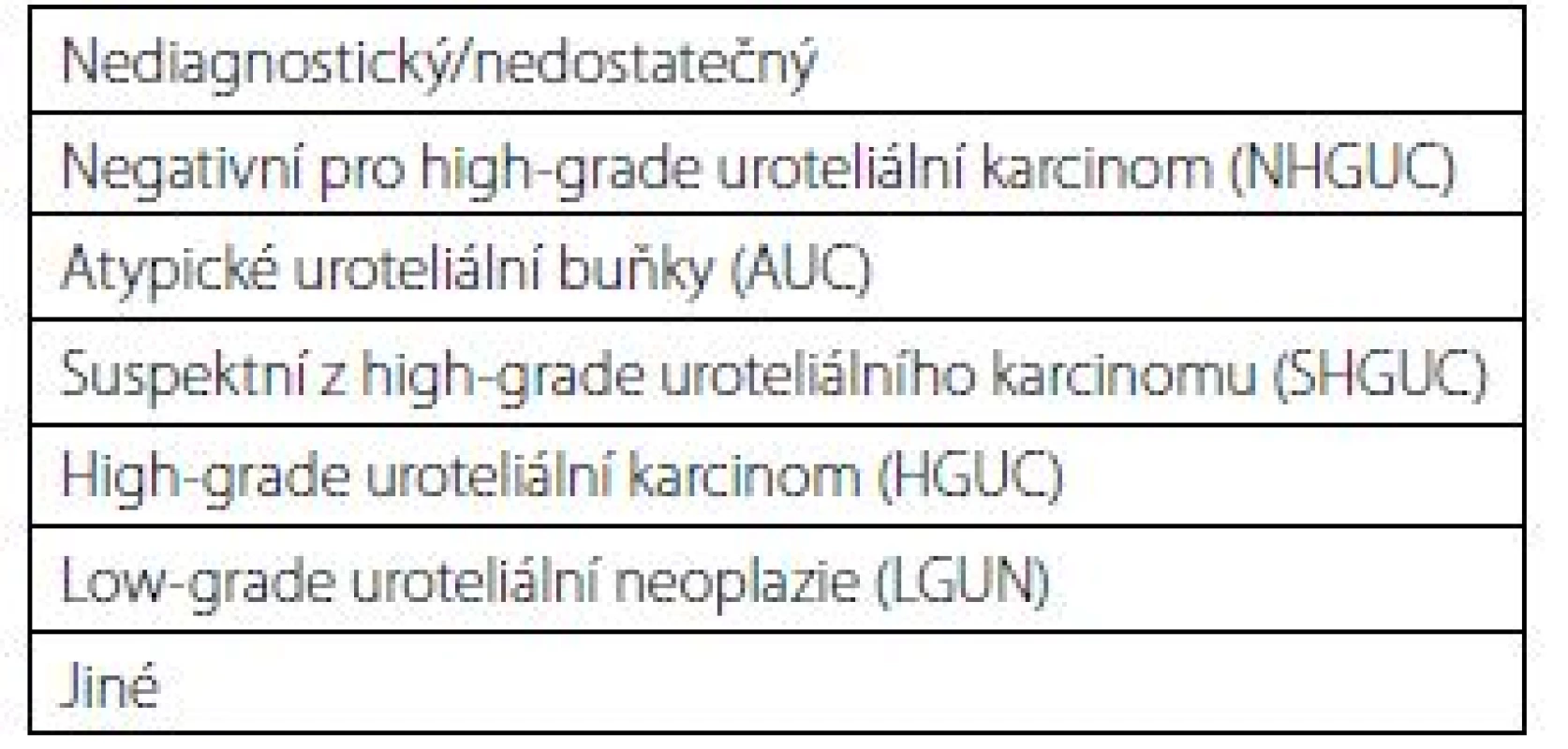
Pařížská klasifikace si klade za cíl s jistotou odhalit karcinom, který je klinicky signifikantní, orientuje se tedy především na záchyt pacientů s high‑grade uroteliálním karcinomem (1). Je to celkem oprávněný přístup, neboť je dobře známý fakt, že močová cytologie vykazuje dobrou senzitivitu a specificitu v záchytu high‑grade uroteliálního karcinomu (senzitivita okolo 79 %, specificita až 100 %), avšak je nízce senzitivní při detekci low‑grade uroteliálních lézí (senzitivita 25–40 % a specificita přibližně 98 %) (2, 3, 4). To je i důvod, proč se celá klasifikace přizpůsobila a specializovala především na záchyt high‑grade lézí (obr. 3), čemuž zcela přizpůsobila i nomenklaturu („benigní“ nález je nyní klasifikací stratifikován pod označním „negativní pro high‑grade uroteliální karcinom“ – NHGUC (obr. 1)).
Obr. 1. NHGUC (barvení PAP) – přítomny jsou především urotelie povrchové, ojediněle urotelie hlubší (skupina buněk v centru), na pozadí viditelné neutrofilní granulocyty (segmentované jádro), erytrocyty a autolyticky změněné blíže nehodnotitelné urotelie
Fig. 1. NHGUC (PAP staining) – superficial urothelial cells and rare deep urothelial cells (group of cells in the centre) are present, with neutrophils (cells with segmented nuclei), erythrocytes and cytolytic urothelial cells in the background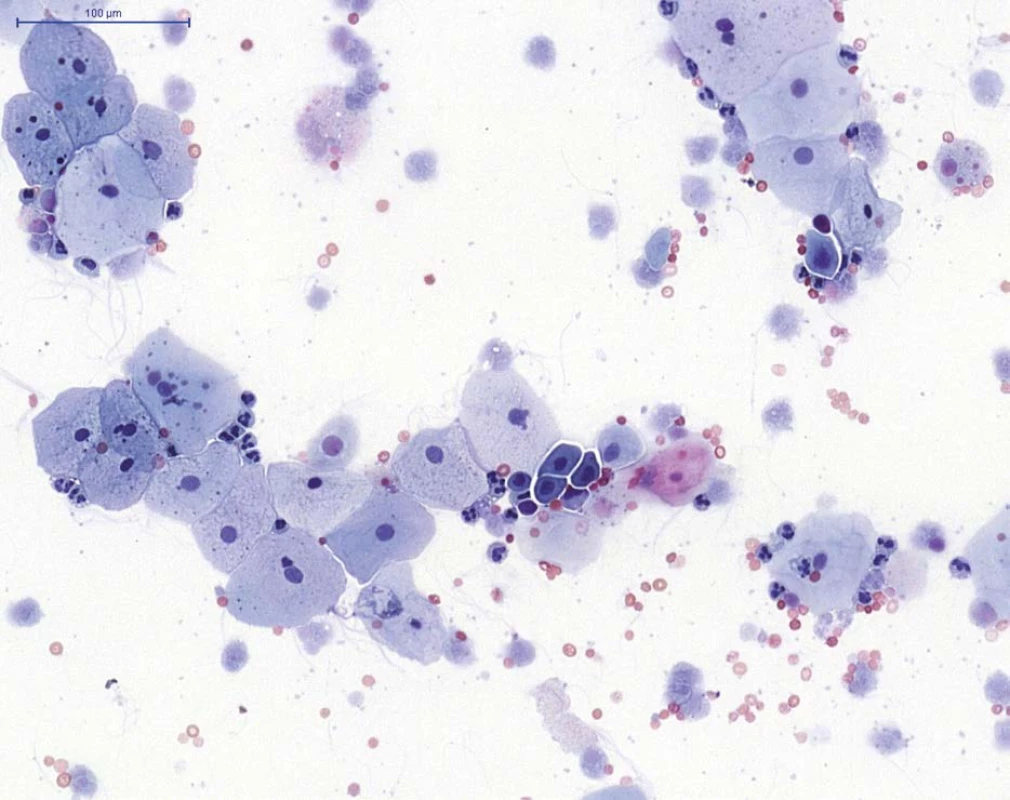
Obr. 2. NHGUC (barvení PAP) – četné hluboké urotelie, bez výraznějších cytologických atypií, místy vytvářející až naznačeně trojrozměrné klastry (v centru), na pozadí četné erytrocyty. Tento nález je vysoce suspekní z low- -grade uroteliální neoplazie, avšak nesplňuje morfologická kritéria Pařížské klasifikace pro označení „LGUN“.(pozn.: z následné transuretrální resekce tumoru potvrzena přítomnost low-grade neinvazivního uroteliálního karcinomu dle WHO 2016, grade 1 dle WHO 1973)
Fig. 2. NHGUC (PAP staining) – numerous intermediate and deep urothelial cells are present, with no significant cytological atypia, arranged focally as threedimensional fragments (in the centre), with erythrocytes in the background. This finding is suspicious for low-grade urothelial neoplasia, but it does not fulfill the morphological definition for category LGUN. (Note: subsequent transuretral resection of the tumor showed low-grade non- -invasive papillary urothelial carcinoma according to WHO 2016 classification, grade 1 according to WHO 1973)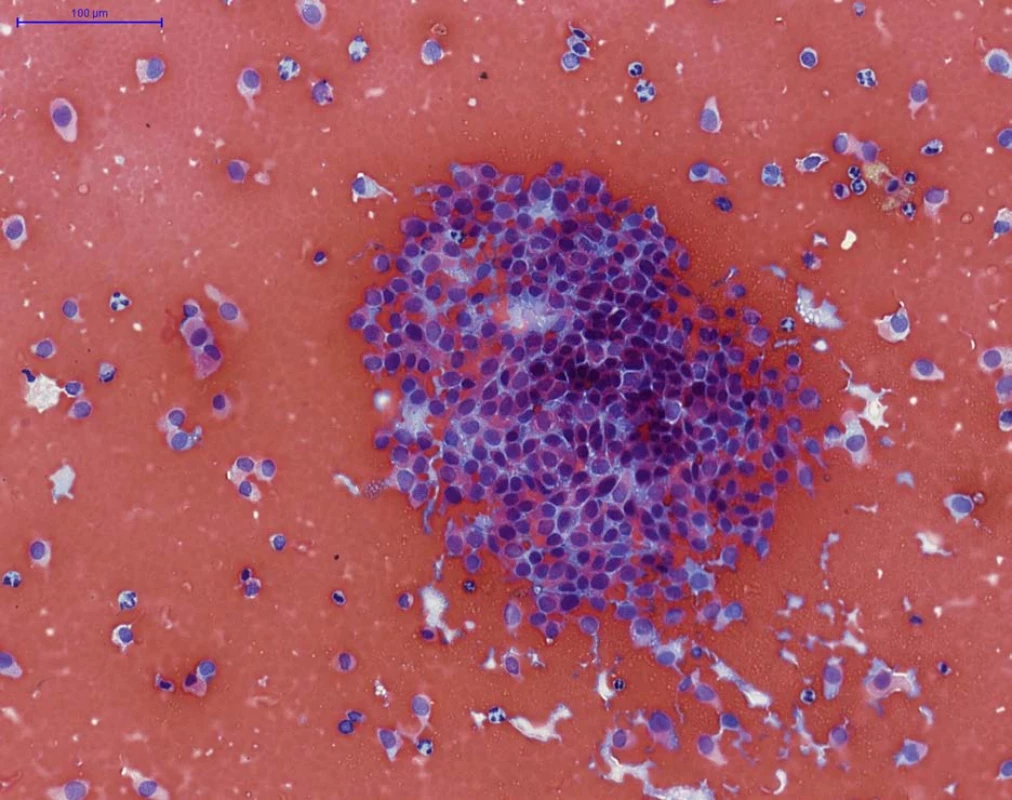
Obr. 3. HGUC (barvení PAP) – přítomna je záplava nádorových urotelií, na pozadí četnější neutrofilní granulocyty (buňky se segmentovaným jádrem) a erytrocyty
Fig. 3. HGUC (PAP staining) – aggregates of neoplastic urothelial cells, with neutrophils (cells with segmented nuclei) and erythrocytes in the background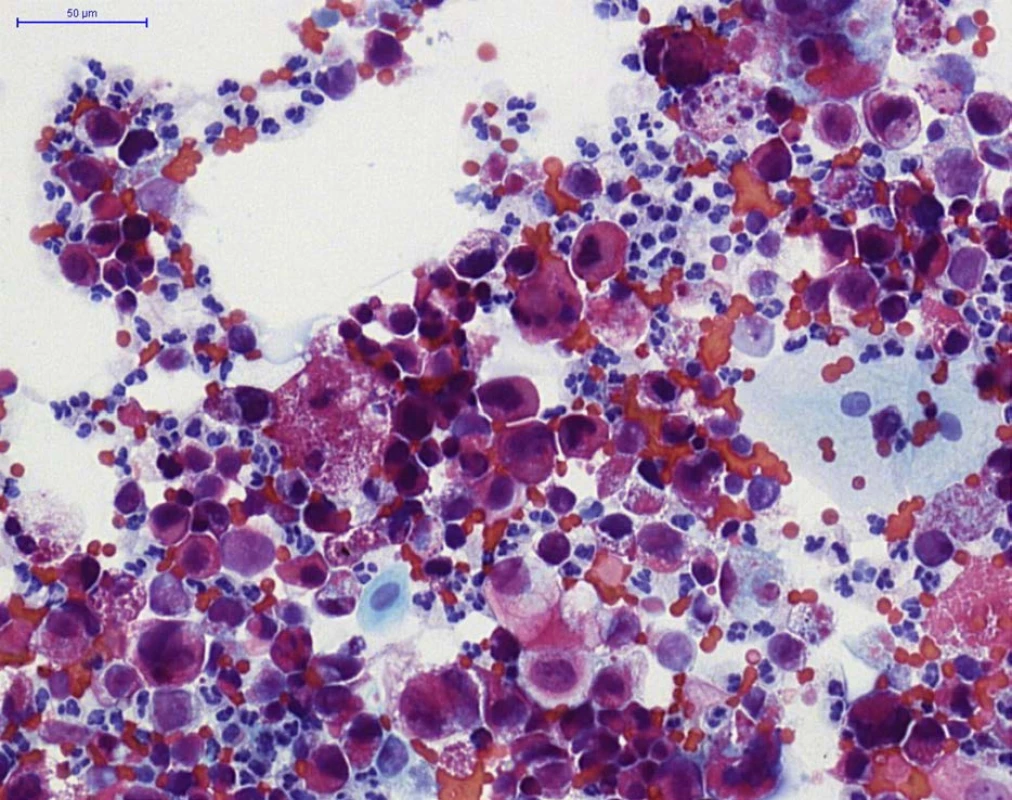
Důležité je mít na mysli, že močová cytologie od pacienta s low‑grade lézí je často opakovaně hodnocena jako negativní. To je dáno tím, že morfologická diagnostická kritéria Pařížské klasifikace jsou velmi striktně nastavena tak, aby mělo vyšetření při detekci low‑grade uroteliálních lézí co nejvyšší specificitu (minimalizace falešně pozitivních výsledků). Bohužel tato morfologická kritéria dokáže splnit jen velmi malé množství vzorků od pacientů s low‑grade uroteliální lézí a tak je většina vzorků od pacientů s následně prokázanou low‑grade lézí patologem opakovaně hodnocena v kategorii „negativní pro high‑grade uroteliální karcinom“ (obr. 2). Nízký záchyt low‑grade lézí však není vinou klasifikace samotné, ale odrazem skutečnosti, že diagnóza low‑grade uroteliální léze je za jistých okolností obtížná i z definitivního histologického preparátu (cytologické atypie jsou jen mírné, důležitá je architektonická alterace urotelu, kterou lze v močové cytologii ve většině případů jen obtížně hodnotit).
Dále je významným mezníkem Pařížské klasifikace i snaha minimalizovat užití často patology zneužívané atypické kategorie („atypické uroteliální buňky“ - AUC), která neposkytuje klinickým lékařům potřebné informace o riziku výskytu uroteliálního karcinomu a nemá tak žádný diagnostický a terapeutický dopad. Patologům pak často sloužila pouze jako „odpadkový koš“ pro případy, které nebyly dostatečně „normální“. To je zařízeno tím, že i kategorie AUC dostává jasná morfologická kritéria, která při této diagnóze musí být splněna, a tím eliminuje její nadbytečné užívání.
Novinkou klasifikace je i hodnocení adekvátnosti vzorku, která je determinována typem odběru, objemem vzorku, buněčností a cytomorfologickými rysy. Jednoduše řečeno – jedná se o základní kritéria, která musí vzorek moči splňovat, aby mohl být hodnocen. Avšak situace není tak jednoznačná, neboť jasně definovaná kritéria pro adekvátnost vzorku nejsou literaturou v současné době nijak podložena. Pařížská klasifikace tak poukázala na publikační mezeru týkající se hodnocení adekvátnosti vzorku, na kterou do budoucna jistě soustředí pozornost řada autorů, což povede k nastolení pevných diagnostických kritérií i v této oblasti. Současně je vycházeno z nezávazných doporučení, která se budou jistě ještě modifikovat. Při bližším pohledu na výše jmenované, kvalitu materiálu ovlivňující, modality – typ odběru a objem vzorku jsou zcela a pouze v rukou urologa, buněčnost a cytomorfologické rysy jsou spíše závislé na zpracování v laboratoři a zkušenostech odečítajícího patologa, ale významně je ovlivňuje i indikující urolog způsobem zvolené fixace a skladováním vzorku.
Katogorie „jiné“ pak slouží pro případy, kdy je močovou cytologií zachycen nádor jiný, než uroteliální karcinom. Jedná se však o situace raritní a k definitivní diagnóze neoplazie je vždy potřeba vyšetření radiologické a bioptické vyšetření resekovaného materiálu (často za použití speciálních imunohistochemických barvení). Cytologie moči tak může upozornit na neobvyklý nález, který zasluhuje další vyšetření.
ZÁKLADNÍ TYPY MOČOVÉ CYTOLOGIE
Z klinického pohledu rozlišujeme moč spontánně vymočenou a moč získanou instrumentací močových cest (moč katetrizovaná, výplachová, event. tzv. brushing).
Asi nejčastěji vyšetřovaným vzorkem je moč spontánně vymočená, která ač typem nejrozšířenějším, je zachováním buněk (stupněm cytolýzy) a buněčností z jmenovaných nejhorší. Nejlepším materiálem pro cytologické vyšetření je druhá ranní moč, která je ihned po odběru fixována pomocí cytofixačního média, či transportována na oddělení patologie k okamžitému zpracování. První ranní moč není pro močovou cytologii vzorek vhodný, neboť odloučené urotelie jsou po dlouhou dobu vystaveny agresivnímu prostředí v močovém měchýři, což vede k jejich cytolýze. Jeden vzorek spontánně vymočené moči není pro věrohodné zhodnocení eventuální přítomnosti neoplazie ve vývodných cestách močových dostačující. Buňky nádoru se do moči uvolňují intermitentně, je tedy dobré vyšetřit alespoň tři vzorky moči od jednoho pacienta ve třech různých dnech. Je prokázáno, že se zvyšujícím se počtem vyšetřených vzorků u každého pacienta, vzrůstá i samotná senzitivita vyšetření (5, 6, 7, 8).
Pro cytologické hodnocení je z hlediska buněčnosti a zachování buněk nejlepší moč výplachová (1). Je to logické – při výplachu výplachovou/instilačním tekutinou jsou mechanicky uvolňovány buňky urotelu, které nejsou po dlouhou dobu vystaveny agresivním účinkům vlastní moči. Při správné fixaci a skladování tak lze dosáhnout vyšší kvality vzorku. Recentní práce autorů Kellera a Jensena porovnávající cytologii spontánně vymočené moči a cytologii výplachovou však neprokázala relevantní rozdíl při porovnání výsledků u pacientů vyšetřených oběma modalitami (celkem bylo v této studii zahrnuto 1 458 pacientů, všichni s cytologickým vyšetřením spontánně vymočené moči i výplachu, shoda obou vyšetření byla dosažena v 99,2 % případů) (9). Ke stejných závěrům došli i jiní autoři (8).
Z hlediska laboratorního zpracování se pak dále můžeme setkat s pojmy klasická/konvenční cytologie (tradičně a nejčastěji prováděné vyšetření) a tzv. liquid based cytologie (LBC). Při konvenční cytologii je materiál zpracován „klasicky“ metodou cytocentrifugace. Při LBC vyšetření je materiál zpracován jednou ze dvou různých zcela automatizovaných cytopreparačních technik, založených buď na filtraci (např. systém ThinPrep®, MonoPrep2, CellprepPlus®) či sedimentaci (AutoCyte PREPTM, SurePathTM) (10). LBC (ve srovnání s konvenční cytologií) zvyšuje celularitu preparátu, odstraňuje rušivé elementy na pozadí, zlepšuje morfologii buněk a snižuje množství nedostatečných a nediagnostických vzorků (11, 12, 13). Speciální cytofixační médium používané při LBC umožňuje dlouhodobější skladování vzorku a jeho postupné zpracování (11), kdy zbytkový materiál může být i dále použit např. pro imunohistochemické barvení či molekulárně genetické vyšetření (10). Provedená metaanalýza porovnávajících LBC a konvenční močovou cytologii (zahrnující 19 publikací) však neprokázala signifikantní zvýšení senzitivity vyšetření při užití LBC metod (14).
ZÁSADY ODBĚRU A SPRÁVNÉHO SKLADOVÁNÍ MOČI PRO CYTOLOGICKÉ VYŠETŘENÍ
Odběr materiálu k cytologickému vyšetření se provádí vždy v ambulanci – pacient v žádném případě nepřináší vzorek z domova (snažíme se zabránit cytolytické degradaci uroteliálních buněk nevhodným skladováním bez použití cytofixačních prostředků).
Adekvátní objem k vyšetření zaslaného materiálu není pevně stanoven, avšak u vzorku spontánně vymočené moči se pravděpodobnost záchytu uroteliálního karcinomu zvyšuje s objemem vzorku. Na základě dostupných publikací je evidentní, že objem nad 30 ml výrazně zvyšuje výskyt suspektních a pozitivních diagnóz z močové cytologie, naopak objem pod 10 ml signifikantně redukuje možnost záchytu uroteliálního karcinomu (15). Planz a kol. prokázali, že senzitivita močové cytologie závisí na počtu vyšetřených vzorků (od jednoho pacienta) a objemu, který je zpracováván. Ve své práci tak striktně doporučují vyšetřovat celý vzorek spontánně vymočené moči (neboť nádorové buňky mohou být na cytologickém skle identifikovány pouze tehdy, jsou‑li ve vzorku zastoupeny v dostatečném množství, což většinou není případ, kdy je urologem zaslána pouze část vzorku o objemu 10 ml) (8). U výplachové cytologie je celkový objem vzorku závislý na objemu tekutiny instilované do vývodných močových cest během výkonu, logicky tedy adekvátní objem u těchto vzorků nelze stanovit (1) (na našem pracovišti je však též upřednostňován objem nad 30 ml).
Ihned po uskutečněném odběru musí být materiál neprodleně odeslán na pracoviště patologie k dalšímu zpracování. Pokud není možno zajistit okamžité zpracování, je třeba materiál fixovat vhodným cytofixačním médiem. Běžně je užíván 1% roztok merthiolátu sodného (dle našich zkušeností 1 ml 1% roztok merthiolátu sodného na 100 ml moči), či LBC medium (dodávané v komerčně dostupném LBC setu). Vzorek je i po použití fixačního média nutné skladovat v chladu (lednice) při teplotách do 4 °C, až do doby odloženého zpracování.
Pro správnost konečné cytologické diagnózy je dále nutné odečítajícímu patologovi poskytnout základní informace. Asi nejdůležitější informací je specifikace uskutečněného odběru (moč spontánně vymočená/výplach) (16). Bez této informace může patolog jen těžko stanovit správnou diagnózu, neboť součástí hodnocení vzorku je i posouzení zastoupení jednotlivých buněčných populací, které se při různých typech odběru samozřejmě liší (ve správně provedeném výplachu je přítomno velké množství buněk hlubokých, často v plachtovitých klastrech, naopak přítomnost takovýchto plachtovitých shluků ve vzorku spontánně vymočené moči může i bez přítomnosti výraznějších cytologických atypií vzbuzovat podezření z low‑grade uroteliální léze). Neinformování patologa o instrumentálním původu materiálu tak může vést i k nesprávné konečné diagnóze, údaj o typu odběru by tak vždy měl být jasně vyznačen na průvodním listu k cytologickému materiálu. Jinou užitečnou informací je pak údaj o předchozí léčbě (např. BCG výplachy, ozáření v oblasti malé pánve), eventuálně informace o výsledcích předchozích histologických vyšetření.
TZV. POMOCNÉ TESTY ZALOŽENÉ NA VYŠETŘENÍ MOČI
V posledních letech se setkáváme s intenzivní snahou najít vhodný diagnostický, prognostický a prediktivní molekulární marker, který by mohl být rutinně využívám k diagnostice a stratifikaci pacientů s uroteliálním karcinomem (17, 18, 19, 20). Zlatým standardem pro záchyt neoplazie ve vývodném močovém traktu a pro sledování pacientů s již diagnostikovaným uroteliálním karcinomem je stále cystoskopie. I tak přetrvává snaha najít neinvazivní test, který by toto invazivní vyšetření mohl spolehlivě nahradit (21). Je tak vyvíjena celá řada tzv. pomocných testů (v anglické literatuře „ancillary tests“) využívajících při analýze spontánně vymočenou moč a molekulárně genetické metody.
V běžné klinické praxi se však tyto testy příliš neujaly, což je z části podmíněno technickými nároky na metodu provádějící laboratoř a jejich vysokou cenou. Autoři Lotan a Roehrborn ve své studii (meta‑analýza) prokázali, že celkově mají pomocné testy lepší senzitivitu pro záchyt low‑grade/ low‑stage onemocnění v porovnání s močovou cytologií, avšak specificita pomocných testů je většinou menší než u cytologie (relativně vysoký výskyt falešně pozitivních výsledků) (21). I tak se v současnosti můžeme setkat s velkým množstvím testů nabízených pro rutinní použití, jako např. UroVysion® a ImmunoCyt/ UCyt+® (tzv. „cell‑based“ testy) a testy založené na nemorfologické analýze moči (tzv. „liquid‑based“ testy), např. BTATM test, NMP22TM test.
UroVysion® využívá FISH k detekci numerických a strukturálních aberací, které jsou jedním ze znaků UC (aneuploidie chromozomů 3, 7, 17; status 9p21 pro gen p16). ImmunoCyt/UCyt+® je test detekující za pomoci immunoflourescence tři proteiny preferenčně exprimováné u UC (19A211, M344 a LDQ10) (1). BTATM test detekuje (za použití imunoeseje) od lidského komplementového faktoru H odvozený protein (hCFHrp), jehož hladina v moči je u pacientů s UC zvýšena (22). NMP22TM testem je pomocí imunoeseje vyšetřována hladina proteinu jaderného mitotického aparátu (nuclear mitotic apparatus protein 22 – NMP22), který je uvolňován z apoptických buněk (23). BTATM a NMP22TM testy by pak podle některých studií měli být u uroteliálních lézí grade 1 a 2 z hlediska senzitivity superiorní nad močovou cytologií (21).
Nastupující doba Next Generation Sequencing (NGS) pak otvírá úplně novou etapu neinvazivních pomocných testů (např. průkaz FGFR3 a TERT) (24, 25, 26, 27, 28), slibným biomarkerem se zdá být volná nádorová DNA v likvidních biopsiích (29, 30, 31).
Důležitou informací je, že žádný z pomocných testů není inkorporován v doporučených postupech Evropské urologické společnosti (EAU) (32, 33) a sledování pacientů pouze pomocí těchto testů obecně není doporučováno (34). Senzitivita pomocných testů není dostatečná, tak aby mohla nahradit cystoskopii (21), avšak pomocné testy (a cytologie) mohou být nápomocné při specifických diagnostických problémech (8).
ZÁVĚR
Až doposud byla publikována celá řada studií zabývající se senzitivitou a specificitou močové cytologie, dostupné výsledky jasně ukazují celkovou senzitivitu vyšetření pohybující se mezi 20–53 % a specificitu 83–99,7 % (8, 21, 35). Neopomenutelným faktem je též, že u metody byla prokázána i falešná pozitivita vyšetření zhruba u 4,3 % pacientů (35). Metoda bude vždy vykazovat limitace především v detekci low‑grade uroteliálních lézí (nízce senzitivní v záchytu low‑grade lézí), což bohužel nelze změnit žádným klasifikačním systémem. Avšak po dlouhém období nesourodých a nejasných patologických závěrů a aplikaci velkého množství rozličných klasifikačních systémů přichází Pařížská klasifikace, která přináší globální standardizaci reportování močových nálezů. Jasně vymezenými diagnostickými kritérii zmenšuje interobservační variabilitu (nikoliv však zcela eliminuje) a patrně povede k poklesu užívání atypických závěrů (36, 37). Doufejme, že do budoucna tato klasifikace poskytne urologům větší srozumitelnost patologických reportů, které budou mít přímý dopad na další management pacienta.
Došlo: 9. 8. 2018
Přijato: 10. 9. 2018
Kontaktní adresa:
MUDr. Kristýna Pivovarčíková, Ph.D.
Šiklův ústav patologie LF UK a FN Plzeň
Alej Svobody 80, 304 60 Plzeň
e-mail: pivovarcikovak@fnplzen.cz
Střet zájmů: Žádný
Prohlášení o podpoře: Podpořeno programem rozvoje vědních oborů Karlovy univerzity (Projekt Q39) a MZ ČR RVO (Fakultní nemocnice Plzeň – FNPl, 00669806).
Zdroje
1. Rosenthal DL, Wojcik EM, Kurtycz DFI. The Paris system for reporting urinary cytology. Switzerland Springer; 2016.
2. Koss LG, Deitch D, Ramanathan R, Sherman AB. Diagnostic value of cytology of voided urine. Acta cytol. 1985; 29(5): 810–816.
3. Raab SS, Grzybicki DM, Vrbin CM, Geisinger KR. Urine cytology discrepancies: frequency, causes, and outcomes. Am J Clin Pathol. 2007; 127(6): 946–953.
4. Bastacky S, Ibrahim S, Wilczynski SP, Murphy WM. The accuracy of urinary cytology in daily practice. Cancer 1999; 87(3): 118–128.
5. Badalament RA, Kimmel M, Gay H, et al. The sensitivity of flow cytometry compared with conventional cytology in the detection of superficial bladder carcinoma. Cancer 1987; 59(12): 2078–2085.
6. Badalament RA, Hermansen DK, Kimmel M, et al. The sensitivity of bladder wash flow cytometry, bladder wash cytology, and voided cytology in the detection of bladder carcinoma. Cancer 1987; 60(7): 1423–1427.
7. Hermansen DK, Badalament RA, Bretton PR, et al. Voided urine flow cytometry in screening high‑risk patients for the presence of bladder cancer. J Occup Med. 1990; 32(9): 894–897.
8. Planz B, Jochims E, Deix T, et al. The role of urinary cytology for detection of bladder cancer. Eur J Surg Oncol. 2005; 31(3): 304–308.
9. Keller AK, Jensen JB. Voided urine versus bladder washing cytology for detection of urothelial carcinoma: which is better? Scand J Urol. 2017; 51(4): 290–292.
10. Son SM, Koo JH, Choi SY, et al. Evaluation of urine cytology in urothelial carcinoma patients: a comparison of CellprepPlus(R) liquid‑based cytology and conventional smear. Korean J Pathol. 2012; 46(1): 68–74.
11. Wright RG, Halford JA. Evaluation of thin‑layer methods in urine cytology. Cytopathology 2001; 12(5): 306–313.
12. Hwang EC, Park SH, Jung SI, et al. Usefulness of liquid‑based preparation in urine cytology. Int J Urol. 2007; 14(7): 626–629.
13. Laucirica R, Bentz JS, Souers RJ, et al. Do liquid‑based preparations of urinary cytology perform differently than classically prepared cases? Observations from the College of American Pathologists Interlaboratory Comparison Program in Nongynecologic Cytology. Arch Pathol Lab Med. 2010; 134(1): 19–22.
14. Luo Y, She DL, Xiong H, Yang L, Fu SJ. Diagnostic value of liquid‑based cytology in urothelial carcinoma diagnosis: a systematic review and meta‑analysis. PloS one. 2015; 10(8): e0134940.
15. VandenBussche CJ, Rosenthal DL, Olson MT. Adequacy in voided urine cytology specimens: the role of volume and a repeat void upon predictive values for high‑grade urothelial carcinoma. Cancer Cytopathol. 2016; 124(3): 174–180.
16. Thiryayi SA, Rana DN. Urine cytopathology: challenges, pitfalls, and mimics. Diagn Cytopathol. 2012; 40(11): 1019–1034.
17. Babjuk M, Koštířová M, Mudra K, et al. Stanovení proteinu blízkého faktoru H komplementu (BTA TRAK A BTA STAT), fragmentů cytokeratinů 8 a 18 (UBC IRMA A UBC RAPID) a cytologie moči při neinvazivní detekci nádorů močového měchýře. Ces Urol 2001; 5(3): 4–8.
18. Babjuk M, Koštířová M, Mudra K, et al. Místo neinvazivních testů (BTA STAT, BTA TRAK, UBC RAPID, UBC IRMA) a cytologie při sledování pacientů s povrchovými nádory močového měchýře. Ces Urol. 2001; 5(3): 9–13.
19. Szakácsová M, Soukup V, Babjuk M, et al. Exprese genů BCL-2 a BAX-1 ve tkáni Ta, T1 uroteliálních karcinomů močového měchýře a jejich prognostický význam. Ces Urol 2013; 17(3): 204–209.
20. Pešl M, Soukup V, Babjuk M, et al. Význam stanovení močové hladiny TATI (tumour associated trypsin inhibitor) pro diagnostiku a prognózu tumorů močového měchýře. Ces Urol. 2015; 19(1): 44–50.
21. Lotan Y, Roehrborn CG. Sensitivity and specificity of commonly available bladder tumor markers versus cytology: results of a comprehensive literature review and meta‑analyses. Urology 2003; 61(1): 109–18; discussion 18.
22. Kinders R, Jones T, Root R, et al. Complement factor H or a related protein is a marker for transitional cell cancer of the bladder. Clin Cancer Res. 1998; 4(10): 2511–2520.
23. Soloway MS, Briggman V, Carpinito GA, et al. Use of a new tumor marker, urinary NMP22, in the detection of occult or rapidly recurring transitional cell carcinoma of the urinary tract following surgical treatment. J Urol. 1996; 156(2 Pt 1): 363–367.
24. Cappellen D, De Oliveira C, Ricol D, et al. Frequent activating mutations of FGFR3 in human bladder and cervix carcinomas. Nat Genet. 1999; 23(1): 18–20.
25. Allory Y, Beukers W, Sagrera A, et al. Telomerase reverse transcriptase promoter mutations in bladder cancer: high frequency across stages, detection in urine, and lack of association with outcome. Eur Urol. 2014; 65(2): 360–366.
26. Rachakonda PS, Hosen I, de Verdier PJ, et al. TERT promoter mutations in bladder cancer affect patient survival and disease recurrence through modification by a common polymorphism. Proc Natl Acad Sciences U S A. 2013; 110(43): 17426–17431.
27. Ward DG, Baxter L, Gordon NS, et al. Multiplex PCR and next generation sequencing for the non‑invasive detection of bladder cancer. PloS one. 2016; 11(2): e0149756.
28. Pivovarcikova K, Pitra T, Vanecek T, et al. Comparative study of TERT gene mutation analysis on voided liquid‑based urine cytology and paraffin‑embedded tumorous tissue. Ann Diagn Pathol. 2016; 24 : 7–10.
29. Ward DG, Bryan RT. Liquid biopsies for bladder cancer. Transl Androl Urol. 2017; 6(2): 331–335.
30. Birkenkamp‑Demtroder K, Christensen E, Nordentoft I, et al. Monitoring treatment response and metastatic relapse in advanced bladder cancer by liquid biopsy analysis. Eur Urol. 2017.
31. Pardini B, Cordero F, Naccarati A, et al. MicroRNA profiles in urine by next‑generation sequencing can stratify bladder cancer subtypes. Oncotarget. 2018; 9(29): 20658–20669.
32. Babjuk M, Bohle A, Burger M, et al. EAU guidelines on non‑muscle‑invasive urothelial carcinoma of the bladder: update 2016. Eur Urol. 2017; 71(3): 447–461.
33. Roupret M, Babjuk M, Comperat E, et al. European Association of Urology guidelines on upper urinary tract urothelial carcinoma: 2017 update. Eur Urol. 2018; 73(1): 111–122.
34. Kamat AM, Hegarty PK, Gee JR, et al. ICUD‑EAU international consultation on bladder cancer 2012: Screening, diagnosis, and molecular markers. Eur Urol. 2013; 63(1): 4–15.
35. Tan WS, Sarpong R, Khetrapal P, et al. Does urinary cytology have a role in haematuria investigations? BJU Int. 2018 Jul 12. doi: 10.1111/bju.14459. [Epub ahead of print].
36. Meilleroux J, Daniel G, Aziza J, et al. One year of experience using the Paris System for Reporting Urinary Cytology. Cancer Cytopathol. 2018; 126(6): 430–436.
37. Wang Y, Auger M, Kanber Y, Caglar D, Brimo F. Implementing The Paris System for Reporting Urinary Cytology results in a decrease in the rate of the „atypical“ category and an increase in its prediction of subsequent high‑grade urothelial carcinoma. Cancer Cytopathol. 2018; 126(3): 207–214.
Štítky
Detská urológia Nefrológia Urológia
Článek Editorial
Článok vyšiel v časopiseČeská urologie
Najčítanejšie tento týždeň
2018 Číslo 4- Aktuálne európske odporúčania pre liečbu renálnej koliky v dôsledku urolitiázy
- MUDr. Šimon Kozák: V algeziológii nič nefunguje zázračne cez noc! Je dôležité nechať si poradiť od špecialistov
- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Editorial
- Roboticky asistovaná resekce objemného angiomyolipomu levé ledviny
- Roboticky asistovaná pyeloplastika pro obstrukci pelviureterálního spojení
- Aktuální pohled na močovou cytologii: Co by měl urolog vědět?
- Nové možnosti intravezikální instilační terapie u karcinomu močového měchýře
- Využití softwarové fúze multiparametrické magnetické rezonance a transrektální ultrasonografie při cílené biopsii nejen signifikantního karcinomu prostaty
- Andrologický faktor - rozhodujúci vplyv veku na úspešnosť asistovanej reprodukcie?
- Porovnání výsledků invazivních vyšetření a močové cytologie: Zkušenosti jednoho urologického centra po prvním roce užívání Pařížské klasifikace pro hodnocení močových cytologií
- Kazuistika pacientky s renálním karcinomem a metachronním postižením bilaterálních nadledvin a kontralaterální ledviny v průběhu 16 let
- Looking back at the 64th annual meeting of the Czech urological society in Ostrava
- Zpráva z nejstarší dětské nemocnice Spojených států
- Výsledky soutěže ČUS o nejlepší vědeckou publikaci za rok 2017
- Dr. h.c. prof. MUDr. Jan Breza, DrSc., MHA - 70-ročný
- Česká urologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Andrologický faktor - rozhodujúci vplyv veku na úspešnosť asistovanej reprodukcie?
- Porovnání výsledků invazivních vyšetření a močové cytologie: Zkušenosti jednoho urologického centra po prvním roce užívání Pařížské klasifikace pro hodnocení močových cytologií
- Aktuální pohled na močovou cytologii: Co by měl urolog vědět?
- Nové možnosti intravezikální instilační terapie u karcinomu močového měchýře
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



