-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Využití softwarové fúze multiparametrické magnetické rezonance a transrektální ultrasonografie při cílené biopsii nejen signifikantního karcinomu prostaty
Use of multiparametric magnetic resonance and transrectal ultrasound software fusion – guided prostate biopsy not only for significant prostate cancer
The aim:
Evaluation of the first results of software fusion – guided prostate biopsies in our workplace using multiparametric magnetic resonance and transrectal ultrasonography.
Methods:
Overall, 128 patients underwent 3 T mpMRI/TRUS fusion software‑based targeted biopsy of prostate from 1/2017 to 3/2018. 22 of them, were biopsy‑naive men with suspicion of prostate cancer. Re‑biopsy were performed in 106 men with persistent suspicion of prostate cancer after previously negative standard biopsy. The average age of patients was 66.5 years (49–84). Median PSA was 8.49 ng/ml (3.87–60.16 ng/ml) and median PHI was 55.84 (18–266). Results: In total, prostate cancer was bioptically verified in 77 patients (60.2%). In 50 cases (65%) Gleason score (GS) 6 (3+3), in 19 cases (24.7%) GS 7 (3+4), by five patients (6.5%) GS 7 (4+3), two patients (2.5%) GS 8 (4+4), one patient (1.3%) GS 9 (4+5). PI‑RADS v2 SCORE was evaluated in 128 patients. 33 patients had a PI‑RADS score 3, of whom 14 were positive (42%), score 4 was present in 54 patients – 33 of whom were positive (61.1%) and score 5 was in 41 patients – 29 of whom were positive (70.7 %).
Conclusion:
In our sample of patients we observed a high percentage of GS 6 (3+3). Our results are different compared to world literature, which shows large identification of significant prostate cancer detected by mpMRI. This finding may be due to several reasons, poor selection of patients, inaccurate radiological description, or a patologist’s histological specimen. Detection of biopsy‑verified prostate cancer using 3 T mpMRI/TRUS fusion software‑based targeted biopsy increases proportionally compared to the increasing PI‑RADS score version 2. To confirm these results, an extended patient population study is required.
KEY WORDS
Magnetic resonance imaging, prostate cancer, software fusion guided prostate biopsy.
Autoři: Tomáš Vavřík 1; Olga Dolejšová 1; Hana Sedláčková 1; Dušan Mrkos 1; Jiří Ferda 2; Jan Kastner 2; Radka Fuchsová 3; Ondřej Topolčan 3; Ondřej Hes 4; Milan Hora 1
Působiště autorů: Urologická klinika LF UK a FN Plzeň 1; Klinika zobrazovacích metod LF UK a FN Plzeň 2; Laboratoř imunochemické diagnostiky LF UK a FN Plzeň 3; Šiklův ústav patologie LF UK a FN Plzeň 4
Vyšlo v časopise: Ces Urol 2018; 22(4): 257-265
Kategorie: Originální práce
Souhrn
Cíl:
Vyhodnocení prvních výsledků biopsií prostaty s využitím softwarové fúze multiparametrické magnetické rezonance a transrektální ultrasonografie na našem pracovišti.
Metody:
V období 1/2017–3/2018 bylo provedeno celkem 128 biopsií prostaty s využitím softwarové fúze TRUS/3 T mpMRI. Ve 22 případech se jednalo o primobiopsii, ve 106 případech o rebiopsii, v některých případech již o několikátou rebiopsii. Průměrný věk pacientů byl 66,5 let (49–84). Medián PSA 8,49 ng/ml (3,87–60,16 ng/ml), medián PHI 55,84 (18–266).
Výsledky:
Karcinom prostaty byl verifikován u 77 ze 128 pacientů (60,2%). U 50 ze 77 pozitivních (65 %) s hodnotou Gleason skóre (GS) 6 (3+3), u 19 pacientů (24,7 %) GS 7 (3+4), pět pacientů (6,5 %) GS7 (4+3), dva pacienti (2,5 %) GS 8 (4+4) a jeden pacient (1,3 %) GS 9 (4+5). Celkem 128 pacientů mělo vyhodnoceno skóre PI‑RADS v2. Skóre 3 u 33 pacientů – pozitivních celkem 14 pacientů (42 %), skóre 4 celkem 54 pacientů – pozitivních 33 (61,1 %) a skóre 5 zhodnoceno u celkem 41 pacientů, kde pozitivních bylo celkem 29 (70,7 %).
Závěr:
Vzhledem k vysokému procentu zastoupení GS 6 (3+3) v našem souboru pacientů se neshodujeme se světovou literaturou, která udává větší záchyt signifikantních karcinomů prostaty zobrazitelných na mpMRI. Toto zjištění může být zapříčiněno několika důvody, špatnou selekcí pacientů, nepřesného radiologického popisu či popis histologického vzorku patologem. V našem souboru zastoupení biopticky verifikovaného karcinomu prostaty s využitím softwarové fúze úměrně roste v porovnání se zvyšujícím se skóre PI‑RADS v2. K potvrzení těchto výsledků je nutné provedení studie rozšířeného souboru pacientů.
KLÍČOVÁ SLOVA
Karcinom prostaty, magnetická rezonance, softwarová fúzní biopsie prostaty.
ÚVOD
Karcinom prostaty (KP) je nejčastějším maligním nádorem u mužů a druhou hlavní příčinou úmrtí na rakovinu po zhoubném novotvaru plic nebo bronchů. Při postupném stárnutí populace bude nejspíše přibývat i nových případů KP (1). U mužů s vysokou hodnotou prostatického specifického antigenu (PSA) se v diagnostickém algoritmu provádí biopsie prostaty naváděná transrektální ultrasonografií (TRUS). Nicméně pomocí samotné TRUS naváděné biopsie prostaty jsou výsledky často falešně negativní a až 20 % pacientů může unikat diagnóze signifikantního karcinomu prostaty (2). Během posledních deseti let získala multiparametrická magnetická rezonance (mpMRI) prostaty rostoucí význam hlavně v možnosti rozšířeného zobrazení. Využívá anatomického zobrazení (T1 a T2 sekvenci) a dále funkčního zobrazení, které se opírá o dynamické kontrastní zobrazení (DCE), difuzní vážené zobrazení (DWI) a spektroskopii (MRS). MpMRI v diagnostice KP je velmi často využívána také pro její vysokou senzitivitu a specificitu. Senzitivita narůstá zvláště s velikostí tumoru a jeho agresivitou. Zvláště u signifikantních tumorů jsou výsledky excelentní, tedy objem tumoru ≥ 0,5 ml či GS ≥ 7 (5). U mpMRI byla zaznamenána vysoká přesnost detekce KP (3, 4, 11, 12, 18, 28). Detekce KP podle mpMRI se pohybuje od 80 do 100 % u skóre Gleason (GS) > 7, od 63 do 97 % u GS 7 a od 21 do 75 % u nádorů GS 6 (5). Ke zhodnocení parametrů pro suspektní KP se využívá několik radiologických strukturovaných skórovacích systémů, např. Likert škála nebo PI‑RADS (the Prostate Imaging and Reporting and Data System) (15, 16, 17). Ve většině zdravotnických pracovišť se využívají PI‑RADS verze 1 a verze 2. Pokroky v zobrazovacích technikách vedly k vývoji různých druhů fúzních biopsií prostaty. Jmenujme např. kognitivní fúzní biopsii, in‑bore fúzní biopsii (biopsii přímo naváděnou za kontroly MRI) a v neposlední řadě softwarovou fúzní biopsii. Ta využívá spojení obrazů mpMRI a TRUS při vyšetření v reálném čase (6, 7, 8, 9). Během posledních let bylo vyvíjeno a testováno několik softwarů a hardwarového zařízení pro fúzní biopsii prostaty (10).
Tab. 1. Počty biopticky verifikovaných KP s jejich Gleason score, ISUP group a procentuální zastoupení
Tab. 1. Numbers of bioptically verified prostate carcinomas with their Gleason score, ISUP group and percentages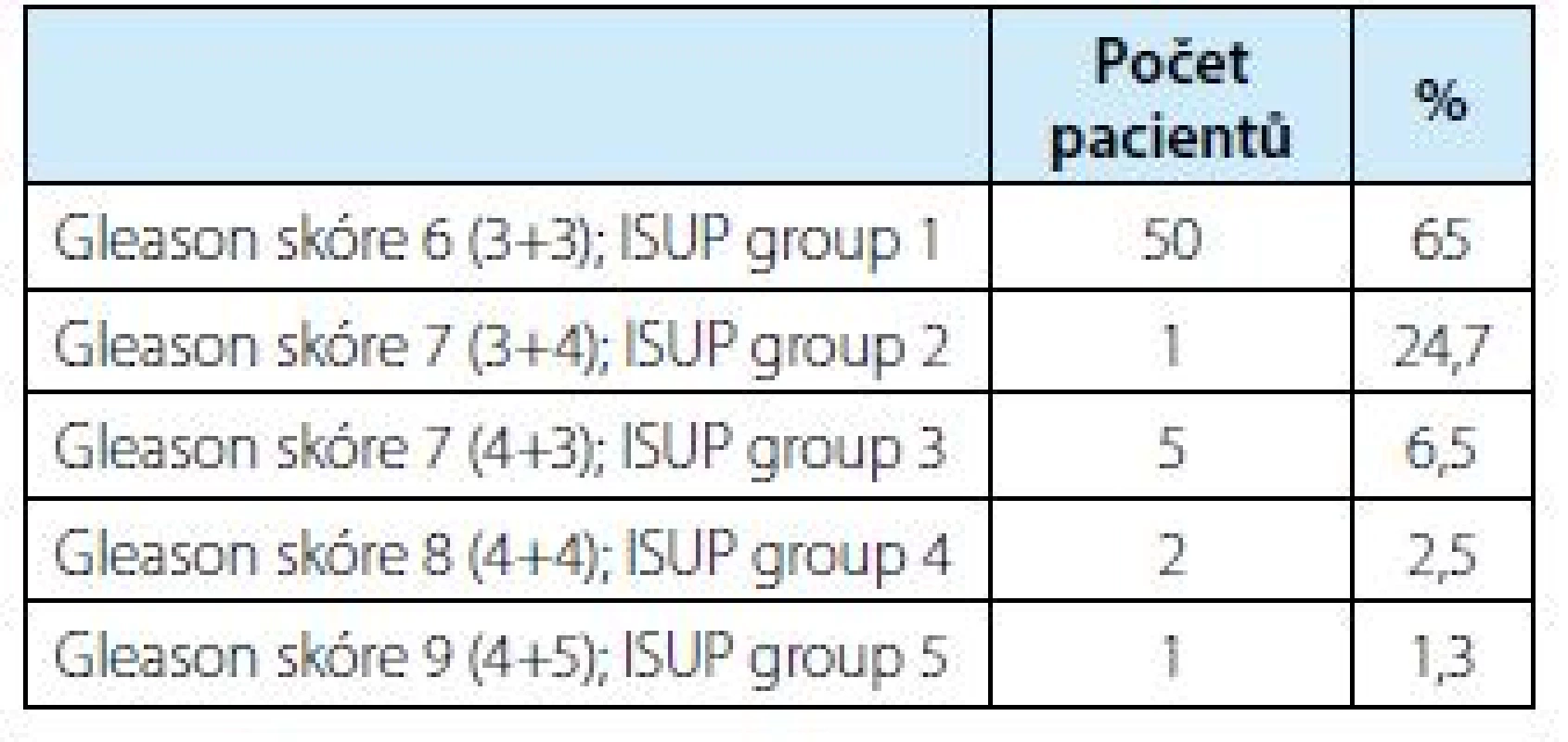
Obr. 1. T2 vážená sekvence mpMRI transverzální řez; červeně – prostata; modře – suspektní ložisko KP; zelenožlutě – bioptické vzorky
Fig. 1. T2 weighted sequence mpMRI axial view; red – prostate; blue – suspect lesion of prostate cancer; greenyellow – bioptic patterns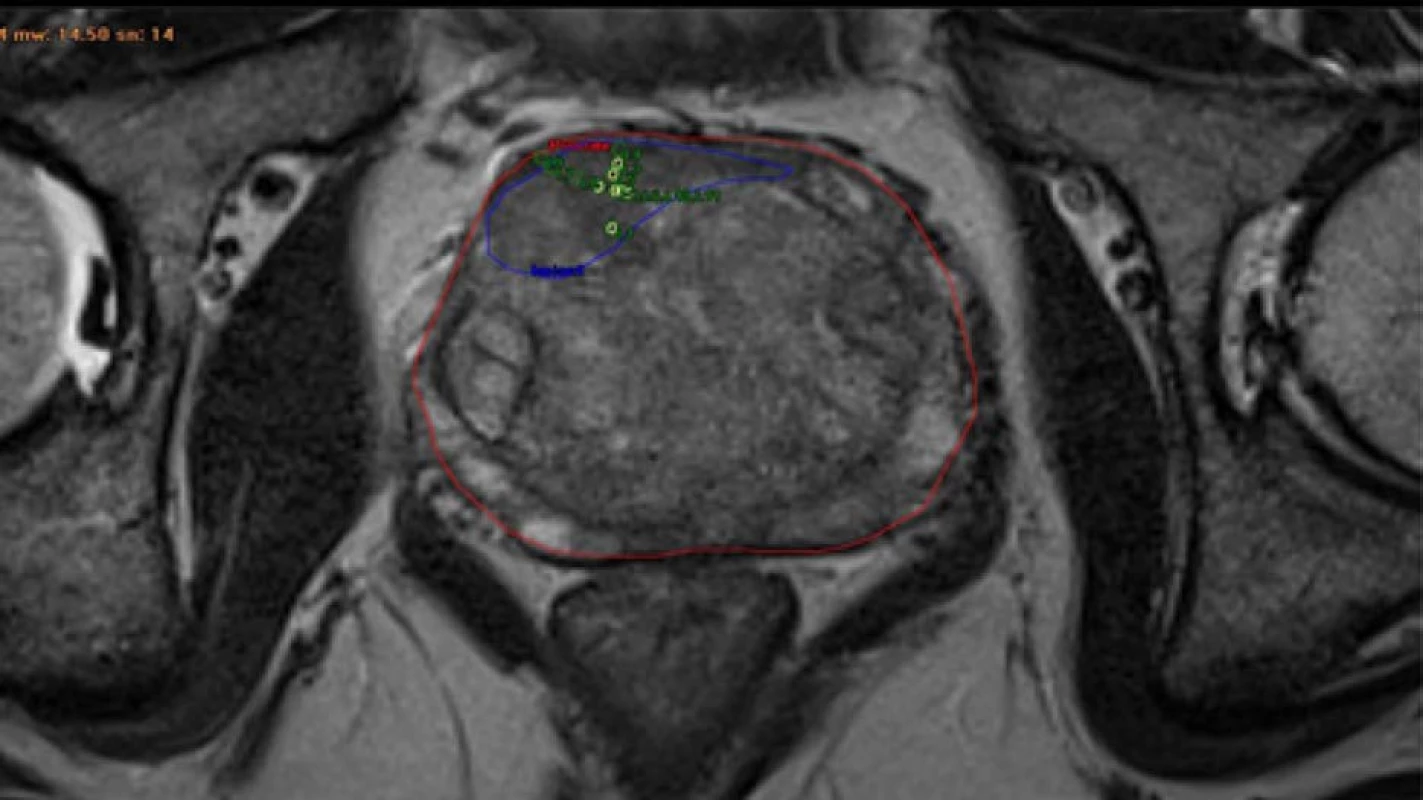
Obr. 2. 3D model prostaty s bioptickými vzorky
Fig. 2. 3D model of prostate with bioptic patterns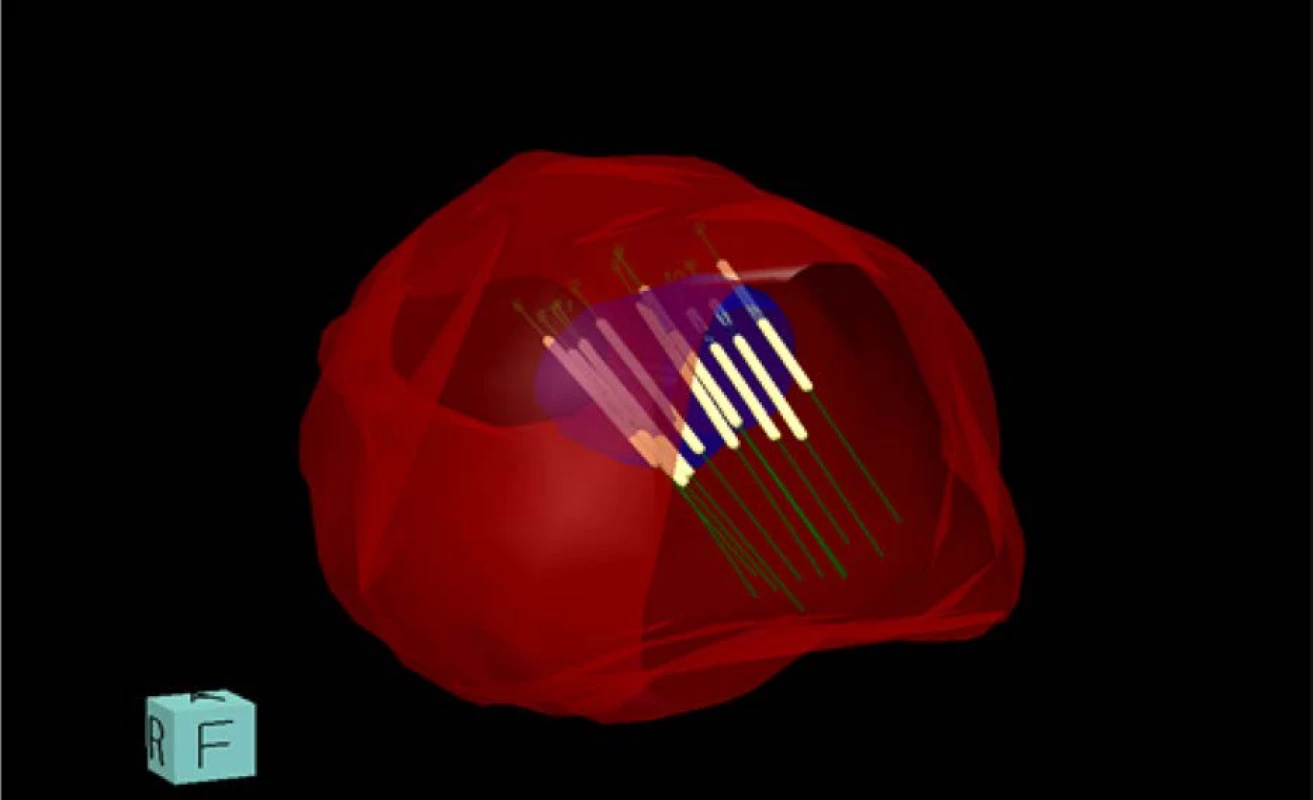
METODY
V období 1/2017–3/2018 bylo provedeno na Urologické klinice ve Fakultní nemocnici Plzeň celkem 128 biopsií prostaty s využitím softwarové fúze TRUS/ mpMRI. Jednalo se o pilotní projekt zavádění nové metodiky. Pacienti byli vybíráni do studie v primobiopsii při elevaci PSA (minimálně 3,5 ng/ml), hodnoty PI‑RADS 3 a vyšší z mpMRI s popsaným suspektním ložiskem. U rebiopsií postupná progrese PSA, negativní předešlé biopsie a hodnota PI‑RADS 3 a vyšší z mpMRI. Z celkových 128 případů se v 22 případech jednalo o primobiopsii a v ostatních 106 případech šlo o rebiopsii. Ve skupině rebiopsií i primobiopsií byla prováděna včetně cílené softwarové fúzní biopsie také biopsie systematická. U každého pacienta bylo odebíráno celkem 12–18 bioptických vzorků. Odběr vzorků závisel na počtu provedených biopsií, počtu a velikosti suspektních ložisek. U 52 pacientů se jednalo o první rebiopsii, u 25 pacientů druhá rebiopsie, 17 pacientů podstoupilo již třetí rebiopsii, sedm pacientů čtvrtou rebiopsii, tři pacienti podstoupili pátou rebiopsii, jeden pacient sedmou rebiopsii a jeden pacient podstoupil již třináctou rebiopsii, tento pacient však nebyl pravidelně dispenzarizován naším pracovištěm. Průměrný věk pacientů byl 66,5 let (49–84). Byly stanoveny hodnoty PSA a tzv. indexu zdraví prostaty (PHI, prostate health index). Hodnoty PSA se pohybovaly v mediánu 8,49 ng/ml (3,87–60,16 ng/ml). Výsledné hodnoty PHI byly v mediánu 55,84 (18–266). Ve skupině primobiopsií byl průměrný věk 62,6 let, medián PSA 7,59 (4,61–33,28) a medián PHI 48,18 (18–80). Ve skupině rebiopsií byl průměrný věk 67,3 let, medián PSA 9 (3,87–60) a medián PHI 58,03 (18–266). Vyšetření byla prováděná na přístrojích Magnetom Skyra Siemens®™ 3 T se všemi dostupnými anatomickými i funkčními vyšetřeními (T1 a T2 sekvence, DWI, DCE a MRS). Dle standardů ESUR z roku 2012 využíváme radiologický skórovací systém PI‑RADS. Na našem pracovišti byla v dobu studie užívána verze 2. K ultrasonografickému vyšetření prostaty byl využit přístroj BK Medical FlexFocus 800®™ s propojenou biplanární sondou 8808e BK Medical®™. Samotné propojení systémů zprostředkovává software BiopSee2®™ Medcom Darmstadt Německo. Před samotným výkonem je nutné stažení obrazové dokumentace ze systému či přenosného média (USB flash disk, CD, DVD) do softwaru BiopSee2®™. Následně je provedena tzv. konturace, která spočívá v označení suspektního ložiska z karcinomu. Dále můžeme označit i další pomocné subjekty k lepší orientaci při výkonu jako prostatolity, cystické léze, uretru či močový měchýř. Poté již přecházíme k samotnému výkonu, který provádíme v gynekologické poloze a po místním znecitlivění zavádíme zmíněnou transrektální ultrazvukovou sondu 8808e BK Medical®™. Po zhodnocení a proměření prostaty se dostáváme ke kroku zvanému registrace, která provádí samotné propojení obrazů TRUS a MRI. Dále již pokračujeme cílenou biopsií prostaty s označeným suspektním ložiskem či ložisky. VÝSLEDKY Z celkových 128 pacientů, kteří podstoupili softwarovou fúzní biopsií, byl biopticky verifikován karcinom prostaty u celkem 77 pacientů (60,2 %). Z těchto pacientů, kteří měli biopticky ověřený KP, mělo hodnotu Gleason skóre (GS) 6 (3+3) celkem 50 pacientů (65 %). Hodnota GS 7 (3+4) byla zachycena u celkem 19 pacientů (24,7 % z pozitivních), pět pacientů mělo GS 7 (4+3) (6,5 %), dva pacienti GS 8 (4+4) (2,5 %) a jeden pacient měl verifikován KP GS 9 (4+5) (1,3 %). Dle klasifikace WHO 2016 byli zachyceni pacienti, kteří spadali do kategorií grading group 1 (GS ≤ 6), grading group 2 (GS 3 + 4 = 7), grading group 3 (GS 7 4 + 3), dva pacienti do skupiny grading group 4 (GS 8) a jeden pacient spadal do skupiny grading group 5 (GS 9–10). Celkem 128 pacientů mělo vyhodnoceno také radiologický skórovací systém PI‑RADS v2. PI‑RADS skóre 3 bylo naměřeno u 33 pacientů, z nichž bylo pozitivních celkem 14 pacientů (42 %). PI‑RADS skóre 4 bylo zhodnoceno celkem u 54 pacientů, z nichž bylo pozitivních celkem 33 pacientů (61,1%). PI‑RADS skóre 5 bylo zhodnoceno u celkem 41 pacientů, kde pozitivních bylo celkem 29 (70,7 %). Ve skupině primobiopsií jsme biopticky verifikovali KP celkem v 14 případech z 22 (63,6 %). Ve druhé skupině rebiopsií byl nalezen KP u 63 pacientů z celkových 106 rebiopsií (59,4 %), 43 pacientů mělo rebiopsii negativní (40,6 %).
Tab. 2. Pacienti s počtem biopticky verifikovaných KP a jejich procentuální zastoupení v závislosti na jejich PI-RADS skóre
Tab. 2. Patients with the number of bioptically verified prostate carcinomas and their percentages depending on their PI-RADS score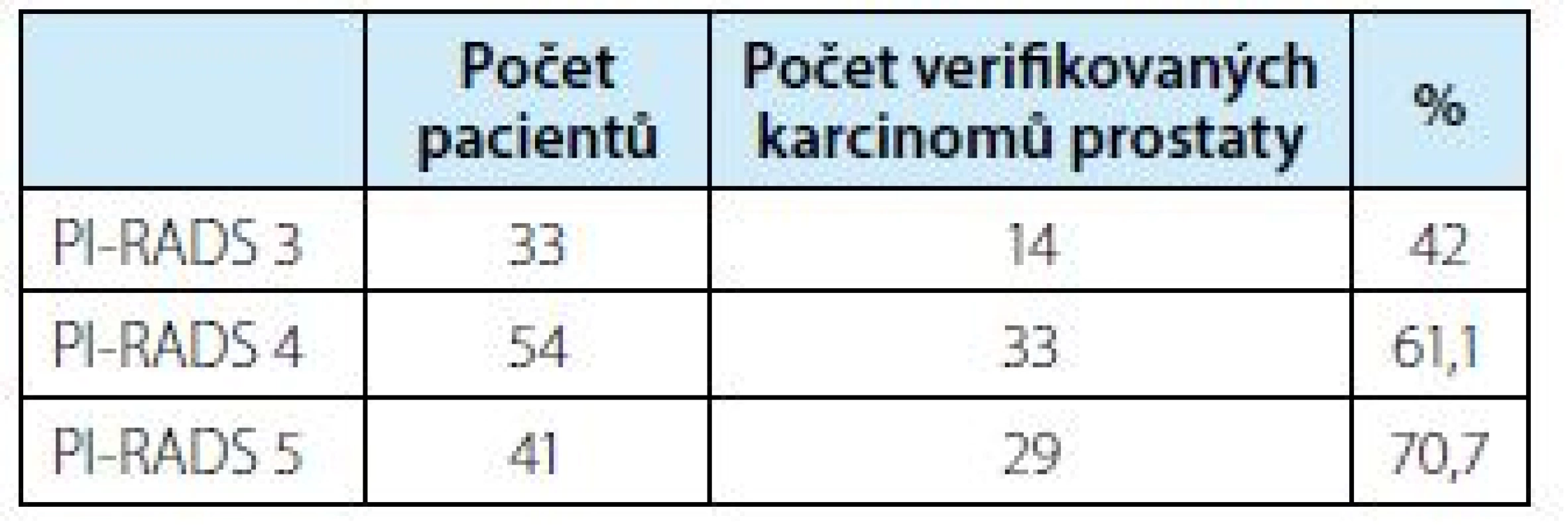
DISKUZE
V současných doporučených postupech Evropské urologické společnosti (EAU) z roku 2018 je zahrnuto MRI/TRUS cílené vyšetření při opakování biopsie. Je možné, že v budoucích letech se toto stanovisko změní i pro indikaci primobiopsie a to z důvodu stále více se rozšiřující možnosti provádění MRI prostaty jejích velmi slibných výsledků. V naší studii jsme prezentovali první zkušenosti a výsledky s využitím MRI/TRUS fúzní biopsie prostaty. Náš soubor obsahuje velké procento nesignifikantních karcinomů prostaty (GS 6). V tomto ohledu se rozcházíme se světovou literaturou, která většinou prezentuje výsledky zachycení signifikantního KP (GS > 7) (22, 23, 24). Tyto výsledky mohou být způsobeny malým počtem pacientů v souboru či nevyhovující selekcí pacientů k tomuto výkonu. Musíme brát také v úvahu možnost nepřesného radiologického popisu mpMRI nebo také popisu patologa. Procentuální zastoupení biopticky verifikovaného KP s využitím softwarové fúze v našem souboru úměrně roste v porovnání se zvyšujícím se skóre PI‑RADS v2. V těchto výsledcích se shodujeme se světovou literaturou, kde také dochází k většímu bioptickému záchytu PCa s postupně se zvyšujícím PI‑RADS (25, 26). Rutinně se již využívají skórovací systémy PI‑RADS verze 1 a verze 2. Verze 2 je navrhována ke zlepšení detekce, lokalizace, charakteristice a také ke zjednodušení, jelikož už do ní není zahrnuta MRS a využívá pouze pětistupňovou škálu (11, 12, 25, 30). Procentuální srovnání záchytu KP mezi skupinami primo a re‑biopsií je pro malý počet pacientů, kteří podstoupili primobiopsii, nepřesné. Soubor pacientů by bylo velmi zajímavé zkomparovat s definitivní histologií z radikální prostatektomie, které jsou prováděny technikou celoplošných řezů (angl. „whole mount section“) (29). Zatím však nejsou dostatečná data pro provedení této studie. Z recentní studie Dolejšové et al. dle hodnot PHI můžeme predikovat hodnotu GS z biopsie a následně i z radikální prostatektomie, kde dochází k vzestupu definitivního GS (31). Na našem pracovišti využíváme tzv. rigidní typ softwarové fúzní biopsie, kde rigidní zahrnuje zarovnání MRI a TRUS obrazů rotací, zvětšením či obojího. Nicméně tvar prostaty není perioperačně shodný s tvarem předoperační MRI. Další nevýhodou jsou pohyby pacienta včetně deformace prostaty sondou. Z těchto důvodů je nutné provedení změny registrace v reálném čase. Systémy pro softwarovou fúzi se mohou lišit v několika parametrech a to např. v typu registrace, navádění jehly či provádění záznamu. Softwarovou fúzní biopsii můžeme rozlišovat na elastickou a rigidní. Elastická obrazová fúze je mnohem sofistikovanější než rigidní fúze, která kompenzuje změny tvaru prostaty v reálném čase během biopsie s ohledem na předoperační MRI (13, 14, 19, 20, 21). Dalším aspektem pro zlepšení výsledků je zkušený radiolog popisující 3 T MRI (18). V neposlední řadě musíme brát v úvahu i finanční náklady spojené s MRI. Bylo prokázáno, že mpMRI může být nákladově výhodnější než‑li systémová TRUS biopsie. To za předpokladu, že bude mít vysokou citlivost pro detekci vysoce či středně rizikového PCa a zároveň vyloučí pacienty s nízce rizikovým karcinomem či pacienty bez nálezu karcinomu (27). Vzhledem k stále narůstajícímu počtu cílených biopsií z důvodu výborných výsledků, můžeme pozorovat trend provádění mpMRI i tohoto cíleného vyšetření u pacientů, kteří přicházejí k biopsii poprvé (32).
Obr. 3. Report po softwarové fúzní biopsii prostaty
Fig. 3. Report after software fusion – guided prostate biopsy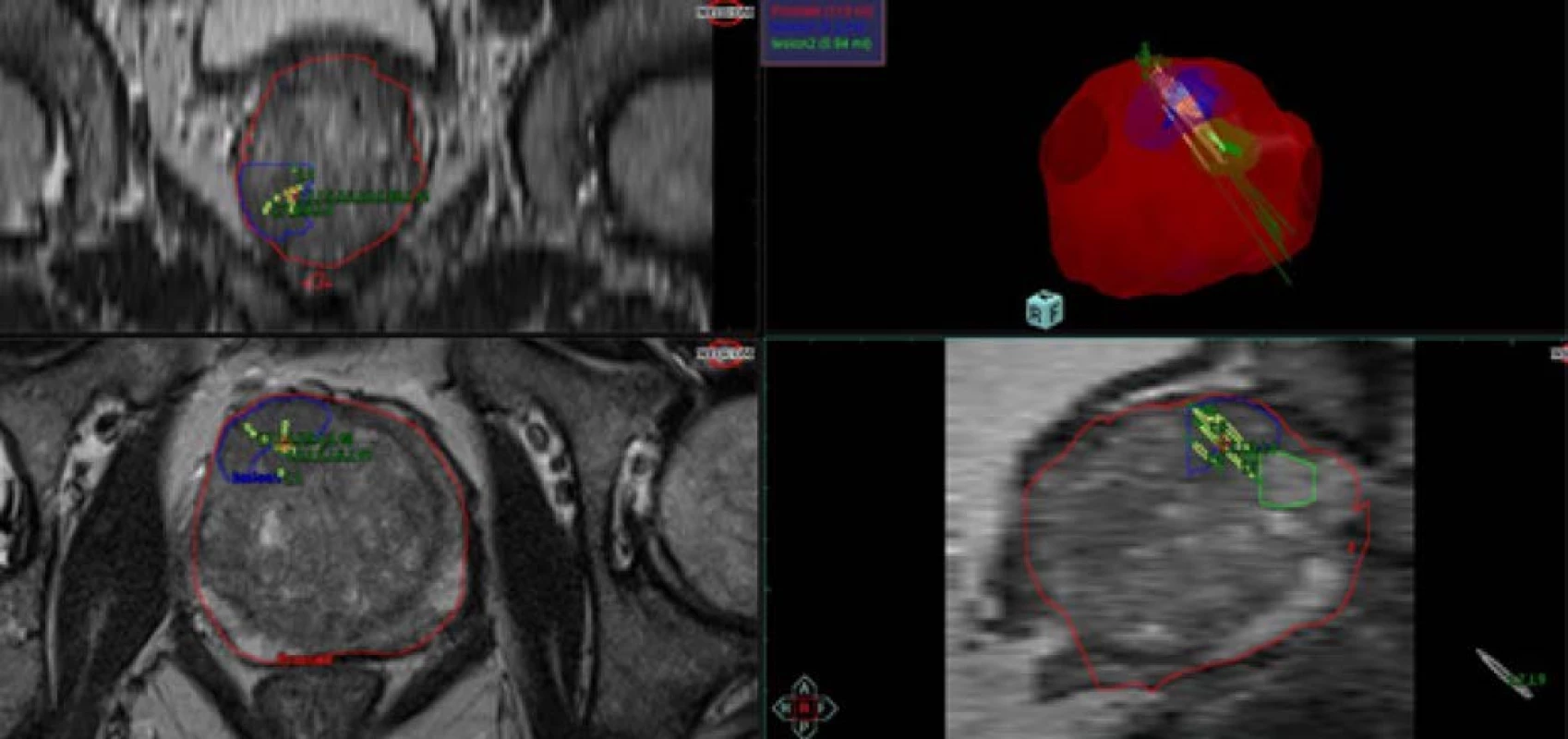
Obr. 4. Ultrasonograf BK Flex Focus 800®™ vlevo; přístroj pro softwarovou fúzní biopsii Medcom®™ vpravo
Fig. 4. Ultrasonography BK Flex Focus 800®™ on the left; software fusion guided biopsy device by Medcom®™ on the right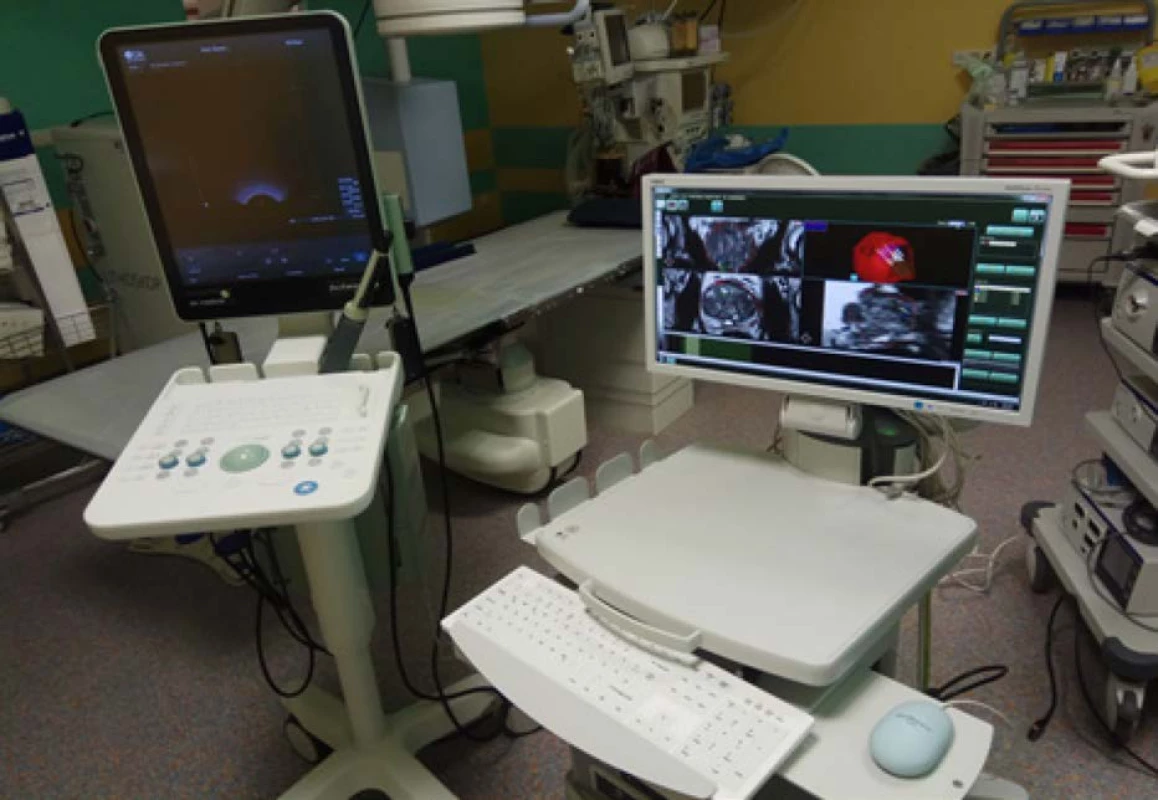
ZÁVĚR
Softwarová fúzní TRUS/MRI biopsie prostaty se stává na našem pracovišti již rutinním vyšetřením. Procentuální zastoupení biopticky verifikovaného KP s využitím softwarové fúze v našem souboru úměrně roste v porovnání se zvyšujícím se skóre PI‑RADS jako ve světové literatuře, avšak záchyt nesignifikantního karcinomu prostaty je v našem souboru vyšší než signifikantního. Tento závěr může být zapříčiněn několika důvody, špatnou selekcí pacientů k výkonu, nepřesného radiologického popisu mpMRI nebo také popisu histologického vzorku patologem. K potvrzení těchto výsledků bude zapotřebí další studie rozšířeného souboru pacientů.
Došlo: 1. 8. 2018
Přijato: 15. 9. 2018
Kontaktní adresa:
MUDr. Tomáš Vavřík
Urologická klinika FN Plzeň
E. Beneše 13, 305 99 Plzeň
e-mail: vavrikt@fnplzen.cz
Střet zájmů: Žádný
Prohlášení o podpoře: Podpořeno MZ ČR – RVO (Fakultní nemocnice Plzeň – FNPl, 00669806).
Zdroje
1. Siegel R, Naishadham D, Jemal A. Cancer statistics. CA Cancer J Clin. 2013; 63 : 11–30.
2. Roehl KA, Antenor JA, Catalona WJ. Serial biopsy results in prostate cancer screening study. J Urol. 2002; 167 : 2435–2439.
3. de Rooij M, Hamoen EHJ, Fütterer JJ, Barentsz JO, Rovers MM. Accuracy of multiparametric MRI for prostate cancer detection: a meta‑analysis. American Journal of Roentgenology 2014; 202(2): 343–351.
4. Dickinson L, Ahmed HU, Allen C, et al. Magnetic resonance imaging for the detection, localisation, and characterisation of prostate cancer: recommendations from a European consensus meeting. European Urology 2011; 59(4): 477–494).
5. Bratan F, Niaf E, Melodelima C, et al. Influence of imaging and histological factors on prostate cancer detection and localisation on multiparametric MRI: a prospective study. European Radiology 2013; 23(7): 2019–2029.
6. Pinto PA, Chung PH, Rastinehad AR, et al. Magnetic resonance imaging/ultrasound fusion guided prostate biopsy improves cancer detection following transrectal ultrasound biopsy and correlates with multiparametric magnetic resonance imaging J Urol 2011; 186(4): 1281–1285.
7. Kaplan I, Oldenburg NE, Meskell P, Blake M, Church P, Holupka EJ. Real time MRI‑ultrasound image guided stereotactic prostate biopsy. Magn Reson Imaging 2002; 20(3): 295–299.
8. Xu S, Kruecker J, Guion P, et al. Closed‑loop control in fused MR‑TRUS image‑guided prostate biopsy. Med Image Comput Assist Interv. 2007; 10(1): 128–135.
9. Sonn GA, Natarajan S, Margolis DJ, et al. Targeted biopsy in the detection of prostate cancer using an office based magnetic resonance ultrasound fusion device. J Urol. 2013; 189(1): 86–91.
10. Franz T, von Hardenberg J, Blana A, et al. MRI/TRUS fusion‑guided prostate biopsy: value in the context of focal therapy. Der Urologe A 2017; 56(2): 208–216.
11. Dolejšová O, Eret V, Šobrová A, et al. Využití multiparametrické magnetické rezonance a srovnání s ostatními moderními zobrazovacími metodami v předoperační diagnostice karcinomu prostaty. Ces Urol 2014; 18(4): 300–309.
12. Ferda J, Hora M, Hes O, et al. Zobrazení prostaty na 3 T MRI u nemocných se zvýšenou hladinou PSA. Ces Radiol 2012; 66(1): 9–17.
13. Kongnyuy M, George AK, Rastinehad AR, Pinto PA. Magnetic resonance imaging‑ultrasound fusion‑guided prostate biopsy: Review of technology, techniques, and outcomes. Curr Urol Rep 2016; 17 : 32.
14. Ukimura O, Desai MM, Palmer S, et al. 3-Dimensional elastic registration system of prostate biopsy location by real‑time 3-dimensional transrectal ultrasound guidance with magnetic resonance/transrectal ultrasound image fusion. J Urol 2012; 187(3): 1080–1086.
15. Barentsz OJ, Richenberg J, Clements R, et al. ESUR prostate MR guidelines 2012. Eur Radiol. 2012; 22 : 746–757.
16. Rosenkrantz AB, Kim S, Lim RP, et al. Prostate cancer localization using multiparametric MR imaging: comparison of Prostate Imaging Reporting and Data System (PI‑RADS) and Likert scales. Radiology 2013; 269(2): 482–492.
17. Moore CM, Kasivisvanathan V, Eggener S, et al. Standards of reporting for MRI‑targeted biopsy studies (START) of the prostate: recommendations from an International Working Group. Eur Urol 2013; 64 : 544–552.
18. Šobrová E, Eret V, Dolejšová O, et al. Komparace multiparametrické magnetické rezonance se silou magnetického pole 3 Tesla s transrektální sonografií naváděnou biopsií prostaty. Ces Urol 2014; 18(3): 225–233.
19. Ukimura O, Hung AJ, Gill IS. Innovations in prostate biopsy strategies for active surveillance and focal therapy. Curr Opin Urol. 2011; 21 : 115–120.
20. Ghilezan MJ, Jaffray DA, Siewerdsen JH, et al. Prostate gland motion assessed with cine‑magnetic resonance imaging (cine‑MRI) Int J Radiat Oncol Biol Phys. 2005; 62 : 406–417.
21. Baumann M, Mozer P, Daanen V, Troccaz J. Prostate biopsy tracking with deformation estimation. Med Image Anal. 2012; 16 : 562–576.
22. Siddiqui MM, Rais‑Bahrami S, Turkbey B, et al. Comparison of MR/ultrasound fusion-guided biopsy with ultrasound - guided biopsy for the diagnosis of prostate cancer. JAMA 2015; 313(4): 390–397.
23. Puech P, Rouvière O, Renard‑Penna R, et al. Prostate cancer diagnosis: multiparametric MR‑targeted biopsy with cognitive and transrectal US‑MR fusion guidance versus systematic biopsy – prospective multicenter study. Radiology. 2013; 268 : 461–469.
24. Borkowetz A, Platzek I, Toma M, et al. Comparison of systematic transrectal biopsy to transperineal magnetic resonance imaging/ ultrasound‑fusion biopsy for the diagnosis of prostate cancer. BJU Int 2015; 116 : 873
25. Junker D, Schäfer G, Edlinger M, et al. Evaluation of the PI‑RADS scoring system for classifying mpMRI findings in men with suspicion of prostate cancer. BioMed Research International 2013; 2013 : 252939.
26. Ghai S, Haider MA. Multiparametric‑MRI in diagnosis of prostate cancer. Indian Journal of Urology: IJU: Journal of the Urological Society of India 2015; 31(3): 194–201.
27. Mowatt G, Scotland G, Boachie C, et al. The diagnostic accuracy and cost‑effectiveness of magnetic resonance spectroscopy and enhanced magnetic resonance imaging techniques in aiding the localisation of prostate abnormalities for biopsy: a systematic review and economic evaluation. Health Technol Assess (Winchester, England) 2013; 17 : 1–281. Vii.xix.
28. Kudláčková Š, Král M, Kurfürstová D, et al. Role multiparametrické magnetické rezonance v režimu active surveillance karcinomu prostaty. Ces Urol 2017; 21(3): 225–230.
29. Pivovarčíková, K, Branžovský J, Bauleth K, et al. Radikální prostatektomie – analýza 191 případů vyšetřovaných metodikou celoplošných řezů (whole‑Mount Section). Ces Urol 2014; 18(1): 26–32.
30. Kudláčková Š, Záťura F, et al. Cílená biopsie prostaty pomocí magnetické rezonance – 1. část. Interní Med. 2017; 18(2): 69–72.
31. Dolejsova O, Kucera R, Fuchsova R, et al. The ability of Prostate Health Index (PHI) to predict Gleason score in patients with prostate cancer and discriminate patients between Gleason score 6 and Gleason score higher than 6 – a study on 320 patients after radical prostatectomy. Technology in Cancer Research & Treatment. 2018; 17 : 1533033818787377.
32. Ahmed HU, El‑Shater Bosaily A, Brown LC, et al. Diagnostic accuracy of multi‑parametric MRI and TRUS biopsy in prostate cancer (PROMIS): a paired validating confirmatory study. Lancet. 2017; 389(10071): 815–822.
Štítky
Detská urológia Nefrológia Urológia
Článek Editorial
Článok vyšiel v časopiseČeská urologie
Najčítanejšie tento týždeň
2018 Číslo 4- Aktuálne európske odporúčania pre liečbu renálnej koliky v dôsledku urolitiázy
- MUDr. Šimon Kozák: V algeziológii nič nefunguje zázračne cez noc! Je dôležité nechať si poradiť od špecialistov
- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Editorial
- Roboticky asistovaná resekce objemného angiomyolipomu levé ledviny
- Roboticky asistovaná pyeloplastika pro obstrukci pelviureterálního spojení
- Aktuální pohled na močovou cytologii: Co by měl urolog vědět?
- Nové možnosti intravezikální instilační terapie u karcinomu močového měchýře
- Využití softwarové fúze multiparametrické magnetické rezonance a transrektální ultrasonografie při cílené biopsii nejen signifikantního karcinomu prostaty
- Andrologický faktor - rozhodujúci vplyv veku na úspešnosť asistovanej reprodukcie?
- Porovnání výsledků invazivních vyšetření a močové cytologie: Zkušenosti jednoho urologického centra po prvním roce užívání Pařížské klasifikace pro hodnocení močových cytologií
- Kazuistika pacientky s renálním karcinomem a metachronním postižením bilaterálních nadledvin a kontralaterální ledviny v průběhu 16 let
- Looking back at the 64th annual meeting of the Czech urological society in Ostrava
- Zpráva z nejstarší dětské nemocnice Spojených států
- Výsledky soutěže ČUS o nejlepší vědeckou publikaci za rok 2017
- Dr. h.c. prof. MUDr. Jan Breza, DrSc., MHA - 70-ročný
- Česká urologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Andrologický faktor - rozhodujúci vplyv veku na úspešnosť asistovanej reprodukcie?
- Porovnání výsledků invazivních vyšetření a močové cytologie: Zkušenosti jednoho urologického centra po prvním roce užívání Pařížské klasifikace pro hodnocení močových cytologií
- Aktuální pohled na močovou cytologii: Co by měl urolog vědět?
- Nové možnosti intravezikální instilační terapie u karcinomu močového měchýře
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



