-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Kožní melanom: diagnostika, léčba a pooperační sledování
Cutaneous melanoma: Diagnosis, Treatment and Postoperative Follow-up
In the forties to the eighties began to dramatically increase the incidence of cutaneous melanoma. The increased frequency was so high that the tumor came to the forefront of professional and public interest. Therefore, it significantly improved clinical diagnostics and increased detection of early melanomas prognostically favorable. Currently the melanomas of stage I represent more than 60% of all melanomas in the Czech Republic. Based on the results of randomized prospective studies the recommendations of standard surgical procedures including the sentinel lymph node examination were elaborated. Development of tumor immunology and deeper insights into the biology of melanoma allow the introduction of new therapies. The last two years have been published results of studies with ipilimumab and vemurafenib, drugs, which open a new era in the treatment of metastatic melanoma.
There are no unified recommendations for the monitoring and investigation of patients after advanced melanoma surgery. The frequency of clinical check-ups and type of staging examinations differs significantly in individual countries. The determining factors for the selection of intervals and monitoring methods in asymptomatic patients after melanoma surgery should be the basic histopathological and clinical prognostic tumor characteristics.Key words:
melanoma – diagnosis – treatment - postoperative follow-up
Autori: I. Krajsová
Pôsobisko autorov: Dermatovenerologická klinika VFN a 1. LF UK, Praha přednosta prof. MUDr. Jiří Štork, CSc.
Vyšlo v časopise: Čes-slov Derm, 87, 2012, No. 5, p. 163-174
Kategória: Souborné referáty (doškolování lékařů)
Súhrn
Ve čtyřicátých až osmdesátých letech minulého století se začala výrazně zvyšovat incidence kožního melanomu. Nárůst byl tak vysoký, že se tento nádor dostal koncem dvacátého století do popředí zájmu odborné i laické veřejnosti. Díky tomu se významně zlepšila klinická diagnostika a zvýšil se záchyt časných prognosticky příznivých melanomů. V současné době tvoří melanomy stadia I v ČR více než 60 %. Na základě výsledků randomizovaných prospektivních studií byla vypracována doporučení standardních chirurgických postupů včetně vyšetřování sentinelové uzliny. V adjuvantní léčbě je již více než 30 let jediným schváleným lékem interferon alfa v různých dávkách i schématech. Rozvoj nádorové imunologie a hlubší pohledy na biologii melanomu umožnily zavedení nových léčebných postupů. V posledních dvou letech byly publikovány výsledky studií s ipilimumabem a vemurafenibem, léky, které otevírají novou éru v léčbě metastazujícího melanomu. Pro sledování a vyšetřování nemocných po operaci pokročilého melanomu neexistují v současné době jednotná doporučení. V jednotlivých zemích se významně liší frekvence klinických kontrol i spektrum prováděných stagingových vyšetření. Určujícími faktory pro volbu intervalů a vyšetřovacích metod u bezpříznakových nemocných po operaci melanomu by měly být základní histopatologické a klinické prognostické charakteristiky nádoru.
Klíčová slova:
melanom – diagnostika – léčba – pooperační sledováníÚVOD
Incidence kožního melanomu se zvyšuje již desítky let. V některých zemích představuje, zejména v mladší populaci, jeden z nejčastějších nádorů. Při porovnání s incidencí melanomu ve světě byla Česká republika v roce 2008 na 12. místě (obr. 1). Díky řadě edukačních programů pro laickou veřejnost i zlepšující se diagnostice kožních nádorů u všech typů lékařských odborností se významně zvyšuje záchyt melanomu v časných vývojových stadiích. Podle posledních údajů ÚZIS ČR bylo v letech 2005–2009 přibližně 65 % všech melanomů diagnostikováno ve stadiu I., tedy ve stadiu, kdy chirurgické odstranění nádoru znamená s vysokou pravděpodobností i kompletní vyléčení (obr. 2). Tato pozorování podporují trvalý význam prevence a včasné diagnostiky pro prognózu melanomu. Také chirurgické přístupy prodělaly od poloviny minulého století podstatný vývojový skok. Za nejpřínosnější je možné považovat snížení radikality chirurgie primárního melanomu a zavedení vyšetřování sentinelových uzlin. Pro nemocné to znamená zásadní snížení pooperační zátěže bez snížení léčebné účinnosti. Základním lékem v adjuvantní léčbě melanomu je stále interferon alfa, ale nově již byla FDA (Food and Drug Administration) schválena jeho pegylovaná varianta, která umožňuje podávání 1krát týdně. V rámci klinických studií se začínají v adjuvantní léčbě zkoušet i léky, které již prokázaly účinnost v terapii metastazujícího melanomu – ipilimumab, vemurafenib, dabrafenib a řada dalších. Otázkou stále zůstává optimalizace sledování pacientů po operaci primárního melanomu. Dosud neexistuje mezinárodní konsenzus v doporučených intervalech kontrol, ve volbě typu vyšetřovacích metod ani v odpovědi na otázku jaký přínos pro nemocné pooperační sledování znamená. Stoupající incidence melanomu a rozšiřující se spektrum diagnostických a léčebných metod vyžaduje stále vyšší specializaci a multidisciplinární přístup k léčbě těchto pacientů.
Obr. 1. Porovnání incidence melanomu v ČR a ostatních zemích 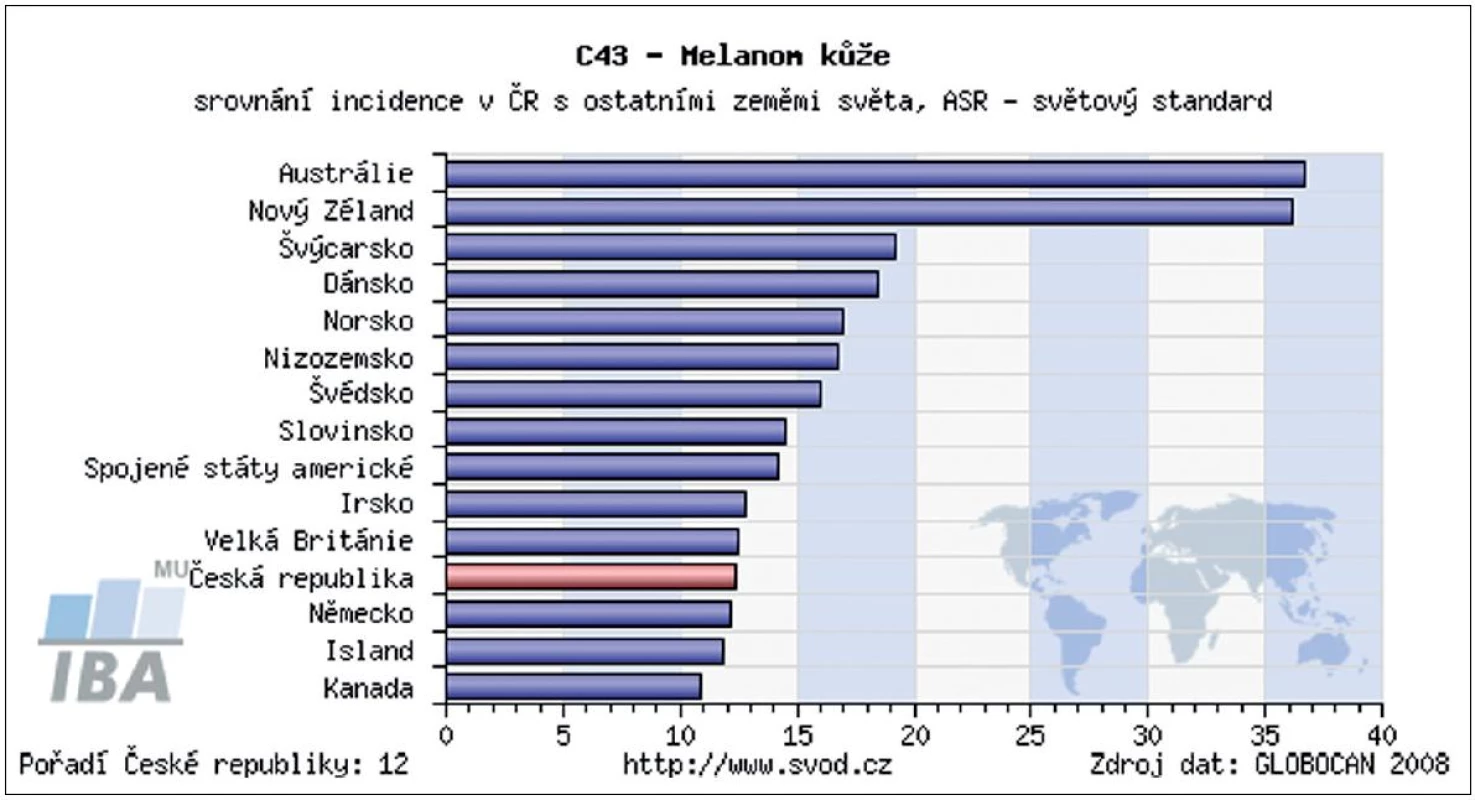
Obr. 2. Zastoupení jednotlivých stadií melanomu v době stanovení 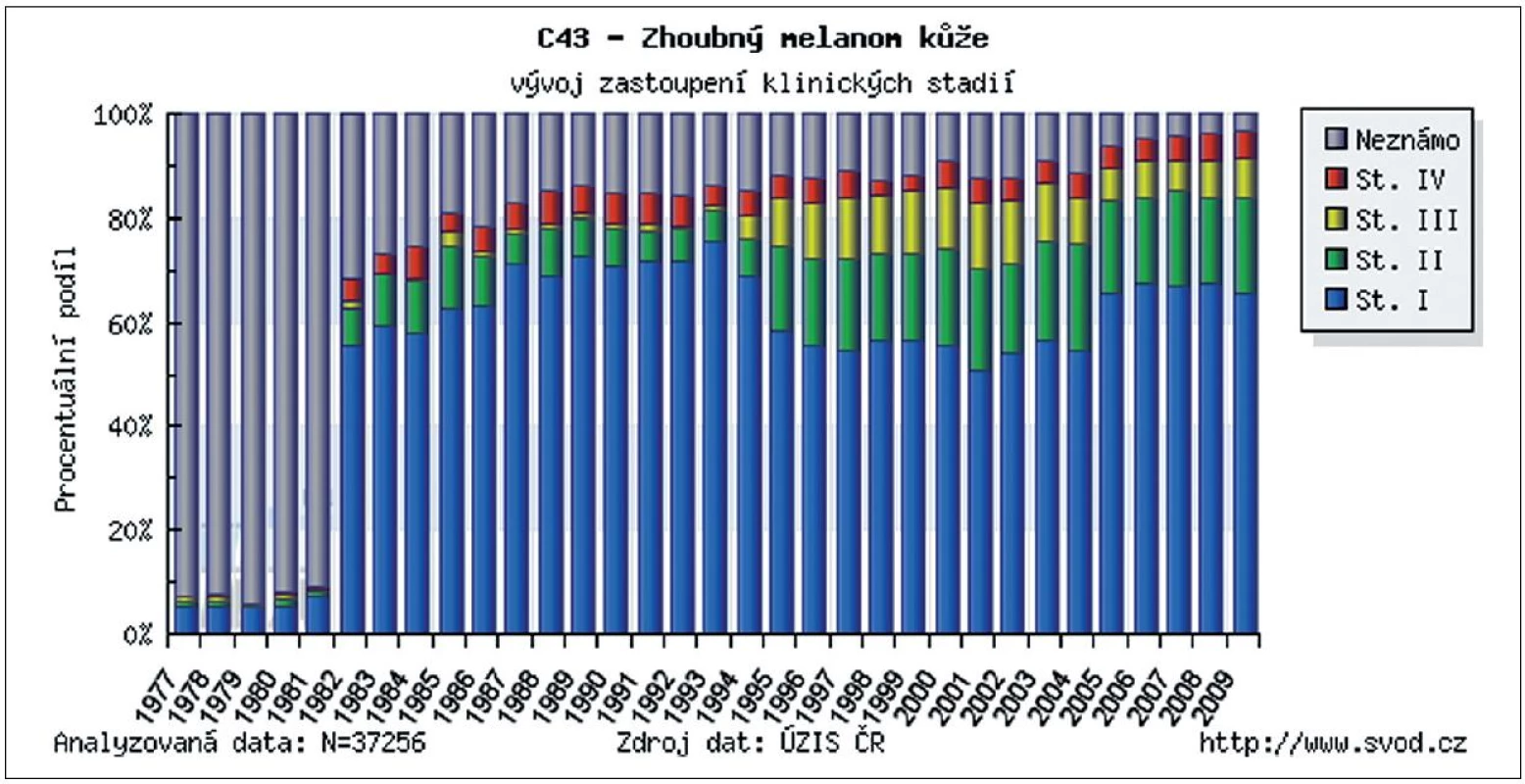
KLINICKÁ A HISTOLOGICKÁ DIAGNOSTIKA MELANOMU
Klinické stanovení diagnózy melanomu je stále založeno na základních ABCDE rysech, jejichž použití usnadňuje rozpoznání zejména časných plošně se šířících melanomů. Pro pokročilé a zvláště nodulární melanomy je jejich využití omezené. Vyšetření dermatoskopem je v současné době nedílnou součástí primárního vyšetření nemocných s pigmentovými névy či suspektním melanomem. Je to rychlá neinvazivní metoda, která umožňuje přesnější odlišení jednotlivých rysů melanocytárních lézí a tím i spolehlivější stanovení diagnózy u klinicky nejasných ložisek. Pro použití dermatoskopu je nezbytné zaškolení, které až o 20 % zlepšuje stanovení diagnózy, ale v nezkušených rukou se naopak přesnost dermatoskopického vyšetření zhoršuje [15]. Asi největší potíže v diagnostice melanomu způsobují drobná ložiska menší než 6 mm. Se stoupající znalostí základních rysů melanomu a díky přesnějším histopatologickým vyšetřením stoupá záchyt velmi malých melanomů, které jsou svou velikostí na hranici klinické detekovatelnosti. Melanocytární léze dosahující maximálně 3 mm již nelze bez ručního či digitálního dermatoskopu vyšetřit. I v těchto případech stále platí, že základním postupem při klinickém podezření na melanom je jeho chirurgické odstranění a histologické vyšetření. Na druhou stranu je ale nutné zdůraznit, že právě díky zpřesnění klinické diagnostiky dermatoskopickým vyšetřením je možné zabránit řadě zbytečných excizí benigních melanocytárních névů.
V naprosté většině případů musí být každý excidovaný névus histologicky vyšetřen. Výjimkou snad mohou být pouze drobné klinicky jednoznačné intradermální névy vhodné např. pro laserové ošetření, u nichž dermatolog odstranění bez následného histologického vyšetření schválil. Při podezření na melanom je histologické vyšetření samozřejmostí. Popis by měl vždy obsahovat všechny základní ukazatele požadované aktuální AJCC klasifikací melanomu [10]. V současné době je platná 7. verze z roku 2009. Pro správné zařazení melanomu v rámci T (tumor) klasifikace je nezbytný přesný popis histologických parametrů uvedených v tabulkách 1 a 2.
Tab. 1. Základní nezbytné histopatologické charakteristiky primárního melanomu 
Tab. 2. Další histopatologické charakteristiky primárního melanomu pomáhající predikovat průběh onemocnění 
Kožní melanomy mají velmi pestrý klinický vzhled a tomu odpovídá i proměnlivost histopatologického obrazu, odlišnost morfologických rysů nádorových buněk, různá intenzita produkce melaninu nebo schopnost šíření mimo místo primárního vzniku. Mezi parametry, které ještě více zpřesňují prognózu onemocnění, patří údaje uvedené v tabulce 2.
Všechny popisované rysy melanomu blíže specifikují jeho biologické vlastnosti, a umožňují tak přesnější odhad dalšího průběhu onemocnění. Jsou nezbytné pro správné zařazení do T klasifikace a také pro rozhodnutí o léčebném postupu, o délce intervalů klinického sledování i pro volbu dalších vyšetřovacích metod. Například ulcerace melanomu výrazně zhoršuje prognózu. V případech pacientů s melanomy se stejnou hodnotou Breslowa mají ti s ulcerovaným nádorem o 10 až 25 % nižší pravděpodobnost 10letého přežití [1].
I při použití různých vyšetřovacích metod zůstává stále diagnostika melanomu v některých případech velmi obtížná, a je proto vhodné soustředit tuto problematiku včetně histopatologického hodnocení do specializovaných center.
CHIRURGICKÁ LÉČBA
Chirurgické odstranění nádoru je u primárního melanomu základním léčebným postupem. Pokud není klinická diagnóza jednoznačná, je vždy indikována prostá neširoká excize ložiska a další léčebný postup určí až výsledek histologického vyšetření. Ve výjimečných případech, např. u rozsáhlých nádorů nejistého klinického vzhledu nebo u ložisek lokalizovaných na obličeji či akrech, je možné provést k potvrzení diagnózy nejprve probatorní excizi. Měla by být vždy provedena z místa s nejvýraznějšími klinickými nebo dermatoskopickými rysy, aby bylo histologické vyšetření přínosné [15]. Při stanovení diagnózy melanomu je vždy indikována totální excize s lemem zdravé tkáně, jehož šířka se řídí tloušťkou nádoru [17] – tabulka 3.
Tab. 3. Doporučovaná šířka lemu zdravé tkáně při excizi či reexcizi melanomu 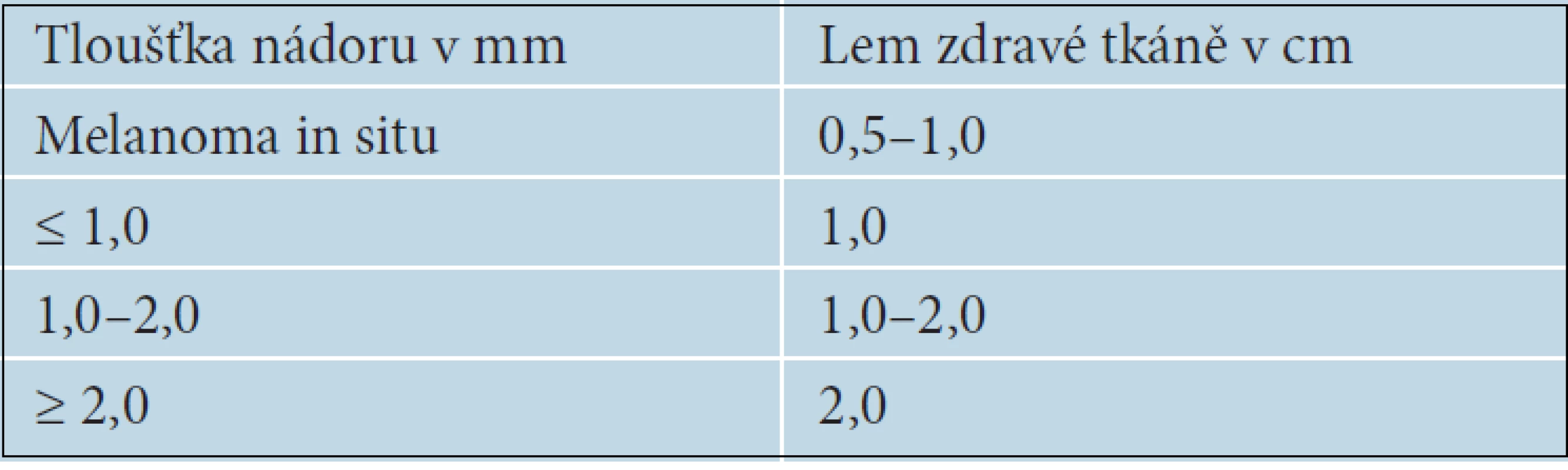
Od devadesátých let minulého století se ve většině pracovišť, která se zabývají léčbou melanomu, provádí kromě excize primárního nádoru také vyšetření sentinelové uzliny (SLN). Je to první uzlina, do které přitéká lymfa z místa nádoru, a tak je to i první uzlina, do které se mohou případně šířit nádorové buňky. Sentinelová uzlina není palpačně detekovatelná a je nutné jí identifikovat předoperační celotělovou scintigrafií, při které se určená oblast a nalezené uzliny označí na kůži nesmyvatelnou barvou. Při následném chirurgickém výkonu se za použití ruční gamakamery peroperačně potvrdí uzliny jako sentinelové, odstraní se a odešlou k podrobnému histologickému vyšetření. Správné histopatologické zhodnocení SLN je podmíněné dodržováním již vypracovaných standardních technik pro zpracování a barvení jednotlivých řezů [2, 23]. Mapování a vyšetřování SLN se má proto provádět pouze ve specializovaných centrech, která se věnují problematice melanomu.
K vyšetření sentinelové uzliny jsou indikovány všechny nádory, jejichž tloušťka přesáhla 1,0 mm, popř. i tenčí nádory s ulcerací nebo vysokým mitotickým indexem, za což je považováno 6 a více mitóz na 1 mm2.
I když má mapování a exstirpace sentinelové uzliny minimum pooperačních komplikací, je nutné tento výkon zvážit u počínajících melanomů s minimálním rizikem metastázování. V těchto případech dosahuje pozitivita vyšetření maximálně 5 %, a tak by případné komplikace a operační zátěž mohly převýšit přínos vyšetření. Kontraindikací pro operaci sentinelových uzlin je stav po radikální excizi primárního nádoru, která mění spád lymfatického řečiště, a tím znemožňuje identifikaci odpovídající sentinelové uzliny. Pokud je stanovena diagnóza melanomu mimo pracoviště věnující se problematice melanomu, nemá být nikdy primárně indikována reexcize jizvy, ale pacient má být poslán do melanomového centra, kde je možné provést současně vyšetření sentinelové uzliny i zvětšení jizvy s požadovaným lemem zdravé tkáně [26].
Pacienti by ale měli být do melanomových center odesílání již při klinickém podezření na melanom, ne až po operaci, aby bylo možné provést současně radikální odstranění primárního nádoru i vyšetření sentinelové uzliny.
AJCC (American Joint Committee on Cancer) klasifikace označuje průkaz nádorových buněk v sentinelové uzlině jako uzlinové mikrometastázy, zatímco o makrometastázách se hovoří v případě palpovatelných uzlin. Pravděpodobnost mikrometastáz v SLN se zvyšuje s tloušťkou nádoru, vysokým mitotickým indexem nebo přítomností ulcerace melanomu. Pozitivní sentinelové uzliny jsou vždy důvodem k systematické regionální lymfadenektomii, i když záchyt nádorových buněk v následných, tzv. nesentinelových, uzlinách nebývá příliš vysoký a pohybuje se v širokém rozmezí mezi 5–30 % podle velikosti mikrometastáz i podle jejich lokalizace v uzlině. Rozsah postižení SLN je považován za prediktivní faktor metastáz v následných uzlinách. Podle platné AJCC klasifikace melanomu jsou za významné považovány až mikrometastázy ≥ 0,2 mm, ale současně je pro pozitivitu sentinelových uzlin postačující průkaz izolovaných nádorových buněk alespoň jedním ze specifických melanomových markrů – HMB45 nebo Melna-A/MART 1. Rotterdamská kritéria navrhují rozdělení mikrometastáz podle rozsahu na tři skupiny < 0,1 mm, 0,1 až 1,0 mm a > 1,0 mm. Je nezbytné měřit každé ložisko zvlášť v jeho nejdelším rozměru [34], Dewarova kritéria pak klasifikují jejich umístění v uzlině. Mikrometastázy mohou být uloženy subkapsulárně nebo v parenchymu, mohou být multifokální, nebo může dojít k extenzivnímu postižní velké části uzliny. Velikost ložisek i jejich mikroanatomická lokalizace mohou být prediktivními faktory postižení uzlin v následné regionální lymfatické oblasti [2, 20, 35]. Indikací exenterace při průkazu mikrometastáz v SLN se zabývá řada studií, např. MSLT-I, II (Multicenter Selective Lymphadenectomy Trial I, II) nebo studie probíhající v rámci MCG – EORTC (Melanoma Cooperative Group – European Organisation of Research and Treatment of Cancer). Výsledky řady z nich ukazují, že riziko vzniku uzlinových metastáz je bez provedení následné disekce regionálních lymfatických uzlin velmi vysoké a také průběh onemocnění a celková doba přežití (OS) se zhoršuje. Pouze u ložisek menších než 0,1 mm nebyl jednoznačně prokázán přínos následné disekce, protože postižení nesentinelových uzlin se v těchto případech neprokazuje a průběh onemocnění je identický jako u nemocných s negativními SLN [35, 36]
Stav sentinelových uzlin je hodnocen jako velmi důležitý prognostický faktor, protože bylo prokázáno, že nemocní s mikrometastázami v SLN mají statisticky významně kratší RFS (relaps free survival) i OS. Mapování sentinelových uzlin ale nelze považovat za léčebnou metodu, protože odstranění pozitivních SLN neprodlužuje celkové přežití nemocných. Nicméně dochází k prodloužení přežití bez relapsu, disekcí regionální lymfatické oblasti při pozitivních SLN se významně snižuje počet nemocných, u kterých by došlo ke vzniku uzlinových metastáz v odstupu měsíců či let po operaci pokročilého primárního nádoru [23].
Makroskopické postižení regionálních lymfatických uzlin, to znamená palpačně detekovatelné zvětšené uzliny, je vždy indikací k provedení radikální exenterace. Nedoporučuje se pouhá exstirpace hmatných uzlin, protože subklinické postižení ostatních uzlin je vysoce pravděpodobné a způsobuje při nedostatečně radikálním výkonu časný uzlinový relaps. Pouze v případech zvětšených uzlin bez známého primárního nádoru se samozřejmě doporučuje nejprve pouhá exstirpace uzliny. Při histologickém potvrzení metastáz melanomu však musí vždy následovat disekce celé regionální lymfatické oblasti, i když nejsou další uzliny hmatné. Radikální výkon je nutný i v případech negativního sonografického nálezu.
ADJUVANTNÍ LÉČBA
Adjuvantní léčba je indikována po operaci primárního nádoru v době, kdy nejsou metastázy jednoznačně prokazatelné, ale můžeme je s různě vysokou pravděpodobností předpokládat. Zahajuje se co nejdříve po odstranění melanomu, protože případný mikroskopický rozsah postižení umožňuje vyšší účinnost léčby. Hlavním cílem adjuvantní léčby je zlepšení celkového přežití pacientů, ale nezanedbatelným přínosem je, zejména u nemocných s melanomem, i prodloužení přežití do vzniku recidivy onemocnění (DFS).
K adjuvantní léčbě melanomu jsou indikováni nemocní s tzv. vysoce rizikovým pokročilým melanomem. Jedná se zejména o nemocné s uzlinovým postižením, s melanomem stadia III. Za prognosticky závažné je považováno jednak makroskopické postižení uzlin, což znamená, že uzliny jsou hmatné již při klinickém vyšetření, ale také pouze mikroskopické postižení sentinelové uzliny. V případě negativních sentinelových uzlin jsou hodnoceny jako vysoce rizikové primární melanomy stadia IIB a IIC, tedy nádory s hodnotou Breslowa větší než 4,0 mm nebo větší než 2,0 mm s ulcerací. Jednotlivá stadia melanomů, která jsou indikována k adjuvantní léčbě, ukazuje tabulka 4.
Tab. 4. Stadia aJCC klasifikace melanomu označující nádory s vysokým rizikem progrese 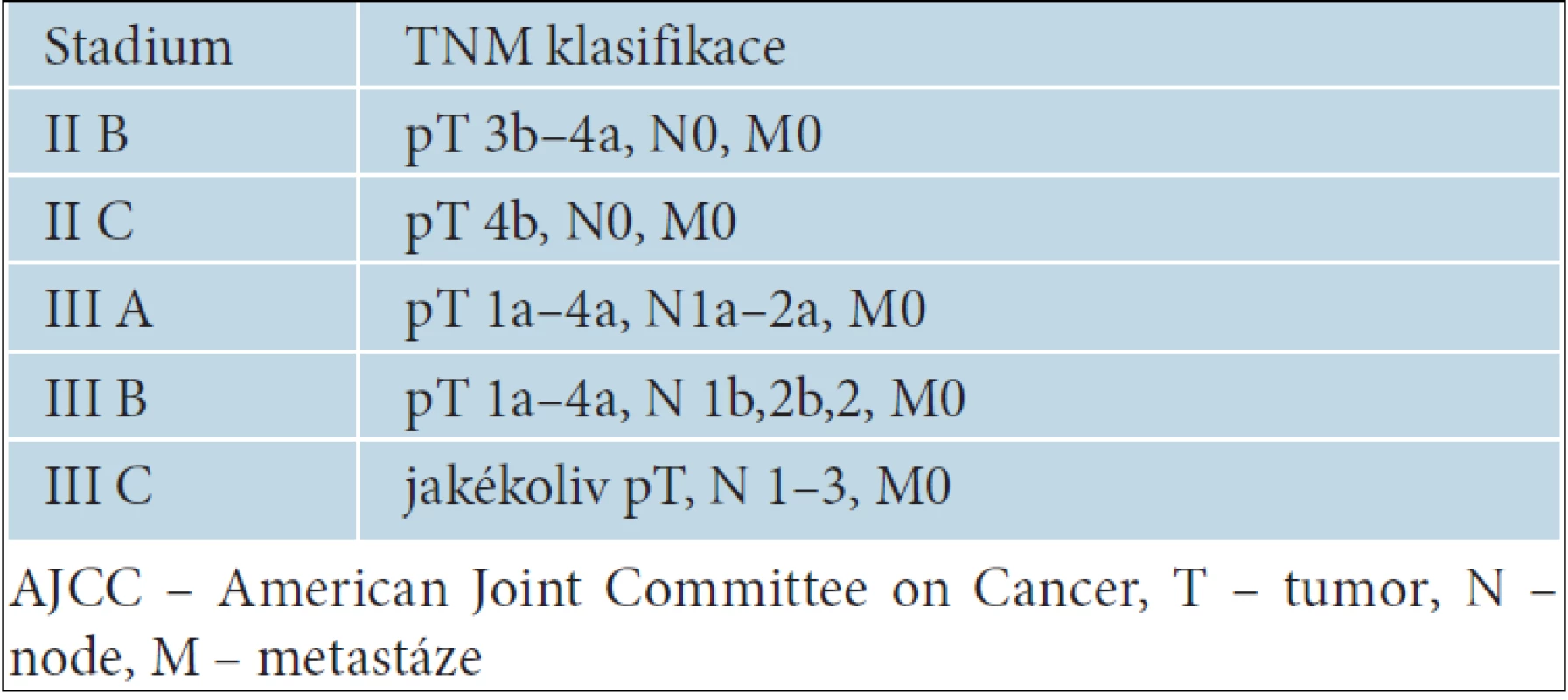
V adjuvantním podávání se ověřovala řada různých léčebných postupů, jako je chemoterapie, radioterapie nebo imunoterapie, pomocí nádorových vakcín či cytokinů. V současné době je jediným přípravkem schváleným FDA i EMA (European Medicines Agency) pro adjuvantní léčbu melanomu interferon alfa (IFN alfa). V ČR je podáván na základě doporučených farmakoterapeutických postupů v klinické onkologii publikovaných v tzv. Modré knize. Interferon alfa se zkouší již od osmdesátých let minulého století, od kdy proběhla řada prospektivních randomizovaných mezinárodních klinických studií a léčeny byly tisíce nemocných s melanomem. Metaanalýza studií z let 1990–2008 s více než 8 000 nemocných byla publikována v roce 2010. V 10 ze 17 studií prokázal interferon alfa zlepšení RFS (relaps free survival) a ve 4 ze 14 i zlepšení OS (overall survival) [22]. Ani podrobnými analýzami jednotlivých použitých léčebných schémat nebyla ale identifikována optimální dávka a doba podávání interferonu alfa. Nejvíce citované studie porovnávající účinnost interferonu alfa s pouhým sledováním nemocných po operaci pokročilého melanomu jsou uvedeny v tabulce 5.
Tab. 5. Přehled léčebných schémat s interferonem alfa nejčastěji používaných v adjuvantní léčbě melanomu 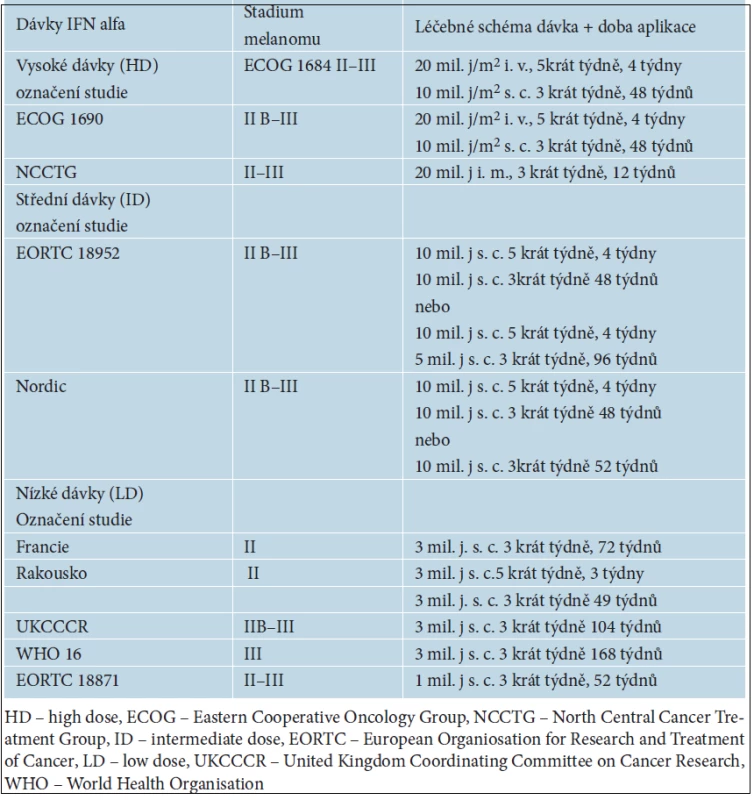
Kromě nejčastěji používaných interferonů alfa 2a a alfa 2b se zkoušel také pegylovaný interferon alfa (PEG IFN alfa). Pegylace znamená konjugaci proteinu s polyetylenglykolem, který zpomaluje absorpci a vylučování léku z organismu a současně snižuje jeho imunogenicitu. První studie využívající PEG IFN alfa v adjuvantní léčbě melanomu měla označení EORTC 18991. Pacienti byli zařazování do dvou ramen buď na léčbu pegylovaným interferonem, nebo do kontrolní neléčené skupiny. Schéma studie je uvedené v tabulce 6.
Tab. 6. Léčebné schéma eoRtC 18991 studie 
Výsledky studie prokázaly statisticky významné prodloužení RFS bez významného prodloužení OS [5]. EORTC 18991 studie byla základem pro to, aby FDA v březnu 2011 schválila pegylovaný interferon alfa 2b ( Sylatron) pro adjuvantní léčbu melanomu všech stadií III. Výhodou pegylovaného IFN alfa je možnost podávání 1krát týdně, účinnost a toxicita jsou podobné jako u klasické formy.
Výsledky mnoha studií celkem důsledně a statisticky významně potvrzují příznivý vliv IFN alfa, včetně jeho pegylované formy, na prodloužení období do relapsu, výrazně méně často a méně významně prokazují ovlivnění celkové doby přežití nemocných s melanomem. Jistě ale existuje skupina pacientů, kteří mají z adjuvantní léčby IFN alfa užitek [24]. Analýzy účinnosti IFN alfa u jednotlivých stadií onemocnění ukazují různé léčebné účinky u různých podskupin pacientů. Údaje se však natolik liší, že stále neznáme prediktivní faktory léčebné odpovědi, a tak nejsme schopni předem vytipovat nemocné, kteří budou z adjuvantní léčby IFN alfa profitovat. Je proto nezbytné dodržovat již uvedená indikační kritéria (vysoce rizikový melanom stadia IIB,C a III), aby toxicita léčby nepřevážila očekávané účinky. Nejčastější nežádoucí účinky jsou uvedeny v tabulce 7.
Tab. 7. Nežádoucí účinky léčby interferonem alfa 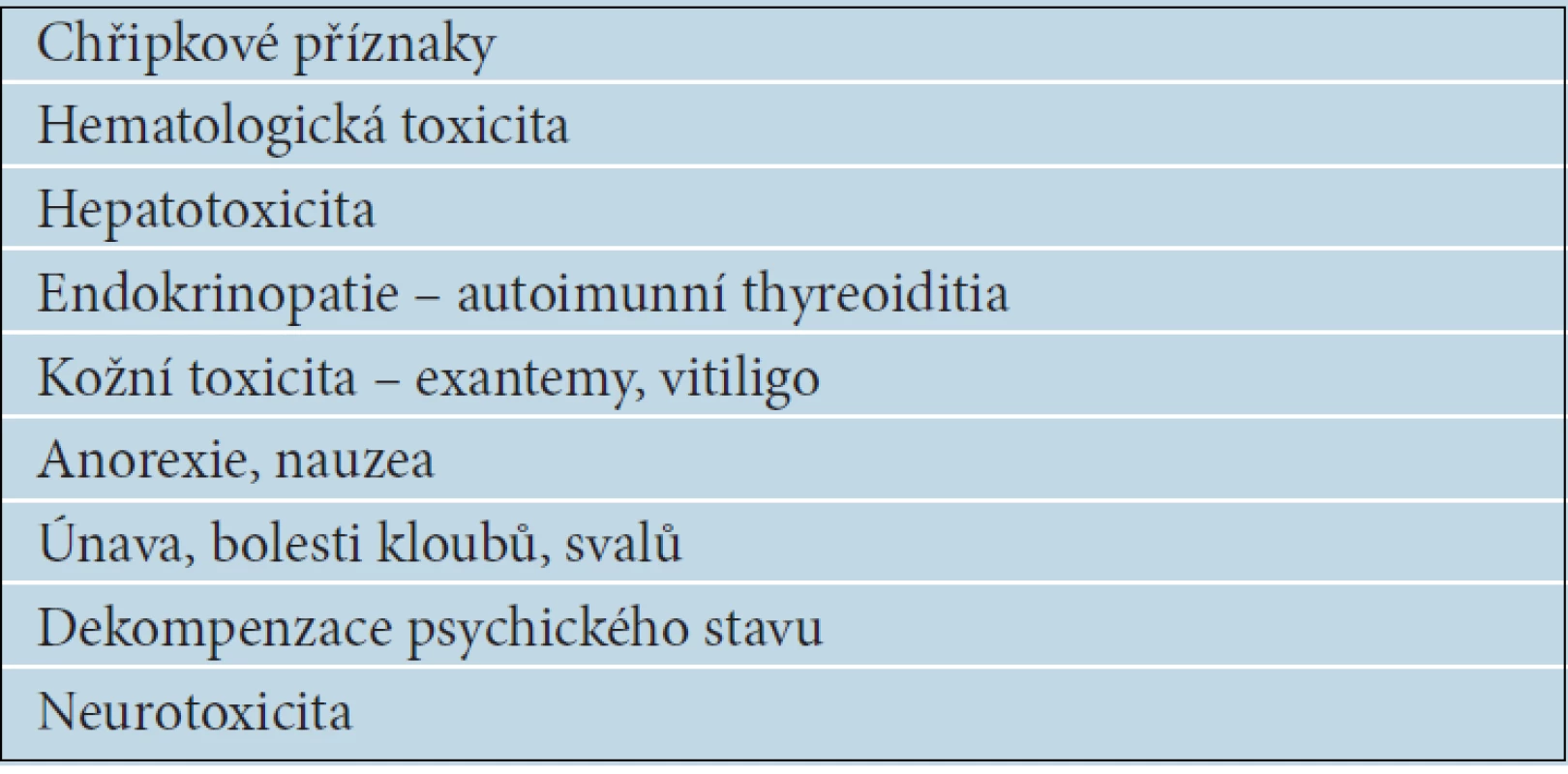
Za hlavní nedostatek adjuvantní léčby melanomu IFN alfa je považována malá účinnost v prodloužení OS. Přesto je možné jí považovat za most mezi léčbou primárního melanomu a léčbou metastazujícího melanomu. Zlepšení celkového přežití by sice bylo lepší než pouhé oddálení vzniku relapsu, ale i prodloužení přežití bez relapsu je lepší než nic (S. Agarwala, cco.com/oncology).
V rámci klinických studií se v adjuvantní léčbě melanomu zkoušejí také nové léčebné metody. První předběžné výsledky studie DERMA s MAGE A3 vakcínou u pacientů s pokročilým melanomem stadia III se očekávají v blízké době. Byla zahájena EORTC studie s pegylovaným interferonem alfa v adjuvantní léčbě ulcerovaných primárních melanomů. Na základě prokázané účinnosti ipilimumabu v léčbě metastazujícího melanomu byla naplánována i studie EORTC 18071 s jeho adjuvantním podáváním. První výsledky se ale očekávají až v roce 2014 nebo 2015. V USA byla zahájena studie porovnávající účinnost vysokých dávek interferonu alfa proti ipilimumabu v dávkách 3mg/kg a 10mg/kg. Přehled v současnosti probíhajících studií je uveden v tabulce 8. Připravují se též studie s adjuvantně podávaným vemurafenibem a dalšími BRAF inhibitory, např. dabrafenibem.
Tab. 8. Nejvýznamnější probíhající studie fáze iii v adjuvantní léčbě melanomu 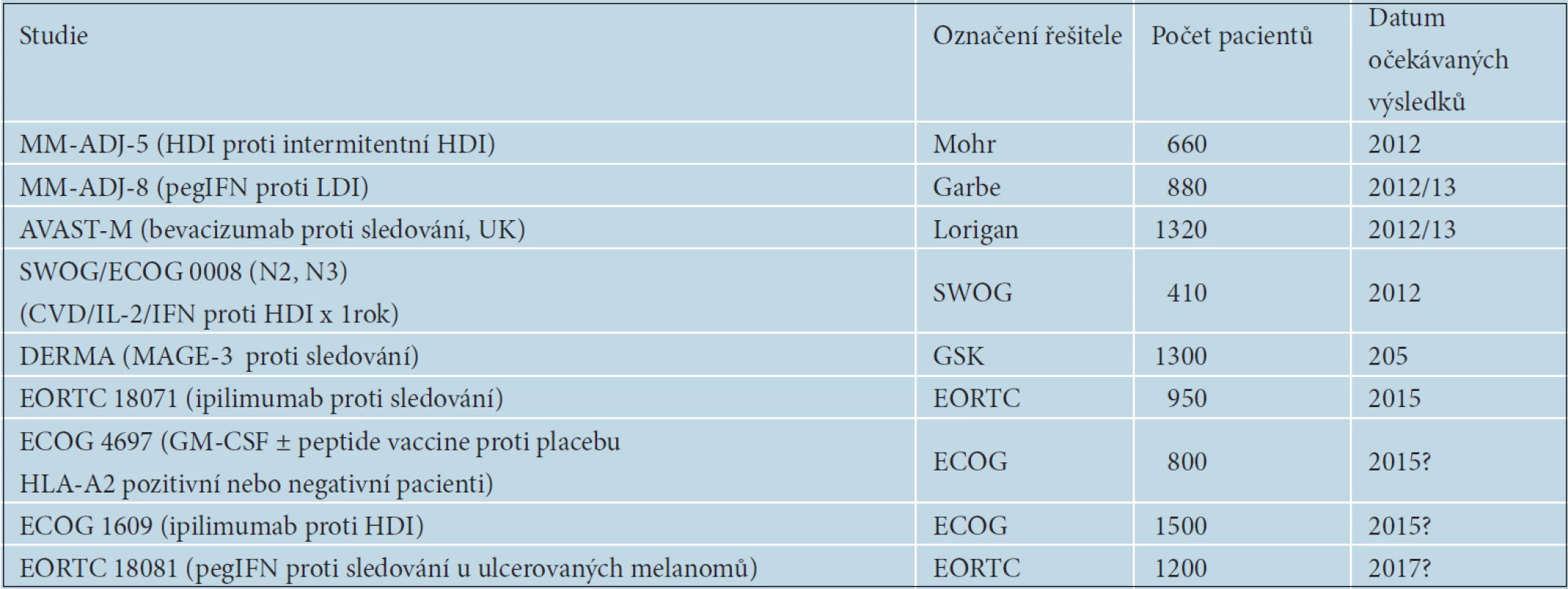
LÉČBA METASTAZUJÍCÍHO MELANOMU
Metastazující melanom je agresivní nádor s vysokou mortalitou, zejména kvůli značné rezistenci ke klasickým léčebným postupům, jako je chemoterapie nebo biochemoterapie. Medián přežití se u těchto terapeutických modalit pohybuje v rozmezí 6–12 měsíců a pěti let se dožívá jen 10 % nemocných [30]. Velmi zřídka je možné pozorovat kompletní léčebnou odpověď, četnější jsou alespoň částečné reakce na léčbu, ale doba jejich trvání je velmi krátká. Pouze vysoké dávky IL-2 (interleukinu-2) dokáží u malého počtu nemocných vyvolat déle trvající odpovědi. Žádná z randomizovaných klinických studií s chemoterapií, biochemoterapií nebo monoterapií IL-2 však neprokázala statisticky významné prodloužení OS.
V březnu 2011 schválila FDA nový lék – ipilimumab – pro léčbu metastazujícího melanomu.
Ipilimumab je monoklonální protilátka proti receptoru CTLA-4, což je jedna z nejvýznamnějších molekul, která reguluje imunitní reakce. Antigen CTLA-4 je exprimován na povrchu pomahačských T lymfocytů odpovědných za cytotoxickou reakci. Představuje hlavní negativní regulační mechanismus protinádorové imunitní odpovědi zprostředkované T lymfocyty a brání vzniku autoimunitních reakcí. Jeho zablokování vede ke zvýšení a prodloužení aktivace cytotoxických T lymfocytů a tím i ke zvýšení protinádorové imunitní reakce. Jednou z látek, která dokáže účinně inhibovat receptor CTLA-4, je plně humánní IgG1 monoklonální protilátka ipilimumab. Byl zkoušen v řadě klinických studií s různými nádory, ale nejvíce u pacientů s melanomem. Za jednu z nejvýznamnějších je považována studie fáze III, ve které byla porovnávána účinnost ipilimumabu samotného nebo v kombinaci s gp100 vakcínou proti samotné gp100 vakcíně. Do této studie bylo zařazeno 676 pacientů HLA-A-0201 pozitivních, u kterých již selhal minimálně jeden terapeutický režim. Ipilimumb byl podáván v dávce 3mg/kg, 4krát v třítýdenních intervalech v tzv. indukční fázi. Výsledky studie ukázaly, že se objevil nový lék, který je jako první v historii léčby metastazujícího melanomu schopen prodloužit celkové přežívání nemocných. Medián OS byl u pacientů léčených ipilimumabem statisticky významně delší než u nemocných léčených pouze gp100 vakcínou [7]. Výsledky uvádí tabulka 9.
Tab. 9. Medián celkového přežívání podle typu léčby 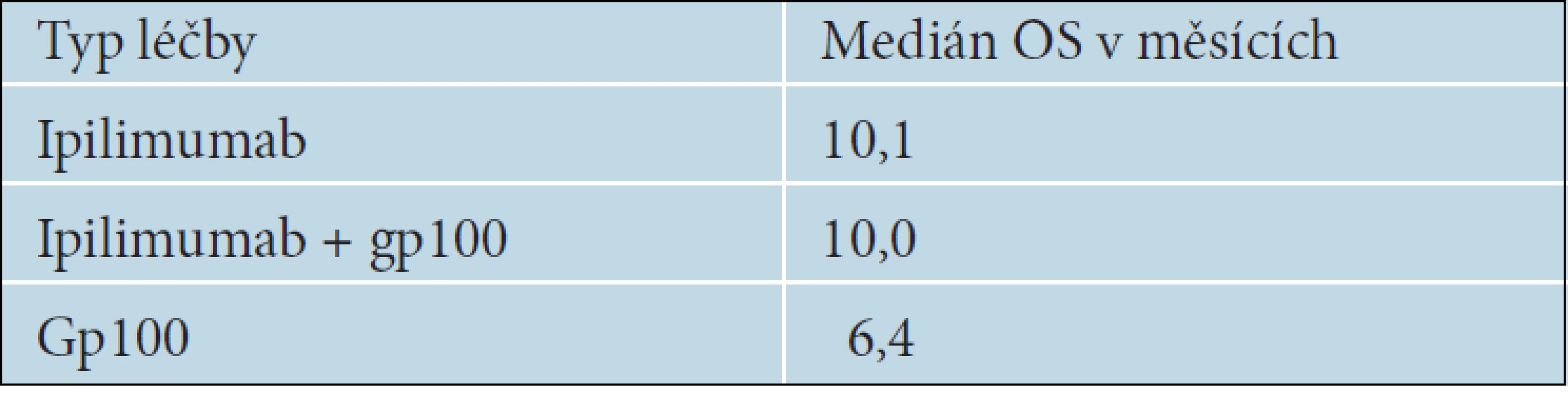
Pokud došlo u nemocných k progresi onemocnění po více než tříměsíčním trvání léčebné odpovědi, byla povolena tzv. reindukční léčba ve stejném léčebném režimu jako v indukční fázi. U 67,7 % pacientů, kteří absolvovali reindukci, byla pozorována částečná odpověď nebo stabilizace onemocnění [25]. Léčebné odpovědi přetrvávaly déle, než je obvyklé při léčbě metastazujícího melanomu. V tabulce 10 je uvedeno celkové přežívání nemocných v jednotlivých léčebných ramenech. Dva roky od zahájení léčby přežívalo více než 20 % nemocných léčených ipilimumabem. Na základě výsledků této studie byl ipilimumab schválen FDA i EMA pro druhou linii léčby metastazujícího melanomu.
Tab. 10. Délka přežívání nemocných podle typu léčby 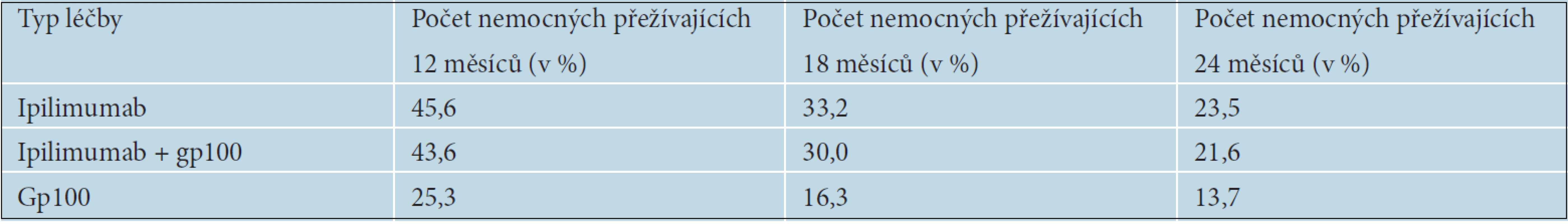
Prodloužení OS i délku trvání léčebných odpovědí následně potvrdila i BMS 024 studie, v níž byl ipilimumab podáván v první linii léčby metastazujícího melanomu. Pacienti s inoperabilním melanomem stadia III nebo s metastazujícím melanomem stadia IV byli randomizováni do dvou ramen – buď na léčbu Ipilimumab + Dacarbazin (DTIC), nebo na léčbu placebo + Dacarbazin. Ipilimumab byl podáván v dávce 10 mg/kg 4krát v třítýdenních intervalech a následně v udržovací léčbě po 12 týdnů do progrese onemocnění nebo nepovolené toxicity, Dacarbazin v dávce 850mg/m2 celkem 8krát v třítýdenních intervalech. Také v této studii bylo prokázáno statisticky významné prodloužení OS u pacientů léčených ipilimumabem 11,2 měsíců proti 9,1 měsícům v rameni s dacarbazinem (p ? 0,0009). Tabulka 11 ukazuje počty nemocných přežívajících 12, 24 a 36 měsíců od zahájení léčby. Riziko úmrtí bylo u nemocných léčených ipilimumabem sníženo o 28 % – HR (hazard ratio) 0,72. K významnému rozdílu v přežívání nemocných mezi jednotlivými léčebnými rameny začínalo docházet přibližně 4. měsíc od zahájení léčby, což je doba, kdy je možné očekávat nástup účinku ipilimumabu. U nemocných léčených ipilimumabem a DTIC došlo ke 24% snížení rizika progrese proti skupině léčené pouze DTIC. Četnost kompletních a částečných odpovědí byla 15,2 oproti 10,3 % v rameni s ipilimumabem. Kontroly onemocnění bylo dosaženo u 33,2 % oproti 30,2 % v léčeném rameni. Progrese onemocnění byla popisována významně častěji v rameni s placebem 52,0 % oproti Ipilimumabu, kde progredovalo 44,4 % nemocných. Dlouhé trvání léčebných odpovědí 19,3 měsíců oproti pouhým 8,1 v rameni s placebem pak potvrdilo výsledky z předchozích studií [12].
Tab. 11. Délka přežívání nemocných podle typu léčby, studie BMs 024 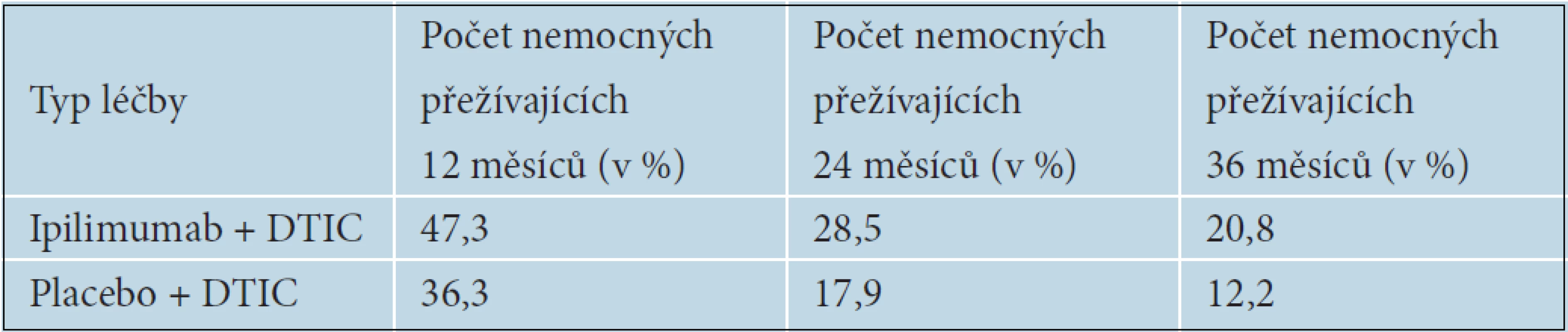
Ipilimumab nemá přímé cytotoxické účinky jako chemoterapie (CHT). Zablokováním receptoru CTLA-4 dochází nejprve k aktivaci cytotoxických T lymfocytů, jejich následné proliferaci a teprve poté k infiltraci nádorových ložisek. To může způsobit často pozorované přechodné zvětšení metastáz i vznik nových ložisek. Nejedná se však většinou o metastázy, ale o makroskopicky patrný shluk lymfocytů způsobený jejich zvýšenou proliferací a označovaný jako pseudoprogrese. Při léčbě ipilimumabem můžeme pozorovat 4 základní typy léčebných odpovědí: okamžitou kompletní nebo parciální odpověď jako u CHT, stabilizaci onemocnění s následným zmenšováním metastáz nebo bez něj, zmenšování metastáz po jejich přechodném zvětšení a zmenšování nádorové masy i při vzniku nových ložisek [37]. Pro hodnocení léčebných odpovědí byla proto zavedena nová kritéria, tzv. immune related response criteria – irRC. Jejich odlišnost od RECIST (Response Evaluation Criteria in Solid Tumors) a kritérií WHO (World Health Organisation) je uvedena v tabulce 12. Hlavním rozdílem je možnost vzniku nových ložisek, aniž by to znamenalo jednoznačnou progresi onemocnění [7]
Tab. 12. Rozdíly mezi ReCist, who a irRC kritérii hodnocení léčebné odpovědi 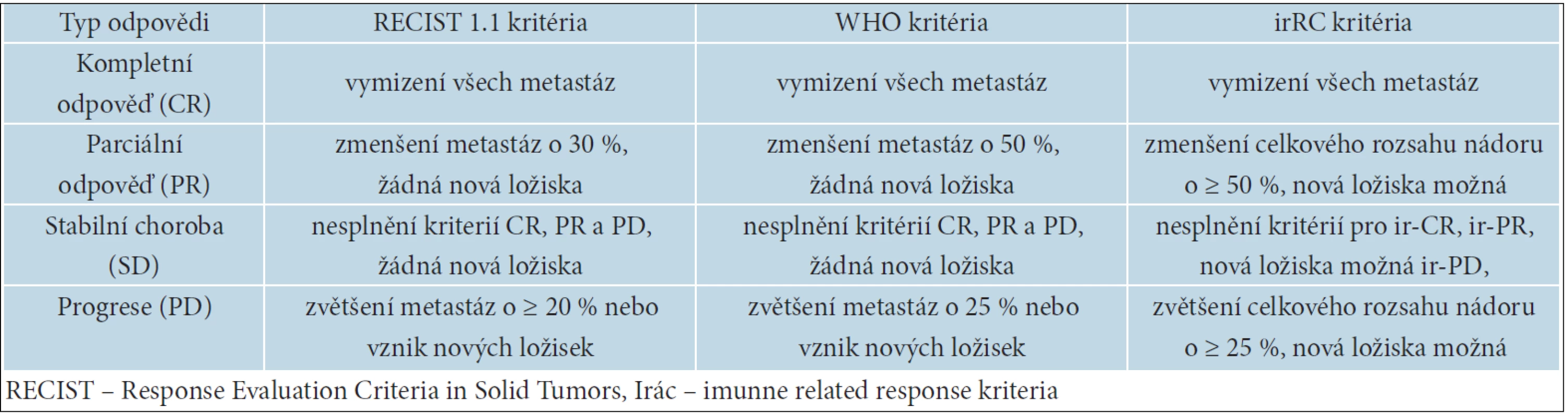
Nová irRC umožňují přesnější a objektivnější zhodnocení a brání předčasnému ukončení léčby. První měření nádorových ložisek se provádí až 12. týden od zahájení léčby a pozorované léčebné odpovědi nebo progrese onemocnění musí být ještě potvrzeny ve čtyřtýdenním odstupu. Dále se nemocní sledují ve dvanáctitýdenních intervalech [16]. Doba nástupu léčebného účinku je velmi individuální a nejspíše značně závislá na výchozím stavu imunitního systému pacienta. V literatuře je popisován i extrémně pozdní vznik léčebných odpovědí.
Nežádoucí účinky (NÚ) léčby jsou převážně způsobeny zvýšenou aktivací imunitního systému díky zablokování CTLA-4 receptoru a spuštěním autoimunitních reakcí [32]. Nejčastější jsou kožní NÚ, které postihují 45–70 % nemocných. Projevují se svěděním kůže a diskrétním drobnopapulózním exantémem na různých partiích těla. Závažnější formy jsou vzácné a jedná se zejména o exudativní multiformní erytém, Stevens-Johnsonův syndrom a ojediněle byly popsány i případy Lyelova syndromu. Za nejzávažnější nežádoucí účinky je možné považovat gastrointestinální (GIT) toxicitu, která se projevuje převážně průjmy a kolitidou u 30–45 % pacientů. Vzácně, zejména v počátcích léčby ipilimumabem byly popsány i střevní perforace. Průjmovitá stolice se většinou objevuje náhle, a pokud závažnost dosáhne stupně 3, tedy více než 7 stolic nad obvyklou denní normu, je důvodem k trvalému ukončení léčby. Základem úspěchu léčby NÚ v GIT oblasti je její včasné zahájení. Lékem volby jsou systémově podávané kortikoidy v dávce 1–2mg/kg i. v. či i. m. podle závažnosti [32]. Pokud je léčba zahájena pozdě, mohou průjmy přetrvávat i řadu týdnů. Při neúčinnosti kortikoidů je indikováno podání infliximabu v dávce 5mg/kg á 2 týdny. Dalším NÚ je hepatotoxicita pozorovaná u 3–9 % nemocných. Probíhá většinou asymptomaticky a projevuje se elevací transamináz a bilirubinu, pouze vzácně jsou uváděny bolesti břicha. Je proto nezbytné při léčbě ipilimumabem pravidelně monitorovat jaterní testy. Základní léčbou je opět systémové podávání kortikoidů. U 3–6 % nemocných jsou popisovány autoimunitně vyvolané endokrinopatie typu hypopituitarismu, hypofyzitidy nebo thyreoiditidy. Projevují se většinou nespecifickými symptomy, jako je bolest hlavy, únava, teploty, nauzea, hypotenze, arytmie nebo výpadky zorného pole. Podle laboratorních vyšetření hladiny hormonů TSH, fT3, fT4, ACTH, kortizolu, testosteronu a prolaktinu je možné stanovit typ postižení. Odpovídající substituční hormonální léčba většinou stačí k potlačení NÚ. Endokrinopatie jsou často ireverzibilní a vyžadují trvalou substituci, nebývají ale důvodem ukončení aplikace ipilimumabu. Základem úspěšnosti léčby všech NÚ je její včasné zahájení a dodržování doporučených dávek kortikoidů i délky jejich podávání [19]. Důležitým faktem je, že aplikace kortikosteroidů neovlivňuje nepříznivě účinnost ipilimumabu.
Ipilimumab zahájil novou éru v léčbě metastazujícího melanomu. Jako první lék v historii dokázal prodloužit celkové přežívání těchto nemocných. Jeho nevýhodou je nízké procento léčebných odpovědí s maximem 30–35 % a neznalost prediktivních faktorů. Výhodou je naopak délka trvání léčebných odpovědí včetně dlouhodobé stabilizace onemocnění bez následné progrese. Stabilizace onemocnění je významnou reakcí na léčbu ipilimumabem, protože bývá provázena prodloužením OS stejně jako při dosažení částečné nebo kompletní odpovědi.
Druhým lékem, který prokázal schopnost prodloužit celkové přežívání nemocných s metastazujícím melanomem, je vemurafenib – inhibitor mutace BRAF.
BRAF je serin/treonin proteinová kináza, která ovlivňuje MAPK signální dráhu. Je již dlouho známo, že aktivace této dráhy se podílí na zvýšené proliferaci a invazi melanomu i na rezistenci nádorových buněk k apoptóze. BRAF mutace je prokazována přibližně u 50 % kožních melanomů, z čehož se až v 90 % jedná o V 600E mutaci, dalšími ale významně méně častými jsou mutace V 600K a V600R. BRAF mutace je nejčastěji prokazována u melanomů vznikajících na neosvětlené kůži, a naopak velmi vzácně je popisována u slizničních, akrálních nebo očních melanomů. BRAF mutace se zvýšením aktivace MAPK signální dráhy podílí na progresi melanomu, ale přesný mechanismus a vliv této mutace na rozvoj nádoru zatím znám není [18]. Dosud též nebyl popsán zásadní rozdíl v průběhu onemocnění mezi melanomy s pozitivní a negativní BRAF mutací, nelze ani jednoznačně říci, že přítomnost mutace zhoršuje prognózu melanomu.
BRAF mutace je považována za jednu z hlavních řídicích onkogenních mutací u melanomu [11]. První pokusy o její inhibici neselektivními BRAF inhibitory, jako je např. sorafenib, ale neprokázaly dostatečnou účinnost. Teprve zavedení selektivních BRAF V600E inhibitorů znamenalo významný předěl v cílené léčbě metastazujícícho melanomu.
Vemurafenib představuje první lék, který inhibicí vysoce specifického molekulárního cíle dokázal blokovat nádorový růst a již ve studiích fáze I a II u metastazujícího melanomu dosahoval více než 50 % léčebných odpovědí. Na základě těchto studií byla též určena maximální tolerovaná dávka vemurafenibu na 960 mg 2krát denně per os (p. o). Následovala registrační studie fáze III ( BRIM 3), do které byli zařazení dosud neléčení pacienti s neresekovatelným melanomem stadia III nebo IV, s pozitivní BRAF mutací. Stratifikováni byli podle stadia, ECOG stavu, hodnoty LD a zeměpisné oblasti. V průběhu 12 měsíců od ledna do prosince 2010 bylo zařazeno 675 nemocných, kteří byli randomizováni 1 : 1 na vemurafenib či DTIC. Vemurafenib byl podáván dávce 960 mg 2krát denně p. o., DTIC v dávce 1000 mg/m2 i. v. á 3 týdny [14].
Již po prvních měsících léčby byl patrný významný rozdíl v mediánu OS mezi nemocnými léčenými vemurafenibem a DTIC ve prospěch vemurafenibu, což ukazovalo na časný nástup léčebného účinku. Při léčbě DTIC docházelo k progresi v prvních 2 měsících zhruba u 60 % nemocných, zatímco při léčbě vemurafenibem to bylo pouze u 10 % pacientů. Při hodnocení výsledků BRIM 3 studie za 12 měsíců od zahájení léčby snížil vemurafenib riziko úmrtí ve srovnání s DTIC o 63 % a dosáhl přežití 6 měsíců u 84 % pacientů, což je o 20 % více než při léčbě DTIC. Medián PFS (progression free survival) byl při tomto hodnocení 1,6 měsíců u DTIC a 5,3 měsíců u vemurafenibu. Hodnocení léčebných odpovědí bylo prováděno podle RECIST 1.1 kritérií. Kompletní remise (CR) nebyly příliš časté, pouze 0,9%, ale částečné remise (PR) dosáhly 47,5 % proti pouhým 5 % v rameni s DTIC. Rozdíl byl natolik veliký, že bylo schváleno převedení nemocných léčených DTIC na léčbu vemurafenbem [14]. FDA schválila vemurafenib pro léčbu pacientů s metastazujícím melanomem s pozitivní BRAF mutací v srpnu 2011 a v únoru 2012 i EMA.
V červnu 2012 byla na ASCO (American Society of Clinical Oncology) přednesena aktualizovaná data BRIM 3 studie [Chapman, Abstrakt 8502], s mediánem sledování pacientů 10,5 u vemurafenibu a 8,4 měsíců u DTIC. Výsledky nadále potvrzují účinnost vemurafenibu a vysokou četnost léčebných odpovědí (tab. 13).
Tab. 13. Aktualizované výsledky BRiM 3 studie s vemurafenibem, asCo 2012 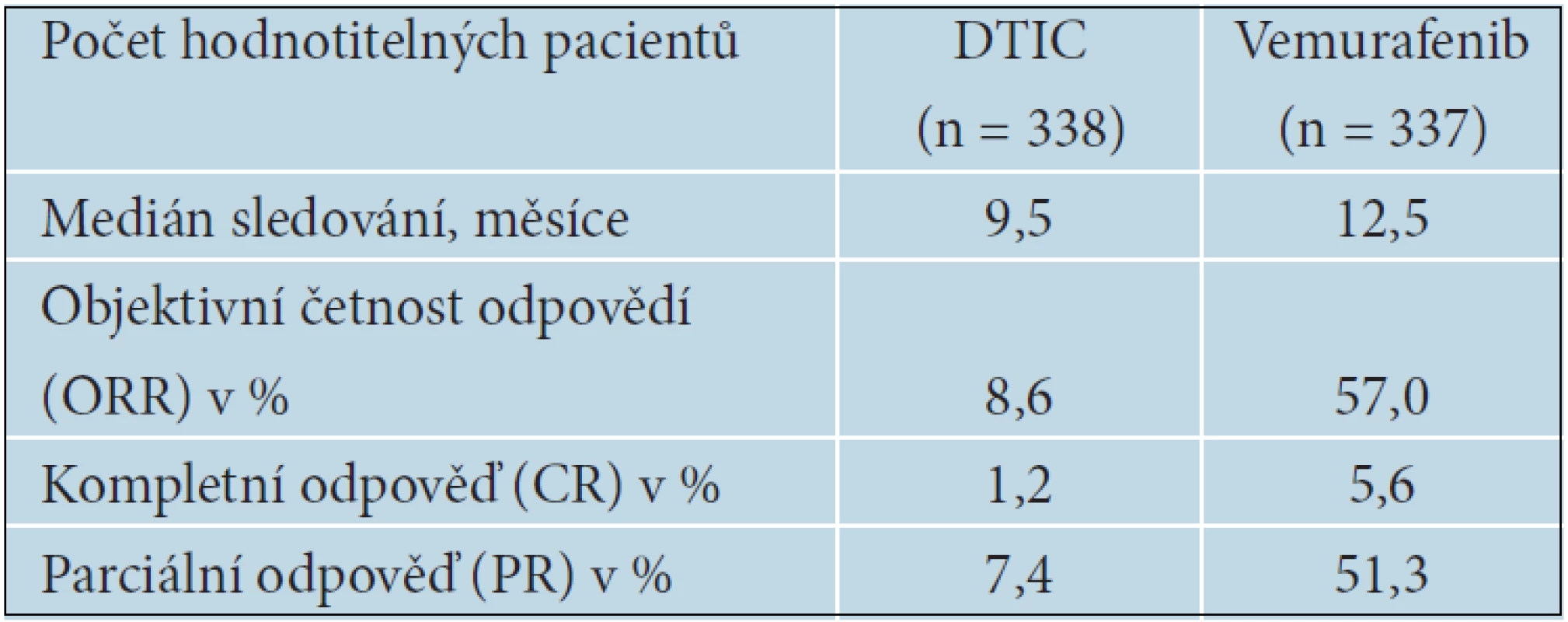
Terapeutický účinek vemurafenibu se projevuje velmi brzy po zahájení léčby, již v prvních měsících, a to i u pacientů s velmi pokročilým onemocněním. Někteří nemocní uvádějí dramatické zmenšování metastáz i zlepšení celkového stavu již v prvních dnech léčby. Nebyla prokázána významná závislost odpovědi na typu orgánových metastáz nebo na hodnotě LD (laktát dehydrogenáza). Nevýhodou vemurafenibu je časová omezenost účinnosti léčby. Rezistence k léčbě se objevuje ve vysokém procentu případů v odstupu 7–12 měsíců od zahájení aplikace vemurafenibu a projevuje se často i velmi rychlou progresí onemocnění. Mechanismy vzniku rezistence nejsou jednoznačně vysvětleny, jedním z důvodů může být reaktivace MAPK signální dráhy, byly popsány i nově vzniklé NRAS a MEK mutace [7].
Nežádoucí účinky jsou hodnoceny převážně jako mírného stupně 1 nebo 2 a pouze vzácně 3 až 4. Přesto bylo nutné v rámci BRIM 3 studie redukovat dávku nebo přerušit léčbu u 38 % nemocných. V tabulce 14 jsou uvedeny nejčastější nežádoucí účinky léčby vemurafenibem. Bolesti kloubů mají většinou přechodný charakter, zřídka vyžadují léčbu. Typickým nežádoucím účinkem jsou kožní exantémy, které se projevují zhrubělou, přesušenou kůží s výraznou folikulární hyperkeratózou. Výrazná fotosenzitivita, vznikající i po krátkodobém oslunění, se objevuje až u 30 % pacientů. Nezbytností je používání vysokých ochranných faktorů na všechny nechráněné kožní partie. Důležitá je i ochrana očí tmavými brýlemi. Prořídnutí a zhoršená kvalita kštice může mít někdy pouze přechodný charakter, v některých případech je dokonce popisován následný růst kudrnatých vlasů. Při léčbě vemurafenibem je popisován vznik spinocelulárních karcinomů (SCC), keratoakantomů a různých verukóznch kožních výrůstků u 10 až 20 % nemocných. Spinaliomy jsou převážně dobře diferencované, s nízkým metastatickým potenciálem a sklonem ke spontánním regresím. Jsou dobře léčitelné chirurgickou excizí, ale i kryalizací nebo fotodynamickou terapií. Patogeneze není zatím jednoznačně vysvětlena, jednou z možností je, že vemurafenib vyvolává paradoxně aktivaci MAPK signální dráhy u buněk s divokým nemutovaným typem BRAF. Vznik spinocelulárních karcinomů není důvodem k přerušení léčby. Gastrointestinální toxicitu v podobě nauzey nebo průjmů je možné řešit symptomatickou léčbou. Nově se objevují zprávy o možném častějším vzniku duplicitních melanomů u nemocných léčených BRAF inhibitory. Dabrafenib další selektivní BRAF V 600E inhibitor má podobnou léčebnou účinnost jako vemurafenib, ale zčásti odlišnou toxicitu. Méně často je pozorován vznik spinocelulárních karcinomů a menší je i fototoxicita, naopak výrazně častěji se objevují teploty dosahující někdy i 40 °C.
Tab. 14. Nejčastější nežádoucí účinky léčby vemurafenibem 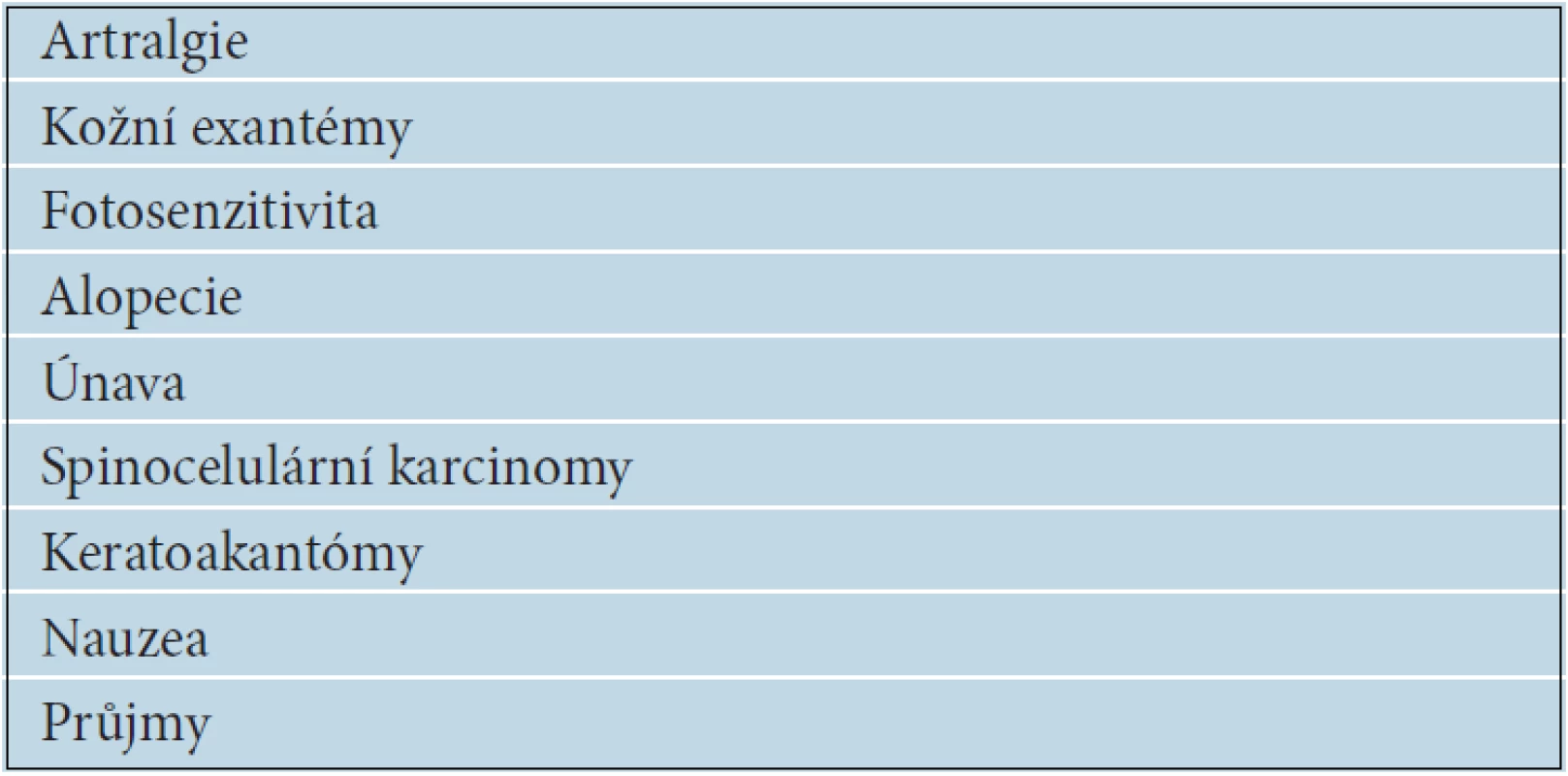
Mezi inhibitory MAPK signální dráhy patří také MEK inhibitory – trametinib a selumetinib. Jejich použití v monoterapii nevykazuje zatím tak vysokou léčebnou účinnost, jakou pozorujeme u vemurafenibu nebo dabrafenibu, ale při jejich použití v kombinované léčbě je patrná potenciace účinku BRAF inhibitorů a oddálení vzniku rezistence. Toxicita MEK inhibitorů je také odlišná, kožní exantémy mají spíše akneiformní charakter a při léčbě MEK inhibitory není popisován vznik spinocelulárních karcinomů. Zajímavé je také pozorování, že toxicita kombinované léčby BRAF a MEK inhibitory je nižší než toxicita monoterapie [6].
V současné době dochází k velkému rozvoji léčebných postupů v oblasti imunoterapie i cílené léčby metastazujícího melanomu. Probíhají nové klinické studie s kombinovanou léčbou BRAF a MEK inhibitory nebo studie s podáváním ipilimumabu a vemurafenibu.
POOPERAČNÍ SLEDOVÁNÍ
Cílem sledování nemocných po operaci melanomu je včasná detekce recidivy nádoru a včasné odhalení dalších kožních nádorů včetně duplicitního melanomu. V současné době však neexistují jednotná mezinárodní doporučení pro sledování a vyšetřování těchto pacientů. Někteří lékaři provádějí zbytečně časté kontroly s nadužíváním radiologických vyšetření, jako je CT nebo PET/CT, jiní naopak zpochybňují význam sledování nemocných po operaci melanomu vůbec [29]. Retrospektivní hodnocení četnosti záchytu recidiv při klinických kontrolách ukazuje, že i při pravidelném sledování nemocných je okolo 70 % recidiv poznáno samotným pacientem a pouze necelých 30 % je prokázáno v ordinaci lékaře. Také přibližně polovina duplicitních melanomů je diagnostikována nemocnými nebo jejich rodinnými příslušníky [8]. Vzhledem k těmto pozorováním se objevují i práce, které uvádějí, že někteří nemocní jsou zváni na kontroly významně častěji, než je nutné [33]. Vyšetřovací postupy se liší podle zvyklostí jednotlivých zemí, jednotlivých center i podle možností daných zdravotním pojištěním. S celosvětově stoupající incidencí melanomu totiž roste významně i počet nemocných vyžadujících dispenzarizaci. Proběhla řada převážně retrospektivních studií hledajících optimální frekvenci kontrol nemocných, celkovou dobu jejich sledování, odbornost lékaře, který by měl sledování provádět, optimální typ i četnost vyšetřovacích metod.
Určujícími faktory pro volbu intervalů a typu vyšetřovacích metod u bezpříznakových nemocných po operaci melanomu jsou základní klinické a histopatologické prognostické charakteristiky nádoru. Umožňují přesný staging onemocnění se stanovením míry rizika další progrese melanomu. Znalost těchto indikačních kritérií může zabránit jak nedostatečnému, tak i zbytečně častému a zatěžujícímu vyšetřování nemocných [10, 13].
V současné době je 60–70 % melanomů diagnostikovaných ve stadiu melanoma in situ nebo IA, tedy ve fázi onemocnění, kdy riziko metastazování je tak nízké, že jakékoliv vyšetřování nemocného s cílem odhalit metastázy znamená zbytečnou zátěž jak pro nemocného, tak pro zdravotnické zařízení a zdravotní pojišťovny. Zejména se to týká podskupiny nemocných s melanoma in situ nebo s nádory tloušťky 0,1–0,5 mm. U těchto pacientů je hlavním smyslem sledování odhalení případných duplicitních melanomů, a tak stačí klinické kontroly s vyšetřením celého kožního povrchu a poučení nemocného o nutnosti samovyšetřování.
V případech pokročilých melanomů jsou hlavními ukazateli rizika další progrese vlastnosti primárního nádoru, z nichž jsou za nejvýznamnější považovány: tloušťka nádoru, přítomnost ulcerace, vysoký počet mitóz a dále stav sentinelových uzlin. Základní orientace tak umožňuje zařazení nemocného do odpovídajícího AJCC stadia onemocnění.
Pro určení intervalů kontrol a typu vyšetřovacích metod je velmi důležitá znalost typické dynamiky metastazování melanomu a nejčastějších míst primárních recidiv. Přibližně 50 % metastáz vzniká v prvních 3–5 letech po operaci, 20–35 % se objevuje za 5 a více let a 2–5 % za 10–15 let. Popisovány jsou i metastázy za 25–30 let. Z toho vyplývá, že intenzita sledování by měla být největší do 3.–5. roku po operaci a vzhledem k možnosti velmi pozdních metastáz také celoživotní [27]. Některá pracoviště hodnotí i psychologický dopad pravidelného sledování na nemocné a doporučují intervaly kontrol přizpůsobit jejich potřebám, protože časté kontroly mohou zvyšovat obavy z onemocnění.
Vyšetřovací metody by měly být vybírány tak, aby jednoduše, spolehlivě a co nejdříve odkryly případné metastázy. Nejčastěji metastazuje melanom primárně do regionálních lymfatických uzlin a do kůže a podkoží formou satelitních a intranzitních metastáz. Orgánové metastázy se objevují primárně, zejména v plicích a játrech, dále v CNS a ve všech ostatních orgánech. Nejčastější lokalizace metastáz melanomu jsou uvedeny v tabulce 15. Mezi rutinní vyšetření u pacientů s pokročilým melanomem patří kromě klinického vyšetření také sonografie regionálních lymfatických uzlin. U melanomů stadia III s vysokým rizikem orgánového metastazování je možné provádět rentgen nebo CT plic, sonografické nebo CT vyšetření břišní dutiny, CT nebo MR CNS nebo celotělové PET/CT vyšetření. Neexistují statisticky podložená doporučení jednotlivých typů vyšetření, ani jejich frekvence. V řadě zemí se dokonce vyšetření indikují pouze v případě vzniku konkrétních potíží [38].
Tab. 15. Nejčastější lokalizace metastáz melanomu 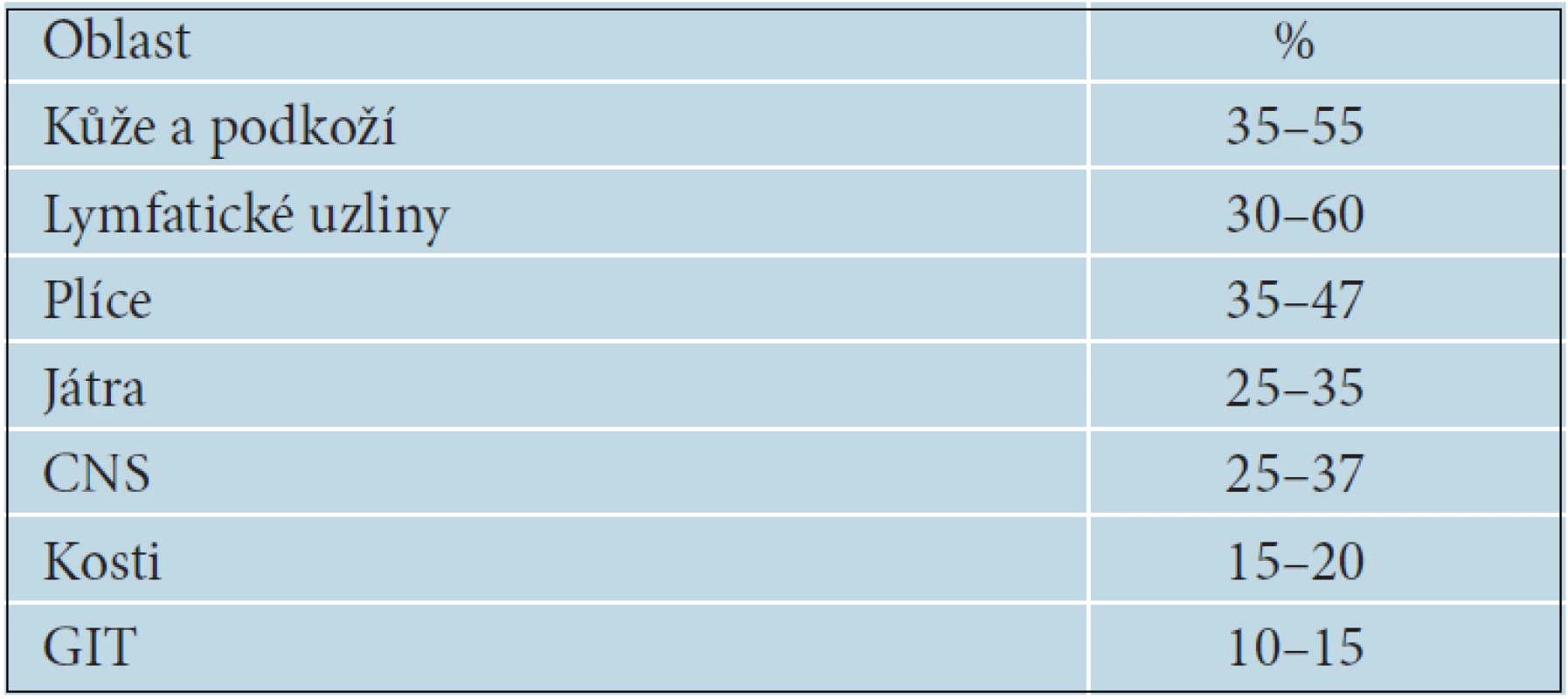
Neexistují ani jednotná doporučení kdo, který lékař, má nemocné po operaci melanomu dispenzarizovat. V některých zemích jsou pacienti po operaci melanomu sledováni v dermatologických ordinacích, v jiných se soustředí kontroly do ambulancí chirurgů nebo plastických chirurgů, v dalších na onkologická oddělení nebo do specializovaných melanomových center [9]. Stoupající počet nemocných, zejména s počínajícími a nerizikovými melanomy, způsobuje obtíže s centralizací péče. Vzhledem k tomu, že až u 8 % nemocných se objevují duplicitní melanomy, je pro možnost včasné diagnózy vhodné sledování u dermatologů. Pacienty s pokročilými melanomy s vysokým rizikem metastazování je vhodnější sledovat ve specializovaných onkologických nebo dermatoonkologických centrech.
V současné době neexistuje konsenzus v doporučovaných intervalech sledování a volbě vyšetřovacích metod. Po zhodnocení mnoha publikací a řady mezinárodních doporučení včetně ESMO (European Society for Medical Oncology) doporučení z roku 2010 lze říci, že četnost kontrol je závislá na pokročilosti primárního nádoru a zvyšuje se se stoupajícím stadiem onemocnění. Melanomy stadia I s minimálním rizikem metastazování mohou být již od operace sledovány maximálně 1–2krát ročně. U melanomů II. stadia jsou doporučovány převážně 6měsíční intervaly po dobu prvních 2–3 let po operaci a teprve od melanomů s pozitivními uzlinami, tedy s nádory stadia III jsou intervaly kontrol zejména v prvních 2 letech po operaci významně častější, 1krát za 3–4 měsíce a do 5 let á 6 měsíců. U všech stadií onemocnění se většinou od 6. roku po operaci prodlužují kontroly na roční intervaly. Přehled nejčastěji doporučovaných sledovacích schémat je uveden v tabulce 16. Z vyšetřovacích metod je za nejpřínosnější považováno sonografické vyšetření regionálních lymfatických uzlin a CT nebo celotělové PET/CT vyšetření. Tato vyšetření umožňují časný záchyt případných metastáz, i když zatím nebylo prokázáno, že by jejich časné odhalení mělo vliv na celkové přežívání nemocných [4]. Typ a četnost těchto vyšetření by opět měla být závislá na míře rizika progrese. U melanomů stadia I–II se většinou doporučuje provádět pouze rentgen plic 1krát ročně a další vyšetření pouze podle případné klinické symptomatologie naznačující možnost recidivy onemocnění. U melanomu stadia III, tedy u nádorů s uzlinovým postižením se převážně provádějí sonografické, CT nebo PET/CT vyšetření 1krát za 6–12 měsíců, v závislosti na spolupráci pacienta i možnostech zdravotního systému. Neexistují rutině doporučovaná laboratorní vyšetření. Ojedinělé práce naznačují význam stanovení hladiny S 100 proteinu v séru a hodnoty laktát dehydrogenázy (LD) v této fázi onemocnění, ale běžně prováděná vyšetření krevního obrazu, jaterních testů a dalších biochemických parametrů nebývají přínosem pro odhalení případné progrese melanomu [3].
Tab. 16. Nejčastěji navrhované intervaly sledování v závislosti na aJCC klasifikaci melanomu 
Základní doporučovaná vyšetření pro pooperační sledování jsou uvedena v tabulce 17. Vzhledem k trvale stoupajícímu počtu nemocných s melanomem a zvyšujícímu se zastoupení pacientů s počínajícími prognosticky příznivými nádory dochází k nezanedbatelnému nárůstu nákladů na zdravotní péči o tyto nemocné. Je proto nezbytné vždy zvažovat výtěžnost plánovaných vyšetření i četnost klinických kontrol. Doporučovaná schémata platí pro asymptomatické a neléčené pacienty. V případech adjuvantní léčby je nutné se řídit individuální reakcí nemocných na podávanou léčbu a v případě jakékoliv symptomatologie je nezbytné vyloučit progresi melanomu odpovídajícími vyšetřeními.
Tab. 17. Doporučované typy vyšetření v závislosti na aJCC klasifikaci melanomu a riziku progrese onemocnění 
ZÁVĚR
Ještě donedávna omezené možnosti léčby metastazujícího melanomu byly v posledních letech rozšířeny o nové postupy v imunoterapii a cílené léčbě. Poprvé v historii se podařilo prodloužit celkové přežívání nemocných. Lepší pochopení biologie melanomu a nádorové imunologie umožnilo zavedení nových léčebných postupů, které s sebou ale současně přinášejí řadu ještě nezodpovězených otázek. Mezi hlavní postupy jistě patří hledání prediktivních faktorů účinnosti imunoterapie, možnosti oddálení vzniku rezistence k BRAF inhibitorům nebo nalezení optimálních kombinací různých typů léčby včetně jejich časové posloupnosti.
Do redakce došlo dne 12. 9. 2012.
Kontaktní adresa:
MUDr. Ivana Krajsová, MBA
Dermatovenerologická klinika 1. LF UK a VFN
U Nemocnice 2
128 08 Praha 2
e-mail: ivana.krajsova@vfn.cz
Zdroje
1. ASCIERTO, P. A., GRIMALDI, A. M., CURIT, B., FLAHERTY, K. et al. Future perspectives in melanoma research. Meeting report from the Melanoma research: a bridge from Naples to the World. Napoli, December 5th–6th 2011. J. Translational. Medicine, 2012, May, 10, doi:10.1186/1479-5876-10-83
2. BOLAND, G. M., GERSHENWALD, J. E. Sentinel lymph node biopsy in melanoma. Cancer J., 2012, 18, 2, p. 185–191.
3. BICHAKJIAN, C. K., HALPERN, A. C., JOHNSON, M. T., HOOT, F. A., GRICHNIK, J. M. et al. Guidelines of care for the management of primary cutaneous melanoma. J. Am. Acad. Dermatol., 2011, 65, p. 1032–1047.
4. DUMMER, R., HAUSCHILD, A., GUGGENHEIM, M., JOST, L., PENTHEROUDAKIS, G. Melanoma: ESMO clinical recommendations for diagnosis, treatment and follow-up. Ann. Oncol., 2010, Suppl 5, 21, p. 194–197.
5. EGGERMONT, A. M. M., TESTORI, A., MAIO, M., ROBERT, C. Anti-CTLA-4 antibody. Adjuvant therapy in melanoma. Semin. Oncol., 2010, 37, 5, p. 455–459.
6. FLAHERTY, T. K., ROBERT, C., HERSEY, P. et al. Improved survival with MEK inhibition of BRAF mutated melanoma. N. Engl. J. Med., 2012, Jun, p. 1–8.
7. FLAHERTY, T. K., SOSMAN, A. J., ATKINS, M. B. New options and new questions: How to select and sequence therapies for patients with metastatic melanoma. Am. Soc. Clin. Oncol., 2012, 1092-9118/10/1-10, p. 524–530.
8. FRANCKEN, A. B., ACCORTT, N. A., SHAW, A. M., COMAN, M. H., WIENER, M. et al. Follow-up schedules after treatment for malignant melanoma. Br. J. Surg., 2008, Nov, 95, 11, p. 1401–1407.
9. FRANCKEN, A. B., SHAW, H. M., SOONG, S. J., THOMPSON, J. F. Detection of first relapse in cutaneous melanoma patients: implication for the formulation of evidence-based follow-up guidelines. Ann. Surg. Oncol., 2007, Jun, 14, 6, p. 1924–1933.
10. FORSCHNER, A., EIGENTLER, T. K., PFLUGPFELDER, A., GARBE, C. et al. Melanoma staging: facts and controversies. Clin. Dermatol., 2010, May-Jun, 28, 3, p. 275–280.
11. HENEBERG, P. Pokroky v klinické léčbě zhoubného melanomu:inhibice kinázy BRAF. Klinická onkologie, 2011, 24, 4, s. 256 až 264.
12. HODI, F. S., O’DAY, S. J., MCDERMOTT, D. F. et al. Improved survival with ipilimumab in patients with metastatic melanoma. N. Engl. J. Med., 2010, 363, p. 711–723.
13. HOLTERHUES, C., VAN DE POLL-FRANSE, L.V., DEVRIES, E., NEUMNN, H. A., NISTEN, T. E. Melanoma patients receive more follow-up care than current guideline recommendations: a study of 546 paitens from general Dutch population. J. Uer. Acad. Dermaol. Venereol., 2011, Oct 31, doi:10.1111/j.1468-3088.
14. CHAPMAN, P. B., HASCHILD, A., ROBERT, C. et al. Improved survival with vemurafenib in melanoma with BRAF V 600E mutation. N. Engl. J. Med., 2011, 364, p. 2507–2516.
15. KANZLER, M. H., MRAZ-GERNHARD, S. Primary cutaneous melanoma and its precursor lesions: Diagnostic and therapeutic overview. J. Am. Acad. Dermatol., 2001, 45, p. 260–276.
16. KRAJSOVÁ, I., VYZULA, R., LAKOMÝ, R., KUBALA, E., ŠTASTNÝ, M., MELICHAR, B. Imunoterapie přináší nové typy klinické odpovědi: ipilimumab u pacientů s metastatickým melanomem. Farmakoterapie, 2012, 8, 2, s. 133–252.
17. KUNISHIGE, J. H., BRODLAND, D. G., ZITELLI, J. A. Surgical margins for melanoma in situ. J. Am. Acad. Dermatol., March 2012, 66, 3, p. 438–444.
18. LEE, B., MUKHI, N., LIU, D. Current managemnt and novel agents for malignant melanoma. J. Hem. Oncol., 2012, 5, 3, p. 1–7.
19. LEMECH, C. H., ARKENAU, H. T. Novel treatments for metastatic cutaneous melanoma and the management of emergent toxicities. Clin. Med. Insights. Oncol., 2012, 6, p. 53–66.
20. McMASTERS, K. M., WONG, S. L., EDWARDS, M. J. et al. Frequency of nonsentinel pmph node metastasis in melanoma. Ann. Surg. Oncol., 2002, 9, 2, p. 137–141.
21. MEYERS, M. O., YEH, J. J., FRANK, J., LONG, P., DEAL, A. M., OLLILA, D. W. Method of detecion of initial recurrence of stage II/III cutaneous melanoma: analysis of the utility of follow - -up staging. Ann. Surg. Oncol., 2009, Apr, 16, 4, p. 941–947.
22. MOCELLIN, S., PASQUALI, S., ROSSIN, C., NITTIN, D. Interferon alfa adjuvant therapy in patients with high-risk melanoma: A systematic review and meta-analysis. J. Natl. Cancer Inst., 2010, 102, p. 493–501.
23. MORTON, D. L., THOMPSON, J. F., COCHRAN, A. J. et al. Sentinel node biopsy or nodal observation in melanoma. N. Engl. J. Med., 2006, 355, 13, p. 1307–1317.
24. OKUYAMA, S., GONZALES, R., LEWIS, D. K. Pegylated interferon alfa-2b as adjuvant treatment of stage III malignant melanoma: an evidence based review. Core Evidence, 2010, 5, p. 39–48.
25. PATEL, S. P., WOODMAN, S. E. Profile of ipilimumab and its role in the treatment of metastatic melanoma. Drug Des. Devel. Ther., 2011, 5, p. 489–495.
26. PHAN, G. Q., MESSINA, J. L., SONDAK, V. K., ZAGER, S. J. Sentinel lymph node biopsy for melanoma: indications and rationale. Cancer Control, 2009, 16, 3, p. 234–239.
27. POO-HWU, W. J., ARIYAN, S., LAMB, L., PAPAC, R., ZELTERMAN, D., HU, G. L., BROWN, J., FISCHER, D., BOLOGNIA, J., BUZAID, A. C. Follow-up recommendations for patients with American Joint Committee on Cancer Stages I-III malignant melanoma. Cancer, 1999, 86, 11, p. 2252–2258.
28. ROBERT, C., THOMAS, L., BONDARENKO, I. et al. Ipilimumab plus Dacarbazin for previously untreated metastatic melanoma. N. Engl. J. Med., 2011, 364, p. 2517–2526.
29. ROMANO, E., SCORDO, M., DUSZA, S. W., COIT, D. G., CHAPMAN, P. B. Site and timing of first relaps in stage III melanoma patients: implication for follow-up guidelines. J. Clin. Oncol., 2010, Jun 20, 28, 18, p. 3042–3047.
30. SCHEIER, B., AMARIA, R., LEWIS, K., GONZALES, R. Novel therapies in melanoma. Immunotherapy, 2011, 3, 12, p. 1461–1469.
31. SIEGEL, R., NAIHADHM, D., JERNAL, H. Cancer statistics 2012, CA Cancer J. Clin., 2012, 62, p. 10–29.
32. THOMPSON, J. A., HAMID, O. ET AL. Ipilimumab in tretament-naive and previously treated patientts with metastatic melanoma: retrospective analysis of efficacy and safety data from a phase II trial. J. Immunother., 2012, 35, 1, p. 73–77.
33. TURNER, M., BELL, J. L. K., MORTON, L. R., THOMPSON, J. F. et al. Optimizing the frequency of follow-up visits in patients treated for localised primary cutanous melanoma. J. Clin. Oncol., 2011, Vol. 29, 35, p. 4641–4646.
34. VAN AKKOOI, A. C., SPATZ, A., EGGERMONT, A. M., MIHM, M., COOK, M. G. Expert opinion in melanoma: the sentinel node; EORTC Melanoma Group recommendations on practical methodology of the measurement of the microanatomic location of metastases and metastatic tumour burden. Eur. J. Cancer, 2009, 45, 16, p. 2736–2742.
35. VAN DER PLOEG, A. P., VAN AKKOOI, A. C., SCHMITZ, P. I., KOLJENOVIC, S., VERHOEF, C., EGGERMONT, A. M. EORTC Melanoma Group sentinel node protocol identifies high rate of submicrometastases according to Rotterdam Criteria. Eur. J. Cancer, 2010, 46, 13, p. 2414–2421.
36. VAN der PLOEG, A. P., VAN AKKOOI, A. C., RUTKOWSKI, P., NOWECKI, Z. I., MICHEJ, W., MITRA, A., NEWTON-BISHOP, J. A., COOK, M., VAN DER PLOEG, I. M., NIEWEG, O. E., VAN DEN HOUT, M. F., VAN LEEUWEN, P. A., VOIT, C. A., CATALDO, F., TESTORI, A., ROBERT, C., HOEKSTRA, H. J., VERHOEF, C., SPATZ, A., EGGERMONT, A. M. Prognosis in patients with sentinel node-positive melanoma is accurately defined by the combined Rotterdam tumor load and Dewar topography criteria. J. Clin. Oncol., 2011, 29, 16, p. 2206–2214.
37. WOLCHOK, J. D., HOOS, A., O’DAY, S. et al. Guidelines for the evaluation of imine therapy aktivity in solid tumors: Immune-related response kriteria. Clin. Cancer Res., 2009, 15, p. 7412–7420.
38. XING, Y., CROMWELL, K. D., CORMIER, J. N. Review of diagnostic imaging modalities for the surveillance of melanoma patients. Dermatol. Res. Pract., 2012, doi:10.1155/2012/941921.
Štítky
Dermatológia Detská dermatológia
Článek Růžová makulopapula na hrudiČlánek Blahopřání doc. NožičkovéČlánek Odborné akce v roce 2012
Článok vyšiel v časopiseČesko-slovenská dermatologie
Najčítanejšie tento týždeň
2012 Číslo 5- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
- První a jediná schválená imunoterapie vzácného agresivního karcinomu kůže
-
Všetky články tohto čísla
- Kožní melanom: diagnostika, léčba a pooperační sledování
- Doškolování lékařů – kontrolní test
- Fotodynamický antiseptický efekt fotoaktivních nanovláken při léčbě bércových vředů
- Sarkoidóza – případ s málo obvyklými klinickými projevy
- Úspěšná léčba pacientky s metastazujícím melanomem ipilimumabem
- Klinický případ: Bolestivá papula na uchu
-
Prim. MUDr. Josef Kastl –
zemřel - Růžová makulopapula na hrudi
-
Zápis ze schůze výboru ČDS
konané dne 14. června 2012 v Bratislavě -
21. kongres Evropské akademie dermatologie (EADV)
Praha, 26.–30. 9. 2012 - Blahopřání doc. Nožičkové
- Odborné akce v roce 2012
- Česko-slovenská dermatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Klinický případ: Bolestivá papula na uchu
- Kožní melanom: diagnostika, léčba a pooperační sledování
- Úspěšná léčba pacientky s metastazujícím melanomem ipilimumabem
- Sarkoidóza – případ s málo obvyklými klinickými projevy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



