-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Fytofotodermatitidy
Phytophotodermatitis
The authors present the current knowledge of the pathogenesis of phytophotodermatitis and list of plants causing this reaction. Phytophotodermatitis is an acute inflammatory skin disease resulting from a contact with plants and UV light exposure. It can be caused by a large amounts of plants and plant products. It usually has a bizarre and divergent clinical picture. In most cases it is a non-immunologic toxic reaction with a typically long lasting deep pigmentation.
Key words:
phytophotodermatitis – furocoumarins – plant extracts – UVA radiation
Autoři: I. Strouhalová 1,2; L. Drlík 2
Působiště autorů: Dermatovenerologická ambulance Zábřeh na Moravě 1; Dermatovenerologické oddělení, Šumperská nemocnice přednosta prim. MUDr. Lubomír Drlík 2
Vyšlo v časopise: Čes-slov Derm, 89, 2014, No. 6, p. 225-262
Kategorie: Souborné referáty (doškolování lékařů)
Souhrn
Autoři předkládají současné poznatky o patogenezi fytofotodermatitid a uvádí přehled rostlin vyvolávajících tuto reakci. Fytofotodermatitidy jsou akutní zánětlivá kožní onemocnění vyvíjející se po kontaktu s rostlinami a expozici UV záření. Mohou být způsobeny řadou rostlin a rostlinných produktů, mívají bizarní a rozmanité klinické obrazy. Většinou se jedná o neimunologickou – toxickou – reakci s typickým dlouhodobým přetrváváním sytých pigmentací.
Klíčová slova:
fytofotodermatitis – furokumariny – rostlinné extrakty – UVA zářeníÚVOD
V průběhu staletí lidé využívali rostliny k obživě i k léčbě a zároveň objevovali jejich vlastnosti. Rostliny a jejich produkty mohou způsobovat patologické reakce kůže (fytodermatitidy) různými mechanismy se vznikem následujících klinických obrazů: iritační kontaktní dermatitidy (mechanický nebo chemický mechanismus), alergické kontaktní dermatitidy, alergické airborne kontaktní dermatitidy, kopřivky (vyvolané toxiny nebo zprostředkované imunologicky) a fytofotodermatitidy. Ty jsou v převážné většině případů toxické, v malém počtu alergické [29, 33, 35].
HISTORIE
Skutečnost, že kontakt s některými rostlinami následovaný ozářením sluncem vede k zánětlivým a pigmentačním změnám na kůži, je známa již od starověku [33, 35].
Dva tisíce let před naším letopočtem užívali Egypťané šťávu z Ammi majus a expozici sluncem pro terapii vitiliga. V Indii o 600 let později pro léčbu téže nemoci extrakty z Psoralea corylifolia. Od názvu této rostliny byl odvozen termín psoralen. Okoličnatými rostlinami indukovaná dermatitida byla popsána v roce 1897 (po pastináku a andělice), ale nebyla známa souvislost s UV radiací [29, 35]. První fototoxické reakce popsal Freund v roce 1916 pod názvem Berloque dermatitis. Termín fytofotodermatitida byl poprve použit v roce 1942 Klaberem a nahradil originální Oppenheimův název z roku 1926 – Ottakrining dermatitis a Dermatitis bullosa pratensis striata z roku 1932 [15, 23, 40]. Postupně byly odhalovány botanické, biochemické a biofyzikální aspekty reakcí, zejména významná byla izolace a charakterizace furokomarinů Kuskem v roce 1938 [22, 33]. V literatuře se setkáváme s množstvím dalších synonym – Berloque dermatitis – přívěsková dermatitis, meadow dermatitis, grass dermatitis, parsnip dermatitis, strimmer dermatitis a trimmer’s rash, weed-eater dermatitis [15, 29, 40, 52].
PATOGENEZE
Fytofotodermatitida vzniká dvojím mechanismem:
- Fototoxické reakce – ty zcela převažují, mají neimunologickou povahu a nevyžadují předchozí senzibilizaci. Kožní změny vyvolává kontakt s fototoxicky působící látkou z rostliny a současná nebo následná expozice UV záření. Největší citlivost na záření je za 30–120 minut po kontaktu s fotosenzibilizátory, především furokumariny. Fotoaktivní molekuly absorbují fotony, dostávají se na vyšší energetickou hladinu, vytvářejí vazby s DNA nebo fotoaditivní sloučeniny. Reakce mezi furokumariny a DNA jsou buď prvního typu, nezávislé na kyslíku, nebo druhého typu, spojené se vznikem singletového kyslíku. Výsledkem je poškození epidermálních, dermálních a endoteliálních buněk. Následná hyperpigmentace indukovaná psoraleny vzniká množstvím vzájemně souvisejících změn – je to zvýšení počtu melanocytárních mitóz, melanocytární hypertrofie, vzestup tyrosinázové aktivity a změny v počtu a distribuci melanozomů [29, 33, 35].
- Fotoalergické kontaktní reakce – jde o buněčně zprostředkované alergické reakce IV. typu na alergen aktivovaný nebo vznikající působením světla na konkrétní látku či metabolit. UV záření aktivuje látky na imunologicky aktivní komponenty (fotoalergeny), které indukují imunitní odpověd. Mají aferentní a eferentní fázi, postihují vnímavé jedince, nezávisí přímo na množství ani koncentraci alergenu a délce expozice. Akční spektrum spadá obvykle do pásma UVA [33, 35]. Tento typ reakce je velmi řídký. Byl prokázán u rostliny Parthenium hysterophorus (Asteraceae), která pochází z tropických oblastí Ameriky, ale vyskytuje se také v Austrálii, Indii a Africe jako invazivní rostlina napadající narušené půdy, pastviny a zemědělské půdy [3, 35]. Reakce tohoto typu byly ojediněle popsány a prokázány testováním i po furokumarinech [21, 31, 33].
FOTOTOXICKY PŮSOBÍCÍ LÁTKY
Mezi nejvýznamnější látky s výraznými fototoxickými účinky patří skupina furokumarinů (furanokumarinů), dále to jsou naftodianthrony, polyacetyleny a deriváty thiofenu, feoforbidy v řasách (chlorella) [1, 8, 35] – tabulka 1-2. Furanokumariny jsou toxické sekundární metabolity rostlin především čeledí Umbelliferae (syn. Apiaceae) – okoličnaté, Rutaceae – routovité, Moraceae – morušovníkovité, Fabaceae – bobovité, vzácněji jiných druhů (Asteraceae, Ranunkulaceae, Hypericaceae, Anacardiaceae, Convolvulaceae) [8, 35, 49]. Pro své biologické účinky se řadí mezi přírodní toxiny (fytoalexiny). Chemicky jsou to deriváty kumarinů a podle struktury se dělí na lineární (psoralenový typ) a angulární (angelicinový typ). Jejich fyziologickou funkcí v rostlinách je ochrana před plísňovými infekcemi. Jsou termostabilní a mimo fototoxického efektu byla u zvířat prokázána mutagenita a kancerogenita. Množství furokumarinů v rostlinách závisí na růstovém období, místu výskytu a roční době. Ke zvýšení jejich obsahu může docházet vlivem stresu – napadení mikroorganismy, hmyzem, mechanickým poškozením, nevhodným klimatem a skladováním za nízkých teplot [7, 35, 49]. Jejich akční spektrum se nachází v rozmezí od 290 do 407 nm, s maximem nad 320 nm. Fotoreaktivita látek se mění podle substituce vodíkových atomů na molekule jednotlivých sloučenin methylovými, methoxylovými, hydroxylovými nebo dalšími radikály. Výraznější fototoxický efekt mají lineární psoraleny oproti angulárním. Nejsilnější fototoxický účinek pak má 5-methoxypsoralen (5-MOP, bergapten) a 8-methoxypsoralen (8-MOP, xantotoxin) [29, 33, 35]. Polyacetyleny a deriváty thiofenu byly izolovány u čeledi Asteraceae (hvězdnicovité), ale fototoxické reakce nebyly publikačně zaznamenány, především asi proto, že tyto sloučeniny nebyly na kůži v dostatečně vysoké koncentraci či nepenetrovaly přes stratum corneum [8, 35]. Zástupci této čeledi jsou zejména zodpovědní za kontaktní alergické reakce prostřednictvím seskviterpenických laktonů [1, 33, 35].
Obr. 1. Polygonaceae (Fagopyrum esculentum) 
Obr. 2. Hypericeae (Hypericum perforatum) 
Naftodianthrony jsou zastoupeny v čeledi Hypericeae (třezalkovité) a Polygonaceae (rdesnovité) – obrázek 1. Nejznámější naftodiantron – hypericin – je obsažen v třezalce tečkované (Hypericum perforatum) – obrázek 2, a fagopyrin v různých druzích pohanky (Fagopyrum). Fototoxicita obou látek se uplatňuje kontaktem s kůží, ale i při systémovém požití, což je významné ve veterinárním lékařství – postižení dobytka hypericismem a fagopyrismem [1, 33]. Herba hyperici je užívaná jako fytofarmakum do čajových směsí a pro euforizující účinky do psychofarmak. Studie s UV zářením a perorálně podávanými extrakty neprokázaly při doporučeném dávkování komerčních preparátů fototoxicitu [4]. Nicméně u 48 % HIV pozitivních pacientů léčených systémově hypericinem byl popsán vývoj fotosenzitivity [35].
Tab. 1. Rizika pro vznik fytofotodermatitidy [8, 34] ![Rizika pro vznik fytofotodermatitidy [8, 34]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/eb553c9385e2f2d965e8d7e45cfb0b61.jpg)
ROSTLINY VÝZNAMNÉ PRO VZNIK FYTOFOTODERMATITID
Jde zejména o zástupce následujících čtyř čeledí – routovité, bobovité, morušovité a miříkovité (tab. 2).
Tab. 2. Přehled tricyklických furokumarinů a jejich přítomnost v některých rostlinách [21, 49] ![Přehled tricyklických furokumarinů a jejich přítomnost v některých rostlinách [21, 49]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/b706e15b7b358b73f84f81738e62ae1d.jpg)
1. Routovité (Rutaceae)
Stromy a keře, zřídka byliny, rostoucí v tropech a subtropech, produkují silice, flavonoidy, furokumariny, triterpenové hořčiny a alkaloidy (obr. 3). Čeleď má 6 podčeledí, z nichž nejvýznamnější jsou podčeledi Rutoideae a Citroideae. V České republice se vyskytují dva zástupci Rutoideae. Prvním je Routa vonná (Routa graveolens), bylina importovaná z jižní Evropy, dříve užívaná v lidovém léčitelství k léčbě bradavic a jako přírodní repelent. Obsahuje fototoxické substance – bergapten, xanthotoxin a angelicin. V Anglii jde o nejčastější rostlinu vyvolávající fototoxicitu [17, 25, 35].
Obr. 3. Rutaceae (zleva: Citrus sinensis, Dictamnus albus, Ruta graveolens) 
Druhým zástupcem je Třemdava bílá (Dictamus albus), rozšířená zejména v USA, Kanadě, ale i v Číně a v Evropě (u nás na jihu Moravy). Výrazné bílé a růžové květy a listy vylučují za teplých dnů aromatické citronovité silice vytvářející lehce vzplanuvší koronu, která je známa z Bible jako Mojžíšův keř (gas plant – Moses bush – burning bush). Třemdava bílá je jediným českým přirozeně se vyskytujícím zástupcem čeledi routovitých, nyní na seznamu ohrožených druhů. V zahradách se objevují také okrasné kultivary. Semena mají vysoký obsah 5-MOP a 8-MOP [14, 17, 35, 44, 48].
Podčeleď Citroideae jsou dřeviny obsahující v kůře, listech a oplodí schizolysigenní nádržky se silicemi, plodem je nepravá bobule, hesperidium. Obsahuje vysoké množství kyseliny citronové a askorbové, flavonoidy, silice a tetranotriterpeny. Nejznámnějšími představiteli jsou Citrus decumana – šedok, pomelo, Citrus nobilis – mandarinka, Citrus paradisi – grapefruit (ten mj. obsahuje množství aktivních látek interagujících s léčivy a složkami potravy) [36], Citrus aurantium – pomerančovník (varianty amara a bergamia jsou využívané ve farmaceutickém a kosmetickém průmyslu) [17]. Zejména limetky (plody stromu Citrus limetta) mají pověst silných fotosenzibilizátorů a reakce na ně získala vlastní označení – Lime disease (obr. 4). Obsahují různé množství furokumarinových látek v závislosti na místě pěstování a odrůdě. Perská (žlutá, arizonská) limetka obsahuje 6krát více 5-methoxypsoralenu než floridská (zelená). Konkrétní furokumariny byly zjišťovány chromatografickými metodami – jde o psoralen, xanthotoxin, bergapten, isopimpinelin a limettin. V kůře bývají 6–182krát koncentrovanější oproti dřeni, nejhojnější je bergapten, který odpovídá za většinu reakcí na kůži, které jsou popisovány v literatuře. Reakce po kontaktu citrusů odpovídají mechanismu manipulace s plody při přípravě nápojů – prsty rukou při vytlačování, stříkance po potřísnění, cheilitida při vysávání štávy z neloupaných plodů, a to nejen v letních měsících, ale i v zimě po občerstvení během lyžování [8, 11, 16, 24, 29, 35, 37, 39, 51]. Reakce nezávisí jen na konkrétním furokumarinu, jeho množství a expozici, ale i na vlhkosti kůže a zevní teplotě [5, 16, 39, 41, 51]. Do routovitých také patří Pelea anisata (mokihana) – byly popsány případy bulózních fytofotodermatitid na šíji po nošení slavnostních věnců na Havajských ostrovech, které obsahují tuto rostlinu [9].
Obr. 4. Účastnice kongresu AAD Miami (duben) – 72 hodin po kontaktu se šťávou z limetky 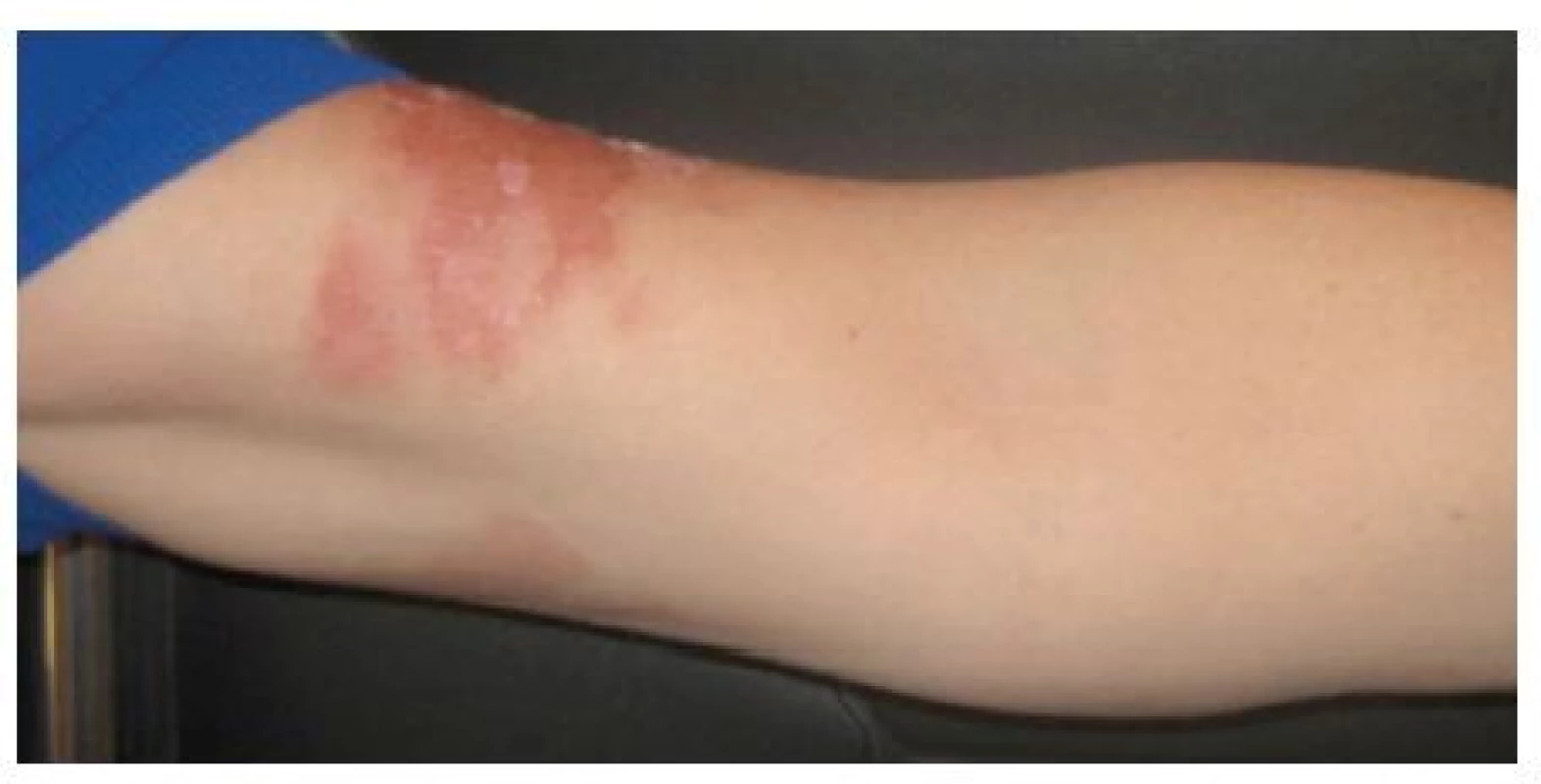
2. Miříkovité (Apiaceae)
Jde o divoce rostoucí i ušlechtilé byliny s typickým květenstvím – okolík (jednoduchý či složený) – obrázek 5. Obsahují významné množství furanokumarinů. Nejstarší využívaný zástupce pro fototoxické účinky je Morač větší, syn. Pakmín větší (Ammi majus, false Bishop’s weed). Roste v nilském údolí, Asii, Rusku a Americe; je využívaný k léčbě již 4000 let. Rostlina je hlavním zdrojem furokumarinu xanthoxinu na světě, největší podíl má v listech a kořeni [4, 28, 29, 35]. I v současnosti egyptští herbalisté volně prodávají prášek ze semen Aatrillal.
Obr. 5. Apiaceae (shora: Angelica archangelica, Anthriscus sylvestris Ammi maius, Heracleum mantezzianum) 
V roce 1940 egyptský profesor Abdel Monem El Mofty z dermatovenerologické kliniky lékařské fakulty v Káhiře začal léčebně využívat 8-MOP k terapii vitiliga a následně v roce 1974 se rozvinula metoda PUVA terapie na Harvard Medical School [8].
Nejdůležitější zástupci miříkovitých vyvolávající fototoxické reakce:
a) Divoce rostoucí byliny neudržovaných ploch, luk a pastvin
- Kerblík lesní (Anthriscus sylvestris) a děhel lesní (Angelica sylvestris) jsou příčinou postižení zahradníků a pracovníků likvidující tyto porosty (strimmer dermatitis).
- Andělika lékařská (Angelica archangelica) je dvouletá bylina až dvoumetrového vzrůstu, rozšířená v Evropě a severní Asii. U nás přirozeně rostoucí v Krkonoších a jako okrasná rostlina přinesená do zahrad. Využívaná je od středověku, kdy se pěstovala v klášterech jako prostředek proti moru. Mimo furokumarinů obsahuje silice a organické kyseliny. Využívá se celá část, zejména plody a kořen, ve velkých dávkách může působit neurotoxicky. Plody se používají pro aromatickou vůni, nerozkvetlé květy a listy ke kandování a ke zvýraznění chuti do pečiva, kořen bývá součástí bylinných likérů (Benediktínka, Chartreuse) [25, 28].
- Bolševník obecný (Heracleum sphondylium) a jeho subspecies, zejména bolševník velkolepý (Heracleum mantegazzianum), způsobuje výrazné reakce u pracovníků, kteří likvidují porosty. Bolševník velkolepý je původem z oblasti Kavkazu, odkud se rozšířil do celého světa jako okrasná rostlina. Do naší krajiny se dostal ve 2. polovině 19. stolení, kdy byl vysazen v zahradě zámku Kynžvart, který vlastnil kníže Metternich. Rostlina dvou - a víceletá je vysoká 2–5 m, vzhledem k mohutnému kořenovému systému, velikosti květenství, množství semen (20 000 z jedné rostliny) a především schopnosti zachovat si klíčivost až 7 roků se stala invazivní a nesnadně likvidovatelnou. Obsahuje isopimpinellin, pimpinellin, bergapten, isobergapten, sphondin, imperatorin, xanthoxin a psoralen. Největší koncentrace furokumarinů je v červnu. Nebezpečné jsou zejména nezralé plody. Kožní reakce může vyvolávat nejen potřísnění z poraněné části, ale i kontakt s neporušenou rostlinou [6, 7, 22, 26, 33].
b) Ušlechtilé byliny – kmín kořenný (Carum carvi), mrkev setá (Daucus carota sativus), petržel zahradní (Petroselinum crispum), celer miřík (Apium graveolens), kopr vonný (Anethum graveolens), fenykl obecný (Phoeniculum vulgare). Nejvýznamnější z této skupiny rostlin jako původce fytofotodermatitidy je celer miřík a pastinák setý.
Celer miřík (Apium graveolens), zelenina pěstovaná pro kořen a nať. Celer běžně nevede k fotodermatitidě, když je užit ve stravě [9]. Nicméně byla popsána závažná reakce po konzumaci většího množství čerstvého celeru (asi 450g k přípravy šťávy) a následného ozáření v soláriu [31]. Na základě tohoto případu se provádělo testování plasmatické hladiny furokumarinů při požití 500 g celeru a analyzování fotosenzitivity metodou minimální fototoxické dávky (MPD) – fototoxicita nebyla prokázána. Nicméně při vyšším požitém množství celeru vzrůstá riziko při UV – zejména PUVA – terapii [13, 19, 42, 45].
Lokální reakce závisí na sluneční expozici během manipulace, stáří a druhu celeru, lokalitě jeho pěstování, klimatických podmínkách (koncentrace psoralenů od 25 do 80 μg/g v různých místech Izraele) a také podle mechanického poškození či napadení plísní Sclerotinia sclerotiorum (pink-rot disease) – v tom případě celer obranně zvyšuje produkci psoralenů (až na 320 μg/g) [10, 13, 45, 52, 53]. Obsah furokumarinů je vyšší v nati než bulvách, ty mívají obsah furokumarinů 3,6–268 μg/g a skladováním při teplotě 4 °C se po 16 týdnech zvýší až 4krát, podobně u nati po 4 týdnech skladování až 9krát [49].
Pastinák setý (Pastinaca sativa) je dvouletá bylina pocházející z Asie. Má zlatožluté okoličnaté květy, roste na loukách a u cest, je pěstován a využíván pro kořen jako zelenina [25] – obrázek 7.
Fenykl obecný (Foeniculum vulgare) je rostlina domácí ve Středomoří, pěstovaná pro plod i nať. Plod má využití jako fytofarmakum pro sekretolytické, spasmolytické a karminativní účinky, destilací vyrobená silice oleum foeniculi má mimo farmacie užití i v likérnictví a mydlářství, nať jako zelenina [25, 50].
Libeček lékařský (Levisticum officinale Koch) pochází ze západní Asie, pěstovaný a zplanělý v Evropě a Severní Americe, využívá se v tradiční medicíně (lékopisnou drogou je kořen Levistici radix) a především v potravinářství k výrobě koření [18, 25].
3. Bobovité (Fabaceae, Leguminosae)
Psoralea corylifolia (Dětelník lékařský) se používá v tradiční čínské a indické medicíně, kde je znám jako babchi (obr. 6). Používá se jako chemoterapeutikum a antidiaroikum, obsahuje chalkony, flavony, silice, furokumarin. Semena obsahují 10krát více psoralenů než semena příbuzných rostlin. Prášek ze semen se importuje do Evropy a používá se v rámci tzv. přírodní medicíny k lokálnímu a perorálnímu užití v laické léčbě vitiliga. Byl popsán případ muže z Londýna s 6 měsíců trvající fotosenzitivitou, erytémy, bulami a jizvením, po delším vyšetřování byla zjištěna samoléčba vitiliga drogou z Psoralea coryliforia v denní dávce ekvivalentní 30 gramů semene [34].
Obr. 6. Fabaceae (Psoralea coryliforia) 
4. Morušovité (Moraceae)
V této čeledi je zastoupeno více jak 750 druhů, nejvíce se vyskytují v tropech a subtropech. Jsou široce rozšířené jako okrasné rostliny, fíkovník smokvoň (Ficus carica) je pěstován pro plody [43] – obrázek 7. Má vysoký obsah furokumarinů (psoralen, bergapten) v listech a výhoncích, ale nikoliv v plodech. Vyšší obsah fotoaktivních látek je na jaře a v časném létě [53]. V některých zemích je čaj z fíkovníkových listů hojně užívaný k získání „perfect tan“ jako akcelerátor opálení s maximem účinku za 24 hodin. V Turecku byl zaznamenán případ ženy s popáleninami 81 % povrchu těla po požití tohoto přípravku, v Brazílii bylo několika nemocnicemi hlášeno v jednom letním období 50 případů popálenin indukovaných fíkovými listy [46]. Fíkovník šplhavý (Ficus pumila) se vyskytuje přirozeně v Číně, Japonsku a na Taiwanu, ale jeho kultivary se nalézají i v jiných místech světa, jako okrasná rostlina je používán k vertikálnímu porůstání stěn či do živých plotů (Nový Zéland, Austrálie). V tradiční medicíně se užívá latexu z fíkovníku pro antihelmintické účinky a v lidové medicíně v Asii jako analgetikum. Obsahuje furokumariny (bergapten), silice a množství seskviterpenoidních glykosidů, které mohou způsobovat také kontaktně alergické reakce [43].
Obr. 7. Moraceae (zleva: Ficus carica, Ficus pumila) 
Nejrůznější kultivary fíkovníků jsou používány u nás jako okrasné kultivary v bytech a v zimních zahradách, při ošetřování těchto rostlin je významné riziko vzniku fotosenzibilizace.
KLINICKÉ PROJEVY
Klinické příznaky se objevují s latencí 24 hodin a je pro ně charakteristický erytém, edém, vezikuly a buly v bizarních konfiguracích. Maximum změn na kůži bývá po 3 dnech. Za 1–2 týdny se většinou objeví hyperpigmentace, které mohou přetrvávat i několik měsíců.
V některých případech se mohou objevit jen pigmentace bez předchozího zjevného zánětlivého stadia. Klinické projevy odpovídají činnosti, při které se pacienti rostlinám či jejich extraktům exponovali. Ležení v trávě – meadow dermatitis, sekání travin kosou – dlouhé stvoly vytvářejí lineární či angulární linie s erytémem, vezikulami a bulami, při užívání mechanizace – sekačky (z kratších stvolů rostlin drobné bizarní léze – weed-eaton dermatitis), projevy poněkud rozdílného charakteru pak vznikají při použití strunové sekačky či elektrických nůžek na rostliny (strimmer dermatitis). Při zpracování zeleniny, bylin či přípravě potravin vždy v místě kontaktu a potřísnění (obr. 8, 9, 10). Typické obrazy jsou pak po používání kosmetik s příměsí bergamotu (parfémové kompozice ze silice Citrus bergamia – Eau de Cologne), hnědočervené pásy následující stékající tekutinu s lokalizací na obličeji, krku a výstřihu. Popsány jsou také generalizované reakce po aromaterapii s použitím bergamotového oleje [20, 47]. V případě přípravy nápojů z citrusů bývají projevy na prstech rukou, při jejich konzumaci na slunci cheilitidy a pericheilitidy. Nepostihuje místa chráněná před UV zářením oděvem, extrémním příkladem je tzv. inverse socking distribution – inverzní ponožková distribuce [52]. Postižené plochy nesvědí, pacienti udávají pálení a bolest. Pro stanovení diagnózy jsou velmi důležité anamnestické údaje, v některých případech je vhodná konzultace botaniků. Postiženi bývají zejména zahrádkáři, farmáři, lesní dělníci, bylinkáři a lidé trávící volný čas v přírodě [34]. Fytofotodermatitidy mohou způsobovat profesionální postižení a měly by být také hlášeny. První literární zmínka o profesionálním postižení pochází z roku 1926 – šlo o dermatitidy po celeru u prodavačů zeleniny [30]. Onemocnění se vyskytuje spíše v pozdním létě, kdy bývá zastoupeno více UVA záření a v rostlinách je vyšší koncentrace psoralenů [27, 35, 38, 43]. Je také častější v subtropických a tropických oblastech pro hojnější a různorodější flóru i pro klimatické podmínky [12].
Obr. 8. 17letá žena – 48 hodin po kontaktu s pastinákem. Výpomoc při sklizni v rodině zabývající se zelinářstvím (srpen). 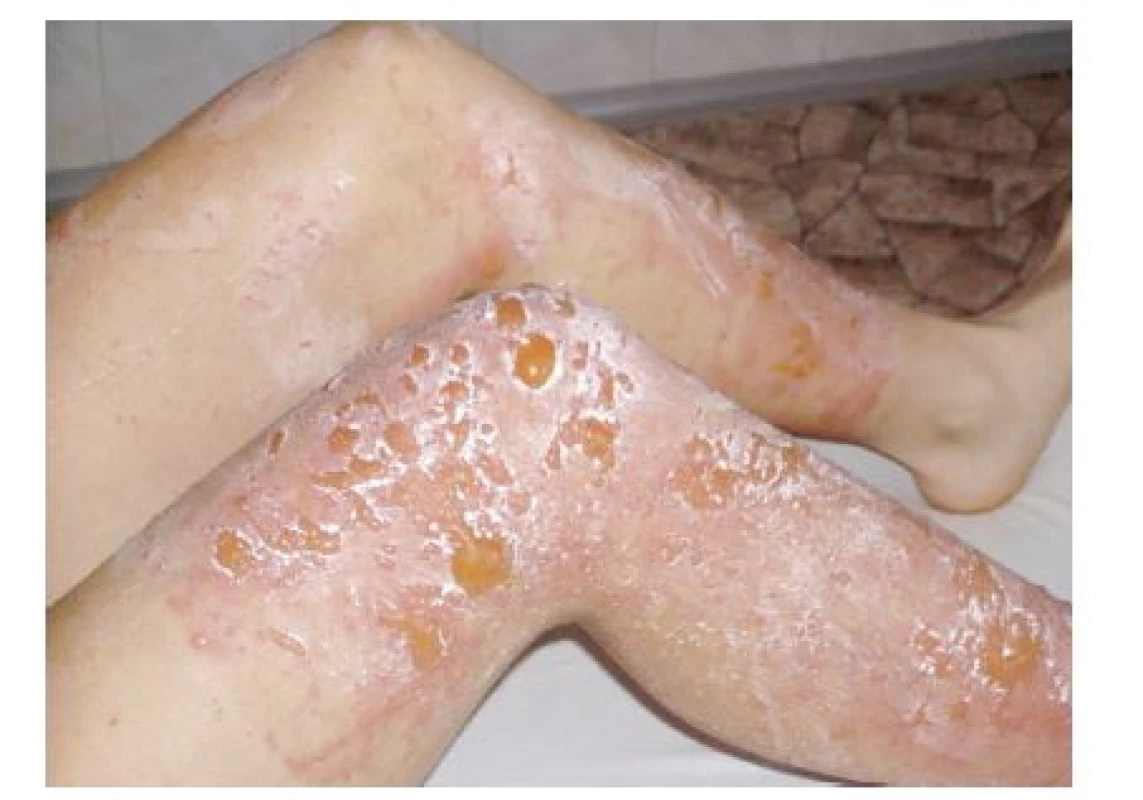
Obr. 9. 52letá žena – 48 hodin po sklízení nati libečku (červenec) 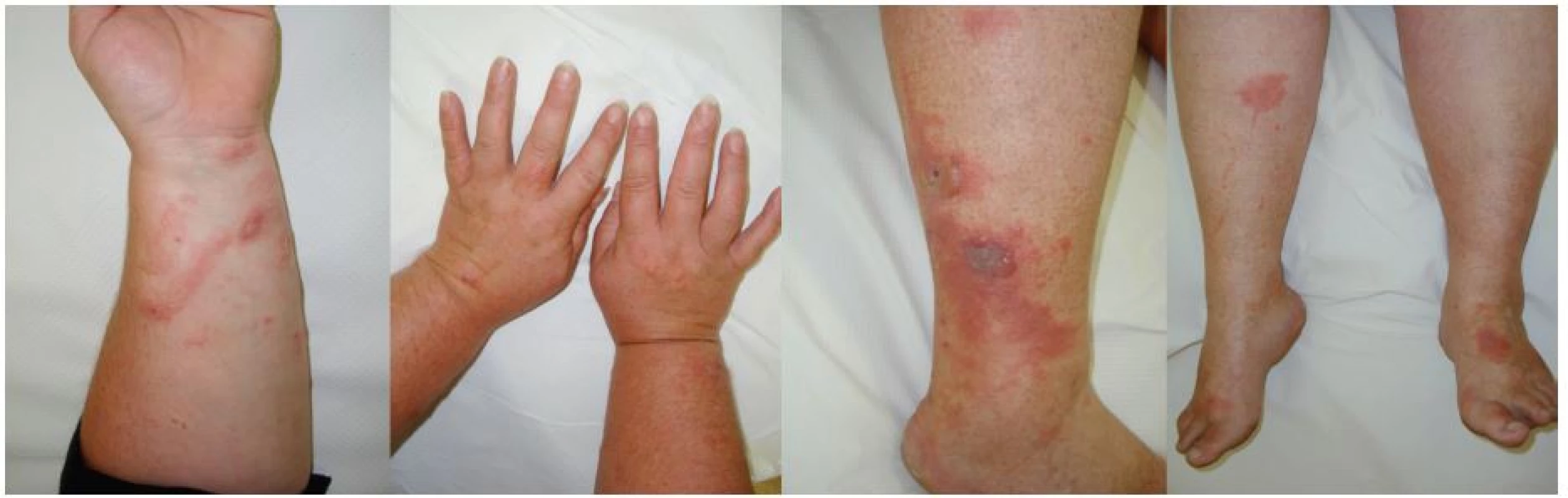
Obr. 10. 43letá žena – 72 hodin po zpracování kořenové zeleniny (říjen) 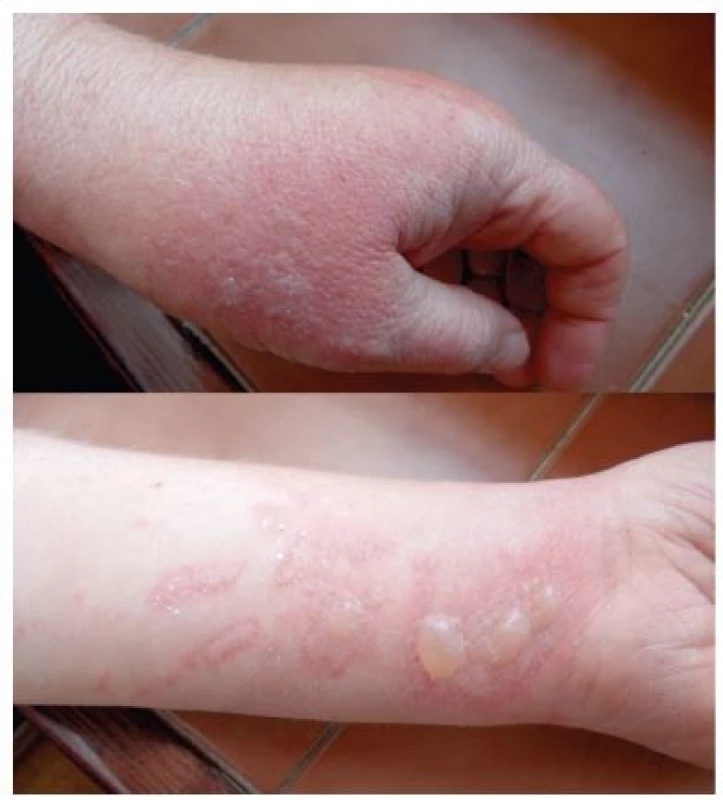
Diferenciální diagnóza zahrnuje puchýřnatá onemocnění, alergické kontaktní dermatitidy, polymorfní světelnou erupci, porphyria cutanea tarda, erysipel, multiformní erytém, varicellu, herpes simplex, herpes zoster, arteficiální dermatitidu, child abuse [6].
TERAPIE
Léčba je symptomatická – zevní nebo celkové kortikosteroidy, obklady, hojivá externa na případné erodované plochy po puchýřích. Je vhodná také dlouhodobá ochrana postižených míst před sluncem, fotosenzitivita přetrvává mnoho měsíců až roků. Prevencí je ochrana oděvem při práci s rostlinami na zahradě a v zaměstnání během sluneční sezony, ale také při sklizni kořenové zeleniny během podzimu, opatrnost při zpracování i konzumaci, poučení dětí a dospělých při nejrůznějších aktivitách v přírodě.
ZÁVĚR
Stanovení diagnózy fytofotodermatidy většinou nebývá obtížné, jsou-li přítomny neobvyklé až bizarní obrazy na kůži a pacient udává pobyt v přírodě a na slunci. Složitější může být zjištění konkrétního rostlinného agens. Dále je nutno mít na zřeteli fakt, že pacienti používající nejrůznější domácí i importované rostlinné extrakty, na které se v praxi zpravidla při zjišťování lékové anamnézy zapomíná a které mohou mít výrazný biologický potenciál a vytvářet závažné klinické projevy. V neposlední řadě je třeba pomýšlet na tyto vyvolávající faktory také v souvislosti s cestovatelskými aktivitami.
Poděkování za spolupráci a poskytnutí obrazového materiálu prof. MUDr. P. Cetkovské, Ph.D., prim. MUDr. M. Selerové, Ph.D., doc. MUDr. K. Ettlerovi, CSc., prim. MUDr. M. Kobsovi, MBA a Z. Pazderovi.
Zdroje fotografií
Autoři (9, 10), prof. MUDr. P. Cetkovská, Ph.D. (4), prim. MUDr. M. Selerová, Ph.D., prim. MUDr. M. Kobsa, MBA (8), Z. Pazdera (3a, 3c, 5a, 5b, 1, 2, 7a), Wikimedia commons (5c – H. Zell, 5d – F. Geller Grimm, 3b – P. Fillipov, 7b, 6 – B. Ganguly)Do redakce došlo dne 26. 8. 2014.
Adresa pro korespondenci:
MUDr. Ivana Strouhalová
Kožní ambulance
Postřelmovská 7a
789 01 Zábřeh na Moravě
e-mail: ivana@strouhal.cz
Zdroje
1. BALOUN, J., JAHODÁŘ, L., LEIFERTOVÁ, I. et al. Rostliny způsobující otravy a alergie. Avicenum: Praha, 1989, 235 s.
2. BELLRINGER, H. E. Phyto-photo-dermatitis. Br. Med. J., 1949, 4, p. 984–986.
3. BHUTANI, J. L., RAO, D. S. Photocontact dermatitis caused by Parthenium hysterophorus. Dermatologica, 1978, 157, p. 206–209.
4. BOWERS, A. G. Phytophotodermatitis. Am. J. Contact Derm., 1999, 10, 2, p. 89–93.
5. BURNET, J. W., NGUYEN, T. V. Phytophotodermatitis: Differentiation from Jellyfish Stings. Australan J. Dermatol., 1989, 30, p. 101–102
6. CARLSEN, K., WEISMANN, K. Phytophotodermatitis in 19 children admitted to hospital and their differential diagnoses: Child abuse and herpes simplex virus infection. JAAD, 2007, 57, 5, p. 88–91.
7. CUPALOVÁ, K. Bolševník velkolepý a fotodermatitida. Prevence úrazů, otrav a násilí, 2006, 1, s. 51–53.
8. DRUGGE, J. R. et al. Botanical Dermatology in The Electronic textbook of Dermatology. 1995–2000, The Internet Dermatology Society. Dostupné na www:
http://telemedicine.org/ botanica/botrefs1.htm#38
9. ELPERN, D. J., MITCHELL, J. C. Phytophotodermatitis from mokihana fruits (Pelea anisata H. Mann, fam. Rutaceae) in Hawaiian lei. Contact Dermatitis, 1984, 10, p. 224–226.
10. FINKELSTEIN, E., AFEK, U., GROSS, E. et al. An outbreak of phytophotodermatitis due to celery. Int. J. Dermatol., 1994, 33, 2, p. 116–118.
11. FLUGMAN, S. L. Mexican Beer Dermatitis: A Unique Variant of lime Phytophotodermatitis Attributable to Contemporary Beer-Drinking Practices. Arch. Dermatol., 2010, 146, 10, p. 1194–1195.
12. GOON, A. T. J., GOH, C. L. Plant dermatitis: Asian perspective. Indian J. Dermatol., 2011, 56, 6, p. 707–710.
13. GRAL, N., BEANI, J. C., BONNOT, D. et al. Plasma levels of psoralens after celery ingestion. Ann. Dermatol. Venerol., 1993, 120, 9, p. 599–603.
14. GREGERSEN, A. B., THESTRUP-PEDERSEN, K., PAULSEN, E. Phytophotodermatitis caused by burning bush of Moses. Ugeskr. Laeger., 2003, 165, 23, p. 2400–2401.
15. IPPEN, H. Phytophotodermatitis caused by plant trimming (edger’s rash). Derm. Beruf. Umwelt, 1990, 38, 6, p. 190–192.
16. IZUMI, A. K., DAWSON, K. L. Zabon phytophotodermatitis: First case report due to Citrus maxima. JAAD, 2002, 46, p. 146–147.
17. JAHODÁŘ, L. Farmakobotanika. Nakladatelství Karolinum: Praha, 2011, 278 s., ISBN 978-80-246-2015-2.
18. JAHODÁŘ, L. Léčivé rostliny v současné medicíně. Havlíček Brain Team, 2010, 240 s., ISBN 978-80-87109-22-9.
19. JEANMOUGIN, M., VARROUD-VIAL, C., DOUBERTRET, L. Phototoxic side-effect following celery ingestion during puvatherapy. Ann. Dermatol. Venereol., 2005, 132, 6–7), p. 566–567.
20. KADDU, S., KERL, H., WOLF, P. Accidental bullous phototoxic reaction to bergamot aromatherapy oil. JAAD, 2001, 45, 3, p. 458–461.
21. KAVLI, G., VOLDEN, G., RAA, J. Accidental induction of Photocontact allergy to Heracleum lacinatum. Acta Dermatovenerologica, 1982, 62, p. 435–438
22. KELLY, A. Phyto-photo-dermatitis, Ulster Med. J., 1969, 38, 1, p. 51–54.
23. KLABER, R. Phyto-photo-dermatitis. Br. J. Dermatol., 1942, 54, p. 19–21.
24. KOH, D., ONG, C. N. Phytophotodermatitis due to the application of Citrus Hystrix as folk remedy. Br. J. Dermatol., 1999, 140, p. 737–738.
25. KORBELÁŘ, J., ENDRIS, Z., KREJČA, J. Naše rostliny v lékařství. Avicenum: Praha, 1970, 500 s.
26. KUBÁT, K., KALINA, T., KOVÁČ J. et al. Botanika. Scientia, 2003, 231 s., ISBN 80-7183-266-9.
27. KUNG, A. C., STEPHENS, M. B., DARLING, T. Phytophotodermatitis: Bulla Formation and Hyperpigmentation During Spring Break. Military Medicine, 2009, 174, p. 657–661
28. KVESÁNEK, J., KREJČA, J. Atlas liečivých rastlín a plodov. Osveta: Bratislava, 1977, 768 s.
29. LENKOVIČ, M., ČABRIJAN, L., GRUBER, F. et al. Phytophotodermatitis in Rijeka region. Croatia, Coll. Antropol., 2008, 32, 2, p. 203–205.
30. LEGRAIN, M. M., BERTHE, R. Dermite professionelle des mains et des avant-bras chez un remasseur de celeris. Bullein de la Society Francaise de Dermatologie et Syphiligraphie, 1926, 33, p. 662.
31. LJUNGGREN, B. Severe Phototoxic Burn Following Celery Ingestion. Arch. Dermatol., 1990, 126, p. 1334–1336
32. LJUNGGREN, B. Psoralen photoallergy cause by plant contact. Contact Derm., 1977, 3, p. 85–90.
33. MALINA, L. Fotodermatózy. 2. rozšířené vydání. Maxdorf, 2005, 206 s., ISBN 80-7345-039-9.
34. MAURICE, P. D., CREAM, J. J. Dangers of herbalism. Br. Med., 1989, 299, p. 1204.
35. MCGOVERN, T. W. Dermatoses due to plants, In Bolognia, J. L., Jorizzo, J. L., Rapini, R. P. Dermalogy. Elsevier Limited, 2008, p. 243–260, ISBN 9781416029991.
36. MESSER, A., RAQUET, N., LOHR, C. et al. Major furocoumarins in grapefruit juice II: phototoxicity, photogenotoxicity, and inhibitory potency vs. cytochrome P450 3A4 activity. Food Chem. Toxicol., 2012, 50, 3–4, p. 756–760.
37. MILL, J., WALLIS, B., CUTTLE, L. et al. Phytophotodermatitis: Case report of children presenting with blistering after preparing lime juice. Burns, 2008, 34, p. 731–733.
38. MITSCHELL, J., ROOK, A. Phytophotodermatitis: a botanic view. The Lancet, 1991, 338, 5, p. 892–893.
39. NIGG, H. N., NORDBY, H. E., BEIER, R. C. et al. Phototoxic coumarins in limes. Food Chem. Toxicol., 1993, 31, 5, p. 331–335.
40. OPPENHEIM, M. Dermatitis striata pratensis bullosa (Grass or meadow dermatitis). Arch. Derm. Syphilol., 1942, 46, 4, p. 541–551.
41. POMERANZ, M. K., KAREN, J. K. Phytophotodermatitis and limes. N. Eng. J. Med., 2007, 5, p. 357.
42. PUIG, L., de MORAGAS, J. M. Enhancement of PUVA phototoxic Effects Following Celery Ingeastion: Cool Broth Also Can Burn. JAMA, 1994, 130, 6, p. 809–810.
43. RADEMAKER, M., DERRAIK, J. G. B. Phytophotodermatitis caused by Ficus pumila. Contact Dermatitis, 2012, 67, p. 47–57.
44. SASSEVILLE, D. Clinical Pattern of Phytodermatitis. Dermatol. Clin., 2009, 27, p. 299–308.
45. SELINGMAN, P. J., MATHIAS, C. G., OęMALLEY, M. A. et al. Phytophotodermatitis from celery among grocery store workers. Arch. Dermatol., 1987, 123, 11, p. 1478–1482.
46. SFORZA, M., ANDJELKOV, K., ZACCHEDDU, R. Severe burn on 81% of body surface after sun tanning. Turkish J. of Trauma and Emergency Surg., 2013, 19, 4, p. 383–384.
47. SCHALLER, M., KORTING, H. C. Allergic airborne contact dermatitis from Essentials oils used in aromatherapy. Clin. Exp. Derm., 1995, 20, p. 143–145.
48. SCHEMP, C. M., SIMON-HAARHAUS, B., KRIEGER, R. et al. Solar Simulator-Induced Phototoxicity of the Furoquinoline Alkaloid Dictamnine Compared to 8-Methoxypsoralen and 5-Methoxypsoralen. Planta Med., 2006, 72, p. 941–943.
49. SCHULTZOVÁ, V., PEROUTKA, R., HAJŠLOVÁ, J. Levels of Furanocoumarins in vegetables from organic and conventional farming. Polish Journal of Food and Nutrition Science, 2002, Vol 11, 52, p. 25–27.
50. TOMKO, J. et al. Farmakognózia. Vydavateĺstvo Osveta, 1989, 418 s., ISBN 80-217-0083-1.
51. WAGNER, A. M., WU, J. J., HANSEN R. C., et al. Bullous phytophotodermatitis assotiated with high natural concentrations of furocoumarins in lime. Am. J. Contact Dermat., 2002, 13, 1, p. 10–14.
52. WILD, G. Phytophotodermatitis after gardening. JR Army Med. Corp., 154, 4, p. 245–246.
53. WU, C. M., KOEHLER, P. E., AYRES, J. C. Isolation and identification of xanthotoxin (8-methoxypsoralen) and bergapten (5-methoxypsoralen) from celery infected Sclerotinia sclerotiorum. Appl. Microbiol., 1972, 23, p. 852–856.
54. ZAYNOUN, S. T., ASTIMOS, B. G., ABI ALI, L. et al. Ficus carica: isolation and quantification of the photoactive components. Contact Derm., 1984, 11, p. 21–25
Štítky
Dermatológia Detská dermatológia
Článok vyšiel v časopiseČesko-slovenská dermatologie
Najčítanejšie tento týždeň
2014 Číslo 6- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
- První a jediná schválená imunoterapie vzácného agresivního karcinomu kůže
-
Všetky články tohto čísla
- Fytofotodermatitidy
- Doškolování lékařů - kontrolní test
- Dermatologický index kvality života rodiny – validace české verze dotazníku
- Buschke-Löwensteinov tumor u imunodeficientného pacienta – popis prípadu a prehľad terapeutických možností
-
Klinický případ:
Svědivý generalizovaný papulózní exantém - Hepatitida jako vzácný projev sekundární syfilis – popis případu
- 15. Světový kongres o rakovinách kůže v Edinburghu ve dnech 2.–6. 9. 2014
- 23. kongres Evropské akademie dermatovenerologie (EADV) v Amsterdamu 8.–12. 10. 2014
- Odborné akce v roce 2015
- 8. konference akné a obličejové dermatózy
- Estetická plastická chirurgie a korektivní dermatologie
- Odborné akce v roce 2015
- Jmenný a věcný rejstřík
- Česko-slovenská dermatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Fytofotodermatitidy
-
Klinický případ:
Svědivý generalizovaný papulózní exantém - Hepatitida jako vzácný projev sekundární syfilis – popis případu
- Dermatologický index kvality života rodiny – validace české verze dotazníku
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



