-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Polymerázová řetězová reakce: princip metody a využití v molekulární patologii
Polymerase chain reaction: basic principles and applications in molecular pathology
Polymerase chain reaction (PCR) is a technology used for quick and easy amplifying DNA sequences, which is based on the principle of enzymatic replication of the nucleic acids. This method has in the field of molecular biology an irreplaceable role and constitutes one of the basic methods for DNA analysis. In the following article we describe the basic principles of PCR, and its importance especially in the field of pathology.
Keywords:
polymerase chain reaction – nucleic acid amplification – primers – detection of amplicons – reverse transcription
Autoři: Libor Staněk
Působiště autorů: Ústav patologie 1. LF UK a VFN, Praha
Vyšlo v časopise: Čes.-slov. Patol., 49, 2013, No. 3, p. 119-121
Kategorie: Přehledový článek
Souhrn
Polymerázová řetězová reakce (PCR - polymerase chain reaction) je metoda rychlého a snadného zmnožení příslušného úseku DNA, která je založena na principu opakované replikace nukleových kyselin pomocí termostabilní polymerázy. Tato metoda má v oblasti molekulární biologie dodnes nezastupitelnou roli a představuje jednu ze základních metod analýzy DNA. V následujícím textu popisujeme základní principy PCR, její vyžití a význam zejména v oblasti patologie.
Klíčová slova:
polymerázová řetězová reakce – amplifikace nukleových kyselin – primery – detekce amplikonu – reverzní transkripcePolymerázová řetězová reakce (PCR) je biochemická a molekulárně biologická metoda, která slouží k enzymatické replikaci DNA in vitro (1–5). Touto metodou lze během opakovaných cyklů získat velké množství kopií příslušného úseku DNA, za použití příslušných reagencií, mezi něž patří analyzovaný úsek nukleové kyseliny (tzv. templát), dále primery (synteticky připravované oligonukleotidové fragmenty komplementární ke koncům sledovaného úseku templátové nukleové kyseliny), deoxyribonukleotid trifosfáty (dATP, dGTP, dCTP a dTTP) a DNA polymeráza, enzym, který generuje dceřinné fragmenty na podkladě komplementarity bází se sekvencí templátu. Nutností je dodržení základních parametrů, mezi něž patří denaturace dvoušroubovice templátu (ta je závislá na kvalitě izolované DNA), přítomnost Mg2+ monovalentních kationtů a také přítomnost pufrů (pomáhají ke stabilitě enzymů, podporují specifičtější funkci enzymu a stabilizuji Tm – melting temperature).
Výsledný produkt (amplikon) se následně vizualizuje např. pomocí gelové elektroforézy (viz dále). Amplikony vytvořené metodou PCR se ovšem využívají i pro jiné vysoce sofistikované metody či analýzy, jako je např. sekvenování DNA, nebo tvorba fylogenetických stromů.
Metoda PCR byla objevena americkým molekulárním biologem Kary Mullisem v roce 1983 (6), který za tento objev obdržel v roce 1993 Nobelovu cenu za chemii.
Objev metody PCR znamenal převratný objev v molekulární biologii. Do této doby byli výzkumníci při studiu nukleových kyselin a genů odkázáni na manipulačně velmi náročnou metodu klonování genů (7). Klonování genů spočívá ve vložení úseku DNA, který chceme klonovat, do kružnicové molekuly DNA (vektoru) za vzniku rekombinantní DNA. Tento vektor je transfekován pomocí elektroporace do hostitelské buňky zpravidla bakteriální, která se množí spolu s transfekovaným vektorem a s kopií genu, kterou nese. Po mnohonásobném dělení vzniká velké množství kopií neboli klonů příslušného genu. PCR se od klonování liší právě svou jednoduchostí. U metody PCR se nejedná o sérii manipulací, celá reakce je provedena v jediné zkumavce.
PRINCIP PCR
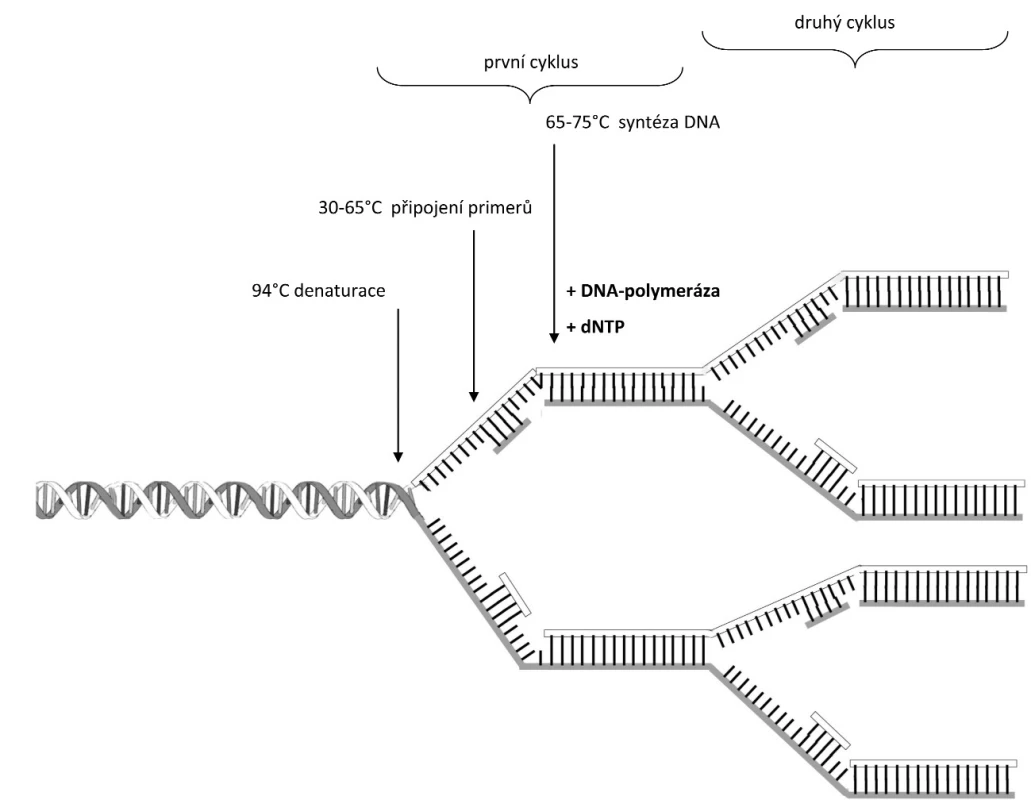
PCR je enzymová syntéza sloužící k selektivní amplifikaci vybraných oblastí molekuly DNA (Obr. 1). Můžeme amplifikovat jakoukoliv oblast molekuly DNA nebo konkrétní gen za předpokladu, že známe okrajové sekvence tohoto úseku. Příslušné úseky DNA, které se mají amplifikovat (namnožit), musí být ohraničeny na začátku a na konci tzv. primery (krátkými syntetickými oligonukleotidy DNA), jejichž přesný návrh a sekvenční složení předurčuje přesnost a úspěšnost celé PCR. PCR slouží k vytváření až mnoha milionů stejných kopií studovaného (označeného) úseku DNA o délce až tisíců nukleotidů (10 000 nukleotidů), což nám umožňuje provést analýzu i s limitním množstvím vstupní DNA. K syntéze DNA se nejčastěji používají termostabilní DNA polymerázy, např. Taq DNA-polymeráza z Thermus aquaticus. Celá reakce probíhá v termocykleru, což je zařízení ve kterém se v naprogramovaných časových intervalech cyklicky mění teplota. Cyklickým opakováním tohoto teplotního procesu se exponenciálně (2n; n je rovno počtu cyklů) vytváří miliony kopií vybraného úseku DNA.
Proces PCR je složen ze tří kroků:
- Denaturace – dvouvláknová DNA se po dobu 20 – 30 sekund zahřeje na 94 °C. Při této teplotě dochází k denaturaci vodíkových můstků, rozvolnění dvoušroubovice a vzniku jednovláknové DNA, na kterou mohou v dalším kroku nasednout primery.
- Nasednutí primerů – teplota se sníží na 30 – 65 °C, což umožňuje nasednutí primerů na specifická místa DNA. Na dvouvláknové úseky DNA-primer se váže DNA polymeráza.
- Syntéza DNA za použití DNA polymerázy. Nejběžnější Taq polymeráza má aktivitu při 65 – 75 °C. V tomto kroku dochází k nasedání volných bází (renaturaci jednovláknových molekul DNA s volnými deoxynukleotidfosfáty (dNTP) v reakční směsi a syntéze DNA ve směru od 5’ ke 3’ konci za vzniku komplementární molekuly DNA.
Popsané kroky se v termocykleru cyklicky opakují. Pro dostatečnou amplifikaci původní molekuly DNA je zapotřebí asi 30 – 35 cyklů, po kterých dosáhneme až miliardy nasyntetizovaných molekul DNA. Skutečný výtěžek PCR bývá podstatně nižší, než zmíněných 109 kopií na jednu molekulu DNA po 30 – 35 cyklech, což je dáno postupným vyčerpáváním složek reakce v průběhu amplifikace. Po určitém počtu cyklů dosáhne koncentrace produktu vrcholu a dále se již prakticky nezvyšuje.
Možnosti využití PCR
Preparativní PCR
Jedná se o amplifikaci určitého úseku DNA, kterým chceme získat velké množství amplifikovaného produktu. Při této technice používáme tzv. re-amplifikaci se stejnými primery jako v iniciální PCR. Využíváme ji v případě, kdy je k dispozici malé množství zásobního DNA roztoku z iniciální amplifikace.
Asymetrická PCR
Asymetrická PCR je metoda, která bývá používána v případě, kdy je třeba syntetizovat pouze jeden ze dvou řetězců analyzované DNA. Produkt asymetrické PCR je možno použít např. jako specifickou sondu pro následující hybridizační krok, a také jako výchozí matrici pro sekvenaci. Ve srovnání se symetrickou PCR je fragment DNA množen lineárně.
Alelicky-specifická PCR
Tuto PCR reakci využíváme v případě, že je nutné odhalit pouze jedno-nukleotidovou záměnu, ovšem musíme pro tvorbu primeru striktně znát nukleotidovou sekvenci hledané mutace. Dojde-li k nasednutí mutačně-specifického primeru, vznikne PCR produkt (tj. hledaná mutace je přítomna).
Nested PCR
Jedná se o metodu dvou po sobě následujících PCR. Metoda je používána především v případě, kdy je amplifikováno velmi malé množství DNA, kdy „nested primery“ fungují jako kontrola specifity reakce pro primery externí či jako metoda množení DNA-fragmentu pro přípravu hybridizační sondy.
Multiplex PCR
Mnohočetná (multiplex) PCR je technika umožňující současnou amplifikaci více oblastí analyzované DNA. Nutností je souběžné použití více primerů, hybridizační teplota však musí být u těchto primerů obdobná, či nejlépe stejná. Díky této metodě tedy může být analyzováno (amplifikováno) několik sekvencí současně.
Diferenciální (kompetitivní) PCR
Tuto PCR použijeme v případě, že potřebujeme porovnat rozdílné zastoupení DNA ve vzorcích. Amplifikujeme tedy DNA o neznámé výchozí koncentraci současně s referenční DNA o známé koncentraci. Požadovaná reakce probíhá v jedné reakční směsi, do které je přidáno známé množství DNA referenčního fragmentu, jehož koncentrace je pak hodnocena kvantitativně se vzorkem DNA neznámé koncentrace.
PCR SPOJENÁ S REVERZNÍ TRANSKRIPCÍ
PCR spojená s reverzní transkripcí (RT-PCR) je metoda, při které využíváme enzymatické funkce reverzní transkriptázy. Reverzní transkripce je enzymová reakce, při níž dochází k přepisu genetické informace z molekuly RNA do DNA. Pomocí metody reverzní transkripce získáme molekulu cDNA (complementary DNA) odpovídající původní mRNA, kterou následně amplifikujeme pomocí PCR. Nevýhodou metody je, že reverzní transkriptáza je termolabilní a obvykle nefunkční nad 42 °C. V případech složité sekundární struktury RNA je znemožněn její převod do cDNA. Proto se používá Tht polymeráza, která je schopná převést RNA do cDNA v přítomnosti Mn2+ iontů.
RT-PCR je v současné době nejcitlivější metodou detekce a kvantifikace mRNA a v porovnání s Northern blotem (další metodou používanou při kvantifikaci mRNA) při RT-PCR se však používá mnohem menších objemů. Metoda umožňuje detekci mRNA i u jedné buňky (po předchozí mikrodisekci).
Výhodou práce s cDNA je, že tato molekula neobsahuje introny, ale pouze kódující úseky DNA exony, a je stabilnější než RNA.
DETEKCE PRODUKTU PCR
Specifický produkt PCR vzniklý na základě amplifikace se nazývá amplikon. Nejčastější a také nejpoužívanější metodou detekce a separace amplikonu je gelová elektroforéza. Principem elektroforetické analýzy je pohyb nabitých molekul v elektrickém poli, využívá se odlišné pohyblivosti jednotlivých molekul ve stejnosměrném elektrickém poli. Pohyblivost v gelu závisí na náboji separované molekuly a její molekulové hmotnosti, intenzitě elektrického pole a samozřejmě typu a porozitě gelu. Elektroforézu provádíme zpravidla na agarózovém, nebo polyakrylamidovém gelu, s ohledem na velkost fragmentu a kvalitu detekce. Výsledný produkt detekujeme v podobě signálu (bandu) v UV světle po předchozí vizualizaci za použití ethydium bromidu.
a. Agarózový gel
Agaróza je polysacharid tvořený D-galaktózou a anhydro-L-galaktózou. Pro elektroforézu nukleových kyselin se používají gely obsahující 0,5 až 4 % agarózy. Čím je obsah polysacharidu vyšší, tím je lepší rozlišovací schopnost gelu, ale delší průběh elektroforézy. Hodí se pro rozdělování delších fragmentů DNA.
b. Polyakrylamidový gel
Polymerací akrylamidu vznikají lineární molekuly polyakrylamidu. Ty se spojují příčnými můstky a vytvářejí molekulové síto, které je velice husté. Tento gel se hodí pro rozdělování kratších fragmentů DNA.
KVANTITATIVNÍ PCR
Kvantitativní PCR neboli Real-Time PCR (qRT-PCR) je metoda založená na principu klasické PCR, umožňuje však kvantifikaci sledovaného úseku DNA. Na rozdíl od běžné PCR, kde se analyzuje až výsledný produkt (amplikon) pomocí elektroforézy, je při Real-Time PCR zaznamenáván každý cyklus PCR ve skutečném čase prostřednictvím detekce a kvantifikace fluorescenčního signálu. Pro tuto detekci produktu se využívají tři základní metody a to využití interkaláčních barviv vázajících se na DNA (např. fluorescenční kyanidová barviva SYBR® Green), dále fluorescenčně značené hybridizační a hydrolyzační sondy vázající se na amplifikovaný produkt. Nevýhodou interkalačních barviv oproti níže uvedeným sondám je skutečnost, že dochází k detekci veškeré dvouřetězcové DNA, tedy i nespecifických produktů amplifikace. Z tohoto důvodu je vhodné využít analýzy křivek tkání (viz dále). Hybridizační sondy se značí speciálními molekulami fluoroforů (tyto molekuly emitují světlo v jiné vlnové délce než byla vlnová délka světla, které před tím absorbovaly). Vychází se z principu, že vlnová délka světla emitovaného (emisní spektrum) je delší než u světla absorbovaného (absorpční spektrum). Hydrolyzační sondy jsou značeny na jednom konci fluoroforem a na druhém konci tzv. zhášečem. Během syntézy PCR produktu dochází k vytěsňování sondy a tím i k oddálení fluorochromu od zhášeče a k nárůstu fluorescence.
Obecně se dá tedy říci, že detekce je založena na záznamu množství uvolněné fluorescence, které odpovídá množství vzniklého produktu, který je zaznamenán v podobě amplifikační křivky. Kvantifikace se provádí prostřednictvím matematické analýzy těchto křivek. Amplifikační křivka má esovitě zakřivený průběh, mající obecně 3 části:
- fázi kdy je ještě množství amplifikátu tak málé, že jeho fluorescence ještě nedosahuje měřitelných hodnot
- exponenciální (narůstající) fázi, kdy množství produktu exponenciálně roste
- fázi plató, kdy, množství amplifikovaného produktu se již dále nemění a fluorescenční signál zůstává konstantní.
Existují dva principy kvantitativní PCR – relativní a absolutní kvantifikace PCR produktu. (Pozn. redakce – problematice kvantitativní PCR a jejího využití se bude detailně věnovat článek o detekci minimální reziduální nemoci v příštím čísle časopisu.)
HIGH RESOLUTION MELTING
Vysoké rozlišení (analýza) křivek tání (HRM) je metoda sloužící k identifikaci změn u nukleových kyselin a to především pro detekci mutací, polymorfismů a epigenetických rozdílů. Metoda je založena na detekci teplotních křivek tání u PCR produktu. Jedná se o modifikaci Real-Time PCR, kdy během zahřívání dochází nejdříve k denaturaci dvoušroubovice DNA (tj. PCR produktů), poté k ochlazení, při kterém dochází k nasednutí fluorescenčně značených mutačně specifických sond. Poté při postupném zahřívání v případě neúplně komplementarity „odtají“ (= denaturují) fluorescenčně značené sondy dříve než v případě komplementarity úplné. Výsledkem je vznik tzv. křivky tání, která je odrazem teplot, při kterých hydridizační sondy denaturovaly od PCR produktu. Tvar křivky tání je charakteristický pro konkrétní záměnu na konkrétní pozici daného amplikonu. Tohoto principu se využívá k detekci jak homozygotních tak heterozygotních mutací.
STRIPASSAY
Jedná se o metodu, při které PCR produkt reverzně hybridizujeme na oligonukleotidy umístěné na stripu (membráně). Pokud je ve studované (analyzované) DNA přítomna mutace, dojde k nahybridizovaní tohoto úseku k příslušnému oligonukleotidu a objeví se band, který detekujeme pomocí vyhodnocovacího softwaru.
ZÁVĚR
PCR je vysoce účelná a relativně jednoduchá metoda, která se prakticky od svého objevení stala základní metodou molekulární biologie. Toto výsostné místo si i přes dramatický rozvoj molekulární biologie včetně rozvoje nových metod udržuje dodnes. Opomineme-li nezpochybnitelný význam PCR jako základní metody vědeckého rozvoje mnoha vědních oborů, tato metoda je také nepostradatelnou při rutinním využití v medicíně pro určování mutačního stavu a kvantifikaci příslušných genů u nádorových onemocnění. Stává se tak nedílnou součástí diagnostiky v rámci typizace a subtypizace některých nádorů, ale i významným pomocníkem při hodnocení prognostických a prediktivních markerů. Výsledky získané pomocí PCR tedy přímo ovlivňují léčbu pacientů, a to zejména v souvislosti s výrazným rozvojem cílené zejména biologické léčby.
Poděkování
Podpořeno projektem PRVOUK-P27/LF1/1.
Adresa pro korespondenci:
Mgr. Ing. Bc. Libor Staněk
Ústav patologie 1. LF UK a VFN
Studničkova 2, 128 00 Praha 2
tel.: 224 968 692
stanek.libor@seznam.cz
Zdroje
1. Coleman WB, Tsongalis GJ. Molecular Patology. Elsevier: USA; 2009 : 197–207.
2. Kolář Z, Bouchal J, Knillová J. Molekulární patologie nádorů. Epava: Olomouc; 2003 : 113–142.
3. Powledge TM. The polymerase chain reaction. Advances in Physiology Education 2004; 28 : 44–50.
4. Rosypal S. Úvod do molekulární biologie, díl třetí. Grafex: Brno; 1999 : 743.
5. Šmarda J, Doškář J, Pantíček R, Růžičková V, Kostíková J. Metody molekulární biologie. Masarykova univerzita v Brně: Brno; 2008 : 13–16; 73–104.
6. Konrad M. A (short) history of PCR. http://www.scienceisart.com/A_PCR/PCR history_2. html.
7. Brown TA. Klonování genů a analýza DNA. Univerzita Palackého v Olomouci:
Olomouc; 2007 : 3–12; 184–189.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článek Jak se vám líbí?Článek Sekvenování nové generace
Článok vyšiel v časopiseČesko-slovenská patologie

2013 Číslo 3-
Všetky články tohto čísla
- Molekulární a personalizovaná medicína - budoucnost patologie v 21. století
- Rád se dívám na svět i jinak než mikroskopem
- MONITOR aneb nemělo by vám uniknout, že ...
- ÚVOD DO MOLEKULÁRNÍ PATOLOGIE
-
Prof. MUDr. Zdeněk Lukáš, CSc.
In Memoriam - Polymerázová řetězová reakce: princip metody a využití v molekulární patologii
- Sekvenování – klasická metodika
- Jak se vám líbí?
- Sekvenování nové generace
- MONITOR aneb nemělo by vám uniknout, že ...
- Endometrióza v mezotelovej cyste tunica vaginalis testis. Kazuistika
- MONITOR aneb nemělo by vám uniknout, že ...
- Nepravá výduť stěny žilního štěpu u pacienta s implantovaným MGuard typem koronárního stentu: kazuistické sdělení a popis mikroskopických změn
- Obrovskobuněčná intersticiální pneumonie bez souvislosti s expozicí tvrdokovům
- Praktická poznámka pro elektronové mikroskopiky
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Polymerázová řetězová reakce: princip metody a využití v molekulární patologii
- Sekvenování – klasická metodika
- Sekvenování nové generace
- Rád se dívám na svět i jinak než mikroskopem
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy