-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Neobvyklý histopatologický obraz akútneho poškodenia pľúc v rôznej fáze rezorpcie s prevahou organizujúcej sa pneumónie u jedinca s chrípkou A(H1N1)
Unusual histopathological picture of acute lung injury in different stages of resorption with predominance of organizing pneumonia in a young man with influenza A (H1N1)
In this case report the authors describe histomorphological findings of acute lung injury with laboratory-confirmed influenza type A(H1N1) pneumonia leading to the death of a 30 year-old unvaccinated man after 27 days of hospitalisation. Histologically all three types of acute lung injuries were unusually present (diffuse alveolar damage, acute interstitial pneumonia, organizing pneumonia) in different phases of resorption and reparation with transition to extensive fibrosis.
Keywords:
influenza – organizing pneumonia – fibrosis – pneumocytes hyperregeneration
Autori: Daniel Farkaš 1; Radoslav Matěj 2; Marián Švajdler ml. 3; Marcela Sluková 4; Jana Seligová 5; Lucia Fröhlichová 6; Silvia Farkašová Iannaccone 7; Vlasta Vyhnálková 1; Alžbeta Ginelliová 1,7
Pôsobisko autorov: Úrad pre dohľad nad zdravotnou starostlivosťou, SLaPA pracovisko, Košice 1; Oddělení patologie a molekulární medicíny, Thomayerova nemocnice, Praha 2; Šiklův ústav patologie, Univerzita Karlova v Praze, Lékařská fakulta v Plzni a Fakultní nemocnice Plzeň 3; Oddelenie anesteziológie a intenzívnej medicíny, Univerzitná nemocnica Louisa Pasteura, Košice 4; Regionálny úrad verejného zdravotníctva, Košice 5; Oddelenie patológie, Univerzitná nemocnica Louisa Pasteura, Košice 6; Ústav súdneho lekárstva UPJŠ LF, Košice 7
Vyšlo v časopise: Čes.-slov. Patol., 53, 2017, No. 1, p. 38-42
Kategória: Původní práce
Súhrn
V kazuistike autori popisujú histomorfologické nálezy akútneho poškodenia pľúc s laboratórne potvrdenou vírusovou pneumóniou chrípky typu A(H1N1), ktoré po 27 dňovej hospitalizácii u 30-ročného neočkovaného muža viedlo k smrti. Histologicky boli prítomné neobvykle všetky tri druhy akútneho poškodenia pľúc (difúzne alveolárne poškodenie, akútna intersticiálna pneumónia, organizujúca sa pneumónia) v rôznej fáze rezorpcie a reparácie s prechodom do rozsiahlej fibrózy.
Kľúčové slová:
chrípka – organizujúca sa pneumónia – fibróza – hyperregenerácia pneumocytov
V marci 2009 v Mexiku došlo k prepuknutiu epidémie respiračného ochorenia, ktorého pôvodcom bol mutovaný vírus prasacej chrípky (1). Koncom decembra 2009 bolo ochorenie identifikované vo viac ako 208 krajinách, pričom spôsobilo smrť najmenej 12220 ľudí (2). Na Slovensku bolo na začiatku pandémie vykonávané vyšetrenie metódou Real-Time PCR v Národnom referenčnom centre pre chrípku v Bratislave, o niečo neskôr na oddelení lekárskej mikrobiológie na Regionálnom úrade verejného zdravia (RÚVZ) v Banskej Bystrici, od začiatku roka 2010 aj na RÚVZ v Košiciach. Na základe vyhodnotenia chrípkovej sezóny 2014/2015 na Slovensku RÚVZ bolo možné konštatovať, že najčastejším etiologickým agensom akútnych respiračných ochorení bol vírus chrípky typu A (83,5%). Akútne respiračné ochorenia vyvolané vírusom chrípky typu A mali miestami charakter okresných epidémií. Najčastejším subtypom chrípky typu A bol typ A/California/7/2009 (H1N1)pdm09 – like, nasledovaný vírusom chrípky typu A bez bližšej špecifikácie a vírusom chrípky typu A/Texas/50/2012(H3N2)-like. Z celkového počtu 74 prípadov ťažkej akútnej respiračnej infekcie (Severe Acute Respiratory Infection - SARI) zomrelo 25 pacientov (33,8 %), pričom u 17 zomrelých (68 %) bol prítomný aj rizikový faktor (napr. onkologické a kardiologické ochorenie, diabetes, obezita, úraz). V dvadsiatich prípadoch išlo o úmrtie na infekčnú príčinu a v piatich prípadoch malo úmrtie inú príčinu. Vírus chrípky sa potvrdil u 19 zomrelých (76 %) na SARI. Ani jeden chorý, ktorý zomrel na SARI, nebol očkovaný proti chrípke. Z celkového počtu 74 prípadov SARI boli proti chrípke očkované tri osoby. Z uvedených 19 zomrelých s laboratórne dokázaným vírusom chrípky malo 14 osôb (75 %) potvrdený vírus chrípky typu A/California/7/2009 (H1N1)pdm09 – like (3). V kazuistike popisujeme prípad 30-ročného muža, ktorý po 27 dňovej hospitalizácii podľahol akútnemu respiračnému zlyhaniu v dôsledku postihnutia vírusom chrípky A/California/7/2009/(H1N1)pdm-like, ktoré bolo potvrdené DNA analýzou.
POPIS PRÍPADU
V danom prípade sa jednalo o 30-ročného muža, ktorý po štyroch dňoch nešpecifických prodromálnych symptómov v domácom prostredí bol prijatý na interné oddelenie pre vysoké teploty, bolesti kĺbov a svalov. Röntgenový nález pľúc, klinické a laboratórne prejavy multiorgánového zlyhávania hneď pri prijatí do nemocnice poukazovali na rozvíjajúcu sa akútnu respiračnú insuficienciu. V dôsledku veľmi rýchleho priebehu ochorenia bol pacient na piaty deň hospitalizácie preložený na oddelenie anesteziológie a intenzívnej medicíny, bol zaintubovaný a napojený na umelú pľúcnu ventiláciu. Ešte v ten istý deň ho transportovali do špecializovanej nemocnice, kde bolo pokračované v analgosedácii, relaxácii, nasadená bola antibiotická, antivirotická (oseltamavir - Tamiflu) a antimykotická liečba. Po preklade pacienta do špecializovanej nemocnice na piaty deň hospitalizácie bola zahájená terapia kortikoidmi, na ktorú však pacient počas svojej hospitalizácie v zmysle zlepšenia oxygenácie vôbec nereagoval. Pre potrebu dlhodobej umelej pľúcnej ventilácie bola na deviaty deň hospitalizácie vykonaná perkutánna dilatačná tracheostómia. Celkový stav pacienta sa postupne zhoršoval, došlo k výstupu septických teplôt so zhoršením auskultačného nálezu. Vyšetrenie počítačovou tomografiou (CT) potvrdilo obojstranné masívne postihnutie pľúcnych krídiel. Vzhľadom k pretrvávajúcemu zlému stavu nebolo možné vykonať opakované CT vyšetrenie, ani biopsiu pľúc. Aj napriek agresívnej ventilačnej liečbe pretrvávala refraktérna hypoxémia a pacient na 27. deň hospitalizácie v ranných hodinách zomrel. Celkový stav pacienta sa počas hospitalizácie nepodarilo zlepšiť ani zmenou jeho polohy (pronačná poloha), ktorá sa využíva u pacientov s akútnym pľúcnym poškodením. Pacient sa v minulosti neliečil na žiadne závažnejšie ochorenie v zmysle zápalového, onkologického alebo systémového postihnutia, ale posledné dva mesiace sa podroboval desenzibilizačnej liečbe (imunoterapii) pre alergiu na ambróziu. Na špecializovanom pracovisku regionálneho úradu verejného zdravotníctva bol pomocou PCR vyšetrenia dokázaný vírus chrípky A/California/7/2009/(H1N1)pdm-like. Pacient nebol očkovaný proti chrípke.
Pitva bola vykonaná v deň smrti. Pri vonkajšej obhliadke bola zistená obezita ľahkého stupňa (BMI 30,1) a ohraničené hojace sa zápalové defekty kože na tvári a bruchu. Najmarkantnejším vnútorným nálezom bolo postihnutie oboch pľúcnych krídiel (hmotnosť pravých pľúc 1256 g, ľavých pľúc 1202 g), s obojstranným hydrotoraxom (po 150 ml). Pľúca boli v celom rozsahu výrazne tuhé, nepoddajné, strakaté, pričom predné oblasti boli mierne povlečené povlakmi fibrínu (obr. 1). Na reznej ploche boli takmer v celom rozsahu tuhé, matné, nezvdušné, na tlak vytekalo iba minimálne množstvo nespenenej tekutiny. Makroskopicky nebolo prakticky možné nájsť areál pľúc normálnej konzistencie. Svetlo žltoružovým sfarbeným areálom lokalizovaným na povrchu pľúc zodpovedali na rezných plochách areály väzivového tkaniva, červenofialovým areálom oblasti recentného krvácania (obr. 2). Ďalej bola pri pitve zistená výrazná kongescia orgánov, hepatosplenomegália (pečeň 3624 g, slezina 406 g) a koncentrická hypertrofia ľavej komory srdca (494 g). Lymfatické uzliny boli bez zväčšenia. Mikroskopickým vyšetrením jednotlivých orgánov nebola zistené prítomnosť hematoonkologického ochorenia. Skúškou zistený pravostranný pneumotorax ľahkého stupňa sa na príčine smrti nepodieľal.
Obr. 1. Pohľad na predobočnú plochu pľúcnych krídiel. 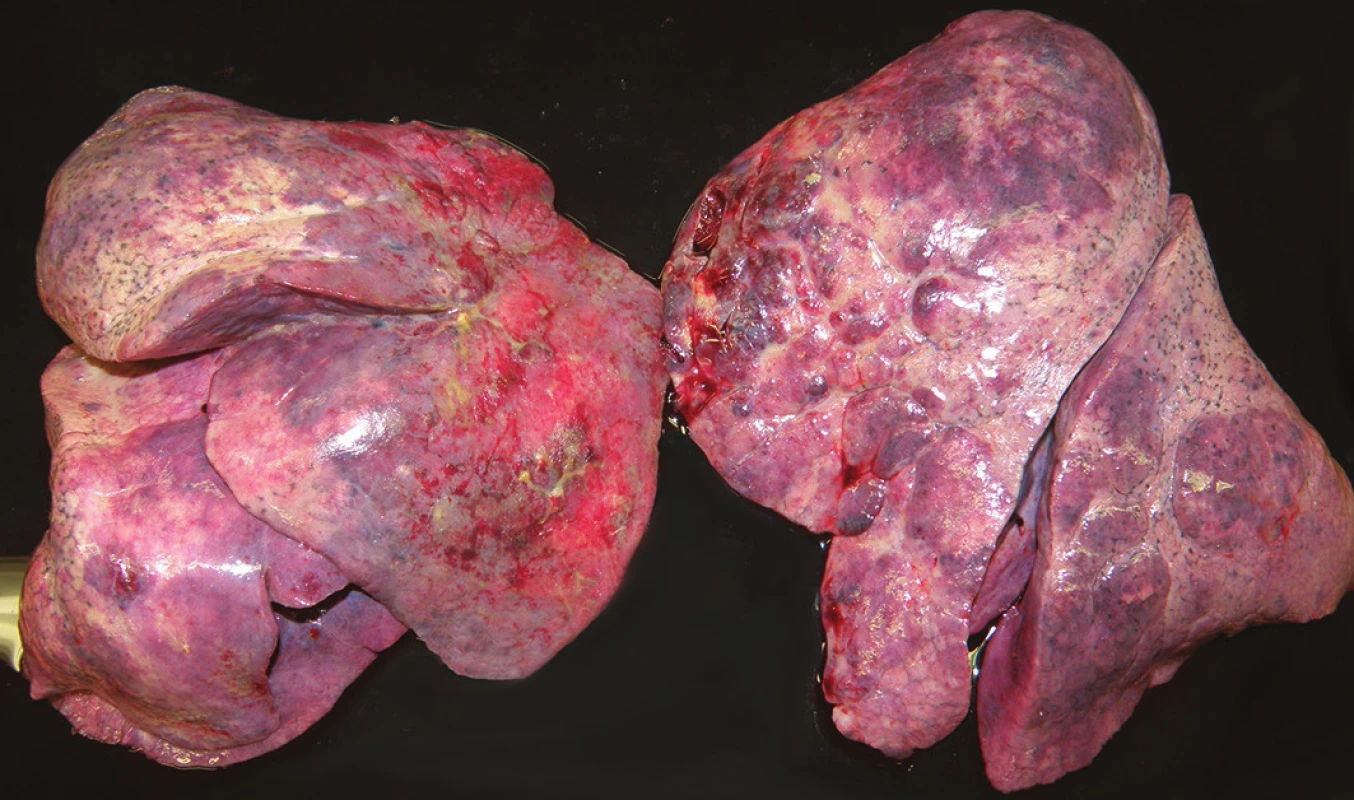
Obr. 2. Rezná plocha pľúcnych krídiel, kde žltoružové areály zodpovedajú fibróze. 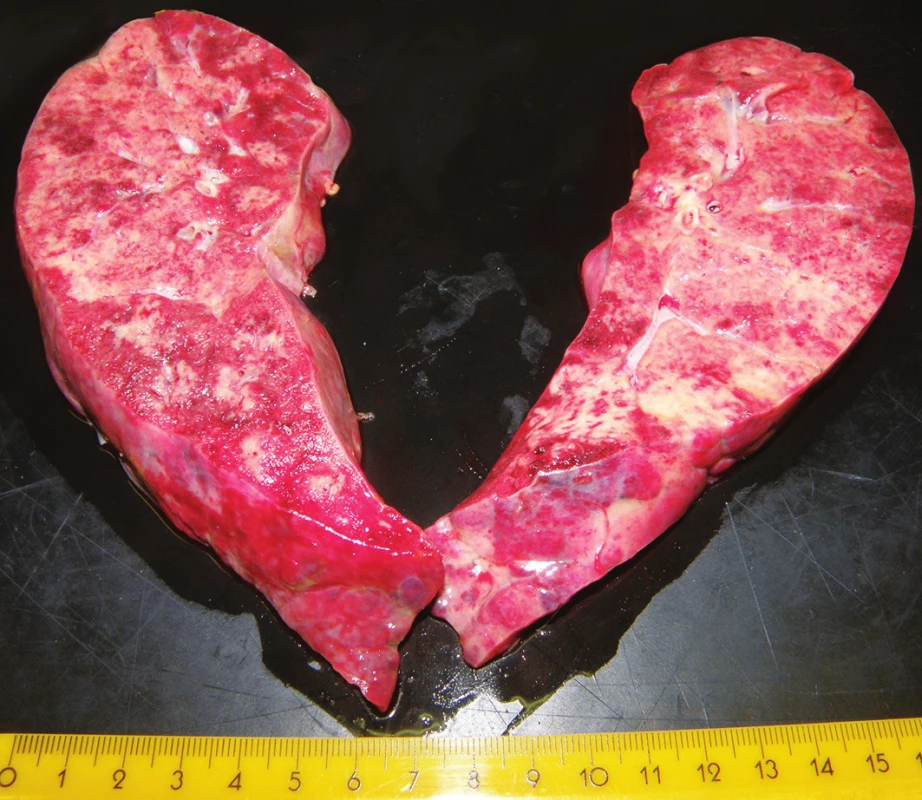
Mikroskopickým vyšetrením bola zistená výrazná polymorfia pľúcneho postihnutia charakteru akútneho pľúcneho poškodenia. Prítomné boli areály intraalveolárneho edému s ohraničenými recentnými pneumorágiami a hyalínnymi membránami v rôznej fáze rezorpcie so zápalovou reakciou (obr. 3), únik fibrínu do alveol, pričom tieto zmeny predstavovali akútne aj neskoré štádium difúzneho alveolárneho poškodenia. Sporadicky boli prítomné areály rozšírených alveolárnych sept podmienené fibrózou s hojným množstvom fibroblastov so zvýšenou lymfoplazmocytárnou infiltráciou interstícia (obr. 4), hyperregenerácia pneumocytov a počínajúca skvamózna metaplázia (obr. 5). Súbor týchto zmien je typický pre akútnu intersticiálnu pneumóniu. Najmarkantnejším a najdominujúcejším nálezom, ktorý prevládal takmer vo všetkých preparátoch boli intrabronchiolárne a intraalveolárne fibroblastické „zátky“ s kompletným alebo čiastočným vyplnením bronchiolárnych (obr. 6) a alveolárnych priesvitov (obr. 7) (tzv. Massonove telieska). Tieto zmeny sú charakteristické pre obraz organizujúcej sa pneumónie. Ložiskovo bolo nápadné zmnoženie penovitých makrofágov (miestami mnohojadrových), celkom ojedinele vaskulárne zmeny v zmysle proliferácie intimy (v iných orgánoch neprítomné) a trombózy periférnych ciev. Hematoxylín-eozínovým farbením, ako aj farbením na dôkaz kolagénu podľa van Giesona boli zistené areály pokročilej fibrotizácie, pričom v rozsiahlych oblastiach už nebolo možné rozpoznať pôvodné pľúcne tkanivo (obr. 8). Imunohistochemickým farbením na dôkaz prítomnosti laminínu, ako súčasti bazálnej membrány alveol, sme prevažne v areáloch s fibroblastickými zátkami zistili ložiskový výpadok jeho farbenia (obr. 9), v miestach s hyperregeneráciou pneumocytov bola jeho vizualizácia zachovaná tak, ako v ojedinelých intaktných oblastiach. Laminín bazálnej mebrány ciev v areáloch organizujúcej sa pneumónie a pokročilej fibrózy nebol prakticky prítomný. V areáloch s obrazom čerstvých krvácaní, hyalínnych membrán s nekrózou bol kompletný výpadok laminínu, tak v stenách alevol ako aj v cievach. Imunohistochemickým farbením pomocou protilátky Ki67 bola zistená zvýšená proliferačná aktivita takmer vo všetkých súčastiach pľúc (hyperregenerujúce pneumocyty, cylindrické bunky bronchiolov, fibroblasty zhrubnutých alveolárnych stien, endotel ciev) (obr. 10).
Obr. 3. Intraalveolárny edém s recentnými pneumorágiami a hyalínnymi membránami (hematoxylín-eozín, zväčšenie 40x). 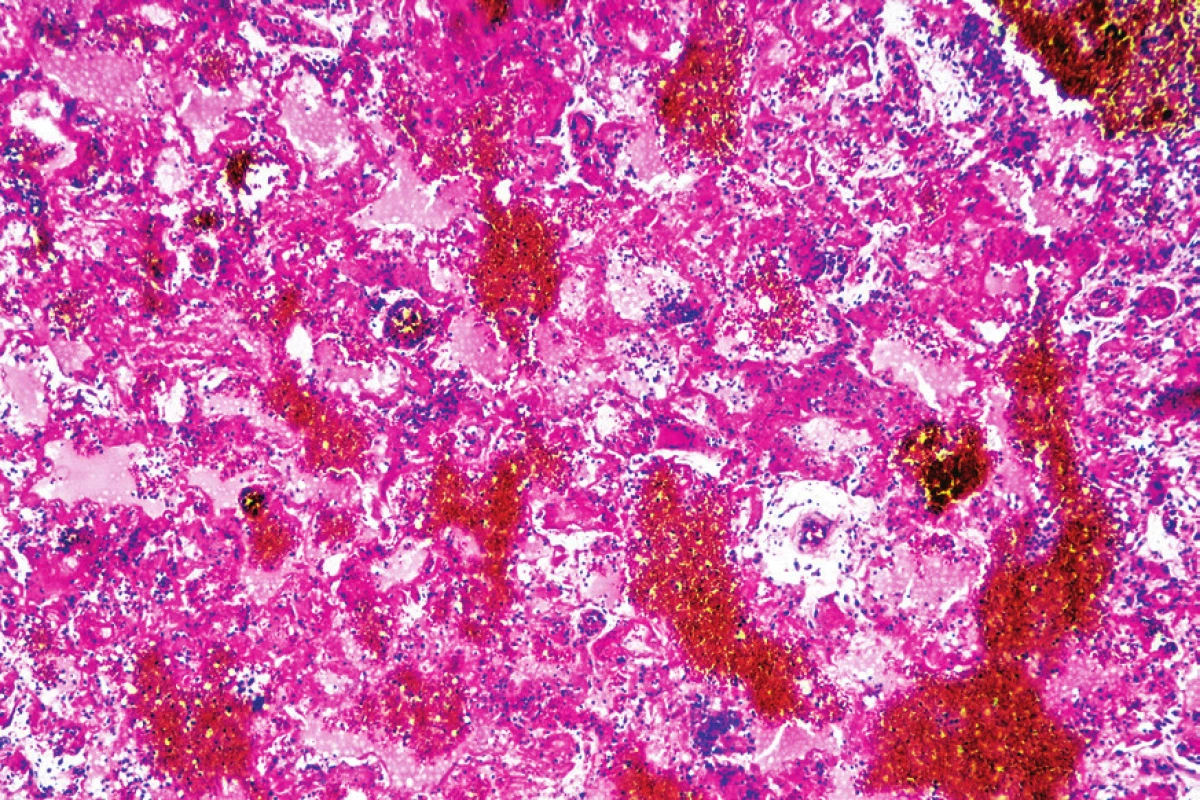
Obr. 4. Rozšírenie alveolárnych sept podmienené fibrózou s lymfoplazmocytárnou infiltráciou (hematoxylín-eozín, zväčšenie 100x). 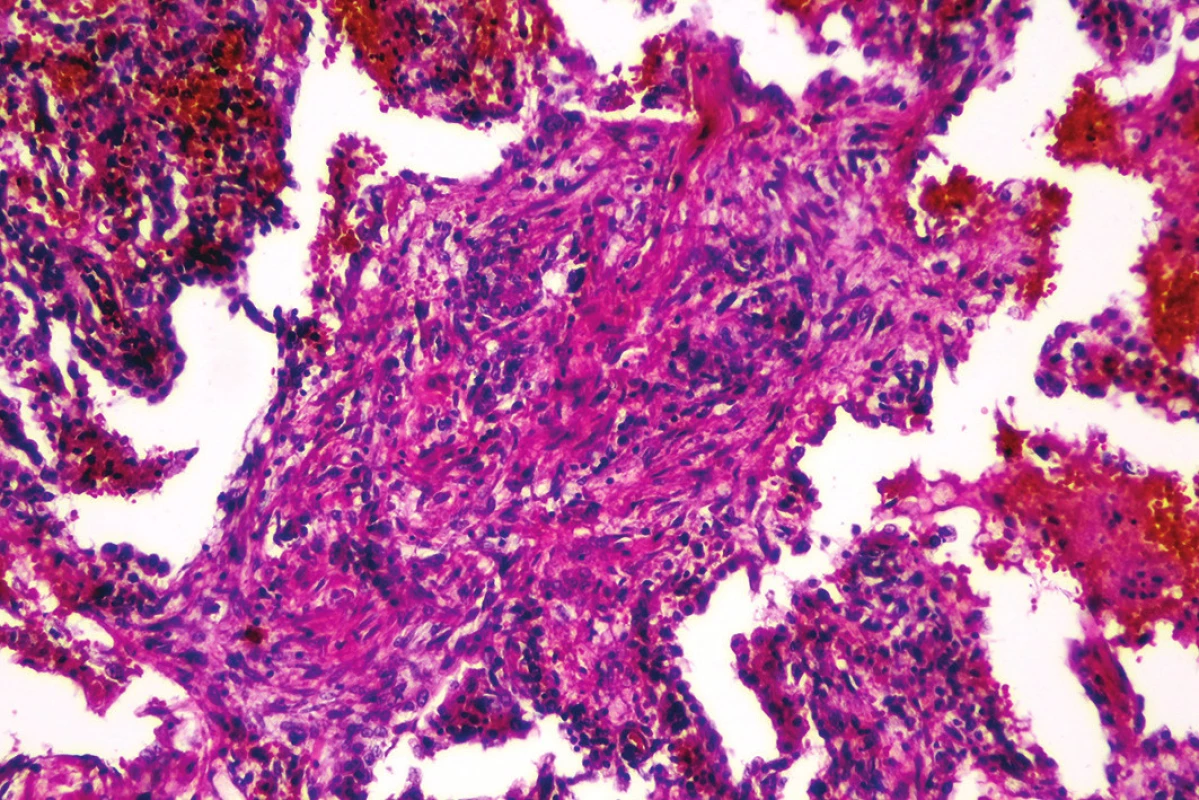
Obr. 5. Hyperregenerácia pneumocytov (hematoxylín-eozín, zväčšenie 100x). 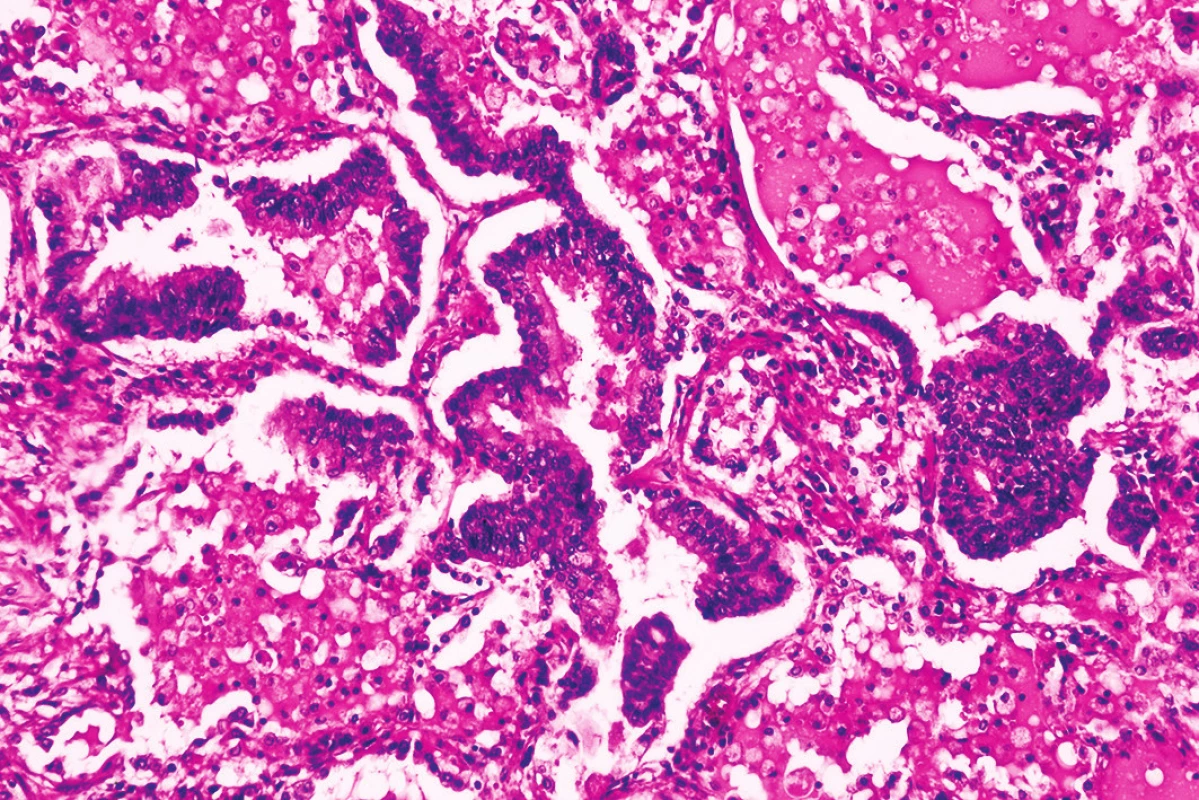
Obr. 6. Obraz obliterujúcej bronchiolitídy (hematoxylín-eozín, zväčšenie 100x). 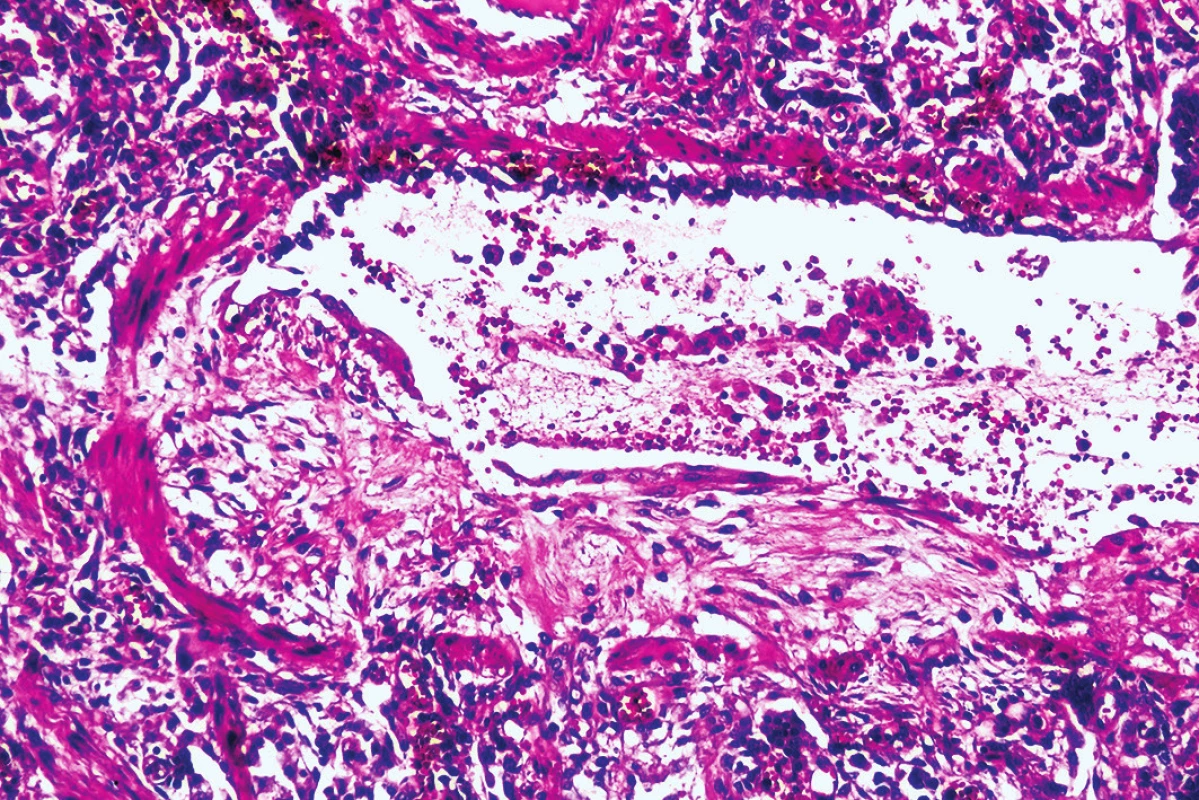
Obr. 7. Obraz organizujúcej sa pneumónie (tvz. Massonove teliesko) (hematoxylín-eozín, zväčšenie 100x). 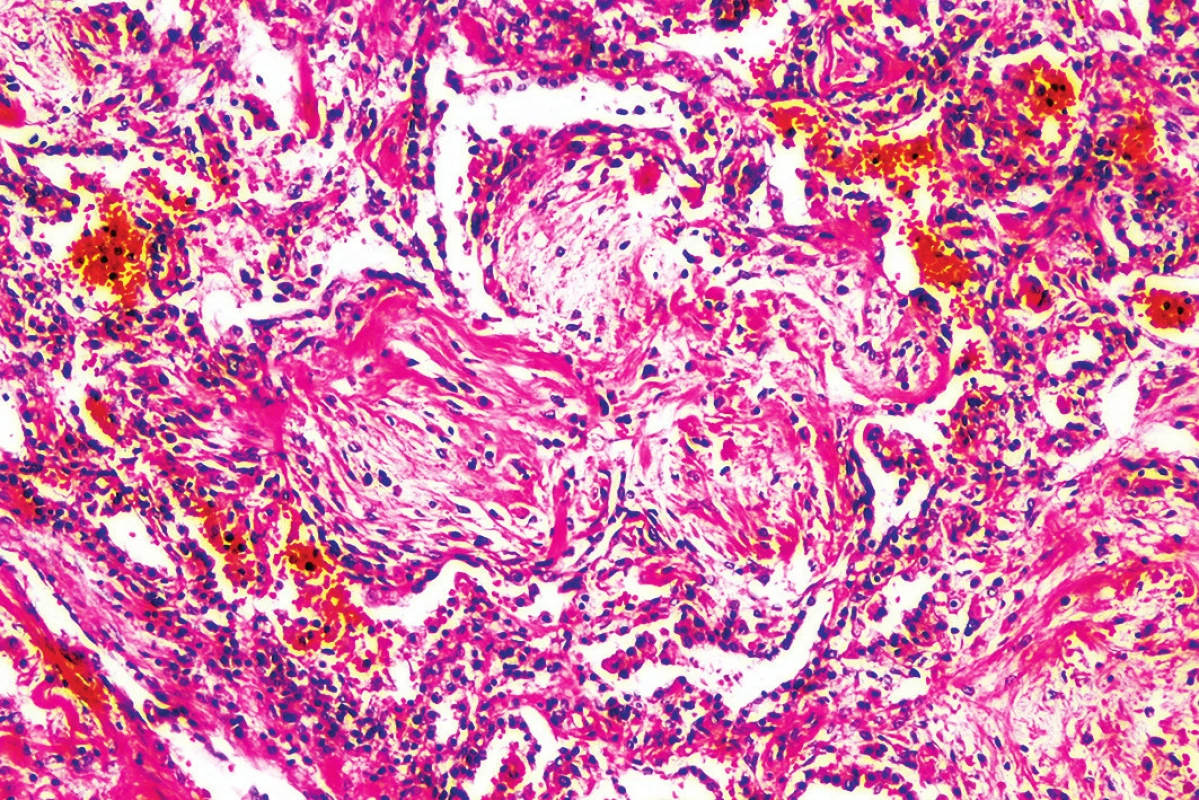
Obr. 8. Rozsiahle areály pľúcnej fibrózy (hematoxylín-eozín, zväčšenie 40x). 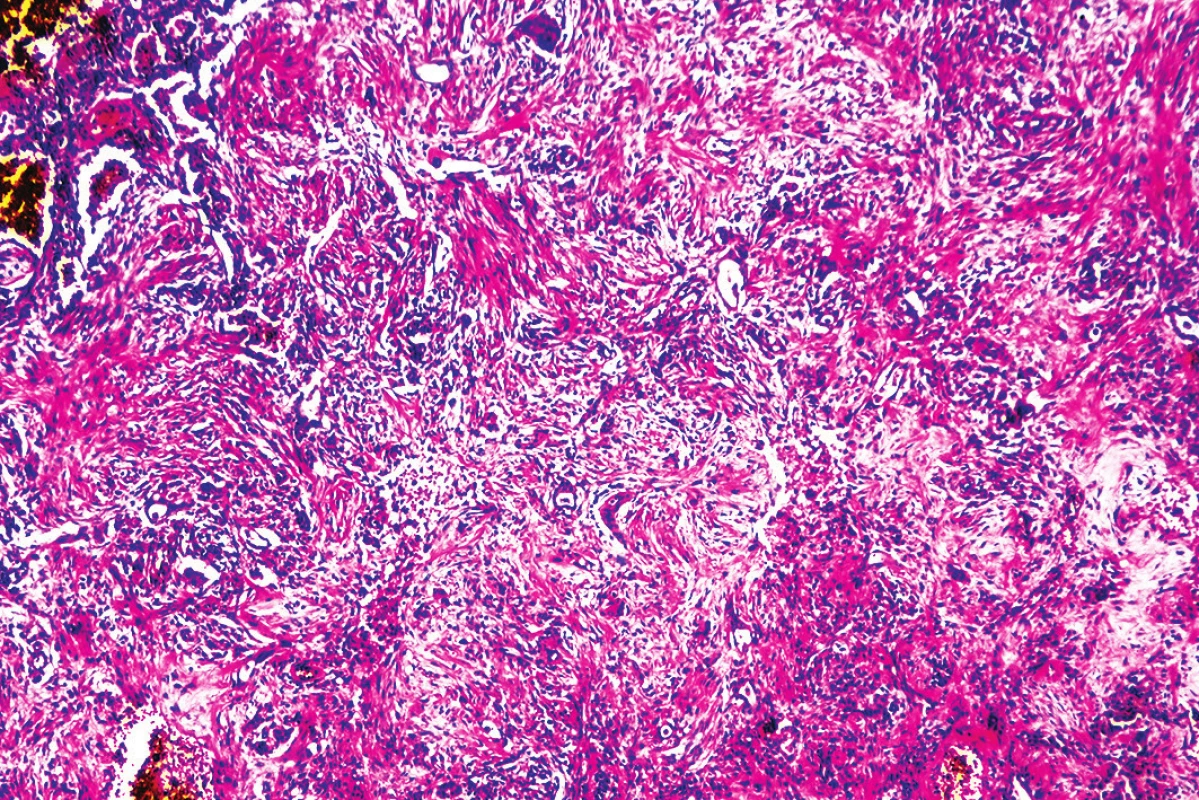
Obr. 9. Imunohistochemický dôkaz výpadku laminínu (šípky) v mieste organizujúcej sa pneumónie (imunohistochémia anti-laminin, zväčšenie 100x). 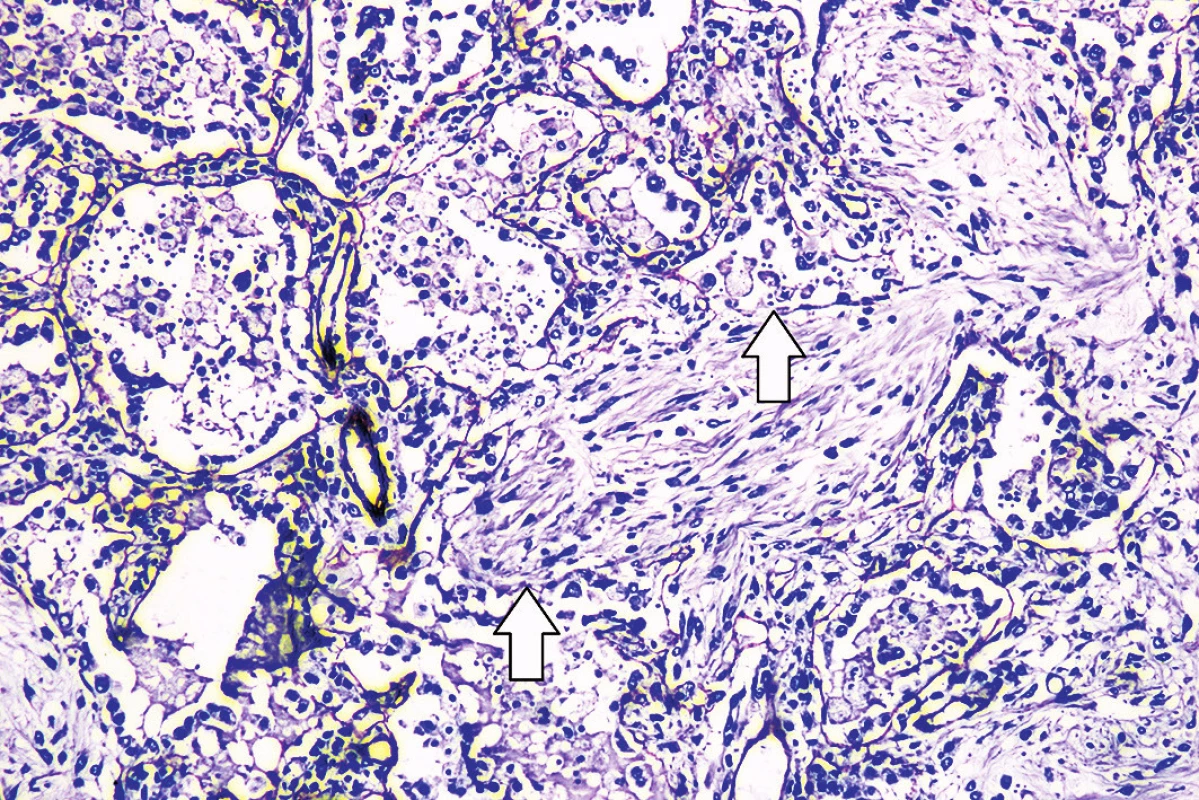
Obr. 10. Imunohistochemický dôkaz Ki-67 so zvýšenou proliferačnou aktivitou takmer vo všetkých súčastiach (imunohistochémia Ki-67, zväčšenie 100x). pľúc 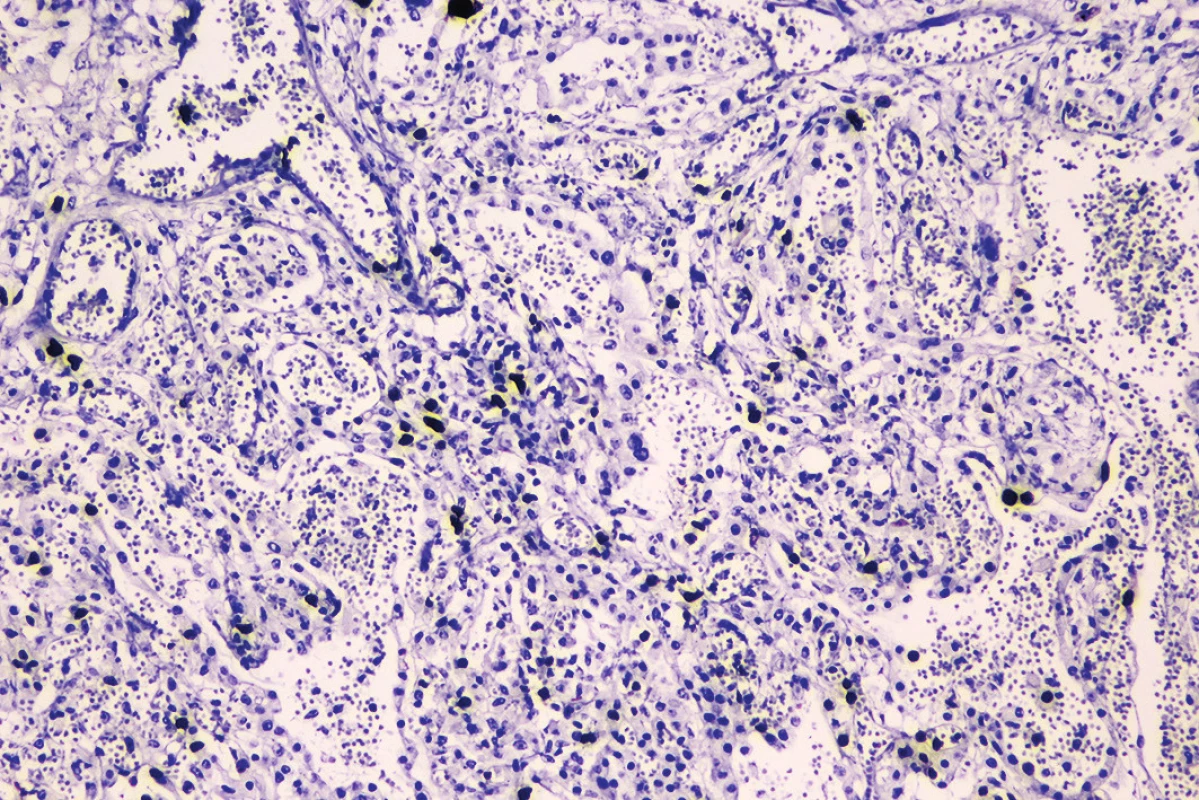
Bakteriálna superinfekcia dokazovaná pomocou špeciálnych farbení (Gram, Ziehl-Neelsen) nebola zistená. Taktiež nebola zistená prítomnosť plesní (farbenie PAS). V papilárnych svaloch ľavej komory myokardu boli hypoxické zmeny kardiomyocytov s leukocytárnym lemom.
Bezprostrednou príčinou smrti 30-ročného pacienta s 27 dňovou hospitalizáciou a s laboratórne potvrdenou chrípkovou A(H1N1) pneumóniou bolo respiračné zlyhanie pri komplexnom akútnom poškodení pľúc s prechodom do fibrózy.
DISKUSIA
V nami popisovanom prípade sa jednalo o chrípku vyvolanú vírusom chrípky typu A/California/7/2009 (H1N1)pdm09 – like u 30-ročného muža s miernou obezitou, ktorý tesne pred prepuknutím ochorenia bol na desenzibilizačnej terapii pre alergiu na ambróziu. Ochorenie malo klinicky výrazne rýchly a ťažký priebeh, ktorý si vyžiadal umelú pľúcnu ventiláciu. Ani napriek opakovane vykonávanej pronačnej polohe pacienta, extenzívnej liečbe antibiotikami, antivirotikom (oseltamavir - Tamiflu) a antimykotikami nedošlo k zlepšeniu celkového stavu. CT vyšetrenie pľúc potvrdilo obojstranne difúzne poškodenie pľúcneho tkaniva charakteru ARDS. Vzhľadom k celkovému zlému klinickému stavu nebolo možné u pacienta realizovať mimotelovú membránovú oxygenáciu tak, ako ju je možné indikovať a vykonať v klinicky priaznivejších prípadoch (4). Taktiež nebolo možné vykonať ďalšie CT vyšetrenie, respektíve pľúcnu biopsiu, ktorá však nepatrí k štandardným vyšetreniam u pacientov s ARDS. Klinický stav pacienta sa zhoršoval, došlo k výstupu septických teplôt so zhoršením auskultačného nálezu a pacient na 27. deň hospitalizácie v dôsledku pľúcneho postihnutia zomrel. V popisovanom prípade je možné uvažovať, že výrazne nepriaznivý a rýchly priebeh ochorenia mohol byť potencovaný imunologickým stavom v čase začatia vírusového ochorenia, v zmysle jeho deficiencie pre približne dva mesiace prebiehajúcu desenzibilizačnú liečbu pre alergiu na ambróziu. Vzhľadom k tomu, že počas takejto terapie dochádza k zmenám dôležitých imunologických mechanizmov a odpovedí (5), nie je možné vylúčiť, že to ovplyvnilo aj nepriaznivú odozvu a nežiadúcu odpoveď organizmu na virózu.
Najpozoruhodnejším nálezom z histopatologického hľadiska bolo postihnutie pľúcneho tkaniva. Extenzívnym vyšetrením pľúc sme zistili obraz osobitého výrazne ťažkého a difúzneho postihnutia charakteru akútneho pľúcneho poškodenia. Akútnym pľúcnym poškodením (acute lung injury – ALI) vo všeobecnosti rozumieme stav, ktorý vzniká ako následok akútneho poškodenia terminálnych dýchacích ciest (od niekoľkých dní po niekoľko týždňov). Hoci sú okolnosti vedúce k takýmto zmenám dýchacích ciest nešpecifické majú za následok relatívne charakteristický klinickopatologický kontext, akým sú difúzne alveolárne poškodenie (diffuse alveolar damage - DAD), akútna intersticiálna pneumónia (AIP, pôvodne Hammanov-Richov syndróm) a organizujúca sa pneumónia (OP) (6). Vo vyšetrenom prípade boli histologicky prítomné všetky tri druhy akútneho poškodenia pľúc (DAD, AIP, OP) v rôznej fáze rezorpcie s prevahou organizujúcej sa pneumónie. Veľmi premenlivý bol obraz reparácie a resorpcie zmien s miestami prominujúcou hyperregeneráciou pneumocytov. Tieto zmeny v konečnom dôsledku viedli k ireverzibilnej fibróze. Charakter postihnutia kolísal z jednej do druhej oblasti, celkovo bolo približne 10 % (DAD), 30 % (AIP) a 60 % (OP). S takýmto výrazne extenzívnym a polymorfným obrazom poškodenia pľúcneho parenchýmu, zahŕňajúcim všetky tri fenotypické typy poškodenia, sme sa na našom pracovisku za posledných mininálne 10 rokov v rámci nekroptickej činnosti nestretli ani raz, či sa už jednalo o postihnutie v dôsledku chorobného alebo úrazového poškodenia. DAD znamená, že sú poškodené prakticky všetky úseky alveol (epitélie, endotel a intersticiálna stróma), pričom medzi najčastejšie príčiny patria infekcie, inhalačná trauma, lieky, chemikálie, sepsa a šok.
Histologický obraz difúzneho alveolárneho poškodenia je neodlíšiteľný od postihnutia pri ARDS, ale klinicky AIP rovnako zodpovedá ARDS, pri ktorom nebola zistená príčina (7). Vo všeobecnosti však AIP ako súčasť akútneho pľúcneho poškodenia postihuje častejš mladších jedincov, ktorí boli zdraví. AIP má zo všetkých troch podjednotiek spadajúcich do akútneho pľúcneho poškodenia najhoršiu prognózu s mortalitou 70 % (6).
Zásadným histologickým znakom organizujúcej sa pneumónie je výskyt tzv. Massonovych teliesok, t.j. polypoidného fibromyxoidného tkaniva v bronchiálnych priesvitoch, v alveolárnych duktoch a v distálnych alveolách (7). Podobne ako pri DAD medzi najčastejšie príčiny organizujúcej sa pneumónie patria organizujúce sa infekcie, systémové ochorenia spojiva, lieky (8,9) a inhalácia toxických látok. Vzhľadom k tomu, že obraz organizujúcej sa pneumónie môže byť prítomný len lokálne napr. v okolí nádorov, granulómov, abscesov je nutné pri podozrení na túto jednotku vykonať histologické vyšetrenie všetkých lalokov pľúc. V prípadoch s histologickým obrazom OP kedy etiologické agens nie je známe, hovoríme o kryptogénnej organizujúcej sa pneumónii (COP)(10). Niektorí autori poukazujú na rozdielne klinické prejavy BOOP (dyspnoe, suchý kašeľ, teplota) a COP (dlhšie trvajúce symptómy pred stanovením diagnózy), avšak u oboch jednotiek poukazujú na dobrú klinickú odpoveď pri liečbe kortikoidmi, alebo po prerušení podávania poškodzujúcej noxy (11), naviac, histopatologický obraz charakterizuje OP. V popísanej kazuistike sa jednalo o prípad, ktorý svojím klinickým obrazom (rapídne rýchlo vzniknuté dyspnoe s dlhotrvajúcou hypoxémiou a febrilitami) spadal do obrazu BOOP pri chrípkovom postihnutí. Obraz organizujúcej sa pneumónie pri postihnutí vírusom chrípky A (H1N1) bol popísaný vo viacerých prácach, pričom aj napriek mnohým kontroverziám bol v niektorých prípadoch v liečbe úspešne použitý metylprednizolón (12-14). V popísanom fatálnom prípade boli v liečbe použité aj kortikoidy, ale bez akéhokoľvek zlepšenia zdravotného stavu. To si vysvetľujeme simultánnou prítomnosťou všetkých troch fenotypov akútneho pľúcneho poškodenia s prechodom do ireverzibilnej fibrózy. So zreteľom na to, že k rozvoju organizujúcej sa pneumónie môže dôjsť aj po niekoľkotýždňovom období bez zjavných zdravotných problémov je nutné myslieť na túto jednotku nielen ako možnú povírusovú, ale tiež liečebnú komplikáciu nielen pri klinickom hodnotení stavu pacienta, ale aj v rámci diferenciálnej diagnostiky (13) pri výkone pitiev. Pri niektorých prípadoch akútneho pľúcneho poškodenia sa za diagnostickým účelom indikuje vykonanie pľúcnej biopsie (12), takže obraz hyperregenerácie pneumocytov ako je videný v tejto kazuistike v rámci akútneho pľúcneho poškodenia môže vo vyšetrovaných vzorkách veľmi ľahko imitovať obraz nádoru. Z tohto dôvodu do diagnostického spektra je nutné zahrnúť nielen malígne nádorové procesy, ale aj nenádorové zmeny vyskytujúce sa pri akútnom pľúcnom vyšetrení. Obraz takejto hyperregenerácie a takejto extenzívnej fibrózy nebol popísaný ani v doposiaľ najrozsiahlejšom súbore s histopatologickým rozborom nálezov u 8. pacientov s chrípkovou (H1N1) pneumóniou (4) v Čechách a na Slovensku. V súlade s literárnymi údajmi o poškodení alveolárnej bazálnej membrány pri difúznom alveolárnom poškodení (15), aj náš prípad pri imunohistochemickom vyšetrení vykazoval v areáloch s obrazom hyalínnych membrán ložiskový výpadok laminínu, tak v stenách alveol ako aj v cievach. Laminín bazálnej mebrány alveol a ciev v areáloch organizujúcej sa pneumónie a pokročilej fibrózy bol buď ložiskovo alebo kompletne neprítomný.
Vzhľadom k tomu, že pri vykonávaní pitiev nie je možné vylúčiť to, že sa napriek obsiahlym anamnestickým údajom, histologickým a genetickým vyšetreniam, stretneme s obrazom nevysvetliteľnej fibrózy pľúc je nutné myslieť aj na to, že fibróza môže byť následkom predchádzajúceho neúmyselného alebo vedomého toxikologického poškodenia pri trestnom čine (16,17). Z tohto dôvodu je v prípadoch podozrenia vhodné zabezpečiť nielen väčšie množstvo fixovaného, ale aj nefixovaného materiálu pľúc.
ZÁVER
V kazuistike sme prezentovali prípad 30 ročného, proti chrípke neočkovaného muža s výrazne variabilným akútnym poškodením pľúc pri chrípke typu A(H1N1), ktorá bola počas života dokázaná PCR metódou. V popísanom prípade boli histologicky prítomné vzácne všetky tri druhy akútneho poškodenia pľúc (DAD, AIP, OP) v rôznej fáze rezorpcie s prevahou organizujúcej sa pneumónie, ktoré v konečnom dôsledku viedli k ireverzibilnej fibróze pľúc a tým aj k smrti na 27. deň hospitalizácie pod klinickým obrazom respiračného zlyhania. Prítomná bola výrazná hyperregenerácia pneumocytov, ktorá do istej miery napodobňovala nádorovú proliferáciu.
PREHLÁSENIE
Autor práce prehlasuje, že v súvislosti s témou, vznikom a publikaciou tohto článku nie je v konflikte záujmov a vznik ani publikácia članku neboli podporene žiadnou farmaceutickou firmou. Toto prehlásenie sa týka i všetkych spoluautorov.
Adresa pre korešpondenciu:
MUDr. Daniel Farkaš, PhD.
Úrad pre dohľad nad zdravotnou starostlivosťou
SLaPA pracovisko Košice
Letná 47,
041 01 Košice
tel.: +421552852660
e-mail: farkas.dany@gmail.com
Zdroje
1. Perez-Padilla R, de la Rosa-Zamboni D, Ponce de Leon S, et. Al. INER Working Group on Influenza. Pneumonia and respiratory failure from swine-origin influenza A (H1N1) in Mexico. N Engl J Med 2009; 361 : 680–689.
2. Pandemic (H1N1) 2009 - update 81 http://www.who.int/csr/don/2009_12_30/en/
3. Vyhodnotenie chrípkovej sezóny 2014/2015 v Slovenskej republike http://www.uvzsr.sk/docs/info/epida/Vyhodnotenie_chripkovej_sezony_2014_2015.pdf
4. Skálová H, Povýšil C, Hofmanová J, Goldová B, Jakša R, Jandová K, Galko J. Histopathological autoptic findings in 8 patients with pandemic influenza A (H1N1) pneumonia. Cesk Patol 2012; 48(3): 161-164.
5. Petrů V. Postavení specifické alergenové imunoterapie v léčbě alergií Remedia 2007; 17 : 21–25.
6. Weidner N, Cote RJ, Suster S, Weiss LM. Modern Surgical Pathology (2nd ed.). Saunders, Elsevier 2009 : 409-414.
7. Vašáková M, Polák J, Matěj R. Intersticiální plícní procesy. Praha: Maxdorf ; 2011 : 77-161.
8. Banka R, Ward MJ. Bronchiolitis obliterans and organising pneumonia caused by carbamazepine and mimicking community acquired pneumonia. Postgrad Med J 2002; 78 : 621-622.
9. Taus-García A, Sánchez-Font A, Servitja-Tormo S, Pijuan L, Maiques-Llácer JM, Curull V. Organizing pneumonia associated with the use of trastuzumab. Arch Bronconeumol 2010; 46(8): 442-444.
10. Cordier JF. Cryptogenic organising pneumonia. Eur Respir J 2006; 28(2): 422-446.
11. Vasu TS, Cavallazzi R, Hirani A, Sharma D, Weibel SB, Kane GC. Clinical and Radiologic Distinctions Between Secondary Bronchiolitis Obliterans Organizing Pneumonia and Cryptogenic Organizing Pneumonia. Respir Care 2009; 54(8): 1028 –1032.
12. Cornejo R, Llanos O, Fernández C, et al. Organizing pneumonia in patients with severe respiratory failure due to novel A (H1N1) influenza. BMJ Case Rep 2010; 2010: bcr0220102708.
13. Torrego A, Pajares V, Mola A, Lerma E, Franquet T. Influenza A (H1N1) organising pneumonia. BMJ Case Rep 2010; 2010: bcr1220092531.
14. Brun-Buisson C, Richard JC, Mercat A, Thiébaut AC, Brochard L; REVA-SRLF A/H1N1v 2009 Registry Group. Early corticosteroids in severe influenza A/H1N1 pneumonia and acute respiratory distress syndrome. Am J Respir Crit Care Med 2011; 183(9): 1200-1206.
15. Matsubara O, Tamura A, Ohdama S, Mark EJ. Alveolar basement membrane breaks down in diffuse alveolar damage: an immunohistochemical study. Pathol Int 1995; 45(7): 473-482.
16. Dinis-Oliveira RJ, Duarte JA, Sánchez-Navarro A, Remião F, Bastos ML, Carvalho F. Paraquat poisonings: mechanisms of lung toxicity, clinical features, and treatment. Crit Rev Toxicol 2008; 38(1): 13-71.
17. Emsley J. Molecules of Murder. Criminal Molecules and Classic Cases. RSC Publishing, Cambridge, UK; 2008 : 187-188.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článek Jaká je Vaše diagnóza?Článek Jaká je Vaše diagnóza?
Článok vyšiel v časopiseČesko-slovenská patologie

2017 Číslo 1-
Všetky články tohto čísla
-
Novinky vo WHO klasifikácii nádorov centrálneho nervového systému 2016
– 1. časť: Difúzne infiltrujúce gliómy -
Novinky ve WHO klasifikaci nádorů centrálního nervového systému 2016
2. část: Embryonální nádory CNS a ostatní skupiny nádorů (kromě difúzních gliomů) - MONITOR aneb nemělo by Vám uniknkout, že...
- Familiární hemofagocytující lymfohistiocytóza: od autopsie k prenatální diagnóze. Kazuistika
- Novinky ve WHO klasifikaci nádorů CNS 2016
- Sebaceozní adenom vzniklý ve zralém cystickém teratomu ovária. Kazuistika
- Neobvyklý histopatologický obraz akútneho poškodenia pľúc v rôznej fáze rezorpcie s prevahou organizujúcej sa pneumónie u jedinca s chrípkou A(H1N1)
- Rozhovor s novým předsedou výboru naší odborné společnosti
- Pitva šlechtice Melchiora z Redernu roku 1600 v Německém Brodu
- Jaká je Vaše diagnóza?
- 90. životní jubileum prof. MUDr. Rostislava Koďouska, DrSc.
- Jaká je Vaše diagnóza?
- MONITOR aneb nemělo by Vám uniknout, že...
-
Novinky vo WHO klasifikácii nádorov centrálneho nervového systému 2016
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle-
Novinky vo WHO klasifikácii nádorov centrálneho nervového systému 2016
– 1. časť: Difúzne infiltrujúce gliómy -
Novinky ve WHO klasifikaci nádorů centrálního nervového systému 2016
2. část: Embryonální nádory CNS a ostatní skupiny nádorů (kromě difúzních gliomů) - Neobvyklý histopatologický obraz akútneho poškodenia pľúc v rôznej fáze rezorpcie s prevahou organizujúcej sa pneumónie u jedinca s chrípkou A(H1N1)
- Sebaceozní adenom vzniklý ve zralém cystickém teratomu ovária. Kazuistika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



