-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Novinky vo WHO klasifikácii nádorov centrálneho nervového systému 2016
– 1. časť: Difúzne infiltrujúce gliómy
Update on the 2016 WHO classification of tumors of the central nervous system
– Part 1: Diffusely infiltrating gliomasRevised WHO 2016 classification of tumors of the central nervous system (CNS) incorporates for the first time genetic information in addition to morphology for classification of many tumor entities. One of the most important changes is restructuring the chapter of diffuse gliomas. Based on shared genetic driver mutations, diffusely infiltrating astrocytomas and oligodendrogliomas are now classified together, separately from “other” glial tumors with a more circumscribed growth pattern, different pathogenesis and clinical outcome. Diffuse gliomas can now be more objectively diagnosed and further prognostically stratified by use of a relatively small number of markers (ATRX and IDH1/2 mutations and del 1p/19q). Another newly genetically-defined and clinically relevant entity is diffuse midline glioma, H3 K27M-mutant. Some glioma entities, variants and growth patterns were deleted and new variants, such as epithelioid glioblastoma and glioblastoma with a primitive neural component were added. In the article, the most important changes of diffuse gliomas classification are summarized and a practical diagnostic approach is illustrated.
Keywords:
astrocytoma – oligodendroglioma – glioblastoma – classification – IDH – ATRX
Autori: Marián Švajdler 1,2; Boris Rychlý 3; Josef Zámečník 4; Peter Švajdler 5
Pôsobisko autorov: Šiklův ústav patologie, Univerzita Karlova v Praze, Lékařská fakulta v Plzni a Fakultní nemocnice Plzeň, Česká republika 1; Bioptická laboratoř, s. r. o., Plzeň, Česká republika 2; Cytopathos s. r. o., Bratislava, Slovenská republika 3; Ústav patologie a molekulární medicíny 2. lékařské fakulty UK a FN v Motole, Praha, Česká republika 4; Oddelenie patológie, Univerzitná nemocnica Louisa Pasteura, Košice, Slovenská Republika 5
Vyšlo v časopise: Čes.-slov. Patol., 53, 2017, No. 1, p. 12-21
Kategória: Přehledový článek
Súhrn
Revidovaná WHO 2016 klasifikácia nádorov centrálneho nervového systému (CNS) historicky po prvý krát používa na klasifikáciu mnohých typov nádorov CNS okrem morfológie aj genetické informácie. Jednou z najhlavnejších zmien je reštrukturalizácia kapitoly difúznych gliómov. Na základe spoločných genetických mutácií sú difúzne astrocytómy a oligodendrogliómy klasifikované v rámci jednej skupiny nádorov, oddelene od „ostatných“ gliómov s ohraničeným spôsobom rastu, ktoré majú odlišnú patogenézu a prognózu. V rámci skupiny difúznych gliómov možno vyšetrením relatívne malého panelu markerov (mutácia ATRX a IDH1/2, del 1p/19q) tieto nádory objektívnejšie diagnostikovať a prognosticky stratifikovať. Ďalšou klinicky dôležitou novou jednotkou, ktorá je definovaná geneticky, sú difúzne „midline“ gliómy s mutáciou K27M v génoch histónu H3. Niektoré entity, varianty a rastové vzory difúznych gliómov boli zrušené a naopak, boli pridané dve varianty glioblastómu - epiteloidný glioblastóm a glioblastóm s primitívnou neurálnou zložkou. V článku sumarizujeme najdôležitejšie zmeny v klasifikácii difúznych gliómov a ilustrujeme praktický postup pri diagnostike tejto skupiny nádorov.
Kľúčové slová:
astrocytóm – oligodendroglióm – glioblastóm – klasifikácia – IDH – ATRX
Začiatkom roka 2016 bola vydaná nová WHO klasifikácia nádorov centrálneho nervového systému (CNS) (1). Formálne sa nejedná o úplne nové (tj. piate) vydanie klasifikácie, ale ide o významnú revíziu predchádzajúceho štvrtého vydania (2). Hlavnou motiváciou na revíziu klasifikácie sú výrazné pokroky v oblasti molekulovej patológie, ktoré významne prispeli k lepšiemu poznaniu onkogenézy mnohých typov nádorov CNS. Tieto poznatky sú tak zásadné, že viaceré nádorové jednotky sú v revidovanej klasifikácii definované na základe kombinácie morfologických a genetických charakteristík. Ide teda o historicky prvú histologicko-genetickú klasifikáciu nádorov CNS, po vzore klasifikácie hematologických malignít (3). V porovnaní s tradičnou klasifikáciou založenou na samotnej histomorfológii by malo používanie genetických informácií viesť k presnejšej a objektívnejšej klasifikácii niektorých typov nádorov, lepšej prognostickej stratifikácii a v mnohých prípadoch aj k detekcii potenciálnych terapeutických cieľov. Vo výsledku by používanie novej klasifikácie malo slúžiť pri dizajnovaní a hodnotení úspešnosti klinických štúdií s konvenčnými ako aj experimentálnymi typmi liečby a zlepšiť prežívanie pacientov s primárnymi nádormi CNS.
Príprave samotnej publikácie predchádzalo stretnutie úzkej 35-člennej pracovnej skupiny v júni 2015 v Heidelbergu v Nemecku. Ešte predtým sa však v máji 2014 v Haarleme v Holandsku pod záštitou International Society of Neuropathology (ISN) konalo stretnutie pod názvom „WHO’s Next?: A Colloquium to Guide Next Steps in Brain Tumor Classification and Grading (4). Cieľom stretnutia bolo odpovedať na otázku akým spôsobom začleniť molekulárno-genetické informácie do novej klasifikácie nádorov CNS. Najdôležitejšie odporúčania z tohto stretnutia bolo možné zhrnúť následovne:
- (i) diagnostické jednotky by mali byť definované čo najpresnejšie/najužšie, aby sa optimizovala reprodukovateľnosť, prediktívna hodnota a terapeutické plánovanie;
- (ii) určiť či je pre definíciu konkrétnych nádorových jednotiek genetická informácia povinná, odporúčaná alebo nepotrebná a stanoviť optimálne poradie testov pre čo najväčšiu efektivitu;
- (iii) genetický reporting by mal byť štandardizovaný, pričom pri niektorých genetických testoch (napr. detekcia kodelécie 1p/19q) by mala byť doporučená preferovaná metodika;
- (iv) samotná diagnóza by mala byť štruktúrovaná vo viacerých vrstvách: „integrovaná“ morfologicko-genetická diagnóza v prvom riadku, pod ktorou by v ďalších riadkoch mala nasledovať histologická diagnóza, WHO grade a genetická informácia;
- (v) pre každú nádorovú jednotku by malo existovať doporučenie pre situácie, kedy je vhodné vysvetlenie/spresnenie informácie o gradingu (napr. v prípade IDH-mutovaného glioblastómu môže byť formálny grade IV zavádzajúci, vzhľadom na očakávaný lepší klinický priebeh);
- (vi) stanoviť spôsob akým reportovať nádory s typickou histomorfológiou, ktoré nemajú očakávané genetické charakteristiky a naopak, ako reportovať nádory, ktoré majú genetické aberácie definujúce jeden typ nádoru ale histologický vzhľad iného typu nádoru;
- (vii) formálne oddeliť niektoré pediatrické nádory od histologicky podobných tumorov u dospelých (4).
Možno skonštatovať, že väčšina týchto doporučení bola v novej klasifikácii splnená. Niektoré doporučenia však naplnené neboli. WHO 2016 napr. neodporúča konkrétne diagnostické metódy a rozhodnutie viacmenej ponecháva na skúsenosti/preferencie diagnostikujúceho patológa alebo genetika. Niektoré doporučenia si takmer okamžite vyslúžili kritiku, s ktorou môžeme v niektorých bodoch iba súhlasiť (5). Napríklad, štruktúra diagnostických záverov s „integrovanou“ morfologicko-genetickou diagnózou v prvom riadku nekorešponduje s prirodzeným poradím diagnostických krokov: prvým krokom je histomorfologická diagnóza (príp. diferenciálna diagnóza) na základe zhodnotenia hematoxylín-eozínových preparátov, ďalej zvyčajne nasleduje imunohistochemické vyšetrenie a až po ňom je vykonaná genetická analýza (ktorá môže trvať aj niekoľko dní). Integrácia všetkých výsledkov do finálnej diagnózy je až záverečným krokom. Vážnou výhradou je, že neboli navrhnuté objektívne kritériá na výber genetických markerov, ktoré by mali byť použité pri tvorbe klasifikácie (5).
V prvej časti prehľadu zmien vo WHO klasifikácii nádorov CNS sa budeme venovať difúznym gliovým nádorom (astrocytómom a oligodendrogliómom), ktoré reprezentujú najväčšiu skupinu primárnych intraaxiálnych nádorov CNS. Zmenám v klasifikácii „špeciálnych“ typov astrocytómov, ependymómov, meduloblastómov a ďalších typov embryonálnych nádorov, meningeómov, hemangiopericytómov a nádorov periférnych nervov sa venuje ďalší článok v tomto čísle časopisu.
KLASIFIKÁCIA DIFÚZNYCH ASTROCYTÓMOV A OLIGODENDROGLIÓMOV
Zásadnou konceptuálnou zmenou v klasifikácii WHO 2016 je nové usporiadanie skupín gliových nádorov. V predchádzajúcej klasifikácii boli všetky astrocytové nádory klasifikované spoločne v rámci jednej skupiny. Oligodendrogliómy a oligoastrocytómy tvorili ďalšiu samostatnú skupinu gliových nádorov (2). V skupine astrocytómov teda boli spoločne klasifikované nádory s výraznými odlišnosťami v epidemiológii, patogenéze, spôsobe liečby a prognóze. Patrili tu jednak difúzne astrocytómy (grade II - IV; s všeobecne horšou prognózou) ako aj „špeciálne“ typy astrocytómov (grade I - II; pilocytický/pilomyxoidný astrocytóm, pleomorfný xantoastrocytóm, subependymálny obrovskobunkový astrocytóm), ktoré majú vďaka ohraničenému spôsobu rastu výrazne lepšiu prognózu (2). V novej klasifikácii sú v rámci jednej skupiny spoločne klasifikované všetky difúzne infiltrujúce gliómy, t.j. astrocytómy spolu s oligodendrogliómami a miznúcou jednotkou oligoastrocytóm. Definujúcim znakom, okrem infiltratívneho spôsobu rastu, je spoločná onkogénna („driver“) mutácia v génoch IDH1 alebo IDH2 (izocitrát dehydrogenáza), ktorá je prítomná prakticky vo všetkých oligodendrogliómoch s kodeléciou 1p/19q a veľkej časti (až do ~70 %) difúznych a anaplastických astrocytómov a v tzv. sekundárnych glioblastómoch (6-8) (obr. 1). Fakt, že mutácie v génoch IDH1/2 sú prítomné v astrocytómoch aj v oligodendrogliómoch, poukazuje na ich pôvod v spoločnej prekurzorovej bunke. Výsledný fenotyp IDH-mutovaného gliómu (astrocytóm versus oligodendroglióm), je závislý od ďalších, navzájom takmer exkluzívnych genetických aberácií. Pre IDH-mutované astrocytómy je charekteristická mutácia ATRX (a-thalassemia/mental retardation syndrome X-linked) a TP53 a pre oligodendrogliómy del 1p/19q a mutácie génov CIC (homológ capicua génu u drozofíl), FUBP1 (Far upstream element binding protein) a TERT (telomerase reverse transcriptase) (9,10).
Obr. 1. Zastúpenie IDH-pozitívnych a IDH negatívnych astrocytómov v súbore 326 pacientov vyšetrených na Oddelení patológie Univerzitnej nemocnice L. Pasteura v Košiciach a v Cytopathos s.r.o. Bratislava (2013-2016). Mutácie <em>IDH1/2</em> sa vyskytujú u väčšej časti difúznych astrocytómov a sú vzácne v glioblastómoch (väčšinou tzv. sekundárnych) <b>(A)</b>. Distribúcia IDH-pozitivity podľa histologického grade a veku <b>(B)</b>. 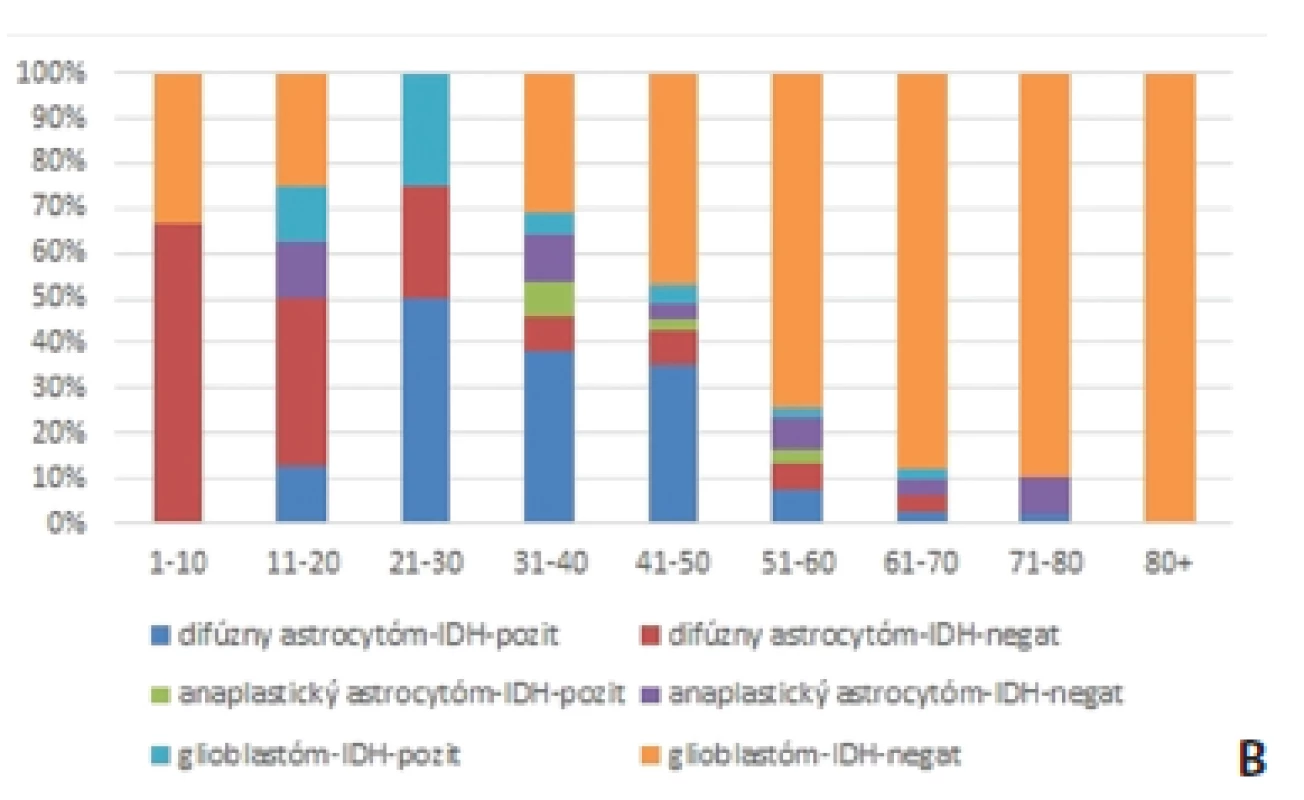
V novej klasifikácii kategória difúznych gliómov teda zahŕňa IDH-mutované a IDH-wildtype difúzne a anaplastické astrocytómy, oligodendrogliómy s IDH-mutáciou a del 1p/19q (grade II a III), IDH-wildtype a IDH-mutované glioblastómy a novú kategóriu gliómov prevažne detského veku – „Diffuse midline glioma, H3 K27M–mutant” (tab.1).
Tab. 1. WHO 2016 klasifikácia difúzne infiltrujúcich gliových nádorov (1). 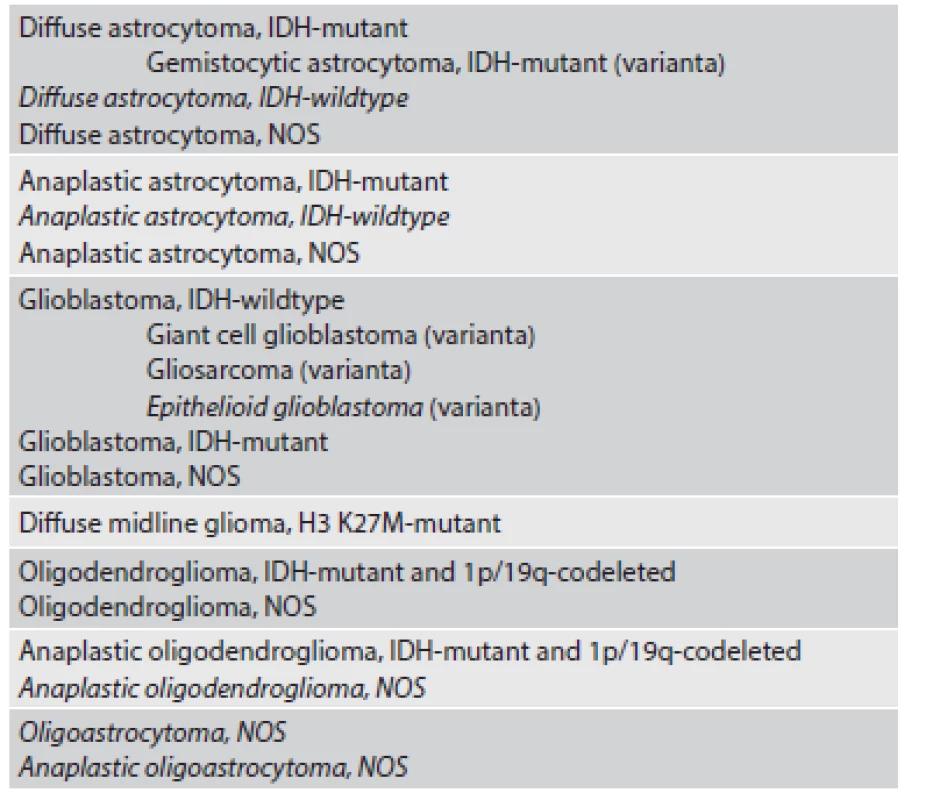
*Jednotky vyznačené kurzívou sú považované za provizórne. Spoločnou klasifikáciou infiltrujúcich astrocytómov a oligodendrogliómov bola vytvorená pomerne homogénna skupina nádorov, v rámci ktorej možno vyšetrením relatívne malého panelu markerov tieto nádory spoľahlivo klasifikovať a ďalej prognosticky stratifikovať (viď nižšie). Astrocytómy, ktoré rastú ohraničene, nemajú IDH mutácie a majú často alterácie zahŕňajúce gén BRAF (pilocytický/pilomyxoidný astrocytóm, pleomorfný xantoastrocytóm) alebo TSC1/2 (subependymálny obrovskobunkový astrocytóm) sú klasifikované samostatne, v skupine ostatných astrocytómov („Other astrocytic tumours“) (1).
NÁZVOSLOVIE NÁDOROV V CNS WHO 2016
Názvoslovie vo WHO 2016 klasifikácii sa približuje názvosloviu nádorov hematopoetického systému (3), kde k integrácii genetických informácií do klasifikácie došlo už dávnejšie (napr. Chronic myelogenous leukaemia, BCR-ABL1 positive; Atypical chronic myeloid leukaemia, BCR-ABL1 negative; Anaplastic large cell lymphoma, ALK positive; Anaplastic large cell lymphoma, ALK negative) (3). Diagnóza nádorov CNS by tak mala pozostávať z histopatologickej diagnózy, ktorá je nasledovaná genetickou informáciou, napr. Anaplastický astrocytóm, IDH-mutovaný, alebo Meduloblastóm, SHH-aktivovaný. Pre niektoré nádory existuje formálna kategória „wildtype“ (napr. Glioblastóm, IDH-wildtype). Vo väčšine prípadov však dodatok „wildtype“ nie je možný a nádory, v ktorých ani po dôkladnom vyšetrení nie je dokázaná diagnostická mutácia sú klasifikované ako NOS („not otherwise specified“). Dodatok „NOS“ (napr. Anaplastický astrocytóm, NOS) však možno použiť aj v prípade, ak príslušné genetické vyšetrenie nie je dostupné, nie je možné pre malé množstvo tkaniva, alebo je výsledok neinterpretovateľný.
Označenie NOS teda neoznačuje nozologickú jednotku, ale vyjadruje to, že patológ nemá dostatok informácii na presnejšiu klasifikáciu nádora.
NOVÉ A ZRUŠENÉ JEDNOTKY, VARIANTY A RASTOVÉ VZORY
Epitelioidný glioblastóm
V skupine difúzne infiltrujúcich gliómov bola pridaná jedna provizórna varianta – epitelioidný glioblastóm (eGBM). Ide o agresívnu variantu IDH-wildtype glioblastómu, s včasnými rekurenciami a tendenciou k leptomeningeálnemu šíreniu, ktorá sa vyskytuje predovšetkým u mladých dospelých a detí (11-13). eGBM je charakterizovaný relatívne uniformnou populáciou epiteloidných („melanoma-like“) buniek s nápadnými bunkovými membránami, eozinofilnou cytoplazmou, excentricky uloženými jadrami s nápadnými jadierkami a ložiskovo diskohezívnym spôsobom rastu (obr. 2). Niektoré bunky môžu mať až rabdoidný vzhľad (filamentózne eozinofilné cytoplazmatické inklúzie). Pomenovanie rabdoidný glioblastóm sa však pre tieto nádory nedoporučuje. Rabdoidný glioblastóm predstavuje pravdepodobne odlišnú variantu glioblastómu (zatiaľ bez formálneho uznania ako samostatnej varianty/rastového vzoru vo WHO klasifikácii); na rozdiel od eGBM je rabdoidný glioblastóm polyfenotypický tumor s ložiskovou stratou expresie INI-1 proteínu (14). Ďalej je nutné rozlišovať medzi eGBM a glioblastómom/gliosarkómom s metaplastickou epitelovou (adenoidnou alebo skvamóznou) diferenciáciou (14,15). Približne polovica eGBM vykazuje mutáciu BRAF V600E, ktorá môže byť relatívne spoľahlivo detekovaná aj imunohistochemicky (11,16-18). eGBM môže byť histologicky neodlíšiteľný od anaplastického pleomorfného xantoastrocytómu. Oba nádory majú navyše podobnú klinickú prezentáciu, imunohistochemický profil a genetiku (mutácia BRAF, delécia ODZ3). Je možné, že tieto nádory predstavujú veľmi príbuzné alebo dokonca identické jednotky a v budúcnosti môže dôjsť k reklasifikácii týchto nádorov (18).
Obr. 2. Epitelioidný glioblastóm (eGBM). MRI tumoru pravej frontoparietálnej oblasti u 21 ročnej ženy <b>(A)</b>. Nádor bol tvorený monotónnou populáciou epiteloidných buniek s objemnou eozinofilnou cytoplazmou. Niektoré bunky mali rabdoidnú morfológiu, s excentricky uloženými jadrami a eozinofilnou cytoplazmatickou inklúziou (šípka, <b>B</b>). Expresia GFAP v eGBM je často limitovaná na malú časť buniek, alebo môže byť kompletne negatívna <b>(C</b>). Difúzna expresia S100 proteínu (alternatívny „gliálny“ marker). Ostatné melanoma-markery sú vždy negatívne <b>(D)</b>. Častá je fokálna expresia „neuronálnych“ markerov, napr. neurofilamet proteínu <b>(E)</b>. Difúzna expresia BRAF V600E mutovaného proteínu <b>(F)</b>. Obrázky láskavo poskytol Arie Perry, Department of Pathology, Division of Neuropathology, University of California, San Francisco, USA. 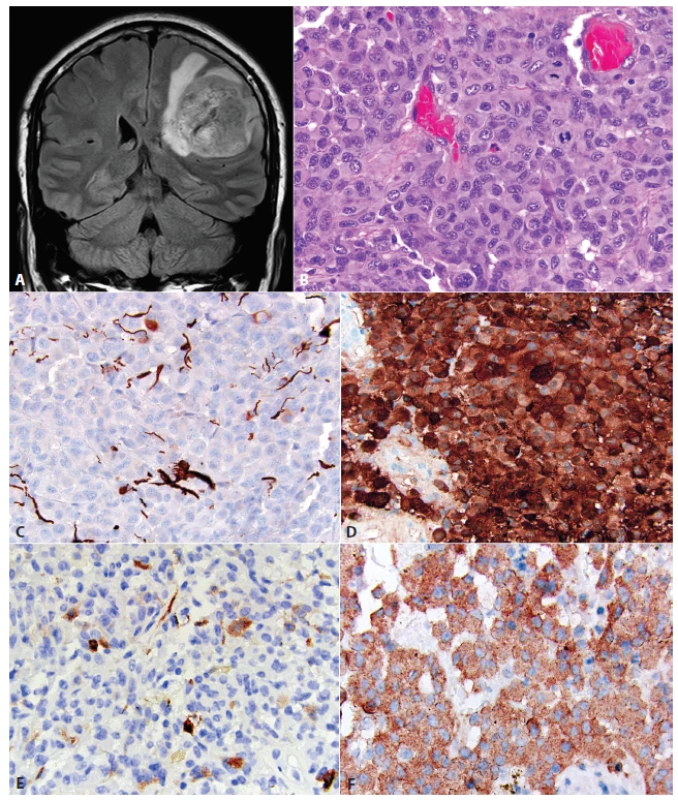
Glioblastóm s primitívnou neurálnou zložkou
V kapitole „Glioblastoma, IDH-wildtype“ bol pridaný rastový vzor (pattern) „Glioblastoma with a primitive neural component“. Tieto nádory, pôvodne pomenované ako malígne gliómy/glioblastómy s PNET-like diferenciáciou majú tendenciu šíriť sa cestou likvoru (19). Gliálna zložka v týchto nádoroch najčastejšie pripomína glioblastóm alebo gliosarkóm, vzácne anaplastický oligodendroglióm. Primitívna neurálna zložka je tvorená jedným alebo viacerými ohraničenými hypercelulárnymi nodulmi, ktoré sú tvorené bunkami pripomínajúcimi primitívne embryonálne nádory CNS alebo meduloblastóm (vrátane dezmoplastického / nodulárneho alebo anaplastického). Expresia „neuronálnych” markerov je obmedzená na PNET-like fókusy (obr. 3). Pomerne často (~40 %) majú tieto nádory v primitívnej neurálnej zložke amplifikovaný MYC gén (väčšinou MYCN, menej často MYC). Naproti tomu, zmeny asociované s gliómami (delécia 10q, delécia PTEN, amplifikácia EGFR, difúzna imunohistochemická pozitivita p53) sú lokalizované v oboch zložkách, čo svedčí najskôr pre sekundárny vznik primitívnej neurálnej zložky dediferenciáciou v high grade glióme (19). Časť glioblastómov s primitívnou neurálnou zložkou pravdepodobne vzniká progresiou z low-grade gliómu; tieto nádory sú IDH-mutované (20,21) a pravdepodobne majú lepšiu prognózu ako primárne IDH-wildtype glioblastómy (21).
Obr. 3. Glioblastóm s primitívnou neurálnou zložkou u 39 ročnej pacientky s krátkou anamnézou bolestí hlavy a krátkodobou stratou vedomia. Išlo o solídne-cystický nádor temporálne vľavo. Mikroskopicky sa jednalo o difúzne infiltrujúci gliový nádor s gemistocytickou morfológiou (A) a ostro ohraničenými ložiskami buniek s primitívnou embryonálnou morfológiou a naznačeným rozetoidným usporiadaním (B). Primitívna neurálna komponenta bola GFAP negatívna (C) a difúzne exprimovala synaptofyzín (D). V oboch zložkách boli prítomné genetických alterácie typické pre glióblastóm: ovexpresia p53 (E) a delécia <em>PTEN</em> (F, fluorescenčná in situ hybridizácia; červený signál=PTEN, zelený signál=centroméra). Gény <em>MYCN</em> ani <em>MYC</em> neboli v tomto prípade amplifikované. 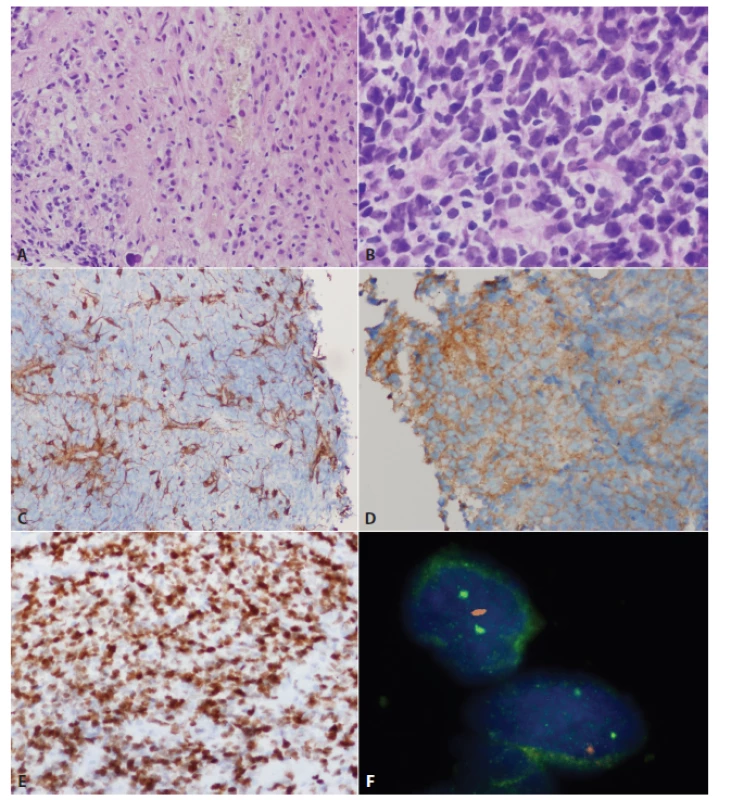
Difúzne gliómy u detí a diffuse midline glioma, H3 K27M-mutant
V minulosti boli gliómy detského veku klasifikované spoločne s nádormi dospelých, napriek tomu, že difúzne gliómy u detí majú odlišné genetické pozadie a biologický potenciál (napr. výrazne menšiu tendenciu k progresii do high-grade gliómu/glioblastómu). Je napríklad dobre známe, že oligodendrogliómy u detí a adolescentov takmer nikdy nemajú mutáciu IDH1/2 a kodeléciu 1p/19q (a ani mutácie CIC, FUBP1 alebo TERT). V prípade „pediatrických“ oligodendrogliómov je dôležité v prvom rade vylúčiť histologicky podobné nádory (pilocytický astrocytóm, clear cell ependymóm, extraventrikulárny neurocytóm alebo dysembryoplastický neuroektodermálny tumor). Diagnostiku komplikuje aj fakt, že „pediatrické“ oligodendrogliómy (ale aj oligodendrogliómy u dospelých) môžu vzácne mať fúziu alebo mutáciu BRAF, podobne ako pilocytický astrocytóm (22,23).
Na rozdiel od difúznych astrocytómov u dospelých, sú mutácie IDH1/2, ATRX a TP53 v pediatrických difúznych astrocytómoch vzácne (v opačnom prípade možno nádor u dieťata/adolescenta klasifikovať ako astrocytóm „adultného typu“). Časť detských hemisferických difúznych astrocytómov je charakterizovaná rekurentnými aberáciami (amplifikácia, parciálna duplikácia) v onkogénoch/transkripčných faktoroch MYB a MYBL1 (10,24-26), ďalej je takmer rovnako častá mutácia BRAF (25,26) a intragénna duplikácia FGFR1, vzácnejšie mutácia RAS (26). Všetky tieto genetické alterácie vedú k aktivácii kinázovej cesty RAS/MAP, čo je typické pre takmer všetky ostatné „low-grade“ gliálne/glioneuronálne nádory detského veku (pilocytický astrocytóm, pleomorfný xantoastrocytóm, ganglioglióm, angiocentrický glióm). Pediatrické difúzne astrocytómy majú teda bližšie k „špeciálnym“ typom astrocytómov s ohraničeným spôsobom rastu, čo je podkladom pre ich spoločnú liečbu v rámci klinických štúdií, oddelene od astrocytómov dospelého veku (27).
„Pediatrický“ oligodendroglióm a difúzny astrocytóm nie sú v novej klasifikácii zatiaľ uvedené ako samostatné jednotky (väčšina bude provizórne klasifikovaná ako oligodendroglióm, NOS, resp. difúzny astrocytóm, IDH-wildtype), na konci príslušných kapitol je však zaradený samostatný komentár k týmto typom nádorov.
Samostatnou novou „pediatrickou“ jednotkou je zatiaľ iba „Diffuse midline glioma, H3 K27M-mutant“. Ide o difúzne infiltrujúce gliómy, ktoré majú prevažne astrocytárnu morfológiu, vzácne však môžu mať vzhľad oligodendrogliómu. Definujúcim znakom je prítomnosť somatickej mutácie (zámena lyzínu za metionín v kodóne 27 - p.Lys27Met; skrátene K27M) v génoch histónu H3.1 (HIST1H3B alebo HIST1H3C) alebo histónu H3.3 (H3F3A) (28-30). Ide o nádory prevažne lokalizované v mozgovom kmeni (v minulosti označované ako „braistem glioma“ alebo „diffuse intrinsic pontine glioma“), talame alebo mieche, raritne v mozočku, tretej komore, alebo s difúznym šírením do hemisfér (obraz gliomatosis cerebri). Typicky sa vyskytujú u detí, vzácne sa ale gliómy s K27M mutáciou vyskytujú aj u dospelých pacientov, prevažne mladšieho veku (31,32). Väčšina K27M-mutovaných gliómov má morfológiu high-grade astrocytómu (anaplastického astrocytómu alebo glioblastómu), popísané je však celé spektrum morfologických variánt, vrátane gliómov s obrovskými bunkami, epitelioidnými/rabdoidnými bunkami, PNET-like fókusmi, neuropil-like fókusmi, sarkomatóznou transformáciou a areálmi pripomínajúcimi ependymóm alebo pilomyxoidný astrocytóm (33). Približne 10 % týchto nádorov nemá prítomné mitózy, mikrovaskulárnu proliferáciu ani nekrózy a histologicky by teda mohli byť klasifikované ako grade II (1). Detské „midline“ gliómy s mutáciou K27M však bez ohľadu na morfológiu majú mimoriadne zlú prognózu. Platí to aj pre dospelých pacientov, výnimkou by mohli byť K27M-mutované gliómy lokalizované v talame (32). K27M-mutované gliómy sú preto klasifikované ako grade IV, bez ohľadu na histopatologický grade. Z praktického hľadiska, nález K27M mutácie v malej biopsii „low grade“ gliómu mozgového kmeňa je inkompatibilný s diagnózou difúzneho astrocytómu alebo pilocytického astrocytómu, aj keď existujú ojedinelé prípady nádorov vzhľadu pilocytického astrocytómu s mutáciou K27M a relatívne indolentným klinickým priebehom (26,34).
Detekcia mutácie K27M v „midline“ gliómoch je aktuálne považovaná za prognostické vyšetrenie. V budúcnosti však môže byť vyšetrením prediktívnym, keďže už prebiehajú preklinické štúdie s inhibítormi demetyláz a deacetyláz histónov, s pomerne povzbudivými výsledkami (35,36). Mutácia K27M v oboch histónoch (H3.3 aj H3.1) je detekovateľná so 100% senzitivitou a špecificitou pomocou polyklonálnej protilátky anti-H3K27M (Millipore, #ABE419) (37).
Zrušené jednotky a varianty
Varianta anaplastického astrocytómu „Glioneural tumor with neuropil-like islands“ bola v novej klasifikácii vynechaná. Ďalej bola zrušená samostatná jednotka gliomatosis cerebri (postihnutie minimálne troch lalokov mozgu v čase iniciálnej klinickej prezentácie). Gliomatóza je v novej klasifikácii považovaná už iba za rastový vzor, ktorý môže byť prítomný v celom spektre difúzne infiltrujúcich gliómov. Doposiaľ nie sú známe žiadne unikátne genetické charakteristiky, ktoré by gliomatózu odlišovali od iných definovaných podtypov difúznych gliómov. Zrušené boli aj dve varianty difúzneho astrocytómu – protoplazmický astrocytóm (bol definovaný veľmi vágne a táto diagnóza takmer nebola patológmi používaná) a fibrilárny astrocytóm – ten predstavuje v podstate prototyp difúzneho astrocytómu (1).
ANALÝZA IDH, ATRX A 1P/19Q AKO ZÁKLAD PRAKTICKEJ „INTEGROVANEJ“ MORFOLOGICKO-GENETICKEJ DIAGNOSTIKY DIFÚZNYCH GLIOVÝCH NÁDOROV U DOSPELÝCH PACIENTOV
Parsons a spol. ako prví v roku 2008 popísali mutácie v géne IDH1, prevažne v tzv. sekundárnych glioblastómoch u mladších pacientov. Pacienti s mutáciou IDH1 mali signifikatne dlhšie prežívanie ako pacienti bez mutácie (8). Následne sa ukázalo, že IDH1 mutácia je častá aj v difúznych gliómoch II. a III. stupňa malignity (astrocytóm, oligoastrocytóm a oligodendroglióm) a je silným priaznivým prognostickým markerom astrocytómov (7,38-42).
Kodelécia 1p/19q, následkom nebalancovanej translokácie t(1;19), je genetická alterácia, ktorá definuje oligodendroglióm u dospelých (43-46), a zároveň je signifikantným prediktorom prežívania ako aj odpovede na chemoterapiu (47,48). Dnes je známe, že s dobrou prognózou je asociovaná iba kombinovaná a kompletná strata ramienok 1p a 19q, ktorú najpoužívanejšie vyšetrenie fluorescenčnou in situ hybridizáciou (FISH) nie je schopné spoľahlivo potvrdiť. Parciálna strata 1p alebo 19q je nešpecifická, je totiž častá v glioblastómoch, resp. anaplastických astrocytómoch (49). Napriek tejto nešpecificite konvenčného FISH vyšetrenia, je toto vyšetrenie stále považované za dostatočné v prípadoch morfologicky klasického/prototypického oligodendrogliómu a nie je nutné použitie komplikovanejších techník (next generation sequencing alebo MLPA - multiplex ligation-dependent probe amplification) (1).
Mutácie ATRX sa vyskytujú v nádoroch s morfológiou astrocytómu alebo oligoastrocytómu a nevyskytujú sa napr. v pilocytickom astrocytóme alebo pleomorfnom xantoastrocytóme. Vo väčšine prípadov je mutácia ATRX asociovaná s mutáciami IDH a v malej časti IDH-wildtype prípadov s mutáciami histónu H3 a to K27M („midline“ gliómy) ako aj G34R, ktorá sa vyskytuje v hemisferických tumoroch a nemá na rozdiel od K27M prognostický význam (50-53). ATRX-mutované gliómy majú ALT fenotyp (alternative lenghtening of telomeres; t.j. predĺženie telomérových sekvencií, ktoré je nezávislé od aktivity telomerázy), často mutácie TP53 a až na ojedinelé výnimky nemajú del 1p/19q ani mutácie CIC, FUBP1 ani TERT (50-54). Geneticky teda ide o astrocytómy. ATRX je navyše významným prognostickým markerom; IDH-mutované astrocytómy s ATRX mutáciou majú signifikantne lepšiu prognózu ako IDH-mutované astrocytómy bez mutácie ATRX (54,55).
Vyšetrením vyššie uvedených markerov možno väčšinu difúznych gliómov (prevažne u dospelých pacientov) klasifikovať minimálne do troch skupín. Vo všeobecnosti, najlepšiu prognózu majú IDH-mutované gliómy s kodeléciou 1p/19q (morfologicky v drvivej väčšine vzhľadu oligodendrogliómu alebo oligoastrocytómu grade II/III), za nimi nasledujú IDH-mutované gliómy bez del 1p/19q (histologicky väčšinou astrocytómy/oligoastrocytómy grade II-III a sekundárne glioblastómy) a najhoršiu prognózu majú IDH-wildtype gliómy (morfologicky väčšinou primárne glioblastómy). Význam ďalšej podrobnejšej subklasifikácie v súčasnosti nie je známy, aj keď napr. prítomnosť CIC mutácií v oligodendrogliómoch s IDH-mutáciou a del 1p/19q môže identifikovať nádory s horšou prognózou (56).
Podľa jedného z publikovaných diagnostických algoritmov, „integrovaná“ morfologicko-genetická diagnostika difúzneho gliového nádoru, bez ohľadu na morfológiu (astrocytóm, oligoastrocytóm alebo oligodendroglióm, glioblastóm alebo tzv. glioblastóm s oligodendrogliálnou zložkou), začína imunohistochemickým vyšetrením expresie IDH1 a ATRX (protilátka proti IDH1 detekuje najčastejšiu mutáciu v géne IDH1 - R132H a strata jadrovej expresie ATRX znamená prítomnosť mutácie génu ATRX) a ďalej podľa potreby pokračuje detekciou del 1p/19q a sekvenáciou DNA na dôkaz vzácnejších mutácií IDH1/2 (57). ATRX-negatívne a IDH1-R132H-pozitívne nádory sú klasifikované ako IDH-mutované astrocytómy grade II - IV (obr. 4A). ATRX-negatívne a IDH1-R132H-negatívne nádory sú ďalej vyšetrené sekvenáciou DNA na dôkaz vzácnejších IDH1/2 mutácií a následne klasifikované ako IDH-mutované alebo IDH-wiltype astrocytómy (obr. 4B). Nádory so zachovanou expresiou ATRX (IDH1-R132H-pozitívne aj negatívne), sú vyšetrené na prítomnosť del 1p/19q (obr. 4C a 4D) a v prípade prítomnosti kodelécie sú bez ohľadu na IDH-status klasifikované ako oligodendrogliómy, grade II/III. IDH1-R132H-pozitívne nádory bez del1p/19q sú klasifikované ako IDH-mutované astrocytómy (obr. 4C). IDH1-R132H-negatívne nádory bez del1p/19q sú ďalej vyšetrené sekvenáciou IDH1/2 a následne klasifikované ako IDH-mutované alebo IDH-wiltype astrocytómy (obr. 4D). V prípade diskordancie medzi morfológiou a genotypom difúzneho gliómu (napr. morfologický astrocytóm/oligoastrocytóm so zachovanou expresiou ATRX, mutáciou IDH1/2 a del 1p/19q) platí, že genotyp má prednosť pred fenotypom (v uvedenom príklade je nádor klasifikovaný ako oligodendroglióm).
Obr. 4. Algoritmus diagnostiky difúznych gliómov (upravené podľa ref. 57). 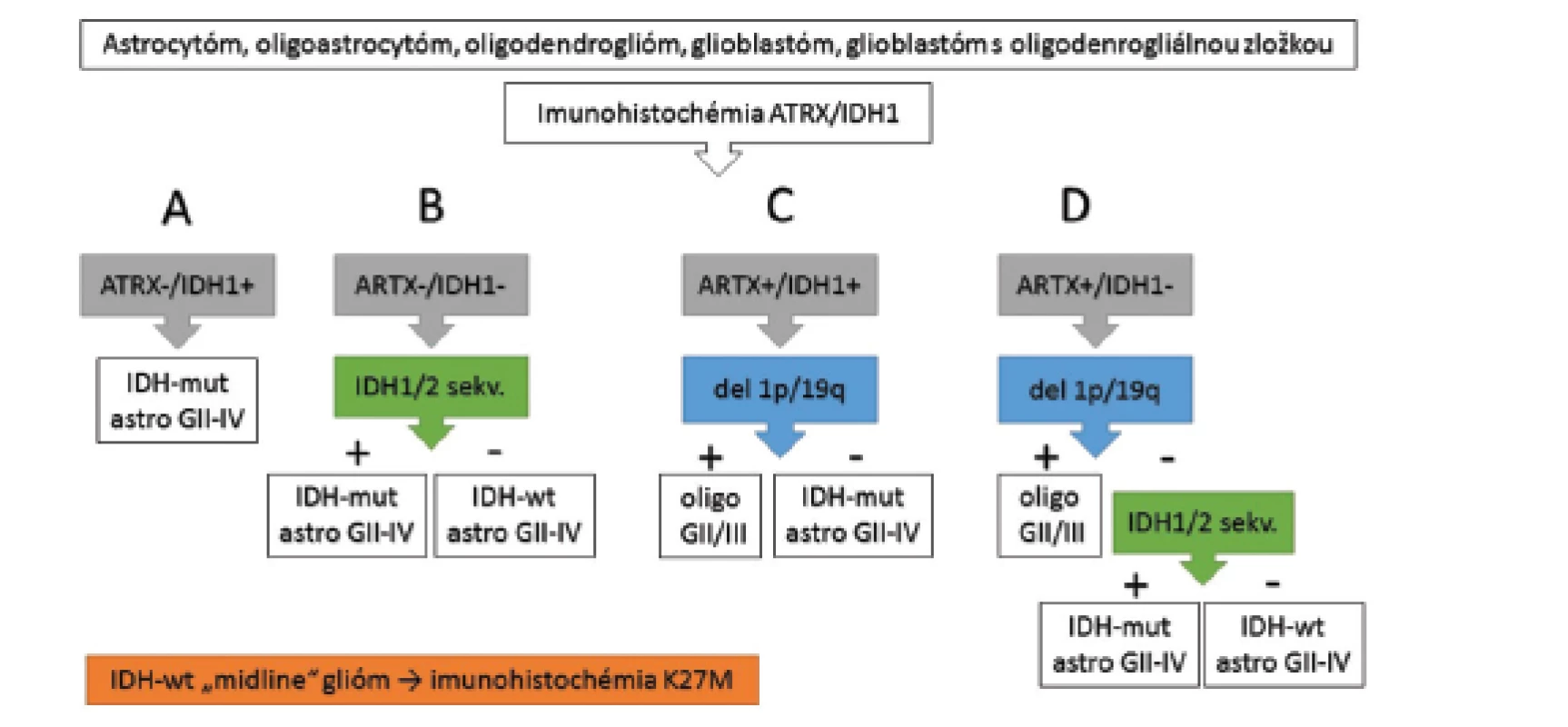
Vysvetlenie v texte. Myslíme si, že v praxi je možná modifikácia algoritmu a IDH1-R132H-negatívne nádory so zachovanou expresiou ATRX a jednoznačnou astrocytárnou morfológiou je možné vyšetriť na prítomnosť vzácnych mutácií IDH1/2 ešte pred testom del 1p/19q a FISH vyšetrenie robiť iba v IDH-mutovaných prípadoch. Takto sa ušetrí jedno vyšetrenie, keďže del 1p/19q sa až na vzácne výnimky nevyskytuje v IDH-wildtype nádoroch (v našom súbore žiadny z 30 oligodendrogliómov s kodeléciou 1p/19q nebol IDH-negatívny, Cytopathos s.r.o. Bratislava 2013-2016, nepublikované dáta) a aj WHO 2016 oligodendroglióm definuje ako IDH-mutovaný tumor (1).
WHO 2016 ďalej pripúšťa možnosť, že glioblastóm, ktorý je IDH1-R132H-negatívny, u pacienta staršieho ako 55 rokov a ktorý nemá anamnézu gliómu nižšieho stupňa malignity (klinicky tzv. primárny glioblastóm) je možné bezpečne klasifikovať ako IDH-wildtype aj bez sekvenačnej anylýzy IDH1/2 (1). Bolo totiž dokázané, že pravdepodobnosť IDH1/2 mutácie u pacientov s glioblastómom starších ako 54 rokov je menej ako 1 % (57). V súlade s literárnymi údalmi, v našom súbore 228 glioblastómov a gliosarkómov sme zaznamenali IDH-pozitivitu iba u dvoch (0,8 %) pacientov vo veku ≥ 55 rokov (Cytopathos s.r.o. Bratislava a UNLP Košice, 2013-2016, nepublikované dáta).
Funkčnosť vyššie popísaného algoritmu v klasifikácii difúznych gliómov potvrdzuje to, že použitím vyššie popísaného panelu markerov (prípadne s pridaním imunohistochemickej detekcie p53) je možné jednoznačne klasifikovať drvivú väčšinu morfologicky „zmiešaných“ gliómov (oligoastrocytómov) buď ako IDH-mutované astrocytómy alebo oligodendrogliómy (obr. 5 a 6) (54,58-61). Provizórna diagnóza oligoastrocytóm, NOS, resp. anaplastický oligoastrocytóm, NOS je v novej WHO klasifikácii vyhradená pre gliómy s nejednoznačnou morfológiou, ktoré nie je možné (z rôznych príčin) adekvátne geneticky vyšetriť. Skutočné „molekulárne“ oligoastrocytómy s geneticky a morfologicky oddelenými zložkami však existujú, jedná sa ale o extrémne vzácne prípady (61,62).
Obr. 5. Glióm parietálneho laloka vpravo u 36 ročnej ženy s anamnézou niekoľo dní trvajúcich bolestí hlavy. MRI vyšetrenie ukázalo nepravidelné izo- až hypodenzné nádorové ložisko s rozsiahlym perifokálnym edémom, cystickou zložkou a prstencovitým vychytávaním kontrastnej látky (A, T1; B, T2; C, T1 s gadolíniom). Mikroskopicky sa jednalo o difúzne infiltrujúci gliový nádor s relatívne pravidelnou monotónnou hypercelularitou, ložiskami nekróz (šípka) a delikátnymi kapilárami (D). Nádorové bunky mali okrúhle jadrá a perinukleárne haló, obraz bol sugestívny pre diagnózu oligodendrogliómu (E). Ložiskovo boli zachytené mikrocysty, nádorové bunky v týchto častiach však mali skôr morfológiu astrocytómu (F,G). Imunohistochemicky bola dokázaná expresia IDH1 (H) a strata jadrovej expresie ATRX (J). Overexpreia p53 nebola prítomná. Nádor bol klasifikovaný ako glioblastóm, IDH-mutovaný, WHO grade IV. Klinicky sa jednalo o tzv. primárny glioblastóm (bez anamnézy resp. progresie z low-grade gliómu). Keďže väčšina IDH-mutovaných glioblastómov vzniká progresiou z low-grade IDH-mutovaných gliómov (tzv. sekundárny glioblastóm), je možné, IDH-mutované primárne glioblastómy vznikajú rýchlou progresiou klinicky nemého low-grade gliómu. 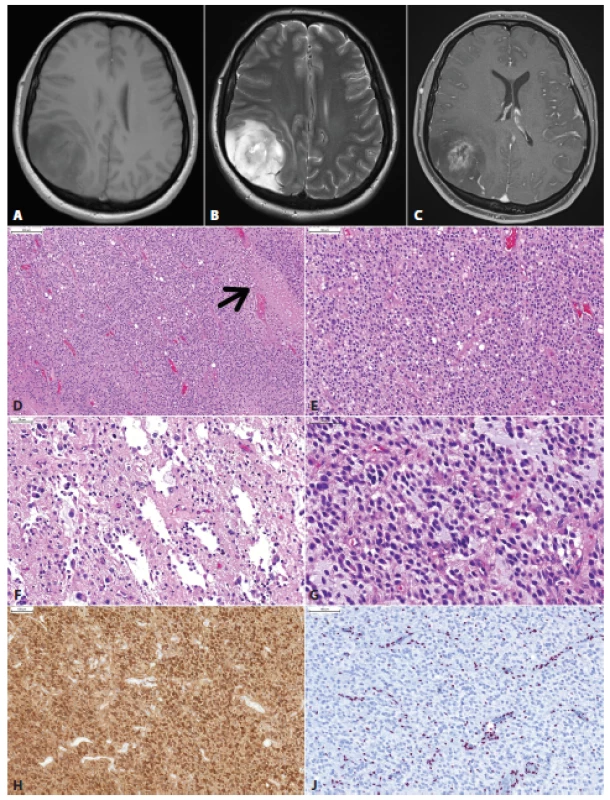
Obr. 6. Glióm frontálneho laloka vpravo u 53-ročnej ženy s anamnézou mesiac trvajúcich bolestí hlavy. Na MRI izo- až hypodenzné cystické ložisko s perifokálnym edémom a prstencovitým „enhancementom“ (A, T1; B, T2; C, T1 s gadolíniom). Lézia mala mikroskopicky dve relatívne ostro oddelené zložky: oligodendrogliálnu (D, ľavá tretina obrázku) a astrocytárnu, s nápadnou gemistocytickou diferenciáciou (D vpravo, E). Oligodendrogliálna zložka mala vzhľad prototypického oligodendrogliómu (F), ložiskovo s početnými minigemistocytmi (G). Imunohistochemicky bol tumor IDH1-pozitívny v oligodendrogliálnej zložke (H, vpravo) a negatívny v astocytárnej časti (H, vľavo). Expresia ATRX bola zachovaná v oboch častiach (I). FISH vyšetrením bola v oligodendrogliálnej časti dokázaná kodelécia 1p/19q (J,K). Nádor bol klasifikovaný ako anaplastický oligodendroglióm, IDH-mutovaný, s kodeléciou 1p/19q, WHO grade III. Astrocytárna zložka je nenádorová/reaktívna. Podľa starej klasifikácie (WHO 2007) by takýto tumor mohlo byť klasifikovaný ako anaplastický oligoastrocytóm (zmiešaný glióm). Použitím genetickej analýzy (alebo zástupných imunohistochemických markerov – p53, IDH1, ATRX) je možné rozdelenie drvivej väčšiny „oligoastrocytómov“ na oligodendrogliómy a astrocytómy. 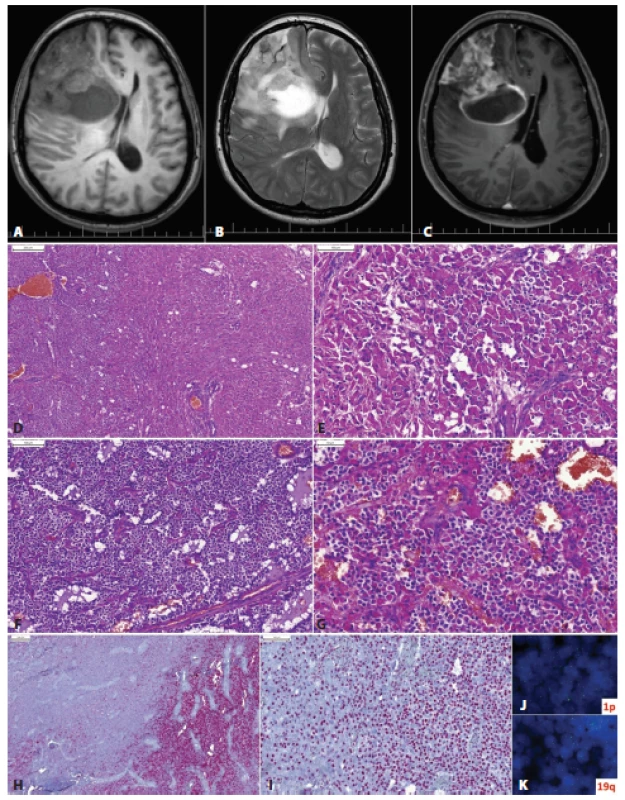
Všetky IDH-wildtype „midline“ gliómy by bez ohľadu na morfológiu tumoru a vek pacienta by mali byť vyšetrené imunohistochemicky alebo DNA sekvenáciou na prítomnosť mutácie H3-K27M (33).
ZÁVER
WHO 2016 „update“ klasifikácie nádorov CNS je prvým pokusom inkorporovať genetické informácie do diagnostiky nádorov mozgu. V ďalšej klasifikácii sa pravdepodobne dočkáme ďalšieho rozšírenia počtu jednotiek definovaných na základe fenotypu a genotypu. V súčasnosti môžeme väčšinu difúznych gliómov u dospelých pacientov a časť agresívnych „midline“ gliómov prevažne detského veku, objektívnejšie a presnejšie diagnostikovať a stratifikovať pomocou kombinácie imunohistochemického a genetického vyšetrenia relatívne malého panelu markerov. Lákavou alternatívou k postupnému časovo náročnému algoritmickému vyšetrovaniu diagnostických, prognostických a prediktívnych markerov je využitie metód „next generation sequencing“ (NGS). Sahm a spol. vytvorili metodiku pre NGS vhodnú pre tkanivá fixované vo formole a spracované v parafíne (63). Metodika (ktorá trvá iba 5 dní) analyzuje panel 130 relevantných génov, ktorých alterácie sa vyskytujú v celom spektre mozgových nádorov. Konkordacia NGS s klasickými metodikami používanými pre jednotlivé gény bola 98 %, navyše metóda NGS bola spoľahlivejšia vo vzorkách s malým množstvom buniek (63). Veríme, že nádory CNS budú jednou z prvých skupín nádorov kde NGS nájde uplatnenie v rutínnej diagnostike. Cena vyšetrenia pomocou NGS už začína byť prijateľná pre každodenné použitie.
PREHLASENIE
Autor práce prehlasuje, že v súvislosti s témou, vznikom a publikácií tohto článku nie v konflikte záujmov a vznik ani publikácia článku neboli podporené žiadnou farmaceutickou firmou. Toto prehlasenie sa týka i všetkých spoluautorov.
Adresa pre korešpondenciu:
MUDr. Marián Švajdler
Bioptická laboratoř, s.r.o.
Mikulášske nám. 4
326 00 Plzeň,
Česká republika
tel.: +420 737220036
e-mail: svajdler@yahoo.com
Zdroje
1. Louis DN, Ohgaki H, Wiestler OD, Cavenee WK, eds. World Health Organization classification of tumours of the central nervous system (revised 4th ed). Lyon, IARC; 2016.
2. Louis DN, Ohgaki H, Wiestler OD, Cavenee WK, eds. World Health Organization classification of tumours of the central nervous system (4th ed). Lyon, IARC; 2007.
3. Swerdlow SH, Campo E, Harris NL, Jaffe ES, Pileri SA, Stein H, Thiele J, Vardiman JW, eds. World Health Organization classification of tumours of haematopoietic and lymphoid tissues (4th ed). Lyon, IARC; 2008.
4. Louis DN, Perry A, Burger P, et al. International Society of Neuropathology-Haarlem consensus guidelines for nervous system tumor classification and grading. Brain Pathol 2014; 24(5): 429-435.
5. Hainfellner J, Louis DN, Perry A, Wesseling P. Letter in response to David N. Louis et al, International Society of Neuropathology-Haarlem consensus guidelines for nervous system tumor classification and grading. Brain Pathol 2014; 24(6): 671-672.
6. Wang XW, Ciccarino P, Rossetto M, et al. IDH mutations: genotype-phenotype correlation and prognostic impact. Biomed Res Int 2014; 2014 : 540236.
7. Hartmann C, Meyer J, Balss J, et al. Type and frequency of IDH1 and IDH2 mutations are related to astrocytic and oligodendroglial differentiation and age: A study of 1,010 diffuse gliomas. Acta Neuropathol 2009; 118(4): 469–474.
8. Parsons DW, Jones S, Zhang X, et al. An integrated genomic analysis of human glioblastoma multiforme. Science 2008; 321(5897): 1807–1812.
9. Wesseling P, van den Bent M, Perry A. Oligodendroglioma: pathology, molecular mechanisms and markers. Acta Neuropathol 2015; 129(6): 809-827.
10. Ichimura K, Narita Y, Hawkins CE. Diffusely infiltrating astrocytomas: pathology, molecular mechanisms and markers. Acta Neuropathol 2015; 129(6): 789-808.
11. Broniscer A, Tatevossian RG, Sabin ND, et al. Clinical, radiological, histological and molecular characteristics of paediatric epithelioid glioblastoma. Neuropathol Appl Neurobiol 2014; 40(3): 327-336.
12. Kleinschmidt-DeMasters BK, Alassiri AH, Birks DK, Newell KL, Moore W, Lillehei KO. Epithelioid versus rhabdoid glioblastomas are distinguished by monosomy 22 and immunohistochemical expression of INI-1 but not claudin 6. Am J Surg Pathol 2010; 34(3): 341-354.
13. Sugimoto K, Ideguchi M, Kimura T,et al. Epithelioid/rhabdoid glioblastoma: a highly aggressive subtype of glioblastoma. Brain Tumor Pathol 2016; 33(2): 137-146.
14. Mørk SJ, Rubinstein LJ, Kepes JJ, Perentes E, Uphoff DF. Patterns of epithelial metaplasia in malignant gliomas. II. Squamous differentiation of epithelial-like formations in gliosarcomas and glioblastomas. J Neuropathol Exp Neurol 1988; 47(2): 101-118.
15. Rodriguez FJ, Scheithauer BW, Giannini C, Bryant SC, Jenkins RB. Epithelial and pseudoepithelial differentiation in glioblastoma and gliosarcoma: a comparative morphologic and molecular genetic study. Cancer 2008; 113(10): 2779-2789.
16. Kleinschmidt-DeMasters BK, Aisner DL, Birks DK, Foreman NK. Epithelioid GBMs show a high percentage of BRAF V600E mutation. Am J Surg Pathol 2013; 37(5): 685-698.
17. Kleinschmidt-DeMasters BK, Aisner DL, Foreman NK. BRAF VE1 immunoreactivity patterns in epithelioid glioblastomas positive for BRAF V600E mutation. Am J Surg Pathol 2015; 39(4): 528-540.
18. Alexandrescu S, Korshunov A, Lai SH, et al. Epithelioid glioblastomas and anaplastic epithelioid pleomorphic xanthoastrocytomas--same entity or first cousins? Brain Pathol 2016; 26(2): 215-223.
19. Perry A, Miller CR, Scheithauer BW, et al. Malignant gliomas with primitive neuroectodermal tumor-like components: a clinicopathologic and genetic study of 53 cases. Brain Pathol 2009; 19(1): 81-90.
20. Joseph NM, Phillips J, Dahiya S, M Felicella M, Tihan T, Brat DJ, Perry A. Diagnostic implications of IDH1-R132H and OLIG2 expression patterns in rare and challenging glioblastoma variants. Mod Pathol 2013; 26(3): 315-326.
21. Song X, Andrew Allen R, Terence Dunn S, et al. Glioblastoma with PNET-like components has a higher frequency of isocitrate dehydrogenase 1 (IDH1) mutation and likely a better prognosis than primary glioblastoma. Int J Clin Exp Pathol 2011; 4(7): 651-660.
22. Kumar A, Pathak P, Purkait S, et al. Oncogenic KIAA1549-BRAF fusion with activation of the MAPK/ERK pathway in pediatric oligodendrogliomas. Cancer Genet 2015; 208(3): 91-95.
23. Badiali M, Gleize V, Paris S, et al. KIAA1549-BRAF fusions and IDH mutations can coexist in diffuse gliomas of adults. Brain Pathol 2012; 22(6): 841-847.
24. Tatevossian RG, Tang B, Dalton J, et al. MYB upregulation and genetic aberrations in a subset of pediatric low-grade gliomas. Acta Neuropathol 2010; 120(6): 731-743.
25. Ramkissoon LA, Horowitz PM, Craig JM, et al. Genomic analysis of diffuse pediatric low-grade gliomas identifies recurrent oncogenic truncating rearrangements in the transcription factor MYBL1. Proc Natl Acad Sci U S A 2013; 110(20): 8188-8193.
26. Zhang J, Wu G, Miller CP, et al. Whole-genome sequencing identifies genetic alterations in pediatric low-grade gliomas. Nat Genet 2013; 45(6): 602-612.
27. Raabe E, Kieran MW, Cohen KJ. New strategies in pediatric gliomas: molecular advances in pediatric low-grade gliomas as a model. Clin Cancer Res 2013; 19(17): 4553-4558.
28. Schwartzentruber J, Korshunov A, Liu XY, et al. Driver mutations in histone H3.3 and chromatin remodelling genes in paediatric glioblastoma. Nature 2012; 482(7384): 226–231.
29. Wu G, Broniscer A, McEachron TA, et al. Somatic histone H3 alterations in pediatric diffuse intrinsic pontine gliomas and nonbrainstem glioblastomas. Nat Genet 2012; 44(3): 251–253.
30. Castel D, Philippe C, Calmon R, et al. Histone H3F3A and HIST1H3B K27M mutations define two subgroups of diffuse intrinsic pontine gliomas with different prognosis and phenotypes. Acta Neuropathol 2015; 130(6): 815-827.
31. Aihara K, Mukasa A, Gotoh K, et al. H3F3A K27M mutations in thalamic gliomas from young adult patients. Neuro Oncol 2014; 16(1): 140-146.
32. Feng J, Hao S, Pan C, et al. The H3.3 K27M mutation results in a poorer prognosis in brainstem gliomas than thalamic gliomas in adults. Hum Pathol 2015; 46(11): 1626-1632.
33. Solomon DA, Wood MD, Tihan T, Bollen AW, Gupta N, Phillips JJ, Perry A. Diffuse midline gliomas with histone H3-K27M mutation: Series of 47 cases assessing the spectrum of morphologic variation and associated genetic alterations. Brain Pathol 2016; 26(5): 569-580.
33. Hochart A, Escande F, Rocourt N, et al. Long survival in a child with a mutated K27M-H3.3 pilocytic astrocytoma. Ann Clin Transl Neurol 2015; 2(4): 439–443.
34. Grasso CS, Tang Y, Truffaux N, et al. Functionally defined therapeutic targets in diffuse intrinsic pontine glioma. Nature Med 2015; 21(7): 555–559.
35. Hashizume R, Andor N, Ihara Y, et al. Pharmacologic inhibition of histone demethylation as a therapy for pediatric brainstem glioma. Nature Med 2014; 20(12): 1394–1396.
36. Bechet D, Gielen GG, Korshunov A, et al. Specific detection of methionine 27 mutation in histone 3 variants (H3K27M) in fixed tissue from high-grade astrocytomas. Acta Neuropathol 2014; 128(5): 733–741.
37. Balss J, Meyer J, Mueller W, Korshunov A, Hartmann C, von Deimling A. Analysis of the IDH1 codon 132 mutation in brain tumors. Acta Neuropathol 2008; 116(6): 597–602.
38. Ichimura K, Pearson DM, Kocialkowski S, et al. IDH1 mutations are present in the majority of common adult gliomas but are rare in primary glioblastomas. Neuro Oncol 2009; 11(4): 341–347.
39. Watanabe T, Nobusawa S, Kleihues P, Ohgaki H. IDH1 Mutations are early events in the development of astrocytomas and oligodendrogliomas. Am J Pathol 2009; 174(4): 653–656.
40. Yan H, Parsons DW, Jin G, et al. IDH1 and IDH2 mutations in gliomas. N Engl J Med 2009; 360(8): 765–773.
41. Hartmann C, Hentschel B, Wick W, et al. Patients with IDH1 wild type anaplastic astrocytomas exhibit worse prognosis than IDH1-mutated glioblastomas, and IDH1 mutation status accounts for the unfavorable prognostic effect of higher age: implications for classification of gliomas. Acta Neuropathol 2010; 120(6): 707–718.
42. Bello MJ, Leone PE, Vaquero J, et al. Allelic loss at 1p and 19q frequently occurs in association and may represent early oncogenic events in oligodendroglial tumors. Int J Cancer 1995; 64(3): 207–210.
43. Kraus JA, Koopmann J, Kaskel P, et al. Shared allelic losses on chromosomes 1p and 19q suggest a common origin of oligodendroglioma and oligoastrocytoma. J Neuropathol Exp Neurol 1995; 54(1): 91–95.
44. Reifenberger J, Reifenberger G, Liu L, James CD, Wechsler W, Collins VP. Molecular genetic analysis of oligodendroglial tumors shows preferential allelic deletions on 19q and 1p. Am J Pathol 1994; 145(5): 1175–1190.
45. Griffin CA, Burger P, Morsberger L, Yonescu R, Swierczynski S, Weingart JD, Murphy KM. Identification of der(1;19) (q10;p10) in five oligodendrogliomas suggests mechanism of concurrent 1p and 19q loss. J Neuropathol Exp Neurol 2006; 65(10): 988–994.
46. Cairncross JG, Ueki K, Zlatescu MC, et al. Specific genetic predictors of chemotherapeutic response and survival in patients with anaplastic oligodendrogliomas. J Natl Cancer Inst 1998; 90(19): 1473–1479.
47. Smith JS, Perry A, Borell TJ, et al. Alterations of chromosome arms 1p and 19q as predictors of survival in oligodendrogliomas, astrocytomas, and mixed oligoastrocytomas. J Clin Oncol 2000; 18(3): 636–645.
48. Jenkins RB, Blair H, Ballman KV, et al. A t(1;19)(q10;p10) mediates the combined deletions of 1p and 19q and predicts a better prognosis of patients with oligodendroglioma. Cancer Res 2006; 66(20): 9852–9861.
49. Kannan K, Inagaki A, Silber J, et al. Whole-exome sequencing identifies ATRX mutation as a key molecular determinant in lower-grade glioma. Oncotarget 2012; 3(10): 1194–1203.
50. Jiao Y, Killela PJ, Reitman ZJ, et al. Frequent ATRX, CIC, FUBP1 and IDH1 mutations refine the classification of malignant gliomas. Oncotarget 2012; 3(7):709–722.
51. Liu XY, Gerges N, Korshunov A, et al. Frequent ATRX mutations and loss of expression in adult diffuse astrocytic tumors carrying IDH1/IDH2 and TP53 mutations. Acta Neuropathol 2012; 124(5): 615-525.
52. Ebrahimi A, Skardelly M, Bonzheim I, et al. ATRX immunostaining predicts IDH and H3F3A status in gliomas. Acta Neuropathol Commun 2016; 4(1): 60.
53. Wiestler B, Capper D, Holland-Letz T, et al. ATRX loss refines the classification of anaplastic gliomas and identifies a subgroup of IDH mutant astrocytic tumors with better prognosis. Acta Neuropathol 2013; 126(3): 443–451.
54. Shao LW, Pan Y, Qi XL, et al. ATRX loss in adult supratentorial diffuse astrocytomas correlates with p53 over expression and IDH1 mutation and predicts better outcome in p53 accumulated patients. Histol Histopathol 2016; 31(1): 103-114.
55. Gleize V, Alentorn A, Connen de Kérillis L, et al. CIC inactivating mutations identify aggressive subset of 1p19q codeleted gliomas. Ann Neurol 2015; 78(3): 355-374.
56. Chen L, Voronovich Z, Clark K, et al. Predicting the likelihood of an isocitrate dehydrogenase 1 or 2 mutation in diagnoses of infiltrative glioma. Neuro Oncol 2014; 16(11): 1478-1483.
57. Reuss DE, Sahm F, Schrimpf D, et al. ATRX and IDH1-R132H immunohistochemistry with subsequent copy number analysis and IDH sequencing as a basis for an “integrated” diagnostic approach for adult astrocytoma, oligodendroglioma and glioblastoma. Acta Neuropathol 2015; 129(1): 133-1346.
58. Sahm F, Reuss D, Koelsche C, et al. Farewell to oligoastrocytoma: in situ molecular genetics favor classification as either oligodendroglioma or astrocytoma. Acta Neuropathol 2014; 128(4): 551-559.
59. Hewer E, Vajtai I, Dettmer MS, Berezowska S, Vassella E. Combined ATRX/IDH1 immunohistochemistry predicts genotype of oligoastrocytomas. Histopathology 2016; 68(2): 272-278.
60. Wilcox P, Li CC, Lee M, et al. Oligoastrocytomas: throwing the baby out with the bathwater? Acta Neuropathol 2015; 129(1): 147-149.
61. Huse JT, Diamond EL, Wang L, Rosenblum MK. Mixed glioma with molecular features of composite oligodendroglioma and astrocytoma: a true “oligoastrocytoma”? Acta Neuropathol 2015; 129(1): 151-153.
62. Sahm F, Schrimpf D, Jones DT, et al. Next-generation sequencing in routine brain tumor diagnostics enables an integrated diagnosis and identifies actionable targets. Acta Neuropathol 2016; 131(6): 903-910.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článek Jaká je Vaše diagnóza?Článek Jaká je Vaše diagnóza?
Článok vyšiel v časopiseČesko-slovenská patologie

2017 Číslo 1-
Všetky články tohto čísla
-
Novinky vo WHO klasifikácii nádorov centrálneho nervového systému 2016
– 1. časť: Difúzne infiltrujúce gliómy -
Novinky ve WHO klasifikaci nádorů centrálního nervového systému 2016
2. část: Embryonální nádory CNS a ostatní skupiny nádorů (kromě difúzních gliomů) - MONITOR aneb nemělo by Vám uniknkout, že...
- Familiární hemofagocytující lymfohistiocytóza: od autopsie k prenatální diagnóze. Kazuistika
- Novinky ve WHO klasifikaci nádorů CNS 2016
- Sebaceozní adenom vzniklý ve zralém cystickém teratomu ovária. Kazuistika
- Neobvyklý histopatologický obraz akútneho poškodenia pľúc v rôznej fáze rezorpcie s prevahou organizujúcej sa pneumónie u jedinca s chrípkou A(H1N1)
- Rozhovor s novým předsedou výboru naší odborné společnosti
- Pitva šlechtice Melchiora z Redernu roku 1600 v Německém Brodu
- Jaká je Vaše diagnóza?
- 90. životní jubileum prof. MUDr. Rostislava Koďouska, DrSc.
- Jaká je Vaše diagnóza?
- MONITOR aneb nemělo by Vám uniknout, že...
-
Novinky vo WHO klasifikácii nádorov centrálneho nervového systému 2016
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle-
Novinky vo WHO klasifikácii nádorov centrálneho nervového systému 2016
– 1. časť: Difúzne infiltrujúce gliómy -
Novinky ve WHO klasifikaci nádorů centrálního nervového systému 2016
2. část: Embryonální nádory CNS a ostatní skupiny nádorů (kromě difúzních gliomů) - Neobvyklý histopatologický obraz akútneho poškodenia pľúc v rôznej fáze rezorpcie s prevahou organizujúcej sa pneumónie u jedinca s chrípkou A(H1N1)
- Sebaceozní adenom vzniklý ve zralém cystickém teratomu ovária. Kazuistika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




