Hodnocení zánětlivé infiltrace (tumor infiltrujících lymfocytů – TIL) u maligního melanomu
Evaluation of inflammatory cells (tumor infiltrating lymphocytes – TIL) in malignant melanoma
The evaluation of inflammatory infiltrate (tumor infiltrating lymphocytes – TIL) should be a standard part of biopsy examination for malignant melanoma. Currently, the most commonly used assessment method according to Clark is not optimal and there have been attempts to find an alternative system. Here we present an overview of possible approaches involving five different evaluation methods based on hematoxylin-eosin staining, including the recent suggestion of unified TIL evaluation method for all solid tumors. The issue of methodology, prognostic and predictive significance of TIL determination as well as the importance of immunohistochemical subtyping of inflammatory infiltrate is discussed.
Keywords:
malignant melanoma – tumor infiltrating lymphocytes – prediction – prognosis
Autoři:
Pavel Dundr; Kristýna Němejcová
; Michaela Bártů; Ivana Tichá; Radek Jakša
Působiště autorů:
Ústav patologie 1. LF UK a VFN v Praze
Vyšlo v časopise:
Čes.-slov. Patol., 54, 2018, No. 1, p. 27-31
Kategorie:
Přehledový článek
Souhrn
Hodnocení zánětlivé celulizace (tumor infiltrujících lymfocytů – TIL) by u maligního melanomu mělo být standardní součástí bioptického vyšetření. Nejčastěji používaný způsob hodnocení podle Clarka však není optimální a je snaha o nalezení alternativního systému. V následujícím sdělení podáváme přehled možných přístupů zahrnujících pět různých způsobů hodnocení z barvení hematoxylin-eozinem včetně recentního návrhu sjednocené koncepce hodnocení TIL pro všechny solidní nádory. Diskutována je problematika metodiky, prognostického a prediktivního významu stanovení TIL a také význam imunohistochemické subtypizace zánětlivého infiltrátu.
Klíčová slova:
maligní melanom – tumor infiltrující lymfocyty – predikce – prognóza
Hodnocení rozsahu zánětlivé infiltrace u maligních nádorů (nejčastěji označované jako tumor infiltrující lymfocyty (TIL)), je parametr, který je předmětem zájmu u některých solidních nádorů už delší dobu (1). Ukázalo se, že tento parametr má u některých nádorů prognostický význam (2,3). Stále častěji se však diskutuje i prediktivní význam, který byl prokázán např. u karcinomu prsu či kolorektálního karcinomu (s ohledem na indikaci chemoterapie), a zřejmě by mohl být u některých nádorů využit i jako prediktor odpovědi na imunoterapii check-point inhibitory (4,5). Problémem využití hodnocení TIL v rutinní praxi je však často nejednotnost v metodice hodnocení, která limituje reprodukovatelnost výsledků a tím i praktický dopad takového hodnocení. Standardizované postupy jsou dostupné zejména pro hodnocení TIL u karcinomu prsu a u kolorektálního karcinomu (tzv. „imunoskóre“)(6-9). U maligního melanomu (MM) je situace s ohledem na metodiku hodnocení nejednoznačná - všechny dostupné guidelines doporučují způsob hodnocení podle Clarka. Tento způsob má však určité limitace a snahou je nalézt a na dostatečném souboru případů validovat způsob jiný s dostatečnou inter- a intrapersonální shodou a výpovědní hodnotou (10, 11). V následujícím sdělení je diskutováno 5 možných způsobů hodnocení rozsahu zánětlivé infiltrace u MM ze základního barvení hematoxylin-eozinem (HE), včetně zcela recentního postupu navrhovaného „International Immuno-Oncology Biomarker Working Group“ pro všechny solidní nádory (11). Zmíněny jsou také možnosti a význam imunohistochemické typizace složení zánětlivého infiltrátu.
HODNOCENÍ ZÁNĚTLIVÉHO INFILTRÁTU U MM
Způsob hodnocení rozsahu zánětlivé celulizace je v různých studiích odlišný. (10-14). Obecně platí několik pravidel: i) hodnotí se přítomnost pouze kulatobuněčných zánětlivých elementů, nikoliv polymorfonukleárů; ii) jako tumor infiltrující lymfocyty jsou označovány pouze buňky infiltrující hnízda nádorových buněk s jejich patrnou disrupcí a / nebo lymfocyty v přímém kontaktu s nádorovými buňkami (nikoliv tedy lymfocyty přítomné pouze v okolí nádoru či v jeho stromatu); iii) hodnotí se pouze vertikální růstová fáze, nikoliv horizontální komponenta; iv) v rámci standardizace a reprodukovatelnosti by mělo z bioptického nálezu vyplývat, jakým způsobem bylo hodnocení provedeno. Uvedené zcela neplatí pro pátý způsob hodnocení navrhovaný „International Immuno-Oncology Biomarker Working Group“ pro všechny solidní nádory, který je obecným přístupem poněkud odlišný a v detailech je popsán níže.
Hodnocení podle Clarka
Jedná se o historicky první klasifikaci, která podle rozsahu TIL rozděluje MM na 3 kategorie – i) „absent“; ii) „non-brisk“; iii) „brisk“ (10).
- i) „Absent“ - z definice nejsou v nádoru přítomny žádné lymfocyty (mohou však být přítomny v okolí nádoru, avšak bez pronikání do vlastního nádoru)(obr. 1A, 1B).
- ii) „Non-brisk“ – přítomno je jedno či více ložisek lymfocytární infiltrace v oblasti vertikální růstové fáze. Ložiska mohou být pouze v periferních částech nádoru (periferní „non-brisk“ kategorie), či v celém rozsahu nádoru (difúzní „non-brisk“ kategorie)(obr. 1C, 1D).
- iii) „Brisk“ – difúzní infiltrace celé oblasti vertikální růstové fáze (difúzní „brisk“ kategorie), či difúzní infiltrát postihující periferní oblasti nádoru v celém rozsahu (periferní „brisk“ kategorie)(obr. 1E, 1F).
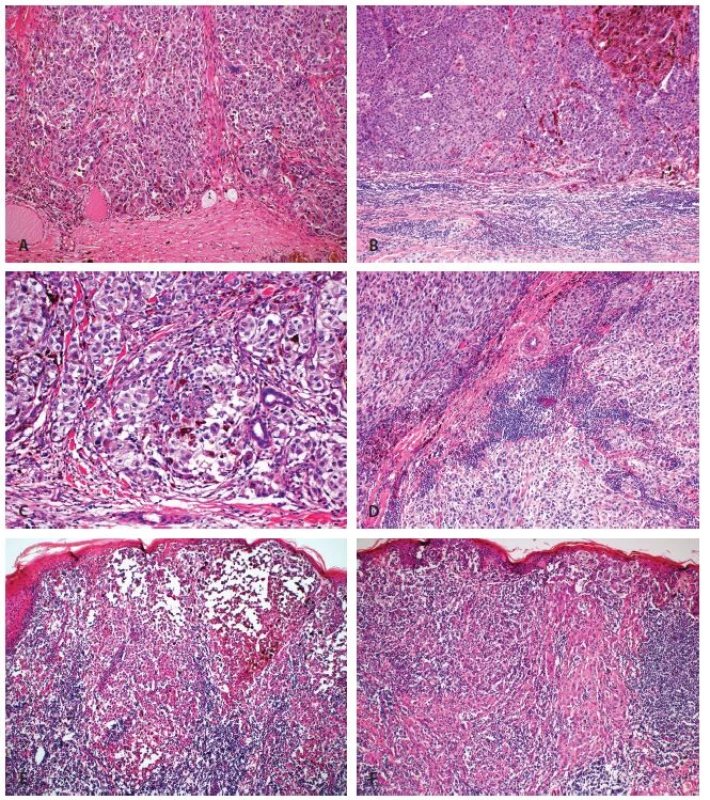
Výhodou tohoto systému hodnocení je jednoduchost a dobrá reprodukovatelnost (inter- i intrapersonální shoda). Nevýhodou je: i) absence přesných kritérií pro hodnocení – není např. jasné, kolik lymfocytů musí být přítomno, aby již byly hodnoceny jako „fokální“; ii) výsledek kategorie periferní „brisk“, zejména u velkých nádoru, nezohledňuje celkový rozsah infiltrace a většina nádoru (centrální oblasti) může být bez TIL, přesto však je nádor hodnocen shodně („brisk“) jako nádory difúzně prostoupené zánětlivými elementy; iii) hodnocení nezohledňuje přítomnost lymfocytů v okolí nádoru, které nepronikají do vlastního nádoru, avšak mohou být přítomny i ve velkém množství – význam tohoto infiltrátu je nicméně nejasný.
Hodnocení podle „Melanoma Institute Australia“
Tento systém byl vyvinut v Austrálii v rámci uvedeného „Melanoma Institute Australia“ v roce 2012. Je založen na hodnocení TIL na 4stupňové škále – grade 0-3. Kombinuje rozsah (fokální, multifokální, difúzní) a denzitu (mírná, střední, výrazná) infiltrace.(12)
- Grade 0 – absence TIL.
- Grade 1 – mírná či střední denzita, rozsah fokální; mírná denzita, rozsah multifokální.
- Grade 2 – výrazná denzita, rozsah fokální; střední či výrazná denzita, rozsah multifokální, mírná denzita, rozsah difúzní.
- Grade 3 – střední či výrazná denzita, rozsah difúzní.
Výhodou systému je oproti hodnocení dle Clarka přesnější klasifikace zejména s ohledem na rozsah infiltrace. Stejně jako u hodnocení dle Clarka lze předpokládat dobrou reprodukovatelnost. Nejsou sice přesná kritéria definující jednotlivé stupně denzity infiltrace, 3stupňová škála však umožňuje poměrně přesné hodnocení. Nevýhodou je stejně jako u hodnocení podle Clarka nezohlednění přítomnosti lymfocytů v okolí nádoru. Další nevýhodou je také limitace daná malými zkušenostmi s tímto způsobem hodnocení, a tedy nedostatkem dat s ohledem na praktický přínos, zejména prognostický význam. To však platí i pro další níže uvedené systémy hodnocení.
Hodnocení podle Saldanhy
Jedná se o semikvantitativní systém založený pouze na hodnocení rozsahu zánětlivé infiltrace, bez ohledu na její denzitu.(14) Rozsah se hodnotí vždy zaokrouhleně v desítkách procent (tedy 10 %, 20 %, 30 % atd.), s tím, že na dolní a horní hranici je povoleno hodnocení na 5 %, resp. 95 %.
Výhodou systému je: i) očekávaná vysoká reproducibilita; ii) zohlednění rozsahu infiltrace bez ohledu na jeho lokalitu (např. oproti hodnocení dle Clarka velké nádory s difúzním infiltrátem v periferních částech budou mít celkově nízké procento infiltrace, byť i při hodnocení podle Clarka by byly klasifikovány jako periferní „brisk“. Nevýhodou je, stejně jako u předchozích systémů, nezohlednění přítomnosti lymfocytů v okolí nádoru.
Hodnocení podle Parka
Toto hodnocení je modifikací způsobu hodnocení, který byl použit u MM v rámci analýzy případů ze studie TCGA – tam byl použit původně z důvodů, že ve vzorcích zařazených do studie často nebyly přítomny periferní oblasti nádoru (15). V modifikaci podle Parka se hodnotí 2 kompartmenty: i) vlastní nádor (zahrnující nádorové elementy i nádorové stroma); ii) okolí nádoru (13). U obou kompartmentů se dále hodnotí na 4stupňové škále distribuce lymfocytů a jejich denzita.
- Distribuce: 0 - absence lymfocytů; 1 – lymfocyty v < 25 %; 2 – lymfocyty ve 25 – 50 %; 3 – lymfocyty ve > 50 %.
- Denzita: 0 – žádná (absence lymfocytů); 1 – mírná; 2 – střední; 3 – výrazná.
Výhodou systému je dobrá reproducibilita, standardizace vyšetřování, a zohlednění přítomnosti lymfocytů v okolí nádoru.
Systém navrhovaný „International Immuno-Oncology Biomarker Working Group“
Jedná se o systém vycházející ze standardizované metodiky pro hodnocení TIL u karcinomu prsu, vypracované stejnou pracovní skupinou v minulosti (8,9,11). Systém hodnotí procentuální rozsah (denzitu) lymfocytární infiltrace odděleně v oblasti stromatu a nádoru (u některých typů nádoru, jako je karcinom prsu, však má prognostický význam pouze hodnocení stromatu). Hodnotí se pouze oblast invazivního nádoru zahrnující invazivní okraj a centrální oblast, které jsou přesně definovány a lze je reportovat samostatně. Invazivní okraj vychází z metodiky hodnocení „imunoskóre“ u kolorektálního karcinomu a z definice se jedná o zónu v periferii nádoru širokou 1 mm (zahrnující 0,5 mm šíře nádoru a 0,5 mm šíře přilehlého stromatu). V tuto chvíli nicméně nejsou definovány klinicky relevantní úrovně TIL – jedná se pouze o metodický návrh, který je nutné ověřit v praxi a provést „naprahování“ do prognosticky významných skupin. Výhodná na tomto systému je kromě tolik žádoucí standardizace i relativní jednoduchost založená na faktu, že se stejně jako u předchozích metodik jedná o systém vycházející z barvení hematoxylin-eozinem bez nutnosti využití imunohistochemických metod či na většině pracovišť nedostupných počítačových systémů obrazové analýzy. Systém lze použít pro primární i metastatické léze, je však nutno jej ověřit v reálné praxi a srovnat jeho výsledky se stávajícími způsoby hodnocení.
DISKUZE
Hodnocení přítomnosti a rozsahu zánětlivé celulizace (tumor infiltrujících lymfocytů - TIL) je u MM standardní součástí bioptického vyšetření. U jiných solidních nádorů lze toto očekávat v brzké době, zavedení do rutinní praxe však naráží na několik problémů, z nichž v tuto chvíli nejvíce limitující je u většiny nádorů aspekt metodický. Bez sjednocené metodiky lze obtížně vyhodnocovat získaná data a udělat si tak jasnou představu o prognostickém a prediktivním významu TIL. V současné době jsou asi nejpropracovanější systémy hodnocení TIL u kolorektálního karcinomu a karcinomu prsu (6,8,9). U kolorektálního karcinomu se jedná o tzv. „imunoskóre“, u kterého je přesně definovaná metodika – problém však je, že se nejedná o volně „dostupnou“ metodiku a vlastní projekt „imunoskóre“ je doposud ve fázi validace a omezen na participující instituce (16). V rámci tohoto hodnocení se používá i imunohistochemické vyšetření a proces je poměrně komplikovaný se sofistikovanými postupy počítání lymfocytů v centrální a periferní oblasti nádoru pomocí počítačové obrazové analýzy. Význam TIL u kolorektálního karcinomu však potvrdily i studie využívající alternativní systémy hodnocení.
Jinou cestou se ubírá hodnocení TIL u karcinomu prsu - toto hodnocení je v rámci pracovní skupiny „International Immuno-Oncology Biomarker Working Group“ standardizováno a jsou definovány přesné a podrobné postupy jak jej provést (8,9). Výhodou je, že se vychází pouze z barvení hematoxylin-eozin. Na rozdíl např. od již zmíněného kolorektálního karcinomu, ale třeba i od maligního melanomu, se však hodnotí pouze přítomnost lymfocytů ve stromatu invazivního nádoru, nikoliv tedy lymfocytů infiltrujících vlastní epitelové nádorové struktury. Z tohoto hodnocení vychází i navrhované standardizované hodnocení TIL, které by bylo využitelné u všech solidních nádorů včetně maligního melanomu.
U maligního melanomu by mělo být hodnocení TIL provedeno standardně v rámci bioptického vyšetření podle všech hlavních guidelines (The Royal College of Pathologists (UK), The Royal College of Pathologists of Australasia, College of American Pathologists, ICCR). Tyto guidelines uvádějí jako doporučený postup hodnocení podle Clarka. Uvedený způsob však není z různých důvodů optimální, výsledky s ohledem na prognostický význam TIL jsou při této metodice nejednoznačné a snaha je o nalezení jiného systému hodnocení, který by umožnil přesnější stratifikaci pacientů do prognosticky významných skupin. Při hodnocení dle Clarka představuje problém zejména heterogenita skupiny „non-brisk“ (zahrnující případy se zcela minimální infiltrací i případy s výraznou, nikoliv však difúzní infiltrací), která bývá pro účely statistického vyhodnocení prediktivního významu někdy slučována s kategorií „absent“. Diskutabilní je také kategorie periferní „brisk“, která zejména u velkých nádorů nezohledňuje reálný rozsah infiltrace s ohledem na procentuální vyjádření. Tyto problémy řeší všechny uvedené semikvantitativní metodiky hodnocení – u těchto systémů je však pro praktické využití nutné „naprahování“ do prognosticky významných skupin.
Prognostický význam stanovení TIL byl u maligního melanomu prokázán ve více studiích (17,18). První z nich, hodnotící různé morfologické aspekty melanomu včetně přítomnosti zánětlivé celulizace, a zmiňující prognostický význam této celulizace, byla uveřejněna v roce 1981 (19). Později definoval Clark et al. metodiku hodnocení přítomnosti TIL a tento způsob hodnocení je dosud nejčastěji používán (10). Studie používající hodnocení podle Clarka však mají rozporuplné výsledky, v některých se prognostický význam prokázal, jiné jsou v tomto ohledu nejednoznačné či prognostický význam neprokázaly (20). Mezi tyto studie patří např. práce Burtona et al., kteří na souboru 515 pacientů (Breslow ≥ 1 mm; stratifikace pouze na „brisk“ a „non-brisk“ zahrnující i kategorii „absent“) sice prokázali prediktivní význam TIL s ohledem na postižení SLN, neprokázali však nezávislý význam TIL jako prediktoru pro disease-free survival (DFS) a overal survival (OS)(21).
Vysvětlení těchto diskrepancí je pravděpodobně multifaktoriální, zahrnuje zejména použitou metodiku hodnocení, charakter souboru (Breslowovo skóre, typ růstu, typ melanomu) a v neposlední řadě i faktory zahrnuté do multivariantní analýzy. Např. ve studii Burtona et al., která neprokázala prediktivní význam TIL pro DFS a OS, sami autoři upozorňují, že tento význam by byl prokázán v případě vyloučení stavu SLN z multivariantních analýz.
Na vliv metodiky poukazuje studie Saldanha et al. (655 pacientů), ve které autoři prokázali statisticky signifikantní význam přítomnosti TIL pro metastasis-free survival (MFS), OS a disease-specific survival (DSS) pouze při použití jimi navrženého numerického skóre (viz výše v popisu metodik hodnocení – pro účely statistického zpracování byli pacienti rozděleni do 3 skupin: i) 0 % a 5 %; ii) 10 % a 20 %; iii) 30 % a více (14). Při použití metodiky podle Clarka (stejně jako v jiných studiích pro hodnocení sloučili kategorii absent a non-brisk) bylo v jejich studii statisticky signifikantní pouze MFS, nikoliv však DSS a OS.
Na dosud asi největším publikovaném souboru čítajícím 1865 případů pacientů s MM ≥ 0,75 mm byla prokázána (metodika hodnocení používaná v rámci „Melanoma Institute Australia“) korelace mezi rozsahem (grade) TIL a rizikem postižením sentinelové uzliny (SLN; vyšetřena u 1138 pacientů)(12). Podle jednotlivých grade TIL bylo riziko postižení SLN následující: grade 0 – 27,8 %; grade 1 – 20,1 %; grade 2 – 18,3 %; grade 3 – 5,6 %). Grade 3 TIL, který byl s ohledem na snížení rizika postižení SLN nejvýznamnější, se však vyskytl ve vyšetřovaném souboru pouze u 3,2 % pacientů. V této studii byl také prokázán prediktivní význam TIL s ohledem na celkové přežití a riziko recidivy (grade TIL byl třetí prognosticky nejsilnější faktor – za Breslowovým skóre a ulcerací – s ohledem na „recurrence-free survival“, slabší avšak statisticky významný prognostický význam byl prokázán i u „melanoma-specific survival“).
Studie Parka et al., při které byla použita modifikace skórovacího systému použitého při analýze TIL u MM ze studie TCGA, klasifikovala melanomy (177 pacientů) podle lymfocytárního skóre v jednotlivých kompartmentech (viz výše uvedená metodika) na nízké (skóre 0-2)/vysoké (skóre 3-6) intratumorální (I-LS low/ I-LS high) a peritumorální skóre (P-LS low a P-LS high)(13). Intratumorální lymfocyty byly v této studii prokázány u 37 % případů, u 15 % byly hodnoceny jako I-LS high. Peritumorální lymfocyty byly prokázány u 82 % případů, u 43 % byly hodnoceny jako P-LS high. Bez ohledu na rozsah infiltrace byly lymfocyty v obou kompartmentech nalezeny u 34 % případů. V rámci studie byly vyhodnoceny různé kombinace skóre či přítomnosti lymfocytu ve srovnání s různými klinickopatologickými rysy (věk, pohlaví, typ melanomu atd.). Prognostický význam s ohledem na DFS či OS se nepodařilo prokázat, pouze ve skupině akrálně-lentiginózního melanomu (80 pacientů) byla přítomnost vysokého LS v obou kompartmentech spojena s delším DFS.
Vlastní biologický význam přítomnosti zánětlivého infiltrátu u maligního melanomu je daleko složitější a pouhá přítomnost zánětlivých elementů sama o sobě může reflektovat určitý stav imunitní odpovědi proti nádoru (či jejího potenciálu), jde však o parametr nedokonalý a s ohledem na komplexnost interakcí mezi nádorem a hostitelem nedostatečný – imunitní interakce jsou mj. ovlivněny stromálním mikroprostředím, globálním stavem imunity, antigenními vlastnostmi nádoru (neoantigeny, nádorové antigeny, virové antigeny), ale i faktory zevního prostředí a v neposlední řadě např. střevním mikrobiomem (22). V tomto kontextu se nabízí podrobnější imunofenotypizace zánětlivého infiltrátu se snahou o rozlišení a případně i kvantifikaci jednotlivých subtypů T lymfocytů. Prací zabývajících se touto problematikou u různých nádorů je poměrně velké množství a výsledky jsou rozporuplné (4,23,24). Vzhledem k rozdílným výsledkům z různých studií i u odlišných typů nádorů je obtížné přesně definovat subtypy lymfocytů asociovaných s dobrou a špatnou prognózou, nicméně obecně lze říci, že přítomnost cytotoxických lymfocytů (CD8+), paměťových lymfocytů (CD45RO+), Th1 lymfocytů, NK buněk, makrofágů s M1 fenotypem a dendritických buněk s DC1 fenotypem se zdá být pozitivní prognostický faktor (25). Význam dalších lymfocytárních populací (Th2, Treg, Th17) je obecně diskutabilní a zřejmě záleží na konkrétním typu nádoru a také na nádorovém mikroprostředí. Imunosupresivní efekt související s nepříznivou prognózou mají makrofágy s M2 fenotypem, dendritické buňky s DC2 fenotypem a tzv. „myeloid-derived supressor cells“ – tedy nezralé myeloidní buňky s imunosupresivním potenciálem.
U MM byl v některých studiích prokázán pozitivní prognostický význam přítomnosti cytotoxických T lymfocytů (CD8+, granzym +), aktivovaných CD69+ lymfocytů a CD20+ B lymfocytů (26). V jedné práci byl prokázán i prediktivní význam CD8+ T lymfocytů, zejména s jejich výskytem v invazivním okraji v periferii nádoru a v přilehlém stromatu (27). Naopak přítomnost FOXP3+ Treg lymfocytů byl negativní prognostický marker. Jiná práce však při srovnání hodnocení TIL z HE a imunohistochemické subtypizace nenalezla žádnou přidanou hodnotu imunohistochemického vyšetření (28).
Kromě prognostického významu však nabývá na důležitosti snaha o nalezení prediktivních markerů odpovědi na imunoterapii. Ta je důležitá zejména s ohledem na fakt, že pouze část pacientů, kteří podstoupí léčbu inhibitory PD-1/PD-L1, vykáže kompletní vymizení nádoru, u další části je pouze parciální odpověď svědčící zpočátku pro účinnost léčby, nicméně bez dosažení žádoucího efektu v podobě kompletní eliminace nádorové populace, a zbylá část pacientů nereaguje vůbec, či dokonce dochází k akcelerované progresi nádoru (29,30). Vlastní prediktivní význam TIL může souviset s faktem, jestli se efektorové T lymfocyty dostanou do kontaktu s nádorovými buňkami. Podle současné koncepce je možné nádory stratifikovat do 3 základních fenotypických skupin: i) „immune-inflamed“ (CD4 a CD8, myeloidní, monocytoidní buňky – přímém kontaktu s nádorovými strukturami) – tento fenotyp svědčí pro přítomnost protinádorové odpovědi, která byla z nějakého důvodu potlačena (nejspíše imunosupresivní prostředí v oblasti nádoru) – studie ukazují, že u pacientů s tímto fenotypem se nejčastěji vyskytuje odpověď na imunoterapii – nikoliv však vždy a přítomnost zánětlivé infiltrace v nádoru je tedy nezbytná, avšak sama o sobě nestačí; ii) „immune-excluded“ (přítomnost hojných zánětlivých elementů, které však nepronikají do nádoru a jsou v jeho okolí či stromatu). Po anti-PD-1/PD-L1 dochází ke známkám aktivace T lymfocytů, nikoliv však jejich pronikání do nádorových struktur a odpověď na imunoterpii je vzácná; iii) „immune-desert“ (absence či pouze minimální přítomnost zánětlivých elementů v nádoru, jeho stromatu i okolí) – tento fenotyp pravděpodobně svědčí po nepřítomnost preexistující protinádorové imunity (22).
ZÁVĚR
Hodnocení rozsahu zánětlivé infiltrace by mělo být součástí každého vyšetření maligního melanomu s vertikální růstovou fází. Prognostický význam přítomnosti TIL nebyl sice přesvědčivě prokázán ve všech studiích, to však může být ovlivněno více faktory, z nichž pouze jedním je použitá metodika. S ohledem na metodiku je vhodné zvážit namísto obvyklého způsobu hodnocení dle Clarka některý z jiných semikvantitativních způsobů, v bioptickém nálezu je však nutné uvést, podle kterého způsobu bylo hodnocení provedeno a dokud nebude více informací, při použití alternativního způsobu je vhodné i současné vyhodnocení dle Clarka (časová zátěž je zcela minimální). Diskutabilní je v tuto chvíli obecně praktický význam stanovení TIL, a to nejen s ohledem na prognózu, ale zejména predikci odpovědi na léčbu imunitními check-point inhibitory. Pro tyto účely je však zapotřebí získat dostatečná data včetně vyhodnocení, stačí-li hodnocení TIL z barvení hematoxylin-eozinem podle některého z uvedených postupů, či je nutné verifikovat složení zánětlivého infiltrátu za použití imunohistochemických metod. Obecně však nutno konstatovat, že využití TIL pro prediktivní účely momentálně není podpořeno dostatečnými důkazy a nutné jsou další studie zaměřené na standardizaci metodiky a vyhodnocení významu TIL. Pokud se však tento marker má dostat do širokého využití v rutinní praxi, je jako první krok nutno vytvořit metodicky co nejjednodušší standardizovaný systém hodnocení nejlépe vycházející pouze z barvení hematoxylin-eozinem. Tento systém však nejprve musí prokázat svou funkčnost s ohledem na prognostickou i prediktivní hodnotu na dostatečném souboru pacientů.
PODĚKOVÁNÍ
Práce podpořena MZ ČR (projekt RVO-VFN 64165 a projekt AZV 16-30954A), Univerzitou Karlovou (projekt Progres Q28/LF1) a OPPK (Výzkumná laboratoř nádorových onemocnění CZ.2.16/3.1.00/24509).
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
Prof. MUDr. Pavel Dundr, Ph.D.
Ústav patologie 1. LF UK a VFN v Praze
Studničkova 2, Praha 2, 128 00
tel.: +420 224968624
email: pdundr@seznam.cz
Zdroje
1. Hersh EM, Mavligit GM, Gutterman JU, Barsales PB. Mononuclear cell content of human solid tumors. Med Pediatr Oncol 1976; 2(1): 1-9.
2. Wang B, Wu S, Zeng H, et al. CD103+ Tumor Infiltrating Lymphocytes Predict a Favorable Prognosis in Urothelial Cell Carcinoma of the Bladder. J Urol 2015; 194(2): 556-562.
3. Wolf GT, Chepeha DB, Bellile E, et al. Tumor infiltrating lymphocytes (TIL) and prognosis in oral cavity squamous carcinoma: a preliminary study. Oral Oncol 2015; 51(1): 90-95.
4. Solinas C, Carbognin L, De Silva P, Criscitiello C, Lambertini M. Tumor-infiltrating lymphocytes in breast cancer according to tumor subtype: Current state of the art. Breast 2017; 35: 142-150.
5. Solinas C, Ceppi M, Lambertini M, et al. Tumor-infiltrating lymphocytes in patients with HER2-positive breast cancer treated with neoadjuvant chemotherapy plus trastuzumab, lapatinib or their combination: A meta-analysis of randomized controlled trials. Cancer Treat Rev 2017; 57: 8-15.
6. Galon J, Costes A, Sanchez-Cabo F, et al. Type, density, and location of immune cells within human colorectal tumors predict clinical outcome. Science 2006; 313(5795): 1960-1964.
7. Mlecnik B, Tosolini M, Kirilovsky A, et al. Histopathologic-based prognostic factors of colorectal cancers are associated with the state of the local immune reaction. J Clin Oncol 2011; 29(6): 610-618.
8. Denkert C, Wienert S, Poterie A, et al. Standardized evaluation of tumor-infiltrating lymphocytes in breast cancer: results of the ring studies of the international immuno-oncology biomarker working group. Mod Pathol 2016; 29(10): 1155-1164.
9. Salgado R, Denkert C, Demaria S, et al. The evaluation of tumor-infiltrating lymphocytes (TILs) in breast cancer: recommendations by an International TILs Working Group 2014. Ann Oncol 2015; 26(2): 259-271.
10. Clark WH, Jr., Elder DE, Guerry Dt, et al. Model predicting survival in stage I melanoma based on tumor progression. J Natl Cancer Inst 1989; 81(24): 1893-1904.
11. Hendry S, Salgado R, Gevaert T, et al. Assessing Tumor-infiltrating Lymphocytes in Solid Tumors: A Practical Review for Pathologists and Proposal for a Standardized Method From the International Immunooncology Biomarkers Working Group: Part 1: Assessing the Host Immune Response, TILs in Invasive Breast Carcinoma and Ductal Carcinoma In Situ, Metastatic Tumor Deposits and Areas for Further Research. Adv Anat Pathol 2017; 24(5): 235-251.
12. Azimi F, Scolyer RA, Rumcheva P, et al. Tumor-infiltrating lymphocyte grade is an independent predictor of sentinel lymph node status and survival in patients with cutaneous melanoma. J Clin Oncol 2012; 30(21): 2678-2683.
13. Park CK, Kim SK. Clinicopathological significance of intratumoral and peritumoral lymphocytes and lymphocyte score based on the histologic subtypes of cutaneous melanoma. Oncotarget 2017; 8(9): 14759-14769.
14. Saldanha G, Flatman K, Teo KW, Bamford M. A Novel Numerical Scoring System for Melanoma Tumor-infiltrating Lymphocytes Has Better Prognostic Value Than Standard Scoring. Am J Surg Pathol 2017; 41(7): 906-914.
15. Cancer Genome Atlas. Genomic Classification of Cutaneous Melanoma. Cell 2015; 161(7): 1681-1696.
16. Kirilovsky A, Marliot F, El Sissy C, Haicheur N, Galon J, Pages F. Rational bases for the use of the Immunoscore in routine clinical settings as a prognostic and predictive biomarker in cancer patients. Int Immunol 2016; 28(8): 373-382.
17. Castaneda CA, Torres-Cabala C, Castillo M, et al. Tumor infiltrating lymphocytes in acral lentiginous melanoma: a study of a large cohort of cases from Latin America. Clin Transl Oncol 2017. In Press
18. Clemente CG, Mihm MC, Jr., Bufalino R, Zurrida S, Collini P, Cascinelli N. Prognostic value of tumor infiltrating lymphocytes in the vertical growth phase of primary cutaneous melanoma. Cancer 1996; 77(7): 1303-1310.
19. Day CL, Sober AJ, Kopf AW, et al. A prognostic model for clinical stage I melanoma of the trunk. Location near the midline is not an independent risk factor for recurrent disease. Am J Surg 1981; 142(2): 247-251.
20. Eriksson H, Frohm-Nilsson M, Jaras J, et al. Prognostic factors in localized invasive primary cutaneous malignant melanoma: results of a large population-based study. Br J Dermatol 2015; 172(1): 175-186.
21. Burton AL, Roach BA, Mays MP, et al. Prognostic significance of tumor infiltrating lymphocytes in melanoma. Am Surg 2011; 77(2): 188-192.
22. Chen DS, Mellman I. Elements of cancer immunity and the cancer-immune set point. Nature 2017; 541(7637): 321-330.
23. Hendry S, Salgado R, Gevaert T, et al. Assessing tumor-infiltrating lymphocytes in solid tumors: a practical review for pathologists and proposal for a standardized method from the international immuno-oncology biomarkers working group: Part 2: TILs in melanoma, gastrointestinal tract carcinomas, non-small cell lung carcinoma and mesothelioma, endometrial and ovarian carcinomas, squamous cell carcinoma of the head and neck, genitourinary carcinomas, and primary brain tumors. Adv Anat Pathol 2017. In Press
24. Zeng DQ, Yu YF, Ou QY, Li XY, Zhong RZ, Xie CM, Hu QG. Prognostic and predictive value of tumor-infiltrating lymphocytes for clinical therapeutic research in patients with non-small cell lung cancer. Oncotarget 2016; 7(12): 13765-13781.
25. Fridman WH, Pages F, Sautes-Fridman C, Galon J. The immune contexture in human tumours: impact on clinical outcome. Nat Rev Cancer 2012; 12(4): 298-306.
26. Miracco C, Mourmouras V, Biagioli M, et al. Utility of tumour-infiltrating CD25+FOXP3+ regulatory T cell evaluation in predicting local recurrence in vertical growth phase cutaneous melanoma. Oncol Rep 2007; 18(5): 1115-1122.
27. Tumeh PC, Harview CL, Yearley JH, et al. PD-1 blockade induces responses by inhibiting adaptive immune resistance. Nature 2014; 515(7528): 568-571.
28. Weiss SA, Han SW, Lui K, et al. Immunologic heterogeneity of tumor-infiltrating lymphocyte composition in primary melanoma. Hum Pathol 2016; 57: 116-125.
29. Champiat S, Dercle L, Ammari S, et al. Hyperprogressive Disease Is a New Pattern of Progression in Cancer Patients Treated by Anti-PD-1/PD-L1. Clin Cancer Res 2017; 23(8): 1920-1928.
30. Saada-Bouzid E, Defaucheux C, Karabajakian A, et al. Hyperprogression during anti-PD-1/PD-L1 therapy in patients with recurrent and/or metastatic head and neck squamous cell carcinoma. Ann Oncol 2017; 28(7): 1605-1617.
Štítky
Patológia Súdne lekárstvo ToxikológiaČlánok vyšiel v časopise
Česko-slovenská patologie

2018 Číslo 1
Najčítanejšie v tomto čísle
- Hodnocení zánětlivé infiltrace (tumor infiltrujících lymfocytů – TIL) u maligního melanomu
- Prediktivní diagnostika u karcinomu prsu – co je nového pro rok 2018?
- Dediferencovaný karcinom ovaria – kazuistika
- Predikce odpovědi metastatického kolorektálního karcinomu na cílenou anti-EGFR léčbu
