-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Imunohistochemická diagnostika morbus Hirschsprung pomocí kalretininu
Immunohistochemical diagnostics of Hirschprung’s disease using calretinin
Histochemical diagnosis of Hirschsprung´s disease at our institution was introduced in the 1970s, calretinin imunohistochemistry on formalin fixed tissue was newly added in 2015. Employing both methods we were able to confirm Hirschsprung´s disease in 13 patients and exclude it in 34 patients since then. Calretinin seems highly reliable and easy to evaluate, it is not influenced by patient´s age, associated genetic features or the length of agangliosis. The number of inadequate samples was very low (3.8%). Histochemistry is useful as an adjunct tool to correct equivocal findings of calretinin staining and to facilitate diagnosis of short and ultra-short Hirschsprung´s disease. Serial biopsies from distal rectum and adjacent large bowel were obtained to assess the length of agangliosis preoperatively. The results of calretinin imunohistochemistry correlated very well with the findings in the colectomy specimens. In contrast, the length of affected bowel detected by histochemistry was often underestimated because acetylcholinesterase activity always diminishes orally irrespective of the length of aganglionic portion.
Keywords:
Hirschsprung´s disease – calretinin – immunohistochemistry – acetylcholinesterase – serial biopsy
Autori: Marta Ježová 1; Ondřej Souček 2; Jiří Tůma 3
Pôsobisko autorov: Ústav patologie, LF MU a FN Brno 1; Histologická a cytologická laboratoř, Ústí nad Orlicí 2; Klinika dětské chirurgie, ortopedie a traumatologie, FN Brno 3
Vyšlo v časopise: Čes.-slov. Patol., 55, 2019, No. 1, p. 53-59
Kategória: Původní práce
Súhrn
Histochemická diagnostika Hirschsprungovy nemoci byla na našem pracovišti zavedena v 70. letech minulého století, v roce 2015 jsme nově přidali imunohistochemický průkaz kalretininu na řezech z parafinových bloků. Od té doby jsme kombinací obou metod diagnostikovali morbus Hirschsprung u 13 pacientů, u 34 jsme jej vyloučili. Výhodou vyšetření exprese kalretininu je snadná interpretace a vysoká spolehlivost nezávislá na věku, genetickém pozadí a rozsahu choroby. Počet nediagnostických vzorků byl mimořádně nízký (3,8 %). Histochemie je pomocnou metodou, která koriguje nejasné nálezy a stále se osvědčuje při diagnostice krátkého a ultrakrátkého segmentu. Hranice aganglionárního úseku, které jsme před operací stanovili pomocí etážových odběrů s kalretininem, velmi dobře korelovaly s nálezem v definitivním resekátu. Proti tomu histochemická detekce vedla častěji k podhodnocení, protože reaktivita acetylcholinesterázy se bez ohledu na délku postiženého segmentu orálním směrem vytrácí.
Klíčová slova:
Hirschsprungova nemoc – kalretinin – imunohistochemie – acetylcholinesteráza – etážová biopsie
Hirschsprungova nemoc (HN) je vrozené neuromuskulární onemocnění tlustého střeva, jehož první přehledný klinický popis podal dánský pediatr Harald Hirschsprung v roce 1886. Trvalo však dalších 60 let, než byla správně pochopena patogeneze onemocnění spočívající v chybění gangliových buněk submukózního a myenterického plexu ve spastickém segmentu (1,2). Tento objev umožnil kauzální chirurgickou léčbu i zavedení bioptické diagnostiky, která se vyvíjela od skalpelem odebíraných excizí rekta s následnou suturou po šetrnější odběry sliznice a submukózy sací sondou. Rektosigma je postiženo v 80 % případů (krátký segment), tzv. dlouhý segment zasahující po lienální flexuru/colon transversum v 15 – 20 % případů (3). Totální aganglionóza tlustého střeva (TCA - total colonic aganglionosis) je definována postižením celého tlustého střeva až po ileocekální chlopeň a může přestupovat i na terminální ileum v délce kratší než 50 cm. Je diagnostikována u 4 – 13 % pacientů (4). Opačným pólem choroby je ultrakrátký segment, který nepřesahuje 2 cm nad vnitřní svěrač. HN postihuje přibližně 1 z 5000 živě narozených dětí s převahou chlapců. Většina případů přichází sporadicky, ale familiární zátěž zvyšuje riziko až 200x. Přibližně pětina dětí má přidružené vývojové vady nebo syndrom. HN je nejčastěji asociována s Downovým syndromem (cca 7 % pacientů), hluchotou, medulárním karcinomem štítné žlázy, syndromy MEN 2, neurofibromatózou, neuroblastomem a vývojovými vadami srdce, trávicí trubice, mozku a močopohlavního ústrojí. HN je multigenní onemocnění s více než 10 příčinnými geny. Nejvíce probádané jsou mutace protoonkogenu RET, které jsou nalézány asi u poloviny familiárních a 7 – 35 % sporadických forem HN (3,5). U novorozence se opožďuje odchod smolky, kojenci trpí chronickou obstipací, ileosními stavy, zvracením i paradoxními průjmy. K závažným komplikacím se řadí sterkorální vřed a perforace, obávaná je enterokolitida a toxické megakolon (6).
Předoperační histologická diagnóza, která je založena na absenci gangliových buněk v submukóze, vyžaduje sériové prokrajování vzorku o adekvátní hloubce. Enzymohistochemický průkaz patologicky zmnožených cholinergních vláken ve sliznici se provádí pouze ze zmražených řezů. Z imunohistochemických metod se nejvíce osvědčila protilátka proti kalretininu, která barví gangliové buňky i jejich slizniční výběžky. Stěna tlustého střeva s normálními inervačními poměry vykazuje jen slabou reakci cholinesterázy (dále negativní histochemie) a protilátka proti kalretininu barví nervová vlákna ve sliznici (dále pozitivní kalretinin). Diagnóza HN je založena na zesílení cholinesterázové reakce v patologických cholinergních vláknech (dále pozitivní histochemie) a současně na absenci gangliových buněk i jejich výběžků, které by bylo možné znázornit imunohistochemicky protilátkou proti kalretininu (dále negativní kalretinin). Délku postiženého úseku lze mapovat irigografií a etážovými odběry histologických vzorků. Cílem této práce je sdílet zkušenosti s diagnostikou HN pomocí imunohistochemického průkazu kalretininu a srovnat spolehlivost předoperačních etážových mikroexcizí hodnocených enzymohistochemicky a imunohistochemicky.
MATERIÁL A METODIKA
V období od ledna 2015 do dubna 2018 jsme kvůli podezření na HN vyšetřili metodou enzymové histochemie a imunohistochemie celkem 49 dětí ve věku 0 – 15 let. Věkové rozložení bylo následující: 0 – 3 měsíce 8 pacientů, 3 – 6 měsíců 14 pacientů, 6 – 12 měsíců 8 pacientů, 1 – 5 let 9 pacientů a více než 5 let 10 pacientů. Diagnóza byla u operovaných ověřena histologickým vyšetřením resekátu.
Odběry prováděl chirurg koloskopem nebo sukční sondou. První vzorek byl lokalizován v distálním rektu 1 – 3 cm nad linea dentata. V případě etážových odběrů následovaly další v pravidelných rozestupech do vzdálenosti 12 – 55 cm od anu. U jednoho pacienta byla místa odběrů měřena od stomie a nebylo dosaženo distální rektum, další měl odlišné anatomické poměry po resekci rektosigmatu pro HN před 10 lety. První sada mikroexcizí (4 – 8 od každého pacienta) byla odesílána nativně do laboratoře enzymové histochemie. Po orientaci pomocí lupy byly vzorky mrazeny směsí propan-butanu v tekutém dusíku a krájeny v kryostatu na 5µ tenké řezy. K průkazu aktivity acetylcholinesterázy byla provedena reakce dle Karnovského. Skla byla po nalití gelového média (acetylthiocholinjodid, tris-maleát pufr pH 6, citronan sodný, síran měďnatý, ferrokyanid draselný) inkubována ve vodní lázni při 37oC po dobu 2 hodin. Poté byl gel odstraněn a vzorky fixovány v Bakerově tekutině. Druhá sada řezů byla modifikována inhibicí nespecifické cholinesterázy ve tkáni přidáním iso-OMPA (iso-ACHE). Ke každému vyšetření byla zhotovena pozitivní kontrola (vzorek pacienta s ověřenou HN z archivního materiálu) a negativní kontrola (pacient bez HN). Struktury vykazující aktivitu enzymu se barví tmavě hnědě.
Druhá paralelní sada (1 – 8 vzorků od každého pacienta) určená k imunohistochemickému vyšetření byla fixována v 10% formolu a zalita do parafínu, poté barvena hematoxylinem a eozinem. K imunohistochemickému vyšetření byla použita primární myší monoklonální protilátka proti kalretininu (DAKO, klon DAK-Calret1, ředění 1 : 50) s detekčním systémem Mouse/Rabbit PolyDetector HRP/DAB (Bio SB Inc.) za vzniku hnědého reakčního produktu. Od října 2017 jsme změnili primární protilátku (Ventana Roche, klon SP 65, ready-to-use; detekční systém UltraView). Jako vnější pozitivní kontrola sloužil apendix, jehož nervové buňky vykazovaly silnou cytoplazmatickou a jadernou pozitivitu. Slabě se barvily žírné buňky, histiocyty a adipocyty, ostatní struktury se s výjimkou mezotelu nepřibarvovaly (negativní kontrola).
VÝSLEDKY
Ve sledovaném období jsme vyšetřili 49 dětí. Čtyři pacienti byli vyšetřeni dvakrát, celkem tedy bylo provedeno 53 paralelních histochemických a imunohistochemických vyšetření.
HN jsme vyloučili u 34 pacientů s negativní histochemií a pozitivním kalretininem (dále negat-HN). U dvou pacientů jsme vyslovili podezření na jinou dysganglionózu.
U 13 dětí jsme HN potvrdili pozitivní histochemií a negativním kalretininem. Jednalo se o 10 chlapců a 3 dívky stáří 7 dní až 3,5 roku. Dva pacienti trpěli Downovým syndromem a jeden srdeční vadou. Rodinná zátěž byla známa u dvou pacientek: HN u bratra a otce, resp. otce a dědečka. U všech pacientů s HN bylo možno vysledovat začátek obtíží v prvních dnech po porodu. Jednalo se o poruchy pasáže smolky, meteorismus a zvracení. Mezi prvními příznaky se objevila i novorozenecká perforace střeva a volvulus sigmatu. Nejstarší chlapec měl typickou trias: vzedmuté břicho, trvalou zácpu a v noci umazával. Všechny operace byly provedeny na stejném pracovišti, a to 9x laparoskopicky asistovaná resekce rektosigmatu podle Swensona a 3x totální kolektomie s ileoananální anastomózou. Histologické vyšetření potvrdilo 1x ultrakrátkou formu HN, 7x klasickou HN rektosigmatu, 2x dlouhý segment a 2x totální aganglionózu tlustého střeva. Jeden novorozenec má vyvedenou stomii a operace ho čeká po stabilizaci klinického stavu.
Histochemické vyšetření
Vzorky z distálního rekta (1 – 3 cm od linea dentata) byly v 9,8 % nevyhovující (anální část, autolýza). U 3 pacientů nebyl hodnotitelný žádný vzorek z této zóny. Ve 34 případech jsme hodnotili histochemii z distálního rekta jako negativní. Patologické zesílení acetylcholinesterázové reakce bylo pozorováno 16x (15x distální rektum, 1x 10 cm od anu u pacienta se stomií)
Imunohistochemická exprese kalretininu
Mikroexcize z distálního rekta chyběla u jednoho pacienta. Nevyhovující vzorky tvořily 3,8 % (anální kanál), nicméně u všech pacientů byl získán alespoň jeden vyhovující vzorek z distálního rekta. Imunohistochemický průkaz kalretininu v distálním rektu byl 37x pozitivní. Použitá protilátka znázornila síť nervových vláken ve sliznici (obr. 1). Patnáct vyšetření bylo negativních: 14x distální rektum, 1x 10 cm od anu u pacienta se stomií (obr. 2). Slabé tečkovité přibarvování hypertrofických submukózních nervů u jednoho pacienta jsme hodnotili jako nespecifické, tj. také negativní.
Obr. 1. Pozitivní imunohistochemický průkaz kalretininu ve slizničních nervových vláknech představuje normální nález, negat-HN (200x). 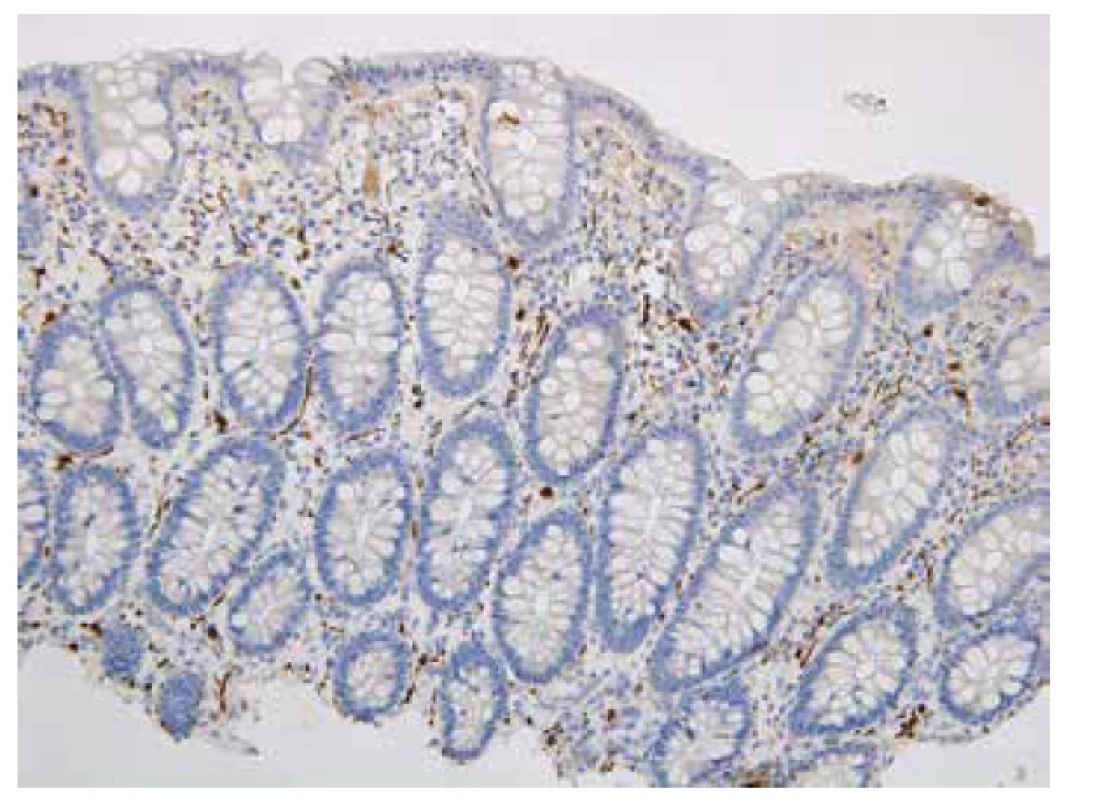
Obr. 2. Negativní imunohistochemický průkaz kalretininu v lamina propria i muscularis mucosae, HN (200x). 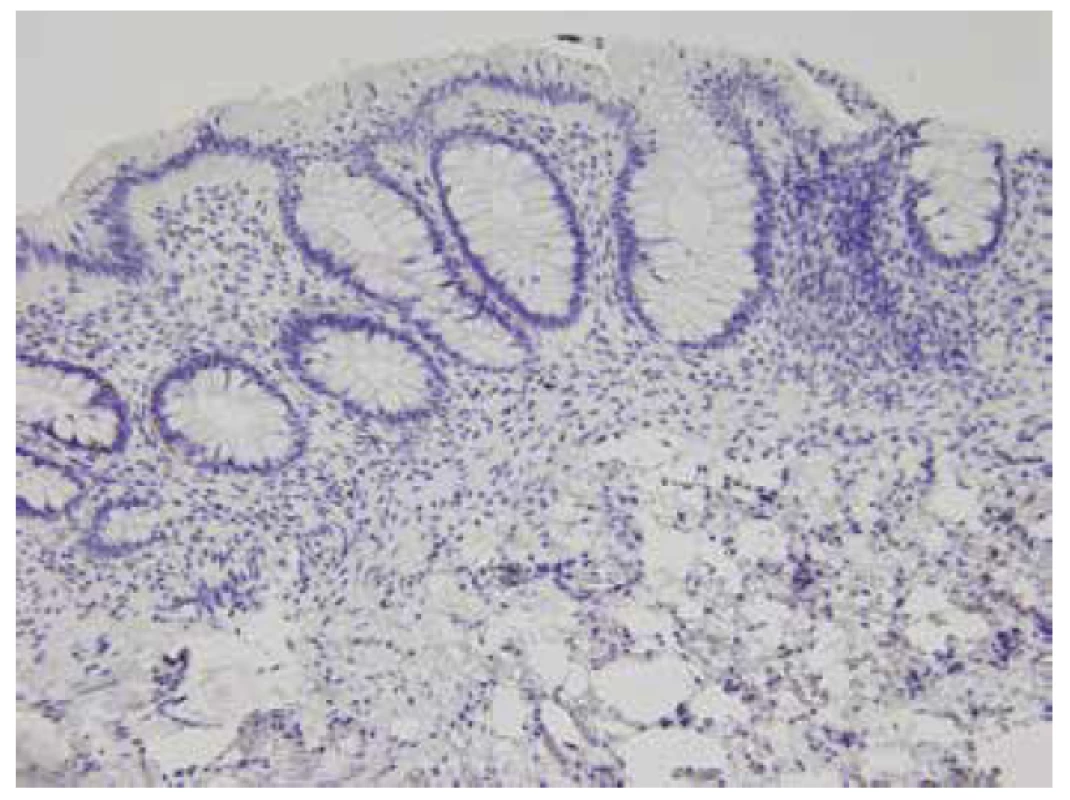
Korelace exprese kalretininu s histochemickým vyšetřením
U 13 pacientů s HN bylo provedeno celkem 16 vyšetření (3x byla indikována rebiopsie). Ve 14 případech byla zjištěna předpokládaná korelace, tj. pozitivní histochemie a negativní kalretinin v mikroexcizích z distálního rekta (1 – 3 cm nad linea dentata). Ve dvou vzorcích byla přítomna diskrepance. V první biopsii pacienta s HN byl negativní nález histochemický ze 3 cm, později byl potvrzen ultrakrátký segment do 2 cm. Druhý pacient s HN měl v rebiopsii pozitivní imunohistochemický průkaz kalretininu a současně výrazně abnormální nález histochemický (tab. 1).
Tab. 1. Případy diskrepance mezi histochemickým a imunohistochemickým vyšetřením. Pacient Vzdálenost 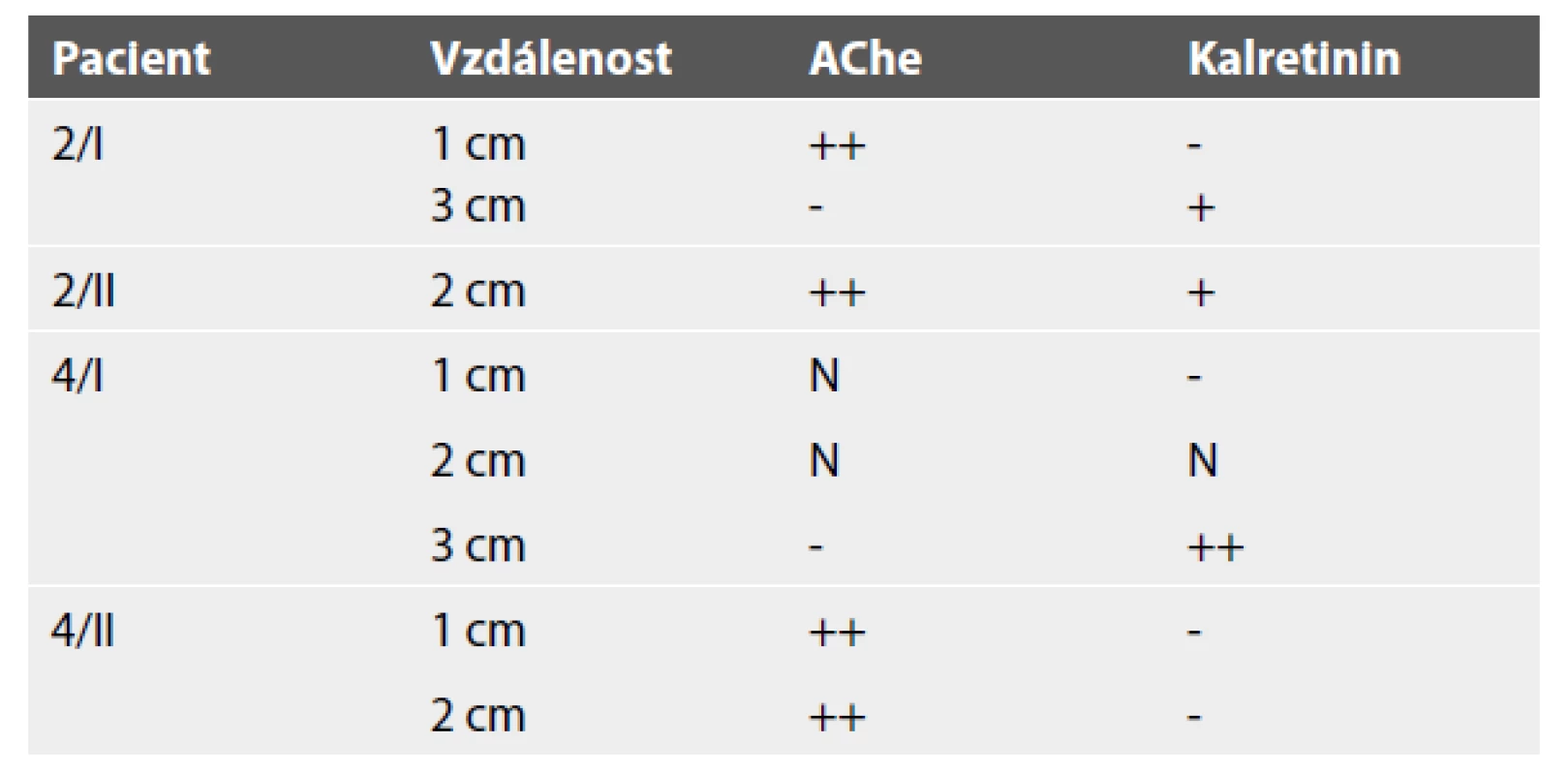
AChe acetylcholinesterázová reakce; N neodebráno, I první biopsie; II rebiopsie U dvou pacientů s předpokládanou dysganglionózou byly výsledky variabilní (1x pozitivní histochemie, 1x negativní histochemie, 2x pozitivní kalretinin, 2x přítomnost gangliových buněk včetně ektopických).
U 34 pacientů bez HN (negat-HN) byla přítomna kalretinin pozitivní nervová vlákna ve sliznici a acetylcholinestrázová reakce nebyla zesílena. V této skupině byla u 7 dětí imunopozitivní intrinsická vlákna v lamina propria mucosae jen sporadická, krátká a fragmentovaná (obr. 3). Z toho v jednom případě byl nález v malém vzorku téměř negativní. V muscularis mucosae byla vždy pozitivní vlákna o málo četnější a také směrem orálním zřetelně přibývala.
Obr. 3. Ojedinělá kalretinin pozitivní vlákna v lamina propria mucosae, negat- HN, 2 cm od anu (400x). 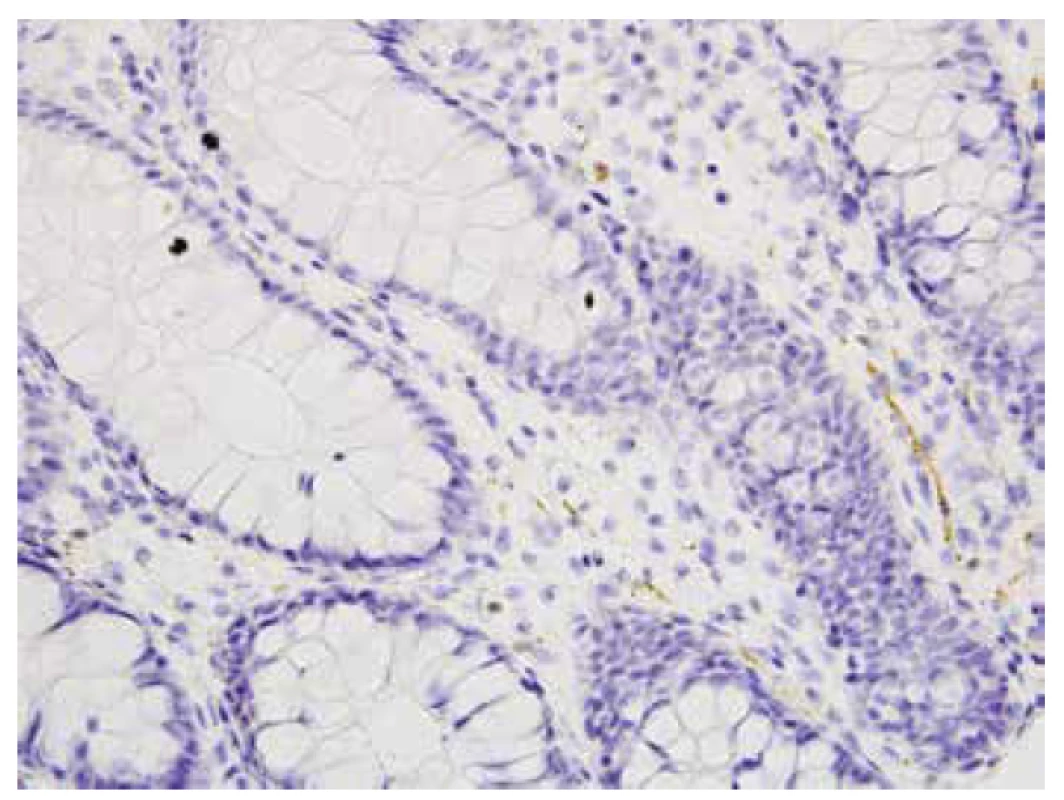
Korelace etážových biopsií s definitivním resekátem
U 12 operovaných pacientů s HN byly porovnány výsledky předoperačních etážových odběrů (histochemie, kalretinin) s resekátem (tab. 2). Vzorky na histochemické vyšetření byly ve 14 případech odebrány tak, že umožňovaly odhadnout délku aganglionárního segmentu. Výsledky korelovaly s definitivním vyšetřením resekátu 8x. V šesti případech byl odhadnutý aganglionární úsek významně kratší než ve skutečnosti. Jednalo se o čtyři pacienty s dlouhou formou/TCA a dvě děti s klasickou HN rektosigmatu.
Tab. 2. Porovnání výsledků preoperačních etážových odběrů s resekáty. 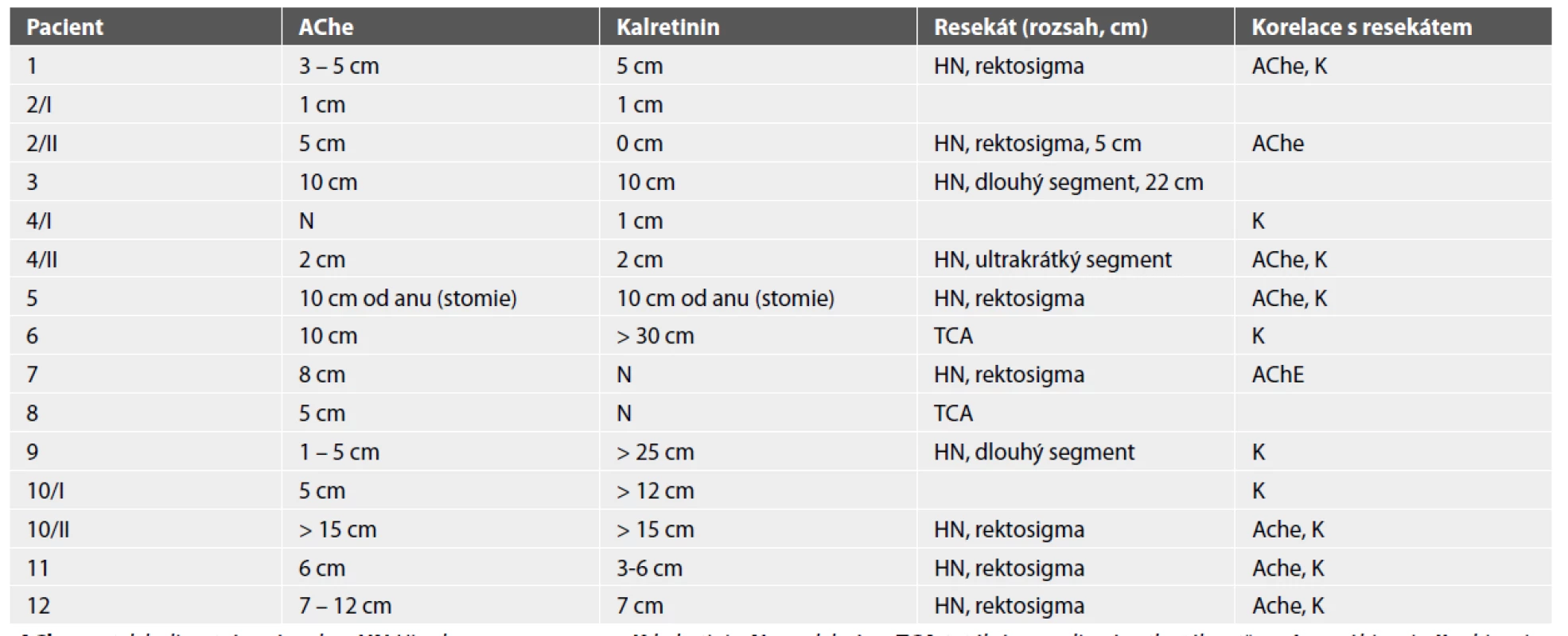
AChe acetylcholinestrázová reakce; HN Hirschsprungova nemoc; K kalretinin; N neodebráno; TCA totální aganglionóza tlustého střeva; I první biopsie; II rebiopsie Etážové odběry na imunohistochemické vyšetření s protilátkou proti kalretininu byly provedeny 13x. Výsledek vyšetření v 10 případech koreloval s definitivním resekátem, 3x se neshodoval. Jeden pacient měl podle resekátu aganglionózu délky 5 cm, ale exprese kalretininu byla v aganglionárním segmentu2 – 5 cm od anu opakovaně falešně pozitivní. Jedno dítě s familiární zátěží mělo negativní imunohistochemický průkaz kalretininu jen do 10 cm, ale peroperační biopsie a následné podrobné vyšetření resekátu prokázalo aganglionózu délky 18 – 22 cm. V resekátu přesvědčivě chyběla exprese kalretininu v souvislém úseku 0 – 22 cm od anu. Výsledky předoperační biopsie a resekátu tady z nejasného důvodu nesouhlasí. Spekulativním vysvětlením je nepřesné odměření vzdálenosti při kolonoskopii, která byla prováděna ve dvou samostatných sezeních (první do 10 cm, druhé od 15 do 55 cm).
DISKUZE
Hirschsprungova nemoc je nejčastějším onemocněním enterického nervového systému ze skupiny dysganglionóz (7). Aganglionární segment končí v myenterickém i submukózním plexu ve shodné vzdálenosti. Diagnózu HN založenou na absenci intrinsických neuronů můžeme proto provádět z mikroexcize obsahující pouze sliznici a submukózu rekta. Guidelines doporučují odběr sukční sondou 2 – 3 cm nad linea dentata (8). Vzorek obsahující dlaždicový epitel anu není reprezentativní, protože nízko nad svěračem jsou gangliové buňky příliš řídce rozložené. Adekvátní excize by měla mít délku 3 mm, z toho submukóza by měla zaujímat alespoň třetinu vzorku (8). Gangliové buňky identifikujeme podle typických cytonukleárních znaků v konvenčním barvení hematoxylinem a eozinem, imunohistochemie (např. NSE, MAP-2, synaptofyzin, peripherin) není nezbytná. Výhodou je přímé hodnocení patognomického znaku. Nevýhodou je potřeba dostatečně velkého a hlubokého vzorku a nutnost sériového prokrajování, kdy počet řezů může dosáhnout 100. HN vylučuje nález jediné gangliové buňky. Diagnózu podporujenález hypertrofických nervů (> 35 – 40 µm). Jako samostatný znak však nestačí, protože tyto nervy lze identifikovat až u 10 % zdravých osob (9).
Histochemický průkaz aktivity enzymu acetylcholinesterázy v kryostatových řezech je považován za zlatý standard zvláště v Evropě a Asii. Metoda je technicky náročná a dostupná pouze ve velkých pediatrických centrech. Na našem pracovišti byla zavedena před více než 40 lety prof. Z. Lukášem. Principem metody je detekce patologické přítomnosti silně reaktivních axonálních výběžků cholinergních extrinsických neuronů v submukóze a ve sliznici. Těla cholinergních neuronů jsou lokalizována v jádrech n. vagus a sakrálních parasympatických ganglií. Jejich axony se za fyziologických podmínek zakončují na tělech intrinsických gangliových buněk submukózního a myenterického plexu. V aganglionárním úseku tyto výběžky prorůstají až do sliznice, kde je možné je detekovat. Za pozitivní výsledek považujeme zmnožení silných a intenzivně reagujících nervových vláken v submukóze, muscularis mucosae a lamina propria. Silné provazce proplétající se mezi kryptami až k povrchu sliznice nalézáme především u pacientů starších 3 – 6 měsíců. Nezralý typ pozitivity, který převládá u novorozenců, se omezuje na zesílení reakce v muscularis mucosae a submukóze, ale v lamina propria reakční produkt chybí úplně nebo je znatelný pouze při bázi krypt. Patologická vlákna mohou probíhat i souběžně nad a pod muscularis mucosae, tzv. tram-track pattern (9-11). Acetylcholinesteráza ve zdravém střevě znázorňuje jen slabá nervová vlákna v submukóze a muscularis mucosae, v lamina propria mucosae mohou být ojedinělá vlákna rovněž slabě zbarvena. Hranice normy není přesně dána, hodnocení je proto subjektivní a vyžaduje zkušenost, kterou je možné získat jen soustředěním pacientů na větším pracovišti. Biopsie nemusí obsahovat submukózu, ale musí zahrnovat muscularis mucosae, v níž je při aganglionóze zesílení reakce konstantní. Hodnocení vzorků obsahujících pouze lamina propria může být falešně negativní (12). Na výsledek má dále vliv věk pacienta, přidružené choroby (m. Down) a délka aganglionárního segmentu. K největšímu počtu diagnostických selhání dochází u novorozenců a totální aganglionózy (13–15). Aktivita enzymu může být znehodnocena autolýzou v preanalytické fázi. Acetylcholinesteráza zkříženě reaguje i s erytrocyty a hladkou svalovinou. Falešně pozitivní barvení bylo vzácně zaznamenáno u vzorků hemorrhagických, u kolitid a některých dysganglionóz (13). Metoda je v rukou zapracovaného patologa poměrně spolehlivá, nicméně nejednoznačné nálezy vedou k prodlevě a zatěžují pacienty opakovanými odběry. Ve velkých souborech je udávána vysoká specificita metody (96 – 100 %), senzitivita je vždy nižší (65 – 92 %) (11,13,16,17).
Kalretinin patří do skupiny proteinů vázajících kalcium. Je exprimován v periferní nervové tkáni včetně gangliových buněk submukózního a myenterického plexu. Barshack jako první popsal expresi kalretininu v gangliových buňkách a nervech normálního střeva jakož i jeho zachovanou expresi v ganglionárních segmentech HN, což ostře kontrastovalo s úplným výpadkem v aganglionárním oddílu (18). Další studie ukázaly, že expresi kalretininu je možné hodnotit také v mikroexcizích, protože z gangliových buněk vybíhají do sliznice jejich výběžky (intrinsická vlákna). Normou rozumíme syté splývající granulární barvení tenkých nervových výběžků v lamina propria mucosae, muscularis mucosae a povrchové vrstvě submukózy (19-21). Metoda je s výhodou použitelná i u povrchových biopsií bez dostatečného objemu submukózy (19,22).
Kalretinin má v odborných kruzích četné příznivce, senzitivita (100 %) i specifita (99,1 %) se jeví jako slibně vysoké (23). Přesto bychom na konkrétních případech chtěli upozornit na možné diagnostické omyly (tab. 3). Obtíží technického rázu se vyvarujeme důsledným používáním vhodné kontroly. Imunohistochemický průkaz kalretininu není spolehlivý v biopsiích dříve fixovaných mrazem (24). To znemožňuje použít jednu sadu vzorků současně pro histochemii a imunohistochemii. Zdrojem chyb a falešně pozitivní diagnózy HN mohou být případy s malou hustotou vláken. Hustota vláken kolísá, ale naštěstí převládají případy s hojnými kalretinin pozitivními vlákny, která snadno zachytíme při přehledném zvětšení. Pouze absolutní negativita kalretininu znamená aganglionózu. Proto musíme biopsie studovat i při zvětšení 200x/400x a oddělit tak případy s ojedinělými pozitivními vlákny od případů zcela negativních (24). Našim pacientům s nízkou hustotou instrinsických vláken bylo průměrně 26 měsíců, proto se nedomníváme, že bychom slabou pozitivitu mohli připsat nízkému věku. Hodnotit nález jako hypoganglionózu považujeme za ukvapené i proto, že sama existence této jednotky je některými odborníky zpochybňována (7). Teprve další zkušenosti s imunohistochemickým vyšetřením exprese kalretininu na velkých souborech pomohou vyhodnotit, zda se tato skupina pacientů nějak odlišuje od zdravých kontrol.
Tab. 3. Obtížné situace při hodnocení imunohistochemické exprese kalretininu a jejich řešení. 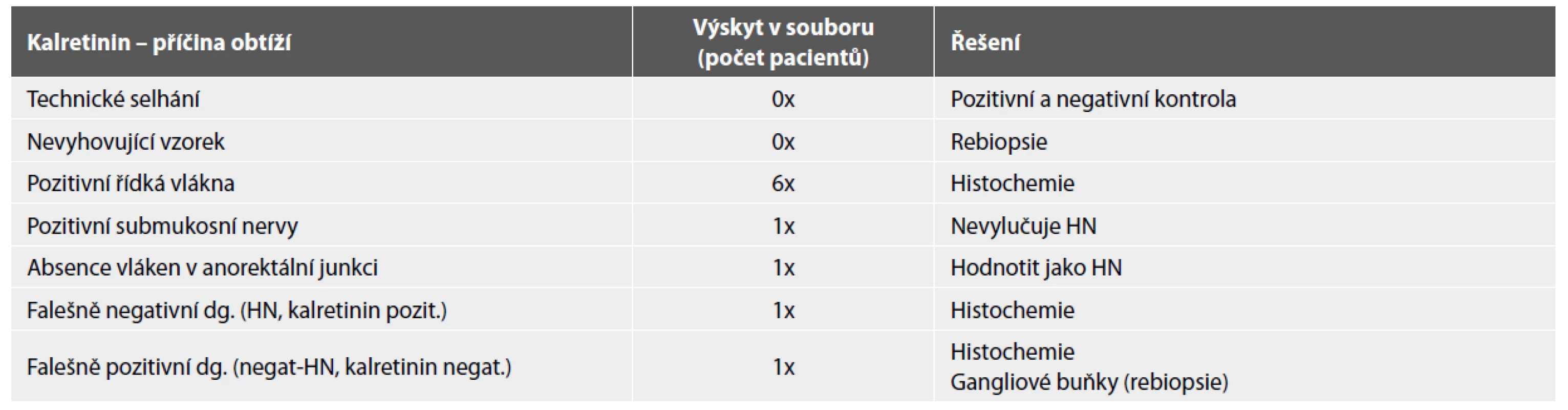
Příčinou falešně negativního závěru může být slabá exprese v submukózních nervech. Přibarvování axonů velkých nervů není v rozporu s diagnózou HN, chybí-li typické splývající granulární barvení vláken ve sliznici a povrchové vrstvě submukózy (19,24). Nově je tento znak pokládán za příznačný pro krátký aganglionární segment (25).
Samostatnou kapitolou je diagnostika ultrakrátké formy nemoci. Prvním krokem je správný odběr vzorků, které musí obsáhnout sliznici distálního rekta nejlépe 1 cm i 2 cm nad linea dentata. Ultrakrátký segment může být minut, pokud chirurg odebere první vzorek až ze 3 cm (tab. 1, pacient 4). Oblast anorektální junkce do 2 cm nad svěračem obsahuje přirozeně malý počet gangliových buněk, ale i ty vyzařují do sliznice kalretinin pozitivní výběžky. Pouze ve vzorcích kompletně krytých dlaždicovým análním epitelem není kalretinin prokazatelný a proto je hodnotíme jako nediagnostické (19,22). Naše zkušenosti potvrzují, že za normálního stavu sleduje pozitivita kalretininu v anorektální junkci přítomnost cylindrického epitelu a relativně ostře mizí s nástupem epitelu dlaždicového (obr. 4). U jednoho dítěte s HN jsme proto zjistili v junkční zóně výpadek barvení.
Obr. 4. Pozitivní imunohistochemický průkaz kalretininu v anorektální junkci, negat-HN (200x). 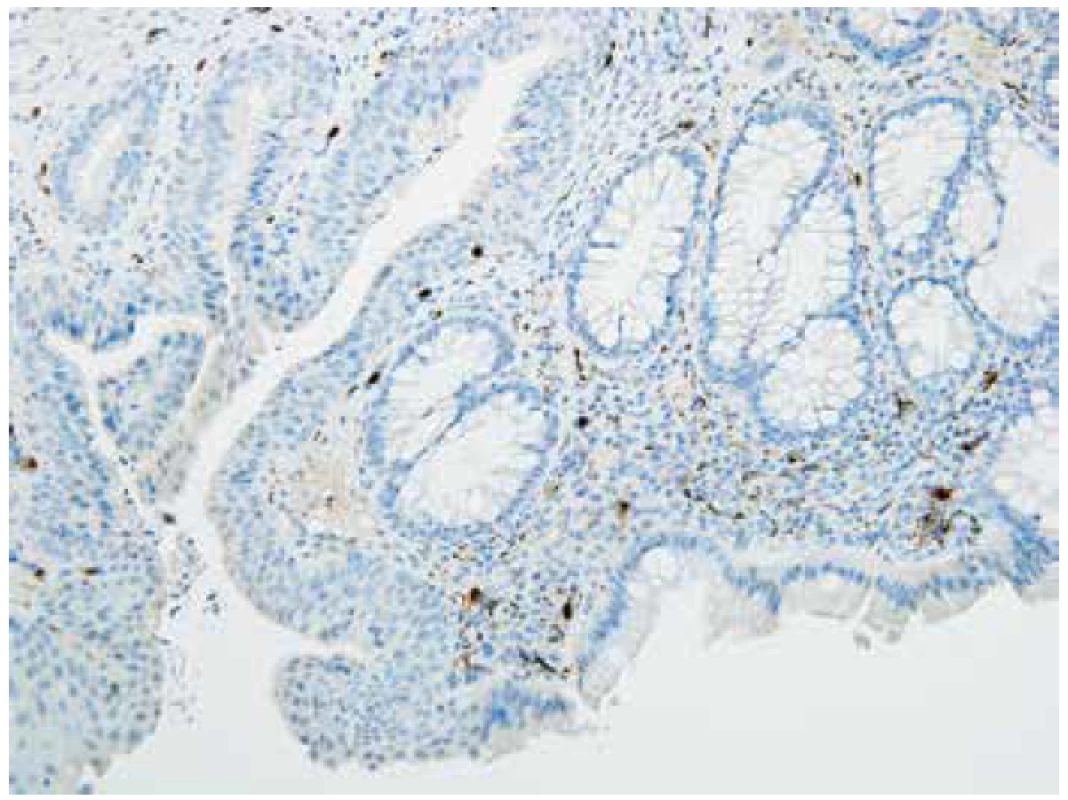
Dalším reálným nebezpečím je přítomnost kalretinin pozitivních vláken v krátké aganglionóze, přičemž zdrojem těchto vláken jsou gangliové buňky proximálně od patologického segmentu (26). U jednoho dítěte jsme za takových okolností stanovili ultrakrátkou aganglionózu jen do 1 cm za svěrač, ale chlapec měl při konzervativní terapii trvalou tendenci k obstipaci a rozvinul se u něj subileus. Rebiopsie po roce a následná operace ukázala aganglionózu rekta do 5 cm s kalretinin pozitivními vlákny ve 2 – 5 cm a výpadkem pouze v 1 cm. Toto pozorování překonává literární údaje, podle nichž kalretinin pozitivní vlákna zasahují do aganglionárního segmentu jen do vzdálenosti 1 – 2 cm (27). Ultrakrátký segment bychom vždy měli verifikovat dvěma metodami (obr. 5) a u dětí, jejichž symptomy se nelepší při konzervativní léčbě, doporučit rebiopsii.
Obr. 5. Silně pozitivní acetylcholinesterázová reakce, HN ultrakrátký segment, 1 cm od anu (iso-ACHE 40x). 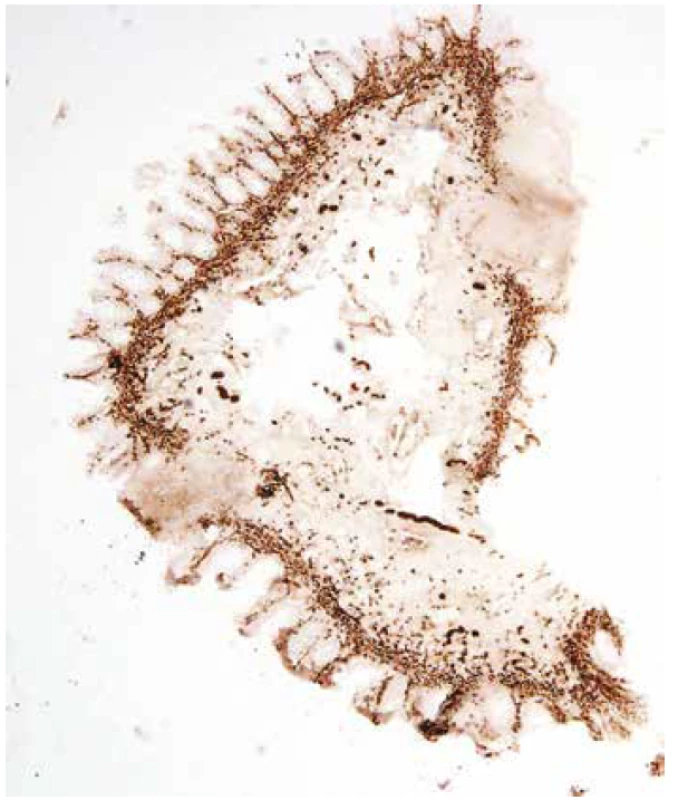
Specifikem našeho pracoviště jsou etážové odběry, jejichž úkolem je předoperační stanovení délky aganglionárního segmentu. Z analýzy našeho souboru vyplývá, že u HN s delším postiženým úsekem (dlouhý segment, TCA) vedou výsledky histochemického vyšetření k výraznému podhodnocení délky aganglionózy. Nejmarkantnější byl případ 8 měsíčního kojence s TCA, u nějž dle histochemické diagnostiky končila předpokládaná aganglionóza v 5 cm od anu. Skutečný rozsah choroby se ozřejmil až 4x opakovanou peroperační biopsií, přičemž tato náročná operace trvala 5 hodin.
Zvýšená aktivita acetylcholinesterázy odráží přítomnost hypertrofických cholinergních nervů, které nepokrývají celý aganglionární segment, neboť se jejich růst v určité vzdálenosti od anu přirozeně zastavuje. Pozitivita kalretininu ukazuje přímo na výskyt intramurálních gangliových buněk v dané etáži, proto s její pomocí dokážeme hranice postiženého úseku určit spolehlivěji. Počet případů v našem souboru je zatím malý, navíc přesné měření aganglionárního úseku v resekátu jsme realizovali jen u dvou pacientů. Tyto závěry považujeme za předběžné, ale v budoucnu plánujeme podrobnější analýzu již proto, že ve světové literatuře nenacházíme až na výjimky podobné pozorování (28).
Práce porovnávající využití histochemie a imunohistochemie s protilátkou proti kalretininu doložily, že interpretace výsledků imunohistochemického vyšetření je oproti acetylcholinesteráze snadnější, s menším počtem závěrů nejasných i nesprávných (19,21). V našem souboru jsme zaznamenali potíže s hodnocením imunohistochemické exprese kalretininu především v počátcích, při získávání zkušeností. Celkově vnímáme metodu jako velmi užitečnou a jednoduchou, kterou si lze na rozdíl od interpretace výsledků cholinesterázové reakce snadno osvojit. Tato metoda umožňuje vyhodnocovat i nejpovrchnější vzorky sliznice bez muscularis mucosae, k vyloučení HN stačí pozitivita v lamina propria mucosae. Velkou výhodu spatřujeme v časné diagnóze, protože výsledek imunohistochemického barvení se na rozdíl od aktivity acetylcholinesterázy nemění s věkem pacienta (obr. 6A – D). Chceme však varovat před nekritickým vyzdvihováním kalretininu jako metody neomylné. V našem souboru nejméně jeden pacient bez HN měl tak malý počet intrinsických vláken v distálním rektu, že výsledek hraničil s negativitou (falešně pozitivní diagnóza HN). Naopak jeden pacient s verifikovanou HN měl imunopozitivní vlákna přesahující i do aganglionárního úseku (falešná negativita).
Obr. 6. Stejný pacient s HN ve věku 14 dní (A, C) a 2 měsíců (B, D).
A: Acetylcholinesterázová reakce jen slabě pozitivní v krátkém úseku muscularis mucosae, v lamina propria je reakce negativní (iso-ACHE 40x).
B: Acetylcholinesterázová reakce pozitivní v muscularis mucosae i lamina propria (iso-ACHE 40x).
C: Negativní imunohistochemický průkaz kalretininu (200x).
D: Negativní imunohistochemický průkaz kalretininu beze změn (200x).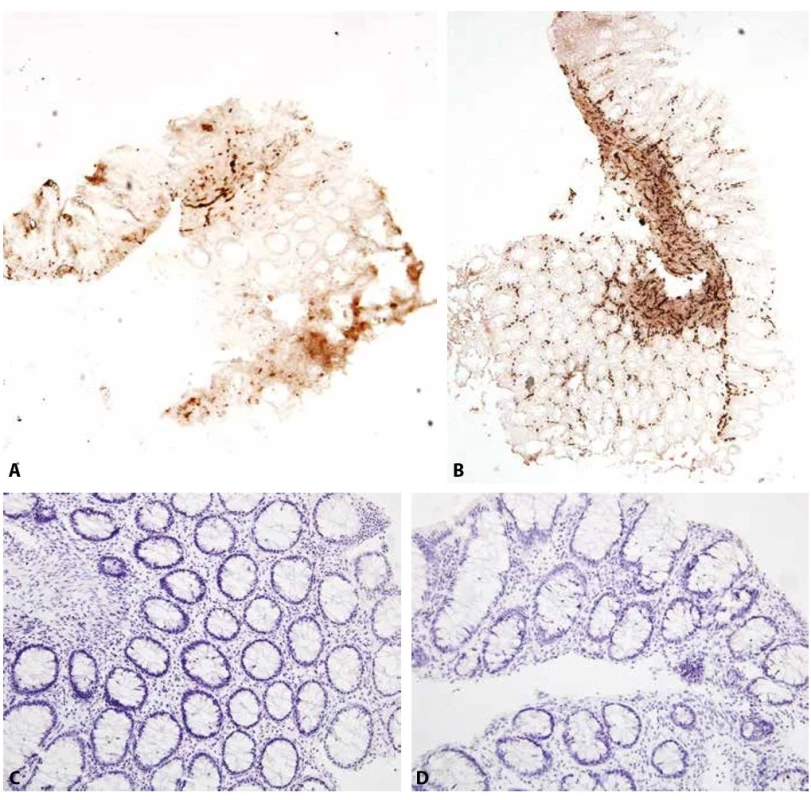
Případným pochybením je lépe předejít zapojením dvou diagnostických metod. Nám se osvědčila kombinace histochemického a imunohistochemického vyšetření s protilátkou proti kalretininu. Právě díky této kombinaci se snížil počet nekonkluzivních biopsií i v dalších studiích (29,30). Histochemie je nedocenitelná při diagnostice ultrakrátkého a krátkého segmentu. Přítomnost ojedinělých kalretinin pozitivních vláken v distálním rektu může být totiž jak variantou normy (histochemie je negativní), tak průvodní známkou krátkého aganglionárního segmentu (histochemie je pozitivní). Pracoviště bez přístupu k enzymové histochemii mohou na parafinových blocích využívat běžné barvení hematoxylinem a eozinem v kombinaci s imunohistochemickým průkazem kalretininu či dalších protilátek, např. GLUT-1 (31,32). Nevýhodou takového přístupu by mohl být vyšší počet nereprezentativních biopsií.
ZÁVĚR
Pro diagnostiku HN doporučujeme spojení enzymové histochemie a imunohistochemického vyšetření s protilátkou proti kalretininu, které dává do kontrastu zvýšenou aktivitou acetylcholinesterázy a výpadek exprese kalretininu v aganglionárním segmentu. Odběr hlubších vrstev submukózy není podmínkou, proto jen výjimečně odmítáme vzorek jako nedostatečný. Hlavní výhodou kalretininu je spolehlivost a jednoduché hodnocení (vlákna ano/ne), histochemie má nezastupitelnou roli v diagnostice krátkého a ultrakrátkého segmentu. Kombinovaným přístupem snižujeme množství nejednoznačných výsledků, z čehož nejvíce profituje malý pacient a jeho rodina.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
MUDr. Marta Ježová, Ph.D.
Ústav patologie FN Brno
Jihlavská 20, Brno, 625 00
tel.: +420 532 231 946
e-mail: Jezova.Marta@fnbrno.cz
Zdroje
1. Škába R. Historic milestones of Hirschsprung’s disease (commemorating the 90th anniversary of Professor Harald Hirschsprung’s death). J Pediatr Surg 2007; 42(1): 249-251.
2. Masiakos PT, Ein SH. The History of Hirschsprung’s Disease: Then and Now. Semin Colon Rectal Surg 2006; 17(1): 10-19.
3. Parisi MA. Hirschsprung Disease Overview. GeneReviews® [Internet]. [Online] 2002 (updated 2015). [Citace: 11. 9 2017.] https://www.ncbi.nlm.nih.gov/books/NBK1439/.
4. Moore SW. Total colonic aganglionosis in Hirschsprung disease. Semin Pediatr Surg 2012; 21 (4): 302-309.
5. Moore, SW. The contribution of associated congenital anomalies in understanding Hirschsprung’s disease. Pediatr Surg Int 2006; 22(4): 305-315.
6. Haricharan, RN, Georgeson KE. Hirschsprung disease. Semin Pediatric Surg 2008; 17(4): 266-275.
7. Martucciello G, Pini Prato A, Puri P, et al. Controversies concerning diagnostic guidelines for anomalies of the enteric nervous system: a report from the fourth International Symposium on Hirschsprung’s disease and related neurocristopathies. J Pediatr Surg 2005; 40(10): 1527-1531.
8. Kapur RP. Practical pathology and genetics of Hirschsprungs disease. Semin Pediatr Surg 2009; 18(4): 212-223.
9. Pacheco MC, Bove KE. Variability of acetylcholinesterase hyperinnervation patterns in distal suction rectal biopsy specimens in Hirschsprung disease. Pediatr Dev Pathol 2010; 11(4): 274-282.
10. Challa VR, Moran JR, Turner CS, Lyerly AD. Histologic diagnosis of Hirschsprung‘s disease. The value of concurrent hematoxylin and eosin and cholinesterase staining of rectal biopsies.Am J Clin Pathol 1987; 88(3): 324-328.
11. Nakao M, Suita S, Taguchi T, Hirose R, Shima Y. Fourteen-year experience of acetylcholinesterase staining for rectal mucosal biopsy in neonatal Hirschsprung‘s disease. J Pediatr Surg 2001; 36(9): 1357-1363.
12. Lukáš Z, Ludvikovský J. Histochemická diagnostika morbus Hirschsprung. Cesk Patol 1979; 15(1): 53-56.
13. Agrawal RK, Kakkar N, Vasishta RK, Kumari V, Samujh R, Rao KLN. Acetylcholinesterase histochemistry (AChE)--A helpful technique in the diagnosis and in aiding the operative procedures of Hirschsprung disease. Diagn Pathol 2015; 10(1): 208.
14. Morris MI, Soglio DB, Ouimet A, Aspirot A, Patey N. A study of calretinin in Hirschsprung pathology, particularly in total colonic aganglionosis. J Pediatr Surg 2013; 48(5): 1037-1043.
15. Rabah R. Total colonic aganglionosis: case report, practical diagnostic approach and pitfalls. Arch Pathol Med 2010; 134(10): 1467-1473.
16. Park WH, Choi SO, Kwon KY, Chang ES. Acetylcholinesterase histochemistry of rectal suction biopsies in the diagnosis of Hirschsprung‘s disease. J Korean Med Science 1992; 7(4): 353 - 359.
17. Wells FE, Addison GM. Acetylcholinesterase activity in rectal biopsies: an assessment of its diagnostic value in Hirschsprung’s disease. J Pediatr Gastroenterol Nutr 1986; 5(6): 912–919.
18. Barshack I, Fridman E, Goldberg I, Chowers Y, Kopolovic J. The loss of calretinin expression indicates aganglionosis in Hirschsprung’s disease. J Clin Pathol 2004; 57(7): 712-716.
19. Kapur RP, Reed RC, Finn LS, Patterson K, Johanson J, Rutledge JC. Calretinin immunohistochemistry versus acetylcholinesterase histochemistry in the evaluation of suction rectal biopsies for Hirschsprung Disease. Pediatr Dev Pathol 2009; 12(1): 6-15.
20. Holland SK, Ramalingam P, Podolsky RH, Reid-Nicholson MD, Lee JR. Calretinin immunostaining as an adjunct in the diagnosis of Hirschsprung disease. Ann Diagn Pathol 2011; 15(5): 323-328.
21. Guinard-Samuel V, Bonnard A, De Lagausie P et al. Calretinin immunohistochemistry: a simple and efficient tool to diagnose Hirschsprung disease. Mod Pathol 2009; 22(10): 1379-1384.
22. Gonzalo DH, Plesec T. Hirschsprung disease and use of calretinin in inadequate rectal suction biopsies. Arch Pathol Lab Med 2013; 137(8): 1099-1102.
23. Tran VQ, Lam KT, Truong DQ et al. Diagnostic value of rectal suction biopsies using calretinin immunohistochemical staining in Hirschsprung’s disease. J Pediatr Surg 2016; 51(12): 2005-2009.
24. Lim KH, Wan WK, Lim TKH, Loh AHL, Nah SA, Chang KT. Primary diagnosis of Hirschsprung disease – Calretinin immunohistochemistry in rectal suction biopsies, with emphasis on diagnostic pitfalls. Word J Pathol 2014; 3 : 14-22.
25. Guinard-Samuel V, Bonnard A, Peuchmaur M, Berrebi D. A variant pattern of Calretinin immunohistochemistry on rectal suction-biopsies is fully specific of short-segment Hirschsprung’s disease. Pediatr Surg Int 2014; 30(8): 803-808.
26. Kaçar A, Arikök AT, Azili MN, Ekberli Ağirbaş G, Tiryaki T. Calretinin immunohistochemistry in Hirschsprung’s disease: An adjunct to formalin-based diagnosis. Turk J Gastroenterol 2012; 23(3): 226-233.
27. Kapur RP. Calretinin-immunoreactive mucosal innervation in very short-segmenta Hirschsprung disease: a potentially misleading observation. Pediatr Dev Pathol 2014; 17(1): 28-35.
28. Yadav L, Kini U, Das K, Mohanty S, Puttegowda D. Calretinin immunohistochemistry versus improvised rapid acetylcholinesterase histochemistry in the evaluation of colorectal biopsies for Hirschsprung disease. Indian J Pathol Microbiol 2014; 57 : 369-375.
29. de Haro Jorge I, Palazón Bellver P, Julia Masip V. Effectiveness of calretinin and role of age in the diagnosis of Hirschsprungdisease. Pediatr Surg Int 2016; 32(8): 723-737.
30. de Arruda Lourenção PL, Takegawa BK, Ortolan EV, Terra SA, Rodrigues MA Does calretinin immunohistochemistry reduce inconclusive diagnosis in rectal biopsies for Hirschsprung disease? J Pediatr Gastroenterol Nutr 2014; 58(5): 603-607.
31. Bachmann L, Besendörfer M, Carbon R, Lux P, Agaimy A, Hartmann A, Rau TT. Immunohistochemical panel for the diagnosis of Hirschsprung’s disease using antibodies to MAP2, calretinin, GLUT1 and S100. Histopathology 2015; 66(6): 824-835.
32. Daum O. …v diagnostice Hirschsprungovy choroby se obejdete bez enzymové histochemie a kryostatu (Monitor). Cesk Patol 2015; 60(4): 153-154.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článek Jaká je vaše diagnóza?
Článok vyšiel v časopiseČesko-slovenská patologie

2019 Číslo 1-
Všetky články tohto čísla
- Aktuální otázky tenkojehlové aspirační biopsie štítné žlázy
- Pneumologická cytodiagnostika – state of the art 2019
- Cytopatologie - State of the Art (2. část)
- Aktuální pohled na močovou cytologii: Co přináší Pařížská klasifikace?
- Primární maligní obrovskobuněčný nádor pažní kosti mikroskopicky napodobující chondroblastom – kazuistika
- Noonanovej syndróm z pohľadu fetopatológa
- MONITOR, aneb nemělo by vám uniknout, že...
- Imunohistochemická diagnostika morbus Hirschsprung pomocí kalretininu
- Opavské Muzeum patologie je moje srdeční záležitost
- Jaká je vaše diagnóza?
- Nový systém pro sjednocené hodnocení tenkojehlových aspiračních cytologií slinných žláz: Co nového přinesl „tzv. Milánský systém reportování“ do cytodiagnostiky lézí slinných žláz?
- Jaká je vaše diagnóza? Odpověď: Difúzny leptomeningeálny glioneuronálny tumor (diffuse leptomeningeal glioneuronal tumor)
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Aktuální otázky tenkojehlové aspirační biopsie štítné žlázy
- Aktuální pohled na močovou cytologii: Co přináší Pařížská klasifikace?
- Noonanovej syndróm z pohľadu fetopatológa
- Pneumologická cytodiagnostika – state of the art 2019
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



