-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Aktuální otázky tenkojehlové aspirační biopsie štítné žlázy
Current issues in fine needle aspiration biopsy of thyroid gland
Fine-needle aspiration biopsy (FNAB) has become an established procedure for the basic examination of thyroid nodules, which remain common in our population. The widely used Bethesda system for reporting thyroid cytopathology has undoubtedly contributed to the understanding among clinicians and cytopathologists. Since its publication in 2010, the system’s overall applicability has been tested by many studies and reclassification of follicular thyroid tumours has occurred. The consensus embedded in the latest version of the WHO classification was the impetus for a revision of the very successful Bethesda 2010 system in 2017. We present a brief overview of the changes in the persistent categories of the original classification to the newly established format along with practical recommendations for routine FNAB diagnostics of thyroid lesions.
Keywords:
thyroid nodules – goitre – FNAB of thyroid gland – thyroid cancer – The Bethesda system for reporting thyroid cytology 2010 – The Bethesda 2017 revised Classification of thyroid FNAB
Autoři: Jaroslava Dušková
Působiště autorů: Ústav patologie 1. LF UK a VFN, Praha
Vyšlo v časopise: Čes.-slov. Patol., 55, 2019, No. 1, p. 13-23
Kategorie: Přehledový článek
Souhrn
Tenkojehlová aspirační biopsie (FNAB) se prosadila jako součást základních vyšetření tyreoidálních uzlů, které zůstávají i v naší populaci častým nálezem. Porozumění mezi kliniky a cytopatology nesporně významně napomohla široce mezinárodně akceptovaná klasifikace Bethesda 2010. V průběhu let následujících od jejího zveřejnění byla její použitelnost ověřována mnohými studiemi. Došlo zároveň k reklasifikaci folikulárních tyreoidálních tumorů. Konsensus zakotvený v poslední verzi WHO klasifikace byl impulsem k revizi úspěšně se prosadivší Bethesda 2010 do verze Bethesda 2017. Popis změn v jednotlivých kategoriích původní klasifikace do nově ustavené podoby spolu s praktickými doporučeními pro rutinní denní tenkojehlovou diagnostiku tyreoidálních lézí přinášíme ve stručném přehledu.
Klíčová slova:
tyreoidální uzly – struma – rakovina štítné žlázy – cytologie štítné žlázy – Bethesda 2010 klasifikace – Bethesda 2017 revidovaná klasifikace cytologií štítné žlázy
Obsah
Patologie štítné žlázy a stav jódové suplementace
Historická poznámka
Tenkojehlová aspirační cytologie štítné žlázy
Metody:
- fixace
- nátěry
- centrifugace
- cytoblok
- barvení základní a doplňující
- speciální metody
Základní cytologické obrazy ve světle původní i revidované Bethesda klasifikace
Formulace cytologického nálezu
Závěr
Seznam zkratek
AUS – Atypia of Undetermined Significance – atypie neurčeného významu
B I – B VI – Bethesda I – Bethesda VI diagnostické kategorie Bethesda klasifikace
FLUS – Follicular Lesion of Undetermined Significance
FNAB – fine Needle Aspiration Biopsy – tenkojehlová aspirační biopsie
FVPTC – Follicular Variant of Papillary Thyroid Carcinoma – folikulární varianta papilárního karcinomu
HE – hematoxylin - eozin
MGG – May - Grünwald –Giemsa
NIFTP - Non Invasive Follicular Thyroid neoplasm with Papillary-like nuclear features – neinvazivní papilární tumor s jadernými rysy podobnými papilárnímu karcinomu
SFN – Suspicious for a Follicular Neoplasm – podezření z folikulární neoplázie
Koncem minulého tisíciletí se podařilo celosvětově vyřešit problémy těžkého jódového deficitu (1). Trvá však problém mírnějšího, nicméně přesto významného jódového deficitu u dětí a těhotných. Stinnou stránkou uplatňovaných suplementačních programů je i skutečnost, že narůstá zvolna také problém jódového excesu (2). Obé má vztah k přetrvávající incidenci tyreoidálních patologií.
Tradiční čínská medicína znala ryze empirickou léčbu strumy sušenými mořskými řasami a houbami již více než 2500 let před naším letopočtem (3). Poznání anatomie, fyziologie a patologie štítné žlázy se však vyvíjelo po staletí a odráželo měnící se stav jódové saturace. I v naší populaci byly poměrně nedávno nově adjustovány křivky velikosti štítné žlázy v populaci s dostatečnoujodurií pomocí sonografie. Autoři průzkumu zjistili synchronní nárůst velikosti u mužů i žen do třiceti let věku, poté je nárůst o něco rychlejší u mužů (4). Až tři čtvrtiny české populace mají ve štítné žláze uzly - mnohdy zjištěné pouze náhodou jakožto tzv. incidentalomy (5). Jen méně než 10 % tyreoidálních uzlů představují uzly maligní. Naprostá většina malých benigních uzlů nevyžaduje chirurgické řešení. Proto se v poslední čtvrtině minulého století prosadila poměrně přímočaře aspirační cytologie, metoda, která minimálně invazivním způsobem umožňuje identifikovat pacienty s velmi malým rizikem malignity a tedy nutné chirurgické intervence. V 60. - 70. letech minulého století se kliničtí endokrinologové orientovali zejména na hmatné tyreoidální uzly a aspiráty v počátcích hodnotili mikroskopicky sami (6). V současné době zůstal klinickým endokrinologům pouze první, avšak velmi významný krok – odběr reprezentativního vzorku. Pravidelnou vyšetřovací metodou v rukou endokrinologů se stávají sonografie a nověji elastografie (7-10). Znamenají nesporně užitečný nástroj rozšiřující možnosti detekce a předběžného hodnocení tyreoidálních uzlů, nicméně morfologické hodnocení tenkojehlovou biopsií a v indikovaných případech následné podrobné vyšetření resekátu zůstávají určujícími body terapeutických postupů a kladou značnou odpovědnost do rukou patologů.
Spolu se zavedením nových klinických vyšetřovacích metod narůstala i potřeba standardizovaného hlášení výsledků aspiračních cytologií. Paralelně se vyvinuly klasifikační systémy v Evropě (Itálie, Velká Británie), Japonsku, Austrálii a posléze v USA (Bethesdě). Jsou si podobné – mají 5-6 kategorií a některé i podrobnější členění. Navzájem jsou převoditelné (11). To je důležité si uvědomit, protože zmíněné národní cytologické komunity s velmi dobrou diagnostickou úrovní a tradicí nebyly ochotny přijmout v Bethesdě zformulovaný systém tak výlučně, jak se prosadil standardizační Bethesda systém pro cytologie gynekologické. Nicméně od roku 2009, kdy byl systém zformulovaný v Bethesdě představen (12, 13) a rok poté zveřejněn (14), byly publikovány desítky prací, které ho ověřovaly, případně se soustředily na dvě nejvíce kritizované kategorie této klasifikace – Bethesda III AUS/FLUS Bethesda IV SFN. Přestože jsme účastnili mezinárodních diskuzí (15) a na národní úrovni o tyreoidální Bethesda klasifikaci informovali v roce následujícím po její oficiální publikaci jak cytopatology, tak kliniky (16), nebyla ani v naší relativně malé komunitě tato klasifikace přijata bezvýhradně (17).
Kvalitní cytologické výsledky lze nepochybně poskytovat i bez použití Bethesda klasifikace. Ta představuje standardizovaný rámec, k němuž v naší praxi velmi pravidelně připojujeme komentář. Je zaměřen na co nejbližší přiřazení popisovaného cytologického nálezu očekávanému histopatologickému výsledku; formulujeme rovněž odpověď na případnou klinickým specialistou položenou otázku.
V následujícím textu podáme krátký nástin současných možností a trendů v tyreoidální cytopatologii. Náš pohled je založen na zkušenosti z více než 35 tisíc základních i konzultačních tyreoidálních vyšetření vyhodnocených v průběhu posledních třiceti let.
METODY ZPRACOVÁNÍ ASPIRÁTŮ ZE ŠTÍTNÉ ŽLÁZY
Získání vzorku a jeho transport do laboratoře představují první a velmi důležitý krok preanalytické fáze vyšetření, který může zásadně ovlivnit výsledek. Akreditovaná laboratoř musí dodavatele svých vzorků informovat o požadavcích na vzorky - zpravidla cestou laboratorní příručky zveřejněné na webových stránkách laboratoře. Požadavky na vstupní parametry vzorku jsou zároveň součástí standardního operačního postupu pro zpracování a kontrolovány laborantkami při příjmu materiálu. Většina klinických specialistů, kteří nám dodávají aspiráty ze štítné žlázy, provádějí do zjištěného ložiska nebo uzlu dva vpichy. Je-li ložisek více a pacienta se podaří přesvědčit, aby odběr toleroval, dostáváme vzorků i více, od řady klinických kolegů s orientačním nákresem situace a míst odběrů. Jako nutné minimum je však třeba vyžadovat přiřazení pořízených nátěrů k jednotlivým odběrům a uvedení lokalizace. Z každého aspirátu jsou pořízeny 2-3 nátěry fixované zaschnutím. Tekutina evakuovaná z cysty je dodávána ve zkumavce v nativním stavu a následně zpracována do cytobloku, popř. cytocentrifugací. Začínající klinické kolegy je z naší zkušenosti záhodno upozornit, že není vhodné aspirovat materiálu více, než kolik se vejde do jehly. Toto množství postačí na požadované tři nátěry správného rozsahu – tedy ponechávající volné okraje podložního skla. Nedodržení podmínky volných okrajů znamená téměř vždy nahrnutí diagnosticky nejcennějších buněčných skupin na hranu nebo k silnější okrajové vrstvě konce nátěru a tím sníženou hodnotitelnost. Teprve opakované zasílání nákresů správného rozsahu nátěru odstranilo u některých klinických kolegů tuto frustrující chybu, při které jsou získány a vzápětí přinejmenším částečně znehodnoceny cenné součásti vzorku; větší množství materiálu a nátěrů znamená prakticky vždy pouze výrazné krevní zředění, snížení kvality vzorku a plýtvání časem patologa. Tam, kde zjistíme, že se opakují stejné chyby odběru, zasíláme (někdy opakovaně) stručný popis spolu s nákresem (viz příloha).
Cytologie štítné žlázy z tekutého média byla a je sice některými pracovišti prosazována (18-22) celkově však nepředstavuje hlavní proud. Její výhodou je však obdobně jako u gynekologických cytologií materiál pro dodatečné využití speciálních diagnostických metodik.
Fixace a příprava preparátů. V naší praxi jsou preparáty dodávány zpravidla všechny fixované zaschnutím. To naprosto neomezuje použití různých barvení, včetně polychromu. Je ovšem nutno počítat s případnou sníženou imunoreaktivitou. Za vlhka lze fixovat 50% metanolem, 95% etanolem nebo sprejovým fixativem (s dostatečnou vzdáleností od nátěru uvedenou na aplikační nádobce).
Cytoblok by měl být zhotoven vždy, pokud jsou v dodaném aspirátu z cystické dutiny makroskopicky patrny částky. Tekutiny bez nich lze zpracovat cytocentrifugací. S ohledem na pokročilejší stav standardizace imunohistochemických postupů lze cytoblokové zpracování doporučit vždy, kdy je punktovaný uzel suspektní z malignity.
Barvení
K tradičně v počátcích užívanému barvení May - Grünwald - Giemsa (MGG) jsme velmi brzy pod vlivem polské cytologické školy připojili HE (každý patolog má s tímto barvením nejvíce zkušeností a v nátěrech s velmi hustým koloidem je v HE thyreocytární komponenta mnohem lépe hodnotitelná než v MGG) a pokud je k dispozici třetí nátěr, barvíme polychromem, v němž vyniknou struktury jaderného chromatinu. Nátěr, který obsahuje pod denzním koloidem v barvení MGG omezeně hodnotitelné buněčné skupiny, necháme někdy následně přebarvit. Preparáty barvené MGG pro základní hodnocení nemontujeme, jsou snadno použitelné pro případná imunocytochemická došetření. Ta jsou v tyreoidální cytopatologii indikována jak u méně obvyklých variant primárních tumorů – zejména příslovečně polymorfního medulárního karcinomu, tak v stále častější situaci metastatického postižení velmi bohatě prokrvené štítné žlázy při déledobém přežití léčených ale i skrytých malignit jiné primární lokalizace. V imunocytochemických došetřeních na nátěrech je však nutno počítat, zejména u výrazněji krevnatých nátěrů, s odlučováním buněk v průběhu inkubací. Vstupní morfologický nález proto zpravidla před provedením imunocytochemických došetření fotograficky dokumentujeme.
ZÁKLADNÍ CYTOLOGICKÉ OBRAZY VE SVĚTLE JEDNOTLIVÝCH KATEGORIÍ REVIDOVANÉ BETHESDA KLASIFIKACE
Přehled diagnostických obrazů aspirační cytologie štítné žlázy lze nalézt v celé řadě cytopatologických učebnic (23-26). V českém jazyce shrnuli své desetileté klinickopatologické zkušenosti do monografie Čáp a Ryška (27), do učebních textů cytologie a klinických monografií Dušková (28, 29). V průběhu necelých deseti let od zavedení Bethesda systému hodnocení tyreoidálních cytologií byly publikovány desítky prací z mnoha světových pracovišť, které testovaly užitečnost této klasifikace a přinášely podněty k možným revizím. Rozhodujícími podněty k publikaci revidované klasifikace Bethesda 2017 (30) se však stalo vymezení nové nozologické jednotky NIFTP (Non Invasive Follicular Thyroid neoplasm with Papillary-like nuclear features (31)) a také čtvrté vydání WHO klasifikace nádorů endokrinních orgánů s novým tříděním folikulárních tumorů (32). V následujícím textu podáme krátký přehled oproti původní klasifikaci nezměněných diagnostických kategorií systému Bethesda 2017 s popisem modifikací, které do nich byly v porovnání s původní klasifikací Bethesda 2010 vneseny. Přehled kategorií Bethesda systému klasifikace podává tab. č. 1. Odpovídající rizika možného maligního nálezu v jednotlivých kategoriích se zařazením NIFTP mezi karcinomy (jak tomu bylo ve verzi 2010) a pokles těchto rizik způsobený vyřazením NIFTP z papilárních karcinomů spolu s obvyklým postupem podává tab. č. 2.
Tab. 1. Bethesda systém klasifikace tyreoidálních cytologií – přehled kategorií (dle Cibase a Aliho, 2017, (29)). 
Pozn.: Zkratky jsou uvedeny pouze u kategorií, které mají delší název a zkratky jsou u nich v nepřeložené formě pro stručnost používány. Tab. 2. Bethesda systém hlášení tyreoidálních cytologií 2017: Předpokládaná rizika malignity a doporučené postupy (dle Cibase a Aliho (29)). 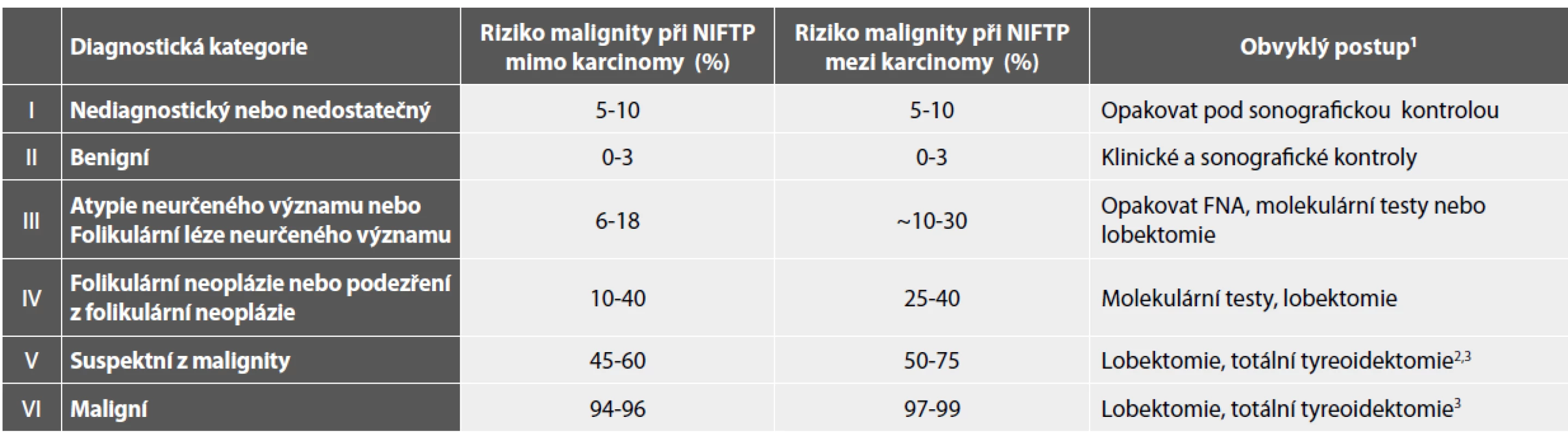
1Může se lišit vlivem jiných faktorů než FNA (sonografický, klinický nález).
2 Rozsah může ovlivnit molekulární vyšetření.
3V případě (susp.) metastatického postižení nemusí být chirurgický zákrok indikován.B I. Nediagnostický nebo nedostatečný vzorek (obr. 1A-D)
Nesporným přínosem této kategorie je jednak jasná formulace minima diagnostických buněk (6 skupin po deseti buňkách), ale i posílení obecně platného principu, že prvním krokem v diagnostickém hodnocení musí být právě zhodnocení kvantity a kvality dodaného vzorku. V souladu s recentně doporučenými výjimkami jsme ve své praxi používali princip snížení nutného počtu pravidelných tyreocytů ve vzorcích s hojným denzním koloidem (někdy s makrofágy), s dodatkem, že obraz odpovídá punkci koloidní cysty. Stejně, jako musí klinický specialista vyloučit nereprezentativnost takového odběru neznepokojivým sonografickým nálezem, praktická rada pro hodnotícího patologa zde zní, neztratit v případě obrazu s hojným koloidem diagnostickou bdělost a pečlivým proskrínováním nátěru vyloučit přítomnost ojedinělých buněčných skupinek diagnostických pro murální papilární karcinom. Pro opakovaný odběr u pacientů s nálezem B I pak doporučujeme provést druhý vpich do okolí cystické léze.
Fakultativní přítomnost tyreocytů v případě bohatého zánětlivého pozadí jsme zejména u dětských pacientů rovněž uplatňovali. Pro diagnózu tyreoiditidy je pouze nutno mít jistotu, že takový odběr představovaný bohatou populací imunitně transformujících lymfocytů pochází skutečně ze štítné žlázy a ne například z istmické či jiné uzliny těsně sousedící.
Obr. 1. B I. Pouze „pozadí“. 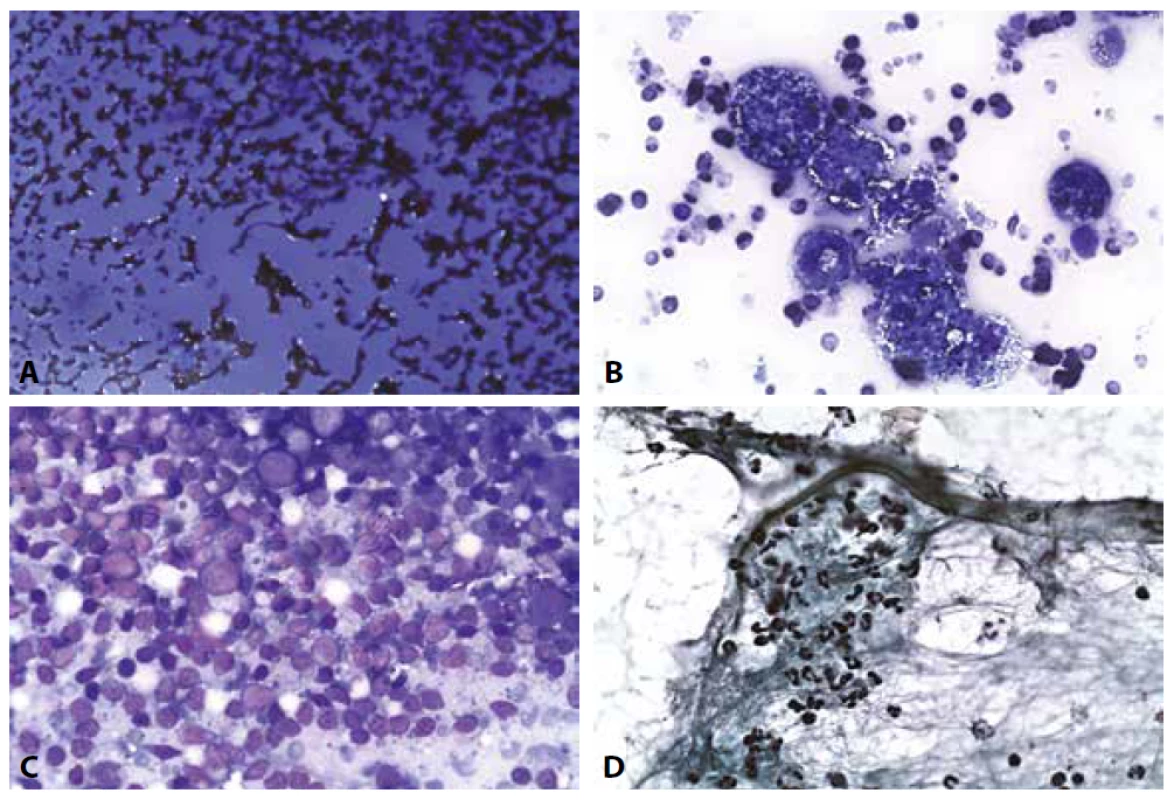
A: Denzní koloid a krev. Tyreocyty chybí. MGG, 100x.
B: Makrofágy se známkami fagocytární aktivity jednotlivě i ve skupinkách. Tyreocyty chybí. MGG, 400x.
C: Lymfocytární tyreoiditida. Populace antigenně transformujících lymfocytů. Tyreocyty chybí. 200x.
D: Nekrotické stromální mikrofragmenty s hojnými neutrofilními granulocyty. Polychrom, 400x.
(Pozn.: Při tomto nálezu je nutno aktivně pátrat po vitálních strukturách v nátěru! Tato pacientka měla anamnesticky karcinom prsu s podezřením na metastatické postižení. Diferenciální diagnóza je široká – absces, nekróza v benigním i maligním, primárním i metastatickém uzlu…).
Poznámka: vybrané ilustrace k jednotlivým klasifikačním skupinám samozřejmě nemohou postihnout celou šíři morfologického spektra. Vybrány byly takové, které jsou jednak častější, jednak dávají možnost upozornit na některá úskalí. Vedle jednotlivých obecných obrázků jsou zařazeny i dvojice nebo čtveřice od jedné pacientky/pacienta pro demonstraci cytologicko-histologické korelace nebo doplňujících vyšetřovacích postupů.B II. Benigní nález (obr. 2A-D)
V revidovaném systému Bethesda 2017 zde nejsou žádné změny. Riziko falešné negativity je nízké, o cystických obrazech i zánětech platí to, co bylo uvedeno výše.
Obr. 2. B II. Benigní nález. 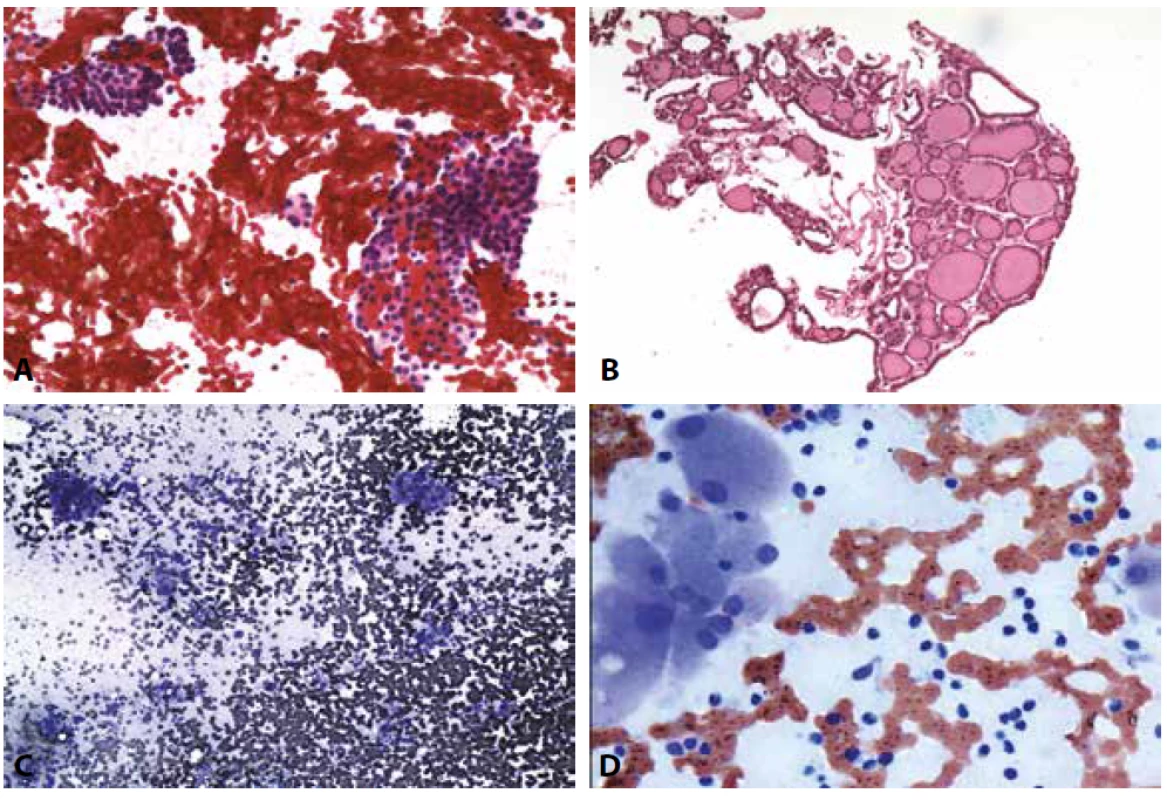
A: Hyperplastická struma. Krevní pozadí. Fragmenty makrofolikulů a v centru skupinka s náznakem mikrofolikulární úpravy. HE, 200x.
B: Hyperplastická struma (táž pacientka jako na obr. 2a). Fragment mikromakrofolikulární klidové koloidní strumy. Cytoblok, HE, 100x.
C: Hashimotova tyreoiditida. Krev, koloid, skupinky onkocytů se zánětlivou celulizací. MGG, 200x.
D: Hashimotova tyreoiditida. Onkocytární skupinky a zánětlivá celulizace. MGG, 400x.B III. Atypie neurčeného významu /Folikulární léze neurčeného významu AUS/FLUS. (Obr. 3A-D)
Poněkud překvapujícím a nelogickým se nám v kontextu naší denní praxe i pečlivě pročítaného textu výchozí Bethesda 2010 klasifikace jeví recentní doporučení, že laboratoř by si měla vybrat jeden z názvů AUS – FLUS a ten užívat výlučně. Je totiž ihned doplněno, že v takovém případě AUS je flexibilnější, protože FLUS popisuje výlučně mikrofolikulární léze. Laboratoř, která by tedy teoreticky zvolila tuto kategorii, by musela např. naznačené diagnostické znaky papilárního karcinomu v kvantitativně a kvalitativně limitovaném vzorku, které z naší i publikované zkušenosti vyznívají někdy v histologickou diagnózu papilárního karcinomu klasifikovat jako folikulární lézi (33). Při snaze akceptovat výlučně kategorii FLUS by si hodnotitel musel uvědomit, že i papilární karcinomy vycházejí z folikulárních buněk… Mnohem praktičtější a bez rozporu s dosud publikovaným popisem kategorie B III se nám jeví výběrové užití jedné nebo druhé podtřídy podle povahy nálezu (výjimečně obou současně, když zvažujeme např. diagnózu NIFTP), doprovázené pravidelně podrobnějším komentářem pro klinika v souladu s doporučeními původní i revidované klasifikace Bethesda. Dobré cytopatologické pracoviště by nemělo nálezů B III hlásit více než 7-10%. Podíl těchto neurčitých diagnóz je nepochybně ovlivněn na klinické straně kvalitou odběru a poskytnuté úplnosti informace (např. o probíhající nebo provedené tyreostatické, chemoterapeutické, radiační léčbě). Pro patologa to nesmí být sběrná kategorie – je nutno při jejím zvažování konkrétně zdůvodnit zařazení, tak, jak je uvedeno v klasifikaci a případnou nižší interpretační zkušenost doplnit konzultačním hodnocením zkušeného kolegy, který nezřídka nález dokáže zařadit do kategorie nižší, nebo vyšší.
Obr. 3. B III. AUS/FLUS. 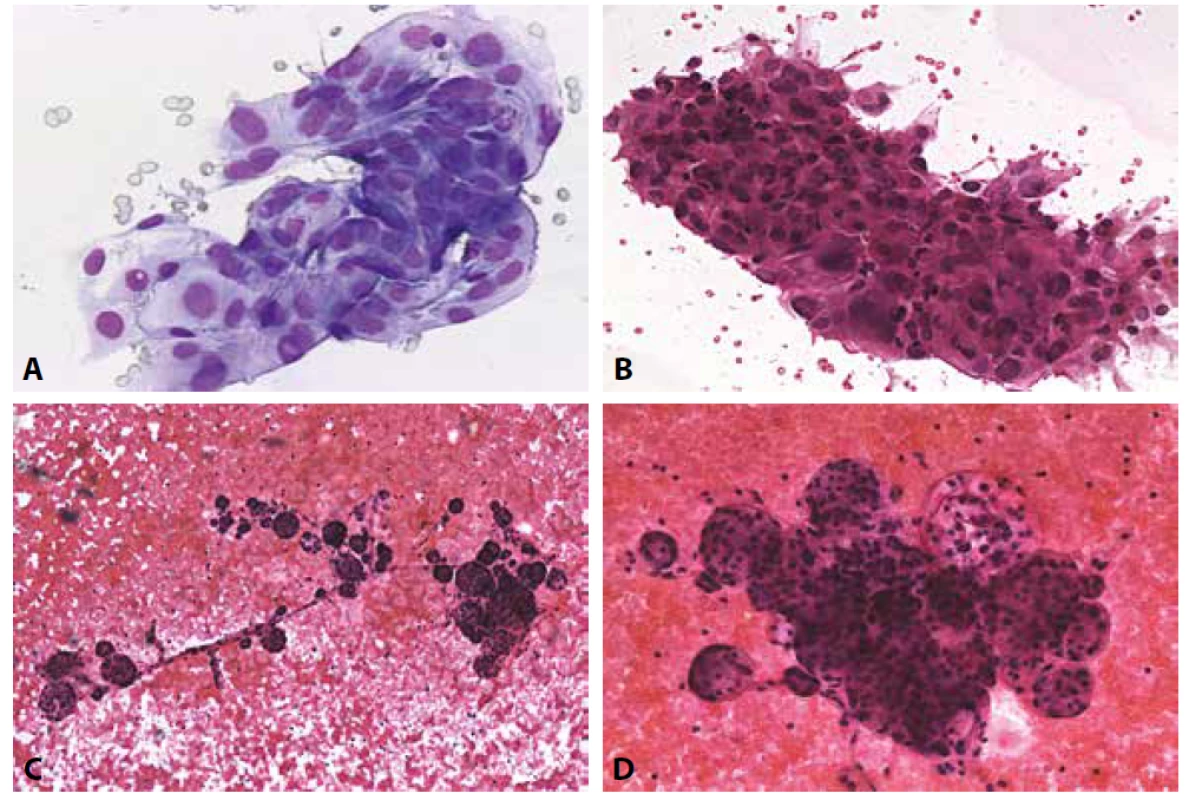
A: Skupinka atypických buněk vs. ze stěny pseudocysty. Pokud by byl nález takto zařaditelný s úplnou jistotu, patřil by do B II. Zařazení do B III však povede ke kontrolnímu zhodnocení sonografického nálezu a odběru dalšího cytologického vzorku – tab. č. 2. MGG, 400x.
B: Žena 71 let. Víceuzlová struma. Solidně trabekulární buněčná formace s atypií nejasného významu. Naznačeny jaderné znaky papilárního karcinomu. Nález je ojedinělý. Skupinka je zánětlivě celulizovaná. Nejsou vyjádřeny všechny jaderné cytodiagnostické znaky. HE, 200x. Operována, v terénu polynodózní strumy prokázán papilární karcinom.
C: Pouze málo až středně buněčný nátěr. Téměř všechny zastižené tyreocyty s mikrofolikulární úpravou. HE, 200x.
D: Mikrofolikulární skupinky buněk. HE, 400x.B IV. Folikulární neoplázie nebo Podezření z folikulární neoplázie FN/SFN (Obr. 4A-F)
Na rozdíl od předchozí se nám v této opět zdvojeně nazvané kategorii jeví doporučovaná volba jednoho z obou pojmů jako logická, a sice toho, který zdůvodněně preferuje mnoho laboratoří - SFN. Tím důvodem je okolnost, že cca třetina těchto obrazů jsou hyperplastické mikrofolikulární proliferace ve víceuzlových strumách.
Tato a další dvě kategorie Bethesda klasifikace byly zřetelně ovlivněny vyřazením NIFTP z karcinomů. Středně až více buněčné nátěry s převahou mikrofolikulů a částečně vyjádřenými znaky papilárního karcinomu připouštějí za současné situace jak diagnózu FVPTC, tak NIFTP, pokud ovšem byla vyloučena přítomnost NIFTP vylučujících znaků: fragmenty pravých papil, psammomatózní tělíska, vysoká mitotická aktivita, nekróza (30,31).
Při vyjádřených jaderných znacích papilárního karcinomu a absenci znaků vylučujících NIFTP je žádoucí poskytnout diferenciální diagnózu připouštějící FVPTC i NIFTP s tím, že rozhodnutí nelze učinit v cytologické rovině. Diagnózu může upřesnit pouze případné podrobné histologické došetření z hemithyreoidektomie.
Obr. 4. B IV SFN. 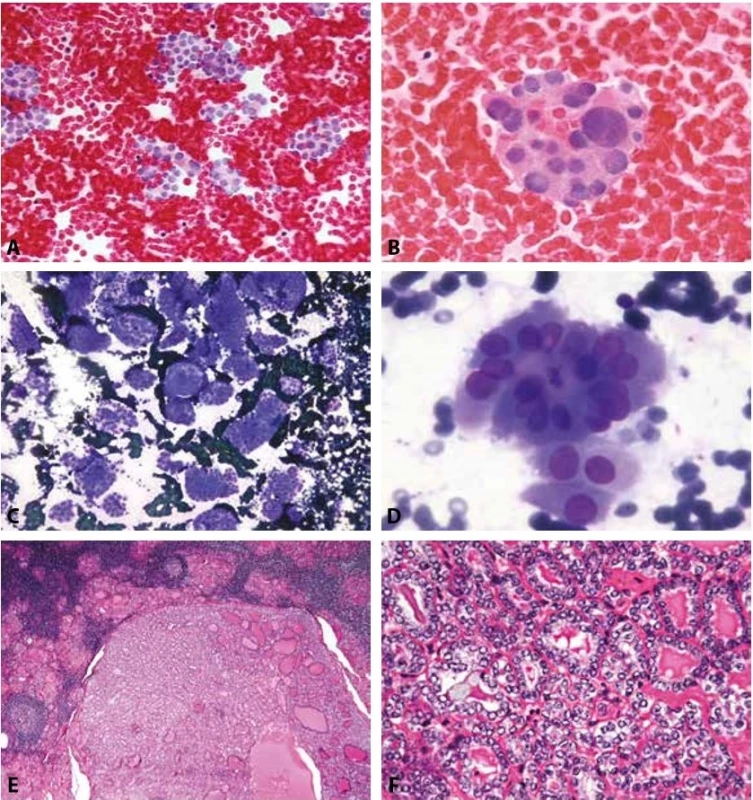
A: Muž 19 let. Solitární uzel. Velmi buněčný nátěr. V krevním pozadí s minimem koloidu relativně monomorfní populace tyreocytů v malých skupinkách, často s náznaky mikrofolikulární úpravy. MGG, 200x.
B: Týž pacient jako 4a. Mikrofolikulární skupinka z tyreocytů s výraznější anizokaryózou. Jádra okrouhlá, chromatin jemný, cytologicky hodnoceno jako polyploidie. MGG, 400x. Histologicky byl prokázán adenom.
C-F: Žena 58 let. Autoimunní tyreoiditida.
C: Velmi buněčný nátěr. V krevním pozadí s minimem koloidu relativně monomorfní populace tyreocytů v malých skupinkách, často s náznaky mikrofolikulární úpravy. MGG, 200x.
D: Mikrofolikulární skupinky z méně pravidelných tyreocytů. Anizokaryóza, překrývání jen mírně neokrouhlých jader. Cytologicky hodnoceno jako proliferující mikrofolikulární léze s podezřením na FVPTC. MGG, 400x.
E: Histologicky uzel v terénu tyreoiditidy. Na primárním pracovišti hodnocen jako mikrofolikulární adenom. HE, 40x.
F: V konzultaci diagnóza změněna na FVPTC. Současná diagnóza by byla NIFTP. (Jaderné skóre 2). HE, 200x.B V. Podezření z malignity (Obr. 5A-H)
I v této kategorii se snížilo riziko malignity vymezením NIFTP (tab. č. 2). Při neúplně vyjádřených jaderných znacích papilárního karcinomu lze zařadit do této kategorie s poznámkou, že diferenciální diagnóza připouští původ uvedených buněk i nově vymezeného indolentního NIFTP. Kategorie slouží pro všechny maligní nálezy odběrem ne zcela jednoznačně reprezentované, nebo z povahy dodaného vzorku nevyšetřitelné v celém dostupném rozsahu speciálních metod. Přítomné diagnostické znaky a zároveň i limity (kvantitativní z hlediska celularity a povahy dodaného vzorku a kvalitativní z hlediska požadovaných setů diagnostických znaků) se objeví v popisu nálezu.
Obr. 5. B V. Podezření z malignity. 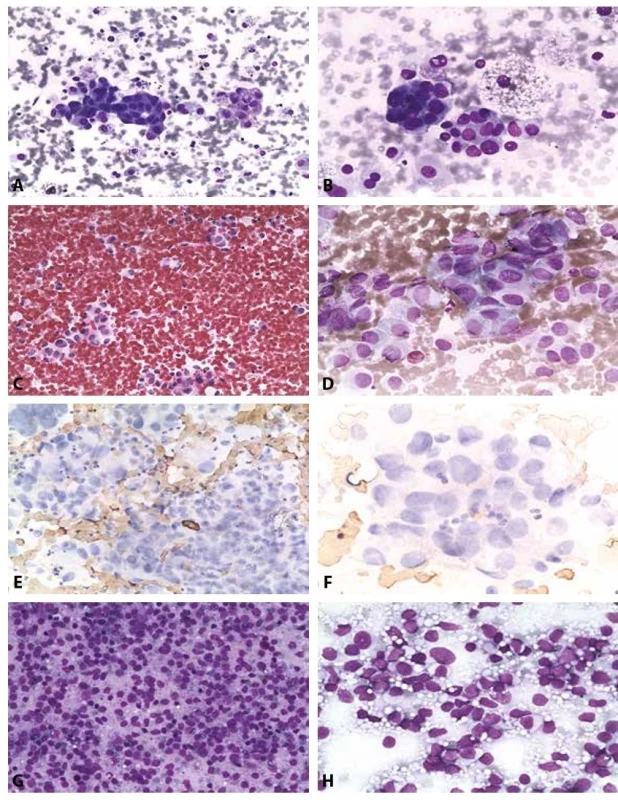
A-B: Podezření z papilárního karcinomu. Žena 38 let, polynodózní struma.
A: V pozadí regresivně změněných erytrocytů a koloidu dispersně makrofágy s pigmentem a skupinky nepravidelných tyreocytů se zvětšenými neokrouhlými jádry; nejsou přítomny pseudoinkluze a fragmenty s jasnou papilární úpravou. MGG, 200x.
B: Výrazná anizokaryóza zvětšených zneokrouhlených překrývajících se jader. Syncyciální formace. Makrofágy. MGG. 400x. Histologicky potvrzen papilární karcinom cysticky degenerovaný.
C: Podezření z velkobuněčné varianty medulárního karcinomu. Vysoká buněčnost. Polygonální buňky s excentrickými jádry, jsou podobné onkocytům. HE, 200x.
D: Podezření z velkobuněčné varianty medulárního karcinomu. Polygonální buňky s excentrickými hyperchromními jádry. Chromatin místy jemně granulovaný – „sůl a pepř“. MGG, 400x. Histologicky byl medulární karcinom potvrzen. V kategorii B V ponecháno vzhledem k širší diferenciální diagnóze tohoto nálezu – včetně metastatického postižení. Nebyl materiál pro imunocytochemické došetření.
E-F: Podezření z nediferencovaného karcinomu. Žena 50 let s anamnézou invazivního duktálního karcinomu prsu.
E: Vysoce buněčný nátěr s přítomností nediferencovaných buněk. V kategorii BV zůstává pro nutné zvážení širší diferenciální diagnózy – včetně případné metastázy. Imunocytochemie na odbarveném MGG, negativní chromogranin, dobarveno hematoxylinem, 200x.
F: Negativní průkaz kalcitoninu na odbarveném MGG. Bez možnosti dalších došetření zůstává v B V. Histologicky prokázán nediferencovaný karcinom.
G: Vysoce buněčný nátěr dyskohezivních elementů. MGG, 200x.
H: V detailu buňky s rysy blastických lymfocytů, monomorfní populace. MGG, 400x. Histologicky prokázán non Hodgkinův maligní lymfom.B VI. Maligní nález (Obr. 6A-H)
Zařazení do této kategorie vyžaduje shodně s předchozí verzí Bethesda klasifikace přítomnost cytomorfologických znaků a ideálně i odpovídající výsledky doplňujících vyšetření k určení typu malignity. S vymezením NIFTP se v této kategorii požaduje pro diagnózu papilárního karcinomu přítomnost diagnostických znaků včetně těch, které představují znaky NIFTP vylučující – tedy pravých papilárních mikrofragmentů, psammomat, jaderných pseudoinkluzí. (Pseudoinkluze však nejsou na podkladě dávné zkušenosti nejen naší rozhodně patognomonické.) Nicméně revidovaný systém Bethesda 2017 zde doporučuje připojit upozornění, že velmi malá část cytologicky diagnostikovaných papilárních karcinomů může být histologicky sledována diagnózou NIFTP. To ovšem pouze tehdy, kdy by nebyla pro posun z B V do B VI striktně uplatněna NIFTP vylučující kritéria, která lze v cytologii zastihnout. Bude tedy nepochybně záležet na strategii diagnostika. U medulárního karcinomu vzhledem k jeho známé polymorfii a tudíž široké diferenciální diagnóze včetně metastatického postižení z kryptogenní či anamnestické malignity používáme kategorii B VI, pokud je možno imunocytochemicky došetřit, jinak zůstáváme v kategorii B V a doporučujeme vyšetření sérového kalcitoninu. Podobně diagnosticky obtížná mohou být anamnesticky specifikovaná metastatická postižení; snažíme se vždy o porovnání histo-cytologické, v případě morfologické přípustnosti pak o užití markerů, které anamnesticky udaný proces exprimoval. V diferenciální diagnóze stojí metachronní malignita, včetně té vycházející ze štítné žlázy samotné. Pro uvažovaný ML obdobně, mezioborově pomůže průtoková cytometrie. Obecně lze tedy z naší zkušenosti říci, že při často limitovaném typu materiálu s absencí cytobloku stojíme často v situaci cytomorfologicky vysoce pravděpodobné diagnózy, kterou nemůžeme posledním krokem do kategorie B VI posunout. Je na klinickém kolegovi, zda se spokojí s diagnózou (vysoké) suspekce v kategorii B V, případně dodá další vzorek k upřesnění diagnózy podle našich požadavků.
Molekulárně patologické došetření je proveditelné nejen z u nás téměř neexistujících LBC vzorků, ale i z nátěrů (34) a v britském systému je zdůvodněna i otázka déledobé ekonomické výhodnosti současného testování BRAF V600 mutace (35). I když však každým dnem narůstá množství informací týkajících se genetických profilů jednotlivých současně vymezenýchnozologických jednotek (32), současný stav poznání neumožňuje zpravidla jejich přímé diagnostické využití v cytologické úrovni a spolu s nároky ekonomickými a technologickými se do rutinní diagnostiky zatím neprosadily. Vzhledem k vývoji posledních let však lze předpokládat, že nejde o stav neměnný (36)
Obr. 6. B VI. Maligní nález. 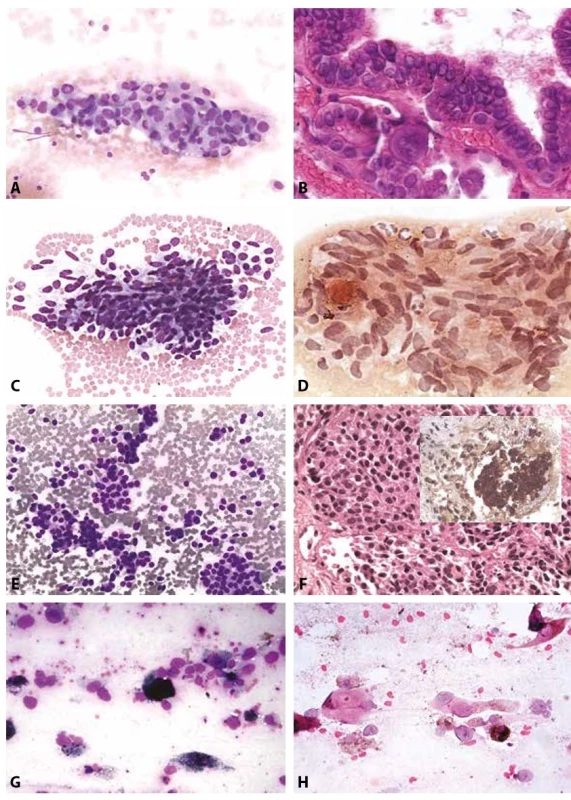
A: Papilární karcinom. Skupinka sestávající z tyreocytů s nepravidelnými překrývajícími se jádry. Pseudoinkluze a fragmenty s jasnou papilární úpravou. MGG, 200x.
B: Papilární karcinom. Fragment pravé papily s psammomatózním tělískem a diagnostickými jadernými znaky. MGG, 400x. Ze základního barvení veškeré cytodiagnostické znaky.
C: Medulární karcinom. Vysoká buněčnost. Vřetenobuněčná varianta s protáhlými jádry. MGG, 200x.
D: Medulární karcinom. Pozitivní barvení Kongo červení ve skupinkách. (Minimální nazelenalý dvojlom v polarizovaném světle nefotografován.). Kongo červeň, 400x.
E: Malobuněčný karcinom s hyperchromními jádry. MGG, 200x.
F: V cytobloku solidní mikrofragmenty pozitivní v imunocytochemickém průkazu kalcitoninu. HE, kalcitonin 400x.
G: Atypické buňky s pigmentací. Známky rozpadu a fagocytózy pigmentu. Anamnéza melanomu. MGG, 400x.
H: V detailu buňky s rysy nádorových melanocytů a pigmentací. Diagnóza stanovena i porovnáním s kožní biopsií archivovanou na tomtéž pracovišti. HE, 400x.FORMULACE CYTOLOGICKÉHO NÁLEZU
Formulace cytologického nálezu představuje velmi důležitý závěrečný krok cytologického vyšetření. Některé principy již byly zmíněny v předchozím textu.
Významným úvodním krokem je popis množství a kvality nátěrů přiřazených k jednotlivým odběrům, případně dodané tekutiny. Následuje údaj o vstupním zpracování – jsme zvyklí uvádět počet a metodu barvení preparátů i počet cytoblokových řezů.
Následuje popis celkové buněčnosti vzorku, charakteru pozadí, jednotlivých subpopulací a zachovalosti buněk, podrobný morfologický popis reziduální cytoarchitektoniky (buněčná uskupení, polarizace buněk, zánětlivá celulizace ve skupinách…) a cytologických charakteristik zastoupených buněk. Z tohoto popisu by měla logicky vycházet indikace k specializovaným došetřením. Jejich výsledky interpretované v návaznosti na morfologický nález vedou k závěru. Tím je diagnóza: buď jednoznačná, nebo diferenciálně diagnostická rozvaha s případným návrhem dalších vyšetření jak za rámec cytomorfologický, tak případně doporučení opakovat cytologické vyšetření ze stejné lokality. Ve formulaci se zásadně snažíme přiblížit co nejvíce terminologii histopatologické.
Závěrečné kódování topickým kódem a kódem Mezinárodní klasifikace nemocí doplňuje informaci a usnadňuje vyhledávání v databázi.
ZÁVĚR
- Tenkojehlová aspirační biopsie FNAB je rutinní součástí diagnostického thyreoidologického postupu
- Užití standardizované klasifikace napomáhá mezioborové komunikaci; její úroveň ve všech fázích vyšetřovacího procesu je pro výsledný přínos naprosto klíčová
- Revidovaná klasifikace Bethesda 2017 odráží současný pohled na nádory štítné žlázy daný poslední (4.) verzí WHO klasifikace nádorů endokrinních tkání.
PODĚKOVÁNÍ
Podpořeno Univerzitou Karlovou - projekt Progres Q28/LF1. Podpořeno MZ ČR – projekt RVO VFN64165.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
PŘÍLOHA
Postup zhotovení cytologického nátěru z aspirátu
- Aspirované množství by nemělo významně přesáhnout objem jehly, další materiál je pouze krev – ředí diagnostický obraz.
- V případě evakuace cysty je žádoucí poslat veškerý obsah v odpovídající nádobce a provést další aspiraci ze stěny kolabovaného útvaru.
Vlastní technika zhotovení nátěrů
Jehla musí být v doteku s odmaštěným (např. etanolem) podložním sklem - místo 1 označeného nátěru - opatrně vyprázdnit kapku, aby se nerozstříkla.
Druhým podložním sklem pod úhlem 45 stupňů roztáhnout materiál lehce do ztracena (POUZE JEDEN POHYB bez hmoždění buněk, tenká vrstva).
Pokud jsou patrny v aspirátu tkáňové mikročástky, sejmout špičkou jehly do formolu v eppendorfce – poslouží k vytvoření cytobloku – velmi užitečné zejména při podezření na nádorový proces.
Nátěry buď nechat zaschnout - nikoli natřenými plochami k sobě, nebo bez doteku natřených ploch navzájem fixovat za vlhka 50% etanolem (popř. metanolem), nebo sprejovým fixativem z dostatečné vzdálenosti.
Výsledný nátěr by měl mít zužující se tvar, který nedosahuje k okrajům podložního skla, viz nákres.
Eppendorf zkumavka pro zasílání cytoblokového materiálu. Aspirát do formolu, uchovávání a transport při pokojové teplotě, nikoli v lednici 
prof. MUDr. J. Dušková, CSc. FIAC, 28.03.2017
Adresa pro korespondenci:
Prof. MUDr. Jaroslava Dušková, CSc., FIAC,
Ústav patologie 1. LF UK a VFN
Studničkova 2, 128 00 Praha 2
tel.: +420224968688
Zdroje
1. Pearce EN, Andersson M, Zimmermann MB. Global iodine nutrition: Where do we stand in 2013? Thyroid 2013; 23(5): 523-528.
2. Zimmermann MB. Iodine deficiency and excess in children: Worldwide status in 2013. Endocrine practice 2013; 19(5): 839-846.
3. Niazi AK, Kalra S, Irfan A, Islam A. Thyroidology over the ages. Indian J Endocrinol Metab 2011; 15(Suppl 2): S121-126.
4. Dvořáková M, Bílek R, Čeřovská J, Hill M, Novák Z, Vavrejnová V, Vlček P, Vrbková J, Zamrazil V. Volumy štítné žlázy u dospělé populace ve věku 18–65 let v české republice – stanovení norem. Vnitř. Lék. 2006; 52(1): 57-63.
5. Jiskra J. Diagnostika a další péče o pacienty s tyreoidálními uzly: Doporučení American thyroid association 2015 modifikované pro podmínky České republiky. Čas lék čes 2017; 156(5): 241-251.
6. Šmejkal V. Technik und Ergebnisse der Aspirationspunktion der Schilddruse. Verh Dtsch Ges Inn Med 1968; 74(1209-1212.
7. Asteria C, Giovanardi A, Pizzocaro A, et al. Us-elastography in the differential diagnosis of benign and malignant thyroid nodules. Thyroid 2008; 18(5): 523-531.
8. Mansor M, Okasha H, Esmat S, et al. Role of ultrasound elastography in prediction of malignancy in thyroid nodules. Endocr Res 2012; 37(2): 67-77.
9. Rago T, Santini F, Scutari M, Pinchera A, Vitti P. Elastography: New developments in ultrasound for predicting malignancy in thyroid nodules. J Clin Endocrinol Metab 2007; 92(8): 2917-2922.
10. Zhao CK, Xu HX, Xu JM, et al. Risk stratification of thyroid nodules with Bethesda category III results on fine-needle aspiration cytology: The additional value of acoustic radiation force impulse elastography. Oncotarget 2017; 8(1): 1580-1592.
11. Poller DN, Baloch ZW, Fadda G, et al. Thyroid FNA: New classifications and new interpretations. Cancer Cytopathol 2016; 124(7): 457-466.
12. Cibas ES, Ali SZ. The Bethesda system for reporting thyroid cytopathology. Thyroid 2009; 19(11): 1159-1165.
13. Cibas ES, Ali SZ. The Bethesda system for reporting thyroid cytopathology. Am J Clin Pathol 2009; 132(5): 658-665.
14. Ali, ZS, Cibas ES. The Bethesda system for reporting thyroid cytopathology. Definitions, criteria and explanatory notes (1st ed.). New York Dordrecht Heidelberg London: Springer; 2010:
15. Kocjan G, Cochand-Priollet B, De Agustin PP, et al. Diagnostic terminology for reporting thyroid fine needle aspiration cytology: European Federation of Cytology Societies thyroid working party symposium, Lisbon 2009. Cytopathology 2010; 21(2): 86-92.
16. Dušková J. Nový systém pro sjednocené hodnocení tenkojehlových aspiračních biopsií štitné žlázy-Bethesda 2010. Cesk Patol 2011; 47(1): 8-14.
17. Srbová L, Gabalec F, Ryška A, Čáp J. Results of retrospective classification of thyroid fnas according to the Bethesda system: Would this have improved accuracy? Cytopathology 2015; 26(4): 231-237.
18. Kwon H, Kim WG, Eszlinger M, et al. Molecular diagnosis using residual liquid-based cytology materials for patients with nondiagnostic or indeterminate thyroid nodules. Endocrinol Metab (Seoul) 2016; 31(4): 586-591.
19. Tripathy K, Misra A, Ghosh JK. Efficacy of liquid-based cytology versus conventional smears in FNA samples. J Cytol 2015; 32(1): 17-20.
20. Rossi ED, Fadda G, Schmitt F. The nightmare of indeterminate follicular proliferations: When liquid-based cytology and ancillary techniques are not a moon landing but a realistic plan. Acta Cytol 2014; 58(6): 543-551.
21. Fadda G, Rossi ED. Liquid-based cytology in fine-needle aspiration biopsies of the thyroid gland. Acta Cytol 2011; 55(5): 389-400.
22. Rossi ED, Raffaelli M, Zannoni GF, et al. Diagnostic efficacy of conventional as compared to liquid-based cytology in thyroid lesions: Evaluation of 10,360 fine needle aspiration cytology cases. Acta Cytol 2009; 53(6): 659-666.
23. Koss LG. Diagnostic cytology and its histopathologic bases (4th ed.). Philadelphia: Lippincott; 1992:
24. De May RM. The art and science of cytopathology (1st ed.). Chicago: ASCP Press; 1995:
25. Bibbo M. Comprehensive cytopathology (2nd ed.). Philadelphia: Saunders; 1997:
26. Spieler P, Rössle M. Nongynecologic cytopathology (1st ed.). Berlin - Heidelberg: Springer; 2012:
27. Čáp J, Ryška A. Aspirační cytologie štítné žlázy (1st ed.). Hradec Králové: Nucleus HK; 2003:
28. Dušková J. Cytologie štítné žlázy, slinných žláz a lymfatických uzlin v oblasti hlavy a krku In: Kobilková J and Dušková J, eds. Základy cytopatologie (1st ed). Praha Karolinum; 2006 : 17-39.
29. Dušková J. Cytologie štítné žlázy. In: Marek J. HV, eds. Endokrinologie (1st ed). Praha: Galén; 2017 : 691.
30. Cibas ES, Ali SZ. The 2017 Bethesda system for reporting thyroid cytopathology. Thyroid 2017; 27(11): 1341-1346.
31. Nikiforov YE, Seethala RR, Tallini G, et al. Nomenclature revision for encapsulated follicular variant of papillary thyroid carcinoma: A paradigm shift to reduce overtreatment of indolent tumors. JAMA Oncol 2016; 2(8): 1023-1029.
32. Chan JKC, Nikiforov YE, Tallini G. Other encapsulated follicular-patterned thyroid tumours. In: Lloyd RW, Osamura RY, Klöpel G and Rosai J, eds. WHO classification of tumours of endocrine organs (4th ed). Lyon: IARC; 2017 : 75-80.
33. Dušková J, Tretiník P. Papillary thyroid carcinoma: An easy fine needle aspiration biopsy diagnosis? Acta Cytol 2011; 55(2): 120-130.
34. Poller DN, Glaysher S. BRAF V600 co-testing is technically feasible in conventional thyroid fine needle aspiration (FNA) cytology smears and can reduce the need for completion thyroidectomy. Cytopathology 2014; 25(3): 155-159.
35. Poller DN, Glaysher S, Agrawal A, et al. BRAF V600 co-testing in thyroid FNA cytology: Short-term experience in a large cancer centre in the UK. J Clin Pathol 2014; 67(8): 684-689.
36. Poller DN, Glaysher S. Molecular pathology and thyroid FNA. Cytopathology 2017; 28(6): 475-481.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článek Jaká je vaše diagnóza?
Článok vyšiel v časopiseČesko-slovenská patologie

2019 Číslo 1-
Všetky články tohto čísla
- Aktuální otázky tenkojehlové aspirační biopsie štítné žlázy
- Pneumologická cytodiagnostika – state of the art 2019
- Cytopatologie - State of the Art (2. část)
- Aktuální pohled na močovou cytologii: Co přináší Pařížská klasifikace?
- Primární maligní obrovskobuněčný nádor pažní kosti mikroskopicky napodobující chondroblastom – kazuistika
- Noonanovej syndróm z pohľadu fetopatológa
- MONITOR, aneb nemělo by vám uniknout, že...
- Imunohistochemická diagnostika morbus Hirschsprung pomocí kalretininu
- Opavské Muzeum patologie je moje srdeční záležitost
- Jaká je vaše diagnóza?
- Nový systém pro sjednocené hodnocení tenkojehlových aspiračních cytologií slinných žláz: Co nového přinesl „tzv. Milánský systém reportování“ do cytodiagnostiky lézí slinných žláz?
- Jaká je vaše diagnóza? Odpověď: Difúzny leptomeningeálny glioneuronálny tumor (diffuse leptomeningeal glioneuronal tumor)
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Aktuální otázky tenkojehlové aspirační biopsie štítné žlázy
- Aktuální pohled na močovou cytologii: Co přináší Pařížská klasifikace?
- Noonanovej syndróm z pohľadu fetopatológa
- Pneumologická cytodiagnostika – state of the art 2019
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




