-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Denzita kostního minerálu u pacientů s cystickou fibrózou – výsledky 3letého sledování a intervence
Bone Mineral Density in Cystic Fibrosis Patients – Results of a 3-years Folow-up and Intervention
Objectives:
Low bone mineral density (BMD) in cystic fibrosis (CF) patients is a problem of multifactorial origin. The aim of this analysis was to assess prospectively BMD in CF patients and the effect of vitamin D (vit. D) and calcium (Ca) supplementation adjustment.Patients:
45 CF patients (aged 4.3–45 years, 27 female, 27 % >18 years).Methods:
Lumbar spine BMD (L1–L4) was measured by DXA (dual-energy X-ray absorptiometry), correction of BMD Z-score was conducted according to height and weight. Other parameters: anthropometry, FEV1, serum levels of Ca, 25-(OH)-vit. D and 1,25-(OH)₂-vit. D, alkaline phosphatase (ALP), calciuria. Measurements were repeated yearly, conducted altogether 4x. Ergocalciferol and Ca supplementation were adjusted according to calciuria every 3 months.Results:
Weight, height and BMI were lower than normal (mean Z-score (SD) = -1.2 (1.14), -1.01 (1.16) a -0.48 (0.90)). Weight and height Z-score did not change during follow up, BMI Z-score decreased. BMD was lower than in normal population in all measurements (mean Z-score (SD) = -1.7 (1.0), -1.2 (0.9), -1.3 (1.1), -1.4 (1.0), p <0.001), even after correction according to weight and height. Between the 1st and 2nd measurement BMD Z-score increased in patients aged <18 years (p = 6.6 x 10-7), then stayed stabilized. BMD Z-score in patients aged >18 years did not change significantly. Vit. D and Ca supplementation was increased between the 1st and 2nd measurement. 25-(OH)-vit. D a 1,25-(OH)₂-vit. D levels were normal and did not change significantly. However, 70% values of 25-(OH)-vit. D levels were <75 nmol/l (the lower limit of levels recommended for CF patients by the international consensus). Calciuria was in normal range and decreased by the time.Conclusions:
Low BMD may be present already in prepubertal CF patients. Vitamin D and Ca supplementation adjustment according to calciuria may help to improve lumbar spine BMD in CF patients.Key words:
bone mineral density, calcium, cystic fibrosis, DXA, osteoporosis,
vitamin D
Autoři: E. Ondrušová-Očenášková 1; Hubert Vaníček 1; A. Jebavá 2
Působiště autorů: Dětská klinika LF a FN, Hradec Králové přednosta prof. MUDr. M. Bayer, CSc. 1; Ústav klinické biochemie a diagnostiky FN, Hradec Králové přednosta prof. MUDr. V. Palička, CSc. 2
Vyšlo v časopise: Čes-slov Pediat 2008; 63 (12): 660-667.
Kategorie: Původní práce
Souhrn
Úvod:
Nízká kostní denzita (BMD) u pacientů s cystickou fibrózou (CF) je dlouhodobě známým problémem multifaktoriální etiologie. Cílem sledování bylo zjistit stav BMD u pacientů s CF a zhodnotit prospektivně efekt úpravy suplementace vitaminu D (vit. D) a vápníku (Ca).Pacienti:
45 CF pacientů (4,3–45 let, 27 žen, 27 % >18 let).Metody:
Pomocí DXA (dual-energy X-ray absorptiometry) vyšetřena BMD L1–L4, provedena orientační korekce podle výšky a hmotnosti. Další parametry: antropometrie, FEV1, sérové hladiny Ca, 25-(OH)-vit. D a 1,25-(OH)₂-vit. D, aktivita ALP, kalciurie. Vyšetření byla opakována po 1 roce, celkem provedena 4krát. Suplementace ergokalciferolu a Ca byla upravována podle kalciurie každé 3 měsíce.Výsledky:
Hmotnost, výška a BMI pacientů byly nižší než norma (průměr Z-skóre (SD) = -1,2 (1,14), -1,01 (1,16) a -0,48 (0,90)). Z-skóre hmotnosti a výšky se neměnila, klesalo Z-skóre BMI. BMD byla při všech vyšetřeních nižší než u normální populace (průměr Z-skóre (SD) = -1,7 (1,0), -1,2 (0,9), -1,3 (1,1), -1,4 (1,0), p <0,001), ani podle výšky a hmotnosti se nekorigovala do norma. Mezi 1. a 2. vyšetřením došlo u pacientů <18 let ke vzestupu Z-skóre BMD (p = 6,6 x 10-7), při dalších vyšetřeních k jeho stabilizaci. U pacientů >18 roků se BMD signifikantně nezměnila. Mezi 1. a 2. vyšetřením byla zvýšena suplementace vit. D a Ca. Hladiny 25-(OH)-vit. D a 1,25-(OH)₂-vit. D byly v normě, neměnily se v čase. 70 % hodnot hladiny 25-(OH)-vit. D bylo pod 75 nmol/l. Kalciurie se pohybovala v rozmezí normálu, postupně klesala.Závěr:
Nízká BMD může být přítomna již u prepubertálních CF pacientů. Úpravou suplementace vitaminu D a Ca na základě monitorace kalciurie lze u CF pacientů dosáhnout zlepšení denzity kostního minerálu v oblasti lumbálních obratlů.Klíčová slova:
cystická fibróza, DXA, kostní denzita, osteoporóza, vápník, vitamin DÚvod
Komplexní péče o pacienty trpící cystickou fibrózou, stále zdokonalovaná v posledních desetiletích, přinesla výrazné prodloužení jejich života. S delším přežíváním těchto pacientů je nutno řešit nové problémy – např. otázky reprodukce, diabetes mellitus, bakteriální rezistence, osteoporóza a další. Osteoporóza a zvýšené riziko fraktur u CF pacientů jsou zmiňovány v literatuře již od roku 1979 [1]. Původ kostního postižení u CF je multifaktoriální [2]. Stavbu těla a metabolismus kostí u pacientů s CF negativně ovlivňují mimo jiné malnutrice a malabsorpce, časté záněty, nízká tělesná aktivita, hypogonadismus a v pozdějších stadiích i léčba systémově podávanými kortikosteroidy. Mechanismus vzniku poruchy kostní struktury je patrně převážně sekundární a je tedy možné mu předcházet, i když se uvažuje i o primárním defektu souvisejícím s mutací CFTR.
Jedním z významných faktorů může být nedostatek vitaminu D a vápníku. Nedostatečný příjem vápníku v potravě je i u zdravých dětí samostatným rizikovým faktorem. V důsledku exokrinní pankreatické insuficience, kterou má 80–90 % pacientů s CF, je sníženo zejména trávení a vstřebávání tuků. Vitaminy rozpustné v tucích se mohou vstřebávat ve snížené míře. Nízký podíl tělesného tuku vede k nízkým zásobám v tucích rozpustných vitaminů. U CF je též ovlivněn metabolismus vitaminu D [3, 4, 5]. U pacientů s CF může být omezen pobyt na slunci (zdroj UV paprsků), různá expozice slunečnímu záření v různých ročních obdobích může být zdrojem variability ve výsledcích stanovení hladin vitaminu D během roku. Jeho metabolismus může ovlivňovat i porušená aktivita 25-hydroxylázy a vyšší clearance vit. D nebo 25-(OH)-vit. D díky zvýšené oxidační aktivitě a zvýšené aktivitě cytochromu P450. Uvažuje se i o enterohepatální recirkulaci vitaminu D2 a 25-(OH)-vit. D a její poruše u CF. U nemocných s CF byly některými studiemi zjištěny nižší hladiny 25-(OH)-vit. D [1, 6], ale normální hladiny 1,25-(OH)2-vit. D. Existují však i studie prokazující u pacientů s CF normální hladiny 25-(OH)-vit. D [5] a snížené hladiny 1,25-(OH)2-vit. D [7]. Uvažuje se o tom, že i současná doporučení ohledně suplementace vitaminem D nemusí být zcela dostačující [6, 8].
Cystická fibróza ovlivňuje negativně zdraví pacientů od časného dětství a preventivní opatření cílená na kostní zdraví musejí začít v dětství. Intervence v dospělosti přinesou již jen malé změny.
Co se týká suplementace vitaminem D, mezinárodní konsenzus [3] doporučuje u pacientů s CF podávání nejméně 400 IU ergokalciferolu denně u kojenců a nejméně 800 IU u pacientů nad 1 rok věku. Dávky až 12 000 IU dětí <5 let věku a až 50 000 IU u pacientů >5 let věku 1–2krát týdně mohou být nezbytné k dosažení cílové sérové koncentrace 25-(OH)-vit. D 75–150 nmol/l (= 30–60 ng/ml). Pravděpodobně každé z dostupných analog (ergokalciferol, cholekalciferol, kalcifediol, kalcitriol) může při vhodném dávkování zlepšit sérovou hladinu vitaminu D, měřítka homeostázy kalcia a výsledně pomoci zvýšit BMD. Ergokalciferol je podporován pro nízké náklady a relativní bezpečnost. Pokud je však agresivní suplementace ergokalciferolem neefektivní, mělo by být zváženo podání polárnějších analog vitaminu D nebo fototerapie.
Cílem analýzy bylo:
- Zjistit stav denzity kostního minerálu u CF pacientů.
- Zhodnotit prospektivně efekt úpravy suplementace vitaminem D a vápníkem.
Pacienti a metody
Pacienti
Na začátku bylo vyšetřeno 45 pacientů ve věku 4,3–45 roků, průměr 14 roků, medián 10,9 roků, 18 mužů, 27 žen, 12 (27 %) starších 18 let. Všichni byli od počátku léčeni podle současných doporučení včetně suplementace vitaminu D (ergokalciferol). Žádný z pacientů neměl systémově podávané kortikosteroidy, 8 (18 %) bylo pankreaticky suficientních, 24 (53 %) podstupovalo pravidelnou ATB léčbu pro infekci Pseudomonas aeruginosa. Šestnáct pacientů (36 %) bylo DF508 homozygotních, 22 pacientů (49 %) s jednou DF508 mutací.
Metody
Analýza prospektivního sledování a výsledků intervence. Pacienti byli vyšetřeni v ročních odstupech v rámci pravidelných kontrol v CF ambulanci nebo za plánované hospitalizace k pravidelné antibiotické léčbě. Vždy byly vyšetřeny: antropometrie, biochemické parametry, plicní funkce, kostní denzita. Kromě toho byla každé 3 měsíce vyšetřována kalciurie (fU-Ca) a upravováno dávkování suplementace vitaminu D (účinná látka ergocalciferolum, přípravek Infadin, výrobce Slovakofarma a.s., Hlohovec, Slovenská republika) a vápníku (účinná látka calcii carbonas cum amylo, přípravek Vitacalcin, výrobce Slovakofarma a.s., Hlohovec, Slovenská republika). Pokud byla fU-Ca nízká nebo v nižším normálním rozmezí, byla zvýšena suplementace Ca o 250–500 mg/den a ergokalciferolu o 800–1600 IU, při hyperkalciurii naopak. 1. vyšetření: 45 pacientů, 12 z nich (27 %) >18 let. 2. vyšetření: 41 pacientů (10 pac. >18 roků). 3. vyšetření: 33 pacientů (7 pac. >18 roků). 4. vyšetření: 27 pacientů (4 pac. >18 roků).
Antropometrie, biochemické parametry a plicní funkce
Tyto parametry byly vyšetřovány společně s BMD. Antropometrická data (hmotnost, výška, BMI) byla u pacientů do 18 let věku porovnána s referenčními hodnotami za pomoci Kompendia pediatrické auxologie 2005 [9] a vyjádřena jako Z-skóre (Z-skóre = [pacientova – průměrná hodnota]/SD). U pacientů starších 18 let to již program neumožňoval, ke zhodnocení stavu výživy byla použita klasifikace WHO, vymezující BMI <18,5 kg/m2 jako podvýživu, 18,5–24,9 kg/m2 jako normální hmotnost, 25–29,9 kg/m2 jako nadváhu a ≥30 kg/m2 jako obezitu.
Z biochemických parametrů byly vyšetřeny: sérová hladina vápníku, aktivita alkalické fosfatázy (ALP), kalciurie (fU-Ca, norma 0,06 ± 0,03 mmol/kg/24 hod), sérová hladina 25-(OH)-vitaminu D (norma laboratoře 23–113 nmol/l) a 1,25-(OH)2-vitaminu D (norma laboratoře 43–150 pmol/l).
Z parametrů plicních funkcí jsme vybrali FEV1 v procentech náležité hodnoty. Spirometrická data byla získána při pravidelném přešetření pacientů metodou tělové pletyzmografie.
Kostní denzita
Pomocí DXA (dual-energy X-ray absorptiometry) byla vyšetřena denzita kostního minerálu (BMD) bederní páteře (L1–L4), anterioposteriorní projekce. Přístroj: multidetektorový přístroj s vějířovitým chodem paprsků (fan-beam) QDR 4500 nebo Delphi A, Hologic, Bedford, USA. Oba přístroje byly zkříženě kalibrovány, aby bylo možno údaje srovnávat. Koeficient variance byl do 1,5 %. Při měření se střídali 2 operátoři. Výsledek byl srovnán s referenčními daty, která byla součástí softwaru přístroje, a vyjádřen jako Z-skóre. Referenční data zahrnují populaci kavkazského původu z různých oblastí Evropy a Ameriky. Radiační riziko pro pacienty bylo podle údajů výrobce 0,05–0,2 mGy.
Orientační korekce výsledků podle hmotnosti a výšky: Podle růstových tabulek jsme zjistili, kterému věku odpovídá daná hmotnost nebo výška na 50. percentilu, pak jsme u této věkové skupiny provedli extrapolaci Z-skóre s ohledem na výšku či hmotnost (height - and weight-adjusted Z-score).
Statistické vyhodnocení
Metodami pro statistické vyhodnocení byly popisná statistika, t-test, lineární regrese, korelační analýza a analýza rozptylu za použití softwaru Microsoft Office Excel 2003.
Výsledky
Antropometrie
V době prvního vyšetření měli CF pacienti statisticky nižší výšku, hmotnost a BMI než referenční populace (tab. 1). Toto přetrvávalo i v následujících letech – nezměnilo se Z-skóre výšky, Z-skóre hmotnosti se nezměnilo mezi 1., 2. a 3. vyšetřením, kleslo mezi 3. a 4. vyšetřením, Z-skóre BMI se nezměnilo pouze mezi 2. a 3. vyšetřením, jinak klesalo. BMI dospělých pacientů (průměr 18,5 kg/m2) se neměnil signifikantně.
Tab. 1. Výsledky antropometrie, 1.vyšetření, pacienti < 18 roků věku. 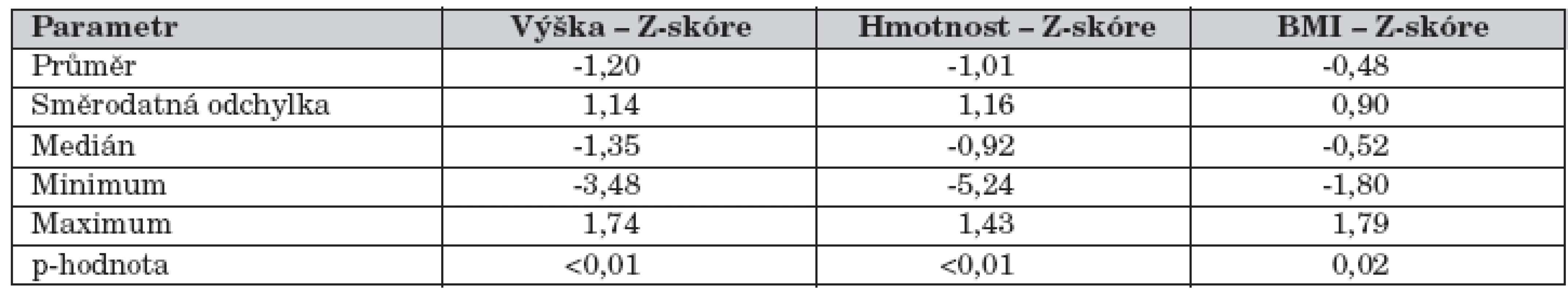
Vit. D – vitamin D Kostní denzita
Při všech vyšetřeních byla BMD nižší než u normální populace (p <0,001) – tab. 2, graf 1. Při orientační korekci podle výšky sice došlo k posunu do vyšších hodnot, nicméně nedošlo ke korekci do normy, pouze podle hmotnosti se korigovala do normy při 3. vyšetření. Při 1. vyšetření byly velmi nízké hodnoty Z-skóre BMD zjištěny i u pacientů <10 roků věku (18 pacientů – 40 % všech, průměr Z-skóre BMD -1,81, p <0,0001), 14 z nich (78 %) mělo Z-skóre BMD <-1. Mezi 1. a 2. vyšetřením došlo u pacientů <18 let věku k vysoce signifikantnímu vzestupu Z-skóre BMD (p = 6,6 x 10-7) – graf 2.
Tab. 2. Výsledky Z-skóre BMD obratlů L1–L4 při opakovaných vyšetřeních. 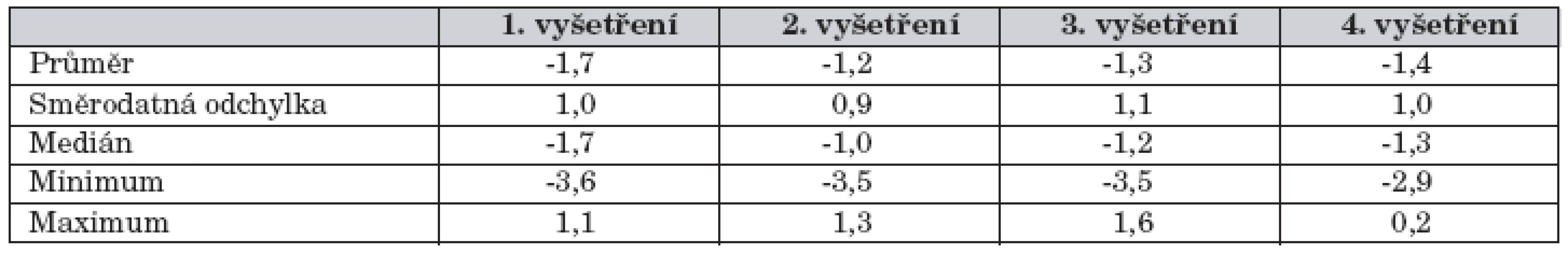
Graf 1. Zastoupení Z-skóre BMD obratlů L1–L4 při jednotlivých vyšetřeních. BMD – bone mineral density (denzita kostního minerálu) 
Graf 2. Změna Z-skóre BMD L1–L4 za rok mezi jednotlivými vyšetřeními. BMD – bone mineral density (denzita kostního minerálu) 
Zejména u pacientů <10 let věku došlo k výraznému zlepšení (průměrné Z-skóre BMD stouplo na -1,1), nicméně i u nich přetrvávala nízká BMD. Při dalších vyšetřeních došlo ke stabilizaci Z-skóre BMD. Zlepšilo se ještě u dětí <10 let věku mezi 3. a 4. vyšetřením (p = 0,012). Při čtvrtém vyšetření jsou ale k dispozici data pouze od 7 dětí <10 let věku (26 % celkového počtu pacientů). Z-skóre BMD nebylo závislé na FEV1, zaznamenali jsme pouze při 1. vyšetření signifikantní závislost Z-skóre BMD korigovaného podle hmotnosti na FEV1 (p = 0,017) a nekorigovaného Z-skóre BMD při 3. vyšetření (p = 0,012) na FEV1. Změna Z-skóre BMD nebyla závislá na změně Z-skóre antropometrických parametrů, s výjimkou BMI mezi 2. a 3. vyšetřením (p = 0,013). U pacientů >18 roků nebyly pozorovány v daném období signifikantní změny BMD.
Hladiny vitaminu D
Střední hodnota hladiny 25-(OH)-vit. D se při 2., 3. a 4. vyšetření pohybovala mírně pod doporučenou hladinou pro CF, i když v rámci normy. Bylo provedeno celkem 54 vyšetření, průměr hodnot 64,8, směrodatná odchylka 40,0, medián 57,4, minimum 17,5, maximum 249,9 nmol/l. Statisticky významně se hladiny při opakovaných vyšetřeních vzájemně nelišily. 70 % hodnot hladiny 25-(OH)-vit. D bylo pod 75 nmol/l, pouze 1 byla nad 150 nmol/l. Pod normou laboratoře (25 nmol/l) byly pouze 2 hodnoty (4 %), nad ní (113 nmol/l) 6 hodnot (12 %).
Průměrná hladina 1,25-(OH)2-vit. D se pohybovala v normálních hodnotách. Sérové hladiny 1,25-(OH)2-vit. D při 1., 2., 3. a 4. vyšetření se statisticky významně vzájemně nelišily. Bylo provedeno celkem 88 vyšetření, průměr hodnot 75,1, medián 64,8, směrodatná odchylka 37,6, minimum 20,2, maximum 194,2 pmol/l. Pod normou laboratoře (43 pmol/l) bylo 17 hodnot (19 %), nad ní (150 pmol/l) 4 hodnoty (4,5 %). Byla patrná tendence k mírnému vzestupu hladin 1,25-(OH)2-vit. D v průběhu sledování.
Kalciurie
Celkově byla kalciurie vyšší než referenční hodnoty (Z-skóre bylo lehce nad nulovou hodnotou), nicméně průměr se pohyboval v rozmezí normálu. V průběhu let došlo k poklesu kalciurie u naší skupiny pacientů (graf 3). Bylo provedeno celkem 217 vyšetření, průměr hodnot 0,069, směrodatná odchylka 0,046, medián 0,062, minimum 0,002, maximum 0,315 mmol/kg/24 hod. Nad 0,12 mmol/kg/24 hod bylo 25 hodnot z 217 vyšetřených za celou dobu sledování (11,4 %).
Graf 3. Kalciurie – chronologické srovnání výsledků všech vyšetření mezi jednotlivými lety. 
FEV1 – neměnila se signifikantně mezi vyšetřeními: průměr (směrodat. odchylka) 71 (25) ‡ 76 (23) ‡ 78 (23) ‡ 79 (17) % náležité hodnoty.
Hladina Ca v séru se nezměnila mezi 1. a 2. a 2. a 3. vyšetřením, klesla mezi 3. a 4. vyšetřením, stále v normálním rozmezí hodnot (průměr při 1. vyšetření 2,42 mmol/l, SD 0,12, při 4. vyšetření 2,25 mmol/l, SD 0,16).
Sérová aktivita ALP se nelišila mezi jednotlivými vyšetřeními a pohybovala se v normálním rozmezí (průměr při 1. vyšetření 3,61 µkat/l, SD 1,82).
Suplementace vitaminem D a vápníkem
Mezi 1. a 2. vyšetřením byla zvýšena suplementace vit. D a Ca prakticky všem pacientům. Před 1. vyšetřením měla suplementaci Ca jen jedna pacientka s již dříve zjištěnou nízkou BMD. Suplementace vit. D se dále již v souboru jako celku nenavyšovala. Suplementace Ca se ještě mírně navýšila mezi 3. a 4. vyšetřením (p = 0,028), tab. 3.
Tab. 3. Vývoj suplementace vitaminu D (ergokalciferol) a vápníku. 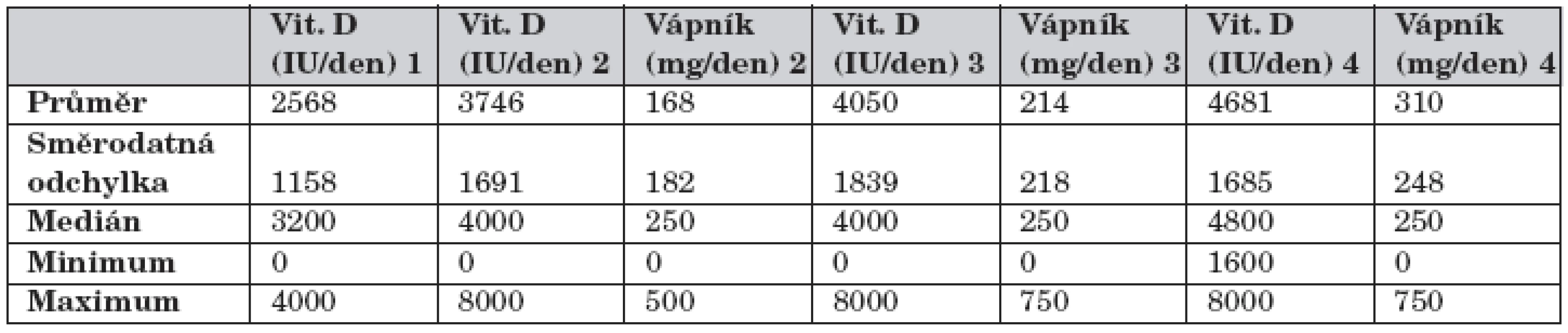
Vit. D – vitamin D Diskuse
U pacientů s CF bývá hodnoceno jako kritické pro denzitu kostního minerálu období puberty s nedostatečným přibýváním kostního minerálu. Oproti tomuto názoru i jiným studiím jsme zde zjistili deficit BMD v oblasti lumbální páteře již u nejmladších věkových skupin, a to i po korekci k rozměrům těla. Literární zdroje přinášejí různorodé informace – některé ze studií zjistily u dětí normální denzitu kostního minerálu, ale sníženou po 9. roce věku [10], u adolescentů [11] či v dospělém věku [7]. Ke stejnému výsledku jako v naší studii, co se týče nízké BMD lumbálních obratlů již u nejmladších CF pacientů, došli i v recentní průřezové studii Sermet-Gaudelus et al. [12]. Oproti mezinárodnímu standardu [3] nebo ECFS konsenzu [13] to znamená, že je třeba na skeletální postižení myslet již u dětí s CF mladších než 6–8 roků a podniknout včas preventivní opatření. Mezinárodní konsenzus doporučuje screeningové vyšetření DXA u všech dospělých a dětí >8 let, pokud mají <90 % ideální tělesné hmotnosti, FEV1 <50 % předpovězeného, celkově podávané glukokortikoidy ≥5 mg/den po ≥90 dní/rok, opožděnou pubertu nebo prodělali zlomeniny [3]. ECFS konsenzus doporučuje DXA vyšetření nejdříve u 6letých CF pacientů [13].
V současnosti je přes poměrně velké množství průřezových (cca více než 60 publikací) stále poměrně málo longitudinálních studií BMD u CF pacientů. Některé studie zjistily vysloveně snížené přibývání kostní hmoty [14, 15, 16], rychlý pokles v dospělosti [17], jiné normální přibývání kostní hmoty [18]. BMD vzrůstá se zvětšováním rozměrů těla. Při DXA vyšetření získáváme v podstatě pouze nedokonalou, plošnou sumaci. Z-skóre antropometrických parametrů našich pacientů bylo nižší než u normální populace stejného věku. To znamená, že byli menší a štíhlejší než jejich vrstevníci. Postupný pokles Z-skóre BMI v průběhu let znamená, že nepřibývali dostatečně na hmotnosti ve srovnání s vrstevníky. V naší skupině pacientů byl vzestup BMD L1–L4 mezi 1. a 2. vyšetřením vyšší než očekávaný vzhledem k růstu, protože se zvýšilo Z-skóre BMD a jeho změna nebyla závislá na změně Z-skóre antropometrických parametrů. I u těch pacientů, kteří nevyrostli podle svého původního percentilu výšky nebo nepřibyli dostatečně na hmotnosti, došlo ke zlepšení BMD. V dalších letech došlo ke stabilizaci Z-skóre BMD, s přetrváváním pozitivního efektu intervence. Mineralizace skeletu tak v dalších letech postupovala podle očekávání vzhledem k věku. I tak ale přetrvává celkově nižší BMD lumbální páteře u těchto CF pacientů, za kterou jsou pravděpodobně zodpovědné jiné příčiny.
I přes relativně vysoké dávky vitaminu D nebyli pacienti jako skupina předávkováni. Vzhledem k tomu, že hladiny 25-(OH)-vit. D byly většinou nižší, než je doporučováno mezinárodním konsenzem, byl zde stále ještě prostor pro možné zvýšení dávek. Sérová hladina 25-(OH)-vit. D nemusí však reflektovat podanou dávku ergokalciferolu. Na tom se může podílet porucha hydroxylace při možném jaterním postižení. Pacienti měli normální sérovou aktivitu ALP, což spolu s negativními klinickými známkami svědčí proti křivici. Pacienti nebyli při pravidelném sledování ohroženi hyperkalciurií. Také při pravidelných UZ kontrolách nebyly u nich patrné známky nefrokalcinózy nebo urolitiázy.
Pokles kalciurie v průběhu let lze při zvýšené suplementaci vitaminem D a vápníkem přičíst pravděpodobně vyšší retenci kalcia v organismu. Pro tuto možnost svědčí i počáteční vzestup Z-skóre BMD a jeho následná stabilizace.
Celkově lze říci, že jsme dosáhli vytyčeného cíle – zlepšilo se zásobení těchto pacientů vitaminem D a vápníkem, zlepšila se mineralizace jejich skeletu a uchoval se počáteční příznivý efekt.
Otázkou je rozdílné postižení jednotlivých částí skeletu. Je možné, že zatímco celotělová denzita kostního minerálu může zůstat relativně zachována, lumbální obratle by mohly být postiženy závažněji. Obsahují značný podíl trabekulární kosti, která rychleji reaguje na působení negativních vlivů (na rozdíl od kosti kortikální). Rozluštění by mohlo přinést vyšetření týchž pacientů DXA oběma způsoby – jak celotělový sken, tak pouze oblast lumbálních obratlů. To by mohlo být provedeno v dalším sledování, prozatím jsme se řídili zvyklostmi pracoviště, co se týče místa měření BMD. Conway et al. nalezli nejvýraznější redukci BMD právě v oblasti lumbálních obratlů [19]. Sood et al. nalezli normální celotělovou BMD, avšak rozporné výsledky v oblasti lumbálních obratlů s nízkou BMAD (bone mineral apparent density) při vyšetření DXA, ale relativně vysokou denzitou trabecularis zjištěnou za pomoci CT [20]. Aris et al. nalezli u skupiny 70 dospělých pacientů s CF a relativně pokročilým onemocněním redukci jak celotělové BMD, tak i BMD lumbálních obratlů [21]. Na stavu těchto pacientů se ale jistě podílela pokračující deteriorace stavu. Další možností je také použití QCT (kvantitativní výpočetní tomografie), která nám určí skutečnou volumetrickou kostní denzitu. QCT použili u dětí i dospělých s CF Gibbens et al. [22] a Haworth et al. [14, 23] a zjistili nízkou denzitu obratlů a snížený přírůstek BMD [14]. U německých pacientů s CF první autorka tohoto článku zjistila normální denzitu trabekulární kosti v oblasti předloktí a normální plochu průřezu kortikální kosti v poměru k průřezu svalu v oblasti předloktí. Plocha průřezu svalovinou byla u těchto pacientů malá vzhledem k věku i výšce [24].
Nízká BMD může vést ke zvýšené incidenci zlomenin periferního i axiálního skeletu, jak zjistili v rozsáhlé a hojně citované studii u CF pacientů např. Aris et al. [21]. Zajímavý paradox však přinesla novější studie Anne Stephenson et al. [25], dospělí CF pacienti s detekovanými zlomeninami obratlů měli v této studii signifikantně vyšší BMD než pacienti bez zlomenin, obě dvě skupiny byly také ve velmi dobrém výživovém stavu. To přináší otázku, zda je vhodné extrapolovat kritéria používaná u postmenopauzálních žen na CF pacienty výrazně mladších věkových skupin a také problém „kvantita versus kvalita“ kosti.
Některé údaje jsme zatím nezjišťovali, což je určitý nedostatek – sérovou hladinu parathormonu a markery kostní resorpce a formace. Plánujeme tak učinit v dalším sledování. Tyto ukazatele by nám přinesly podrobnější informaci o metabolických pochodech probíhajících ve skeletu pacientů. Potencionálně zajímavé by mohly být také ukazatele: příjem vápníku v potravě, pubertální stadium a kostní věk. Kostní věk se v současné době u těchto pacientů již vyšetřuje. Chybí také počáteční hladiny 25-(OH)-vit. D, zpětně je již nelze vyšetřit. Tato analýza byla orientována prakticky, s cílem zajistit individuální potřebu pacientů s vynaložením co nejnižších nákladů a s co nejnižší zátěží odběry a vyšetřeními. Je také možné, že by tyto chybějící údaje nebyly již výrazně přínosné k dosažení vytyčených cílů – např. v mezinárodně oceněné studii autorů Benden et al. [26] nebyla sérová hladina parathormonu prediktorem BMD a hladiny 25-(OH)-vit. D měli jejich CF pacienti v normě. Také ve studii autorů Sermet-Gaudelus et al. [12] nepřinesly hladiny parathormonu a osteokalcinu novou informaci a v longitudinální studii Schulze et al. hladiny parathormonu, osteokalcinu a 25-(OH)-vit. D nebyly prediktory přibývání kostního minerálu [15].
Otázkou zůstává compliance pacientů, která se obecně často zhoršuje u chronicky nemocných dětí v pubertě a adolescenci.
Závěry
- Nízká BMD může být přítomna již u nejmladších pacientů s CF.
- Měření kalciurie je přínosná, neinvazivní a levná metoda k monitoringu suplementace vitaminu D a vápníku.
- Úpravou suplementace vitaminu D a Ca na základě monitorace kalciurie lze u CF pacientů dosáhnout zlepšení denzity kostního minerálu v oblasti lumbálních obratlů a jejího normálního přibývání.
- Lze doporučit kontrolu sérové hladiny 25-(OH)--vitaminu D 1krát ročně.
Zkratky
25-(OH)-vit. D – 25-hydroxyvitamin D
1,25-(OH)2-vit. D – 1,25-dihydroxyvitamin D
ALP – alkalická fosfatáza
BMAD – bone mineral apparent density (zdánlivá denzita kostního minerálu, matematický převod plošné na hypotetickou volumetrickou kostní denzitu)
BMD – bone mineral density (denzita kostního minerálu)
Ca – vápník
CF – cystická fibróza
CFTR – cystic fibrosis transmembrane conductance regulator (transmembránový regulátor vodivosti)
DXA – dual-energy X-ray absorptiometry (dvouenergiová absorpciometrie)
ECFS – European Cystic Fibrosis Society
FEV1 – one-second forced expiratory volume (kapacita jednosekundového usilovného výdechu)
fU-Ca – kalciurie
pQCT – peripheral quantitative computed tomography (periferní kvantitativní výpočetní tomografie)
QCT – quantitative computed tomography (kvantitativní výpočetní tomografie)
SD – standard deviation (směrodatná odchylka)
vit. D – vitamin D
Z-skóre – srovnání pacientových dat s referenčními podle věku a pohlaví
Z-skóre = [hodnota u pacienta – průměrná hodnota]/SD
Došlo: 23. 7. 2008
Přijato: 5. 8. 2008
Věnováno k významnému životnímu jubileu doc. MUDr. Věry Vávrové, DrSc.
MUDr. Erika Ondrušová, Ph.D.
Dětská klinika LF a FN
Fakultní nemocnice
Sokolská 581
500 05 Hradec Králové
e-mail: erika.ocenaskova@seznam.cz
Zdroje
1. Hahn TJ, Squires AE, Halstead LR, et al. Reduced serum 25-hydroxyvitamin D concentration and disordered mineral metabolism in patients with cystic fibrosis. J. Pediatr. 1979;94(1): 38–42.
2. Očenášková E, Vaníček H. Kostní postižení u cystické fibrózy. Osteologický Bulletin 2006;11(4):104–110.
3. Aris RM, Merkel PA, Bachrach LK, et al. Consensus Conference Report: Guide to bone health and disease in cystic fibrosis. J. Clin. Endocrinol. Metab. 2005;90 : 1888–1896.
4. Elkin SL, Fairney A, Burnett S, et al. Vertebral deformities and low bone mineral density in adults with cystic fibrosis: a cross-sectional study. Osteoporos. Int. 2001;12 : 366–372.
5. Chavasse RJ, Francis J, Balfour-Lynn I, et al. Serum vitamin D levels in children with cystic fibrosis. Pediatr. Pulmonol. 2004;38 : 119–122.
6. Boyle MP, Noschese ML, Watts SL, et al. Failure of high-dose ergocalciferol to correct vitamin D deficiency in adults with cystic fibrosis. Am. J. Respir. Crit. Care Med. 2005;172 : 212–217.
7. Buntain HM, Greer RM, Schluter PJ, et al. Bone mineral density in Australian children, adolescents and adults with cystic fibrosis: a controlled cross sectional study. Thorax 2004;59 : 149–155.
8. Boyle MP, Noschese ML, Watts SL, et al. Prevalence of 25-hydroxyvitamin D deficiency in adults with CF and effect of high dose ergocalciferol supplementation. Ped. Pulmonol. 2003;25: S350.
9. Lesný P, Krásničanová H. Kompendium pediatrické auxologie 2005.
10. Fok J, Brown NE, Zuberbuhler P, et al. Low bone mineral density in cystic fibrosis patients. Can. J. Diet. Pract. Res. 2002;63 : 192–197.
11. Ujhelyi R, Treszl A, Vasarhelyi B, et al. Bone mineral density and bone acquisition in children and young adults with cystic fibrosis: a follow-up study. J. Pediatr. Gastroenterol. Nutr. 2004;38 : 401–406.
12. Sermet-Gaudelus I, Souberbielle JC, Ruiz JC, et al. Low bone mineral density in young children with cystic fibrosis. Am. J. Respir. Crit. Care Med. 2007;175 : 951–957.
13. Kerem E, Conway S, Elborn S, et al. Standards of care for patients with cystic fibrosis: a European consensus. J. Cyst. Fibros. 2005;4:.7–26.
14. Haworth CS, Selby PL, Horrocks AW, et al. A prospective study of change in bone mineral density over one year in adults with cystic fibrosis. Thorax 2002;57 : 719–723.
15. Schulze KJ, Cutchins C, Rosenstein BJ, et al. Calcium acquisition rates do not support age-appropriate gains in total body bone mineral content in prepuberty and late puberty in girls with cystic fibrosis. Osteoporos. Int. 2006;17 : 731–740.
16. Buntain HM, Schluter PJ, Bell SC, et al. Controlled longitudinal study of bone mass accrual in children and adolescents with cystic fibrosis. Thorax 2006;6 : 146–154.
17. Giron RM, Sanchez Molini P, Garcia Vadillo A, et al. Efectividad en la aplicación de tres protocolos de prevención y tratamiento de la osteoporosis en pacientes adultos con fibrosis quística. [Protocol for prevention and treatment of osteoporosis in patients with cystic fibrosis]. Med. Clin. (Barc). 2005;125 : 325–328.
18. Gronowitz E, Garemo M, Lindblad A, et al. Decreased bone mineral density in normal-growing patients with cystic fibrosis. Acta Paediatr. 2003;92 : 688–693.
19. Conway SP, Morton AM, Oldroyd B, et al. Osteoporosis and osteopenia in adults and adolescents with cystic fibrosis: prevalence and associated factors. Thorax 2000;55 : 798–804.
20. Sood M, Hambleton G, Super M, et al. Bone status in cystic fibrosis. Arch. Dis. Child. 2001;84 : 516–520.
21. Aris RM, Renner JB, Winders AD, et al. Increased rate of fractures and severe kyphosis: sequelae of living into adulthood with cystic fibrosis. Ann. Intern. Med. 1998;128 : 186–193.
22. Gibbens DT, Gilsanz V, Boechat MI, et al. Osteoporosis in cystic fibrosis. J. Pediatr. 1988;113 : 295–300.
23. Haworth CS, Selby PL, Webb AK, et al. Low bone mineral density in adults with cystic fibrosis. Thorax 1999;54 : 961–967.
24. Očenášková E, Liebhardt K, Stern M, et al. The muscle-bone relationship in cystic fibrosis patients. Čes.-slov. Pediat. 2007;62 : 204–212.
25. Stephenson A, Jamal S, Dowdell T, et al. Prevalence of vertebral fractures in adults with cystic fibrosis and their relationship to bone mineral density. Chest 2006;130 : 539–544.
26. Benden C, Jaffe A, Williams JE, et al. Bone mineralisation and turnover in 8 to 12 year-old children with cystic fibrosis. J. Cyst. Fibros. 2005;4: S84.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článek Oznámení
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2008 Číslo 12- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Gastroezofageální reflux a gastroezofageální refluxní onemocnění u kojenců a batolat
-
Všetky články tohto čísla
- Výsledky léčby neonatální hydronefrózy
- Denzita kostního minerálu u pacientů s cystickou fibrózou – výsledky 3letého sledování a intervence
- Výskyt a rizikové faktory alergických ochorení u detí predškolského veku v priemyselnom a vidieckom regióne Slovenska
- Klinické projevy a výsledky laboratorních vyšetření u čtyř pacientů s alfa-manosidózou
- Oznámení
- Problematika HIV/AIDS v pediatrii
- Správné odpovědi na kontrolní otázky k doškolovacímu článku Jeseňák M., Havlíčeková Z., Buchanec J. a kol.: Diagnostický algoritmus potravinovej alergie v detskom veku (č. 5/2008)
- Seznam čtenářů se správnou odpovědí na kontrolní otázky k doškolovacímu článku z č. 5/2008 Jeseňák M., Havlíčeková Z., Buchanec J. a kol.: Diagnostický algoritmus potravinovej alergie v detskom veku
- Správné odpovědi na kontrolní otázky k doškolovacímu článku Podracká Ľ., Kovács L.: Vyšetrovací postup u dieťaťa s proteinúriou (č. 6/2008)
- Seznam čtenářů se správnou odpovědí na kontrolní otázky k doškolovacímu článku z č. 6/2008 Podracká Ľ., Kovács L.: Vyšetrovací postup u dieťaťa s proteinúriou
- Anti-TNF léčba juvenilní idiopatické artritidy
- Stoleté jubileum paní profesorky MUDr. Jiřiny Čížkové-Písařovicové, DrSc.
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Výsledky léčby neonatální hydronefrózy
- Klinické projevy a výsledky laboratorních vyšetření u čtyř pacientů s alfa-manosidózou
- Problematika HIV/AIDS v pediatrii
- Výskyt a rizikové faktory alergických ochorení u detí predškolského veku v priemyselnom a vidieckom regióne Slovenska
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



