-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Artériová mozgová príhoda v detskom veku
Arterial cerebral event in childhood
Arterial cerebral strokes are rare, however occassionally very urgent conditions in children´s age. The true incidence likely remains underdiagnosed. Advance in diagnostic evaluation have increasingly recognised disorders in children. Their risk factors, outcomes, and even presentation are different from adult events. Cerebral vessel arteriopathies, that are non-atherosclerotic (traumatic, inflammatory, idiopathic) and the prothrombotic abnormalities (congenital and acquired, especially in neonates) seem to play an important role in the pathogenesis of childhood cerebral arterial events.
This article demonstrates current review of epidemiology, etiology, clinical picture, diagnostic approaches, management and long-term consequences of these disorders in pediatric patients. Caring for pediatric patients with AMP requires close cooperation of several experts. Antithrombotic therapy must be completed by timely and professionally-led rehabilitation, as well as special approach of social reintegration of pediatric patients.Key words:
arterial cerebral events, children, arteriopathies
Autori: M. Grešíková
Pôsobisko autorov: Klinika detskej hematológie a onkológie, Detská fakultná nemocnica s poliklinikou, Bratislava, prednosta doc. MUDr. E. Kaiserová, CSc.
Vyšlo v časopise: Čes-slov Pediat 2011; 66 (4): 226-234.
Kategória: Postgraduální vzdělávání
Súhrn
Artériové mozgové príhody sú vzácne, niekedy veľmi naliehavé stavy u detí. Pravá incidencia je pravdepodobne poddiagnostikovaná. Pokroky v diagnostickom hodnotení prispievajú k ich zvýšenému spoznávaniu. Rizikové faktory, následky a dokonca prejavy sú odlišné od príhod u dospelých. Zdá sa, že v patogenéze detských mozgových artériových príhod hrajú dôležitú úlohu artériopatie mozgových ciev, ktoré nie sú aterosklerotické (traumatické, zápalové, idiopatické) a protrombotické abnormality (vrodené aj získané, najmä u novorodencov).
Tento článok poskytuje aktuálny pohľad na epidemiológiu, etiológiu, klinický obraz, diagnostický a liečebný prístup, aj dlhodobé následky týchto stavov u detských pacientov. Starostlivosť o detských pacientov s artériovou mozgovou príhodou vyžaduje úzku medziodborovú spoluprácu. Antitrombotickú liečbu musí dopĺňať včasná a odborne vedená rehabilitácia, aj špeciálne prístupy resocializácie detských pacientov.Kľúčové slová:
artériové mozgové príhody, deti, artériopatieÚVOD
Artériové mozgové príhody (AMP) u detí sú vzácne, avšak pokrok a dostupnosť najmä zobrazovacích vyšetrení v posledných rokoch prispeli k ich zvýšenému spoznávaniu. Definícia Svetovej zdravotníckej organizácie charakterizuje AMP ako klinický syndróm rýchlo sa rozvíjajúcej mozgovej dysfunkcie z cievnej príčiny, alebo bez nej, s prejavmi ložiskovej, alebo celkovej poruchy organizmu, ktorá pretrváva viac ako 24 hodín, alebo vedie k smrti [1]. Jej patologickým podkladom je ischémia, alebo infarkt mozgového tkaniva rôzneho rozsahu, s lokalizáciou, ktorá odpovedá cievnemu zásobeniu postihnutej mozgovej artérie.
Táto definícia, používaná u dospelých pacientov, nevyhovuje stavom v detskom veku. AMP u detí predstavujú nielen naliehavé, život ohrozujúce situácie s dramatickým klinickým priebehom, ale aj frustné, alebo prechodné neurologické poruchy. Napríklad deti s klinickými prejavmi odpovedajúcimi prechodnému ischemickému záchvatu (transient ischemic attack – TIA) majú krátkodobú neurologickú symptomatológiu, ale pri zobrazovacom vyšetrení sa obyčajne potvrdí infarkt, prípadne ischémia v mozgovom tkanive [2]. Epizódy s klinickým priebehom podobným AMP môžu sprevádzať migrénu, alebo metabolickú chorobu, nemajú dokázanú cievnu príčinu a vyžadujú špecifickú liečbu. Rozmanitosť v klinickom prejave sa odráža aj v nejednotnej terminológii. Synonymné označenie je pestré (príhoda, infarkt, iktus, mŕtvica, inzult, záchvat) a zatiaľ nejednotné (anglosaská terminológia používa označenie stroke) [3]. V tomto článku je uprednostnený termín artériová mozgová príhoda.
EPIDEMIOLÓGIA
Je málo reprezentatívnych štúdií u detí, ktoré poskytujú objektívne údaje o incidencii AMP v detskom veku. Štatistické údaje registrov rôznych štátov sa líšia: v roku 2002 v USA sa uvádzala incidencia asi 18 AMP/100 000 novorodencov/ 1 rok [3], v roku 2011 stúpla na 93 AMP/100 000 novorodencov/1 rok [4].
V ďalšom detskom veku je výskyt 3–10 ráz nižší, pohybuje sa okolo 2–13 AMP/100 000 detí/1 rok [5]. V rannom veku mierne prevažujú chlapci. Až 65 % prežívajúcich pacientov má nejakú formu chronickej neurologickej poruchy. Napriek liečbe mortalita predstavuje viac ako 10 % [6].
ROZDELENIE AMP V DETSKOM VEKU
Pre rôznu etiológiu, klinický prejav aj liečebný prístup je vhodné rozlišovať novorodenecké a detské AMP [3]. Novorodenecké príhody sa vyskytujú v prvých 28 dňoch života.
Rozdielne klinické prejavy u novorodencov odlišujú prenatálne, perinatálne a postnatálne situácie. Prenatálna AMP je dôsledkom ischémie mozgového tkaniva pri lézii dokumentovanej od 28. gestačného týždňa (niektorí autori uvádzajú už 20. gestačný týždeň). Ak artériový ischemický inzult vznikne počas pôrodu, alebo v prvých siedmich dňoch života, môže viesť k perinatálnej AMP. Postnatálne AMP sú mozgové inzulty od 8. do 28. dňa života, detské AMP sa odohrávajú od novorodeneckého obdobia do adolescencie [7].
PATOGENÉZA
Typické rizikové faktory mozgovej ischemickej príhody u dospelých – ako sú ateroskleróza, hypertenzia, diabetes mellitus, dyslipoproteinémia, obezita, fajčenie – sa môžu uplatniť len u adolescentov [1]. Príčiny AMP u detí, ale najmä u novorodencov sú odlišné. Prebiehajú na podklade troch mechanizmov: buď ide o poškodenie cievneho endotelu artérie (mozgové artériopatie), alebo dôjde k narušeniu prietoku krvi cez artériu, napríklad jej stlačením, stenózou alebo cievnym spazmom (v oboch prípadoch ide o trombózu in situ), alebo ide o kardioembolickú príhodu [5].
Pri poškodení endotelu artérie dochádza k aktivácii trombocytov ich kontaktom s poškodenou cievnou stenou. Za spoluúčasti plazmatických bielkovín (najmä von Willebrandovho faktora a fibrinogénu) aktivované trombocyty adherujú na obnažený subendotel a agregáciou vytvárajú „biely trombus“, v zhluku ktorého sú aj leukocyty. Spomalenie krvného prietoku a uvoľnenie tkanivového faktora v mieste poškodenia mozgovej artérie môžu alterovať sekundárnu hemostázu. Výsledkom môže byť formácia „červeného trombu“, súčasťou ktorého sú aj erytrocyty. Trombus čiastočne, alebo úplne obliteruje poškodenú mozgovú artériu, alebo je uvoľnený a zanesený krvným prúdom do vzdialenejšej mozgovej artérie, ktorú embolicky uzatvorí. Výsledkom je mozgová artériová príhoda, s ischémiou, alebo infarktom v rozsahu prerušeného cievneho zásobenia.
Ruptúra artériovej steny vedie k hemoragickej príhode s deštrukciou mozgového tkaniva. Je často sprevádzaná vážnou poruchou vedomia, vyžaduje neodkladnú diagnostiku a neraz rýchlu neurochirurgickú intervenciu [1, 8].
ETIOLÓGIA
Etiológia artériových a venóznych cievnych príhod sa často prekrýva, typ postihnutej cievy obyčajne objasní najmä zobrazovacie vyšetrenie. Zmenšuje sa počet idiopatických epizód (<15 %), až 75 % detských pacientov má objasnenú príčinu [1, 5]. Asi u polovice postihnutých je prítomný už preexistujúci rizikový stav, u ďalšej štvrtiny pacientov je odhalený vrodený, alebo získaný rizikový faktor (tab. 1).
Tab. 1. Etiológia artériovej mozgovej príhody v detskom veku. 
Legenda: AMP – artériová mozgová príhoda Synergicky pôsobia hyperkoagulačné situácie pri akútnych, alebo chronických ochoreniach so systémovou infekciou, alebo dehydratáciou [5, 9, 10].
NAJČASTEJŠIE STAVY A OCHORENIA S RIZIKOM AMP U DETÍ
AMP v dôsledku poškodenia cievnej steny možno očakávať pri úraze hlavy a krku. Disekujúce artériopatie kraniálnych, karotických a vertebrogénnych artérií tvoria asi 7 % okluzívnych, alebo hemoragických AMP [5, 16].
Akútne neuroinfekcie (bakteriálne, vírusové, plesňové a iné) u imunokomprimovaných jedincov aj perakútne infekcie stredoušia, či angíny (častejšie riziká venóznych trombóz) môžu ojedinele komplikovať artériové mozgové ikty. V patomechanizme dominuje poškodenie cievneho endotelu mozgovej artérie toxínmi a aktivácia hemostázy s protrombotickým potenciálom a znížením prirodzených inhibítorov (antitrombínu, proteínu C a proteínu S). Z častých detských infekcií s vyšším rizikom výskytu AMP je varicella. Zobrazovacie vyšetrenia potvrdia trombózu obyčajne v oblasti arteria carotis interna, arteria cerebri media alebo arteria cerebri anterior. Infarkt je unilaterálny, najčastejšie v oblasti bazálnych ganglií. V patomechanizme sa uplatní synergizmus parainfekčnej artériopatie a zníženie proteínu S a proteínu C. Deficit prirodzených inhibítorov pretrváva aj rok po akútnej fáze infekcie a u vnímavých jedincov trojnásobne zvyšuje riziko vzniku AMP [3, 17].
Asi u 25 % detí môže nastať oklúzia mozgových artérií tvarovo deformovanými erytrocytmi s patologickým hemoglobínom HbS [20, 21], alebo stenotická deformácia mozgovej artérie po opakovanej traumatizácii cievnej steny, s následnou mozgovou ischémiou. Opísané zmeny sú typické pre AMP pri kosáčikovitej anémii (sickle cell disease – SCD), najmä u detí čiernej rasy.
V japonskej populácii sa zvýšene vyskytujú steno-trombotizujúce AMP pri včasnom moyamoya syndróme (s obojstrannou stenózou terminálnej časti arteria carotis interna (ICA), s vytvorením tenkých kolaterálnych artérií, ktoré na klasickom angiograme vytvárajú obraz „puff of smoke“ – „obláčika dymu pri fajčení“) [3, 21]. Cievne anomálie majú heterogénny pôvod (geneticky podmienené, sekundárne vaskulopatie pri ochoreniach spojiva, infekčné) a môžu, aj nemusia progredovať. AMP môžu prebiehať ako tiché epizódy (TAI), s ischémiou mozgového tkaniva pri jeho chronickej nedokrvenosti, alebo klinicky manifestne, pri infarkte mozgovej artérie v dôsledku trombotickej oklúzie. Rekurencia je častá [5].
Vzácnou príčinou AMP sú artériopatie v dôsledku vrodených porúch spojivového tkaniva (napr. kolagénopatie – typ III, Ehlersov-Danlosov a Marfanov syndróm, fibromuskulárna dysplázia) [1, 4].
AMP na podklade embolickej oklúzie sú neželanou komplikáciou niektorých vrodených srdcových chýb, najmä nekorigovaných, s ľavo-pravým skratom [11]. Pri kryptogénnom ikte sa až u 40 % pacientov odhalí foramen ovale patens, s embolickým uvoľnením venózneho trombu paradoxnou cestou cez pravo-ľavý skrat [11–14]. Kardioembolické tromby môžu byť aj septického pôvodu pri infekčnej endokarditíde, neoplastické pri myxóme srdca, alebo iatrogénne pri kardiochirurgických operáciách a katetrizácii [15].
AMP sa vzácne vyskytnú aj u jedincov s významnou vrodenou trombofilnou dispozíciou. Demaskovanie vrodenej trombofílie predpokladá aktiváciu hemostázy iným získaným činiteľom, neraz s trombotickým rizikom (napr. infektom, zápalom, úrazom, operáciou). Z vrodených trombofilných stavov sa najčastejšie uplatní deficit prirodzených inhibítorov hemostázy (antitrombínu, proteínu C, proteínu S), alebo mutácia koagulačného faktora FV Leiden (G1691A) a mutácia protrombínu FII (G20210A) [18]. Najväčšie riziko majú homozygotní jedinci, v populácii sa však vyskytujú vzácne. Zo získaných trombofilných stavov prispievajú k dočasnému riziku AMP antifosfolipidové protilátky, najmä po infekciách (tzv. „antifosfolipidové-like“ protilátky), alebo pri systémových, reumatologických, autoimunitných ochoreniach [19]. Vaskulopatia a následná AMP môže ohroziť detského pacienta s hyperhomocysteinémiou (pri metabolických ochoreniach s mutáciou cystation-β-syntetázy, u homozygotov s mutáciou metyléntetrahydrofolátreduktázy (MTHFR-C6779T), alebo zvýšenou hladinou lipoproteínu (a), či dyslipoproteinémiou [18]. Pacienti sú obyčajne v období puberty a adolescencie, lebo poškodenie cievnej steny je výsledkom dlhodobejšieho pôsobenia noxy na endotel artériovej steny. Pre túto vekovú skupinu pacientov je treba akceptovať aj riziká AMP, vyplývajúce zo vzniku prechodných hyperkoagulačných stavov, navodených životným štýlom, podobným dospelým, ako je užívanie hormonálnej antikoncepcie, obezita, fajčenie, abúzus drog (najmä metamfetaminu a kokainu) [1, 3].
V novorodeneckom období sú najčastejším rizikovým faktorom AMP vrodené trombofilné poruchy [22], alebo ide o kardioembolické príhody (pri vrodených srdcových chybách) [11]. Príčinou prenatálnych a perinatálnych AMP môžu byť rizikové situácie, súvisiace s vývojom plodu a pôrodom, alebo z chorobných stavov u matky v gravidite (tzv. maternálne rizikové faktory) (tab. 2). Aj vertikálny transplacentárny prenos antifosfolipidových protilátok triedy IgG, alebo protrombotických molekúl môže za určitých podmienok privodiť AMP u plodu, či novorodenca [19, 23]. Približne 80 % novorodeneckých cievnych mozgových príhod sú ischemické AMP, ostatné sú buď hemoragické artériové ikty, alebo cerebrálne sinovenózne trombózy [1].
Tab. 2. Príčiny prenatálnych a perinatálnych artériových mozgových príhod u novorodencov. 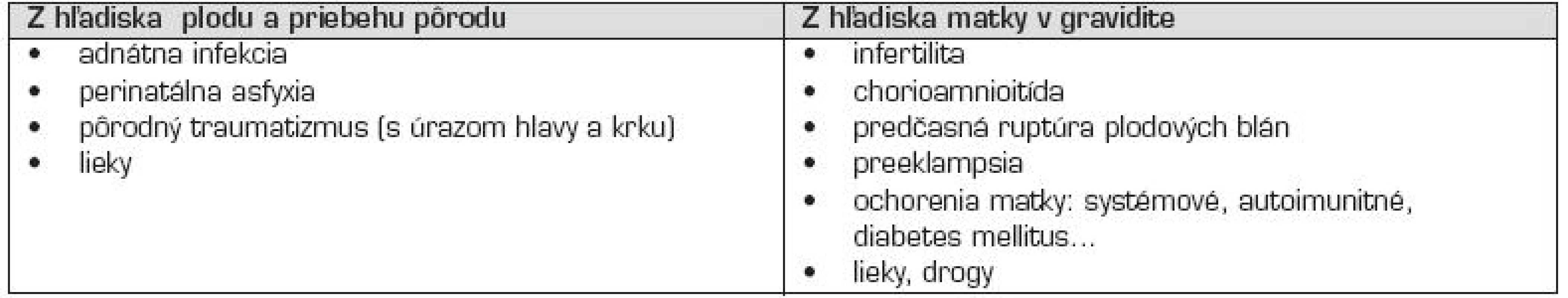
Hemoragické AMP u detí sú zriedkavé (tab. 3). Krvácanie môže byť minimálne, intraparenchymatórne v ischemickom ložisku, alebo je život ohrozujúce, zasahujúce mozgový parenchým, príp. subarachnoidálne priestory, alebo mozgový komorový systém. Porucha cievnej steny mozgových artérií môže byť súčasťou arteriovenóznej malformácie, vážnej artériovej aneuryzmy, aj systémových angiodysplázií [24–26].
Tab. 3. Príčiny hemoragických artériových mozgových príhod u detí. 
Legenda: CNS – centrálny nervový systém, Tr – trombocyty DIFERENCIÁLNA DIAGNOSTIKA
Pozitívna rodinná anamnéza s údajom o výskyte mozgovej príhody už v detskom veku, s včasnou demenciou, zmyslovými poruchami, ťažkou migrénou, postihujúcou najmä matku detského pacienta, môže u detí napomôcť v diagnostike jej metabolickej príčiny (niekedy označovanej ako „stroke-like“ epizóda). Klasickým príkladom metabolického mozgového iktu sú mitochondriopatie MELAS (myopatie, encephalopatie, laktátová acidóza, „stroke-like“ epizódy). Aj keď sa spočiatku poruchy neurologických funkcií upravia, opakovanie epizód postupom času vedie k trvalým neurologickým poruchám, častým trvalým následkom je hemianopia. V prípade pozitívnej rodinnej anamnézy, alebo pri atypickom klinickom priebehu mozgovej príhody je treba pátrať aj po iných vrodených poruchách (cerebrálne autozómovo dominantne dedičné artériopatie so subkortikálnymi infarktami alebo leukoencefalopatiou – CADASIL, lyzozomálne poruchy, organické acidémie) [3].
Akútne fokálne neurologické prejavy, imitujúce cievnu mozgovú príhodu, vyžadujú prehodnotiť aj iné možnosti – napr. migrénu, epilepsiu, Todd parézu, tumor, alebo absces CNS, subdurálny a epidurálny hematóm, neuroinfekcie, alebo systémové infekcie, demyelinizačné ochorenia [1, 5].
KLINICKÝ OBRAZ
Klinické prejavy sú rozmanité a odzrkadľujú lokalizáciu, rozsah a čas trvania mozgovej ischémie. V novorodeneckom období môže byť AMP aj asymptomatická. Až vývoj hemiparézy v 4.–12. mesiaci života upozorní na jej prenatálny vývoj [1, 3, 27]. Typicky je viac postihnutá ruka než rameno (infarkt je lokalizovaný najmä v oblasti arteria cerebri media), častejšie vpravo (ľavá hemisféra). Perinatálne AMP majú podobnú predilekčnú lokalizáciu, sprevádzajú ich najmä fokálne záchvaty, obyčajne pozorované na pravej hornej končatine [11]. Postnatálne AMP sú klinicky podobné perinatálnym, alebo detským AMP.
Klinický priebeh detských AMP je stereotypnejší a viac závislý od oblasti ischémie a jej rozsahu. Ložiskový výpadok funkcie sa prejaví motorickou poruchou s obrazom periférnej parézy, či plégie na jednej alebo viacerých končatinách, alebo obrnou hlavových nervov, zriedka ataxiou. Častým sprievodným príznakom je vertigo, zvracanie, senzorické poruchy (najmä poruchy videnia – výpadok v zornom poli, diplopia až amauróza). Nepravidelným a diagnosticky nejednoznačným nálezom sú poruchy symbolických funkcií (rôzne formy afázie, zmätenosť, poruchy pamäti), či senzitívne poruchy. Porucha vedomia sprevádza veľké ischemické ložiská, príp. hemoragickú AMP, často s generalizovanými kŕčami [1, 9].
Klinický priebeh umožňuje rozlíšiť 4 formy AMP u detí [28]:
- transitórny ischemický záchvat (transient ischemic attack, TIA) – krátkodobú epizódu ložiskového výpadku funkcie, trvajúcu menej ako 24 hodín, často len niekoľko minút, s dobrou prognózou;
- reverzibilný ischemický neurologický defekt – epizódu s fokálnym neurologickým deficitom, trvajúcu viac než 24 hodín, s následnou úpravou ad integrum;
- dokončený iktus (complete stroke, CS) – epizódu s definitívnym funkčným výpadkom, bez ďalšieho vývoja za posledných 24 hodín;
- rozvíjajúcu sa ischemickú príhodu (evolutionary stroke, ES) – epizódu, keď sa výpadok funkcie ešte vyvíja a neurologický nález v priebehu posledných 24 hodín nie je stabilizovaný.
DIAGNOSTIKA
Diagnostika AMP v detskom veku je náročnejšia než u dospelých pre vyšší výskyt artériopatií rôznej príčiny a širokú diferenciálnu diagnostiku. Neočakávaný, neraz dramatický priebeh AMP v detskom veku vyžaduje rýchlu diagnostickú úvahu pre správne a včasné liečebné rozhodnutia. Anamnéza, opis klinických prejavov, ich progresia a trvanie, zhodnotenie somatického a najmä neurologického nálezu a systémového tlaku (TK) sú prvým diagnostickým krokom. Odlíšia ischemickú a hemoragickú epizódu, posúdia životne dôležité funkcie, odhalia preexistujúce ochorenia, úraz hlavy, alebo krku, užívanie liekov, alebo drog. Vstupné laboratórne vyšetrenie aktualizuje stav krvného obrazu, vnútorného prostredia, koagulačných pomerov, upozorní na infekciu. Pre určenie diagnózy sú nosnými zobrazovacie vyšetrenia CNS, ktoré jednoznačne potvrdia AMP, určia jej lokalizáciu, rozsah, niekedy aj príčinu a liečebný postup (neurochirurgickú intervenciu, antitrombotickú liečbu) [28].
U malých detí je pre prvú orientáciu vhodné ultrasonografické vyšetrenie CNS, doplnené Dopplerovým fenoménom, hodnotiacim prietok v mozgovom cievnom riečisku. Je rýchle, dostupné, neinvazívne, bez radiačnej záťaže. Poskytuje základnú diagnostickú orientáciu o ischemickej, či hemoragickej príhode, určí jej rozsah, lokalizáciu, umožňuje predvídať komplikácie (edém CNS, hroziaci kónus, obštrukciu likvorových ciest), alebo určiť predisponujúcu príčinu (tumor, vrodené, alebo získané cievne, či iné anomálie CNS). Transkraniálne USG vyšetrenie s Dopplerom má orientačnú hodnotu aj u starších detí [3, 6].
Najrýchlejšie dostupné diagnostické vyšetrenie 1. línie je kontrastná computerová tomografia (CT) a CT angiografia CNS. Jej nevýhodou je potreba spolupráce detských pacientov (prípadne vyšetrenie v krátkodobej anestéze) a radiačná záťaž. Známky ischemickej AMP môžu byť nešpecifické, alebo sa len vyvinú a včasný scan CT ich nemusí zachytiť. Výhodnejšou je magnetická rezonancia (MRI), doplnená angiografiou (MRA), bez radiačnej záťaže s väčšou rozlišovacou schopnosťou. Diagnostické posúdenie najmä subtilných lézií umožňuje použitie MRI v difúznom vážení. Zhodnotí cytotoxický edém, sprevádzajúci akútnu ischémiu a na základe identifikácie rizikových oblastí CNS umožňuje predvídať neurologickú dysfunkciu. Pri odhalení vaskulitídy/vaskulopatie malých ciev, alebo atypickej cievnej kresby (moyamoya syndróm) je opodstatnená konvenčná angiografia [29, 30].
Súčasťou diagnostického minima je echokardiologické vyšetrenie, vrátane EKG, Dopplerove USG vyšetrenie karotíd, v indikovaných prípadoch lumbálna punkcia, toxikologický a metabolický skríning.
Až u stabilizovaného pacienta je možné pátrať po inej príčine AMP a ďalších rizikových faktoroch. Súčasťou vyšetrenia je bakteriologické a sérologické vyšetrenie, lipidový profil, metabolický a trombofilný panel, vyšetrenia na systémový zápal, autoimunitné ochorenia (tab. 4) [3].
Tab. 4. Navrhované diagnostické laboratórne vyšetrenia pri podozrení na artériovú mozgovú príhodu u detí. 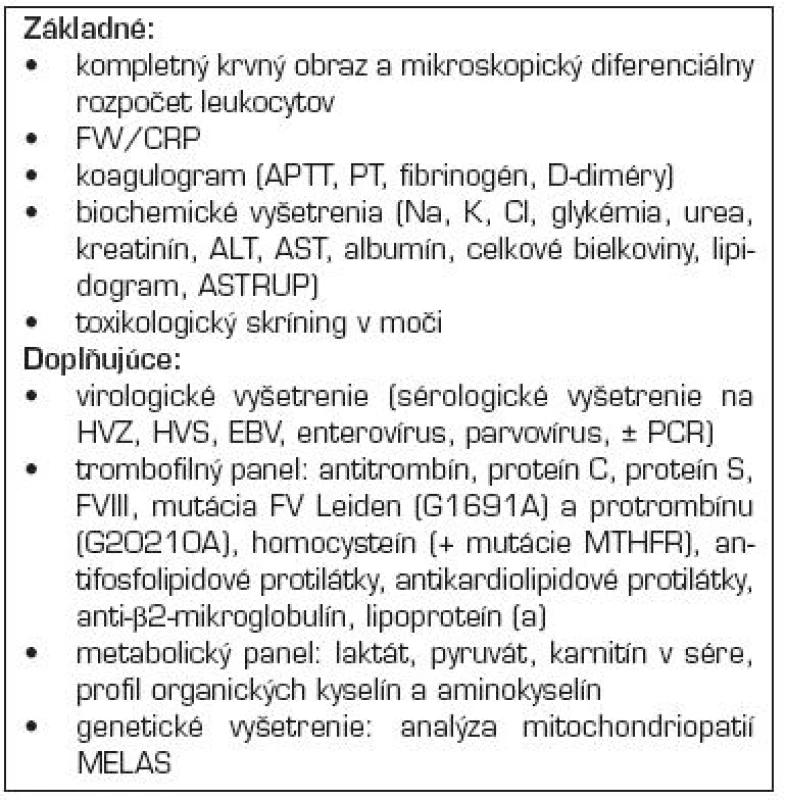
Legenda: FW – sedimentácia erytrocytov, CRP – C-reaktívny proteín, APTT – aktivovaný parciálny protrombínový čas, PT – protrombínový čas, Na – nátrium, K – kálium, Cl – chloridy, ALT – alanínaminotransferáza, AST – asparátaminotransferáza, HZV – virus herpes zoster, HSV – virus herpes simplex, EBV – virus Epsteina Barrovej, PCR – polymerázová reťazová reakcia, MTHFR – metyléntetrahydrofolátreduktáza, mitochondriopatie MELAS (myopatie, encephalopatie, laktátová acidóza, stroke-like epizódy) LIEČBA
Liečebné protokoly pre mozgovú AMP u detí nemajú hodnotu „medicíny dôkazov“ („evidence based medicine“), s výnimkou liečby AMP pri kosáčikovitej anémii. Dostupné štúdie obyčajne hodnotia menší, heterogénny súbor detí rôzneho veku, s rôznym sprievodným ochorením, neumožňujú jednoznačné závery. V klinickej praxi sa používajú odporúčania 8. kongresu Amerického kolégia pľúcnych lekárov (The American College of Chest Physicians – ACCP) z roku 2008 a spoločnosti Royal College of Physicians z rovnakého obdobia [3, 5, 31]. Predstavujú aktuálny konsenzus, využívajúc tiež liečebné schémy používané u dospelých. Liečebný prístup je rozdielny u novorodencov a starších detí a vyžaduje úzku medziodborovú spoluprácu.
Každý detský pacient s podozrením na AMP patrí na monitorovacie lôžko s možnosťou akútneho laboratórneho a vyšetrovacieho zázemia. Neodkladnosť liečebných opatrení odpovedá závažnosti klinických prejavov AMP.
Iniciálnym liečebným prístupom je podporná liečba, cieľom ktorej je stabilizácia dýchania, oxygenácie, normotenzie a normotermie, úprava hydratácie, vnútorného prostredia, s vyrovnanou hladinou kľúčových minerálov a glukózy, čím sa vytvoria predpoklady pre udržanie kyslíkových a energetických nárokov CNS. Ďalším krokom je symptomatická liečba kŕčov použitím antikonvulzív a iných akútnych prejavov (zvracanie, horúčka), úprava hemokoagulačných porúch. Zobrazovacie vyšetrenia upozornia na pacientov, ktorí potrebujú neodkladné neurochirurgické riešenie (kraniálnu dekompresiu, alebo evakuáciu hematómu).
Najbežnejšie používanými liekmi s antitrombotickým účinkom sú buď preparáty kyseliny acetylsalicylovej, alebo heparín [1, 5]. Podľa 8. kongresu ACCP sa u všetkých prvých epizód detských AMP (okrem novorodencov a AMP pri SCD) uprednostňuje iniciálne antitrombotická liečba nízkomolekulovým heparínom (LMWH), alebo štandardným heparínom (UFH) v terapeutických dávkach určených pre detský vek, a to 5–7 dní [32, 33]. Ďalší postup sa riadi rizikom odhalenej príčiny (napr. disekcia, kardioembolická príčina). Liečebné odporúčanie pri najčastejších typoch AMP u novorodencov a starších detí publikované v posledných rokoch sú v tabuľke 5 [4, 5, 34].
Tab. 5. Antitrombotická lieãba u detí s artériovou mozgovou príhodou (AMP). 
Legenda: AMP – artériová mozgová príhoda, UFH – nefrakciovaný heparín, LMWH – nízkomolekulový heparín, TIA – tranzitórna ischemická príhoda, 1B – odporúčanie s vysokou prevahou výhod liečby nad jej rizikami a cenou, podporené menšími štúdiami, 2B – odporúčanie, kde pomer výhod s rizikami liečby a cenou nie je jednoznačný, podporené menšími štúdiami Naopak, podľa Royal College of Physicians v iniciálnej liečbe sa volí preparát kyseliny acetylosalicylovej (Aspirín, Anopyrín) pred antikoagulačnou liečbou, a to v nízkej dávke (1–5 mg/kg/d). Zatiaľ chýba vyhodnotenie lepšej účinnosti. Zdá sa, že nie sú významné rozdiely v incidencii rekurentných AMP a vedľajších účinkoch, ktoré by zvýhodňovali niektorú liečebnú modalitu [3, 35].
Liečba AMP pri kosáčikovitej anémii je založená viac na klinických skúsenostiach a retrospektívnej analýze. Odporúča sa dostatočná hydratácia a výmenná transfúzia s cieľom znížiť hladinu hemoglobínu S pod 30 % celkového hemoglobínu. Následne je pacient zaradený do dlhodobého transfúzneho programu [5, 31].
Pre zvýšené riziko krvácania a rekurencie AMP sa u pacientov s moyamoya syndrómom prvolíniovo uprednostňujú neurochirurgické prístupy s cieľom revaskularizácie [5]. Dlhodobá antitrombotická liečba je rezervovaná pre deti s tzv. „možným moyamoya“ syndrómom (jednostanná stenóza v terminálnom segmente ICA s kolaterálami, alebo prítomnosť obojstrannej stenózy terminálnej časti ICA, bez kolaterál) [3, 21] a pre detských pacientov s rekurenciou AMP, alebo pri TIA [34].
Systémová, či selektívna intervenčná trombolytická liečba sa pri AMP u novorodencov aj starších detí neodporúča. Nie sú zatiaľ určené podmienky jej aplikácie, najmä šírka diagnostického okna pre začatie účinnej a bezpečnej liečby (3–6 hodín?), chýba ohodnotenie krvácavého rizika. Odpoveď majú priniesť klinické štúdie na vybraných pracoviskách, s individuálnym výberom starších detských pacientov [5, 36, 37].
V liečbe novorodeneckých AMP sa odporúča podporná liečba. Pri nízkom riziku rekurencie (asi 3 % za medián sledovania 3,5 roka) prevláda zdržanlivý prístup pre použitie antitrombotickej liečby. Prehodnotenie jej použitia je individuálne, u novorodencov s rekurenciou AMP, pri potvrdení významných protrombotických, alebo kardiálnych rizikových faktorov [5, 32].
DLHODOBÉ NÁSLEDKY
Rozmanité, početné a dlhodobé rizikové faktory AMP u detí sú jedným z hlavných dôvodov, pre ktoré sa u postihnutých detí realizuje sekundárna profylaxia [38]. Riziko rekurencie AMP u detí počas 5-ročného sledovania je vysoké, približne 20–40 % [3, 39]. Možno ju očakávať u detských pacientov s dokázanou artériovou abnormalitou (v 66 %) [1, 3], stupňuje ho počet dokázaných rizikových faktorov. S rekurenciou sa zvyšuje riziko a závažnosť dlhodobých neurologických následkov.
Asi 30 % prežívajúcich detí s AMP má normálnu motorickú funkciu (pri priemernom sledovaní 6 mesiacov až 2,5 roka) [3]. Neuromotorické, jazykové a kognitívne následky detí a novorodencov s AMP sú vysoko variabilné, závisia od veľkosti mozgovej ischémie, či infarktu, komorbidity a veku v čase diagnózy. Najčastejšie ide o motorické poruchy, najmä hemiparézu, potom poruchy učenia, záchvatové stavy (25–33 %), poruchy kognitívnych funkcií a výslovnosti (18 %), zmeny chovania (29–44 % pri 5–7-ročnom sledovaní) [3, 39, 40].
Pri novorodeneckých AMP je riziko rekurencie nízke (do 3 % pri priemernom sledovaní 3,5–6 rokov) [6, 11]. Rekurenciu možno očakávať u pacientov s vrodenou chybou srdca a vrodenými protrombotickými abnormalitami [4]. Patologický encefalogram a rozsah ischémie, ktorý postihuje capsula interna, bazálne gangliá a okolitý kortex korelujú s vývojom hemiparézy, alebo asymetrie tonusu bez hemiplégie [3]. Zdá sa, že výsledky MRI vyšetrenia v difúznom vážení s presným posúdením rozsahu ischemického poškodenia v jednotlivých oddieloch mozgu umožnia predvídať vývoj a typ neurologickej poruchy [3, 39]. Z ďalších následkov sa udáva zlá výslovnosť (12 %), porucha kognitívnych funkcií a zmena správania (3–14 % počas 2–6-ročného sledovania) [3, 11].
ZÁVER
Mozgové artériové ischemické príhody v novorodeneckom a detskom veku sú vzácne, niekedy dramaticky prebiehajúce situácie. Pokroky zobrazovacích vyšetrení napomáhajú v ich častejšom odhaľovaní. Vekovo špecifické rozdiely medzi príčinou, prejavmi, liečebnou odpoveďou aj následkami ich odlišujú od príhod u dospelých. Pokus o aplikáciu liečebných schém u dospelých preto nemôže byť priamočiary a vyžaduje minimálne opatrnosť. Ukazuje sa, že najdôležitejším rizikovým faktorom detských AMP sú artériopatie mozgových ciev, ktoré nie sú aterosklerotické (traumatické, zápalové, idiopatické) a protrombotické abnormality (vrodené aj získané), najmä u novorodencov.
Starostlivosť o detských pacientov s AMP by mala byť komplexná a dlhodobá. Vyžaduje úzku spoluprácu niekoľkých odborníkov (neurológa, neonatológa, hematológa, radiológa, neurochirurga, rehabilitačného lekára, posudkového lekára, logopéda, psychológa), ktorí majú vedomosti aj skúsenosti s detskými pacientmi s rozmanitým typom AMP v rôznych obdobiach detského veku. Antitrombotickú liečbu musí dopĺňať včasná a odborne vedená rehabilitácia, aj špeciálne prístupy resocializácie. Aj keď je ťažké realizovať ďalšie klinické štúdie pre zodpovedanie všetkých nejasností v oblasti AMP u detí, je nutné sa o ne pokúsiť. Pomôžu získať reálne skúsenosti u pacientov vo všetkých obdobiach detského veku a optimalizovať diagnosticko-liečebné postupy.
Došlo: 24. 1. 2011
Přijato: 12. 5. 2011MUDr. Monika Grešíková
Klinika detskej hematológie a onkológie DFNsP
Limbova 1
833 40 Bratislava
Slovenská republika
e-mail: gresikova@dfnsp.sk
gresik@chello.sk
Zdroje
1. Roach ES, Golomb MR, Adams R, et al. Management of stroke in infants and children. Stroke 2008; 39 : 2644–2691.
2. Sébire G. Transient cerebral arteriopathy in childhood. Lancet 2006; 368 : 8–10.
3. Bernard TJ, Goldenberg NA. Pediatric arterial ischemic stroke. Pediatr Clin N Amer 2008; 55 : 323–338.
4. Lanzkowsky Ph. Thrombosis disorders. In: Manual of Pediatric Hematology and Oncology. 5th ed. London, Burlington, San Diego: Elsevier, 2011 : 419–440.
5. Monagle P, Chalmers E, Chan A, et al. Antitrombotic therapy in neonate and children. American College of Chest Physicians Evidence – based clinical practice guidelines, 8th ed. Chest 2008; 133 (Suppl): 887S–968S.
6. Journeycake JM. Thrombosis in infancy and childhood. In: Colman RW, Marder VJ, Clowes AW, et al. Hemostasis and Thrombosis. Basic Principles and Clinical Practice. 5th ed. Philadelphia: Lippincott Williams and Wilkins, 2006 : 1637–1647.
7. Sébire G, Fullerton H, Riou E, et al. Toward the definition of cerebral arteriopathies of childhood. Curr Opin Pediatr 2004; 16 : 617–622.
8. Danchaivijitr N, Cox TC, Saunders DE, et al. Evolution of cerebral arteriopathies in childhood arterial ischemic stroke. Ann Neurol 2006; 59 : 620–626.
9. Kirkham F. Improvement or progression in childhood cerebral arteriopathies: current difficulties in prediction and suggestions for research. Ann Neurol 2006; 59 : 580–582.
10. Braun KPJ, Rafay MF, Uiterwaal CSPM, et al. Mode of onset predicts etiological diagnosis of arterial ischemic stroke in children. Stroke 2007; 38 : 298–302.
11. Rafay MF, Armstrong D, deVeber G, et al. Craniocervical arterial dissection in children: clinical and radiographic presentation and outcome. J Child Neurol 2006; 21 : 8–16.
12. Benseler SM, Silverman E, Aviv RI, et al. Primary central nervous system vasculitis in children. Arthritis Rheum 2006; 54 : 1291–1297.
13. Wang WC. The pathophysiology, prevention, and treatment of stroke in sickle cell disease. Curr Opin Hematol 2007; 14 : 191–197.
14. Hogan AM, Kirkham FJ, Isaacs EB, et al. Intellectual decline in children with moyamoya and sickle cell anaemia. Dev Med Child Neurol 2005; 47 : 824–829.
15. Curry CJ, Bhullar S, Holmes J, et al. Risk factors for perinatal arterial stroke: a study of 60 mother-child pairs. Pediatr Neurol 2007; 37 : 99–107.
16. Shellhaas R, Smith SE, O´Tool E, et al. Mimics of childhood stroke: characteristics of a prospective cohort. Pediatrics 2006; 118 : 704.
17. Bartz PJ, Cetta F, Cabalka AK, et al. Paradoxical emboli in children and young adults: role of atrial septal defect and patent foramen ovale device closure. Mayo Clin Proc 2006; 81 : 615–618.
18. Agnetti A, Carano N, Sani E, et al. Cryptogenic stroke in children: possible role of patent foramen ovale. Neuropediatrics 2006; 37 : 53–56.
19. Butany J, Nair V, Naseemuddin A, et al. Cardiac tumours: diagnosis and management. Lancet Oncol 2005; 6 : 219–228.
20. Barnes C, deVeber G. Prothrombotic abnormalities in childhood ischemic stroke. Thromb Res 2006; 118 : 67–74.
21. Boffa MC, Lachassinne E. Review: infant perinatal thrombosis and antiphospholipid antibodies: a review. Lupus 2007; 16 : 634–641.
22. Mackay MT, Monagle P. Perinatal and early childhood stroke and thrombophilia. Pathology 2008; 1 : 116–123.
23. Lee J, Croen LA, Backstrand KH, et al. Maternal and infant characteristics associated with perinatal arterial stroke in the infant. JAMA 2005; 293 : 723–729.
24. Huang J, McGirt MJ, Gailloud P, et al. Intracranial aneurysms in the pediatric population: case series and literature review. Surg Neurol 2005; 63 : 424–433.
25. Lee JW, Kim DS, Shim KW, et al. Management of intracranial cavernous malformation in pediatric patients. Childs Nerv Syst 2008; 24 : 321–327.
26. Fullerton HJ, Wu YW, Sidney S, et al. Recurrent hemorrhagic stroke in children: a population-based cohort study. Stroke 2007; 38 : 2658–2662.
27. Lee J, Croen LA, Lindan C, et al. Predictors of outcome in perinatal arterial stroke: a population-based study. Ann Neurol 2005; 58 : 303–308.
28. Gut J. Cévni mozgové príhody u dětí – 1. Pediatrie pro Praxi 2008; 9 : 154–157.
29. Boardman JP, Ganesan V, Rutherford MA, et al. Magnetic resonance image correlates of hemiparesis after neonatal and childhood middle cerebral artery stroke. Pediatrics 2005; 115 : 321–326.
30. Liu AC, Segaren N, Cox TS, et al. Is there a role for magnetic resonance imaging in the evaluation of non-traumatic intraparenchymal haemorrhage in children? Pediatr Radiol 2006; 36 : 940–946.
31. Hirsh J. Antithrombotic therapy in neonates and children. In: Guidelines for Antitrombotic Therapy. 8th ed. Hamilton, 2008 : 140–149.
32. Bernard TJ, Goldenberg NA, Triputi M, et al. Anticoagulation in childhood-onset arterial ischemic stroke with nonmoyamoya arteriopathy. Stroke 2009; 40 : 2869–2871.
33. Grešíková M. Zásady antitrombotickej liečby u novorodencov a detí. Pediatria 2010; 1 : 44–49.
34. Sacco RL, Adams R, Albers G, et al. Guidelines for prevention of stroke in patients with ischemic stroke or transient ischemic attack: a statement for healthcare professionals from the American Heart Association/American Stroke Association Council on Stroke. Stroke 2006; 37 : 577–617.
35. Soman T, Rafay MF, Hune S, et al. The risks and safety of clopidogrel in pediatric arterial ischemic stroke. Stroke 2006; 37 : 1120–1122.
36. Janjua N, Nasar A, Lynch JK, et al. Thrombolysis for ischemic stroke in children: data from the nationwide in patient sample. Stroke 2007; 38 : 1850–1854.
37. Benedict SL, Ni OK, Schloesser P, et al. Intra-arterial thrombolysis in a 2-year-old with cardioembolic stroke. J Child Neurol 2007; 22 : 225–227.
38. Zahuranec DB, Brown DL, Lisabeth LD, et al. Is it time for a large, collaborative study of pediatric stroke? Stroke 2005; 36 : 1825–1829.
39. Pavlovic J, Kaufmann F, Boltshauser E, et al. Neuropsychological problems after paediatric stroke: two year follow-up of Swiss children. Neuropediatrics 2006; 37 : 13–19.
40. Ganesan V, Prengler M, Wade A, et al. Clinical and radiological recurrence after childhood arterial ischemic stroke. Circulation 2006; 114 : 2170–2177.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2011 Číslo 4- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Gastroezofageální reflux a gastroezofageální refluxní onemocnění u kojenců a batolat
-
Všetky články tohto čísla
- Srovnání podílů kojených dětí v Baby-friendly a ostatních porodnicích ČR v letech 2000 až 2006
- Mukopolysacharidóza I – klinické projevy u 24 dětí z České republiky a Slovenska
- Artériová mozgová príhoda v detskom veku
- Praktický přístup k enterální výživě v pediatrii – doporučení ESPGHAN
- Slovenský pediatrický kongres s medzinárodnou účasťou
- Poruchy příjmu potravy
- Onemocnění spojená s malabsorpcí
- 10. CELOSTÁTNÍ KONFERENCE DĚTSKÉ PNEUMOLOGIE
- Ostravský den preventivní pediatrie
- Pediatria pre prax – 51. pediatrické dni Bratislava, 14.–15. 4. 2011
- XIII. hradecké pediatrické dny Hradec Králové, 11.–12. listopadu 2011
- Pařízková J.: Nutrition, Physical Activity, and Health in Early Life. 2. vyd.
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Onemocnění spojená s malabsorpcí
- Mukopolysacharidóza I – klinické projevy u 24 dětí z České republiky a Slovenska
- Praktický přístup k enterální výživě v pediatrii – doporučení ESPGHAN
- Artériová mozgová príhoda v detskom veku
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



