-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Mukopolysacharidóza I – klinické projevy u 24 dětí z České republiky a Slovenska
Mucopolysaccharidosis I – clinical manifestations in 24 children from the Czech Republic and Slovakia
Mucopolysaccharidosis I (MPS I) is severe metabolic storage disease caused by impaired function of α-L-iduronidase. The aim of this study is to describe clinical symptoms, natural course and to evaluate results of treatment in Czech and Slovak children with MPS I.
Methods:
Study group consists of 24 children from 23 families. In all children diagnosis of MPS I was confirmed on enzymatic level and in 22 children on molecular level.Results:
First symptoms of disease – hepatosplenomegaly, craniofacial dysmorphy, corneal clouding and psychomotor delay – were observed in all patients. The most of them have macrocephaly (11/21) and skeletal changes – dysostosis multiplex (21/23). Cardiomyopathy with valves impairment (16/21), hearing impairment (9/18), joint stiffness (19/22) and carpal tunnel syndrome (7/23) belongs to later symptoms. All children had increased glycosaminoglycans excretion in urine and decreased activity of α-L-iduronidase in isolated leucocytes. Two mutations in gene α-L-iduronidase were prevalent, the mutation p.W402X was found in 9 and the mutation p.Q70X in 7 children. Hematopoietic stem cell transplantation (HSCT) was performed in 7 children, in 5 of them with good clinical result. 6 children with milder form of disease were treated by a long-lasting enzyme replacement therapy (ERT) with good therapeutic effect, but one patient died due to complication after neurosurgery intervention for compression of cervical spinal cord. The most of children without therapy died (7/11).Conclusion:
Diagnostic of MPS I in early phases of disease improves prognosis, because correct therapy (HSCT or ERT) can be chosen. Prognosis for children with later diagnosis is very unfavourable. The advance diagnosis is very important also for prenatal diagnostic in affected families.Key words:
mucopolysaccharidosis I, glycosaminoglycans, α-L-iduronidase, lysosomal storage disorders, enzyme replacement therapy, hematopoietic stem cell transplantation
Autoři: P. Ješina 1,2; M. Magner 1; H. Poupětová 2; J. Honzíková 2; L. Dvořáková 2; V. Malinová 1; E. Hrubá 2; A. Hlavatá 3; T. Honzík 1,2; K. Veselá 1; P. Sedláček 4; J. Starý 4; J. Zeman 1,2
Působiště autorů: Klinika dětského a dorostového lékařství UK 1. LF a VFN, Praha, přednosta prof. MUDr. J. Zeman, DrSc. 1; Ústav dědičných a metabolických chorob UK 1. LF a VFN, Praha, přednosta doc. MUDr. V. Kožich, CSc. 2; II. detska klinika DFNsP, Bratislava, Slovensko, přednosta prof. MUDr. L. Kovács, DrSc. 3; Klinika dětské hematologie a onkologie UK 2. LF a FN Motol, Praha, přednosta prof. MUDr. J. Starý, DrSc. 4
Vyšlo v časopise: Čes-slov Pediat 2011; 66 (4): 215-225.
Kategorie: Původní práce
Souhrn
Mukopolysacharidóza I (MPS I) je závažné metabolické střádavé onemocnění způsobené poruchou funkce α-L-iduronidázy. Cílem práce je popsat klinické projevy onemocnění a zhodnotit výsledky léčby u českých a slovenských dětí s MPS I.
Metody:
Soubor tvoří 24 dětí s MPS I z 23 rodin. U všech dětí byla diagnóza MPS I potvrzena na enzymatické úrovni a u všech dětí kromě dvou i na molekulární úrovni.Výsledky:
První příznaky onemocnění – hepatosplenomegalie, kraniofacialní dysmorfie, zákal rohovky a opoždění psychomotorického vývoje – byly pozorovány u všech pacientů. Většina dětí měla makrocefalii (11/21) a kostní změny charakteru dysostosis multiplex (21/23). Mezi pozdější projevy onemocnění patřily kardiomyopatie s postižením chlopní (16/21), porucha sluchu (9/18), ztuhlost kloubů (19/22) a syndrom karpálního tunelu (7/23). Všechny děti měly zvýšené vylučování glykosaminoglykanů v moči a sníženou aktivitu α-L-iduronidázy v izolovaných leukocytech. Dvě mutace v genu pro α-L-iduronidázu byly prevalentní, mutace p.W402X byla nalezena u 9 a mutace p.Q70X u 7 dětí. U 7 dětí s těžší formou onemocnění byla provedena transplantace hematopoetických kmenových buněk (HSCT), u 5 z nich s dobrým klinickým výsledkem. Dlouhodobou enzymovou substituční terapii (ERT) s dobrým terapeutickým efektem dostalo 6 dětí s mírnější formou onemocnění, ale jedna pacientka zemřela na komplikace po neurochirurgické operaci stenózy krční míchy. Většina dětí, které byly bez léčby, zemřela (7/11).Závěr:
Diagnostika dětí s MPS I v časných fázích onemocnění významně zlepšuje prognózu postižených dětí, protože umožňuje správnou volbu nejvhodnější terapie (HSCT nebo ERT). Prognóza dětí s pozdní diagnostikou je velmi nepříznivá. Včasná diagnostika je důležitá i pro eventuální prenatální diagnostiku v postižených rodinách.Klíčová slova:
mukopolysacharidóza I, glykosaminoglykany, α-L-iduronidáza, lyzozomální onemocnění, enzymová substituční terapie, transplantace hematopoetickými kmenovými buňkamiÚVOD
Mukopolysacharidóza I (MPS I) patří do rozsáhlé skupiny lyzozomálních střádavých onemocnění. Je způsobena nedostatečnou aktivitou enzymu α-L - -iduronidázy (IDUA, EC 3.2.1.76; MIM *252800), která katalyzuje degradaci glykosaminoglykanů (GAG), dříve označovaných jako mukopolysacharidy. GAG jsou důležitou složkou extracelulární matrix a podílejí se na stavbě pojivové tkáně. Snížená anebo chybějící aktivita IDUA vede pomalu, ale progresivně k hromadění GAG, zejména heparansulfátu a dermatansulfátu, v jednotlivých buňkách a tkáních s následnou poruchou jejich funkcí, které jsou v pokročilé fázi onemocnění již ireverzibilní [1, 2].
MPS I je onemocnění s autozomálně recesivní dědičností, které se vyskytuje panetnicky. Frekvence výskytu se udává přibližně 1 : 100 000–150 000. Pro Českou republiku byla prevalence stanovena na 1 : 140 000 [3]. Klinicky se MPS I projevuje jako pozvolně progredující multisystémové onemocnění se širokou variabilitou. Klinické symptomy představují kontinuální spektrum, kdy se závažnost jednotlivých příznaků v průběhu života mění. Tíži fenotypu vyjadřuje věk nástupu nemoci, progrese postižení a přidružené komplikace. MPS I je nutno chápat jako soubor klinických postižení, pohybujících se od těžce změněného fenotypu až po nejmírnější projevy [4]. Klinicky nejtěžší forma MPS I je označována jako syndrom Hurlerové (MPS I-H). Na druhém konci klinického spektra obtíží stojí syndrom Scheie (MPS I-S) charakterizovaný pozdějším začátkem a mírnějším průběhem. Mezistupeň tvoří syndrom Hurler-Scheie (MPS I-HS). Nutno zdůraznit, že dělení MPS I na 3 podtypy vychází spíše z tradice a je čistě arbitrární.
Nejčastěji je u pacientů s MPS I popisována typická kraniofaciální dysmorfie, hepatosplenomegalie, zákal rohovky, hernie, drápovité postavení prstů na rukou, kardiovaskulární obtíže, zejména postižení srdečních chlopní, časté obstrukce dýchacích cest a porucha růstu s protruzí sterna. Rtg vyšetření skeletu ukáže projevy „dysostotis multiplex“. U dětí s těžkou formou MPS I postupně progreduje postižení CNS, které se projevuje zpomalením vývoje kognitivních a motorických funkcí a postupnou zástavou a regresem psychomotorického vývoje.
Při podezření na MPS I se provádí vyšetření GAG v moči. Diagnózu potvrdí enzymologické vyšetření v izolovaných leukocytech nebo kultivovaných kožních fibroblastech, mutační analýza v postižené rodině umožní eventuální prenatální diagnostiku.
V současné době je metodou volby u dětí s MPS I, které jsou diagnostikovány ještě před rozvojem psychomotorické retardace, transplantace hematopoetických kmenových buněk (HSCT) nebo „enzym substituční terapie“ (ERT – enzyme replacement therapy) pomocí rekombinantně vyráběného enzymu, který je komerčně dostupný pod názvem Aldurazyme®. Další léčebné metody – substrát-inhibiční terapie a genová léčba – jsou ve fázi výzkumu [5, 6].
Cílem našeho sdělení je popsat klinické projevy onemocnění a analyzovat výsledky léčby u 24 dětí s MPS I, které byly diagnostikovány na našem pracovišti.
SOUBOR PACIENTŮ
V letech 1985 až 2010 jsme na biochemické a molekulární úrovni diagnostikovali MPS I u 24 dětí z 23 rodin z České republiky a Slovenska (13 chlapců a 11 dívek). Z naší zdravotnické dokumentace byly analyzovány tíže a nástup klinických příznaků nemoci i výsledky biochemických, enzymologických a molekulárně genetických vyšetření.
METODY
Zvýšená exkrece GAG byla kvantitativně stanovena reakcí s dimetylmetylenovou modří. Kvalitativní analýza byla provedena jednorozměrnou elektroforézou GAG izolovaných z moči na acetylcelulózových plotnách [7].
Aktivita enzymu α-L-iduronidázy byla stanovena v leukocytech izolovaných z periferní krve použitím fluorogenního substrátu 4-methylumbelliferyl-α - -L-iduronidu (Glycosynth) [8].
Mutační analýza byla provedena z periferních leukocytů u 22 dětí a genotyp byl určen přímým sekvenováním PCR produktů zahrnujících celou kódující oblast genu IDUA. V případě potřeby byl analyzován i transkript (cDNA) [9].
VÝSLEDKY
Na klinické úrovni byla z celkového počtu 24 dětí s MPS I u 17 dětí diagnostikována těžká forma onemocnění (MPS I-H) s postižením CNS, středně těžká forma MPS I-HS u 5 dětí a mírnější forma MPS I-S u 2 sourozenců (tab. 1, 2 a 3). U dětí s MPS I-H se onemocnění manifestovalo již v kojeneckém věku, průměrně v 8.–9. měsíci života. Mezi první příznaky onemocnění patřily zejména pupeční a tříselné hernie (obr. 2), kraniofaciální dysmorfie (obr. 1), zákal rohovky, hepatomegalie (obr. 2) a kostní změny charakteru dysostosis multiplex. U této skupiny dětí byla diagnóza stanovena v průměru mezi 22.–23. měsícem věku. U druhé skupiny MPS I-HS byly první příznaky (kontraktury na horních končetinách – obr. 3, střádavé změny na srdečních chlopních) dokumentovány ve věku průměrně 1,5 roku a diagnóza ve 3 letech. U dvou sourozenců s mírnou formou MPS I-S byl první příznak popsán přibližně ve 4 letech, ale diagnóza byla určena až v 11, resp. 15 letech po náhodném nálezu hepatosplenomegalie.
Tab. 1. Klinická data u pacientů s MPS I. 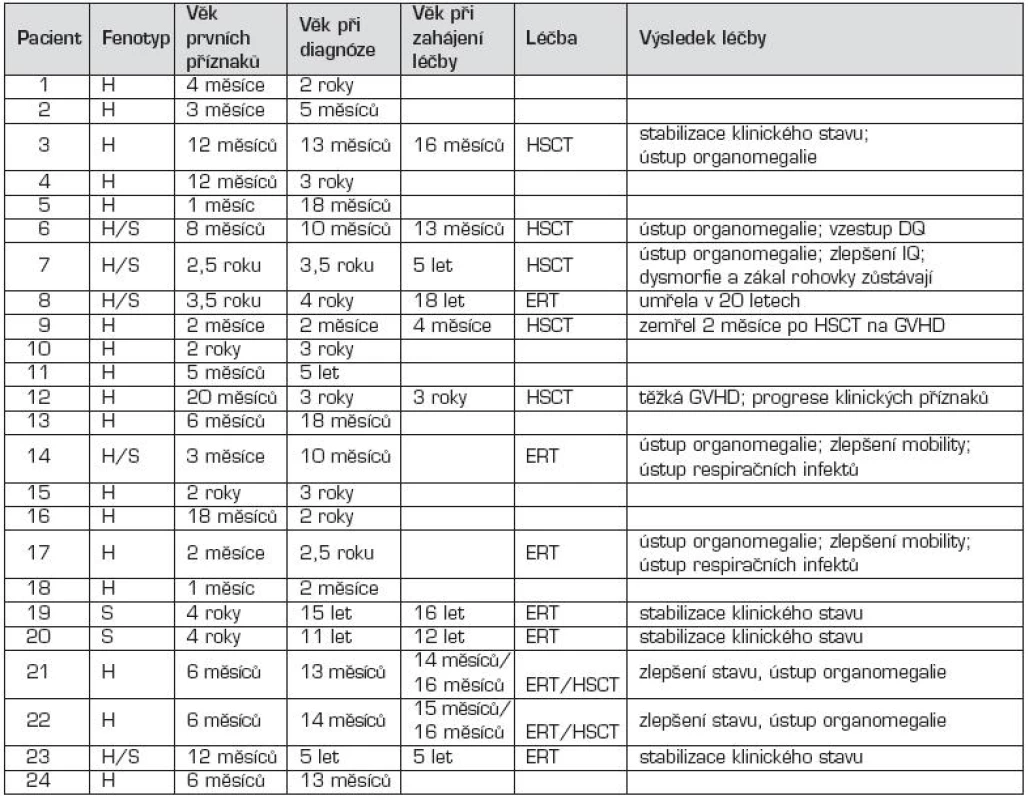
H – MPS I-H, syndrom Hurlerové H/S – MPS I-HS, syndrom Hurler-Scheie S – MPS I-S, syndrom Scheie ERT – enzymová substituční léčba (enzyme replacement therapy) HSCT – transplantace hematopoetickými kmenovými buňkami (hematopoietic stem cell transplantation) GVHD – reakce štěpu proti hostiteli (graft versus host disease) IQ – inteligenční kvocient DQ – vývojový kvocient (development quotient) Tab. 2. Klinické projevy u MPS I pacientů. 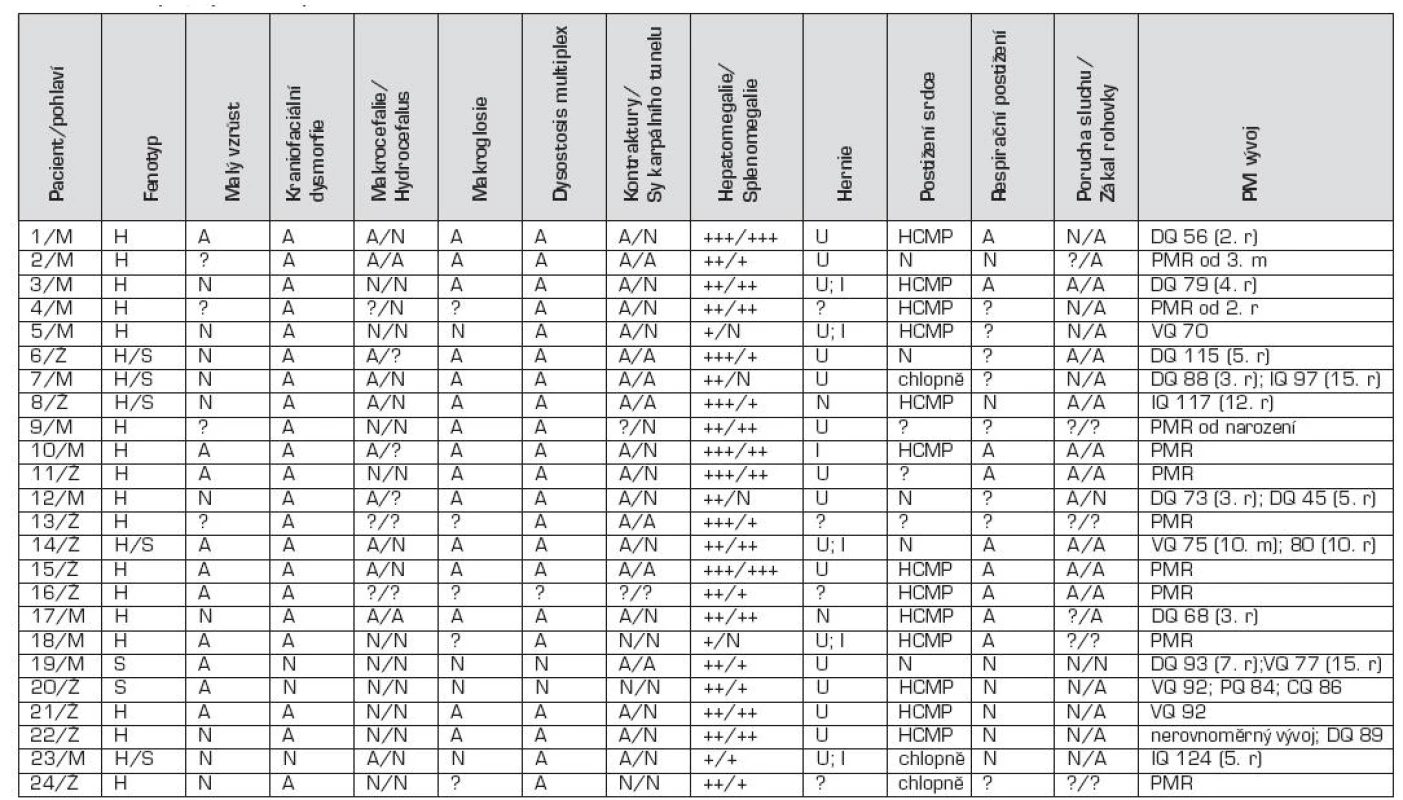
H – MPS I-H, syndrom Hurlerové H/S – MPS I-HS, syndrom Hurler-Scheie S – MPS I-S, syndrom Scheie M – muž Ž – žena A – přítomen N – nepřítomen ? - nezjištěno +, ++, +++ – míra hepato/splenomegalie U – umbilikální hernie I – inguinální hernie HCMP – hypertrofická kardiomyopatie PMR – psychomotorická retardace r – rok DQ – vývojový kvocient (development quotient) VQ – verbalní kvocient (verbal quotient) PQ – performance/product quotient CQ – creative quotient Tab. 3. Výsledky biochemické, enzymologické a molekulárně genetické analýzy u pacientů s MPS I. 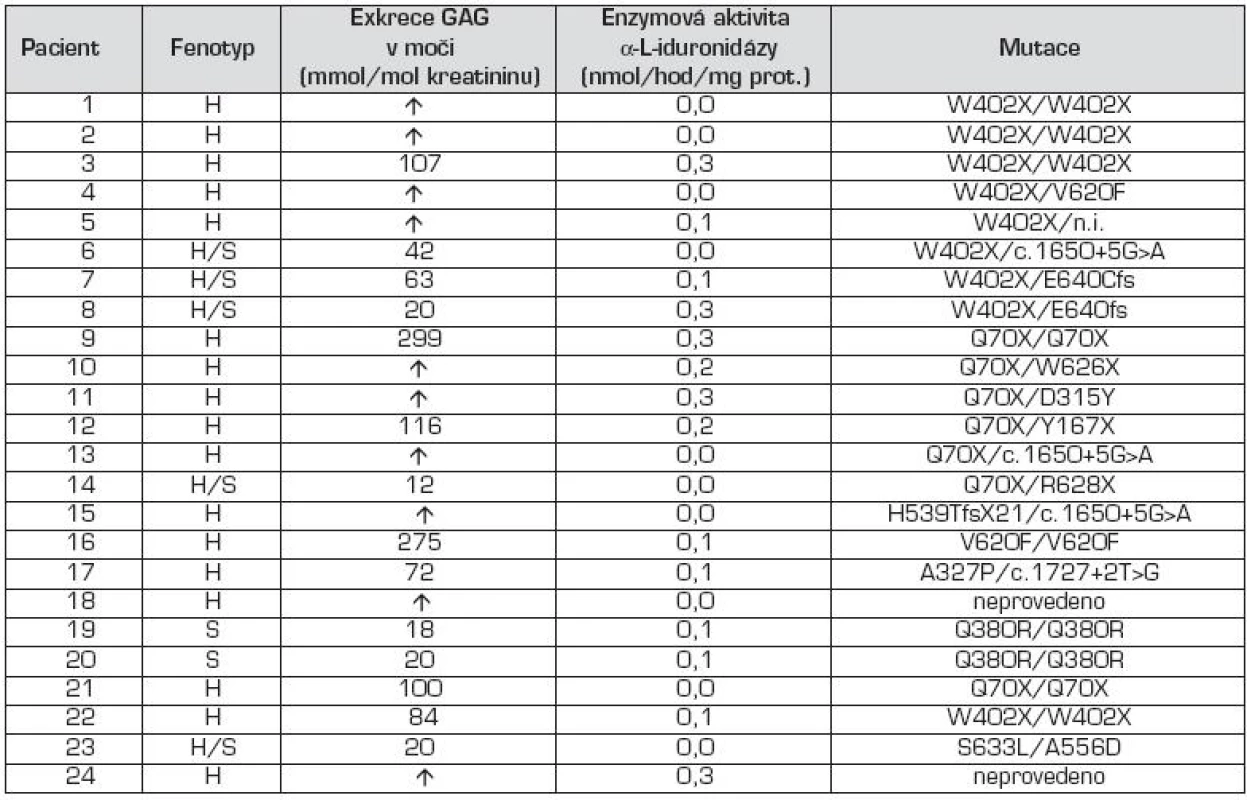
H – MPS I-H, syndrom Hurlerové H/S – MPS I-HS, syndrom Hurler-Scheie S – MPS I-S, syndrom Scheie GAG – glykosaminoglykany ↑ – zvýšené vylučování nad normu pro daný věk Tabulka 1 uvádí věk při nástupu prvních příznaků u jednotlivých pacientů a v tabulce 2 jsou uvedeny všechny klinické příznaky. Hepatomegalie byla pozorována u všech pacientů s MPS I-H (17/17), zatímco splenomegalie u 14/17 pacientů (81 %) – obr. 2. Ve skupině pacientů s MPS I-HS se hepatomegalie nebo splenomegalie vyskytovaly u 5/5, resp. 4/5 pacientů. U nejlehčí formy MPS I-S byla dokumentována mírná hepatosplenomegalie u obou pacientů. U 90 % pacientů (18/20) byly pozorovány kýly; z toho umbilikální hernie v 12 případech (67 %), inguinální hernie v jednom (5 %) a kombinace obou v 5 případech (28 %) (obr. 2).
Obr. 1. Kraniofaciální dysmorfie u pacienta s MPS I. Fig. 1. Craniofacial dysmorphia in a patient with MPS I. 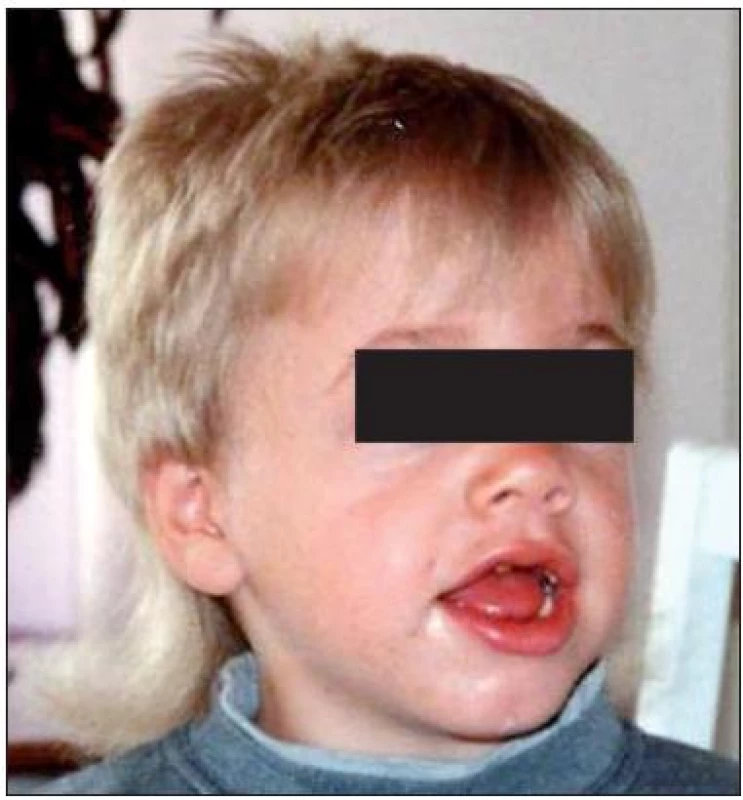
Obr. 2. Hepatosplenomegalie a umbilikální hernie. Fig. 2. Hepatosplenomegaly and umbilical hernia. 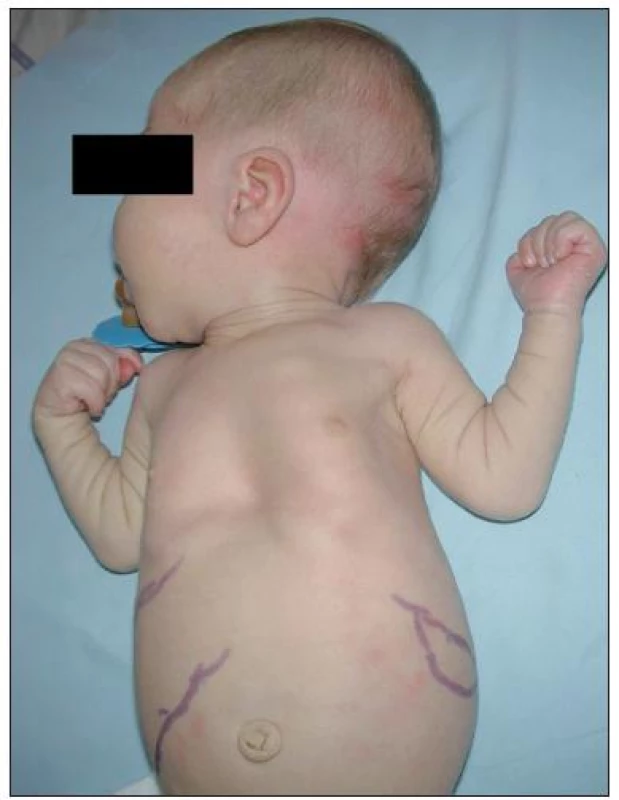
Střádavé změny na srdečních chlopních byly popsány u 16 z 24 pacientů, zejména na mitrální a aortální chlopni. U pacientů s MPS I-H byla již v čase diagnózy (přibližně ve 2 letech) dokumentována hypertrofická kardiomyopatie různého stupně jako následek progrese nálezu na srdečních chlopních (11/14). U formy MPS I-HS došlo u jednoho pacienta k rozvoji kardiomyopatie po 4. roce věku života. Mírné dysplastické změny na mitrální chlopni byly popsány i u jednoho ze sourozenců s mírnou formou MPS I-S, a to až v čase diagnózy, tedy v 11 letech. Respirační obtíže ve smyslu častých respiračních infektů byly popisovány u 9/16 (56 %), a to častěji u MPS I-H v 8/11 (73 %). Naopak u formy MPS I-S nejsou respirační obtíže charakteristické.
Kraniofaciální dysmorfie (obr. 1) byla přítomna u 21 z 24 pacientů, nejvýrazněji u pacientů s MPS I-H (17/17) a u 4 z 5 pacientů s MPS I-HS. U sourozenců s MPS I-S byly změny natolik diskrétní, že je nehodnotíme jako dysmorfické. U 15 pacientů z 19 (79 %) se vyskytla makroglosie; u MPS I-H 11/12 (92 %); MPS I-HS 4/5 (80 %); MPS I-S 0/2. Makrocefalie byla popsána u 11 z 21 pacientů MPS I. U formy MPS I-H byla popsána u 6/14 pacientů, kdy se u 2 nemocných stav zkomplikoval rozvojem hydrocefalu. Makrocefalie byla dokumentována i u všech pacientů s MPS I-HS. Většinou se jednalo o hraniční nálezy a ani v jednom případě nebyl přítomen hydrocefalus. U pacientů s nejmírnější formou nebyla makrocefalie přítomna. Opoždění růstu bylo pozorováno u 10/20 pacientů u všech forem MPS I. U všech pacientů s MPS I-H a MPS I-HS (21/21) byly vyjádřeny kostní změny charakteru dysostosis multiplex na rentgenových snímcích. U sourozenců s MPS I-S byly změny diskrétní, a to jen na rtg snímku pánve.
Opoždění psychomotorického vývoje bylo přítomno u 18 z 24 dětí, u všech pacientů s MPS I-H (17/17), a to od velmi lehkého opoždění až po hlubší stupeň retardace. U jednoho z 5 pacientů s MPS I-HS byla dokumentována výraznější psychomotorická retardace. Naopak u 3 pacientů s touto formou byl IQ (resp. DQ) stanoven v rozmezí 115 až 124. U jednoho sourozence s MPS I-S byla mentální úroveň hodnocena jako hraničně podprůměrná. Z neurologických obtíží byla dokumentována hypotonie a centrální koordinační porucha u několika pacientů v kojeneckém věku (5/11). Křeče se nevyskytly u žádného z našich pacientů. Syndrom karpálního tunelu se objevil u 7 z 23 pacientů (30 %) – 3 s MPS I-H, 3 s MPS I-HS a 1 s MPS I-S. Ztuhlost a kontraktury na prstech horních končetin byly popsány u 19 z 22 pacientů (86 %). Porucha sluchu až hluchota byla prokázána u 9/18 pacientů – 6/11 u MPS I-H; 3/5 u MPS I-HS a 0/2 u MPS I-S. Až na 2 pacienty (18/20, tj. 90 %) měli všichni již popsané střádavé změny v rohovce, projevující se jako zákal rohovky. U nejtěžší formy MPS I-H byly tyto změny popsány u 12/13 (92 %); u všech 5 pacientů s MPS I-HS (100 %) a u jednoho s MPS I-S (50 %).
Biochemické, enzymologické a molekulárně genetické analýzy
V tabulce 3 jsou uvedeny výsledky biochemických, enzymologických a molekulárně genetických analýz. U všech pacientů byla výrazně zvýšená exkrece GAG v moči oproti kontrolním hodnotám příslušných věkových skupin.
Měření aktivity α-L-iduronidázy v leukocytech izolovaných z periferní krve pacientů prokázalo výrazně sníženou specifickou aktivitu v rozmezí 0 až 0,3 nmol/hod/mg proteinu (n = 24), aktivita u kontrol je v rozmezí 18,8 do 55,4 nmol/hod/mg proteinu. Mezi pacienty jednotlivých forem MPS I nejsou signifikantní rozdíly.
Molekulárně genetické vyšetření genu pro MPS I identifikovalo mutované alely u 22 pacientů ze souboru. Mutace p.W402X a p.Q70X byly nejfrekventovanější a byly zastoupeny ve 30,2 %, resp. 20,9 %. Další četnější mutace byly p.V620F, c.1650+5G>A a u sourozenců s MPS I – S p.Q380R. Pacienti s fenotypem MPS I-HS byly složení heterozygoti s jednou alelou p.W402X, resp. p.Q70X.
Léčba
V tabulce 1 jsou uvedeny údaje o léčbě pacientů. Osm pacientů podstoupilo transplantaci hematopoetickými kmenovými buňkami (HSCT). Z nich 6 mělo formu onemocnění MPS I-H a dva MPS I-HS. Enzymová terapie (ERT) rekombinantně připravenou α-L-iduronidázou, která je komerčně dostupná pod názvem Aldurazyme®, byla indikována u 8 dětí: u 3 s MPS I-H, u 3 s MPS I-HS a u dvou s MPS I-S. Dvě děti s MPS I-H, u kterých byla indikována léčba HCST, dostávaly enzym pouze několik měsíců do doby, kdy se ukázalo, že transplantace je úspěšná.
DISKUSE
Výskyt a dělení
Ačkoliv výskyt jednotlivých LSD je poměrně nízký (cca 1 : 25 000–500 000), celkový výskyt všech LSD v populaci se odhaduje na více než 1 : 3500, čímž se řadí mezi nejčastější metabolická onemocnění. Incidence MPS I se odhaduje na 1 : 100 000–150 000 [10]. V České republice a na Slovensku bylo za posledních 25 let diagnostikováno celkem 24 dětí s MPS I. Frekvence MPS I, stanovená podle použité metody uvedené v citaci [11], je 0,72 : 100 000 v České republice a 1,32 : 100 000 na Slovensku [3]. Tato data jsou v souladu s dosud publikovanými studiemi – Moore udává prevalenci 1,07 : 100 000 v Anglii a Walesu; 0,77 : 100 000 [12] v Britské Kolumbii v Kanadě; 1,19 : 100 000 v Nizozemí [11]; 0,69 : 100 000 v Německu [10]. V české populaci tvoří MPS I spolu s MPS III více než polovinu všech pacientů s diagnózou mukopolysacharidózy.
V naší studii je poměr chlapců a děvčat 13 : 11. V mezinárodním registru pacientů s MPS I – MPS I Registry [13] – je evidováno 888 pacientů z celého světa s rozložením muži:ženy v poměru 439 : 449. Poměr podle pohlaví zcela odpovídá autozomálně recesivnímu typu dědičnosti. Rozdělení podle formy (závažnosti) onemocnění na MPS I, typy H : HS : S je v naší studii 17 : 5 : 2, což představuje 70,8 % : 20,8 % : 8,4 %. Tento poměr také odpovídá výsledkům zahraničních prácí v různých populacích: 72,9 % : 20,9 % : 6,2 % [14]. V MPS I Registry připadá na 62,5 % pacientů MPS I-H, 25,8 % MPS I-HS a 11,7 % MPS I-S (údaje z února 2010). Výrazný nepoměr k méně závažné formě MPS I-S neodpovídá pravděpodobně nižší prevalenci onemocnění, je spíše ovlivněn snazší diagnostikou u pacientů s těžkou formou MPS I-H, zatímco řada pacientů s mírnou formou onemocnění může být vedena pod nesprávnou diagnózou. Obvyklé chybné diagnózy na základě klinických symptomů zahrnují (juvenilní) revmatoidní artritidu, artrogrypózu, sklerodermii a další degenerativní onemocnění a autoimunitní choroby.
Klinické příznaky
Pacienti s MPS I mají velmi široké spektrum příznaků, postihující různou tíží mnoho orgánových systémů. Dosud je užíván systém členění na 3 formy podle tíže onemocnění, ačkoliv klinické projevy u pacientů s MPS I představují spíše kontinuální spektrum příznaků. První projevy onemocnění i věk při diagnóze jsou časnější u dětí s nejtěžší formou MPS I-H (syndrom Hurlerové). U dětí s MPS I-H se v kojeneckém věku objevuje hepatomegalie, kraniofaciální dysmorfie, makroglosie, pupečníková i inguinální hernie, protruze sterna a kyfóza až gibbus v oblasti Th/L přechodu a zákal rohovky. Přes výrazné klinické projevy onemocnění je diagnostika MPS I-H často opožděná o 6–12 měsíců, obvykle až do batolecího věku. Přitom na včasné diagnóze závisí i úspěch léčby. Naopak u dětí s nejlehčí formou MPS I-S se první příznaky manifestují přibližně ve 4–5 letech, ale pro jejich plíživost bývá správná diagnóza často opožděna až do staršího školního věku. U dětí s MPS I-S se v předškolním věku objevuje drápovitá ruka s kontrakturami interfalangeálních kloubů, později i syndrom karpálního tunelu a systolický šelest z postižení srdečních chlopní.
U většiny našich pacientů byla přítomna kraniofaciální dysmorfie různého stupně (obr. 1), doprovázená makroglosií a makrocefalií, které vznikají v důsledku ukládání GAG v pojivových tkáních a chybné přestavby kostních struktur v orofaciální oblasti [15]. V případě kostních změn charakteru dysostosis multiplex se jedná o defekty strukturní remodelace rostoucí kosti. Patří mezi ně četné deformity dlouhých kostí, změněné metakarpální kůstky či dysplastické hlavice stehenních kostí. Proto rtg vyšetření skeletu pomáhá při diagnostice, i když jednotlivé rtg změny nemohou odlišit různé typy mukopolysacharidóz. Typickým nálezem je deformovaná sella tvaru J na lebce v boční projekci. Obratlová těla na rtg boční páteře mívají ovoidní tvar se zobcovitě vytaženou přední stranou, kterým se říká „rybí obratle“. Tvar žeber připomíná vesla – zúžení u obratlového konce a rozšíření u sternálního zakončení [16]. U čtvrtiny našich dětí s MPS I byla prvním příznakem dysplazie kyčlí zapříčiněná deformitami pánve. K akutním komplikacím patří míšní poranění v důsledku spondylolistézy a nestabilita atlantookcipitálního spojení způsobená dysplazií čepu druhého krčního obratle. U dvou těžce postižených dětí s MPS I-H jsme museli řešit i komunikující hydrocefalus.
Závažnou komplikací je progresivní cervikální myelopatie, která vyžaduje neurochirurgickou dekompresi míchy [17]. Kraniofaciální dysmorfie, změny v nazo - a orofaryngu a dysplastické změny krční páteře představují vysoké riziko při anestezii, kdy intubace a extubace jsou obtížné a záklon hlavy je omezený.
Porucha růstu se objevila u necelé poloviny našich pacientů, především s MPS I-H. Časté je abnormální zakřivení páteře. Progresivní artropatie projevující se kontrakturami v kolenních a loketních kloubech bývá patrná již od věku 2–3 let. Klouby jsou postiženy symetricky, zpočátku bez známek bolesti či zánětu [18]. Jemná motorika ruky je zhoršena a může se vyvinout tzv. „drápovitá ruka“, kterou jsme pozorovali u 86 % pacientů (obr. 3). Pacienti s MPS IV vykazují naopak hypermobilitu a hypotonii. U více než jedné třetiny dětí s MPS I byl přítomen syndrom karpálního tunelu, většina z nich byla indikována ke korekčnímu chirurgickému výkonu.
Obr. 3. Vlevo – typická „drápovitá“ ruka u pacienta s MPS I. Vpravo – hypermobilita a hypotonie ruky u pacienta s MPS IV. Fig. 3. On the left is the typical “clawlike hand” in a patient with MPS I. On the right there is hypermobility and hypotonia of the hand in a patient with MPS IV. 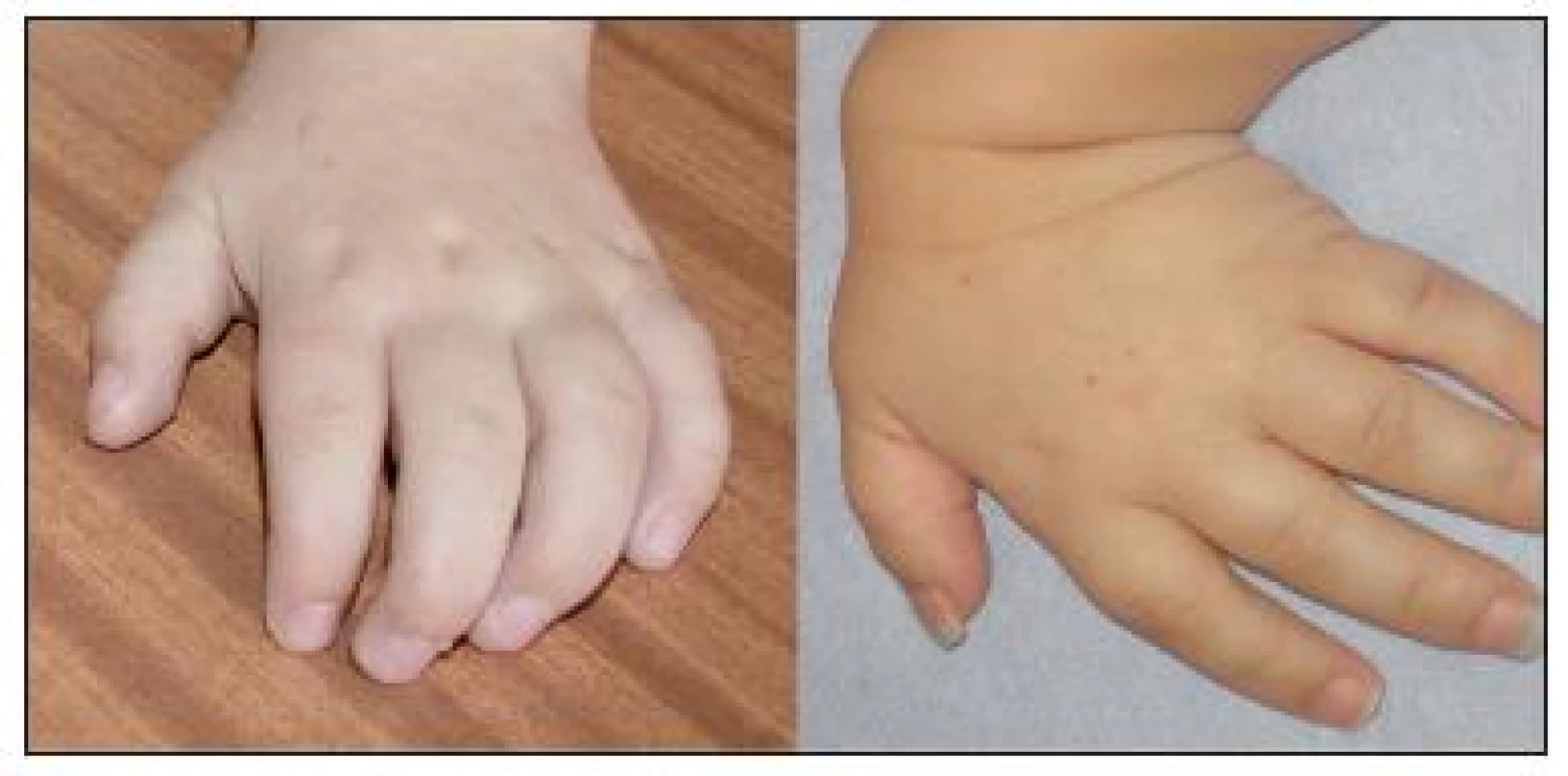
Postižení kostí a kloubů u dětí s MPS I vede k horšící se schopnosti chůze na delší vzdálenost, kterou lze monitorovat tzv. „6minutovým testem chůze“, při kterém je měřena vzdálenost, kterou pacient ujde po rovině za 6 minut. Tento test se používá i k monitorování úspěšnosti léčby. U dětí s MPS I bez úspěšné léčby porucha hybnosti progreduje a pacienti končí na invalidním vozíku [18].
V 90 % případů byly popisovány inguinální a/nebo umbilikální hernie (obr. 2), které mohou recidivovat. U těžkých forem vznikly v prvních měsících života, u mírnějších forem se vyskytují vzácně a jsou spíše diskrétní. Jsou důsledkem kombinace zvýšeného nitrobřišního tlaku zejména díky hepatosplenomegalii (u více než 90 % našich pacientů) a oslabené pojivové tkáně břišní stěny [19]. To dokládá i naše sledování, ve kterém převládaly umbilikální hernie (95 %).
U dvou třetin našich pacientů byly přítomny střádavé změny na srdečních chlopních způsobené akumulací GAG. Nejčastějším nálezem byly insuficience a stenózy na mitrální a aortální chlopni. Pozdějším nálezem bývá hypertrofická kardiomyopatie a srdeční nedostatečnost [20], kterou jsme v našem souboru pozorovali u 80 % pacientů s MPS I-H.
Zejména u dětí s těžší formou MPS I-H došlo k těžšímu opoždění psychomotorického vývoje. Z literatury je známo, že u nejvíce postižených dětí se po dosažení 6. měsíce věku vývoj kognitivních a motorických funkcí zpomalí, přechodně dochází k zástavě psychomotorického vývoje a nakonec (cca ve věku kolem 5 let) je pozorován regres ve vývoji. Řečové dovednosti jsou také omezeny ztrátou sluchu a makroglosií. U některých dětí se rozvine těžká spasticita nebo mozečková ataxie. Epilepsie není většinou u MPS I popisována. U mírných forem nebývá ovlivnění psychomotorického vývoje tolik vyjádřeno. U našich MPS I-S pacientů byl popsán hraničně podprůměrný intelekt [21].
Typickým znakem u MPS I, kterým se odlišuje od MPS typ II, je zákal rohovky, který byl přítomen u 18 našich pacientů. Zákal rohovky bývá zpočátku pouze periferní se zachováním dobré zrakové ostrosti, ale obvykle progreduje. V některých případech se vyskytne glaukom. Degenerace pigmentového epitelu sítnice je doprovázena zhoršeným periferním viděním a noční slepotou [22, 23].
Chronická serózní rýma a časté recidivy mezotitid se vyskytovaly v našem souboru u dvou třetin dětí. Hypertrofii adenoidní tkáně, která je projevem střádání, je nutno řešit adenotomií, často i opakovaně. Střádání GAG v orofaryngu, dysostóza ušních kůstek, poškození sluchového nervu a opakované mezotitidy způsobují částečnou nebo úplnou ztrátu sluchu. V našem souboru se porucha sluchu nebo hluchota vyskytla u 9/18 pacientů. Senzorineuronální hluchota může být zlepšena pomůckami (naslouchadla), ačkoli mentální úroveň pacienta je někdy limitující pro využití tohoto zařízení [24, 25].
Diagnostika a laboratorní nálezy
V případě klinického podezření na mukopolysacharidózu je prvním diagnostickým testem kvantitativní stanovení GAG v moči a kvalitativní vyšetření pomocí elektroforetické analýzy. Všichni naši pacienti měli výrazně zvýšený obsah celkových GAG v moči, zejména dermatansulfátu a heparansulfátu [26]. Se zvyšujícím se věkem dochází k přirozenému snižování vylučování GAG v moči. Abychom zabránili falešně negativnímu výsledku na základě nízko zkoncentrované moči, je nutný odběr ranní porce nebo delší sběr moči. Z těchto důvodů je nutno mít na paměti, že fyziologický výsledek kvantitativního testu nevylučuje diagnózu MPS I. Diagnóza MPS I byla stanovena měřením specifické enzymové aktivity α-L-iduronidázy v izolovaných leukocytech z periferní krve a/nebo v kultivovaných kožních fibroblastech [27]. Při měření vzorků od pacientů s MPS I dosahovala aktivita nulových nebo velmi nízkých hodnot.
V naší studii byly nejfrekventovanější mutace p.W402X a p.Q70X, které celkem představují až 51 % stanovených mutací. Podle dostupné literatury patří tyto mutace mezi prevalentní kavkazské mutace a podobné frekvence byly stanoveny i ve studiích z Německa a Nizozemí [28]. Podle MPS I registru je frekvence těchto dvou mutací cca 49 %; ostatní zjištěné mutace měly frekvenci nižší než 10 % a ani námi nalezené mutace nevykazovaly vyšší zastoupení. Stanovení patogenní mutace umožňuje eventuální prenatální diagnostiku MPS I, která se v České republice provádí biochemickým i molekulárním vyšetřením nativních nebo kultivovaných choriových klků, event. kultivovaných amniocytů.
U MPS I neexistuje jasná korelace genotypu a klinického fenotypu. Je všeobecně přijímaným faktem, že kombinace dvou „nulových“ mutací vede k těžkému fenotypu, zatímco méně závažné formy jsou asociovány s alespoň jednou alelou vedoucí k nenulové zbytkové aktivitě enzymu [28–30]. Výsledný fenotyp však může být ovlivněn epigenetickými faktory a genetickým pozadím zahrnujícím funkční polymorfismy a haplotypy [28, 31, 32]. Práce popisující vztah genotypu a fenotypu na souboru pacientů s MPS I byla publikována v roce 2009 [9].
Léčba
Dlouhou dobu byla symptomatická léčba jedinou možností léčebné péče o pacienty s MPS I a mukopolysacharidózami vůbec. Byly prováděny transplantace srdečních chlopní, osteotomie a četné další ortopedické zákroky ke korekci kosterních abnormalit. Další postupy zahrnovaly užití naslouchadel, rehabilitaci a sociální terapii, u těžce nemocných pacientů v terminální fázi podporu dýchání a tracheostomii.
V roce 1980 byla provedena první úspěšná transplantace hematopoetických kmenových buněk. Do poloviny první dekády tohoto století podstoupilo transplantaci více než 400 pacientů s těžkou formou MPS I, zpočátku použitím kostní dřeně a později stále více s využitím pupečníkové krve. V současné době představuje transplantace hematopoetických kmenových buněk nejúčinnější léčbu především u pacientů s nejtěžší formou MPS I [33]. Podmínkou účinnosti transplantace je nejen HLA identický dárce v rodině nebo v registrech dárců, ale i včasná diagnostika onemocnění (obvykle do 2 let věku), tedy ještě před rozvojem psychomotorické retardace. Samotná HSCT však má i rizika. Retrospektivní studie ukázaly, že i přes výrazné zlepšení výsledků se úmrtnost pohybuje kolem 10 %. Literární údaje uvádějí u pacientů, kteří podstoupili transplantaci, zlepšení kloubní mobility, respiračních a srdečních funkcí a sluchu, ústup hepatosplenomegalie a obstrukce horních dýchacích cest, snížení frekvencí spánkové apnoe. Stabilizoval se zákal rohovky a došlo k zachování stávajícího intelektu [34]. Naopak střádavé změny na srdečních chlopních se zdají být rezistentní na transplantační léčbu a často dále progredují. Na kosterní změny charakteru dysostosis multiplex neměla transplantace žádný vliv [35]. Někteří pacienti museli podstoupit další ortopedické korekční operace i po úspěšné transplantaci.
V našem souboru bylo transplantováno celkem 7 pacientů. V případě HSCT bylo u 5 pacientů popsáno zlepšení klinických i laboratorních příznaků. Zaznamenali jsme normalizaci enzymatické aktivity v leukocytech, pokles exkrece GAG močí k fyziologickým hodnotám, ústup organomegalie, zlepšení hybnosti, snížení frekvence respiračních infektů. Nejvýznamnější přínos včasné a úspěšné HSCT však spočíval v tom, že psychomotorický vývoj dítěte dále pokračuje bez zpomalení. Naopak dysmorfické změny ani zákal rohovky se nezlepšily a ani známky střádání v srdci neustoupily. Dvě děti měly po HSCT závažné komplikace v podobě reakce štěpu proti hostiteli. Jeden chlapec zemřel měsíc po výkonu a u jednoho chlapce s pokročilou formou MPS I-H ani úspěšná HSCT již neovlivnila jeho nepříznivě probíhající regres vývoje.
Stanovení genetické podstaty onemocnění v 80. letech minulého století umožnilo vývoj a přípravu rekombinantní α-L-iduronidázy a rozvoj tzv. „enzyme replacement therapy“ (ERT, enzymová substituční terapie). Po zkouškách provedených na zvířecích modelech bylo intravenózní podávání enzymu zavedeno do terapie MPS I i u dětí. V současné době je používána rekombinantní varianta enzymu, která je komerčně dostupná pod názvem Aldurazyme®. Přípravek je aplikován jednou týdně v infuzi [36]. Jelikož enzym neproniká hematoencefalickou bariérou, neovlivňuje kognitivní funkce a postižení CNS, a proto je samostatná enzymoterapie indikována u mírnějších forem MPS I bez významného postižení funkcí mozku. ERT je však doporučena i u malých dětí s těžkou formou MPS I, které jsou v přípravě na transplantaci, a také v průběhu prvních 3–6 měsíců po úspěšné transplantaci. Tím se snažíme stabilizovat klinický stav dítěte a zabránit dalšímu zhoršení viscerálních a skeletálních příznaků. ERT je indikována i u některých pacientů s MPS I po HSCT, pokud se u nich v důsledku vzniku chimerismu dostatečně neupraví vlastní enzymatická aktivita [33, 37].
U 5 z našich 6 dětí s mírnějšími formami MPS I, které dostávají ERT, se klinický stav stabilizoval. Došlo k zlepšení hybnosti, k ústupu organomegalie a k poklesu vylučování GAG, ale nedošlo ke zlepšení mentálních funkcí, dysmorfických změn ani srdečních nálezů. Jedno dítě mělo při ERT alergickou reakci, kterou se podařilo dobře zvládnut kortikoidy a antihistaminiky, takže bylo možné pokračovat v další léčbě.
Ve fázi výzkumu je pravidelné intrathekální podávání ERT u pacientů s MPS I s postižením CNS. Studie vychází z předpokladu, že přímé podání enzymu do mozkomíšního moku může překlenout současný problém hematoencefalické bariéry. Zkouší se i perorální podávání substrát-inhibiční terapie pomocí malé molekuly, jejíž cílem je snížit v těle obsah prekurzorů pro GAG. Také genová terapie MPS I je stále jen ve fázi výzkumu [38].
Úspěšnost podávání rekombinantního enzymu nebo HSCT a celková prognóza dětí s MPS I je výrazně závislá na časné diagnostice. Dobrá povědomost o klinickém průběhu onemocnění pomáhá identifikovat postižené děti včas. Navíc je včasná diagnostika důležitá i pro genetické poradenství a eventuální prenatální diagnostiku v postižených rodinách.
Práce vznikla s podporou výzkumného záměru MSM 0021620806 a MSM 0021620849.
Došlo: 1. 2. 2011
Přijato: 18. 5. 2011MUDr. RNDr. Pavel Ješina, PhD.
Klinika dětského a dorostového lékařství 1. LF UK a VFN
Ústav dědičných metabolických chorob
Ke Karlovu 2
128 08 Praha 2
e-mail: paveljesina@seznam.cz
Zdroje
1. Hopwood JJ, Morris CP. The mucopolysaccharidosis. Diagnosis, molecular genetics and treatment. Review. Mol Biol Med 1990 Oct; 7(5): 381–404.
2. Martins AM, Dualibi AP, Norato D, et al. Guidelines for the management of mucopolysaccharidosis type I. Review. J Pediatr 2009 Oct; 155(4 Suppl): S32–S46.
3. Poupetová H, Ledvinová J, Berná L, et al. The birth prevalence of lysosomal storage disorders in the Czech Republic: comparison with data in different populations. J Inherit Metab Dis 2010 Aug; 33(4): 387–396. Epub 2010 May 20.
4. Pastores GM, Arn P, Beck M, et al. The MPS I registry: design, methodology, and early findings of a global disease registry for monitoring patients with Mucopolysaccharidosis Type I. Mol Genet Metab 2007 May; 91(1): 37–47. Epub 2007 Mar 2.
5. Wynn RF, Mercer J, Page J, et al. Use of enzyme replacement therapy (Laronidase) before hematopoietic stem cell transplantation for mucopolysaccharidosis I: experience in 18 patients. J Pediatr 2009 Jan; 154(1): 135–139.
6. Beck M. Therapy for lysosomal storage disorders. Review. IUBMB Life 2010 Jan; 62(1): 33–40.
7. Dembure P, Roesel R. Screening for mucopolysaccharidoses by analysis of urinary glycosaminoglycans. In: Hommes FA (ed). Techniques in Diagnostic Human Biochemical Genetics: A Laboratory Manual. New York: Wiley-Liss, Inc., 1991 : 77–86.
8. Young EP. Prenatal diagnosis of Hurler disease by analysis of alphaiduronidase in chorionic villi. J Inherit Metab Dis 1992; 15 : 224–230.
9. Vazna A, Beesley C, Berna L, et al. Mucopolysaccharidosis type I in 21 Czech and Slovak patients: mutation analysis suggests a functional importance of C-terminus of the IDUA protein. Am J Med Genet A 2009 May; 149A(5): 965–974.
10. Baehner F, Schmiedeskamp C, Krummenauer F, et al. Cumulative incidence rates of the mucopolysaccharidoses in Germany. J Inherit Metab Dis 2005; 28(6): 1011–1017.
11. Poorthuis BJ, Wevers RA, Kleijer WJ, et al. The frequency of lysosomal storage diseases in The Netherlands. Hum Genet 1999; 105 : 151–156.
12. Lowry RB, Applegarth DA, Toone JR, et al. An update on the frequency of mucopolysaccharide syndromes in British Columbia. Hum Genet 1990 Aug; 85(3): 389–390.
13. Pastores GM, Arn P, Beck M, Clarke JT, Guffon N, Kaplan P, Muenzer J, Norato DY, Shapiro E, Thomas J, Viskochil D, Wraith JE. The MPS I registry: design, methodology, and early findings of a global disease registry for monitoring patients with Mucopolysaccharidosis Type I. Mol Genet Metab 2007 May; 91(1): 37–47. Epub 2007 Mar 2.
14. Moore D, Connock MJ, Wraith E, et al. The prevalence and survival in Mucopolysaccharidosis I: Hurler, Hurler-Scheie and Scheie syndromes in the UK. Orphanet J Rare Dis 2008 Sep16; 3 : 24.
15. Keith O, Scully C, Weidmann GM. Orofacial features of Scheie (Hurler-Scheie) syndrome (alpha-L-iduronidase deficiency). Oral Surg Oral Med Oral Pathol 1990; 70(1): 70–74.
16. Chen SJ, Li YW, Wang TR, Hsu JC. Bony changes in common mucopolysaccharidoses. Zhonghua Min Guo Xiao Er Ke Yi Xue Hui Za Zhi 1996 May–Jun; 37(3): 178–184.
17. Kachur E, Del Maestro R. Mucopolysaccharidoses and spinal cord compression: case report and review of the literature with implications of bone marrow transplantation. Review. Neurosurgery 2000 Jul; 47(1): 223–228; discussion: 228–229.
18. Hamilton E, Pitt P. Articular manifestations of Scheie’s syndrome. Ann Rheum Dis 1992 Apr; 51(4): 542–543.
19. Arn P, Wraith JE, Underhill L. Characterization of surgical procedures in patients with mucopolysaccharidosis type I: findings from the MPS I Registry. J Pediatr 2009 Jun; 154(6): 859–864. Epub 2009 Feb 12.
20. Soliman OI, Timmermans RG, Nemes A, et al. Cardiac abnormalities in adults with the attenuated form of mucopolysaccharidosis type I. J Inherit Metab Dis 2007 Oct; 30(5): 750–757. Epub 2007 Jun 14.
21. Dusing SC. Developmental outcomes in children with Hurler syndrome after stem cell transplantation. Dev Med Child Neurol 2007 Sep; 49(9): 646.
22. Cáceres-Marzal C, García-Reymundo M, Solana J, et al. Decreased corneal opacity and improved vision in a patient with mucopolysaccharidosis I (Hurler-Scheie) treated with enzyme replacement therapy (laronidase, Aldurazyme). Am J Med Genet A 2008 Jul 1; 146A(13): 1768–1770.
23. Ashworth JL, Biswas S, Wraith E, et al. The ocular features of the mucopolysaccharidoses. Eye (Lond) 2006 May; 20(5): 553–563.
24. Gocer C, Linthicum FH Jr. Hurler disease. Otol Neurotol 2004 Jan; 25(1): 81–82.
25. Oghan F, Harputluoglu U, Guclu E, et al. Permanent t-tube insertion in two patients with Hurler’s syndrome. Int J Audiol 2007 Feb; 46(2): 94–96.
26. Tomatsu S, Montaño AM, Oguma T, et al. Dermatan sulfate and heparan sulfate as a biomarker for mucopolysaccharidosis I. J Inherit Metab Dis 2010 Apr; 33(2): 141–150. Epub 2010 Feb 17.
27. Fujibayashi S, Minami R, Ishikawa Y, et al. Properties of alpha-L-iduronidase in cultured skin fibroblasts from alpha-L-iduronidase - deficient patients. Hum Genet 1984; 65(3): 268–272.
28. Scott HS, Bunge S, Gal A, et al. Molecular genetics of mucopolysaccharidosis type I: diagnostic, clinical, and biological implications. Review. Hum Mutat 1995; 6(4): 288–302.
29. Beesley CE, Meaney CA, Greenland G, et al. Mutational analysis of 85 mucopolysaccharidosis type I families: frequency of known mutations, identification of 17 novel mutations and in vitro expression of missense mutations. Hum Genet 2001 Nov; 109(5): 503–511. Epub 2001 Oct 19.
30. Terlato NJ, Cox GF. Can mucopolysaccharidosis type I disease severity be predicted based on a patient’s genotype? A comprehensive review of the literature. Genet Med 2003 Jul–Aug; 5(4): 286–294.
31. Scott HS, Nelson PV, Litjens T, et al. Multiple polymorphisms within the alpha-L-iduronidase gene (IDUA): implications for a role in modification of MPS-I disease phenotype. Hum Mol Genet 1993 Sep; 2(9): 1471–1473.
32. Yogalingam G, Guo XH, Muller VJ, et al. Identification and molecular characterization of alpha-L-iduronidase mutations present in mucopolysaccharidosis type I patients undergoing enzyme replacement therapy. Hum Mutat 2004 Sep; 24(3): 199–207.
33. Muenzer J, Wraith JE, Clarke LA. Mucopolysaccharidosis I: management and treatment guidelines. International Consensus Panel on Management and Treatment of Mucopolysaccharidosis I. Pediatrics 2009 Jan; 123(1): 19–29.
34. Aldenhoven M, Boelens JJ, de Koning TJ. The clinical outcome of Hurler syndrome after stem cell transplantation. Review. Biol Blood Marrow Transplant 2008 May; 14(5): 485–498.
35. Valayannopoulos V, de Blic J, Mahlaoui N, et al. Laronidase for cardiopulmonary disease in Hurler syndrome 12 years after bone marrow transplantation. Pediatrics 2010 Nov; 126(5): e1242–e1247. Epub 2010 Oct 25.
36. Giugliani R, Rojas VM, Martins AM, et al. A dose-optimization trial of laronidase (Aldurazyme) in patients with mucopolysaccharidosis I. Mol Genet Metab 2009 Jan; 96(1): 13–19. Epub 2008 Nov 26.
37. Tolar J, Grewal SS, Bjoraker KJ, et al. Combination of enzyme replacement and hematopoietic stem cell transplantation as therapy for Hurler syndrome. Bone Marrow Transplant 2008 Mar; 41(6): 531–535. Epub 2007 Nov 26.
38. Munoz-Rojas MV, Vieira T, Costa R, et al. Intrathecal enzyme replacement therapy in a patient with mucopolysaccharidosis type I and symptomatic spinal cord compression. Am J Med Genet A 2008 Oct 1; 146A(19): 2538–2544.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2011 Číslo 4- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
-
Všetky články tohto čísla
- Srovnání podílů kojených dětí v Baby-friendly a ostatních porodnicích ČR v letech 2000 až 2006
- Mukopolysacharidóza I – klinické projevy u 24 dětí z České republiky a Slovenska
- Artériová mozgová príhoda v detskom veku
- Praktický přístup k enterální výživě v pediatrii – doporučení ESPGHAN
- Slovenský pediatrický kongres s medzinárodnou účasťou
- Poruchy příjmu potravy
- Onemocnění spojená s malabsorpcí
- 10. CELOSTÁTNÍ KONFERENCE DĚTSKÉ PNEUMOLOGIE
- Ostravský den preventivní pediatrie
- Pediatria pre prax – 51. pediatrické dni Bratislava, 14.–15. 4. 2011
- XIII. hradecké pediatrické dny Hradec Králové, 11.–12. listopadu 2011
- Pařízková J.: Nutrition, Physical Activity, and Health in Early Life. 2. vyd.
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Onemocnění spojená s malabsorpcí
- Mukopolysacharidóza I – klinické projevy u 24 dětí z České republiky a Slovenska
- Praktický přístup k enterální výživě v pediatrii – doporučení ESPGHAN
- Artériová mozgová príhoda v detskom veku
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



