-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Onemocnění spojená s malabsorpcí
Autori: J. Nevoral; R. Kotalová; J. Bronský
Pôsobisko autorov: Pediatrická klinika UK 2. LF a FN Motol, Praha
Vyšlo v časopise: Čes-slov Pediat 2011; 66 (4): 248-259.
Kategória: Vybrané kapitoly z nové učebnice Klinická pediatrie
1. POTRAVINAMI INDUKOVANÉ ENTEROPATIE
1.1 Celiakie
Celiakie (glutensenzitivní enteropatie, celiakální sprue, netropická sprue) je celoživotní autoimunitní onemocnění postihující děti i dospělé. Imunitní reakce je příčinou charakteristické léze sliznice tenkého střeva (atrofie klků, hyperplazie krypt a zvýšeného počtu intraepiteliálních lymfocytů), která vede k malabsorpci živin a při dostatečně dlouhém trvání způsobuje výraznou malnutrici. Onemocnění se vyskytuje u geneticky predisponovaných jedinců, kteří ve stravě přijímají prolaminy, tj. v alkoholu rozpustné bílkoviny bohaté na glutamin a prolin, jež jsou přítomny v pšenici, žitu a ječmenu. Prolamin v bílkovině pšenice (lepku neboli glutenu) se jmenuje gliadin.
Epidemiologie
Během posledních 15 let se dramaticky změnil pohled na celiakii, což bylo způsobeno zavedením nových sérologických testů s vysokou specificitou i senzitivitou – protilátky proti endomyziu (EmA) a protilátky proti tkáňové transglutamináze (anti - -tTG). Prevalence celiakie se dříve udávala 1 : 1000–1 : 3000, v současné době je 1 : 100–1 : 300, což je více než 12krát tolik při srovnání s prevalencí hodnocenou pouze na podkladě klinických příznaků a starších screeningových dat. Odhad prevalence v ČR je 1 : 200–1 : 250, tj. asi 40 000–50 000 nemocných celiakií v celkové populaci ČR, evidováno je však pouhých 10 %.
Patofyziologie
Celiakie je imunitně zprostředkovaná choroba vyžadující na jedné straně přítomnost gliadinu a na druhé straně jedince, který je schopen jej vnímat jako antigen. Zásadní roli v kontrole imunitní odpovědi jedince vnímavého na gliadin mají CD4+ T lymfocyty v lamina propria aktivované za přítomnosti gliadinu subepiteliálními antigen-prezentujícími buňkami nesoucími molekuly HLA-DQ2 kódované alelami (DQA1*0501 a DQB1*02) a výjimečně HLA-DQ8 (DQA1*0301 a DQB1*0302). Tyto aktivované T lymfocyty (přítomné výhradně v jejunálních biopsiích pacientů s celiakií a nikoliv u zdravých kontrol) identifikují tkáňovou transglutaminázou deamidované peptidy gliadinu jako antigen a spouští kaskádu imunopatologických reakcí vedoucích k lézi střevní sliznice. Toto selhání orální tolerance je provázeno řadou odchylek v kvantitativním i kvalitativním zastoupení imunokompetentních buněk včetně jejich mediátorů ve střevní sliznici a v krvi pacientů s celiakií.
Patologie
Přítomnost gliadinu ve stravě u vnímavého jedince vede k postupnému rozvoji morfologické léze střevní sliznice. Ta se vyvíjí od nepatrných odchylek v zastoupení počtu imunokompetentních buněk ve střevním epitelu a v lamina propria přes mírné změny architektoniky sliznice tenkého střeva až k závažné lézi – k atrofii střevních klků (obr. 1).
Obr. 1. V horní části normální histologický obraz sliznice tenkého střeva. V dolní části obraz atrofické sliznice při celiakii. 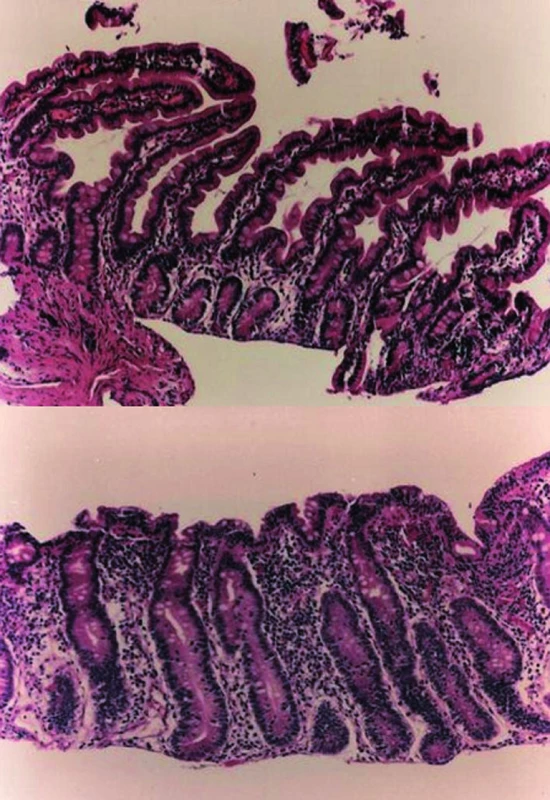
Těžká léze střevní sliznice je charakterizována snížením až vymizením klků jejunální sliznice (parciální až totální atrofií) provázené prodloužením krypt, v nichž je zvýšený počet mitóz. Enterocyty jsou snížené, kubického tvaru s jádry nepravidelně uspořádanými, jen na dně krypt bývá zachován jejich cylindrický tvar. Do destruktivních změn je začleněn i kartáčový lem enterocytů. Aktivity zde přítomných enzymů se následně snižují a event. i mizí. Mezi epiteliálními buňkami je zvýšený počet intraepiteliálních lymfocytů (IEL) – jedná se z 90 % o CD8+ T lymfocyty a v méně než 10 % o CD4+ T lymfocyty. Stoupá zde absolutní počet T lymfocytů nesoucích charakteristiky γ/δ. V lamina propria jsou zmnožené B i T lymfocyty, plazmocyty s IgA, IgG, IgM, buňky obsahující IgE, žírné buňky, eozinofilní, bazofilní leukocyty a další.
Při vyloučení glutenu ze stravy se sliznice obnovuje a po dlouhodobé dietě klky dosahují původní výšky. Obnovuje se aktivita enzymů kartáčového lemu enterocytů, jen laktáza v některých případech nedosahuje plné aktivity zvláště při vrcholcích klků. V epitelu klesá počet IEL, podíl γ/δ T lymfocytů zůstává však zvýšen i při jinak zhojené sliznici. V lamina propria je menší počet buněk než ve floridním stadiu. Popsaný morfologický obraz je pro celiakii charakteristický, ale není patognomický. Může být způsoben i jinými onemocněními – např. závažnými potravinovými alergiemi, nejčastěji na bílkovinu kravského mléka, dále virovými, bakteriálními a parazitárními infekcemi nebo některými imunodeficitními stavy. Více specifický pro celiakii je nález zvýšeného počtu γ/δ lymfocytů, ale zdaleka ne s absolutní specificitou a senzitivitou.
Genetika
Existuje silná asociace celiakie s určitým typem HLA antigenů II. třídy. HLA-DQ2 je nalézán u 90 až 95 % pacientů s celiakií a 5 % zbývajících pacientů má HLA-DQ8. HLA-DQ2 je však přítomen v populaci ve 20–30 %, ale jen přibližně u jednoho procenta se vyvine celiakie. Znamená to, že existují i další non-HLA geny nebo faktory nutné k rozvoji celiakie. Z výše uvedeného vyplývá, že stanovení HLA je nevhodný screeningový test pro vyhledávání pacientů s celiakií, používá se pouze u některých diagnosticky nejasných pacientů. Odhaduje se, že HLA antigeny II. třídy jsou odpovědny asi za 50 % vnímavosti k celiakii.
Klinický průběh
Klinické projevy onemocnění se v posledních dvou desetiletích podstatně změnily a jsou mnohem širší, než bylo původně uváděno. Ve stejném období byl pozorován také časový posun v začátku projevů onemocnění, které se častěji začalo manifestovat později, než tomu bylo dříve. Tato skutečnost se vysvětluje prodlouženou dobou kojení, pozdějším zaváděním lepku do jídelníčku a menším množstvím lepku, které děti konzumují. Některé studie ukazují, že zavádění lepku do jídelníčku kojence při současném kojení má preventivní vliv na rozvoj celiakie. Vliv ale mohou mít také další, dosud nepoznané faktory.
V současné době se rozeznává několik forem celiakie. Hovoří se o fenoménu ledovce, kdy dříve byla rozpoznávána jen klinicky manifestní celiakie jako viditelný vrchol ledovce (obr. 2).
Obr. 2. Fenomén ledovce. Klinická manifestace celiakie. Celiakie má mnoho forem. Klasická celiakie s průjmy je nyní méně častá než formy mimostřevní („atypické“). Jen část pacientů (vrchol ledovce) byla dříve diagnostikována na základě klinické symptomatologie. 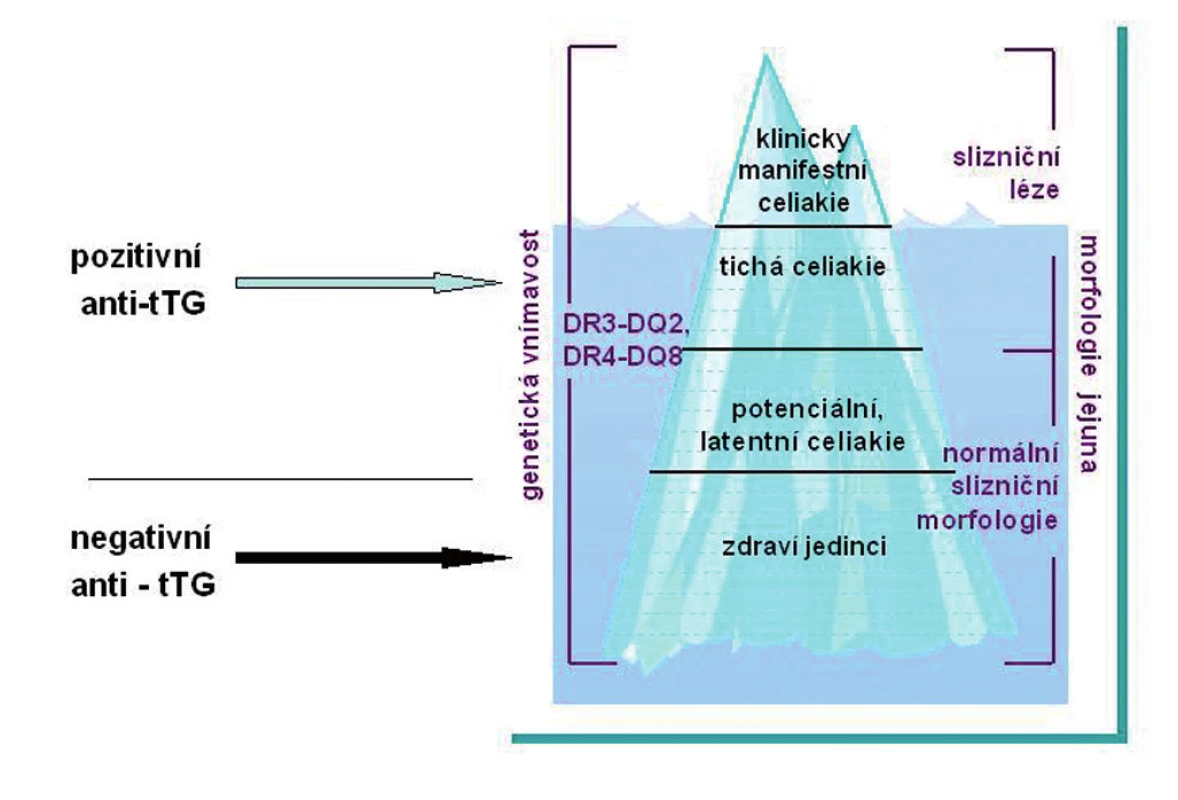
1.1.1 Klasická forma
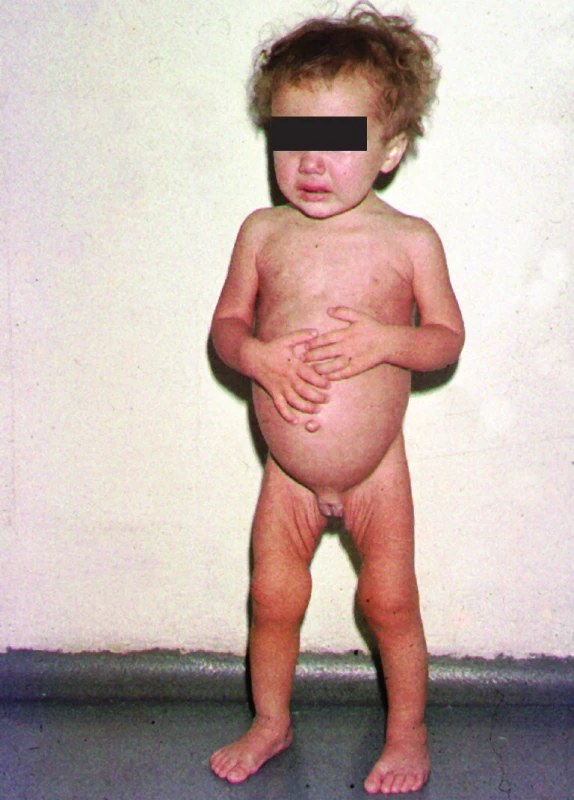
Tato forma celiakie má gastrointestinální symptomatologii. U dětí do dvou let je charakterizována především průjmy, neprospíváním, velkým břichem, hypotrofickým kosterním svalstvem, hypotonií, apatií, vzácněji může dítě trpět i zácpou a vytvářet tak podezření na Hirschsprungovu nemoc (obr. 3).
Děti s pozdním začátkem onemocnění od předškolního věku do dospělosti mohou mít průjmy, které jsou však ve svých projevech méně časté (do 12 %), více variabilní nebo intermitentní, trpí břišním diskomfortem, bolestmi břicha, nadýmáním, nauzeou, ale i zácpou a úbytkem na váze. Onemocnění celiakií s časným začátkem gastrointestinálních projevů u dětí mladších než dva roky bylo považováno za „klasické onemocnění“ a v této formě bylo také nejčastěji rozpoznáváno. Ve většině zemí se v současné době projevy onemocnění začínají objevovat nikoliv u kojenců a batolat, ale až u předškolních, školních dětí a dokonce v adolescenci a v dospělosti.
1.1.2 Mimostřevní forma celiakie
Možnost použití nových sérologických testů a aktivní vyhledávání pacientů umožnilo diagnostikovat celiakii s projevy jinými než gastrointestinálními.
Celiakie s mimostřevními projevy je stejně častá jako celiakie s gastrointestinálními symptomy.
a) Kostní a svalové projevy
Mezi dětmi vyšetřovanými pro malý růst je nalézáno asi 10 % dětí s celiakií, proto u každého dítěte s malým růstem musí být celiakie vyloučena. Jediným projevem celiakie může být také metabolická osteopatie (osteoporóza, malacie, patologické fraktury, defekty zubní skloviny, artritidy a myopatie) (obr. 4).
Obr. 4. Školní dítě s celiakií. Opoždění růstu a sexuálního zrání, žádný podkožní tuk, ale ve stoje vyklenutý podbříšek jako známka distenze střevních kliček. 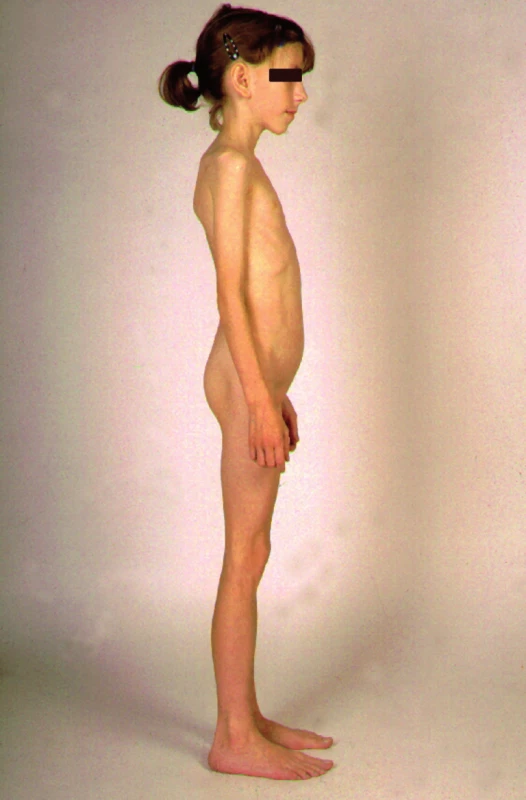
Obr. 5. Postup při diagnostice celiakie na základě doporučení ESPGHAN 1989. *V průběhu diagnostiky se zásadně mění symptomy a histologický nález v závislosti na konzumaci lepku. Proto je třeba diagnostiku provádět při stravě, která obsahuje lepek. # Doporučuje se stanovení protilátek proti tkáňové transglutamináze (anti-tTG) ve třídě IgA a stanovení celkového IgA. Asi u 3 % pacientů s celiakií je přítomen izolovaný deficit IgA a v těchto případech je třeba vyšetřit autoprotilátky ve třídû IgG. 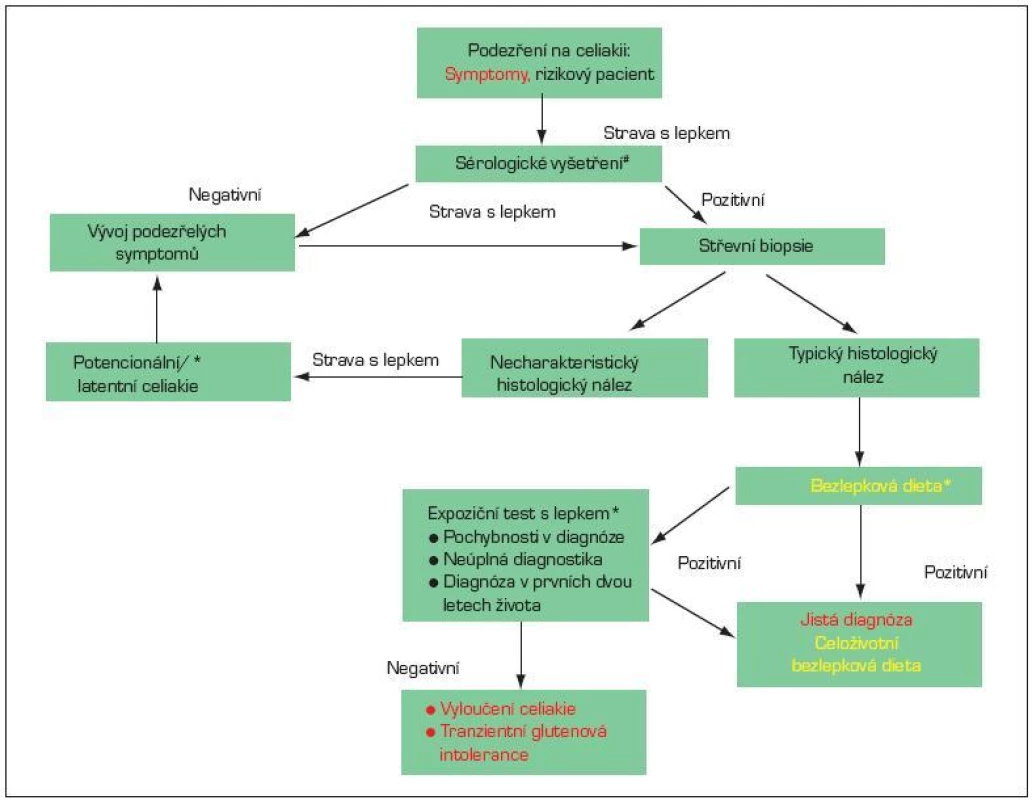
b) Kožní a slizniční projevy
Z kožních projevů celiakie je nejznámější dermatitis herpetiformis Duhring. Jedná se o velmi svědivé kožní papulopustulózní eflorescence na extenzorových stranách končetin, na zádech a hýždích. U dětí se onemocnění jen zřídka objevuje před druhým rokem života, častěji až po pátém roce věku. Onemocnění je často zaměňováno za atopický ekzém u dětí, i když lokalizace kožních změn a jejich charakter jsou jiné. U 80–90 % pacientů s tímto onemocněním histologické vyšetření sliznice tenkého střeva prokazuje změny charakteristické pro celiakii, většinou však nejsou příliš vyjádřené. Diagnóza herpetiformní dermatitidy vyplývá z nálezu na kůži a imunohistochemického vyšetření kožních eflorescencí (depozita IgA). Jak změny na sliznici tenkého střeva, tak kožní eflorescence dobře reagují na bezlepkovou dietu, část pacientů však musí k léčení kožních změn užívat ještě sulfony, někdy jen na přechodnou dobu.
Ke kožním a slizničním projevům celiakie patří též alopecie, vitiligo, aftózní stomatitidya vaskulitidy.
c) Hematologické projevy
Jediným příznakem celiakie může být např. na léčbu nereagující hypochromní anémie z nedostatečné resorpce železa, případně anémie z nedostatku vitaminu B12. Mezi dětmi s nevysvětlenou hypochromní anémií bylo nalezeno 6–12 % pacientů s celiakií.
d) Projevy v oblasti reprodukce
U děvčat bývají častější gynekologické poruchy, jako jsou pozdní menarché, amenorea (opožděná puberta může být i jediným příznakem onemocnění), spontánní potraty nebo stavy těžkého vyčerpání po porodu s projevy řady výše uvedených symptomů. Infertilita způsobená nerozpoznanou celiakií je udávána do 3 %.
e) Psychické a neurologické projevy
Psychické poruchy u pacientů s celiakií jsou poměrně časté, popisují se depresivní stavy, včetně endogenních depresí s těžkým průběhem a suicidálními tendencemi. Význam se přikládá nízké úrovni monoaminového metabolismu v centrálním nervovém systému. Některé peptidy (exorfiny) vzniklé štěpením lepku a kaseinu digestivními proteinázami mají opiátovou aktivitua předpokládá se jejich význam v patogenezi některých forem idiopatické schizofrenie. U nejasných případů endogenní deprese a idiopatické schizofrenie je proto vhodné vyloučit celiakii. U neléčené celiakie byla pozorována epilepsie s mozkovými kalcifikacemi, mozečková ataxie a periferní neuropatie.
f) Různé projevy celiakie
Celiakie se může projevovat zvýšenými hodnotami aminotransferáz. Izolované zvýšení hodnot aminotransferáz může být projevem jinak asymptomatické celiakie.
1.1.3 Tichá celiakie
Další formou je „tichá celiakie“, která nemá klinické projevy nebo jsou tak nevýrazné, že si je dotyčný neuvědomuje. Pacient má však pozitivní sérologické vyšetření a lézi na sliznici tenkého střeva. Nejčastěji bývá tato forma celiakie diagnostikována mezi příbuznými pacienta. Při terapii bezlepkovou dietou se někteří pacienti cítí lépe, protože vymizí nevýrazné symptomy, které sami nepovažovali za nemoc.
1.1.4 Latentní celiakie
Latentní celiakie se vyskytuje u osob, které měly v minulosti diagnostikovanou celiakii s charakteristickým nálezem na sliznici, který ustoupil po bezlepkové dietě. V dalším průběhu konzumují dlouhodobě stravu s lepkem, nemají žádné klinické projevy, mají pozitivní EmA a anti-tTG, ale normální histologický nález na sliznici tenkého střeva. V imunohistochemickém vyšetření je nález zvýšeného počtu intraepiteliálních T lymfocytů. Je známo, že někteří pacienti po léčbě bezlepkovou dietou tolerují přechodně potravu s lepkem, než se znovu vytvoří zánětlivé změny sliznice tenkého střeva charakteristické pro celiakii. Toto období může trvat šest i více let. Proto tito pacienti mají být dlouhodobě sledováni.
1.1.5 Potencionální celiakie
Osoby s potencionální celiakií dlouhodobě přijímají lepek ve stravě, nemají žádné klinické projevy, mají pozitivní EmA a anti-tTG, ale normální histologický nález na sliznici tenkého střeva. V imunohistochemickém vyšetření je nález zvýšeného počtu intraepiteliálních T lymfocytů. Tito jedinci jsou nalézáni nejčastěji mezi příbuznými pacientů s celiakií. Teprve po dlouhodobém příjmu lepku ve stravě nebo po jeho velkém množství nebo po přídatných patogenetických faktorech, jako jsou např. gastrointestinální infekce, se může plně rozvinout celiakie. Tito jedinci mají být sledováni a teprve při rozvoji klinické symptomatologie spolu s pozitivními sérologickými a histologickými nálezy na sliznici tenkého střeva je doporučována bezlepková dieta.
Přidružená onemocnění
S celiakií se sdružují především autoimunitní onemocnění. Výskyt celiakie u autoimunitních onemocnění je 10–30krát vyšší než v běžné populaci. Celiakie je často asymptomatická, nebo jsou její příznaky překryty symptomatologií druhého onemocnění. Je to především diabetes mellitus 1. typu (3–8 % pacientů s diabetem I. typu má také celiakii), autoimunitní tyroiditida (celiakie u více než 10 % nemocných). Riziko vzniku autoimunitního onemocnění se zdá být přímo úměrné době, po kterou byl lepek podáván. S celiakií se sdružují i jiná onemocnění, nejčastěji je to deficit sérového IgA (3 % všech pacientů s celiakií a 9 % všech pacientů s deficitem IgA má celiakii, tj. 10krát častěji v porovnání s ostatní populací), Downův syndrom (4–16 %), Turnerův syndrom (7–8 %). Není však doloženo, že pacienti s autismem mají častěji celiakii, a není proto žádný důvod rutinně testovat tyto pacienty na přítomnost celiakie.
Riziko maligního onemocnění u pacientů s celiakií je 2–3krát vyšší ve srovnání s ostatní populací, přičemž riziko non-Hodgkinského lymfomu střeva je pětkrát vyšší. Zvláště obávaným je T-lymfom sdružený s enteritidou u dospělých pacientů s refrakterní celiakií. Striktní bezlepková dieta se považuje za prevenci maligního onemocnění u pacientů s celiakií.
Závěrem lze říci, že klasický klinický obraz celiakie tradovaný v pediatrických učebnicích se v posledních desetiletích významně změnil, ubývá typických průběhů s manifestací v kojeneckém, resp. batolecím věku. Zlepšená diagnostika detekuje naopak řadu mimostřevních a tichých forem onemocnění s různými přidruženými onemocněními, která zasluhují stejnou pozornost.
Diagnostika
Diagnostika celiakie je založena na následujících kritériích:
- Typické klinické symptomy nebo laboratorní nálezy (např. anémie z nedostatku železa)
- Pozitivní protilátky proti tkáňové transglutamináze (anti-tTG) v séru, event. doplněné o protilátky proti endomyziu (EmA)
- Typická morfologie sliznice tenkého střeva
- Bezlepková dieta vede k úpravě klinického stavu a titru protilátek
Diagnóza je založena na kombinaci klinických známek, sérologického vyšetření protilátek, histologie sliznice tenkého střeva a v některých případech genetiky.
Sérologické vyšetření
V současné době je za nejlepší sérologické vyšetření k vyhledávání celiakie považováno stanovení protilátek proti rekombinantní lidské tkáňové transglutamináze ve třídě IgA a stanovení protilátek proti endomyziu ve třídě IgA (obr. 6).
Obr. 6. Pozitivní endomyziální protilátky v imunofluorescenčním mikroskopu. 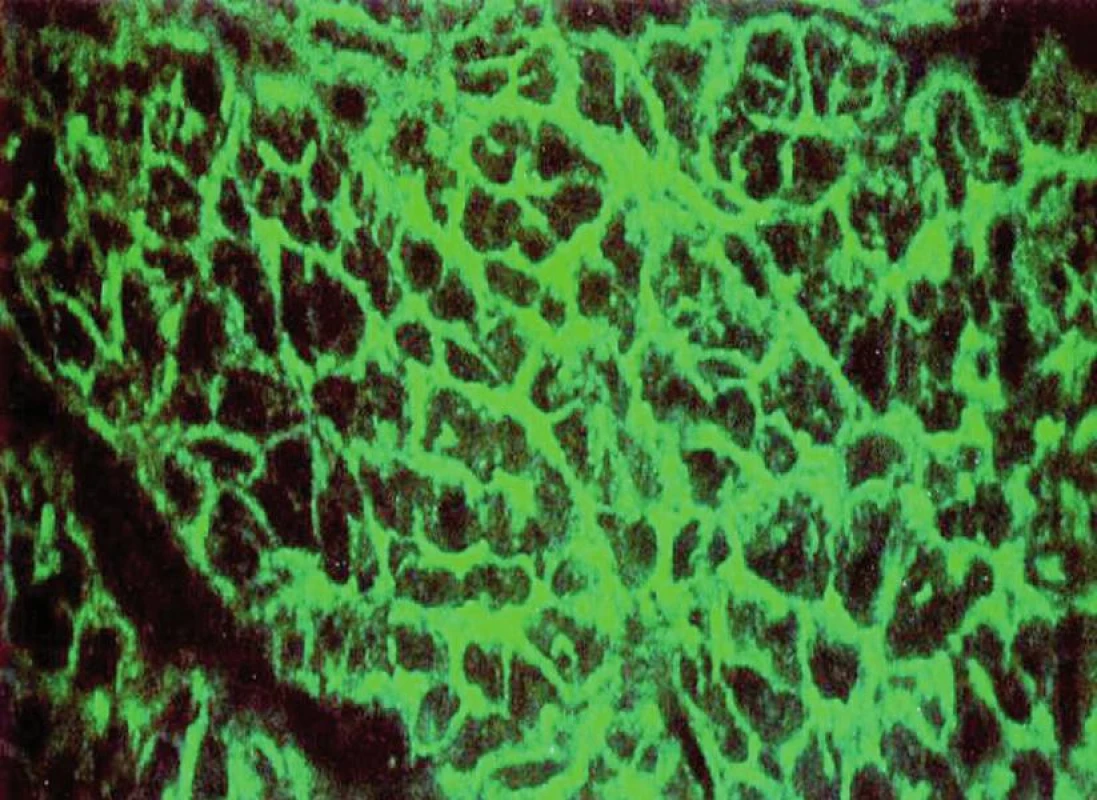
Vzhledem k tomu, že až 3 % pacientů s celiakií má deficit IgA, je nutné jako součást vyšetření stanovit celkovou koncentraci IgA v séru. U jedinců s deficitem IgA je potom třeba vyšetřit anti -tTG ve třídě IgG. Stanovení anti-tTG ve třídě IgA je výborným screeningovým vyšetřením celiakie, jejich pozitivita je indikací k provedení biopsie. Dříve používané protilátky proti gliadinu jsou v současné době považovány za překonané. Nověji se testují protilátky proti deamidovanému gliadinu.
Střevní biopsie
Zlatým diagnostickým standardem pro celiakii je biopsie sliznice tenkého střeva. Diagnóza celiakie musí být potvrzena biopsií, protože žádný ze sérologických testů nemá 100% spolehlivost. U malých dětí se provádí bioptickou sací kapslí, u větších dětí také gastroskopem (obr. 7). Histologický nález se klasifikuje podle Marshe, hodnotí se aktivity enzymů kartáčového lemu a stanovuje se též počet intraepiteliálních lymfocytů, jejichž zvýšený počet svědčí pro celiakii.
Kontrolní biopsie
Podle současných kritérií není potřeba provádět druhou kontrolní biopsii. Ta se dělá tehdy, pokud při bezlepkové dietě nedošlo ke klinické nebo laboratorní odpovědi, může být také provedena při latentní celiakii nebo chybějící compliance k dietě.
Expoziční test s lepkem
Zátěžový test lepkem je nutný při původně nedostatečné diagnostice, pochybnostech o diagnóze celiakie nebo u dětí, u kterých byla diagnóza stanovena před 2. rokem života. Asi u 5–10 % těchto dětí mohou mít histologicky zjištěné zánětlivé změny střevní sliznice jinou příčinu než celiakii (např. alergii na bílkovinu kravského mléka, virové a bakteriální střevní infekce, imunodeficitní stavy). Při zátěžovém testu se podává normální strava obsahující lepek vždy pod lékařskou kontrolou. Nové vyšetření se provádí po zátěži lepkem v době, kdy se objeví znovu symptomy nebo nejpozději 6 měsíců od zahájení expozičního testu. Nová pozitivita sérologického vyšetření může být potom doplněna novou biopsií. Pozitivita protilátek se může objevit vzácněji i se značným zpožděním (6 i více let) a nelze proto ze sledování vyřazovat pacienty, u kterých zůstaly protilátky negativní, po krátkodobém expozičním testu. Expoziční test je potřeba provádět u pacientů starších více než dva roky, pokud v době diagnózy zcela nesplňují výše uvedená diagnostická kritéria nebo mají nález, který vede k sebemenší pochybnosti o přítomnosti léze sliznice tenkého střeva na podkladě celiakie. Potřeba vyloučit falešně pozitivní diagnózy je stejně důležitá jako je správná diagnóza!
Screening celiakie
Pro vysokou prevalenci je celiakie jedním z nejdůležitějších onemocnění trávicího ústrojí. Vysoký výskyt jiných forem celiakie než formy klasické a významná rizika spojená s pozdní diagnostikou a terapií ve formě sdružených autoimunitních onemocnění a jejich závažných komplikací vyžaduje zavedení cíleného screeningu celiakie „za pacientem“. To znamená, že by měl být prováděn u rizikových onemocnění a rizikových skupin, u podezřelých symptomů, u autoimunitních onemocnění sdružených s celiakií a u možných komplikací celiakie. Screeningové vyšetření se provádí také u příbuzných prvního stupně diagnostikovaného pacienta (tab. 1).
Tab. 1. Kdo a co má být vyšetřováno na možnou celiakii. 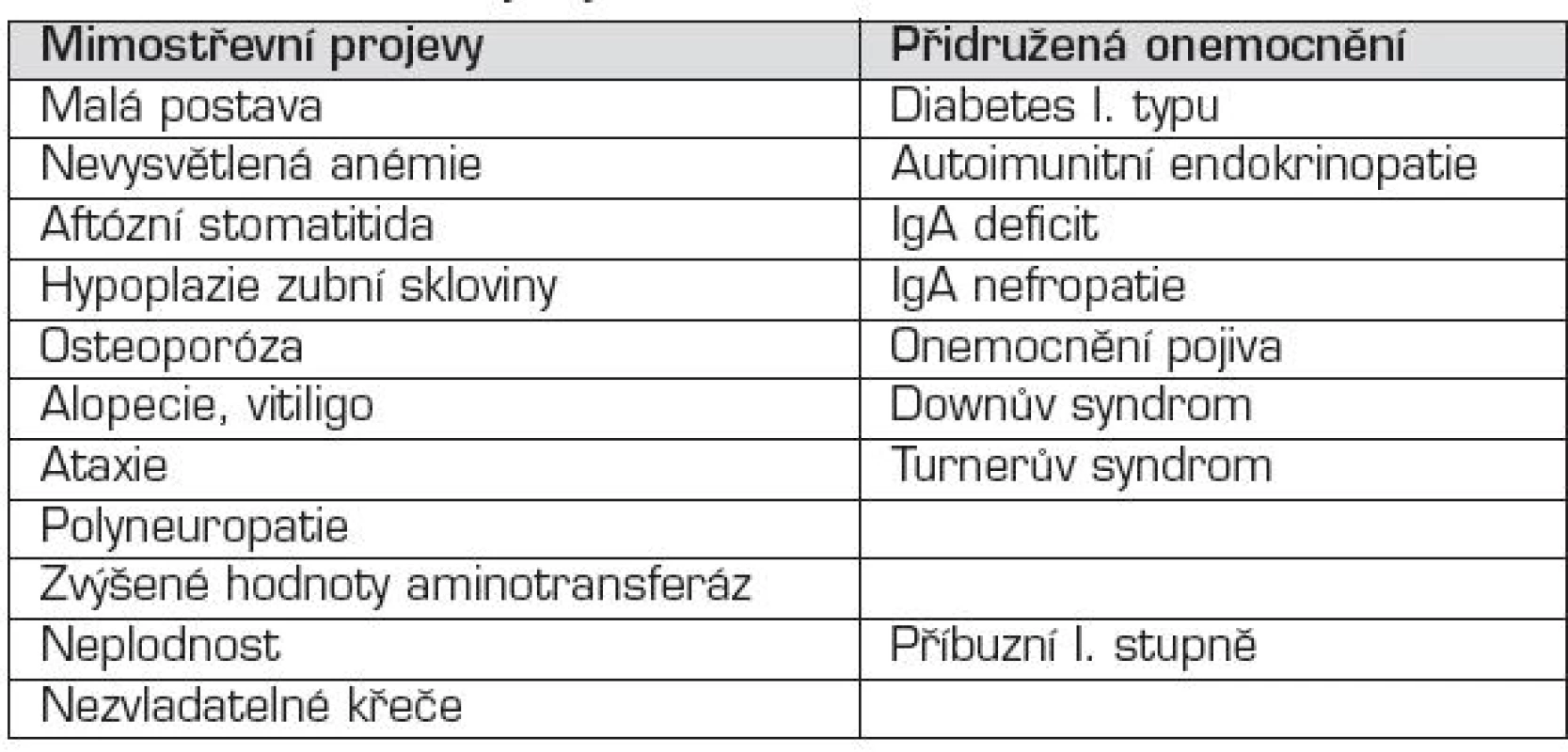
Léčba a prognóza
Léčba celiakie spočíváv celoživotní bezlepkové dietě. Ze stravy musí být vyloučeny všechny potraviny obsahující pšenici, žito a ječmen. Neškodnost ovsa je prokazována některými studiemi, z praktického hlediska však pro možnost kontaminace ve výrobě není ani oves doporučován jako součást bezlepkové diety. Jako náhrada se používá rýže, kukuřice, sója, pohanka. Potravinářské výrobky, které neobsahují lepek, jsou označovány logem přeškrtnutého klasu. Klinická odpověď na bezlepkovou dietu je často dramatická. Sliznice se normalizuje asi po šesti měsících jejího podávání. V atrofické sliznici jsou sníženy aktivity disacharidáz, doporučuje se proto nepodávatna přechodnou dobu mléčné výrobky. Dočasný deficit laktázy se rychle upravuje při bezlepkové dietě a mléko je obvykle dobře snášeno již za jeden měsíc po zahájení léčby. Novým pacientům se závažným průběhem onemocnění je nutné doplnit železo, magnezium, kyselinu listovou, vitamin B12 a v tucích rozpustné vitaminy. Compliance k bezlepkové dietě je třeba zejména u adolescentů udržovat pravidelnými kontrolami v jednoročních odstupech, velkou pomocí jsou rovněž sdružení pacientů, ve kterých se lze dobře informovat i o sortimentu bezlepkových potravin. Prognóza pacientů s celiakií při udržování striktní bezlepkové diety je výborná.
Hrubou chybou je zkusmé zavádění bezlepkové diety na zkoušku bez jakéhokoliv vyšetření, chybná je rovněž dieta u nedostatečně diagnostikovaných pacientů.
2. EXSUDATIVNÍ ENTEROPATIE
Ztráty bílkovin do trávicího traktu jsou přítomny u celé řady onemocnění, při kterých je poškozena sliznice infekčními i neinfekčními onemocněními. Může být však také důsledkem malformace nebo obstrukce střevního lymfatického systému. Rozlišení obou dvou patomechanismů je důležité pro léčbu (tab. 2).
Tab. 2. Onemocnûní spojená se zvýšenými střevními ztrátami bílkovin. 
Klinický obraz
Primární střevní lymfangiektázie jsou často provázeny malformovanými lymfatickými cévami kdekoliv v těle, jako je tomu u Turnerova syndromu a syndromu Noonanové. Při výraznějších ztrátách bílkovin, které již nemohou být kompenzovány syntézou albuminu v játrech, se objevují symetrické edémy z nedostatku bílkovin. Asymetrické edémy u primárních lymfangiektázií jsou způsobeny malformacemi periferních lymfatických cest. Hlavním projevem bývají průjmové stolice, gastrointestinální symptomy však mohou i chybět. U těžkých forem exsudativních enteropatií se tvoří ascites a chylotorax, přítomna může být porucha růstu. U onemocnění srdce může být v popředí kardiální symptomatologie.
Diagnostika
Diagnostika spočívá v pečlivé anamnéze, fyzikálním vyšetření a na laboratorních výsledcích. Při lymfangiektáziích jsou přítomny nízké hodnoty triacylglycerolů v krvi, lymfopénie 1,5 x 109/l, hypoalbuminémie a hypogamaglobulinémie. Jaterní funkce a funkce ledvin jsou v mezích normy. Nejlepší vyšetření k dokumentaci ztrát bílkovin střevem je clearanceα1-antitrypsinu ve stolici. K diagnóze může přispět horní endoskopické vyšetření s biopsiemi, kontrastní rtg vyšetření a scintigrafické vyšetření dextranem značeným 99mTechneciem. Vzácně se provádí u dětí lymfografické vyšetření. Indikováno je rovněž vyšetření endoskopickou kapslí. Sekundární střevní lymfangiektázie jako důsledek srdečního onemocnění jsou vzácné a bez anamnézy srdečního onemocnění se jen obtížně diagnostikují.
Léčba
Léčba je chirurgická u vrozených lymfangiektázií, pokud lze ohraničené úseky s lymfangiektáziemi odstranit. Konzervativní léčba spočívá ve výrazném omezení tuků s mastnými kyselinami s dlouhými řetězci a náhradě MCT tuky (triacylglycerolů se středně dlouhým řetězcem), v podávání bílkovinných doplňků, esenciálních mastných kyselin, vápníku a vitaminů. Při sklonu k infekcím jsou aplikovány parenterálně gamaglobuliny, při velkých edémech albumin, event. diuretika. Používán je také prednison pro jeho nespecifický účinek. Při selhání těchto opatření se používá octreotid nebo analoga heparinu u lymfangiektázií. V případě, že lymfangiektázie jsou přítomny jen v určité části střeva, lze zvážit resekci tohoto postiženého úseku.
3. STŘEVNÍ ENZYMOPATIE A TRANSPORTNÍ DEFEKTY
3.1 Malabsorpce disacharidů
V kartáčovém lemu enterocytů se nalézají různé enzymy, které dále hydrolyzují trávením vzniklé peptidy stejně jako disacharidy a oligosacharidy. Primární deficit disacharidáz musí být vždy odlišen od sekundárního deficitu, který vzniká při těžkém poškození sliznice různými mechanismy. U primárních forem deficitů je naopak zcela zachována architektura sliznice a je snížena pouze aktivita jednoho nebo dvou enzymů.
Patofyziologie
Při nedostatku enzymů v tenkém střevě jsou fermentovány neresorbované disacharidy bakteriemi v tlustém střevě za vzniku vodíku, metanu, kysličníku uhličitého, laktátu a mastných kyselin s krátkým řetězcem. Důsledkem je malabsorpce a osmotický průjem.
Klinický obraz
Symptomatologie bývá více nápadná u malých dětí než v dospělosti. K hlavním symptomům patří bolesti břicha, meteorismus, průjem, nevolnost a zvracení.
Diagnostika
Diagnóza je založena na anamnéze a převážně na neinvazivních testech:
- Vyšetření stolice: nízké pH stolice (<5), redukující substance (>0,5 %)
- Pozitivní dechový H2 test po perorální zátěži (laktóza, sacharóza, škrob), při kterém se současně sleduje klinická odezva u pacienta
- Stanovení aktivity enzymů ve sliznici (při speciálních indikacích)
- Vymizení symptomů po eliminaci disacharidů ze stravy
Pozn. Někdy používaný pojem „intolerance“odpovídá malabsorpci disacharidů a nesmí být zaměňován s alergií např. na bílkovinu kravského mléka.
Intolerance laktózy
Primární deficit laktázy
-
Malabsorpce laktózy s vrozeným deficitem
laktázy
Vrozená malabsorpce laktózy je velmi vzácné onemocnění, které se projevuje průjmem od okamžiku, kdy je dítěti podáno mléko včetně mateřského mléka. Stolice jsou vodnaté, pěnivé a kyselé. Postupně se rozvíjí metabolická acidóza, dehydratace a neprospívání. Onemocnění lze prokázat molekulárně genetickým vyšetřením. -
Malabsorpce laktózy s pozdním deficitem
laktázy
Adultní hypolaktázie je autozomálně recesivně dědičná a odpovídá fyziologickému procesu poklesu aktivity enzymu, který začíná po odstavení dítěte a manifestuje se od dětství po dospělost. Adultní hypolaktázie se vykytuje u Evropanů kavkazského plemene (20–25 %), Afroameričanů (80 %) a jižních Asiatů (100 %). Diagnózu lze potvrdit molekulárně genetickým vyšetřením nebo střevní biopsií. -
Přechodný nedostatek laktázy u nedonošených
dětí
U nedonošených dětí přetrvává až do 36. gestačního týdne relativně nízká aktivita laktázy.
Sekundární deficit laktázy
Vrozené deficity disacharidáz jsou vzácná onemocnění. Mnohem častější jsou sekundární deficity, které vznikají především u onemocnění spojených s atrofií klků sliznice tenkého střeva:
- Chronické průjmové onemocnění dětí
- Střevní infekce
- Potravinové alergie/eozinofilní gastroenteropatie
- Chronické zánětlivé střevní onemocnění
- Celiakie
- Imunodefekty
- Krátké střevo
- Marasmus, kwashiorkor
Pozor! Při intoleranci laktózy má být vždy sérologicky vyloučena celiakie!
K léčbě jsou u kojenců s vrozeným nebo získaným deficitem laktázy k dispozici bezlaktózová mléka nebo kojenecká výživa na bázi sóji. U jedinců s adultní hypolaktázií bývají lépe tolerovány jogurty, jejichž bakterie obsahují laktázu a sýry, ve kterých je méně laktózy, která byla spotřebována výrobním procesem. Existují rovněž bezlaktózová mléka a preparáty obsahující laktázu, které se přidávají do mléčných výrobků. Při omezeném příjmu mléčných výrobků je třeba vždy pečlivě dodávat vápník.
Deficit sacharázy-izomaltázy
Prevalence vrozeného deficitu je 1 : 5000. Jedná se o autozomálně recesivně dědičné onemocnění. Podle genetického defektu je známo 5 různých fenotypů onemocnění. Onemocnění se projevuje kyselými stříkavými stolicemi v době, kdy dítě dostane poprvé sacharózu nebo větší množství škrobu.
Klinická symptomatologie a diagnostika jsou podobné jako u deficitu laktázy. Léčba spočívá ve vyloučení sacharózy ze stravy. Tolerance sacharózy i škrobu se s věkem obvykle zlepšuje.
Deficit trehalázy
Autozomálně recesivně dědičné onemocnění. Trehaláza je především obsažena v houbách a řasách. Při nedostatku trehalázy se po požití hub dostaví bolesti břicha a průjem, stav může pak imitovat otravu houbami.
Deficit enterokinázy
Vzácné autozomálně recesivně dědičné, molekulárně geneticky diagnostikovatelné onemocnění, při kterém chybí enterokináza v kartáčovém lemu sliznice tenkého střeva. Enterokináza aktivuje trypsin a další proteinázy, ale také kolipázu. Při jejím nedostatku je těžce poškozeno trávení bílkovin a tuků, důsledkem jsou edémy z nedostatku bílkovin a neprospívání.
3.2 Transportní defekty
Většina selektivních transportních defektů jsou vzácná recesivně dědičná onemocnění, při kterých je transportní protein poškozen nebo chybí. Jsou známy transportní defekty pro monosacharidy, aminokyseliny, lipidy, žlučové kyseliny, minerály, stopové prvky a vitaminy.
Jejich klinický význam spočívá ve skutečnosti, že pokud nejsou rozpoznány a včas léčeny, mají trvalé až fatální následky. Transportní defekty mohou však vzniknout i sekundárně např. při závažném poškození střevní sliznice.
Abetalipoproteinémie
Jedná se o dědičnou poruchu lipidového metabolismu způsobenou defektní syntézou apoproteinu B vedoucí k absenci chylomikronů, VLDL a LDL v plazmě. K projevům onemocnění patří malabsorpce tuků, neuropatie, retinitis pigmentosa, ataxie, mentální retardace a akantocytóza.
Glukózo-galaktozóvá malabsorpce
Příčina je v mutaci SGLT1-genu na chromozomu 22q, který kóduje glukózový transportér závislý na natriu. Symptomatologie odpovídá vrozenému deficitu laktázy. Výživa dítěte je obtížná, protože glukóza je přítomna téměř ve všech sacharidech a tolerovány jsou pouze fruktóza a inulin (polysacharid fruktózy).
Malabsorpce fruktózy
Absorpce fruktózy je mnohem pomalejší v porovnání s glukózou a galaktózou. Při malabsorpci fruktózy se nejedná o defekt transportního mechanismu, nýbrž o individuálně nízkou transportní kapacitu, která zejména u malých dětí je příčinou recidivujících průjmů (průjmové onemocnění batolat). Průkaz se provádí dechovým testem po zátěži fruktózou v množství 1 g/kg, max. 25 g, při kterém je patrný patologický vzestup množství H2 ve vydechovaném vzduchu. Při pozitivním výsledku se test opakuje se sacharózou 2 g/kg, max. 50 g. Typicky u zdravého jedince při zátěži nedojde k vzestupu H2 ani k symptomům. Samotný vzestup H2 bez současných nebo následných symptomů je velmi častý a nestačí proto pro diagnózu.
Malabsorpce fruktózy bývá označována jako intolerance fruktózy, což může vést k záměně s hereditární intolerancí fruktózy, která je důsledkem autozomálně recesivního nedostatku fruktózo-1-fosfát-aldolázy. Při tomto onemocnění je perorální zátěžový test kontraindikován.
Léčebně se při pozitivní zátěži fruktózou (patologický dechový test a přítomnost symptomů) omezují potraviny, které vedou k převaze fruktózy nad glukózou (např. jablečný a hruškový džus, hroznové víno, švestky, fíky). Šťáva z hrušek a švestek obsahuje ještě také velké množství sorbitolu, který u predisponovaných osob vede k bolestem břicha a průjmu. Je-li test pozitivní i po zátěži sacharózou, je třeba biopticky vyloučit deficit sacharózo-isomaltázy.
Kongenitální chloridorea
Zmenšená resorpce chloridů v ileu a kolon vede k vodnatým stolicím. Děti jsou téměř vždy předčasně narozené, přítomen je hydroamnion. Břicho je vzedmuté, což může vést k záměně s vrozenou intestinální pseudoobstrukcí. U dítěte je patrná dehydratace s alkalózou s hyponatrémií, hypokalémií a hypochlorémií. Ve stolici jsou vysoké hodnoty chloridů (80–180 mmol/l, normální hodnota <25 mmol/l). Vylučování chloridů močí je nízké nebo neměřitelné.
Léčba spočívá v celoživotní substituci NaCl a KCl. Dávky pro kojence se pohybují v rozmezí 8–12 mmol Cl/kg/den a musí být individuálně přizpůsobeny. Potřeba susbstituce se s věkem zmenšuje.
Kongenitální natriumrhea
Jde o poruchu transportu natria, která se podobá poruše transportu chloridů. V alkalické stolici je velké množství natria a normální množství chloridů. Terapie spočívá v suplementaci natria ve formě citrátu nebo NaCl.
Acrodermatitis enteropathica
Acrodermatitis enteropathica je autozomálně recesivní onemocnění s defektem absorpce zinku. Existují také sekundární formy, kdy onemocnění může vzniknout v důsledku nedostatku zinku při jeho zvýšených ztrátách (např. krátké střevo, Crohnova nemoc), při jeho malé dodávce během parenterální výživy nebo při nedostatečné výživě.
Klinicky se projevuje erytémem, vezikobulózními nebo ekzému podobnými změnami v okolí konečníku, genitálu, na prstech, v okolí úst (obr. 8, 9). Postiženy mohou být i sliznice, což vede k průjmům. Na střevní sliznici je patrná subtotální atrofie se zánětlivými změnami, ale také prakticky normální nález. V krvi je nízká hladina zinku (ne vždy!), nízká hodnota esenciální kyseliny linolové a nízká aktivita enzymů závislých na zinku (např. alkalické fosfatázy).
Obr. 8. Kožní změny při acrodermatitis enteropathica. 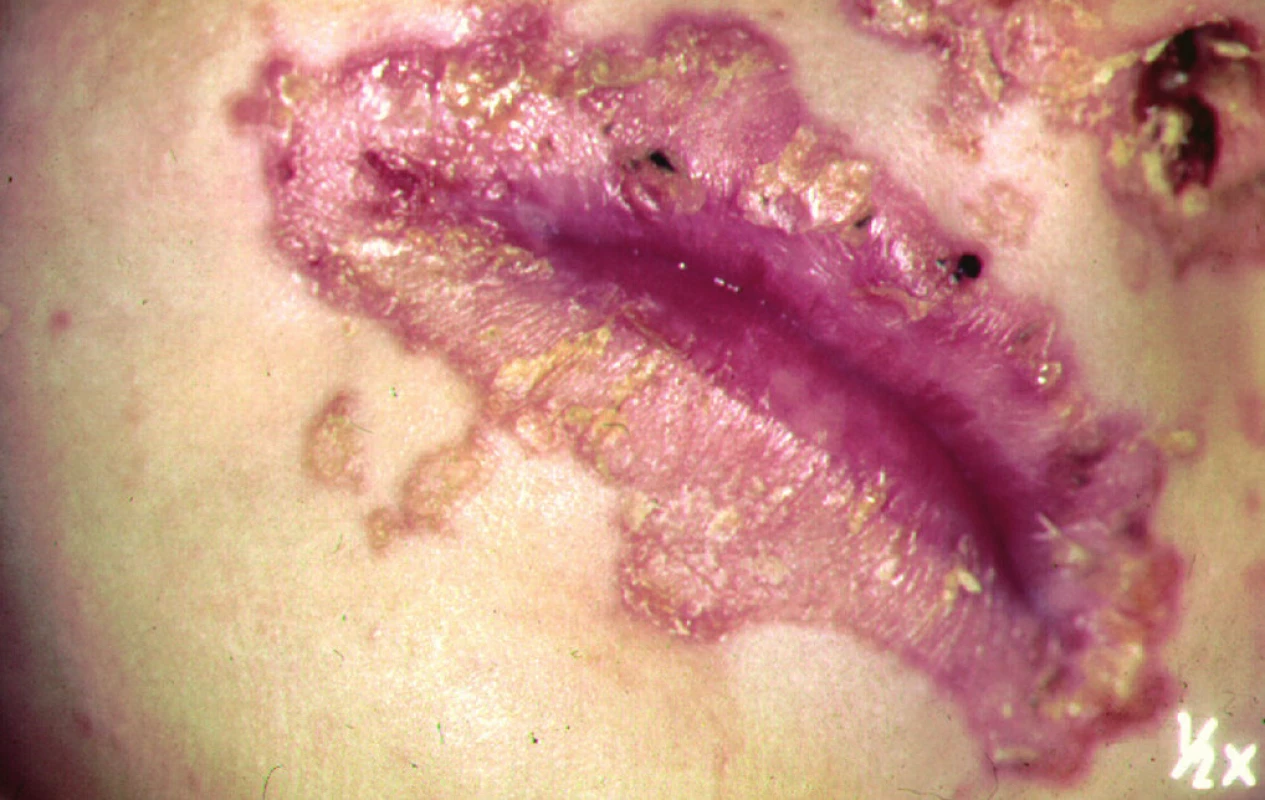
Obr. 9. Kožní změny při acrodermatitis enteropathica. 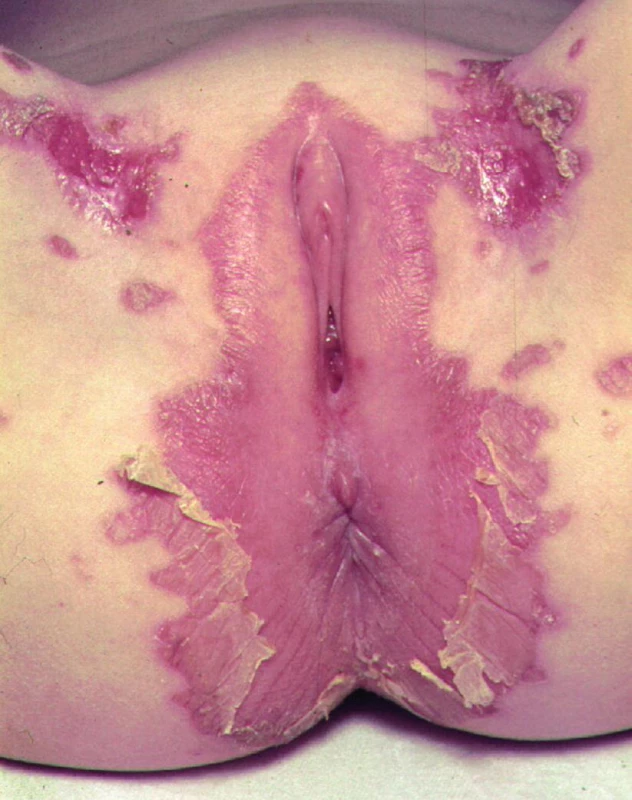
Terapie
Podávání individuálně přizpůsobené dávky zinku (30–45 mg elementárního zinku, což odpovídá 135–200 mg zinksulfátu, je relativně nezávislé na váze dítěte) vede k zhojení všech projevů onemocnění. Pro kompetitivní absorpci zinku a mědi musí být kontrolována hladina mědi v krvi. Substituční terapie je celoživotní. Během těhotenství je třeba přísná kontrola hladin zinku k prevenci malformací způsobených jeho nedostatkem.
Primární malabsorpce žlučových kyselin
Onemocnění vede k průjmům, nedostatku žlučových kyselin, neprospívání, steatorhee, nedostatku vitaminů rozpustných v tucích a hypoproteinémii. Mastné kyseliny s dlouhými řetězci musí být nahrazeny mastnými kyselinami se středně dlouhými řetězci (MCT tuky).
4. ENTEROPATIE PŘI IMUNODEFICIENCI
U některých imunodefektů může být průjmové onemocnění vedoucím příznakem. Patogeneticky hrají roli problémy s vývojem orální tolerance spolu s potravinovými alergiemi, autoimunitními mechanismy a infekcemi.
Mezi tato onemocnění patří:
- Selektivní nedostatek IgA – obvykle asymptomatický průběh, avšak možná je malabsorpce způsobená infekcí Giardia lamblia, enteropatií způsobenou bakteriálním přerůstáním a deficitem disacharidáz. Vyloučena musí být celiakie, u které je častý defeicit IgA.
- Agamaglobulinémie vázaná na X-chromozom – chronické rotavirové infekce, infekce Giardia lamblia, bakteriální přerůstání, bílkoviny ztrácející enteropatie.
- Variabilní imunodefekt (CVID) – malabsorpce se pozoruje asi u 10 % pacientů s pozdním začátkem onemocnění, často v důsledku infekce Giardia lamblia.
- Chronická granulomatóza – chronické průjmy někdy provázené steatorheou mohou být první manifestací onemocnění v dětském věku. Granulomatózní změny a zánětlivé striktury v celém trávicím traktu a perianální abscesy mohou vést k záměně s Crohnovou nemocí. Léčba spočívá v podávání antibiotik, antimykotik, kortikosteroidů, γ-interferonu, případně v transplantaci kostní dřeně.
- IPEX syndrom (immunodysregulation polyendocrinopathy
enteropathy X-linked syndrome)
- AIE typ 1. V prvních měsících života kombinace diabetu I. typu s těžkou, často hemoragickou exsudativní enteropatií. Příčinou je mutace ve FOXP3 genu, který je kritickou molekulou pro vytváření regulačních T lymfocytů. V laboratorním vyšetření jsou vysoké IgE hodnoty. Často jsou přítomny atopický ekzém a různé hematologické symptomy jako neutropenie, trombocytopenie nebo hemolytická anémie. Přítomna může být také glomerulonefritida, autoimunitní hepatitida a hypo - nebo hypertyreóza a další endokrinopatie.
- AIE typ 2. IPEX podobná varianta pozorovaná u chlapců i dívek. Mírnější forma exsudativní enteropatie většinou kombinovaná s vícečetnými autoimunitními fenomény, jako jsou celiakie, autoimunitní endokrinopatie, nebo s hematologickými onemocněními.
- AIE typ 3. Pouze střevní onemocnění bez přidružených systémových symptomů.
Při podezření na IPEX syndrom jsou indikovány gastroskopie a kolonoskopie, přítomny jsou oblasti s erytémem a erozemi. V histologickém nálezu je patrná slizniční atrofie s masivním zánětlivým infiltrátem v lamina propria (α/βlymfocyty na rozdíl od γ/δ lymfocytů u celiakie). V séru jsou nalézány výrazně zvýšené protilátky proti enterocytům ve třídě IgG a IgA. Současně bývá značně zvýšené celkové IgE. Terapie spočívá v podávání imunomodulačních léků a parenterální výživě. Léčba endokrinních onemocnění prodlužuje život. Léčba transplantací kostní dřeně je sporná.
- Infekce HIV – oportunní infekce včetně Cryptosporidium parvum, které může vyvolávat chronický sekreční průjem.
- Chemoterapie onkologických onemocnění – může způsobovat poškození střevní sliznice se sekundárním deficitem laktázy.
- Graft vs host disease po transplantaci kostní dřeně – může vyvolávat průjmy s malabsorpcí. Na sliznici tenkého střeva je patrná nespecifická atrofie klků provázená smíšenými zánětlivými infiltráty.
5. VROZENÉ INTESTINÁLNÍ SLIZNIČNÍ DEFEKTY
Jedná se o vzácná a závažná průjmová onemocnění, která začínají krátce po porodu nebo během prvních dvou let života a trvají i při vyloučení stravy. Primární strukturální změny enterocytů, kam patří vzácné hereditární enteropatie, lze diagnostikovat elektronopticky.
Do této skupiny onemocnění patří mikrovilózní inkluzní onemocnění (kongenitální mikrovilózní atrofie) a intestinální epiteliální dysplazie (tufting enteropathy). Kauzální terapie většinou sekrečního průjmu s velkými ztrátami vody a minerálů není možná. Děti jsou léčeny parenterální výživou nebo musí být provedena transplantace střeva.
6. SYNDROM KRÁTKÉHO STŘEVA
Vrozené krátké střevo je vzácné. Syndrom krátkého střeva je většinou důsledkem rozsáhlé resekce tenkého střeva (volvulus, nekrotizující enterokolitida, Crohnova nemoc a další). Po resekci vzniká porucha motility, sekrece, digesce a absorpce spojená s mnoha problémy.
Rozsah malabsorpce je dán délkou resekovaného střeva. Délka tenkého střeva u nedonošeného dítěte je 100–200 cm, u zralého novorozence 250 cm a u dospělého člověka 600–800 cm. Odhaduje se, že u resekce až do 50 % délky střeva lze brzy zahájit enterální výživu, při zbylé délce 20–50 % tenkého střeva je nutná dlouhodobá parenterální výživa, u resekcí se zbytkem střeva do 10 % lze úplné enterální výživy dosáhnout jen vzácně. Adaptace střeva ke zvýšení jeho resorpční kapacity musí být co nejdříve zahájena částečnou enterální výživou. Adaptační proces je kombinací nárůstu funkční kapacity ve zbylém střevě spolu s růstem střeva. Při ztrátě ileocékální chlopně je stav komplikován bakteriálním osídlením tenkého střeva mikrobiální flórou kolon s negativním dopadem na sliznici a absorpci žlučových kyselin.
Dlouhodobá parenterální výživa je příčinou velké morbidity způsobené katétrovými sepsemi, trombózami, metabolickými poruchami a jaterní cirhózou. Chirurgickou léčbou jsou prodlužovací operace na tenkém střevě a transplantace tenkého střeva.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2011 Číslo 4- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Gastroezofageální reflux a gastroezofageální refluxní onemocnění u kojenců a batolat
-
Všetky články tohto čísla
- Srovnání podílů kojených dětí v Baby-friendly a ostatních porodnicích ČR v letech 2000 až 2006
- Mukopolysacharidóza I – klinické projevy u 24 dětí z České republiky a Slovenska
- Artériová mozgová príhoda v detskom veku
- Praktický přístup k enterální výživě v pediatrii – doporučení ESPGHAN
- Slovenský pediatrický kongres s medzinárodnou účasťou
- Poruchy příjmu potravy
- Onemocnění spojená s malabsorpcí
- 10. CELOSTÁTNÍ KONFERENCE DĚTSKÉ PNEUMOLOGIE
- Ostravský den preventivní pediatrie
- Pediatria pre prax – 51. pediatrické dni Bratislava, 14.–15. 4. 2011
- XIII. hradecké pediatrické dny Hradec Králové, 11.–12. listopadu 2011
- Pařízková J.: Nutrition, Physical Activity, and Health in Early Life. 2. vyd.
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Onemocnění spojená s malabsorpcí
- Mukopolysacharidóza I – klinické projevy u 24 dětí z České republiky a Slovenska
- Praktický přístup k enterální výživě v pediatrii – doporučení ESPGHAN
- Artériová mozgová príhoda v detskom veku
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy