-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Tromboembolické príhody u novorodencov pohľadom dnešnej medicíny
Thromboembolism events in the newborn child from the point of view of present medicine
The incidence of thrombosis in childhood is very low in comparison to the adult population. Venous and arterial thromboses are rare diseases, being increasingly recognised and diagnosed not only in infants but also in newborns and premature newborns. Newborns, particularly the premature ones, are rather predisposed to bleeding complications due to the special properties of haemostatic system. Therefore every thrombotic event is a potentially serious condition which requires adequate diagnostic and therapeutic approach. It is very probable that most thromboembolic events occur in children, which have certain prothrombotic risk or may have met it. Acquired risk factors such as central vascular approaches, sepsis, perinatal infection and congenital heart defects are applied more frequently than congenital thrombophilic factors, with a smaller population incidence.
The following article describes the causes, clinical presentation and current management of thrombosis in neonates focusing on the clinically most relevant conditions.Key words:
thrombosis, neonate, antitrombotic treatment
Autoři: M. Grešíková
Působiště autorů: Klinika detskej hematológie a onkológie, Detská fakultná nemocnica s poliklinikou, Bratislava prednosta doc. MUDr. E. Kaiserová, CSc.
Vyšlo v časopise: Čes-slov Pediat 2011; 66 (5): 299-307.
Kategorie: Přehledový článek
Souhrn
Incidencia tromboembolických príhod v detstve je v porovnaní s dospelou populáciou nízka. Venózna a artériová trombóza je vzácnym, ale zvýšene rozpoznávaným a diagnostikovaným ochorením nielen v detskom veku, ale aj u novorodencov a prematúrnych detí. Vzhľadom na veku špecifické osobitosti hemostázy sú novorodenci, zvlášť predčasne narodení, predisponovaní skôr ku krvácavým komplikáciám. Preto každá trombotická epizóda je potenciálne vážnym stavom, vyžadujúcim vhodný diagnostický a terapeutický prístup. Je pravdepodobné, že väčšina tromboembolických príhod prebehne u detí, ktoré nesú nejaký rizikový faktor, alebo sa s ním stretnú. Získané rizikové faktory, ako centrálne cievne prístupy, sepsa, perinatálna infekcia a vrodené srdcové chyby, sa uplatnia častejšie ako vrodené trombofilné faktory, s menším populačným výskytom.
Článok opisuje príčiny, klinický prejav, aktuálny diagnostický a liečebný postup pri trombóze u novorodencov, so zameraním na najzávažnejšie stavy.Kľúčové slová:
trombóza, novorodenec, antitrombotická liečbaÚVOD
Tromboembolizmus (TE) v detskom veku je v porovnaní s dospelou populáciou ojedinelou situáciou, s nerovnomerným výskytom. Krivka incidencie má dva vrcholy: v období puberty a adolescencie, s pomermi hemostázy a rizikami TE, blízkymi dospelým, a prekvapivo v novorodeneckom období a u najmenších detí v prvom roku života, napriek špecifickým osobitostiam nezrelej hemostázy, naklonenej skôr ku krvácavým komplikáciám.
V poslednom období frekvencia TE udalostí narastá, a to z niekoľkých príčin [1]. Nové vyšetrovacie a liečebné postupy, najmä v intenzívnej medicíne umožňujúce záchranu, alebo dlhodobé prežitie detí s chorobami, alebo stavmi v minulosti fatálnymi, pri priamoúmerne zvyšujúcom používaní centrálnych cievnych prístupov. Cievne katétre, používané na podávanie liekov, dlhodobú parenterálnu výživu, aplikáciu krvných prípravkov, ale aj monitorovanie životne dôležitých funkcií a odber vzoriek krvi na vyšetrenia sú najčastejším získaným rizikovým faktorom, spojeným s trombózou v detskom veku. Lepšia dostupnosť a kvalita zobrazovacích vyšetrení vedie k zvýšenému spoznávaniu TE príhod a upozorňuje na ich poddiagnostikovanie v minulosti. Index podozrenia na TE sa zvýšil aj primárne, lepšou odbornou zdatnosťou lekárov rôznych odborov v jej predvídaní, a to vďaka novým vedomostiam o vrodených a získaných trombofilných stavoch [2]. V plnom rozsahu to platí pre pacientov novorodeneckého obdobia. Prežívajú zrelé aj nezrelé deti, so závažnými vrodenými chybami, vďaka úspešnému zvládnutiu stavov s perinatálnou asfyxiou, sepsou, so sprievodnou polyglobúliou, alebo naopak dehydratáciou, za pomoci centrálnych cievnych prístupov, ktoré sú najdôležitejšie rizikové faktory TE epizód v novorodeneckom období.
INCIDENCIA
Údaje o incidencii TE v novorodeneckom období poskytujú len niektoré národné registre. Získanie objektívnych údajov je ťažké pre malý počet pacientov zaradených do štúdií. Heterogénne príčiny TE u donosených aj nedonosených novorodencov, sprievodné ochorenia, či vrodené chyby, vývojové osobitosti hemostázy, variabilné klinické prejavy, aj klinicky nemé stavy sťažujú hodnotenie, a preto sa údaje z rôznych štátov rôznia.
Frekvencia TE príhod u novorodencov podľa kanadského registra z roku 2004 udáva 2,4 TE príhod/1000 novorodencov na jednotkách intenzívnej starostlivosti, nemecký register – 0,52/10 000 živorodených novorodencov [3], posledné publikované údaje z USA z roku 2011 sú podobné (0,51/10 000 novorodencov) [4]. Mortalita a morbidita nie sú u novorodencov definované. V kanadskom registri najčastejšou príčinou smrti bol trombus v pravej predsieni srdca, alebo vo vena cava superior (33 %), aj keď nie je jasné, či smrť nastala len vďaka trombóze. Incidencia rekurencie a neskorých komplikácií TE v novorodeneckom období je udávaná len v niektorých situáciách.
OSOBITOSTI HEMOSTÁZY U NOVORODENCOV
Hemostáza je dynamický proces s významnými odlišnosťami u novorodencov, znásobenými u prematúrnych detí (tab. 1). Vitamin-K-dependentné koagulačné faktory a faktory kontaktu sú znížené (na 30 až 50%-nú hodnotu dospelých) a zostávajú nižšie aj počas detstva (asi o 15 %). Naopak, hladina niektorých koagulačných faktorov je porovnateľná, aj zvýšená oproti dospelým (FVIII, von Willebrandov faktor, FV, FXIII). Prirodzené inhibítory hemostázy sú znížené na približne 25%-nú hodnotu dospelých. Kým hodnota antitrombínu (AT) a heparín-kofaktora II sa upraví počas ranného detstva (6. mesiac života), hodnota proteínu C (PC) a proteínu S (PS) môže byť ľahko znížená do adolescencie. Deficit prirodzených inhibítorov koagulácie kompenzuje inhibičný vplyv α2-makroglobulínu, ktorý je zvýšený oproti neskoršiemu obdobiu.
Tab. 1. Niektoré osobitosti primárnej a sekundárnej hemostázy u novorodenca. 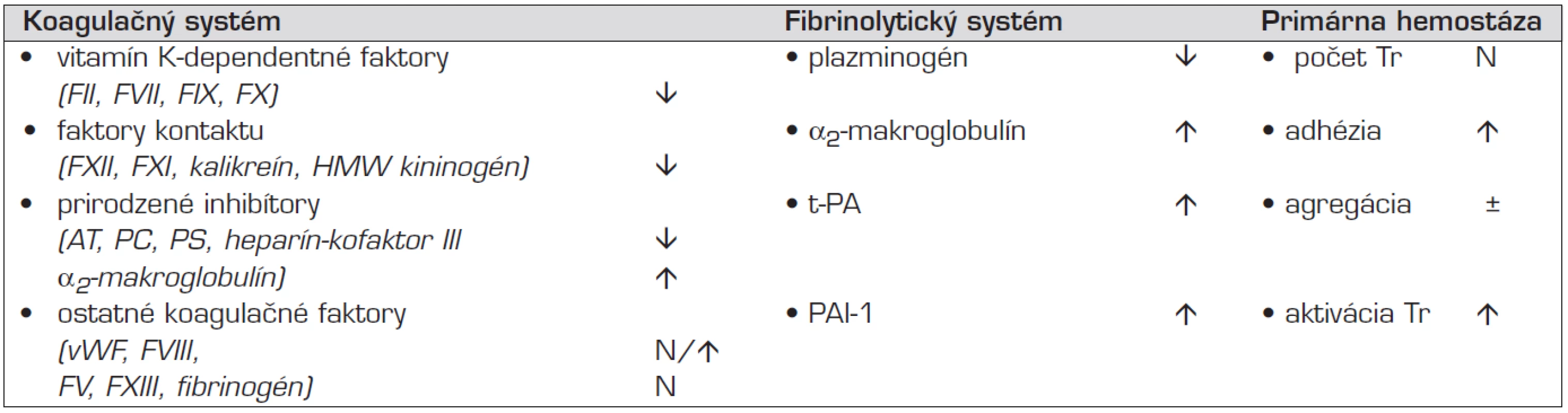
Legenda: Tr – trombocyty, HMW kininogén – vysokomolekulový kininogén, AT – antitrombín, PC – proteín C, PS – proteín S, t-PA – tkanivový aktivátor plazminogénu, PAI-1 – inhibítor aktivátora plazminogénu 1, vWF – von Willebrandov faktor Znížená a spomalená schopnosť novorodeneckej plazmy generovať trombín (asi na 50 % kapacity u dospelého) je v rovnováhe s významne zníženou endogénnou aktivitou fibrinolytického systému (hladina plazminogénu je znížená pod 50 %, α2-antiplazmínu na 80 % normy dospelých, kým prirodzené inhibítory fibrinolýzy sú zvýšené). Fyziologická rovnováha nezrelej hemostázy u novorodenca je labilná, za vhodných okolností ľahšie preváži riziko krvácania. Podnety aktivujúce hemostázu narážajú na zvýšenú pohotovosť primárnej hemostázy. Aktivované trombocyty ľahko adherujú na obnažený subendotel vďaka zvýšenej koncentrácii a adhezívnej väzbe prostredníctvom vysokomolekulových multimérov von Willebrandovho faktora (vWF). Pri nízkom potenciále endogénnej fibrinolýzy a prirodzených inhibítorov koagulácie a normálnej, či vyššej hladine vWF a FVIII môže dôjsť k opačnému narušeniu krehkej rovnováhy hemostázy, so zvýšením rizika trombózy [2, 4].
ETIOLÓGIA TE U NOVORODENCOV
Viac než 80 % trombotických príhod u novorodencov súvisí s centrálnym venóznym katétrom (CVK) [4]. Podiel idiopatických príhod sa zmenšuje (v detskom veku tvoria menej ako 10 %), pravidlom je synergické pôsobenie niekoľkých trombofilných stavov (vrodených a získaných). Identifikované príčinné faktory možno priradiť k trom činiteľov stále platnej tzv. Virchowovej triády, zjednodušene popisujúcej patomechanizmus vzniku trombózy: buď narúšajú prietok krvi v cieve (pri paralýze systémového obehu, polyglobúlii, hyperleukocytóze), poškodzujú cievny endotel (centrálne venózne katétre, toxíny pri sepse, lieky, antifosfolipidové protilátky), alebo ide o hyperkoagulačný stav (navodený získanými a vrodenými trombofilnými faktormi) [5].
TE príhody u novorodencov majú vzťah k rozmanitým patologickým stavom postihujúcimi už plod in utero, môžu byť komplikáciou priebehu pôrodu, alebo postnatálneho novorodeneckého obdobia. Aj ťažkosti v gravidite zo strany matky sú vzácnou príčinou trombózy u novorodenca (tab. 2) [2].
Tab. 2. Prenatálne a perinatálne riziká, spojené s trombózou u novorodencov. 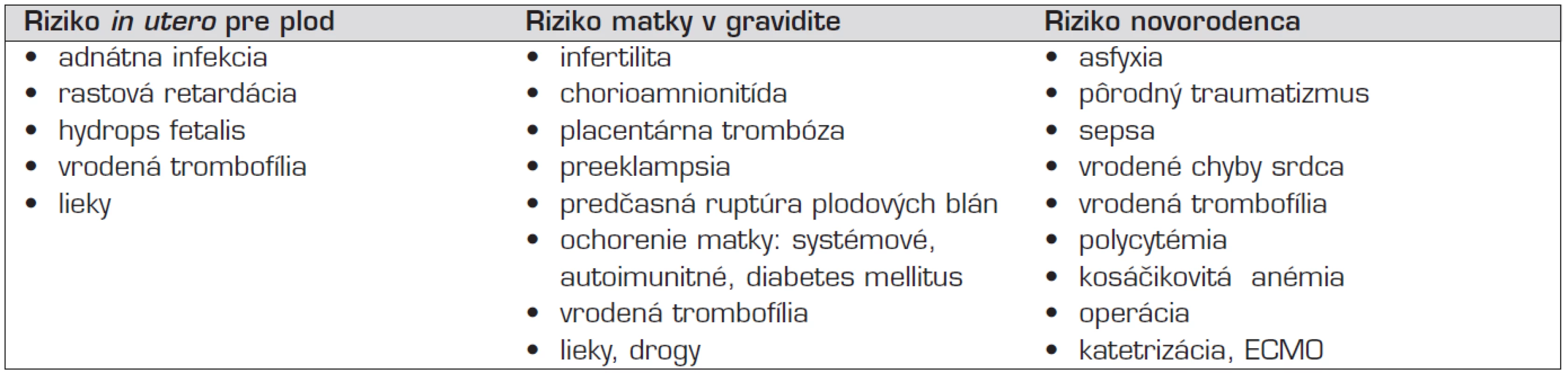
Legenda: ECMO – extrakorporálna membránová oxygenácia Vrodená trombofília samotná nie je chorobou, ale geneticky kódovanou zvýšenou náchylnosťou k trombóze [6]. Zoznam vrodených trombofilných faktorov sa dnes stále rozširuje, ale ich klinický význam nie je rovnocenný a vždy dobre poznaný. U novorodencov sa uplatní najmä päť vrodených trombofilných stavov – deficit prirodzených inhibítorov (AT, PC, PS) a mutácia v génoch koagulačného faktora FV Leiden (G1691A) a protrombínu FII (G20210A). Všetky sú geneticky podmienenými trombofilnými stavmi, s nezávislým trombotickým účinkom v hemostáze, s možnými kritickými klinickými prejavmi pri vzácnej homozygotnej forme defektu a možnými vážnymi klinickými prejavmi u heterozygotov. Kým zníženie aktivity AT znižuje neutralizáciu trombínu, nedostatok PC a PS narúša, alebo zvyšuje generáciu trombínu. Oba mechanizmy tak zvyšujú možnosť trombózy. Kontrola generácie trombínu je narušená aj mutáciami v génoch pre koagulačný faktor FV a protrombín. Geneticky podmienená zmena FV spôsobí, že jeho aktivovaná forma FVa neodpovedá na prirodzený kontrolný inhibičný systém APC komplexu (aktivovaného komplexu proteínu C, s kofaktorom proteínom S) a vedie k spomalenej inaktivácii aktívnej formy FVa a zvýšenej generácii trombínu. Najčastejšou mutáciou, spôsobujúcou tzv. APC-rezistenciu je Leidenská mutácia FV (G1691A). Podobne mutácia protrombínu (G20210A) vedie k zmene štruktúry protrombínu, zvýšeniu jeho plazmatickej hladiny a nakoniec k zvýšenej generácii trombínu [7].
Vážnu trombotickú udalosť môže u novorodenca privodiť aj vertikálny transplacentárny prenos antifosfolipidových protilátok triedy IgG, alebo iných protrombotických molekúl a vazokonstrikčných liekov od matky [8]. Trombotické následky spojené so zvýšenou hladinou homocysteínu a lipoproteínu (a) v sére u novorodenca sú publikované, ale nie sú celkom dobre vysvetlené. Niektoré práce popierajú TE prejav týchto metabolických ochorení už v novorodeneckom veku. Pripúšťajú skôr vertikálne prenesené riziko matky na plod pri metabolickom ochorení u matky [9].
LOKALIZÁCIA TE U NOVORODENCOV
Hoci väčšina trombotických príhod u novorodenca postihuje cievy, do ktorých je zavedený katéter (napr. umbilikálne artérie a vény, veľké vény centrálneho venózneho systému v povodí vena cava superior), ďalším možným miestom postihnutia sú cerebrálne a abdominálne cievy (vena /v./portae, v. hepatica, v. renalis, v. cava inferior).
Najčastejšie TE príhody sú opísané osobitne, s upozornením na odlišnosti v klinickom obraze, diagnostike a liečbe.
DIAGNOSTICKÝ PRÍSTUP
Diagnostika TE epizód v novorodeneckom období je náročná. Predpokladá dôslednú anamnézu, s posúdením možných rizík pre vývoj trombózy už prenatálne, alebo počas pôrodu. Objektívne údaje zohľadňujú aj ohrozenie novorodenca prechodnými faktormi, ktoré môže predstavovať ochorenie matky, alebo priebeh tehotenstva. Laboratórne vyšetrenie aktualizuje stav krvného obrazu, vnútorného prostredia, upozorní na infekciu. Hodnotenie koagulačného vyšetrenia nie je jednoduché pre fyziologickú hypokoagulopatiu, ktorá odpovedá pomerom nezrelej hemostázy, ale nevylučuje možnosť trombózy. Interpretácia zvýšenia laboratórnych markerov aktivácie hemostázy (zvýšenie FVIII, pozitívne D-diméry) pri častom sprievodnom ochorení (infekcia, nezrelosť pľúc s potrebou umelej pľúcnej ventilácie) a použití centrálneho venózneho katétra nie je jednoznačná. Nosným diagnostickým prístupom sú zobrazovacie vyšetrenia, ktoré určia lokalizáciu aj rozsah trombózy. Výber vhodnej metódy závisí od očakávanej lokalizácie trombózy (tab. 3) [4].
Tab. 3. Diagnostika a liečba najčastejších tromboembolických príhod u novorodenca. 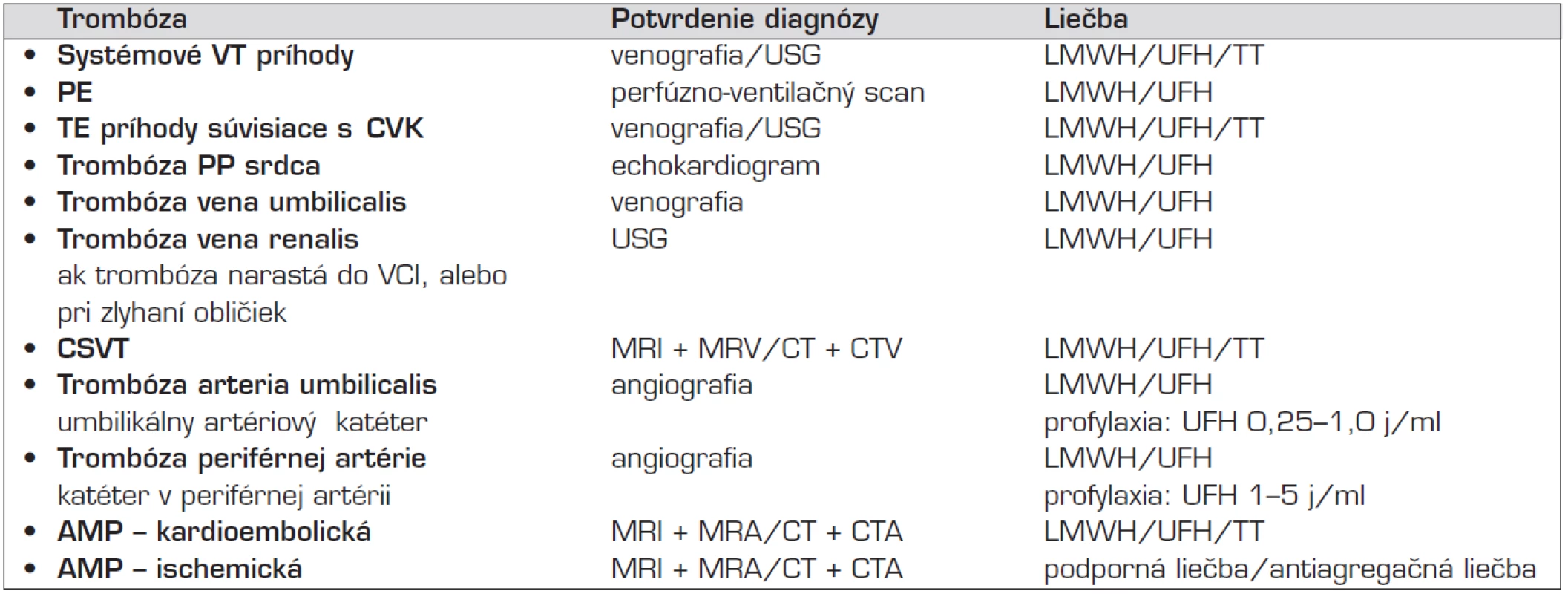
Legenda: VT – venózna trombóza, USG – ultrasonografia, LMWH – nízkomolekulový heparín, UFH – nefrakcionovaný heparín, TT – trombolytická liečba, PE – pľúcna embólia, TE – tromboembolizmus, CVK – centrálny venózny katéter, PP – pravá predsieň, CSVT – cerebrálna sinovenózna trombóza, MRI – magnetická rezonancia, MRV – magnetická rezonancia s venografiou, CT – computerová tomografia, CTV – computerová tomografia s venografiou, AMP – artériová mozgová príhoda, MRA – magnetická rezonancia s angiografiou, CTA – computerová tomografia s angiografiou Najpoužívanejšou, neinvazívnou, dostupnou a nezaťažujúcou metódou pre diagnostiku trombózy v bežných lokalizáciách je duplexná ultrasonografia (USG). Využíva dôkaz chýbania Dopplerovho signálu v periférnych cievach, ktorých lúmen pri trombóze nemožno priamym tlakom sondy prístroja stlačiť. Používa sa na potvrdenie trombózy periférnych vén dolných končatín. Keďže lúmen ciev novorodenca je malý, presnosť vyšetrenia je obmedzená. Vyhovuje tiež pre dôkaz väčšiny abdominálnych trombóz. Nie je vhodná pre tzv. centrálne trombózy (v. cava, aorta) a trombózy hlbokých vén horných končatín (v. subclavia, v. brachiocephalica). Pre diagnostiku artériových a venóznych trombóz súvisiacich s CVK je presnejšia konvenčná artériografia a venografia (nesú riziko alergie pacienta na kontrastnú látku). Pre mozgové TE príhody sa uprednostňuje magnetická rezonancia, doplnená angiografiou, alebo venografiou (MRI, MRA, MRV) pred computerovou tomografiou (CT), so scanmi s kontrastnou látkou. Výhodou je vyššia presnosť v rozlíšení ischémie a chýbanie radiačnej záťaže. MRI v difúznom vážení umožňuje odhaliť subtilné lézie, s cytotoxickým edémom, ktorý je korelátom akútnej mozgovej ischémie [5, 10]. Echokardiografia môže potvrdiť trombus v pravej predsieni, pre vzácnu pľúcnu embóliu sa volí perfúzno-ventilačný scan.
LIEČBA
Liečebný prístup u novorodencov sa líši od odporúčaní pre staršie deti. Nezrelosť hemostázy a jej zvýšená náchylnosť ku krvácaniu vedú k opatrnosti. Odporúčania pre antitrombotickú liečbu nemajú oporu vo výsledkoch z veľkých štúdií novorodencov, či nezrelých detí s rôznymi typmi TE príhod. V klinickej praxi sa dnes používajú najmä odporúčania, formulované na 8. kongrese Amerického kolégia pľúcnych lekárov (American College of Chest Physicians – ACCP) alebo spoločnosti The Royal College of Physicians, oba z roku 2008 [4, 5, 11]. Vychádzajú z menších klinických sledovaní u novorodencov a nezrelých detí a predstavujú aktuálny konsenzus, odpovedajúci dnešnému poznaniu, doplnený skúsenosťami v liečbe dospelých a väčších detí.
Pri voľbe antitrombotickej liečby sa aj u novorodencov liekom prvého výberu stávajú nízkomolekulové heparíny (LMWH), upúšťa sa od dlhodobého podávania nefrakcionovaného heparínu (UFH) [12, 13]. Napriek problémom s prípravou malých dávok (využívajú sa liekovky na viacnásobnú aplikáciu) a ťažkostiam podávania lieku (redukcia podkožného tuku, bolesť pri subkutánnej aplikácii) prevažujú výhody. Najdôležitejšími sú bezpečnejšie udržanie terapeutických hladín vďaka minimálnej interakcii s inými liekmi a nezávislosť na výživovom režime. Lepším predvídaním antitrombotického účinku dávky LMWH, meniacej sa podľa hmotnosti pacienta, s trvaním 12 až 24 hodín (podľa typu prípravku) sa zvyšuje bezpečnosť zvoleného LMWH, najmä znížením rizika krvácania. Dlhodobé nežiaduce účinky (heparínom indukovaná trombocytopénia II. typu, osteoporóza) sú zriedkavejšie ako pri UFH. Pre novorodencov so zlým žilovým prístupom je vítaná nezávislosť na intravenóznom prístupe. Výber preparátu sa na pracoviskách líši, odporúčajú sa lieky overené v malých štúdiách u novorodencov (enoxaparín, dalteparín, reviparín, tinzaparín). Jednotlivé preparáty majú rozdielne farmakokinetické vlastnosti, aj rozdielne dávkovanie, závislé na hmotnosti (tab. 4), ktoré vylučuje ich jednoduchú zámenu [13].
Po parenterálnej aplikácii boli publikované individuálne rozdiely v antitrombotickom účinku, preto monitorovanie skutočného účinku terapeutickej dávky (stanovením anti-FXa) je nutné. Pri stabilizácii pomerov hemostázy aj hmotnosti pacienta však opakované kontroly nie sú časté. Reprezentatívne hodnoty poskytujú vzorky krvi, odoberané obyčajne po 2 dňoch liečby, a to 4 hodiny po podaní v čase vrcholu antitrombotického účinku (prípustné rozpätie je 2–6 hodín po aplikácii). U novorodencov a najmenších detí v prvom roku života sa LMWH používajú v liečbe väčšiny venóznych trombóz, ale aj v sekundárnej profylaxii (tab. 3). Názory rôznych pracovísk sa rozchádzajú v dĺžke antitrombotickej liečby u novorodenca. Zohľadňuje sa efekt iniciálnej liečby po 10–14 dňoch. V prípade prvej venóznej trombózy sa dĺžka liečby pohybuje od 6 týždňov do 3 mesiacov. Lokalizácia a veľkosť trombu, prípadne jeho propagačný rast, zistené trombofilné faktory, riziká rekurencie, ale aj gestačný vek, pôrodná hmotnosť a sprievodná komorbidita (ochorenie pľúc, nekrotizujúca enterokolitída, sepsa, mozgová hemoragická príhoda) individualizujú liečebné rozhodnutia [3].
V liečbe mozgových artériových trombóz prevažuje podporná liečba, v niektorých situáciách, najmä v sekundárnej prevencii sa odporúča preparát kyseliny acetylosalicylovej (Aspirín, Anopyrin v nízkej dávke). Pri kardioembolickej mozgovej artériovej príhode, alebo trombóze periférnej artérie možno individuálne uprednostniť antitrombotickú liečbu [3, 4].
Trombolytická liečba sa u novorodencov neodporúča. Výnimkou sú život ohrozujúce stavy (zlyhanie funkcie orgánov, ohrozenie končatiny), alebo zaradenia pacientov do schválených štúdií. Liekom voľby sú prípravky tkanivového aktivátora plazminogénu. Rovnako ojedinelý je chirurgický prístup, vo vážnych prípadoch TE s kontraindikáciou systémovej trombolýzy [3, 14].
Substitúcia prirodzených inhibítorov u jedincov s klinickými prejavmi ich nedostatku, ktorý je potvrdený aj laboratórne, je život zachraňujúci liečebný postup [3].
NAJČASTEJŠIE TYPY TE U NOVORODENCOV, OSOBITOSTI DIAGNOSTIKY A LIEČBY
Katétrové trombózy
V novorodeneckom období sú katétrové trombózy najčastejšie (až 80 %) [3]. Riziko znásobuje aplikácia hyperosmolárnych roztokov parenterálnej výživy, hemostaticky aktívne lieky, aj systémová infekcia. Trombus sa vytvorí buď na stene katétra, alebo na jeho konci a spôsobí jeho čiastočnú, alebo úplnú nepriechodnosť [15]. Nebezpečným je proximálny rast trombu z katétra po stene cievy do centrálnejších častí cievneho riečiska, s úplnou venóznou oklúziou, alebo jeho uvoľnenie a zanesenie krvným prúdom do vzdialenejšej cievy. Tento mechanizmus je najčastejším zdrojom pľúcnej embólie u detí, ktorá môže byť fatálna. Nepriechodnosť katétra u novorodenca je dôvodom pre jeho odstránenie. Pre zníženie rizika paradoxnej embolizácie niektoré pracoviská odporúčajú tento výkon až po 3–5-dňovej antitrombotickej liečbe [16].
U novorodencov, zvlášť nezrelých, sa často využíva umbilikálny cievny prístup. Strata priechodnosti artériového umbilikálneho katétra v dôsledku trombózy sa vyskytuje u 13–73 % novorodencov bez profylaktického podávania heparínu. Pri odporúčanej primárnej profylaxii (0,25–1,0 j UFH/1 ml/hod. v kontinuálnej infúzii) sa riziko významne znižuje (0–13 %) [3, 4]. Pre venózny umbilikálny katéter chýba odporúčanie primárnej profylaxie, aj keď mnoho pracovísk používa podobný preventívny prístup.
Abdominálna trombóza
Najčastejšou príhodou je umbilikálna trombóza s možným šírením do vena porte a do vena hepatica. Súvisí s umbilikálnym venóznym katétrom, jeho nepriechodnosť nie je nevyhnutne prítomná. Klinické prejavy budia podozrenie na akútnu brušnú príhodu, inokedy sú nešpecifické. Správna diagnóza nemusí byť včas stanovená, stav môže zostať nepoznaný a neliečený. Až odhalenie kolaterálnych ciev v oblasti v. porte, v. hepatica a retrográdna anamnéza s pozitívnou prítomnosťou umbilikálneho venózneho katétra potvrdia neskoré následky prekonanej trombózy, súvisiacej s umbilikálnym katétrom. Vážnou komplikáciou je portálna hypertenzia so splenomegáliou, konzumpčnou trombocytopéniou, prípadne aj leukopéniou a vývoj gastroezofageálnych varixov s gastrointestinálnym krvácaním, ktoré môžu privodiť náhodné, život ohrozujúce krvácanie [17, 18].
Spontánna cievna trombóza sa u novorodenca vyskytuje vzácne. V oblasti brucha postihuje v. cava inferior, alebo aortu. Venózna trombóza môže vzniknúť v dôsledku tlaku tumoróznej masy, pôrodného traumatizmu, asfyxie, sepsy. Trombóza aorty je ojedinelá, spravidla idiopatická. Niekedy sa potvrdí koarktácia aorty, deficit AT, prípadne antifosfolipidové protilátky, prenesené od matky. Veľkosť trombózy určuje voľbu liečebného postupu (štandardne – antitrombotická liečba, pri ohrození života – trombolýza, alebo chirurgická trombektómia) [19].
Najčastejšou nekatétrovou trombózou u novorodenca je renálna venózna trombóza (RVT). Predstavuje 10 % všetkých venóznych oklúzií v tomto období, v 24 % je bilaterálna. Obyčajne sa vyvíja už prenatálne, v dôsledku patologických stavov u plodu, alebo prenesených rizík zo strany matky. Klinické prejavy môžu byť nešpecifické, alebo ju odhalí hematúria, tumorózna rezistencia v laterálnej časti brucha. Pri šírení trombu do vena cava inferior (v 52–60 %) sa môžu objaviť príznaky kaválneho syndrómu (opuch a zmena sfarbenia kože dolných končatín). Pre stanovenie diagnózy je testom výberu ultrasonografické vyšetrenie (USG), niekedy potvrdí aj krvácanie do nadobličky [20].
Liečba závisí od rozsahu a charakteru trombózy. Pri prenatálnom vývoji je trombus často organizovaný a efekt antitrombotickej liečby neistý. Preto pri jednostrannej RVT a uspokojivej funkcii postihnutej obličky je možné voliť podpornú liečbu a sledovanie, alebo antitrombotickú liečbu. Pri šírení trombu do vena cava inferior, obličkovej nedostatočnosti, alebo bilaterálnom postihnutí je indikovaná antitrombotická liečba. Pri jej zlyhaní je voľbou trombolytická liečba, alebo chirurgická trombektómia [3].
Mozgové príhody
Cievna mozgová príhoda (CMP) v rámci detského veku postihuje najčastejšie práve novorodencov. Aktuálna incidencia je 0,51/10 000 novorodencov [4]. Často je ťažké určiť, či príhoda nastala in utero (asi od 28. gestačného týždňa), v čase pôrodu, alebo do 28. dňa postnatálne. Typ postihnutej cievy a rozsah CMP rozlíši zobrazovacie vyšetrenie [5].
Podľa 8. kongresu ACCP je incidencia artériových mozgových príhod (AMP) 1/4000 novorodencov [3], publikácie posledných rokov potvrdzujú významný nárast [4]. V našej literatúre tento údaj chýba a udalosť má pestré synonymné označenie (príhoda, infarkt, iktus, mŕtvica, inzult, záchvat; anglosaská terminológia uprednostňuje označenie stroke) [5].
Väčšinou ide o multifaktorovú príhodu, objasnenú u viac než 70 % detí. Okrem rizík v gravidite a v čase pôrodu (tab. 2) sa uplatnia vrodené srdcové chyby, najmä bez korekcie, ktoré sú zdrojom kardioembolických AMP (vzácnejšie venóznych iktov). Ďalším významným rizikom sú opísané protrombotické poruchy (u starších detí je hlavným etiologickým faktorom traumatické, zápalové a idiopatické poškodenie cievnej steny mozgovej artérie) [21] . Ojedinelou príčinou je obturácia artérií pri kosáčikovitej anémii. Predilekčnou lokalizáciou je vetvenie ľavej arteria cerebri media. Novorodenci sú letargickí, alebo majú kŕče, najmä fokálne, netypické pre nezrelosť mozgu. Niekedy je novorodenecké obdobie bezpríznakové. Na prenatálnu AMP upozorní hemiparéza s viaznutím úchopu pravej ruky, s vývojom v 4. až 12. mesiaci života, alebo sa u jedinca objaví neočakávaná preferencia ľavej ruky [22, 23].
Rekurencia AMP míňa novorodenecký vek a posúva sa do ďalšieho obdobia detského veku. Jej výskyt závisí od príčiny (10–30 %) [2], zvyšuje sa u jedincov s viacerými rizikovými faktormi. Viac ako 50 % detí rehabilitáciou dobehne psychomotorický vývoj do 12 až 18 mesiacov. Dlhodobé následky predstavujú najmä epilepsia, mozgová obrna, prípadne kognitívne, emočné, rečové, alebo iné poruchy [24].
Venózne príhody s predilekčným postihnutím sinovenóznych sínusov sa označujú ako cerebrálne sinovenózne trombózy (CSVT). Aktuálna incidencia u detí je 0,7/100 000 ročne [4], podľa údajov 8. kongresu ACCP je u novorodencov vyššia (najmenej 2,6/100 000) [3]. Obštrukciu sinovenóznych splavov sprevádza intrakraniálna hypertenzia s fokálnym, alebo generalizovaným edémom mozgového tkaniva. V zóne infarktu môžu byť známky krvácania, typicky v talamickej oblasti. Progresiou stavu je chronický pseudotumor cerebri a vývoj hydrocefalu. Príčinou sú prenatálne a perinatálne riziká (tab. 4), protrombotické poruchy (uplatnia sa častejšie ako u artériových príhod) a získané ochorenia, najmä neuroinfekcie a systémové infekcie, infekcie krku, stredoušia, ojedinele vrodené srdcové chyby.
Tab. 4. Odporúčané terapeutické dávky LMWH u novorodencov. 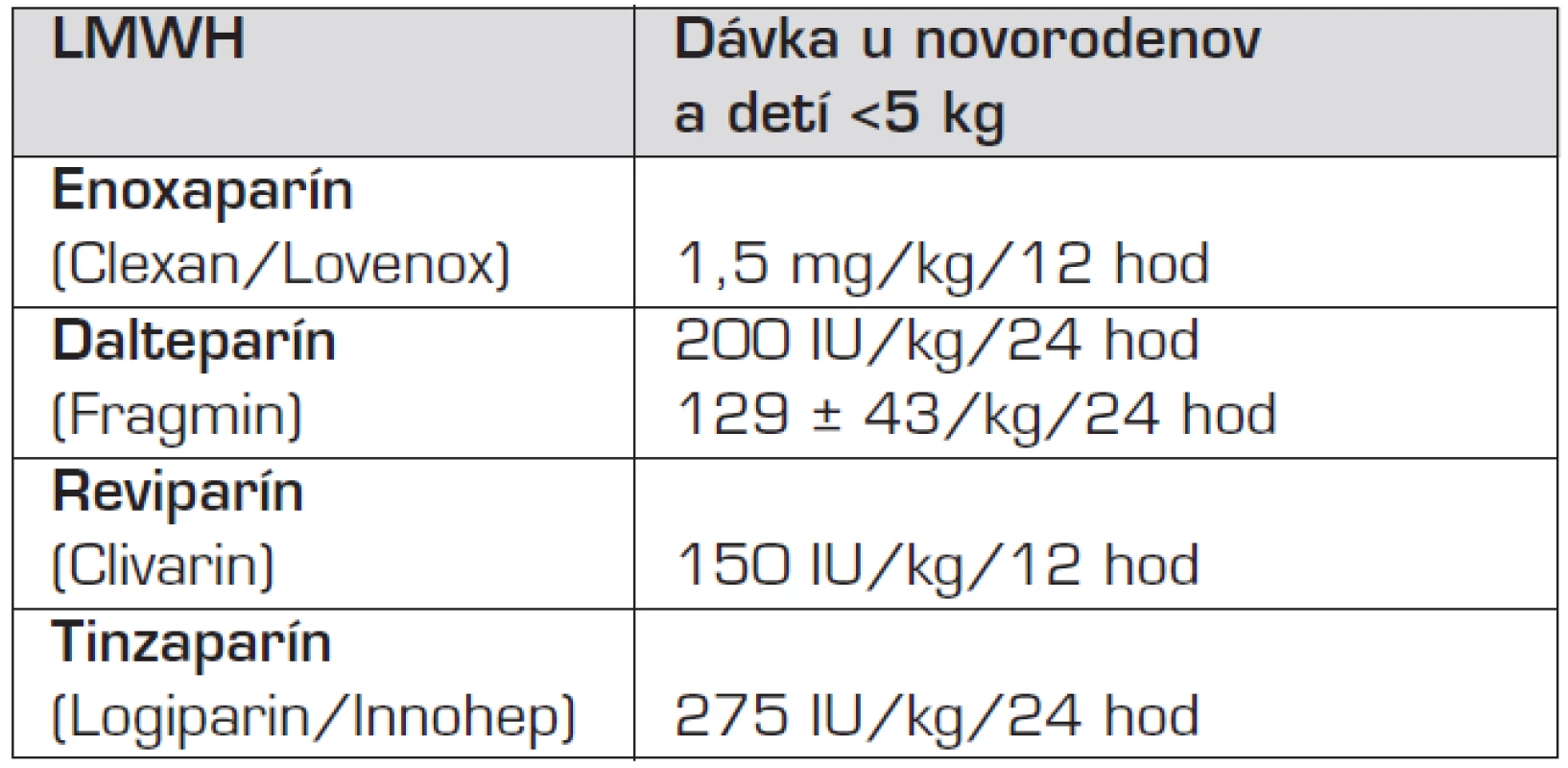
Klinické prejavy odpovedajú lokalizácii, rozsahu a času trvania mozgovej ischémie. Typické sú letargia, zvýšená dráždivosť, kŕče. Ich kumulácia a generalizácia a porucha vedomia zvyšujú podozrenie na krvácanie do centrálneho nervového systému (CNS). Prítomnosť infarktu v čase diagnózy a perinatálne komplikácie (asi v 40 %) nepriaznivo ovplyvňujú psychomotorický vývoj. Dlhodobé následky predstavujú epilepsia, motorické a kognitívne poruchy. Rekurencia je ojedinelá, mortalita je asi v 7 % [24, 25].
V diagnostike novorodeneckej CMP má rýchlo dostupné a neinvazívne USG vyšetrenie obmedzenú výpovednú hodnotu. Diagnostickým vyšetrením 1. línie je čoraz častejšie magnetická rezonancia (MRI) CNS, doplnená kontrastnou angiografiou (MRA), alebo venografiou (MRV). Poskytuje obraz mozgového artériového alebo venózneho riečiska, vylúči krvácanie. Jej nevýhodou pre novorodenca je výkon v krátkodobej anestéze, výhodou chýbanie radiačnej záťaže. V prípade nedostupnosti je stále aktuálna computerová tomografia (CT), doplnená scanmi s kontrastnou látkou. V diagnostike nejasných stavov možno využiť subtrakčnú digitálnu angiografiu (CSTV), alebo MRI v difúznom vážení (AMP) [5].
V liečbe AMP sa v novorodeneckom období uprednostňujú podporné prístupy, so zabezpečením dostatočnej oxygenácie, hydratácie, normotermie. Antiagregačná liečba sa zvažuje len u novorodencov s významným sprievodným ochorením.
V prípadoch CSVT a kardioembolickej AMP bez dokázaného intrakraniálneho krvácania sa odporúča antitrombotická liečba heparínom (s nejednotným názorom na jej dĺžku: minimálne 14 dní – 6 týždňov, maximálne 3 mesiace) [3, 26].
Homozygotný deficit proteínu C a proteínu S
Jednou z fatálnych trombotických komplikácií, ktorá sa prejaví v prvých hodinách po narodení, je homozygotný deficit PC, homozygotný deficit PS je omnoho vzácnejší. U postihnutých jedincov sa hladina prirodzených inhibítorov obyčajne nedá stanoviť, podmienkou vrodenej poruchy je dôkaz heterozygotného defektu u rodičov. Klinickým prejavom je purpura fulminans. Ide o akútny syndróm diseminovanej intravaskulárnej koagulácie, s difúznou trombózou kožných ciev, ktorá vedie k prudkej, progredujúcej hemoragickej nekróze kože. Trombóza veľkej cievy je ojedinelá, prítomná trombóza mozgových, alebo očných ciev vzniká prenatálne. Na koži sa objavia ekchymózy, najskôr na končatinách, v gluteogenitálnej oblasti, na bruchu, na koži lebky, s rýchlym plošným šírením. V priebehu hodín sa menia na fialovočierne morfy s bulami a nekrózou, až gangrénou kože a podkožia.
Diagnóza homozygotov PC a PS je obyčajne neočakávaná, nepredvídaná, robí ju sám život. Len včasná kauzálna liečba môže byť pokusom o záchranu novorodenca s homozygotným postihnutím. Ideálne sú prípravky s vysokou hladinou chýbajúcich inhibítorov (pre daný vek je u nás dostupný len koncentrát proteínu C v neaktívnej forme; PC a PS obsahujú aj niektoré protrombínové koncentráty). Alternatívou je čerstvá zmrazená plazma s nižšou koncentráciou proteínu C a proteínu S a objemovým zaťažením pacienta. Liečba je dlhodobá, do zhojenia kožných lézií, neraz niekoľko týždňov. Problémom je udržanie intravenózneho prístupu, dostupnosť a finančná náročnosť liečby. U jedincov s ťažkou vrodenou poruchou PC a PS je indikovaná dlhodobá substitučná a antikoagulačná liečba, inou alternatívou je transplantácia pečene [2, 3].
UŽITOČNOSŤ SKRÍNINGU VRODENÝCH TROMBOFILNÝCH STAVOV
Názory sú kontroverzné, lebo pri vzniku TE u novorodenca sa častejšie uplatnia získané trombofilné faktory. Univerzálny skríning je nevhodný. Uprednostňuje sa selektívny prístup, a to u postihnutých novorodencov s TE príhodou s neobvyklou lokalizáciou (CNS, abdominálna lokalizácia), pri pozitívnej rodinnej anamnéze v prvej línii, alebo riziku ochorenia matky, ktoré môže ohroziť novorodenca TE príhodou. Diskutovaná je jeho potreba pri kaválovej trombóze. Základom je 5 vrodených trombofilných porúch (deficit AT, PC, PS, uvedené mutácie FV Leiden a protrombínu), ktorých pozitivita môže ovplyvniť dĺžku antikoagulačnej liečby, alebo upozorniť na potrebu jej doplnenia o substitúciu znížených prirodzených antikoagulantov [27, 28].
PREVENCIA TE PRÍHOD U NOVORODENCOV
TE príhody u novorodencov sú neočakávané situácie. Len pri stavoch, využívajúcich cievny katéter, možno očakávať riziko trombózy. Doteraz bolo uskutočnených niekoľko štúdií so snahou nájsť účinný spôsob, ktorý by zachoval priechodnosť CVK a predišiel vývoju trombózy, ktorá s ním súvisí. Testovalo sa použitie niekoľkých antitrombotických liekov v rôznych dávkach (UFH, dalteparín, reviparín, warfarín) [3]. Účinná preventívna ochrana však zatiaľ nie je známa.
Podľa odporúčaní 8. kongresu ACCP sa u detských aj dospelých pacientov s CVK rutinná primárna systémová profylaxia neodporúča. Jedinou situáciou, v ktorej je u novorodenca odporúčaná antitrombotická prevencia, je zavedenie umbilikálneho katétra do arteria umbilicalis (uvedená vyššie) [3, 28]. Novorodenecká trombóza, spojená s vrodenou trombofíliou, je pri nízkej prevalencii vrodených trombofilných stavov v populácii (tab. 5) vzácnou situáciou [29]. Pri fyziologicky nízkej hladine prirodzených inhibítorov v novorodeneckom veku je odlíšenie vrodených defektov ťažké. Vyžaduje potvrdenie príslušného deficitu prirodzených antikoagulantov u rodičov. Pozitívna rodinná anamnéza s výskytom trombózy u rodičov v detskom alebo mladom adolescentnom veku je pri predvídaní trombofilného rizika významne nápomocná. Fakt, že novorodenec je nositeľom vrodenej trombofilnej dispozície, nie je automatickou indikáciou pre antitrombotickú profylaxiu [28]. Zvažuje sa prísne individuálne, v prípadoch, keď pôsobí ďalší získaný faktor, ktorý vedie k významnej aktivácii hemostázy (ťažká infekcia/sepsa, asfyxia, veľká operácia, pôrodný traumatizmus).
Tab. 5. Prevalencia vrodenej trombofílie a relatívne riziko prvej tromboembolickej príhody v kaukazskej populácii [29]. ![Prevalencia vrodenej trombofílie a relatívne riziko prvej tromboembolickej príhody v kaukazskej populácii [29].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/6d9651b1a9e7da28d485fbd0ab3671bf.png)
PROGNÓZA
Pri včasnej diagnostike a vhodnej antitrombotickej liečbe je prognóza kaválovej končatinovej venóznej trombózy dobrá. Problémom sú asymptomatické a nediagnostikované trombózy a dlhodobé pôsobenie trombotických rizikových faktorov. Trombóza je často závažnejšia (s proximálnym šírením), sprevádzaná vývojom kompenzačných kolaterál a neskorých dlhodobých následkov (napr. potrombotický syndróm, gastroezofageálne varixy, splenomegália s cytopéniou a gastrointestinálnym krvácaním po neliečenej trombóze v. portae, medikamentózne nekorigovateľná hypertenzia pri trombóze v. renalis). Trombóza centrálnych ciev (aorta, vena cava inferior) a v. renalis je často vrodená, s organizovaným trombom a kolaterálnymi cievami už pri narodení.
Efekt neskorej antikoagulačnej liečby je neistý, rekanalizácia je často parciálna, alebo nenastane. Pri neúspechu je možná systémová trombolýza. Pri vysokom krvácavom riziku sa volí len pri orgánovom zlyhaní, alebo ohrození končatiny. Chirurgická trombektómia je v novorodeneckom období, pri malom lumene aj u centrálnych ciev, veľmi limitovaná. Prognóza cievnych mozgových príhod varíruje, závisí nielen od včasnej diagnostiky a antitrombotickej liečby, ale aj od sprievodného ochorenia. Včasná liečba a rehabilitácia minimalizujú následky, inokedy je postihnutie celoživotné a ťažké.
ZÁVER
Tromboembolizmus u novorodencov a prematúrnych detí je narastajúci a zvýšene spoznávaný problém. Zdá sa, že získané rizikové faktory, ako centrálne cievne prístupy, sepsa, perinatálna infekcia a vrodené srdcové chyby sú významnejšie ako vrodené trombofilné faktory. Pre novorodencov s uvedenými komplikáciami novorodeneckého obdobia zatiaľ nie sú známe preventívne opatrenia, ktoré by účinne predchádzali vzniku TE príhod. Situácie, kedy pozitívna rodinná anamnéza upozorní na možnosť porodenia novorodenca s vážnym vrodeným deficitom prirodzených inhibítorov, sú skôr fikciou.
V liečbe sú najviac využívané postupy, odporúčané 8. kongresom ACCP z roku 2008. Včasná diagnóza, zohľadnenie komorbidity, ale aj osobitostí hemostázy v norodeneckom období môžu prispieť k individualizácii liečebných postupov. Nové štúdie, ktoré by testovali konvenčné, ale aj nové lieky v rôznych situáciách TE u novorodencov, sú veľmi potrebné. Len takto získané výsledky môžu optimalizovať liečené rozhodnutia, vhodné pre novorodencov a prematúrne deti a prispieť k zvýšeniu bezpečnosti antitrombotickej liečby, aj zníženiu rizika rekurencie a dlhodobých následkov.
Došlo: 12. 1. 2011
Přijato: 17. 5. 2011
MUDr. Monika Grešíková
Klinika detskej hematológie
a onkológie DFNsP
Limbova 1
833 40 Bratislava
Slovenská republika
e-mail: gresikova@dfnsp.sk
gresik@chello.sk
Zdroje
1. Raffini L, Huang YSh, Witmer Ch, et al. Dramatic increase in venous thromboembolism in children´s hospitals in the United States from 2001 to 2007. Pediatrics 2009; 124 : 1001–1008.
2. Journeycake JM. Thrombosis in infancy and childhood. In: Colman RW, Marder VJ, Clowes AW, George JN, Goldhaber SZ. Hemostasis and Thrombosis. Basic Principles and Clinical Practice. 5th ed. Philadelphia: Lippincott Williams and Wilkins, 2006 : 1637–1647.
3. Monagle P, Chalmers E, Chan A, et al. Antitrombotic therapy in neonate and children. American College of Chest Physicians Evidence – based clinical practice guidelines, 8th ed. Chest 2008; 133(Suppl): 887S–968S.
4. Lanzkowsky Ph. Thrombosis disorders. In: Manual of Pediatric Hematology and Oncology. 5th ed. London, Burlington, San Diego: Elsevier, 2011 : 419–440.
5. Bernard TJ, Goldenberg NA. Pediatric arterial ischemic stroke. Pediatr Clin N Amer 2008; 55 : 323–338.
6. Trenor CC, Michelson AD. Thrombophilia and pediatric stroke. Circulation 2010; 121 : 1838–1847.
7. Fischer D, Porto L, Stoll H, et al. Intracerebral mass bleeding in a term neonate: manifestation of hereditary protein S deficiency with a new mutation in the PROS1 gene. Neonatology 2010; 98 : 337–340.
8. Boffa MC, Lachassinne E. Review: infant perinatal thrombosis and antiphospholipid antibodies: a review. Lupus 2007; 16 : 634–641.
9. Renaud C, Bonneau Ch, Presles E, et al. Lipoprotein (a), birth weight and neonatal stroke. Neonatology 2010; 98 : 225–228.
10. Srinivasan J, Miller S, Phan TG, et al. Delayed recognition of initial stroke in children: need for increased awareness. Pediatrics 2009; 124 :e227–e234.
11. Hirsh J. Antithrombotic therapy in neonates and children. In: Guidelines for Antitrombotic Therapy. 8th ed. Hamilton: 2008 : 140–149.
12. Olosová A, Chovancová D, Drobná H, et al. Liečba heparínom u novorodencov a detí. Čes-slov Pediat 2004; 59 : 152–159.
13. Grešíková M. Zásady antitrombotickej liečby u novorodencov a detí. Pediatria 2010; 1 : 44–49.
14. Leary SE, Harrod VL, deAlarcon PA, et al. Low-dose systemic thrombolytic therapy for deep vein thrombosis in pediatric patients. J Pediat Hematol/Oncol 2010; 32 : 97–102.
15. Harney KM, McCabe M, Branowicki P, et al. Observation cohort study of pediatric in patients with central venous catheters at „intermediate risk“ of thrombosis and eligible for anticoagulant prophylaxis. J Pediat Oncol Nursing 2010; 27 : 325–329.
16. Revel-Vilk Sh. Central venous line-related thrombosis in children. Acta Haematol 2006; 115 : 201–206.
17. Shahr L, Boehlen F, de Moerloose Ph, et al. Anticoagulants in portal vein thrombosis: don´t be so shy! Blood 2009; 113 : 5031–5032.
18. Lam HS, Li AM, Chu WCW, et al. Mal-positioned umbilical venous catheters causing liver abscess in a preterm infant. Neonatology 2005; 88 : 54–56.
19. Sharathkumar AA, LaMear N, Pipe S, et al. Management of neonatal aortic arch thrombosis with low-molecular weigth heparin: a case series. J Pediat Hematol/Oncol 2009; 31 : 516–521.
20. Winyard PJD, Bharucha T, deBruyn R, et al. Perinatal renal venous thrombosis: presenting renal length predicts outcome. Arch Dis Child Fetal Neonatal Ed 2006; 91: F273–F278.
21. Lee J, Croen LA, Backstrand KH, et al. Maternal and infant characteristics associated with perinatal arterial stroke in the infant. JAMA 2005; 293 : 723–729.
22. Roach ES, Golomb MR, Adams R, et al. Management of stroke in infants and children. Stroke 2008; 39 : 2644–2691.
23. Bernard TJ, Goldenberg NA, Tripputi M, et al. Anticoagulation in childhood-onset arterial ishcemic stroke with non-moyamoya arteriopathy. Stroke 2009; 40 : 2869–2871.
24. Lee J, Croen LA, Lindan C, et al. Predictors of outcome in perinatal arterial stroke: a population-based study. Ann Neurol 2005; 58 : 303–308.
25. Perkins E, Stephens J, Xiang H, et al. The cost of pediatric stroke acute care in the United States. Stroke 2009; 40 : 2840.
26. Pappachan J, Kirkham FJ. Cerebrovascular disease and stroke. Arch Dis Child 2008; 93 : 890–898.
27. Blatný J, Penka M, Štěrba J. Trombóza v dětském věku – důvod k vyšetření? Čes-slov Pediat 2002; 57 : 375–377.
28. Grešíková M. Aký je medicínsky racionálny postup v odhaľovaní trombofílie u detí? Lek Obz 2011; 3 : 136–141.
29. Poul H, Kessler P. Trombofilní stavy: význam pro prevenci a léčbu žilního tromboembolizmu. Vnitř Lék 2009; 5 : 242–252.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článek Rehydratační léčbaČlánek Hospitalizace dětí a dospívajících pro intoxikaci alkoholem a drogami na dětských odděleních v ČRČlánek Lesk a bída české pediatrieČlánek XVII. Moravskoslezské pediatrické dny 11.–12. 11. 2011, Ostrava, Clarion Congress Hotel (dříve Atom)Článek Charta práv dětí v nemocnici
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2011 Číslo 5- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
-
Všetky články tohto čísla
-
Vliv pasivní expozice cigaretovému kouři na zdraví a vývoj dětí v období prenatálním i postnatálním až do věku sedmi let
Výsledky studie ELSPAC - Kvalita života detí trpiacich alergickou rinitídou
- Vplyv dýchania cez ústa na rastové zmeny splanchnokránia v detskom veku
- Tromboembolické príhody u novorodencov pohľadom dnešnej medicíny
- Vnitřní prostředí a patofyziologie tělesných tekutin
- Rehydratační léčba
- Hospitalizace dětí a dospívajících pro intoxikaci alkoholem a drogami na dětských odděleních v ČR
- Půl století české pediatrické endokrinologie a diabetologie
- Lesk a bída české pediatrie
- 17th Workshop of Middle-European Society of Paediatric Endocrinology (MESPE)
- Cena České pediatrické společnosti ČLS JEP
- XVII. Moravskoslezské pediatrické dny 11.–12. 11. 2011, Ostrava, Clarion Congress Hotel (dříve Atom)
- Charta práv dětí v nemocnici
-
Vliv pasivní expozice cigaretovému kouři na zdraví a vývoj dětí v období prenatálním i postnatálním až do věku sedmi let
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Rehydratační léčba
- Tromboembolické príhody u novorodencov pohľadom dnešnej medicíny
- Vnitřní prostředí a patofyziologie tělesných tekutin
- Vplyv dýchania cez ústa na rastové zmeny splanchnokránia v detskom veku
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



