-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vnitřní prostředí a patofyziologie tělesných tekutin
Autori: K. Bláhová; F. Fencl
Pôsobisko autorov: Pediatrická klinika, UK 2. LF a FN Motol, Praha
Vyšlo v časopise: Čes-slov Pediat 2011; 66 (5): 308-318.
Kategória: Vybrané kapitoly z nové učebnice Klinická pediatrie
Nakladatelství Galén připravuje k vydání novou učebnici „Klinická pediatrie“, která bude určena jak pro pregraduální studium na lékařských fakultách, tak i v rámci postgraduálního vzdělávání pro přípravu na atestaci z dětského lékařství a z praktického dětského lékařství. Autoři věří, že učebnici ocení i dětští lékaři v praxi.
Ve spolupráci nakladatelství Galén a redakce Česko-slovenské pediatrie na stránkách našeho časopisu v letošním roce postupně uveřejňujeme jednotlivé stati z nové učebnice – a jako bonus také některé kapitoly, které se do nové učebnice už „nevešly“, protože učebnice má přesně stanovený rozsah.
ÚVOD
Vnitřním prostředím organismu jsou tělesné tekutiny, v nichž je rozpustidlem voda a v ní látky v ionizované či neionizované podobě. Optimální složení a stálost vnitřního prostředí (homeostáza) má zásadní důležitost pro všechny metabolické děje a pro funkci životně důležitých orgánů.
1. TĚLESNÉ TEKUTINY
Objem celkové tělesné vody (CTV) vyjadřujeme jako procento tělesné hmotnosti. Významně se mění s věkem. U fétu je podíl CTV vysoký, postupně poněkud klesá a u donošeného novorozence činí 75 % porodní hmotnosti. Nedonošený novorozenec má podíl CTV k hmotnosti vyšší. Během prvního roku života množství CTV klesne na 60 % tělesné hmotnosti. Tato hodnota zůstává přibližně stejná po celé dětství, do období puberty. U chlapců během puberty naroste zejména svalovina (s vyšším obsahem vody), u dívek ve větší míře tuková tkáň (s nižším obsahem vody). U mladých mužů proto podíl CTV zůstává na hodnotě cca 60 % tělesné hmotnosti, zatímco u mladých žen činí jen cca 50 % tělesné hmotnosti.
1.1. Distribuce tělesných tekutin
Tělesné tekutiny jsou v organismu rozděleny do intracelulárního a extracelulárního oddílu. Ty jsou navzájem oddělené membránami. U novorozence je objem extracelulární tekutiny (ECT) větší než objem intracelulární tekutiny (ICT). Postnatální nástup diurézy vede k poklesu ECT a naopak buněčný růst k vzestupu ICT. Tím se poměr ICT/ECT postupně mění a v jednom roce věku je již zhruba stejný jako v dospělosti – ECT tvoří přibližně 20 až 25 % tělesné hmotnosti, ICT 30–40 %. Od puberty mají chlapci a muži lehce vyšší ICT ve srovnání s dívkami, zatímco ECT se mezi oběma pohlavími ani po pubertě neliší.
Mezi ECT počítáme tekutinu intravaskulární (plazmatickou vodu), intersticiální a tekutinu v tělesných dutinách.
Objem plazmatické vody představuje v průměru 5 % tělesné hmotnosti (krev při hematokritu 0,40 odpovídá 8 % tělesné hmotnosti; u novorozenců a malých kojenců je ale tato hodnota vyšší – u nedonošených dětí až 10 %). Objem plazmatické vody je abnormální u řady patologických stavů, zejména při dehydrataci, anémii, polycytémii, srdečním selhání, hypoalbuminémii či abnormální osmolalitě plazmy.
Objem intersticiální tekutiny (fyziologicky 15 % tělesné hmotnosti) výrazně stoupá při onemocněních spojených s otoky (srdeční selhání, exsudativní enteropatie, jaterní onemocnění, nefrotický syndrom, sepse).
Objem tekutin v tělesných dutinách stoupá při ascitu, pleurálním výpotku, hydrocefalu.
1.2. Složení tělesných tekutin
Obsah elektrolytů v ECT a ICT je odlišný. V ECT převažují sodíkové a chloridové ionty. V ICT je hlavním kationtem draslík – jeho koncentrace je přibližně 30krát vyšší než v ECT. V ICT jsou dále hojně zastoupené proteiny, organické anionty a fosfáty. Stálý obsah aniontů v ECT a ICT je zajištěn neprostupností intracelulárních molekul přes buněčné membrány, které ECT od ICT oddělují. Naproti tomu distribuce kationtů (sodík, draslík) je řízena aktivním transportem pomocí Na,K-ATPázových pump, které transportují sodík z buněk a draslík do buněk.
Klinicky má znalost odlišného složení ECT a ICT zásadní význam. Běžně měřené sérové koncentrace iontů nemusejí odpovídat jejich celkovému obsahu v organismu. Tento rozdíl může být způsoben větším objemem ICT a odlišnou koncentrací iontů (např. draslíku, fosforu) v ICT než v ECT. Např. i přes masivní ztráty draslíku z ICT může být jeho deplece provázena normální či zvýšenou koncentrací v séru, zejména při diabetické ketoacidóze (viz příslušný oddíl).
1.3. Osmolalita tělesných tekutin
Osmolalita je koncentrace osmoticky aktivních látek v jednotce hmotnosti rozpouštědla. Osmolarita je definována jako koncentrace osmoticky aktivních látek v jednotce objemu rozpouštědla. Za fyziologických okolností je osmolalita plazmy 280–295 mosmol/kg. Osmolalita je dána celkovým počtem rozpuštěných částic, nezáleží přitom na jejich velikosti. Rozdíl v množství osmoticky aktivních (na vodu působících) částic na obou stranách propustné membrány vytváří osmotický tlak, osmotický koncentrační gradient. Z klinického pohledu je prvořadé zjistit změny osmolality ECT. Osmolalitu plazmy lze orientačně vypočítat podle vzorce:
osmolalita plazmy [mosmol/kg] = 2x Na+ [mmol/l] + glykémie [mmol/l] + urea [mmol/l]
Obvykle je takto vypočtená osmolalita o něco nižší než osmolalita změřená. Rozdíl činí zpravidla méně než 10 mosmol/kg. Glykémie a hladiny urey za fyziologického stavu ovlivňují osmolalitu málo.
Při hyperglykémii stoupá osmolalita plazmy, ale nikoliv intracelulárního prostoru. Voda proto přechází z ICT do ECT. Důsledkem je diluční hyponatrémie bez poklesu osmolality plazmy.
Pokud je změřená osmolalita vyšší o více než 10 mosmol/kg ve srovnání s vypočtenou osmolalitou, jsou příčinou tzv. „neměřitelné osmoly“ v plazmě, které společně tvoří tzv. osmotic gap. Mezi „neměřitelné osmoly“ patří etanol, metanol, etylenglykol nebo manitol.
Při léčbě patologických hodnot sérové osmolality se vyhýbáme rychlým „léčebným“ korekcím. Většina poruch osmolality vzniká v průběhu hodin či desítek hodin a průběžně vyvolává řadu kompenzačních mechanismů v jednotlivých oddílech tělesných tekutin. Rychlá korekce s náhlými změnami osmolality ohrožuje především buňky CNS – buď edémem (při rychlém iatrogenním poklesu plazmatické osmolality), nebo buněčnou dehydratací (při rychlém iatrogenním vzestupu plazmatické osmolality). V obou případech může následovat myelolýza (centrální pontinní myelolýza).
Efektivní osmolalita (tonicita) je koncentrace těch rozpuštěných látek, které nesnadno přecházejí do buněk. Proto se v tonicitě neuplatňuje urea, která mezi ECT a ICT přechází celkem volně. Hlavními komponentami tonicity jsou soli Na a glukóza (tzv. efektivní soluty). Tonicitu určují z více než 95 % soli Na.
1.4. Regulace objemu a osmolality tělesných tekutin
Organismus reaguje i na velmi malé změny v objemu tělesných tekutin (1 %). Informace o změně objemu krevní plazmy pocházejí z baroreceptorů v oblouku aorty, receptorů v glomus caroticum a nízkotlakých receptorů v srdečních síních. Aferentní dráhy (n. vagus, n. glossopharyngeus a sympatický nervový systém) přivádějí tyto signály do center v CNS – v prodloužené míše, pontu a v hypotalamu. Tam jsou zpracovány a následně vedou k aktivaci efektorových mechanismů.
Mezi efektorové systémy patří antidiuretický hormon (ADH), systém kalikrein-bradykinin, systém renin-angiontenzin-aldosteron, renální prostaglandiny, srdeční a hypotalamický natriuretický peptid, sympatikus-parasympatikus a další. Dojde k ovlivnění srdeční činnosti, průsvitu cév a ke změnám ve vylučování sodíku a vody ledvinami. Současně se mění pocit žízně a tím příjem tekutin, což také přispívá k obnovení fyziologického objemu tělesných tekutin.
Změny osmolality (již kolem 1 %) registruje osmoregulační centrum v hypotalamu, které řídí sekreci ADH. Sekrece ADH se zvyšuje při vzestupu osmolality nad 280 mosmol/kg. Centrum žízně se aktivuje při osmolalitě nad 290 mosmol/kg. K této aktivaci přispívají i neosmotické mechanismy, např. průtok krve v juxtamedulární zóně ledvin.
2. SODÍK
Sodíkové (natriové) ionty jsou nejdůležitějším kationtem ECT a nejvíce ovlivňují hodnotu extracelulární osmolality a tím zachování intravaskulárního objemu. Fyziologická sérová koncentrace sodíkových iontů (natrémie) je 136–145 mmol/l.
Více než 40 % sodíku je v organismu obsaženo v kostech, zbytek v intersticiální a intravaskulární tekutině. Na+ ionty ze stravy se rychle resorbují v gastrointestinálním traktu. Tuto resorpci zvyšují mineralokortikoidy a glukóza. Kotransportérového efektu glukózy a Na+ se využívá v perorálních rehydratačních nápojích. Na+ ionty se vylučují ledvinami a v menší míře potem. Stolicí se za fyziologických okolností vylučují minimálně, ztráty stoupají při průjmu. Koncentrace Na+ iontů v potu je 5–40 mmol/l. Ke zvýšeným ztrátám potem dochází při cystické fibróze, při deficitu aldosteronu a při pseudohypoaldosteronismu.
Zvýšení sérové koncentrace Na+ iontů (hypernatrémie) způsobuje zvýšení osmolality plazmy. To vyvolá pocit žízně a zvýšení sekrece ADH. Následuje renální reabsorpce vody a zvýšení tělesného obsahu vody. Naopak snížení osmolality plazmy sekreci ADH zastaví. Vylučování Na+ iontů ledvinami není řízeno regulačními mechanismy osmolality. Na exkreci Na+ iontů močí má vliv efektivní plazmatický objem prostřednictvím renin-angiotenzin-aldosteronového systému a intrarenální mechanismy.
2.1. Hypernatrémie
Hypernatrémie je definována jako hodnota natrémie vyšší nežli 145 mmol/l. Příčiny hypernatrémie shrnuje tabulka 1.
Tab. 1. Etiologie hypernatrémie. 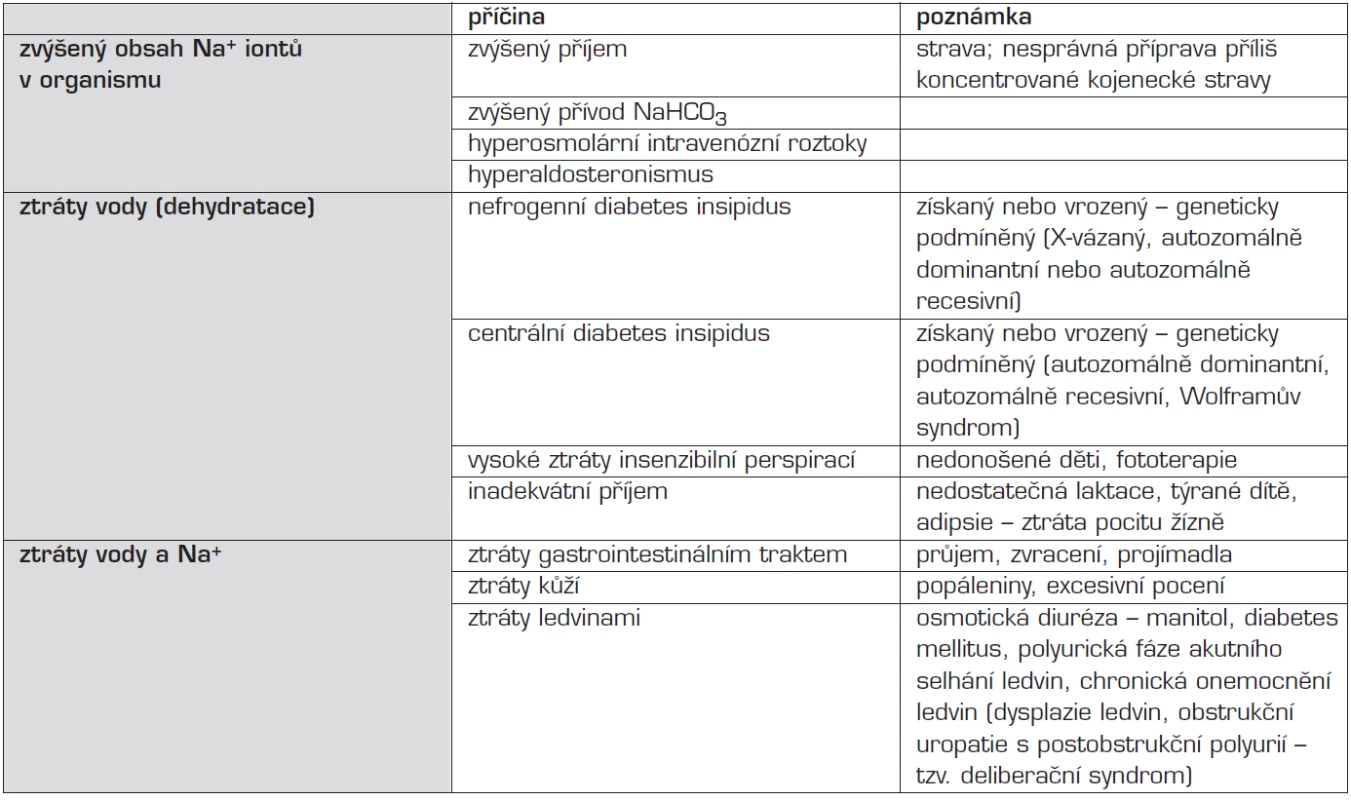
2.1.1. Klinické projevy hypernatrémie
Většina dětí s hypernatrémií má klinické známky dehydratace, nicméně vzhledem k přesunu Na+ iontů z intracelulární do extracelulární tekutiny může být zprvu krevní tlak normální, diuréza zachovaná a známky dehydratace maskované („těstovité podkoží“, kožní řasa na břiše nemusí být patrná, je nutné vyšetření kožní řasy v axile). Tíže a rychlost rozvoje hypernatrémie (i pokud není provázena dehydratací) má přímý vliv na CNS symptomatologii (dráždivost, spavost, letargie). Křeče a porucha vědomí jsou často projevem devastujícího krvácení do CNS, protože dochází k úbytku vody v mozkových buňkách, k buněčné dehydrataci a ke zmenšení objemu mozku s následným cévním poškozením. Krvácení může být subarachnoidální, subdurální nebo intraparenchymatózní. Podobné příznaky vznikají při rychlé korekci hypernatrémie. Těžká hypernatremická dehydratace může být provázena trombotickými komplikacemi v oblasti mozkových splavů, ale i v periferních a renálních žilách.
2.1.2. Diferenciální diagnostika hypernatrémie
Etiologii hypernatrémie často vysvětlí již anamnéza (ztráty vody, dehydratace, chybná příprava kojenecké stravy). Není-li dehydratace patrná, je důležité objasnit přívod sodíku. U hypernatrémie způsobené nadměrným příjmem je exkreční frakce Na+ zvýšená, u hypernatrémie z nadměrné ztráty vody je exkreční frakce nízká. Při hyperaldosteronismu je hypernatrémie obvykle středně závažná, je spojena s otoky, hypertenzí, hypokalémií a metabolickou alkalózou. Při extrarenálních ztrátách vody je objem moči snížen a moč je velmi koncentrovaná, s osmolalitou často nad 1000 mosmol/kg. Při renálních ztrátách vody (renální nebo centrální diabetes insipidus) je diuréza zvýšená a moč je hypoosmolární (osmolalita moči nedosahuje osmolality plazmy). Při kombinovaných deficitech Na+ a vody reagují ledviny na snížený cirkulující volum poklesem diurézy, koncentrovanou močí a retencí sodíku (Na+ v moči pod 20 mmol/l). Exkreční frakce Na+ je nižší než 1–2 %.
2.1.3. Léčba hypernatrémie
Úpravu hypernatrémie lze ukázat na klinickém případu hypernatremické dehydratace. Cílem je doplnit tekutiny (zajistit efektivní perfuzi tkání) při zajištění pomalého poklesu natrémie (o 0,5 mmol/hod, t.j. o 12 mmol/24 hod). Při rehydrataci by koncentrace sodíku v infuzním roztoku neměla být o více než 60 mmol/l nižší než aktuální natrémie. Např. při sérové hladině Na+ 163 mmol/l je vhodným rehydratačním roztokem 2/3 fyziologický roztok (s koncentrací Na+ 103 mmol/l). Platí tedy, že čím těžší je hypernatrémie, tím vyšší koncentraci Na+ podáváme v infuzních rehydratačních roztocích. Kromě komerčně vyráběných infuzních roztoků lze použít individuálně připravené roztoky s definovaným obsahem Na+ (do roztoků přidáváme molární, tj. 5,85% roztok NaCl, případně v kombinaci s 4,2% nebo 8,4% (molárním) roztokem NaHCO3). Při závažné dehydrataci je počáteční rychlost infuze 25–30 ml/kg/hod a podle vývoje klinického stavu (úprava krevního tlaku, pulzu, zahřívání periferních tkání, zlepšení stavu vědomí) rychlost infuze zpomalujeme.
Každý stav s hypernatrémií vyžaduje pečlivé monitorování pacienta, časté kontroly vnitřního prostředí, sledování diurézy, stavu vědomí a vývoje váhy dítěte.
Složení a osmolaritu často používaných infuzních roztoků shrnuje tabulka 2.
Tab. 2. Nejvýznamnější složky a celková osmolarita často používaných infuzních roztoků. Některé z uvedených roztoků obsahují další přísady. 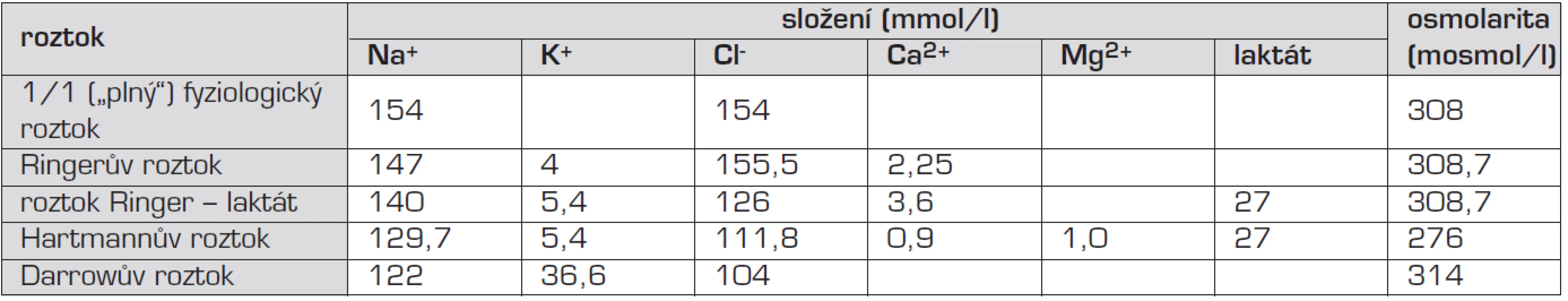
2.2. Hyponatrémie
Hyponatrémie je definována jako pokles natrémie pod 135 mmol/l. Natrémii (sérovou hladinu sodíkových iontů) ovlivňuje objem celkové tělesné vody a celkový obsah Na+ v organismu. Hyponatrémie je častou (a někdy nerozpoznanou) iontovou poruchou u hospitalizovaných pacientů. Příčiny hyponatrémie shrnuje tabulka 3.
Tab. 3. Etiologie hyponatrémie. Součástí klasifikace hyponatrémie je posouzení celkového objemu tělesné vody. 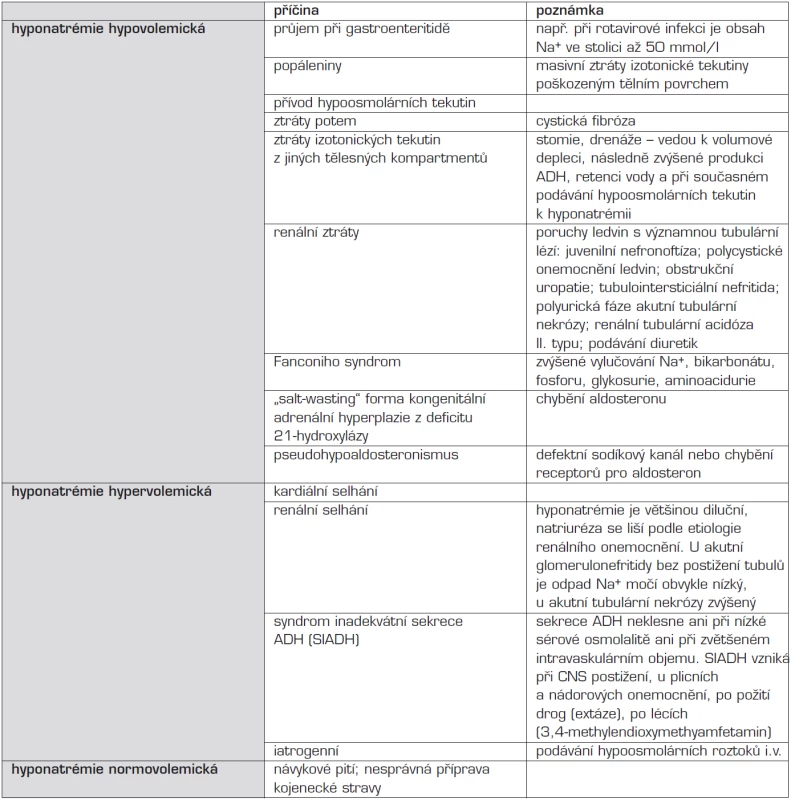
2.2.1. Klinické projevy hyponatrémie
Hyponatrémie vede k přesunu vody do intracelulárního prostoru a k edému buněk. Ve většině orgánů nepůsobí edém buněk akutní problémy, ale edém mozkových buněk vede k nitrolební hypertenzi. Akutně vzniklá těžká hyponatrémie (rychlý pokles sérového Na+ z normálního pásma na hodnoty pod 120 mmol/l) může způsobit poruchu vědomí, křeče a v extrémním případě až konus. Naopak při chronické hyponatrémii může být pacient asymptomatický.
Hyponatrémie se tedy projevuje především příznaky edému mozku – bolestí hlavy, nauzeou, anorexií, zvracením, letargií, agitovaností, snížením reflexů, křečemi až kómatem. Z dalších příznaků lze pozorovat Cheyne-Stokesovo dýchání, bolesti a křeče svalů.
2.2.2. Diferenciální diagnostika hyponatrémie
Již z anamnézy lze u řady pacientů stanovit příčinu hyponatrémie – průjem, léčbu diuretiky, případně inadekvátní příjem hypotonických tekutin (intravenózně nebo perorálně). Polyurie s normálním či zvýšeným odpadem Na+ močí, někdy ve spojení s enurézou, naznačuje možnost renální poruchy (např. juvenilní nefronoftíza).
Pacienti s hyponatrémií mohou mít osmolalitu plazmy nízkou, normální či vysokou. Při hyperglykémii, po aplikaci osmoticky aktivních látek (např. manitolu) nebo v urémii může být hyponatrémie provázena normální či dokonce zvýšenou osmolalitou plazmy. Hyperglykémie ani zvýšená hladina urey nemají při hyponatrémii protektivní účinek na CNS.
U pacientů s hyponatrémií je nutné zhodnotit stav hydratace. Příčiny hypovolemické hyponatrémie jsou renální (močová koncentrace Na+ přesahuje 20 mmol/l) a non-renální (močová koncentrace Na+ pod 10 mmol/l). Vylučování Na+ močí ovlivňují diuretika a metabolická alkalóza. Hyponatrémie s hyperkalémií a natriurézou je příznačná pro hypoaldosteronismus. U pacientů s hypervolemickou hyponatrémií je stanovení odpadu Na+ močí diagnosticky přínosné (močová koncentrace Na+ pod 10 mmol/l), vyjma pacientů s renální insuficiencí.
2.2.3. Léčba hyponatrémie
Jako příklad léčby hyponatrémie slouží schéma postupu při hyponatremické dehydrataci. Pacient má klinické známky dehydratace, úbytek ECT v průběhu 48 hodin, nízkou osmolalitu séra a hyponatrémii pod 125 mmol/l.
Je třeba doplnit objem ECT a deficit natria. Orientačně platí, že děti s hmotností 1–10 kg mají denní potřebu tekutin 100 ml/kg tělesné hmotnosti, děti vážící 10–20 kg mají potřebu 1000 ml + 50 ml na každý kilogram nad 10 kg tělesné hmotnosti, děti s hmotností nad 20 kg mají denní potřebu 1500 ml + 20 ml na každý kilogram nad 20 kg tělesné hmotnosti. K vypočítané základní potřebě tekutin přičteme aktuální deficit. Při korekci natrémie se doporučuje zvyšovat sérovou hladinu o 12 mmol/l za 24 hodin (tj. o 0,5 mmol/l/hod), při výrazné klinické symptomatologii lze korigovat hyponatrémii i rychleji, maximálně však o 1 mmol/l/hod. Pro výpočet dodávky natria je vhodné stanovit tzv. cílovou hladinu natria, které chceme za určitou dobu dosáhnout. Natrémii kontrolujeme nejméně každých 12 hodin.
Deficit Na+ spočítáme podle vzorce:
deficit Na+ [mmol] = (cílová hladina Na+ [mmol/l] - naměřená hladina Na+ [mmol/l]) x hmotnost [kg] x 0,6
Pokud se u dítěte s hmotností 10 kg s Na+ = 120 mmol/l rozhodneme za 12, resp. 24 hodin dosáhnout natrémie 126, resp. 132 mmol/l, musíme pro korekci natrémie dodat 36 mmol Na+ za 12 hod, resp. 72 mmol Na+ za 24 hod. K tomuto množství připočítáme základní denní potřebu Na+ (3–5 mmol/kg/24 hodin).
3. DRASLÍK
Sérová koncentrace draslíku (kalémie) je za fyziologických okolností 3,6–5,5 mmol/l, u novorozenců až 6 mmol/l.
Draslík je hlavním intracelulárním kationtem. V buňkách je jeho koncentrace přibližně 150 mmol/l. Nejvíce draslíku obsahují svaly. V moči je vzájemný poměr koncentrace natriových a kaliových iontů 2–3 : 1. Vysoká koncentrace draslíku v ICT (a tím i zachování membránového potenciálu a buněčné integrity) je udržována aktivním transportem Na,K-ATPázou. Při acidóze se koncentrace draslíku v ECT zvyšuje (uvolňuje se z buněk, kde je vázán na fosfátové pufry) a naopak. Se změnou pH o 0,1 se mění kalémie o 0,6 mmol/l. Zvýšení osmolality (únik vody a poté draslíku z buněk) vede k hyperkalémii. Zvýšení osmolality o 10 mosm/kg vede k vzestupu kalemie o 0,6 mmol/l. Klinickým příkladem je diabetická ketoacidóza, kdy stoupá sérová osmolalita vlivem hyperglykémie.
Draslík je bohatě obsažen v běžné stravě. Doporučovaný denní přívod je 1–2 mmol/kg. V tenkém střevě je absorbováno 90 % draslíku, jeho sekreci z tlustého střeva zvyšují aldosteron a glukokortikoidy a stoupá při urémii. Většina draslíku je z organismu vylučována ledvinami, jenom minimální množství potem a tlustým střevem. Z glomerulárního filtrátu se v distálním nefronu vyloučí 10–15 % kalia. V závislosti na denním příjmu vyloučí dospělý člověk 5–1000 mmol K+/24 hodin. Exkreci draslíku ledvinami reguluje především aldosteron. Vylučování draslíku zvyšují glukokortikoidy (svými mineralokortikoidními účinky) a antidiuretický hormon, stoupá také při vyšší diuréze, vyšším obsahu Na+ v distálním nefronu a po podání kličkových a thiazidových diuretik. Exkreci draslíku ledvinami snižuje inzulin a katecholaminy, klesá také při urémii.
3.1. Hyperkalémie
Hyperkalémie (K+ vyšší než 5 mmol/l, u novorozenců vyšší než 6 mmol/l) je nejobávanější elektrolytovou dysbalancí, protože může vyvolat letální arytmii.
Arteficiální nález vysoké hladiny kalia v plazmě bývá u dětských pacientů důsledkem obtížného krevního odběru, při kterém došlo k rozpadu buněk (komprese svalu, hemolýza v jehle, rozpad erytrocytů vlivem časové prodlevy od odběru do zpracování). Sérová hladina draslíku je o 0,4 mmol/l vyšší než hladina plazmatická v důsledku uvolnění draslíku z buněk během srážení. Tento rozdíl je vystupňován při trombocytóze a při leukémii.
Příčiny hyperkalémie shrnuje tabulka 4.
Tab. 4. Etiologie hyperkalémie. 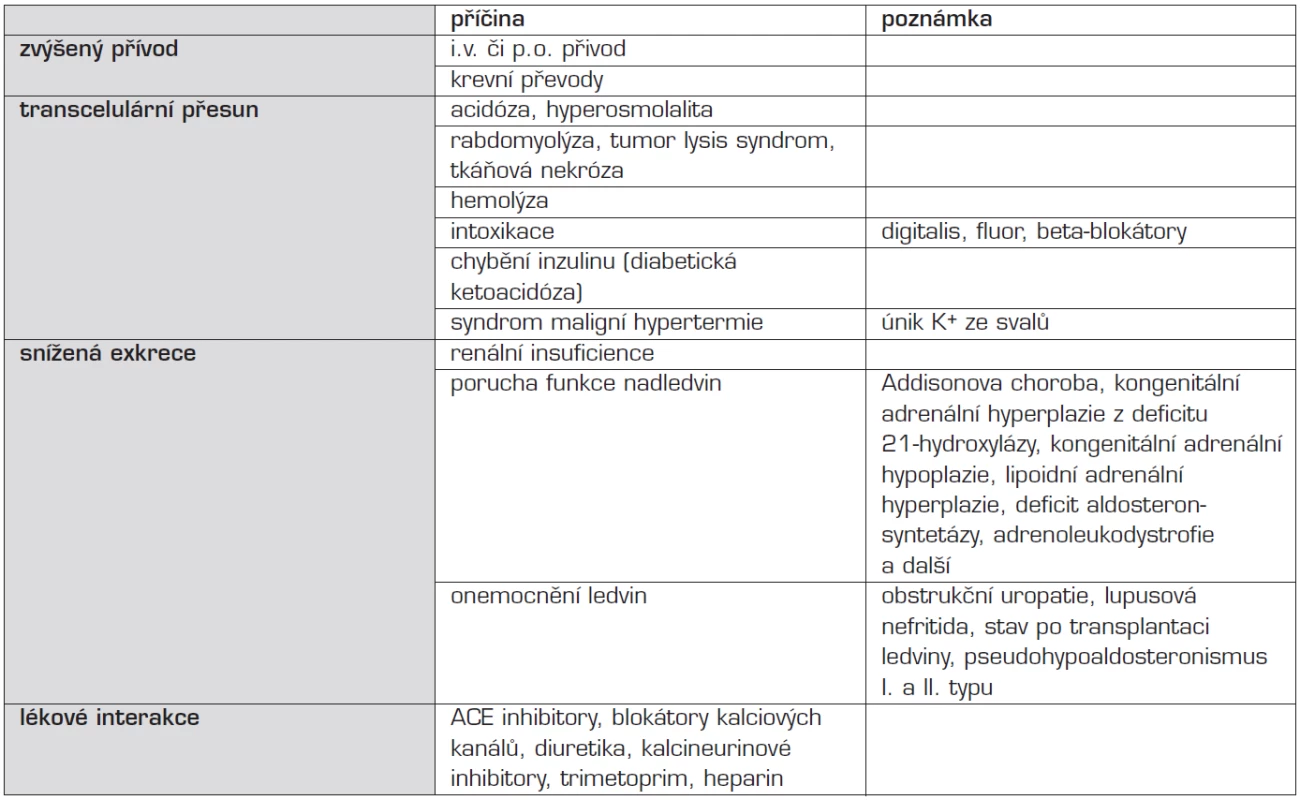
3.1.1. Klinické projevy hyperkalémie
Kritický je vliv hyperkalémie na převodní systém myokardu. Změny na EKG začínají hrotnatými vlnami T. Pokud kalémie dále stoupá, prodlužuje se interval PQ, poté se rozšiřuje QRS komplex, mizí vlna T a může dojít až ke komorové fibrilaci a asystolii. Někdy pacienti pociťují slabost, chvění a parestézie, ale většinou chybějí prodromální subjektivní příznaky a hyperkalémie působí přímo toxicky na myokard.
3.1.2. Diferenciální diagnostika hyperkalémie
V dětském věku je hyperkalémie způsobena nejčastěji dvěma mechanismy: selháním ledvin (snížená exkrece draslíku) a hypoaldosteronismem (zejména při kongenitální adrenální hyperplazii). K základním vyšetřením patří krevní obraz, biochemické vyšetření krve (včetně kreatinkinázy a laktátdehydrogenázy) a moči (včetně osmolality), vyšetření acidobazické rovnováhy a křivka EKG. V další fázi stanovujeme hladinu aldosteronu a spektra dalších steroidních hormonů. K odlišení renální a non-renální příčiny lze stanovit tzv. transtubulární draslíkový gradient (TTKG):
TTKG = (K+ v moči/K+ v séru) x (osmolalita séra/osmolalita moči)
Hodnoty TTKG nad 10 svědčí pro normální vylučování draslíku ledvinami, hodnota menší než 8 pro jeho nedostatečnou exkreci.
3.1.3. Léčba hyperkalémie
Sérová koncentrace K+ nad 6 mmol/l vyžaduje aktivní léčbu, hodnoty nad 7 mmol/l jsou indikací k akutní dialýze.
Z konzervativních postupů s cílem poněkud snížit riziko toxického vlivu hyperkalémie na myokard se používá podávání beta-mimetik, které vede k poklesu hladiny sérového kalia o více než 1 mmol/l během 15–20 minut. Efekt však není trvalý. Podává se salbutamol (např. Ventolin) či terbutalin (Bricanyl) v obvyklých terapeutických dávkách ve formě inhalace nebo perorálně či parenterálně.
Toxicitu kalia dále sníží korekce acidózy a podání kalcia i.v. (10% Calcium gluconicum v dávce 0,5–1 ml/kg během 5 minut). Dávku lze opakovat. Pro zvýšení vstupu draslíku do buněk lze aplikovat glukózu i.v. v dávce 0,5–1 g/kg během 30 minut spolu s inzulinem (na 4–5 g glukózy 1 j. inzulinu). Lze zvážit i podání iontoměničů, jejichž účinek ale nastupuje až v řádu hodin.
3.2. Hypokalémie
Jako hypokalémii označujeme koncentraci K+ iontů v séru pod 3,6 mmol/l. Nejčastější příčinou hypokalémie v dětském věku je gastroenteritida. Při interpretaci hladiny kalia je nutné vzít v úvahu pH a osmolalitu krve. Příčiny hypokalémie shrnuje tabulka 5.
Tab. 5. Přehled příčin hypokalémie. 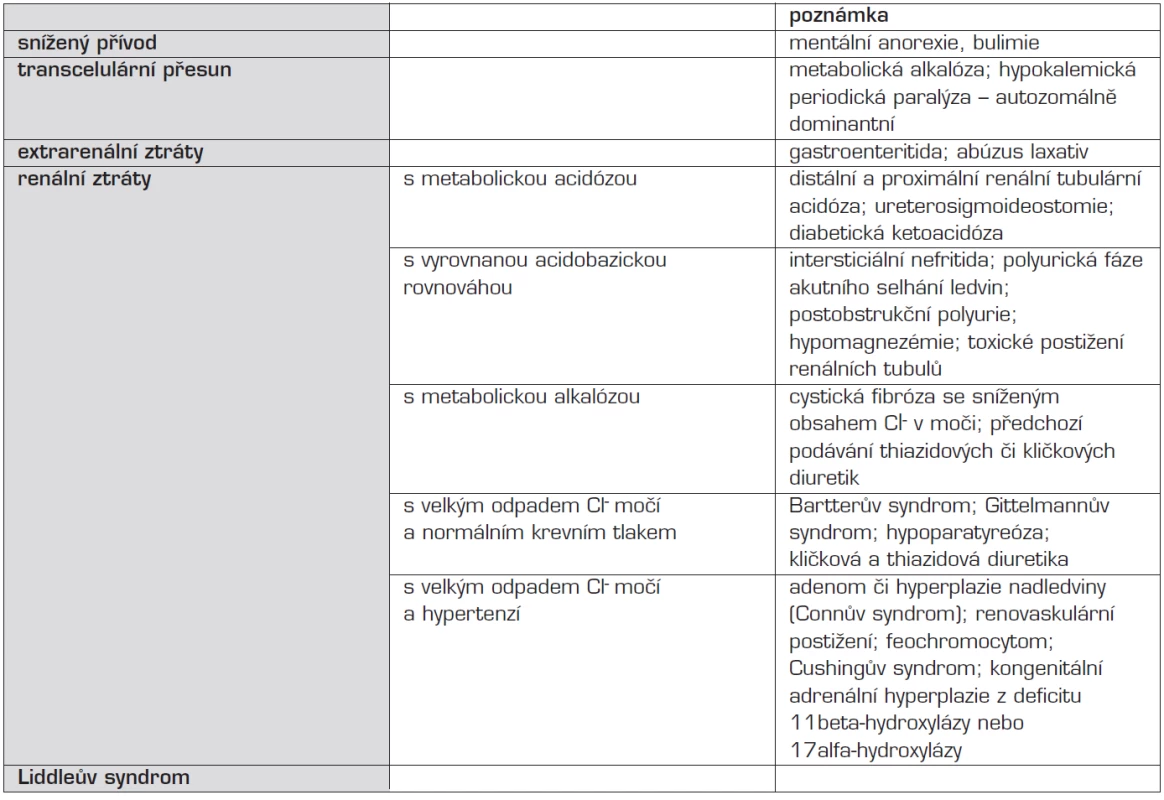
3.2.1. Klinické projevy hypokalémie
Mezi klinické příznaky hypokalémie patří svalová slabost, křeče lýtek a paží, obstipace až ileus (při kalémii pod 2,5 mmol/l), poruchy ventilace, paralýza (při extrémně nízkých hodnotách).
Dlouhodobá hypokalémie vede k hypokalemické nefropatii. Primární polydipsie (drážděním centra žízně) a pokles koncentrační schopnosti ledvin připomíná nefrogenní diabetes insipidus. V důsledku kompenzačních mechanismů ABR dochází k hyperamonémii.
Chronická hypokalémie u dětí zpomaluje růst (Bartterův syndrom, Gittelmannův syndrom).
3.2.2. Diferenciální diagnostika hypokalémie
Kromě případů gastroenteritidy a podávání léků lze příčinu hypokalémie jen obtížně zjistit z anamnézy.
Pokud současně zjišťujeme hypertenzi, můžeme uvažovat o vlivu mineralokortikoidů. Kombinace hypokalémie s metabolickou acidózou je typická pro gastroenteritidu nebo distální a proximální typ renální tubulární acidózy. Hypokalémie při současné metabolické alkalóze ukazuje na ztráty gastrointestinálním traktem, nadprodukci aldosteronu nebo Bartterův a Gittelmannův syndrom.
Při rozvoji hypokalémie se na EKG křivce postupně oplošťuje vlna T, zvýrazní se vlna U a dochází k depresi úseku ST. V dalším průběhu se mohou objevit síňové a komorové extrasystoly a stoupá citlivost k digitalisu.
3.2.3. Léčba hypokalémie
Substituce draslíku při hypokalémii má být pozvolná, 0,5–1 mmol/kg/hod, a koncentrace draslíku v infuzních roztocích by neměla přesáhnout 40 mmol/l (např. v plném Darrowově roztoku je koncentrace kalia 36,6 mmol/l). Molární roztok draslíku (7,5% KCl) je používán častěji k dodávce draslíku při přípravě parenterální výživy, při které je fyziologická potřeba draslíku 1–2 mmol/kg/24 hod.
Deficit K+ spočítáme podle vzorce:
deficit K+ [mmol] = (cílová hladina K+ [mmol/l] - naměřená hladina K+ [mmol/l]) x hmotnost [kg] x 0,3
Pro podávání kalia při léčbě diabetické ketoacidózy platí zvláštní pravidla (viz příslušná kapitola).
4. VÁPNÍK
Fyziologická sérová koncentrace celkového vápníku se pohybuje v rozmezí 2,15–2,79 mmol/l. 40–45 % vápníku je v séru vázáno na bílkoviny, 5–10 % je součástí komplexů s anionty kyselin. Ionizovaného vápníku je tedy přibližně 50 %. Snížení frakce ionizovaného vápníku pod 1 mmol/l zvýší neuromuskulární dráždivost, ale snižuje kontraktilitu svalů včetně myokardu. Hladina ionizovaného kalcia má vztah k pH krve: při alkalóze jeho hladina klesá, proto je psychogenní hyperventilace provázena tetanií. Hypokalcémie je častá mezi 12.–72. hodinou po narození, především u nedonošených dětí, u dětí s asfyxií a u novorozenců diabetických matek. Mnohdy je po narození pozorována tzv. tranzientní hypokalcémie, jejíž příčinou může být nedozrálost příštítných tělísek.
4.1. Hyperkalcémie
Hyperkalcémie nad 4 mmol/l může být životu nebezpečná, ale u dětí je poměrně vzácným nálezem. Možná příčiny hyperkalcémie shrnuje tabulka 6.
Tab. 6. Přehled příčin hyperkalcémie. 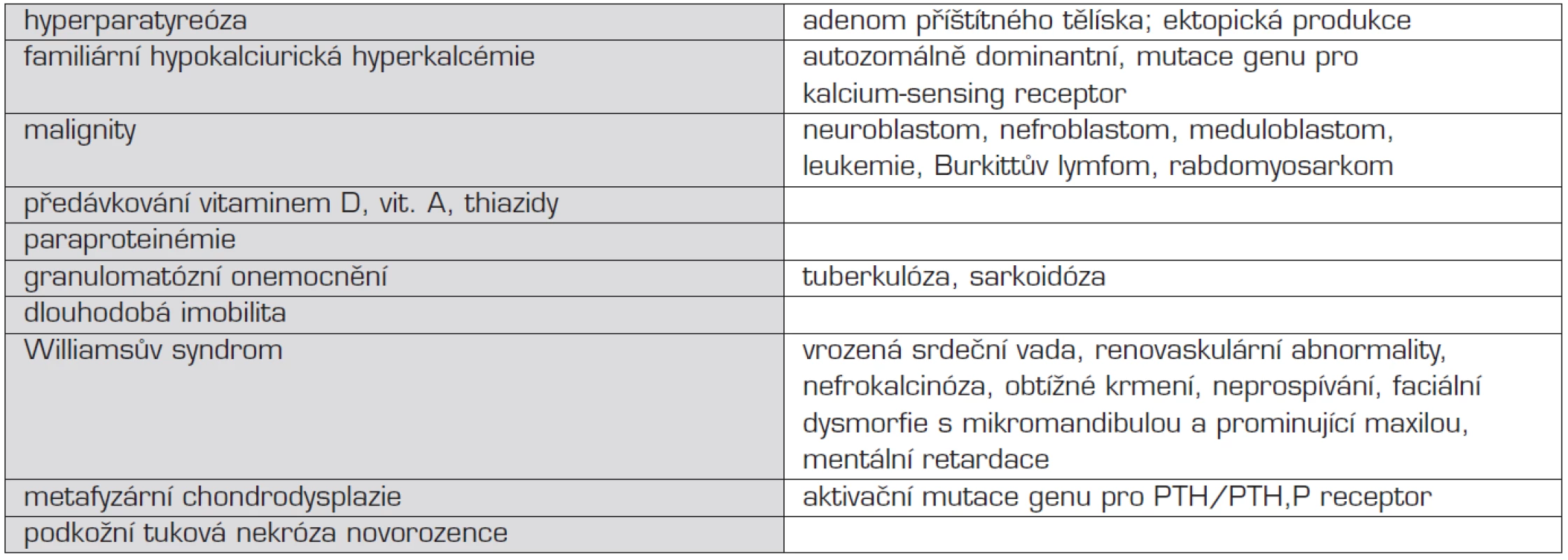
4.1.1. Klinické projevy hyperkalcémie
Hyperkalcémie se projevuje suchostí v ústech, nauzeou, zvracením, polydipsií, polyurií, zácpou, zmateností. EKG ukáže zkrácení QT intervalu. Pacient je při hyperkalcémii ohrožen zástavou srdce v systole.
4.1.2. Léčba hyperkalcémie
Mezi léčebné postupy s cílem zvládnout hyperkalcémii patří:
- Dodávka tekutin infuzí (zdvojnásobení fyziologické denní potřeby tekutin) s glukózou, Na+ a K+ včetně podání KH2PO4, protože fosfáty vážou vápník a snižují jeho uvolňování z kostí;
- furosemid v dávce 1 mg/kg (dávku možné opakovat při sledování bilance tekutin);
- prednison v dávce 0,5–1 mg/kg/24 hod. po dobu 7–10 dní (způsobí otevření kalciových kanálů a přestup kalcia do ICT);
- při závažné hyperkalcémii lze podávat kalcitonin v dávce 5–10 IU/kg/den, s.c., i.m., rozděleně do 2 dávek;
- bisfosfonáty, účinný je i.v. pamidronát, 0,5 až 1 mg/kg v jednorázové infuzi;
- v některých případech je nezbytná hemodialýza.
4.2. Hypokalcémie
Příčiny hypokalcémie shrnuje tabulka 7.
Tab. 7. Přehled příčin hypokalcémie. 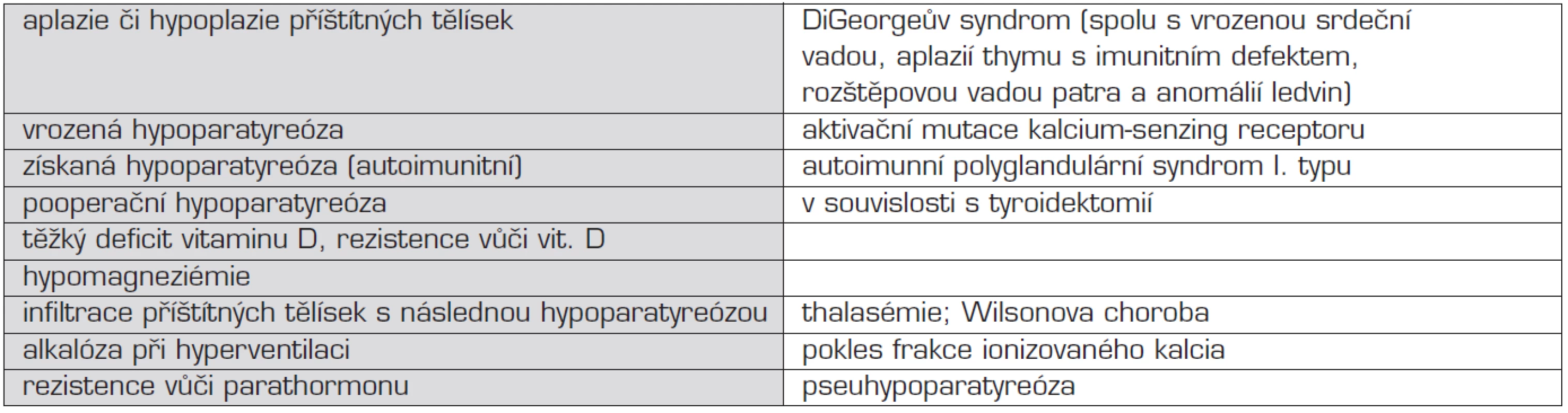
4.2.1. Klinické projevy hypokalcémie
Hypokalcémie se projevuje zvýšenou neuromuskulární dráždivostí. Pacient může pociťovat bolesti břicha a parestézie. Objektivně jsou patrné tetanické křeče, dysartrie, karpopedální spazmy (Trousseauův příznak) a Chvostkův příznak. Příznaky mohou být někdy mylně považovány za epilepsii. Pomalu vznikající a dlouhodobá hypokalcémie vede k opožděnému vývoji dentice, která je nekvalitní, je suchá kůže a na nehtech jsou patrné horizontální linie. Autoimunitnímu polyglandulárnímu syndromu I. typu předcházejí kožní a slizniční kandidové infekce (mukokutánní kandidóza). Na EKG bývá prodloužen QT interval, může se objevit až kongestivní srdeční selhání.
4.2.2. Léčba hypokalcémie
Pro akutní korekci hypokalcémie se podá 0,2 ml/kg (= 0,2 mmol/kg) 10% CaCl2 nebo 10% Ca guconicum/kg během 5 minut i.v. Jednotlivá dávka by neměla přesáhnout 10 ml roztoku. Dále lze pokračovat dávkou 0,4 ml/kg/hod i.v. po 8 hodin. Současně se podává i.v. magnézium (10% MgSO4) přibližně v poloviční dávce. Pro dlouhodobou léčbu hypoparatyreózy se používají deriváty vitaminu D.
5. HOŘČÍK
Fyziologická sérová koncentrace celkového hořčíku se pohybuje v rozmezí 0,78–0,99 mmol/l.
Hořčík je druhým nejvýznamnějším kationtem ICT. Až 60 % celkového tělesného hořčíku je uloženo v kostech. Intracelulární hořčík je ze 75 % vázán na proteiny, pouze 25 % hořčíku je ionizováno. Nejvyšší obsah hořčíku je v tkáních s vysokým buněčným metabolismem (játra, svaly). Pouze 1 % celkového tělesného hořčíku je součástí ECT (z toho je 60 % v ionizované formě, 15 % je vázáno v komplexech a 25 % vázáno na proteiny).
Hořčík je nezbytným kofaktorem téměř 300 enzymů (ATPázy, kinázy a jiné), stabilizuje buněčné membrány, snižuje nervosvalovou dráždivost a dráždí parasympatikus.
Hořčík je obsažen v zelenině, mase, mléce, ořechách a cereáliích. V tenkém střevě se vstřebává 30–50 % z hořčíku přijatého v potravě. Regulace jeho absorpce není zcela jasná. Uplatňuje se pasivní absorpce, kterou snižují látky vytvářející s Mg2+ komplexy (volné mastné kyseliny, fosfáty, oxaláty) a také vápník. Vitamin D a parathormon absorpci ovlivňují jen částečně. Mg2+ je vylučován ledvinami; jediným známým regulačním mechanismem je parathormon, který zvyšuje jeho tubulární resorpci.
5.1. Hypermagneziémie
Hypermagneziémie je u dětí málo častá. Většinou je sekundární. Přehled příčin hypermagneziémie přináší tabulka 8.
Tab. 8. Přehled příčin hypermagneziémie. 
Klinicky se hypermagneziémie projevuje až při vzestupu hladin nad 2 mmol/l. Objeví se somnolence, útlum nervosvalového přenosu se snížením šlachových reflexů, bradykardie až arytmie. U novorozenců mohou být prvním příznakem apnoické pauzy a opožděný odchod smolky.
Při léčení závažnějších případů hypermagneziémie se používá i.v. kalcium a kortikoidy (Prednison v dávce 1 mg/kg/den). Při dostatečné hydrataci lze podat furosemid.
5.2. Hypomagneziémie
Většina pacientů s hypomagneziémií nemá klinické příznaky a o odchylce se neví, neboť vyšetření Mg2+ v séru nepatří do panelu základních vyšetření. Přehled příčin hypomagneziémie shrnuje tabulka 9.
Tab. 9. Přehled příčin hypomagneziémie. 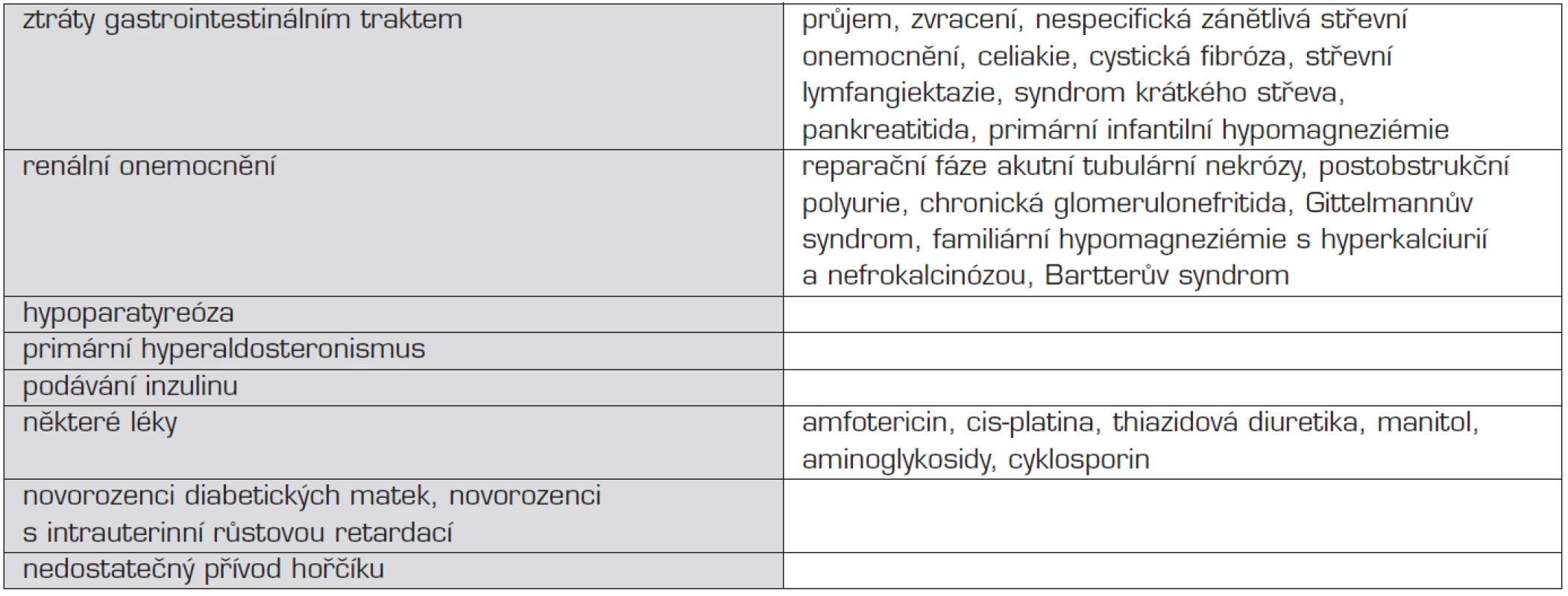
Hypomagneziémie způsobí sekundárně hypokalcémii, protože vázne sekrece parathormonu a klesá citlivost tkání na parathormon. To se při extrémní hypomagneziémii (při hladinách pod 0,4 mmol/l) klinicky projeví tetanií, pozitivním Chvostkovým a Trousseauovým příznakem, bývají přítomny extrasystoly a poruchy srdečního rytmu. Další klinické příznaky mohou souviset s hypokalémií.
Fyziologický denní příjem Mg2+ je 0,5 mmol/kg. Při těžké hypomagneziémii lze léčebně podat i.v. infuzi s 10% MgSO4 (v 1 ml je 0,4 mmol Mg2+). Pro dlouhodobou léčbu je vhodná p.o. substituce.
6. FOSFOR
Fyziologické sérové hladiny fosfátů se pohybují mezi 1,16 a 1,19 mmol/l. U dětí starších jednoho roku se za horní hranici považuje až 2,26 mmol/l, u novorozenců a mladších kojenců bývají hodnoty do 2,5 mmol/l.
Intracelulárně se fosfor vyskytuje především jako estery kyseliny fosforečné, extracelulárně jde o anorganický fosfor v podobě hydrogenfosforečnanů a dihydrogenfosforečnanů, při pH 7,4 ve vzájemném poměru 4 : 1. V ECT je obsaženo pouze 1 % celkového tělesného fosforu.
Fosfor je důležitou minerální součástí kostí, součástí životně důležitých organických sloučenin (nukleových kyselin, fosfolipidů, koenzymů), je nutný k esterifikaci cukrů (glykolýza). Jeho anorganické sloučeniny v séru a především v moči plní funkci pufrů. Metabolismus fosforu úzce souvisí s metabolismem vápníku i z hlediska regulačních mechanismů – hyperfosfatémie stimuluje sekreci parathormonu jednak přímo, jednak nepřímo snížením ionizovaného kalcia; kalcitriol zvyšuje střevní absorpci jak kalcia, tak fosfátů.
6.1. Hyperfosfatémie
Příčiny hyperfosfatémie shrnuje tabulka 10.
Tab. 10. Etiologie hyperfosfatémie. 
Sama hyperfosfatémie nemá klinické příznaky. Příznaky vyvolává souběžná porucha hladin kalcia. Delší trvání vede k sekundární hyperparatyreóze.
Léčba hyperfosfatémie závisí na vyvolávající příčině a zahrnuje dietní opatření, dostatečnou hydrataci a diurézu, podávání kalcia p.o., vazačů fosfátu, případně dialýzu.
6.2. Hypofosfatémie
Možné příčiny hypofosfatémie jsou shrnuty v tabulce 11.
Tab. 11. Příčiny hypofosfatémie. 
Klinické projevy hypofosfatémie lze rozdělit na akutní a chronické. Prudký pokles hladiny fosfátů (pod 1 mmol/l) způsobí hemolýzu a dysfunkci leukocytů, ovlivněním CNS vzniká až obraz metabolické encefalopatie s případnou poruchou vědomí. Dlouhodobá hypofosfatémie vede k rozvoji příznaků rachitidy, může se rozvinout kardiomyopatie.
Akutní hypofosfatémii lze zmírnit i.v. podáním roztoků fosfátových solí – KH2PO4 nebo NaH2PO4. Chronickou hypofosfatémii je nutné řešit podle vyvolávající příčiny, např. suplementací vitaminem D.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článek Rehydratační léčbaČlánek Hospitalizace dětí a dospívajících pro intoxikaci alkoholem a drogami na dětských odděleních v ČRČlánek Lesk a bída české pediatrieČlánek XVII. Moravskoslezské pediatrické dny 11.–12. 11. 2011, Ostrava, Clarion Congress Hotel (dříve Atom)Článek Charta práv dětí v nemocnici
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2011 Číslo 5- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficitmi v reálnej praxi
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
-
Všetky články tohto čísla
-
Vliv pasivní expozice cigaretovému kouři na zdraví a vývoj dětí v období prenatálním i postnatálním až do věku sedmi let
Výsledky studie ELSPAC - Kvalita života detí trpiacich alergickou rinitídou
- Vplyv dýchania cez ústa na rastové zmeny splanchnokránia v detskom veku
- Tromboembolické príhody u novorodencov pohľadom dnešnej medicíny
- Vnitřní prostředí a patofyziologie tělesných tekutin
- Rehydratační léčba
- Hospitalizace dětí a dospívajících pro intoxikaci alkoholem a drogami na dětských odděleních v ČR
- Půl století české pediatrické endokrinologie a diabetologie
- Lesk a bída české pediatrie
- 17th Workshop of Middle-European Society of Paediatric Endocrinology (MESPE)
- Cena České pediatrické společnosti ČLS JEP
- XVII. Moravskoslezské pediatrické dny 11.–12. 11. 2011, Ostrava, Clarion Congress Hotel (dříve Atom)
- Charta práv dětí v nemocnici
-
Vliv pasivní expozice cigaretovému kouři na zdraví a vývoj dětí v období prenatálním i postnatálním až do věku sedmi let
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Rehydratační léčba
- Tromboembolické príhody u novorodencov pohľadom dnešnej medicíny
- Vnitřní prostředí a patofyziologie tělesných tekutin
- Vplyv dýchania cez ústa na rastové zmeny splanchnokránia v detskom veku
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



