-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Imunodeficience
Autori: A. Šedivá
Pôsobisko autorov: Ústav imunologie UK 2. LF a FN Motol, Praha
Vyšlo v časopise: Čes-slov Pediat 2011; 66 (6): 387-398.
Kategória: Vybrané kapitoly z nové učebnice Klinická pediatrie
Nakladatelství Galén připravuje k vydání novou učebnici „Klinická pediatrie“, která bude určena jak pro pregraduální studium na lékařských fakultách, tak i v rámci postgraduálního vzdělávání pro přípravu na atestaci z dětského lékařství a z praktického dětského lékařství. Autoři věří, že učebnici ocení i dětští lékaři v praxi.
Ve spolupráci nakladatelství Galén a redakce Česko-slovenské pediatrie na stránkách našeho časopisu v letošním roce postupně uveřejňujeme jednotlivé stati z nové učebnice – a jako bonus také některé kapitoly, které se do nové učebnice už „nevešly“, protože učebnice má přesně stanovený rozsah.
1.1 NOMENKLATURA
Nomenklatura imunodeficiencí je uvedena u každé nozologické jednotky v jejich přehledu a v tabulkách 1 a 2.
Tab. 1. Primární imunodeficience – přehled. 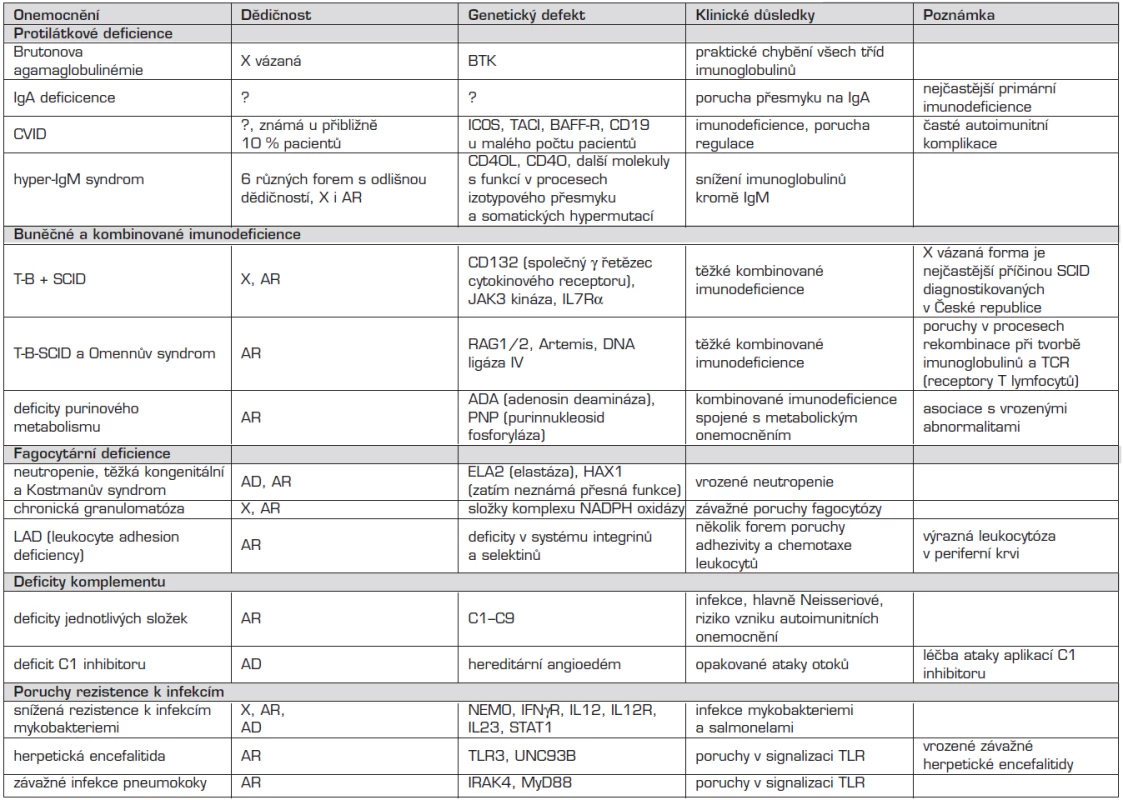
Tab. 2. Sekundární imunodeficience – přehled. 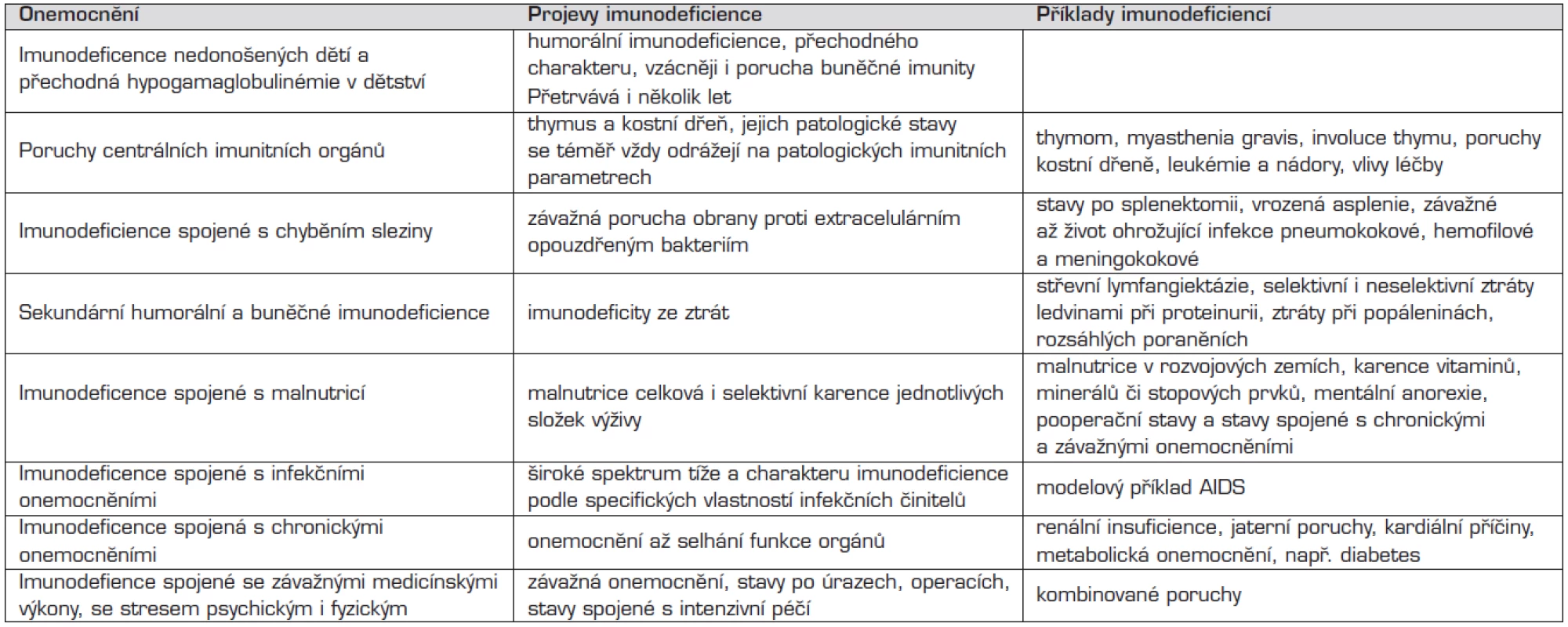
1.2 ÚVOD A DEFINICE
Imunodeficience jsou stavy charakterizované poruchou struktury či funkce imunitního systému. Ve většině případů vedou imunodeficience ke zvýšené náchylnosti k infekcím, ale mohou přispívat také k rozvoji autoimunitních onemocnění, alergií nebo nádorů.
Obranyschopnost organismu proti infekcím a vlivům zevního prostředí je zajišťována na několika úrovních. První bariéru tvoří obecné obranné mechanismy: povrch kůže a sliznic a jejich ochranné mechanismy, například tvorba potu, hlenu, pohyb řasinek, prostředí žaludku, přirozená střevní mikroflóra a další. Poruchy v těchto složkách mohou vést ke klinickému obrazu snížené rezistence k infekcím, aniž by se jednalo o poruchu imunity. Imunologické mechanismy obranyschopnosti potom zahrnují složky imunity vrozené a získané, které tvoří hierarchický systém orgánů a složek imunitního systému, které po aktivaci vedou k rozvoji imunitní reakce. Do vrozených složek imunity patří z humorálních faktorů komplementový systém a různé sérové bílkoviny s efektem zejména opsonizačním, z buněčných složek pak profesionální fagocyty (polymorfonukleární leukocyty a monocyty-makrofágy) a NK (natural killer) buňky. Specifické složky imunity představují ve své buněčné podobě zejména lymfocyty T a B a jejich subpopulace, představiteli humorální složky specifické imunity jsou protilátky. Imunitní systém je dále velmi úzce spojen se systémem hemokoagulačním a neuroendokrinním, s nimiž společně zajišťují v širším slova smyslu homeostázu organismu.
Imunokompetentní buňky vznikají ze společné kmenové buňky v kostní dřeni. Zrají a diferencují se v centrálních lymfatických orgánech, kterými jsou kostní dřeň a thymus. Vlastní imunitní reakce probíhá v periferních lymfatických orgánech, které tvoří buď anatomicky definované struktury, nebo funkční celky. Do první skupiny patří lymfatické uzliny a slezina, do druhé potom slizniční a kožní imunitní systém, imunitní systém jednotlivých orgánových celků.
1.3 EPIDEMIOLOGIE
Primární imunodeficence jsou onemocnění velmi vzácná. Jejich frekvence v populaci se pohybuje od 1 : 500 u zdaleka nejčastějšího deficitu IgA k nízkým frekvencím přibližně 1 : 100 000 u těžkého kombinovaného imunodeficitu. Některé jednotky jsou ještě vzácnější. Vyjádření frekvence v populaci je velmi ovlivněno malými čísly a zřejmě podhodnocenou diagnostikou, kdy řada pacientů uniká přesnému diagnostickému stanovení. Vrozenými imunodeficiencemi jsou postiženi asi 2krát častěji chlapci než dívky, což je důsledek skutečnosti, že na chromozomu X je soustředěno hned několik genů, jejichž mutace vedou k imunodeficienci.
Oproti tomu jsou sekundární imunodeficience časté stavy, které však nelze zachytit ve formě přesného uvedení frekvence výskytu pro jejich mnohočetnost a různorodost a nasedání na celou škálu dalších onemocnění. Obecně lze říci, že nejčastější sekundární imunodeficence je v rámci globálního pohledu způsobena malnutricí, na druhém místě je sekundární získaná imunodeficience při AIDS.
1.4 ETIOLOGIE A KLASIFIKACE IMUNODEFICIENCÍ
Imunodeficience je možné rozdělovat z mnoha hledisek, která se vzájemně překrývají. V praktické rovině se setkáváme s rozdělením podle etiologie imunodeficience nebo podle složky imunitního systému, která je u dané imunodeficience postižena. Obě tato dělení vystihují velmi dobře charakter imunodeficiencí a společně dávají dobrý podklad k zařazení nozologických jednotek.
Podle etiologie se imunodeficience dělí na primární (vrozené) a na sekundární (získané) imunodeficience, které se vyvíjejí jako komplikace některé jiné choroby nebo pod vlivem různých faktorů. Primární imunodeficience jsou způsobeny obvykle poruchou na genové úrovni a tkví v mutacích genů, které kódují složky imunitního systému. Sekundární imunodeficience jsou důsledkem jiných onemocnění, která postihují orgány či složky imunitního systému.
Podle postižení jednotlivých součástí imunitního systému se imunodeficience rozdělují na poruchy specifické imunity (protilátkové imunodeficience, poruchy lymfocytů T, kombinované poruchy), na poruchy nespecifické imunity (poruchy fagocytujících buněk, defekty komplementového systému) a v případě primárních imunodeficiencí ještě na imunodeficience spojené s jinými vrozenými syndromy.
Dynamický rozvoj poznatků o primárních imundeficiencích v posledních letech mění a do určité míry rozšiřuje toto základní dělení a zařazuje celé skupiny nových onemocnění, jako jsou další poruchy mechanismů vrozené imunity, které přesně nezapadají do základních schémat. Patří sem imunodeficience úzce vymezené, které na rozdíl od klasických imunodeficiencí se širokou vnímavostí velkému spektru infekcí vedou k patologické vnímavosti omezenému a jasně vymezenému spektru patogenů. Příčiny těchto stavů jsou většinou deficity postihující receptory a signální cesty účastnící se iniciálních, vrozených kroků imunitní reakce a dále celá skupina periodických zánětlivých stavů.
Klinické jednotky spadající do uvedených kategorií jsou popsány v odpovídajících odstavcích.
1.5 KLINICKÝ OBRAZ
Základním klinickým příznakem imunodeficiencí je zvýšená náchylnost k infekcím, která je do určité míry obdobná u jednotlivých kategorií imunodeficiencí. Klinický obraz je tedy rozveden v tomto odstavci a platí pro celé skupiny onemocnění.
Infekce u imunodeficitních pacientů jsou charakteristické svým prolongovaným, komplikovaným, atypickým nebo recidivujícím průběhem. U většiny typů imunodeficiencí je nejčastěji postižen infekcemi dýchací systém, zejména dolní cesty dýchací. Z oblasti ORL pro poruchu obranyschopnosti mohou svědčit recidivující otitidy a mastoiditidy. Naopak infekce postihující pouze horní respirační trakt nebývají příznakem závažnější imunodeficience. Dalším systémem postiženým u imunodeficitních pacientů je gastrointestinální trakt. Průjmy a jiné symptomy postižení GIT mohou být způsobeny bakteriálními a parazitárními patogeny nebo střevní dysmikrobií. První nespecifickou manifestací u malých dětí může být neprospívání, u větších dětí váhový úbytek. Imunodeficience se dále může projevit sepsí, meningitidou, kožními a slizničními eflorescencemi (pyodermiemi, flegmónami, ekzémy), dále artritidami, osteomyelitidami, abscesy vnitřních orgánů. Neobvyklý mikrobiologický nález u výše popsaných infekcí (zejména oportunní mikroby) je vždy suspektní z poruchy imunity.
Respirační infekce bývají známkou humorálních deficiencí, v těžší formě a u infekcí intracelulárními patogeny známkou buněčných a kombinovaných imunodeficiencí. Hnisavé komplikace provázejí deficience fagocytární.
První manifestací imunodeficience může být také reakce na očkování, zejména na BCG nebo další živé vakcíny. Absence reakce však diagnózu imunodeficience nevylučuje.
Věk manifestace příznaků imunodeficience záleží na typu postižené složky. Protilátkové imunodeficience se obvykle neprojeví dříve než po prvním půl roce života (do té doby je kojenec chráněn mateřskými protilátkami přenesenými transplacentárně). Těžké kombinované imunodeficience se projeví již několik dní až měsíců po narození v závislosti na molekulární podstatě poruchy imunity a v závislosti na podmínkách, ve kterých dítě vyrůstá. Některé vrozené syndromy spojené s poruchou imunity se mohou dříve manifestovat přidruženými symptomy, infekce nastupují až později (např.Di Georgeův syndrom – projeví se křečemi nebo srdeční vadou, Wiskottův-Aldrichův syndrom se může nejdříve projevit ekzémem nebo krvácivými projevy).
U imunodeficitních pacientů se také ve zvýšené míře vyskytují nádorová onemocnění, zejména lymfatické tkáně, a dále alergické a autoimunitní choroby. Většinou se tyto komplikace vyvíjejí až v průběhu onemocnění, ale mohou být i jednou z prvních manifestací (např. autoimunitní poruchy postihující krevní buňky).
1.6 DIAGNOSTIKA, LABORATORNÍ VYŠETŘENÍ
Diagnostika imunodeficiencí vychází z anamnézy, a to jak osobní, tak rodinné. Tyto údaje jsou obzvláště důležité u imunodeficiencí primárních, které spočívají na genetickém podkladě. Anamnéza je dále doplněna klinickým vyšetřením, které zachycuje většinou příznaky probíhající akutní infekce či další komplikace. Samotný stav imunodeficience se v objektivním klinickém vyšetření pacienta projevuje jen okrajově, u primárních imunodeficiencí může být přítomna hypoplazie lymfatické tkáně, nicméně není to pravidlem.
Klinické podezření na poruchu imunity se dále potvrzuje laboratorním imunologickým vyšetřením, které je hierarchicky členěno a začíná základními vyšetřeními, jež umožní hrubé zařazení imunodeficience, a pokračuje specifickými testy upřesňujícími etiopatogenetické příčiny stavu (tab. 3).
Tab. 3. Vyšetření imunodeficiencí. 
Orientačním vyšetřením je krevní obraz (stačí k diagnóze kvantitativních poruch imunokompetentních buněk) a elektroforéza sérových bílkovin (absence nebo snížení frakce gama ke hrubému stanovení kvantity protilátek). Ke specifikaci poruchy tvorby protilátek je třeba stanovit koncentraci imunoglobulinů v séru, eventuálně jejich podtříd. Funkčním testem protilátkové imunity je stanovení specifických protilátek po očkování nebo vyšetření izohemaglutininů. Testy buněčné imunity představují vyšetření subpopulací lymfocytů. Funkčním testem je test schopnosti proliferace lymfocytů na stimulaci nespecifickými mitogeny a specifickými antigeny (tzv. blastická transformace). Kvalitativní poruchy fagocytujících buněk se diagnostikují pomocí baktericidních testů, vyšetřením schopnosti produkovat kyslíkové radikály a fenotypovou analýzou důležitých molekul na polymorfonukleárních leukocytech. Defekty komplementu lze diagnostikovat kvantitativním stanovením jednotlivých složek a funkčním testem. S postupným zpřesňováním znalostí o imunitním systému a s objevováním dalších stavů imunodeficience se stále více uplatňují specifické testy, které umožní bližší zařazení imunodeficience. Řada z nich využívá metod detailního stanovení lymfocytárních populací průtokovou cytometrií, další metody se potom zaměřují na funkční testy, například produkce cytokinů po specifickém stimulu a další metodiky. Specifikace genové podstaty vrozených imunodeficiencí se provádí pomocí molekulárně biologických metod ve specializovaných laboratořích.
Přínosné je mikrobiologické vyšetření. Podle spektra vyvolávajících agens lze usuzovat na složku imunity, která je postižena. Pacienti s poruchou protilátkové imunity jsou zvýšeně náchylní k infekcím opouzdřenými mikroby (pneumokoky, streptokoky), pacienti s kombinovanými a buněčnými deficity k infekcím viry, plísněmi a oportunními mikroby. Poruchy fagocytujících buněk se projeví infekcemi zejména stafylokoky a plísněmi. Pacienti s poruchou některých složek komplementu trpí pyogenními infekcemi a zvláště infekcemi vyvolanými kmeny Neisseria. V poslední době se objevují i imunodeficience, charakterizované náchylností pouze k omezenému spektru mikroorganismů, například k pneumokokovým infekcím, mykobakteriálním infekcím, infekcím některými viry. V těchto případech je těsná spolupráce s mikrobiology nutností.
V případě sekundárních imunodeficiencí samotní infekční činitelé mohou vyvolat imunodeficienci, s klasickým příkladem HIV infekce. I v těchto případech nastupuje pečlivá mikrobiologická diagnostika.
Imunologická a základní doplňující vyšetření hematologická a mikrobiologická jsou dále rozšiřována podle aktuálního stavu pacienta a podle individuální situace o paletu dalších diagnostických možností, zahrnujících biochemická vyšetření, zobrazovací metody a další přístupy k základní diagnostice a sledování pacienta s imunodeficitem. Vyšetření se taktéž používají k monitorování léčby těchto nemocných, například dlouhodobé sledování hladin imunoglobulinů při jejich substituci.
1.7 DIAGNÓZA A DIFERENCIÁLNÍ DIAGNÓZA
Podezření na poruchu imunitního systému vzniká na základě klinického obrazu recidivujících infekcí, které probíhají prolongovaně, komplikovaně nebo atypicky a opakovaně, případně se prokáže infekce oportunními mikroorganismy. K podezření na imunodeficienci vedou další klinické příznaky, uvedené v kapitole Klinický obraz. Podezření je vždy nutné doplnit podrobnými údaji z rodinné a osobní anamnézy. Zvláště u primárních imunodeficiencí, které se dědí podle mendelovských pravidel, je rodinná anamnéza velmi důležitá. U sekundárních imunodeficiencí je třeba pečlivě zkoumat údaje z osobní anamnézy včetně epidemiologické anamnézy předchorobí. Zvláště u dospívajících nyní nabývá na významu způsob života, užívání drog, léků, sexuálně přenosné nemoci, možnosti nákazou HIV, všechny musí být zváženy při podezření na stav sekundární imunodeficience.
Potvrzení klinické diagnózy může přinést laboratorní imunologické vyšetření, eventuálně doplňující vyšetření (viz Vyšetření imunodeficiencí).
V diferenciální diagnostice je nutné vyloučit jiné příčiny recidivujících infekcí, jakými mohou být poruchy obecných obranných mechanismů, anatomické změny vrozené nebo potraumatické, chronická onemocnění respirační, jako je cystická fibróza, syndrom nepohyblivých řasinek a další.
Diagnóza se posléze skládá z uceleného souboru uvedených údajů. V případě primárních imunodeficiencí a u některých forem sekundárních imunodeficiencí se může jednat o velmi závažnou diagnózu, která musí být jednoznačně potvrzena předtím, než je sdělena pacientovi a jeho rodině a než jsou zahájena léčebná opatření.
1.8 TERAPIE
Rozlišení terapie:
- a) nefarmakologická intervence
- b) standardní farmakoterapie, nové a perspektivní léčebné možnosti
- c) další složky léčení (dieta, pohybové aktivity, fyzikální léčba, rehabilitace, psychologické aspekty, edukace, posouzení compliance)
Léčba poruch imunity je rozdílná a pečlivě se řídí podle diagnózy. Léčba je různá u různých forem imunodeficiencí. V každém případě je na místě ochrana před infekcemi režimovými opatřeními, léčba interkurentních infekcí, racionálně uplatňovaná antibiotická terapie a rekonvalescence (tab. 4).
Tab. 4. Terapie imunodeficiencí. 
Kauzální terapie je možná u některých jasně definovaných vrozených imunodeficiencí, kdy přichází v úvahu genová terapie nebo transplantace kostní dřeně. Genová terapie se nejvíce blíží léčbě kauzální. Je možná v zahraničí u několika vybraných jednotek, mezi které patří těžké kombinované imunodeficity na podkladě deficience adenosindeaminázy, dále na podkladě mutací ve společné gama podjednotce cytokinového receptoru a u některých forem chronické granulomatózy. Další nozologické jednotky se zvažují. Léčba je stále riziková, první pokusy o léčbu SCID, těžkého kombinovaného imunodeficitu genovou terapií, byly komplikovány u některých pacientů vznikem leukémie. Tato komplikace není stále zcela vyřešena. Některé další jednotky z vrozených imunodeficiencí lze kauzálně léčit transplantací hematopoetických kmenových buněk kostní dřeně, eventuálně periferních kmenových buněk či pupečníkové krve.
Protilátkové imunodeficience vrozené i získané se léčí substitučně podáváním imunoglobulinů, většinou v intravenózní, ale nyní i v subkutánní formě. U pacientů s primárními i sekundárními formami granulocytopenií a agranulocytóz jsou indikovány cytokiny stimulující kmenové prekurzory granulocytů – GM-CSF (faktor stimulující tvorbu kolonií granulocytů a makrofágů) a G-CSF (faktor stimulující tvorbu kolonií granulocytů). Použití dalších cytokinů, hlavně interferonu gama, se používá u chronické granulomatózy v období akutních komplikací. Vždy je kladen důraz na další symptomatickou terapii, léčebné i preventivní podávání antibiotik, případně antimykotik a virostatik. Projevy autoimunity v rámci imunodeficitů vyžadují někdy léčbu kortikoidy nebo jinými imunosupresivy.
Podle aktuálních klinických projevů se uplatňuje i další léčba se zaměřením na postižení jednotlivých systémů, mukolytika, bronchodilatancia a protizánětlivé léky při postižení dýchacích cest, dechová rehabilitace, chirurgická léčba abscesů u fagocytárních defektů a další postupy, které se řídí podle situace.
V případě sekundárních imunodeficiencí je důležitá především léčba základního onemocnění. Léčba HIV je komplexní a je zajištěna většinou v odborných centrech podle platných protokolů kombinací antivirové léčby a léčby komplikací. I u těchto pacientů se v případech imunodeficitu postupuje symptomaticky. Různé imunostimulační a imunomodulační přípravky (transfer faktor, izoprinosin, bakteriální imunomodulátory a celá škála dalších léků cílících na imunitní systém) lze použít v indikovaných případech jako pomocnou léčbu některých nezávažných přechodných imunodeficitních stavů. Nejsou indikovány u primárních imunodeficiencí. Tyto léky nemají místo ani efekt jako náhrada režimových opatření u recidivujících infekcí způsobených nedostatečnou výživou, nadměrnou expozicí infekcím v dětském kolektivu, nedostatečnou rekonvalescencí po proběhlých infektech ap.
Léčba primárních imunodeficiencí probíhá obvykle ve specializovaných centrech. V udržovací terapii je však nutná spolupráce specialisty s terénním lékařem. Vzhledem k relativní vzácnosti těchto onemocnění je třeba řešit každý případ individuálně.
1.9 PROGNÓZA
Prognóza pacientů s imunodeficiencemi je velmi individuální a liší se v závislosti na mnoha faktorech. Nejzávažnější je tíže imunodeficience, prognóza dětí s vrozenými těžkými kombinovanými imunodeficiencemi je velmi závažná a bez transplantace kostní dřeně či genové terapie je infaustní. Naopak prognóza pacientů s lehkými protilátkovými deficity je při dostupnosti adekvátní zdravotní péče excelentní. V každém případě právě úroveň zdravotní péče, možnosti substituce protilátek a stále se zlepšující možnosti transplantace kmenových buněk velmi významně přispívají k prognóze pacientů s imunodeficiencemi. Právě z těchto důvodů je nutná dispenzarizace pacientů a jejich soustředění do specializovaných pracovišť. Stejně důležitá je včasná diagnóza a úzká spolupráce s praktickými lékaři pro děti a dorost i pro dospělé.
U sekundárních imunodeficiencí je prognóza závislá na základní chorobě a na úspěšnosti zvládnutí sekundární imunodeficience. I zde je prognóza velmi individuální, u pacientů s HIV infekcí závažná, u ostatních stavů se pohybuje v celé škále od velmi závažných po přechodné a mírné poruchy.
1.10 PREVENCE
Prevence primárních imunodeficiencí není jednoduchá. Jedná se o vrozená onemocnění, často způsobená mutacemi „de novo“, kde je prevence prakticky nemožná. V případě, že již je v rodině výskyt imunodeficience zaznamenán, je možná v řadě případů prenatální diagnostika. V ostatních případech nastupují běžná preventivní pravidla ochrany před infekcí a dalšími komplikacemi, která kromě režimových opatření v některých situacích znamenají celoživotní užívání preventivních antibiotik a antimykotik. V určitém slova smyslu je preventivní i celá léčba substitucí imunoglobulinů.
U některých nozologických jednotek nastupují specifická preventivní opatření, jako například vakcinace proti extracelulárním mikroorganismům před splenektomií a další uplatňované strategie.
Prevence sekundárních poruch imunity by měla být integrální součástí životního stylu všech a měla by se uplatňovat celý život. V těchto preventivních opatřeních hraje úlohu životospráva, správná výživa, kojení u dětí, životní styl, otužování, pohyb, vyvarovat se kouření a drogovým závislostem a další obdobná opatření, která jsou velmi podceňována a která, pokud jsou důsledně uplatňována, jsou velmi efektivní.
V následné části uvedeme přehled nejčastějších imunodeficiencí. Pro všechna onemocnění platí údaje ze základní části, specifické odlišnosti jsou potom probrány u jednotlivých nozologických jednotek.
2 Přehled primárních imunodeficiencí
Primární imunodeficience jsou v různých zdrojích různě rozdělovány. Z praktického hlediska je stále platné dělení na deficity humorální, buněčné a kombinované, deficity fagocytózy a deficity komplementu, které uplatníme i zde. Toto dělení je potom doplněno nověji definovanými jednotkami genově podmíněné náchylnosti specifickým infekcím.
2.1 Protilátkové imunodeficience
Jako primární protilátkové deficience se označují stavy, kde organismus není schopen tvořit specifické protilátky proti antigenům. Klinicky se tyto stavy projevují opakovanými infekcemi hlavně extracelulárními mikroorganismy. Virové infekce jsou většinou eliminovány adekvátními imunitními mechanismy, ale následná protilátková imunitní odpověď je v důsledku imunodeficience nedostatečně vyvinuta. Neschopnost tvořit specifické protilátky může, ale nemusí být spojena i s kvantitativním snížením koncentrace imunoglobulinů. Snížené koncentrace imunoglobulinů v séru se označují jako hypogamaglobulinémie (snížení všech tříd imunoglobulinů) nebo dysimunoglobulinémie (je snížena pouze některá třída nebo podtřída imunoglobulinů, zatímco hladiny jiných tříd jsou normální nebo mohou být i zvýšeny). Poznání molekulární podstaty některých protilátkových deficitů ukazuje, že v řadě případů jde o regulační poruchu tkvící spíš v lymfocytech T nebo jejich produktech, kterou lze vysvětlit asociované projevy autoimunity a další projevy dysregulace imunitního systému.
Do této kapitoly přiřazujeme i syndromy charakterizované zvýšením IgM a IgE, i když se o typické protilátkové imunodeficience nejedná.
2.1.1 Brutonova agamaglobulinémie
Brutonova agamaglobulinémie je klasická primární humorální deficience, způsobená mutacemi v genu pro Brutonovu tyrozin kinázu (Btk). Je vázána na chromozom X. Btk ovliňuje diferenciaci preB lymfocytů do B lymfocytů. Zralé B lymfocyty nejsou u těchto pacientů přítomny, v některých případech je detekovatelné nepatrné množství (méně než 1 %) těchto buněk v periferní krvi. Onemocnění se následně manifestuje jako závažná typická humorální deficience.
Onemocnění nese jméno doktora Brutona, který v 50. letech 20. století jako první popsal uvedenou jednotku a prokázal chybění gamaglobulinů v séru nemocných. Genová podstata byla posléze objevena v 90. letech. Prevalence se uvádí asi 1 na 50 000 až 100 000 obyvatel. Klinické obtíže se objevují typicky až po šestém měsíci života, kdy postupně mizí mateřské přenesené protilátky. Hlavním problémem bývají opakované a těžké infekce respirační s postižením plic, které bývá zatíženo následnými komplikacemi. Postižení plic vede u neléčených nebo špatně léčených pacientů ke vzniku bronchiektazií a k fibrotickým změnám. Artritidy neinfekčního původu obvykle ustupují po zavedení adekvátní gamaglobulinové léčby. Mohou se objevovat i infekční formy artritid. Laboratorně se prokáží velmi nízké koncentrace všech tříd imunoglobulinů a chybí lymfocyty B. Molekulárně biologické vyšetření může určit typ mutace, což je výhodné pro případnou prenatální diagnostiku. V současné době je toto vyšetření dostupné i v České republice. Terapií je celoživotní substituční podávání gamaglobulinů, doplněné adekvátní terapií probíhajících infekcí. Důležitá je včasná diagnóza a neodkladné zahájení substituční léčby. Očkování je u pacientů s Brutonovou agamaglobulinémií neúčinné pro neschopnost tvorby protilátek a je kontraindikováno.
2.1.2 Běžný variabilní imunodeficit – CVID (common variable immunodeficiency)
Jak napovídá název onemocnění, jedná se o relativně nejběžnější závažný humorální deficit, nicméně i přesto je jeho prevalence udávána přibližně 1 případ na 50 000 obyvatel. K manifestaci příznaků dochází nejčastěji ve druhé a třetí dekádě, ale ani u dětí není vzácností. Jedná se o heterogenní skupinu onemocnění s dědičným základem, dosud nespecifikovaným a zřejmě nejednotným. Toto je potvrzeno i objevy nedávné doby, kdy se u zlomku pacientů prokázaly mutace v několika genech, které jsou zodpovědné za jejich variantu CVID. Jedná se o molekulu ICOS, exprimovanou na T lymfocytech a zasahující do T a B lymfocytárních interakcí, dále molekulu CD19 na B lymfocytech a BAFF_R, receptor faktoru BAFF. BAFF je faktor aktivující B lymfocyty, který je nezbytný pro jejich diferenciaci a přežívání. Další molekuly s možnou kauzální rolí u CVID jsou zkoumány, ale přes velké úsilí je zatím možné prokázat molekulární podstatu u méně než 10 % pacientů s CVID.
U pacientů dojde v různém období života po obvykle neobjasněném podnětu k útlumu tvorby protilátek. Klinický obraz a spektrum vyvolavatelů infekcí jsou stejné jako u pacientů s Brutonovou agamaglobulinémií. Na rozdíl od Brutonovy agamaglobulinémie dochází u CVID častěji k poruchám regulace imunitní odpovědi a k rozvoji autoimunitních komplikujících onemocnění, zvláště autoimunit postihujících hematopoetické řady. Časté je také postižení gastrointestinálního traktu. Některé formy CVID jsou spojeny s tvorbou granulomů v různých oblastech těla s tomu odpovídající klinickou manifestací. CVID je také rizikem pro vznik lymfoproliferativních onemocnění. Laboratorně je prokazatelná hypogamaglobulinémie, sníženy jsou vždy hladiny IgG a IgA, zatímco hladina IgM může být u některých pacientů normální. Většina pacientů má v periferní krvi normální počet lymfocytů B, u malého podílu nemocných je počet lymfocytů B výrazně snížen. Poruchy ve funkci T lymfocytů jsou obtížněji laboratorně prokazatelné. Terapie v praxi spočívá v substitučním podávání gamaglobulinových derivátů, včasné antibiotické léčbě probíhajících infekcí, případně i v profylaktickém podávání antibiotik. Vzniklá autoimunitní onemocnění je třeba adekvátně léčit i s nevyhnutelnými riziky imunosupresivní léčby, neboť představují pro tyto pacienty velmi závažné riziko.
2.1.3 Selektivní deficit IgA
Ve vyspělých zemích jde o nejčastější protilátkovou imunodeficienci spočívající v neschopnosti tvořit protilátky izotypu IgA včetně sekrečního IgA. Incidence defektu IgA (sérová hladina pod 0,05 g/l) je asi 1/600 až 1/1000 obyvatel. Molekulární podstata IgA deficitu není známa, opětovně se stejně jako u CVID bude zřejmě jednat o řadu různých etiologických jednotek se společným klinickým projevem. Klinicky je selektivní deficit IgA nejčastěji bezpříznakový. U některých osob se však projevuje častými infekcemi horních dýchacích cest, otitidami, případně průjmy. Pokud se objeví závažnější infekce dolních cest dýchacích, jedná se většinou o kombinaci s dalšími imunodeficiencemi. Deficit IgA se také častěji nachází u kohort pacientů s autoimunitními onemocněními, například revmatoidní artritidou. Léčba je symptomatická. Aplikace intravenózních gamaglobulinů je u pacientů s úplným deficitem IgA kontraindikována. Může dojít k rozpoznání malého množství IgA obsaženého v těchto přípravcích jako cizorodého antigenu a k tvorbě protilátek proti němu. Při opakovaném podání jakéhokoli krevního derivátu (včetně transfuze krve), který IgA obsahuje, existuje u senzibilizovaného pacienta nebezpečí anafylaktických reakcí. Pacienti a jejich ošetřující lékaři by měli být o této komplikaci informováni, u plánované operace je nejvhodnější autotransfuze. Přítomnost protilátek proti IgA lze vyšetřit na specializovaných pracovištích.
2.1.4 Deficity podtříd imunoglobulinů a specifických protilátek
Poruchy podtříd IgG (IgG1–IgG4) se vyskytují buď samostatně, nebo v kombinaci s deficitem IgA (IgG2, IgG4). Někteří pacienti trpí poruchou tvorby některých specifických protilátek, zejména protilátek proti polysacharidovým antigenům. V případě nutnosti se profylakticky podávají antibiotika nebo se aplikují gamaglobuliny. V některých případech je účelné pacienty očkovat vakcínami obsahujícími polysacharidové antigeny opakovaně, případně použít vakcínu s polysacharidem vázaným na proteinový nosič.
2.1.5 Přechodná hypogamaglobulinémie v dětství
Přechodná hypogamaglobulinémie v dětství je způsobena opožděným nástupem tvorby vlastních imunoglobulinů. Zvláště v období po poklesu mateřských protilátek mívají děti opakované a častější infekce. Stav se většinou spontánně upraví do 2 let, někdy až do 4 let věku. Pokud nedojde ke spontánní úpravě, nejedná se o přechodnou hypogamaglobulinémii v dětství a je třeba pátrat po jiné příčině imunodeficitu. Laboratorně se prokazují nízké hladiny imunoglobulinů; zastoupení lymfocytů B je normální. Substituční gamaglobulinová léčba je indikována v případech závažnějších recidivujících infekcí.
2.1.6 Syndrom hyperimunoglobulinémie IgM
Jedná se o vzácnou formu imunodeficience, která je výrazem poruchy procesů přesmyku izotypových tříd. V současné době je známo nejméně 6 forem tohoto onemocnění, s různými molekulárními podstatami a různými patogenetickými pochody vedoucími k obdobné manifestaci onemocnění. Základní, první objevenou formou, je klasická, na X chromozom vázaná forma způsobená mutací v molekule T lymfocytu CD40L, ligandem CD40, který je exprimován na B lymfocytech. Interakce tohoto páru molekul vede za fyziologických okolností k přesmyku syntézy IgM na ostatní třídy. V případě syndromu hyperIgM k této interakci nedochází a plazmatické buňky produkují pouze IgM. Ostatní formy mají odlišné podstaty onemocnění s obdobnými klinickými důsledky. Klinicky se syndrom projevuje jako kombinovaná imunodeficience, pacienti mají často oportunní infekce (pneumocysty, toxoplazmózu), obzvláště náchylní jsou tito pacienti k infekci Cryptosporidii. Poměrně častou komplikací je postižení jater ve formě sklerózující cholangoitidy. Prognóza tohoto onemocnění je velmi závažná. Terapie odpovídá léčbě imunodeficiencí, spočívá v kombinaci substituce imunoglobulinů a léčbě přidružených onemocnění. Pacienti jsou indikováni k transplantaci kostní dřeně, s lepšími vyhlídkami u mladších pacientů.
2.1.7 Syndrom hyperimunoglobulinémie IgE
Hyper-IgE syndrom, dříve označovaný také jako syndrom Jobův nebo syndrom Buckleyové, je vzácná imunodeficience s typickými klinickými projevy infekcí vyvolaných hlavně kmeny Staphylococcus aureus a Candida albicans. Infekce postihují hlavně kůži, kde nasedají do terénu ekzému, a dále to jsou často plíce ve formě abscedujících pneumonií. Ve shodě s názvem onemocnění je velmi vysoká sérová hladina IgE, dosahující desetitisícových hodnot UI/ml a eozinofilie. V roce 2007 byla objevena genová podstata tohoto onemocnění, která spočívá v mutacích proteinu STAT3, faktoru v signální cestě řady cytokinů a růstových faktorů, který má důležitou úlohu v různých buněčných procesech. V patogenezi hyper-IgE syndromu se projevuje tato porucha na mnoha úrovních, včetně postižení skeletu a pojivových tkání, které potom vedou k fenotypickým projevům syndromu. Typický „lví obličej“, poruchy dentice či skeletu jsou obvyklou známkou hyper-IgE syndromu (obr. 1, 2). Nicméně i u této jednotky je určitá heterogenita mezi nemocnými a lze očekávat, že STAT3 nebude jediná molekula, jejíž mutace jsou s hyper-IgE syndromem spjaty.
Obr. 1, 2. Typický „lví“ obličej je obvyklou známkou hyper-IgE syndromu. 
Laboratorně kromě vysokého IgE bývají různé projevy imunodeficitu. Důsledkem poruchy STAT3 signalizace dochází k snížení až vymizení Th17 pomocných lymfocytů, což vede k typickým projevům zánětu hlavně způsobenému kmeny stafylokoků. V terapii se podávají v preventivním dlouhodobém režimu antibiotika a antimykotika, dále léky zasahující přidružené komplikace alergické povahy ve formě ekzému a respiračního postižení. Průběh a prognóza bývají komplikované a individuální. Z velmi aktivního probíhajícího výzkumu lze očekávat nové poznatky o funkci imunitního systému.
2.2 Poruchy buněčné imunity a kombinované poruchy imunity
Poruchy specifické buněčné imunity zasahují na různých úrovních do komplexních pochodů spojených se vznikem, diferenciací a funkcí T lymfocytů. Vzhledem k nutné spolupráci T a B lymfocytů při tvorbě protilátek se porucha T lymfocytů obvykle sekundárně projeví i v poruchách protilátkové imunity.
2.2.1 Di Georgeův syndrom
Di Georgeův syndrom je vrozenou poruchou embryonálního vývoje 3. a 4. žaberní výchlipky, která vyústí v poruchu vývoje thymu spojenou se srdečními malformacemi a poruchou vývinu příštítných tělísek. Metabolické projevy a projevy srdeční vady jsou dominující v klinických projevech většinou brzy po narození. Průvodní imunodeficience se většinou projeví později, často je však diagnostikovaná dříve, než dojde ke klinickým projevům právě pro podezření na Di Georgeův syndrom vyslovené kardiology. Imunodeficence je způsobená poruchou vývoje T lymfocytární řady v důsledku patologie thymu. Málokdy jde však o úplnou absenci thymu a vývoj lymfocytů T je zajišťován buď reziduální thymovou tkání, nebo extrathymickou diferenciací lymfocytů T v zažívacím traktu. Velmi závažná je porucha u tak zvaného kompletního syndromu Di George, kdy zcela chybí thymová tkáň i T lymfocyty. V takovém případě se jedná o život ohrožující buněčnou imunodeficienci. U ostatních, parciálních syndromů Di George je naopak prognóza příznivější. Stav může být komplikován autoimunitou, zvláště namířenou proti štítné žláze, nebo autoimunitní trombocytopenií. Incidence onemocnění je asi 1 : 50 000, příčinou jsou delece 22. chromozomu prokazatelné ve většině případů.
2.2.2 Těžké kombinované imunodeficience (SCID)
Tímto názvem (SCID – severe combine immunodeficiency) se označuje skupina vrozených závažných stavů charakterizovaných poruchou jak buněčné, tak protilátkové imunity. Molekulární podstata je různá a podle toho jsou i laboratorní nálezy různé. Společným znakem je hluboká funkční porucha lymfocytů. Onemocnění se projevuje podle druhu poruchy záhy po narození, vzácněji mohou být klinické projevy pozdější. Podezření na tento druh imunodeficience musí být vzneseno včas, neboť jedinou léčebnou možností je dnes transplantace kmenových buněk, jejíž výsledky závisí zejména na včasné indikaci.
Nejtěžší formou SCID je retikulární dysgeneze, kde defekt je již na úrovni kmenové buňky. Další příčinou SCID jsou enzymové defekty (adenosindeaminázy nebo purinnukleosifosforylázy). Poruchy v samotném vývoji T lymfocytu se soustřeďují do mutací genů, které kódují struktury zásadně důležité pro procesy rekombinace, zajišťující variabilitu receptoru T i B lymfocytů (TCR, BCR). Sem patří deficity rekombináz, které vedou buď k obrazu těžké kombinované imunodeficience, nebo k projevům Ommenova syndromu, kdy je SCID spojen s hypereozinofilií a erytrodermií. Nejčastější forma SCID je vázána na chromozom X a je způsobena defektem gama řetězce společného pro několik cytokinových receptorů. Tento deficit blokuje vývoj T lymfocytů. Další molekulární podstaty SCID zasahují do dalších procesů vývoje lymfocytární řady a projevují se kombinovaným imunodeficitem, buněčným i protilátkovým (viz také tab. 1).
2.3 Poruchy komplementového systému
Poruchy komplementu zahrnují poruchy jednotlivých složek a dále poruchy v regulačních mechanismech komplementových kaskád. Podle místa poruchy potom vedou ke klinickým projevům, které buď ústí v imunokomplexová onemocnění autoimunitní povahy (časné složky komplementu, C1–C4), nebo v náchylnost k infekcím, při kterých chybí opsonizační funkce komplementu nebo přímo lýza bakterií podmíněná funkcí komplementové kaskády (C5–C9). Z regulačních složek je jasně definovaná porucha C1 inhibitoru, vedoucí k projevům hereditárního angioedému. Nejčastější forma je dominantně dědičná, při níž dochází po minimálních stimulech (drobné poranění, stomatologický zákrok, infekce) k aktivaci celé komplementové kaskády. Symptomy se většinou i u vrozených forem objevují až ve druhé dekádě života. Na kůži se projevují nesvědivým bledým otokem, postižení sliznic se projeví dechovými obtížemi (otok laryngu může být životu nebezpečný), bolestmi břicha se zvracením a průjmy, případně i retencí moči. Otok není ovlivněn podáním antihistaminik ani kalcia, někdy má určitý efekt hydrokortizon. Terapeuticky je nejúspěšnější podání koncentrátu C1 inhibitoru nebo blokáda bradykininu, zodpovědného přímo za tkáňový otok. Profylakticky se uplatňuje podávání syntetického androgenu danazolu, který zvyšuje tvorbu inhibitoru v játrech. Získaná forma hereditárního angioedému se vyskytuje u pacientů s malignitami lymfatické tkáně.
2.4 Poruchy fagocytózy
Poruchy fagocytujících buněk mohou být kvantitativní nebo kvalitativní. Sekundárně se jako porucha fagocytózy může projevit protilátkový a komplementový imunodeficit vedoucí k poruchám opsonizace nebo defekt dalších faktorů nutných pro proces fagocytózy.
2.4.1 Kostmanův syndrom a cyklická neutropenie
Vrozené neutropenie mají řadu příčin, z nichž některé jsou v poslední době objeveny a charakterizovány na molekulární úrovni.
Kostmanův syndrom je klasickou formou vrozené dědičné neutropenie. Jeho příčina byla odhalena zcela recentně a je zmapována do proteinu HAX1, s genovou příčinou v mutacích odpovídajícího genu na 1. chromozomu a se zatím ne zcela objasněnou funkcí. Další formy vrozené a cyklické neutropenie mají taktéž genetickou příčinu, vedoucí k poruše ELA2, proteinu s funkcí v lyzozomech neutrofilů. Klinické důsledky jsou obdobné a odpovídají stavu neutropenie.
2.4.2 Chronická granulomatózní choroba
Chronická granulomatóza je vrozenou primární imunodeficiencí vedoucí k poruše fagocytárních funkcí na podkladě defektu v systému NADPH oxidázy, což v konečném důsledku vede k poruše tvorby kyslíkových radikálů a k neschopnosti intracelulárně zabít některé pohlcené mikroby. Podle typu deficitního enzymu se jedná buď o chorobu vázanou na chromozom X, nebo o formu recesivně dědičnou. Onemocnění se projevuje od kojeneckého věku hnisavými infekcemi kůže, abscesy a granulomy v orgánech a hnisavými lymfadenitidami.
Laboratorně je snížena baktericidní schopnost granulocytů vůči některým mikrobům. Diagnostická je téměř nulová redukce tetrazoliových solí v testu NBT (nitroblue tetrazolium) nebo absence produkce kyslíkových radikálů v novějších modifikacích testů oxidačního metabolismu granulocytů. V terapii se uplatňuje preventivní podávání antibiotik a antimykotik, léčba komplikací, v individuálně indikovaných případech se závažnými klinickými projevy je indikována transplantace kostní dřeně. Podpůrný význam v případech závažných infekcí má aplikace interferonu gama.
2.4.3 Poruchy adhezivity leukocytů
Další z definovaných poruch fagocytů je syndrom deficitu leukocytárních adhezních molekul (LAD syndrom). U pacientů postižených typem I chybí povrchové receptorové struktury ze skupiny integrinů – komplex adhezních molekul CD11/CD18, u typu II chybí sialyl-Lewis CD15, který je ligandem pro selektiny, nově je definován i vzácný typ III, vedoucí k poruše exprese selektinů. Klinickými příznaky jsou známky špatně se hojícího zánětu bez přítomnosti neutrofilů, které zůstávají v krevním oběhu.
2.5 Imunodeficity spojené s dalšími syndromy
2.5.1 Syndrom Wiskottův-Aldrichův
Základní poruchou je trombocytopenie a trombocytopatie, asociovaná s opakovanými infekcemi na podkladě přidružené imunodeficience. Indikována je časná transplantace kostní dřeně.
2.5.2 Chédiakův-Higashiho syndrom
Syndrom Chédiakův-Higashiho je charakterizován poruchou formace fagolyzozomu a poruchou nitrocelulárního transportního mechanismu. Postižení pacienti mají kromě imunodeficitu parciální albinismus. Diagnózu lze laboratorně učinit již z krevního nátěru pacienta – granulocyty mají velká lyzozomálními granula. Léčbou volby je transplantace kostní dřeně.
2.5.3 Ataxia teleangiectasia
Ataxia teleangiectasia je vzácné onemocnění vznikající na podkladě mutací ATM genu, lokalizovaného na 11. chromozomu. V důsledku této poruchy dochází k závažnému onemocnění asociovanému se zvýšenou lomivostí chromozomů, výrazně zvýšeným rizikem vzniku nádorů, imunodeficiencí, progresivním neurologickým postižením. Přítomny jsou teleangiektazie, zřejmé hlavně na spojivkách, které daly onemocnění název, stejně tak progresivní ataxie, která je dominantním klinickým příznakem počátku onemocnění.
2.5.4 Lymfoproliferativní syndrom vázaný na chromozom X, XLP
Na X chromozom vázaný lymfoproliferativní syndrom je vzácné onemocnění, spojené u postižených chlapců s infekcí EB virem. Tato infekce je spouštěcím faktorem klinických projevů, které jsou různé u jednotlivých pacientů a mohou se projevit jako závažná až fatální EB viróza, lymfom nebo imunodeficience s hlubokým defektem protilátek. Časná diagnóza je nutná k indikaci transplantace kostní dřeně, která má výrazně lepší vyhlídky, pokud je provedena v časném věku.
2.5.5 Primární hemofagocytující lymfohistiocytóza
Primární hemofagocytující lymfohistiocytóza (HLH), někdy také označovaná jako familiární hemofagocytující lymfohistiocytóza (FHL), je geneticky podmíněné heterogenní onemocnění charakterizované porušenou cytotoxickou funkcí T lymfocytů a NK buněk, které se typicky projevuje během prvních měsíců po narození. V posledních letech byl objasněn genetický podklad několika podskupin FHL. Přibližně u 30 % pacientů je FHL způsobeno mutací v genu, který kóduje perforin. U další třetiny pacientů je podkladem FHL mutace genu UNC13D, který kóduje protein hMunc13-4. Zcela nedávno byl identifikován další gen STX11, který je lokalizován na 6. chromozomu a který kóduje bílkovinu syntaxin 11. Absence všech tří identifikovaných proteinů narušuje proces exocytózy cytotoxických granul. Manifestace onemocnění je pravděpodobně spouštěna infekcí, která vyvolá nepřiměřenou a zároveň neefektivní imunitní odpověď. Podkladem onemocnění je nekontrolovaná proliferace aktivovaných T lymfocytů a aktivace makrofágů, které dále fagocytují krevní elementy (hemofagocytóza). FLH se klinicky nejčastěji projevuje horečkou, výraznou hepatosplenomegalií, koagulopatií a často i neurologickými příznaky z postižení CNS. Laboratorní vyšetření prokazují různý stupeň cytopenie, postižení jaterního parenchymu, hypertriglyceridémii, hypofibrinogenémii a výrazně zvýšený feritin. Cíleným vyšetřením cytotoxických testů lze prokázat defekt v cytotoxické aktivitě T lymfocytů a NK buněk. V terapii se uplatňují FLH protokoly, založené na kombinaci glukokortikoidů, etoposidu a cyklosporinu A. Jedinou kauzální léčbou je transplantace hematopoetických kmenových buněk.
Klinický obraz hemofagocytárního syndromu se může rozvinout i sekundárně v asociaci se systémovou infekcí, nádorovým onemocněním nebo onemocněním autoimunitním, tzv. sekundární HLH. Tato forma potom spadá do sekundárních imunodeficiencí, případně do kategorií onemocnění odpovídajících primární vyvolávající příčině. Transplantace hematopoetických kmenových buněk v tomto případě není indikována.
2.6 Poruchy rezistence k infekcím
V předchozí kapitole jsou uvedeny primární imunodeficience, jejichž charakteristickým znakem je zvýšená vnímavost většinou širšímu spektru infekcí. Poslední popsané onemocnění, na X chromozom vázaný lymfoproliferativní syndrom, tvoří přechod k nové kategorii primárních imunodeficiencí, které zde popisujeme jako poruchy rezistence k infekcím. Tyto poruchy jsou typické tím, že na základě velmi specifického defektu způsobují náchylnost ke zcela určitým infekcím, zatímco obrana proti celému spektru ostatních infekčních činitelů je zachována. Do této kategorie se zařazují deficity postihující receptory a signální cesty účastnící se iniciálních, vrozených kroků imunitní reakce.
2.6.1 Deficity TLR receptorů a asociovaných signálních cest
K defektům receptorů a signálních cest patří poruchy spojené s TLR receptory a následnými signálními cestami. Toll-like receptory jsou membránově vázané molekuly, které jsou zodpovědné za rozpoznání patogenu a zprostředkování iniciálních kroků odpovídající imunitní reakce. Patří do rodiny PRR, pattern recognition receptors, které rozpoznávají charakteristické znaky patogenů, tak zvané PAMPs, pathogen assocaited molecular patterns. PAMPs jsou charakteristické pro jednotlivé kategorie patogenů a rozliší například G+ a G - bakterie, bičíkaté bakterie, jednotlivé skupiny virů i další patogeny. Jedná se o relativně nedávno objevené struktury, nicméně i v této oblasti již byly zjištěny primární imunodeficience.
Dosud jsou popsány deficity TLR3 a následné signální molekuly UNC93B, které jsou klinicky asociovány s projevy herpetické encefalitidy. Objevy mutací právě v těchto molekulách logicky zapadají do současného pohledu na rozvoj imunitní odpovědi, neboť TLR3, TLR7 a TLR9 jsou receptory účastnící se v obraně proti virovým infekcím. Zcela recentně bylo popsáno, že úlohou UNC93B je právě podpora nitrobuněčného transportu TLR7 a TLR9 na místo jejich exprese v endolyzozomech. Ztráta funkce všech zmíněných molekul hraje zásadní roli v rozvoji těžké herpetické encefalitidy, která se tímto řadí do kategorie primárních imunodeficiencí.
Do stejné skupiny spadají mutace v dalších molekulách, které zprostředkují intercelulární signalizaci v návaznosti na aktivaci TLR receptorů, konkrétně v molekule IRAK4 a zcela nedávno objevené mutace v MyD88, které vedou k opakovaným a těžkým pneumokokovým infekcím.
2.6.2 Vrozená vnímavost k mykobakteriálním infekcím
Do širší oblasti vrozené imunity taktéž spadá skupina zvýšené vnímavosti k mykobakteriálním infekcím a infekcím atypickými mykobakteriemi, která zahrnuje řadu molekul z oblasti cytokinů, jejich receptorů a signálních molekul, IFNγR, IL12, IL12R, IL23, STAT1.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2011 Číslo 6- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Gastroezofageální reflux a gastroezofageální refluxní onemocnění u kojenců a batolat
-
Všetky články tohto čísla
- Prof. MUDr. Vladimír Mihál, CSc. – šedesátiletý
- Vývoj neonatální péče a zhodnocení zkušeností prvních pěti let operací rozštěpu rtu v neonatálním období
- Změny elektrické kožní vodivosti v důsledku bolestivého stimulu u novorozenců různých gestačních kategorií a srovnání se změnami vybraných fyziologických parametrů
- Nekrotizujúca enterokolitída donosených novorodencov – kazuistika a prehľad literatúry
- Používání léků mimo schválené indikace v pediatrii
- Imunodeficience
- Vzpomínky na půl století života s dětmi s cystickou fibrózou
- Správné odpovědi na kontrolní otázky k doškolovacímu článku Grešíková M.: Artériová mozgová príhoda v detskom veku (č. 4/2011)
- 20th Meeting of European Society of Pediatric Clinical Research (ES-PCR, previously known as Pediatric Research of Central European Countries)
- Životní jubileum paní profesorky MUDr. Olgy Hníkové, CSc.
- Primář MUDr. Miroslav Malý – 90 let
- Významné životní jubileum profesora Františka Stožického
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Nekrotizujúca enterokolitída donosených novorodencov – kazuistika a prehľad literatúry
- Imunodeficience
- Používání léků mimo schválené indikace v pediatrii
- Změny elektrické kožní vodivosti v důsledku bolestivého stimulu u novorozenců různých gestačních kategorií a srovnání se změnami vybraných fyziologických parametrů
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




