-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Poruchy vnitřního prostředí novorozenců
Autoři: P. Zoban; Michal Černý
Působiště autorů: Novorozenecké oddělení s JIRP, Gynekologicko-porodnická klinika UK 2. LF a FN Motol, Praha
Vyšlo v časopise: Čes-slov Pediat 2012; 67 (3): 209-212.
Kategorie: Vybrané kapitoly z nové učebnice Klinická pediatrie
1. VÝVOJ RENÁLNÍCH FUNKCÍ
Hlavní funkcí fetálních ledvin je vylučování moči a elektrolytů do amniálního prostoru. Jedná se o základní mechanismus, který se podílí na udržování adekvátního objemu amniální tekutiny. Po porodu ledviny odpovídají za vodní a elektrolytovou rovnováhu novorozence.
1.1 Vývoj renální perfuze a glomerulární filtrace
Během fetálního období odpovídá průtok krve ledvinami 2–3 % srdečního výdeje, u dospělého 15–18 % srdečního výdeje. Po porodu perfuze ledvin stoupá v důsledku poklesu renální cévní rezistence a vysokých hladin endogenních katecholaminů a reninu, vyvolaných porodním stresem. Současně stoupají hladiny vazodilatačních prostaglandinů.
Do 36. týdne těhotenství, s postupem nefrogeneze, se glomerulární filtrace (GF) zvyšuje, mezi 36.–40. týdnem zůstává stabilní, ale po porodu v termínu dramaticky roste a ve věku 2 týdnů je dvojnásobná.
Hodnoty kreatininu s rostoucím gestačním stářím klesají. U novorozenců porozených před 28. týdnem těhotenství je koncentrace kreatininu kolem 1,5 mg/100 ml, u donošených dětí v prvním týdnu života je 3krát nižší.
1.2 Renální funkce po porodu
Acidifikace moči (exkrece vodíkových iontů) je u nedonošených novorozenců proti donošeným nižší. Reabsorpce bikarbonátů je u donošených i nedonošených novorozenců po porodu snížená. U donošených dětí vymizí ztráty bikarbonátů močí během 1–2 týdnů, u nedonošených dětí přetrvávají déle.
Diluční funkce ledvin je normální, koncentrační schopnost je v časném poporodním období omezená pro snížení tonicity dřeně ledvin a odpovědi na arginin vazopresin.
Donošený novorozenec zachovává sodíkovou rovnováhu již po několika hodinách, ale schopnost nedonošeného novorozence je v tomto ohledu omezená. Důvodem je zejména snížená reabsorpce v proximálním tubulu a nižší odpověď na aldosteron. Nezralí novorozenci mají rovněž problémy při udržování normální koncentrace draslíku. Příčinami jsou snížená aktivita renální Na-K-ATPázy distálních tubulů a snížená GF.
Přes 90 % novorozenců zahajuje diurézu během prvních 24 hodin, 100 % do 48 hodin po porodu. V průběhu prvních dvou dnů novorozenec močí 2 až 6krát za 24 hodin.
2. VODNÍ A ELEKTROLYTOVÁ ROVNOVÁHA
2.1 Tělesná tekutina
Donošení i nedonošení novorozenci vylučují vodu a sodík již krátce po porodu. Současně dochází ke zmenšení objemu extracelulární tekutiny (ECT). U nedonošených dětí pokles objemu ECT přispívá ke snížení výskytu otevřené tepenné dučeje, nekrotizující enterokolitidy či bronchopulmonální dysplazie.
Na vodní rovnováze novorozenců se významně podílí insenzibilní ztráty tělesné tekutiny. Insenzibilní vodní ztráty klesají se zvyšujícím se gestačním a postnatálním věkem, naopak rostou se stoupající teplotou prostředí a snížením vlhkosti (při ošetřování na otevřených, vyhřívaných lůžcích). Insenzibilní vodní ztráty činí u extrémně nezralých novorozenců (pod 28 týdnů) až 60 g/m2/hod, u donošených dětí výrazně méně – cca 5 g/m2/hod.
Graf 1. Změny obsahu vody během tělesného vývoje. 
2.2 Sodík
Za normálních okolností je po porodu hlavním mechanismem ztrát sodíku natriuréza. Protože je diuréza po porodu nízká (0,5–2 ml/kg/hod), jsou i ztráty sodíku nízké. Při zvýšení insenzibilních vodních ztrát nebo diurézy koncentrace sodíku v séru stoupá. V prvních třech dnech po porodu není třeba natrium dodávat, zejména pak velmi nezralým dětem, u kterých by mohlo dojít k rozvoji těžké hypernatrémie.
2.3 Draslík
Hlavní cestou exkrece draslíku je jeho vylučování močí. Po porodu jsou diuréza i ztráty kalia nízké. U těžce nezralých dětí může kalemie stoupnout, a to přesto, že draslík není dodáván (tzv. non-oligurická hyperkalemie). Proto se doporučuje, zvláště u těžce nedonošených dětí, draslík v prvních dnech po porodu nedodávat, a to tak dlouho, dokud nedojde ke stabilizaci diurézy a koncentrace kalia v plazmě (tj. přibližně po 72 hodin po porodu).
Graf 2. Vývoj koncentrací hlavních elektrolytů. 
3. METABOLISMUS VÁPNÍKU A FOSFÁTŮ
3.1 Vápník
Během pozdní fáze gravidity je kalcium aktivně transportováno přes placentu. Výsledkem je vyšší koncentrace celkového i ionizovaného kalcia u plodu než u matky.
Prvních 48 hodin po porodu plazmatická koncentrace kalcia klesá. Následně jeho koncentrace opět stoupá, až dosáhne konstantních hodnot mezi 2,1 až 2,7 mmol/l. Z celkového množství vápníku je 40 % vázáno na bílkoviny (převážně na albumin), 60 % činí tzv. ultrafiltrovatelná frakce. Pokles koncentrace albuminu může vést ke snížení celkové koncentrace kalcia. Čtvrtinu ultrafiltrovatelné frakce vápníku tvoří komplexy s fosfáty a citráty, zbytek představuje tzv. volné (ionizované) kalcium. Právě změny ionizované frakce kalcia vyvolávají klinické příznaky. Acidóza ionizovanou frakci zvyšuje, alkalóza snižuje.
Denní potřeba kalcia u novorozenců činí 1–2 mmol/kg. Celkový obsah vápníku v těle závisí na střevní absorpci a renální exkreci. Střevní absorpce kalcia, hlavně v duodenu a jejunu, je efektivní transportní systém, stimulovaný 1,25-dihydroxycholekalciferolem.
Renální exkrece kalcia je regulována zčásti společně se sodíkem v proximálních vinutých tubulech a zčásti nezávisle v distálních tubulech. Parathormon podporuje reabsorpci kalcia v Henleově kličce a v distálních vinutých tubulech a snižuje tak kalciurii. Některé zevní faktory, např. diuretika, mohou zvyšovat jak exkreci kalcia močí, tak plazmatickou koncentraci fosfátů.
Distribuce kalcia mezi kostní tkání a extracelulární tekutinou je regulována hormonálně. Parathormon a kalcitriol stimulují uvolňování vápníku z kostí. Kalcitonin inhibuje kostní resorpci a zvyšuje vylučování kalcia močí.
Hypokalcemie znamená pokles celkové kalcemie pod 1,8 mmol/l, resp. ionizované frakce pod 0,7 mmol/l. Klinickými projevy hypokalcemie jsou třes, apnoe, křeče, Chvostkův příznak a prodloužení intervalu QT na EKG křivce. Symptomatická hypokalcemie se vyskytuje častěji u nedonošených a hypotrofických novorozenců, u novorozenců matek diabetiček a také v souvislosti s perinatálním hypoxicko-ischemickým inzultem.
Tab. 1. Příčiny hypoglykemie novorozenců. 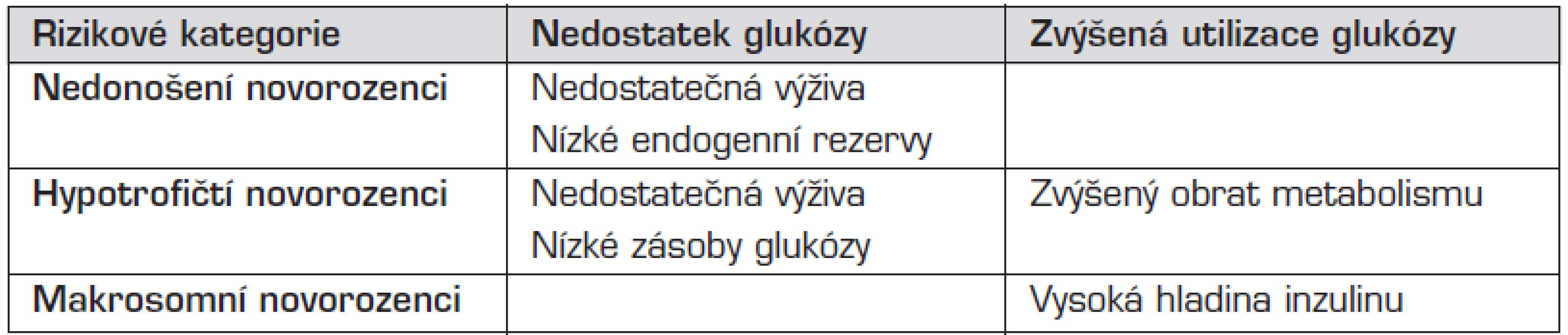
Léčba:
Hypokalcemii je třeba korigovat před léčbou event. metabolické acidózy. Při vzestupu pH hladina ionizovaného kalcia rychle klesá. Asymptomatickou hypokalcemii není třeba léčit. V případě křečí je na místě pomalá nitrožilní aplikace přípravku 10% Calcium gluconicum v dávce 2 ml/kg hmotnosti při současné kontrole EKG křivky. Následně se podává kalcium per os (200–500 mg/kg a 24 hodin), nejlépe ve formě citrátu nebo karbonátu. Současně je třeba korigovat vyvolávající příčinu. Při hypokalcemii je třeba vyšetřit i plazmatickou koncentraci hořčíku a případnou hypomagneziemii řešit současně podáním magnesium sulfátu i.v.
Hyperkalcemie je definována koncentrací celkového kalcia v plazmě nad 2,7 mmol/l. Hyperkalcemie je u novorozence vzácná. Příznaky zahrnují dráždivost, zácpu, neprospívání, polydipsii a polyurii (pro snížení koncentrační schopnosti ledvin) a nefrokalcinózu se selháním ledvin.
Hyperkalcemie s hypofosfatémií a hyperkalciurií hrozí u nedonošených novorozenců s deplecí fosfátů. Hyperkalciurie bez hyperkalcemie může u nedonošených dětí s nedostatečnou acidifikací moči vyvolat přechodnou nefrokalcinózu, zejména při nízké diuréze. Nefrokalcinóza může vzniknout i v souvislosti s dlouhodobým podáváním furosemidu, např. při léčbě vrozené srdeční vady nebo bronchopulmonální dysplazie těžce nezralých dětí. V takovém případě je třeba furosemid nahradit thiazidovým diuretikem.
3.2 Fosfáty
Plazmatická koncentrace fosfátů je u plodu vyšší než u matky. Retence fosfátů plodem činí ve 28. týdnu cca 2 mmol/kg a den, následně až do porodu v termínu zvolna stoupá, ale po porodu se opět snižuje.
Mateřské mléko v množství 150 ml/kg a den poskytuje pouze 0,9 mmol/kg a den fosforu, který se téměř kompletně resorbuje. Rovněž formulovaná mléka poskytují méně fosforu, než je tomu v závěrečné fázi fetálního vývoje. Retence fosforu z formulovaných mlék je proti mateřskému mléku čtvrtinová.
Více než 80 % fosforu v organismu novorozence je uloženo v extracelulárním prostoru, konkrétně v kostní tkáni. Zbytek je distribuován do měkkých tkání a tělesných tekutin. Děti retinují ze stravy více než 50 % obsahu fosforu, který se absorbuje v tenkém střevě, částečně za kontroly kalcitriolem. U nedonošených dětí, při nedostatečném přívodu anorganického fosforu mlékem, se střevní absorpce fosforu zvyšuje. Zvýšení absorpce fosforu ve střevě je z velké části na kalcitriolu nezávislé. Denní potřeba fosfátů se u donošených dětí pohybuje mezi 1–2 mmol/kg a u nedonošených mezi 2–3 mmol/kg hmotnosti. Regulace koncentrace anorganických fosfátů v plazmě se děje prostřednictvím renální tubulární reabsorpce. Parathormon snižuje tubulární reabsorpci a vede tak ke zvýšení exkrece fosfátů močí.
Chronický nedostatek kalcia a fosforu vede k poruše mineralizace nově se tvořící kostní tkáně nebo k demineralizaci již vytvořených kostí se vznikem metabolické osteopatie. Metabolická osteopatie (tzv. „osteopenie nedonošených“) ohrožuje zejména těžce nezralé děti poruchami vývoje skeletu a vznikem spontánních zlomenin nebo zlomenin po minimálním zatížení kostí (např. žeber). U postižených dětí bývá normální kalcemie, výrazně snížená plazmatická koncentrace fosfátů (pod 2, někdy i pod 1 mmol/l) a vysoká aktivita kostní alkalické fosfatázy. Tubulární reabsorpce fosfátů je vyšší než 90 %, což vede ke snížení poměru fosfátů a kreatininu v moči.
Léčba spočívá v dostatečném přívodu vitaminu D (800 IU/den) a stravy obohacené fosfáty. Pro interakci mezi kalciem a fosfáty se doporučuje při formulaci výživových režimů (perorálních/parenterálních) zachovávat molární poměr „Ca/P“ = 1,3–1,4 : 1.
4. METABOLISMUS GLUKÓZY
Glukóza je primárním zdrojem energie pro mozek a podílí se 90 % na celkové spotřebě kyslíku během časné fáze hladovění. Protože novorozenci mají vyšší poměr „mozek/celková hmotnost“, mají také větší nároky na dodávku glukózy než dospělí. Rychlost produkce glukózy v játrech je aproximativně 6 mg/kg/min, tj. 3–6krát vyšší než u dospělých. Při hladovění se zapojují adaptační mechanismy, jejichž účinnost se mezi jednotlivými kategoriemi novorozenců liší (donošení novorozenci proti nedonošeným, růstově retardovaným nebo nemocným novorozencům).
Glykogenolýza v játrech zajišťuje produkci glukózy během prvních 6 až 12 hodin hladovění. Glukoneogeneze zahrnuje konverzi aminokyselin (zejména alaninu) uvolněných ze svalů a triacylglycerolů, pocházejících z glycerolu. K dalším adaptačním mechanismům patří lipolýza, oxidace mastných kyselin a ketogeneze. Produkce volných mastných kyselin je zdrojem energie, kterou využívají svaly, ale nikoli mozek. Naopak jaterní ketogeneze produkuje energetické zdroje, které mozek novorozence dokáže využít. Přechod na oxidaci tuků a ketogenezi se odehrává cca za 12 až 16 hodin hladovění a šetří excesivní odbourávání svalové hmoty.
Při nedostatku energetických zdrojů (hladovění) se dále uplatňuje hormonální regulace metabolických pochodů. Inzulin inhibuje metabolické pochody zapojené do kompenzace energetického deficitu, adrenalin stimuluje glykogenolýzu, glukoneogenezi a ketogenezi v játrech, glukagon zvyšuje jaterní glykogenolýzu a kortison jaterní glukoneogenezi. Růstový hormon se účastní zvýšení lipolýzy.
4.1 Hypoglykemie
Hypoglykemie se u donošených novorozenců vyskytuje v 5–8 %, u nedonošených v 15 %. Dosud není shody o tom, jak hypoglykemii novorozenců definovat. Opírat se pouze o koncentraci glukózy v krvi nestačí, a to pro rozdílnou toleranci aktuálních koncentrací glukózy v krvi donošenými a nedonošenými novorozenci a pro interindividuální rozdíly aktivity kompenzačních mechanismů regulace energetické deplece (hladovění). Nicméně z hlediska intaktního vývoje mozku se v poslední době doporučuje udržovat glykemii novorozenců starších 12 hodin nad 2,5 mmol/l.
Hypoglykemie se u novorozenců nejčastěji objevuje během prvních 12 až 24 hodin. Hypoglykemie, které se vyskytují po porodu a přetrvávají více než 24 hodin, budí podezření na selhávání kontrolních nebo kompenzačních mechanismů hladovění. Nedonošení a hypotrofičtí novorozenci jsou častěji ohroženi hypoglykemií, a to pro nízké zásoby energetických substrátů, nedostatečnou odpověď nezralých hormonálních a enzymatických systémů na hladovění, pro omezenou toleranci objemu tekutin nebo nedostatečný kalorický obsah či příjem stavy.
Ke klinickým projevům hypoglykemie patří:
- neurologické poruchy a poruchy stavu vědomí (dráždivost, třes, křeče, hypotonie, letargie, stupor až kóma);
- apnoe, záchvaty cyanózy;
- hypotermie.
Perorální korekce hypoglykemie v prvních 24 hodinách po porodu přichází v úvahu při hodnotách glykemie mezi 2,0–2,5 mmol/l. Při hodnotách glykemie pod 2,0 mmol/l naměřených dvakrát za sebou je namístě léčba intravenózně podávanou 10% glukózou v dávce 2 ml/kg hmotnosti. Za 15 minut po aplikaci a dále v pravidelných intervalech 4 až 6 hodin je třeba glykemii kontrolovat, udržovat ji na hodnotě nad 3 mmol/l a předcházet tak epizodám hypoglykemie. V případě nutnosti lze podat 10% roztok glukózy formou kontinuální infuze o počáteční rychlosti 6–7 mg/kg/min. Novorozence s epizodami hypoglykemie v prvních dnech po porodu je zapotřebí sledovat i po propuštění, včetně kontrol dětským neurologem.
4.2 Hyperglykemie
Hyperglykemie je u novorozenců definována hodnotou glykemie nad 8 mmol/l. Hyperglykemie s glykosurií snižuje mechanismem osmotické diurézy cirkulující intravaskulární objem, krevní tlak a tělesnou hmotnost novorozenců. Současně může být vyjádřena acidóza nebo ketoacidóza. Neonatální hyperglykemie je obvykle přechodná a spontánně se upraví. Poměrně často vzniká v souvislosti s parenterální výživou a podáváním glukokortikoidů novorozencům s velmi nízkou porodní hmotností (tj. pod 1500 g).
Novorozenecký diabetes mellitus je velmi vzácný (1 : 500 000). Kolem třetiny případů je tranzientních a mizí v průběhu novorozeneckého období.
4.2.1 Příčiny hyperglykemie
- Nitroděložní retardace růstu plodu (IUGR) nebo nedonošené děti s velkou náloží glukózy (v rámci parenterální výživy nebo léčby kortikosteroidy);
- Novorozenecký diabetes mellitus;
- Novorozenci s IUGR s neefektivním centrálním glykemickým mechanismem při mléčné výživě;
- Nemocný/septický novorozenec (zvýšený kortison, snížený inzulin).
4.2.2 Léčba hyperglykemie u novorozence
- Snížení přívodu glukózy;
- Screening vyvolávající příčiny (např. sepse);
- Úprava vodní rovnováhy 1/3 fyziologickým roztokem společně se 4,5% albuminem, event. i.v. podáním inzulinu;
- U novorozenců s velmi nízkou porodní hmotností kontinuální infuze s inzulinem – počáteční dávka 0,05 U/kg/hod a zvyšovat v relaci s aktuálními hodnotami glykemie.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článek Čtení o logopedii – 1. částČlánek Nedonošený novorozenec
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2012 Číslo 3- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Gastroezofageální reflux a gastroezofageální refluxní onemocnění u kojenců a batolat
-
Všetky články tohto čísla
- Incidence dyslipidemií v populaci dětí s obezitou
- Deficit pyruvátkinázy v dětském věku
- Neobvyklé manifestace infekce parvovirem B19 u dětí
- Vyšetření sérové koncentrace prealbuminu a selenu ke sledování nutričního stavu pacientů s fenylketonurií a hyperfenylalaninemií
- Variabilita klinické manifestace norovirové infekce u novorozence – od perakutní nekrotizující enterokolitidy po asymptomatický průběh
- Benigní infantilní křeče asociované s norovirovou gastroenteritidou
- Současné užití léků blokujících adrenergní receptory beta u dětí se srdečním selháním
- Čtení o logopedii – 1. část
- Nedonošený novorozenec
- Poruchy vnitřního prostředí novorozenců
- Vzpomínky na budoucnost: Nefrologie na II. dětské klinice FDL UK a na Dětské klinice FN Pod Petřínem v Praze
- Primář MUDr. Petr Tax šedesátiletý
- VI. Martinské neonatologické dni
- X. český pediatrický kongres s mezinárodní účastí
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Nedonošený novorozenec
- Neobvyklé manifestace infekce parvovirem B19 u dětí
- Poruchy vnitřního prostředí novorozenců
- Deficit pyruvátkinázy v dětském věku
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



