-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Neobvyklé manifestace infekce parvovirem B19 u dětí
Unusual manifestations of parvovirus B19 infection in children
Purpose of the study:
Parvovirus B19 is known as the cause of the „fifth disease” in preschool children, febrile infection with arthralgias, transient aplastic crisis in patients with hemolytic anemia and nonimmune hydrops fetalis. The aim of the work is to evaluate the course of parvovirus B19 infection in children with less common clinical manifestations that are not routinely described with respect to this infection.Methods:
Parvovirus B19 infection was found in 8 patients with the following diagnoses: pericarditis with pleural effusions and thrombocytopenia, severe anemia with neutropenia, myocarditis with fulminant course and sudden onset of severe anemia requiring transfusion. Test for IgG and IgM antibodies (ELISA) and/or detection of the virus DNA by polymerase chain reaction were used to prove the infection.Results:
In a patient with pericarditis, pleural effusions and thrombocytopenia, the parvovirus DNA was found in bone marrow and peripheral blood. Severe and protracted course of the infection led to the detection of congenital immunodeficiency: common variable immunodeficiency. Chronic iron deficiency anemia with increased demands on the turnover of erythropoiesis in another patient contributed to the development of severe anemia accompanied by neutropenia. In the patient with severe myocarditis, parvovirus infection was proven as late as from autopsy material. The course of parvoviral myocarditis in children can, in rare cases, be very severe and can have a fatal outcome. Parvovirus infection was, serologically and/or by evidence of the virus DNA, demonstrated in 5 patients with acute severe anemia, in whom previously unrecognized hereditary spherocytosis was found later.Conclusion:
The abovementioned cases demonstrate the variability of clinical symptoms of parvovirus B19 infection which mainly depend on the immunological profile of the host and the current demands on the turnover of erythropoiesis.Key words:
parvovirus B19, polymerase chain reaction, pericarditis, pleural effusions, myocarditis, transient aplastic crisis, anemia, neutropenia, hereditary spherocytosis
Autoři: B. Ludíková 1; M. Luhový 2; E. Klásková 1; Z. Novák 1; F. Kopřiva 1; D. Pospíšilová 1
Působiště autorů: Dětská klinika Lékařské fakulty Univerzity Palackého a Fakultní nemocnice, Olomouc, přednosta prof. MUDr. V. Mihál, CSc. 1; Laboratoře Mikrochem Olomouc, a. s., Olomouc 2
Vyšlo v časopise: Čes-slov Pediat 2012; 67 (3): 160-168.
Kategorie: Původní práce
Souhrn
Účel studie:
Parvovirus B19 je znám jako původce páté nemoci u dětí předškolního věku, horečnaté infekce s artralgiemi, tranzientní aplastické krize u pacientů s hemolytickou anemií a neimunitního hydropsu plodu. Cílem práce je zhodnotit průběh infekce parvovirem B19 u dětí s méně obvyklými klinickými projevy, které nejsou u parvovirové infekce běžně popisovány.Metody:
Infekce parvovirem B19 byla prokázána u 8 pacientů s následujícími diagnózami: perikarditidou s pleurálními výpotky a trombocytopenií, těžkou anemií s neutropenií, myokarditidou s fulminantním průběhem a náhle vzniklou těžkou anemií vyžádující transfuzi. K průkazu infekce bylo použito vyšetření protilátek třídy IgG a IgM (ELISA) a/nebo detekce DNA viru metodou polymerázové řetězové reakce.Výsledky:
U pacienta s perikarditidou, pleurálními výpotky a trombocytopenií byla DNA parvoviru prokázána v kostní dřeni i periferní krvi. Závažný a protrahovaný průběh infekce vedl k odhalení vrozeného imunodeficitu: běžné variabilní imunodeficience. Na vzniku těžké anemie doprovázené neutropenií se podílela chronická sideropenická anemie se zvýšenými nároky na obrat erytropoezy. U pacienta s těžce probíhající myokarditidou byla parvovirová infekce prokázána až v autoptickém materiálu. Průběh parvovirové myokarditidy může být u dětí vzácně velmi těžký a skončit fatálně. Parvovirová infekce byla sérologicky a/nebo průkazem DNA viru prokázána u 5 pacientů s akutně vzniklou těžkou anemií, u kterých byla poté prokázána dosud nerozpoznaná hereditární sférocytóza.Závěr:
Uvedené případy demonstrují variabilitu klinických příznaků infekce parvovirem B19, které závisí do značné míry na imunologickém profilu hostitele a aktuálních nárocích na obrat erytropoezy.Klíčová slova:
parvovirus B19, polymerázová řetězová reakce, perikarditida, pleurální výpotky, myokarditida, tranzientní aplastická krize, anemie, neutropenie, hereditární sférocytózaÚVOD
Parvovirus B19 je neopouzdřený DNA virus velikosti kolem 26 nm, který patří mezi nejmenší známé DNA viry infikující lidské buňky (parvum = malý). Jako jediný z čeledi Parvoviridae způsobuje onemocnění u člověka. Poprvé byl popsán v roce 1974, asociace s onemocněním u lidí je známa od roku 1981 [1]. Je tvořen jednovláknovou DNA a třemi základními proteiny: NS1, VP1 a VP2. VP1 protein indukuje tvorbu neutralizačních protilátek.
Parvovirus B19 je běžným lidským patogenem, promořenost populace vzrůstá s věkem. Přenos infekce je možný kapénkovou nákazou, slinami, krevními deriváty nebo vertikálním přenosem z matky na plod. Buněčným receptorem parvoviru B19 je P antigen krevních skupin – neutrální glykosfingolipid nacházející se většinou na povrchu erytroidních progenitorových a prekurzorových buněk. Proto parvovirus B19 vykazuje výrazný tropismus k buňkám kostní dřeně. Replikuje se zejména v progenitorových buňkách (BFU-E, CFU-E), pronormoblastech a normoblastech [2], na které působí přímo cytotoxicky. Exprese nestrukturálního virového proteinu NS1 indukuje buněčnou smrt, přičemž infikované buňky vykazují ultrastrukturální změny typické pro apoptózu [3].
P antigen se nachází rovněž na povrchu megakaryocytů, endoteliálních buněk, kardiomyocytů a buněk placentárního trofoblastu [4]. Žádná z těchto neerytroidních buněk však neumožňuje efektivní replikaci viru, dovolují pravděpodobně pouze omezenou expresi NS1 proteinu bez produkce virové kapsidy. I nízká transkripce nestrukturálního proteinu viru může mít při zachování cytopatického efektu výrazný vliv na funkci některých typů hostitelských buněk. Vzhledem k tomu, že exprese P antigenu nekoreluje s intenzitou vazby viru, předpokládá se existence dalšího buněčného koreceptoru nezbytného pro účinný vstup viru do lidské buňky. Role koreceptoru je dnes přisuzována dvěma proteinům: α5β1 integrinu [5] a Ku80 [6]. Přesný mechanismus působení viru na neerytroidní buňky je dále zkoumán.
U zdravých jedinců může infekce parvovirem B19 probíhat asymptomaticky nebo pod obrazem mírného chřipkového onemocnění. Dochází k lehkému poklesu hemoglobinu (Hb), většinou ne více než o 10 g/l, který se klinicky obvykle neprojeví.
Parvovirus B19 je znám také jako původce řady dobře definovaných klinických jednotek, především páté nemoci (erythema infectiosum) u dětí předškolního věku a horečnaté infekce s polyartralgiemi u dětí i dospělých.
Je příčinou tzv. tranzientní aplastické krize u pacientů s hemolytickou anemií, při infekci v těhotenství může vést k úmrtí plodu nebo neimunitnímu hydropsu plodu [7].
Artritida při parvovirové infekci může při chronickém průběhu připomínat revmatoidní artritidu [8]. Parvovirus byl popsán také jako vyvolávající příčina myokarditidy [9], hepatitidy [10], encefalitidy [11], aplastické anemie [12] a syndromu „rukavic a ponožek“ u adolescentů a mladých dospělých [13]. U imunosuprimovaných pacientů může vzhledem k nedostatečné produkci ochranných protilátek vzniknout chronická aplazie erytropoezy [14].
Rozvoj molekulárně genetických metod, především velmi citlivých technik polymerázové řetězové reakce s možností přímého průkazu DNA viru, poskytuje v poslední době nové informace o dalších pestrých klinických manifestacích parvovirové infekce u člověka.
Cílem práce je demonstrovat na souboru 8 pacientů s neobvyklým průběhem onemocnění způsobeným parvovirem B19 variabilitu klinických příznaků a upozornit především na možný závažný průběh infekce s potenciálně fatálním koncem.
PACIENTI
Soubor pacientů tvoří 8 dětí (4 dívky a 4 chlapci) ve věku 3–14 let léčených pro různorodá onemocnění, u kterých bylo v rámci diferenciálně diagnostických úvah pátráno také po infekci parvovirem B19. U všech pacientů bylo provedeno sérologické vyšetření k detekci protilátek třídy IgM a IgG proti parvoviru B19, v 6 případech byl proveden také průkaz přítomnosti DNA viru. Sérologická vyšetření a průkaz DNA viru byly u každého pacienta opakovány 2–3krát. U všech byla infekce parvovirem B19 jednoznačně potvrzena. Přehled pacientů je uveden v tabulce 1.
Tab. 1. Základní charakteristiky souboru pacientů. 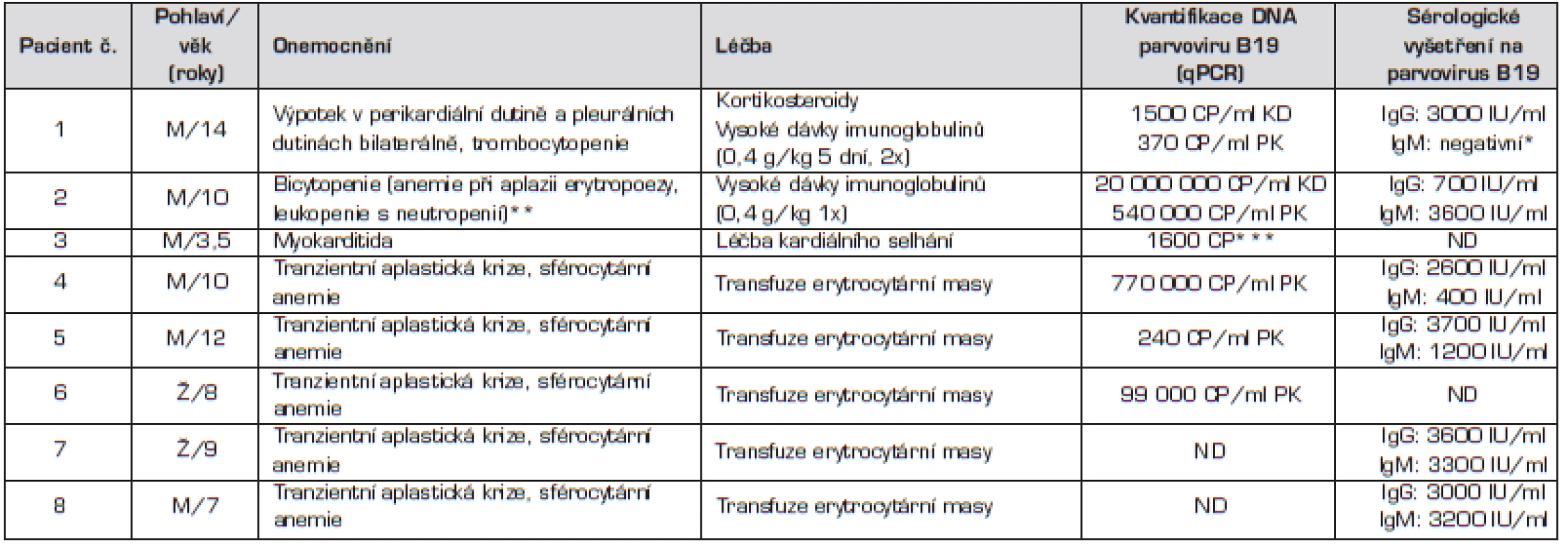
CP – počet kopií viru, KD – kostní dřeň, PK – periferní krev * vyšetřeno 14 dní po aplikaci intravenózních imunoglobulinů ** v anamnéze chronická sideropenická anemie *** vyšetření vzorku myokardu při autopsii METODY
Sérologické vyšetření
Titr protilátek třídy IgG a IgM byl stanoven u všech pacientů z periferní krve metodou ELISA za použití komerčního kitu (Genzyme Virotech GmbH).
Izolace DNA ze vzorků krve, kostní dřeně a tělních tekutin
K izolaci DNA ze vzorků byla použita separace na mikrokolonkách NucleoSpin Blood Kit (Macherey-Nagel, Düren, Německo) a izolovaná DNA byla uchovávána při -20 °C. Izolace byla prováděna podle návodu výrobce z 200 μl vzorku (sérum, plazma, buněčná suspenze, punktát) s extrakcí do 50 μl extrakčního pufru.
Kvantifikace parvoviru B19 DNA metodou qPCR
Pro stanovení obsahu parvoviru B19 DNA v klinickém materiálu byla použita kvantitativní real-time PCR (qPCR) (podle Gruber F, 2001). Amplifikační reakce probíhala v 50 μl, obsahujících 20 μl purifikované DNA z klinických vzorků a 30 μl PCR amplifikační směsi (50 mM KCl, 10 mM Tris-HCl pH 8,3, 5 mM MgCl2, 200 mM každého deoxynukleosid trifosfátu, 2,5 U Hot Start Taq Polymerase) (Sigma Aldrich) a 200 nM každého primeru s 100 nM TaqMan hydrolyzační sondy značené FAM (Generi Biotech, s.r.o., Hradec Králové). Amplifikační reakce probíhala v mikrozkumavkách (200 μl) v přístroji RotorGene 6000 (Corbett) s následujícím teplotním profilem: počáteční denaturace 10 minut při 95 °C a následně 40 amplifikačních cyklů (95 °C 15 s, 60 °C 60 s). Validace metody byla provedena externí kontrolou kvality v mezinárodním systému Quality Control for Molecular Diagnostics (QCMD, Glasgow, UK), pozitivní vzorky byly použity jako kalibrátory.
PRŮBĚH ONEMOCNĚNÍ A VÝSLEDKY
Pacient č. 1 sledovaný od 3 let věku pro recidivující infekce dýchacích cest byl přijat na jednotku intenzivní péče pro přetrvávající teploty, kašel a dušnost. Rtg snímek a sonografické vyšetření srdce a hrudníku prokázaly výpotek v perikardiální dutině a v pleurálních dutinách bilaterálně. Při echokardiografickém vyšetření byl zjištěn významný perikardiální výpotek s incipientními známkami srdeční tamponády. Proto byla zahájena léčba vysokými dávkami kortikoidů po dobu 3 dnů. V průběhu dalších dnů byla zjištěna mírná anemie (Hb 115 g/l) a těžká trombocytopenie (10 x 109/l), proto byla provedena punkce kostní dřeně a vzhledem k nálezu pancytopenie bylo pátráno i po infekci parvovirem B19. PCR metodou byla v kostní dřeni potvrzena přítomnost DNA parvoviru B19, která byla posléze prokázána i v periferní krvi (tab. 1).
Při cytologickém vyšetření kostní dřeně byla zjištěna normální buněčnost s lehce nižším zastoupením prekurzorových buněk erytropoezy a byl nalezen zvýšený počet aktivovaných makrofágů s projevy hemofagocytózy. Kromě pancytopenie a vyšší hladiny feritinu však u pacienta nebyla splněna kritéria pro hemofagocytující lymfohistiocytózu. Vzhledem k závažnému klinickému obrazu a jasně prokázané infekci parvovirem B19 byl pacient léčen vysokými dávkami imunoglobulinů v režimu doporučeném pro léčbu parvovirové infekce (0,4 g/kg 5 dní). Za 6 týdnů vzhledem k přetrvávání infekce bylo nutné podat ještě 2 dávky 0,8 g/kg HD IVIG v odstupu 72 hodin. Postupně došlo k vymizení perikardiálního i pleurálních výpotků, úpravě celkového stavu, plné úpravě trombocytopenie, přetrvávala pouze lehká normocytární anemie. Po úpravě klinického nálezu byl pacient podrobně vyšetřen imunologem. Na základě výsledků kontrolních imunologických vyšetření byla potvrzena vrozená porucha imunity – běžná variabilní imunodeficience (CVID). Nyní je chlapec v trvalé péči imunologů s pravidelnou substitucí imunoglobuliny.
Pacient č. 2 byl desetiletý chlapec léčený v předškolním věku dlouhodobě pro sideropenickou anemii. Byl přijat na spádové dětské oddělení pro vysoké teploty do 40,3 °C a těžkou anemii s hladinou hemoglobinu 45 g/l. Byla podána transfuze erytrocytární masy a pro přetrvávající subfebrilie, anemii a leukopenii byl odeslán k hospitalizaci na oddělení dětské hematologie k vyloučení leukemie. Při přijetí byla zjištěna těžká anemie (65 g/l po transfuzi) s nulovým počtem retikulocytů a leukopenie 3,03 x 109/l s absolutním počtem neutrofilních leukocytů 920/μl krve. Při vyšetření kostní dřeně byla zjištěna těžká hypoplazie erytropoezy (5,2 %) s normálním zastoupením ostatních hematopoetických řad. PCR metodou byla prokázána vysoká pozitivita nálezu DNA parvoviru B19 (tab. 1), která byla potvrzena i v periferní krvi a svědčila pro akutně probíhající infekci. Po podání vysokých dávek imunoglobulinů (0,4 g/kg 5 po sobě jdoucích dní) došlo k úpravě leukopenie, regeneraci erytropoezy a klinický nález se normalizoval. Až 10 dní po propuštění se u nemocného objevil celotělový exantém, typický pro pátou dětskou nemoc. Hodnoty Hb a leukocytů byly již normalizovány.
Obr. 1. Erythema infectiosum: obraz „zpolíčkované tváře“ u pacienta č. 2. Fig. 1. Erythema infectiosum: image of „slapped cheek” in patient No. 2. 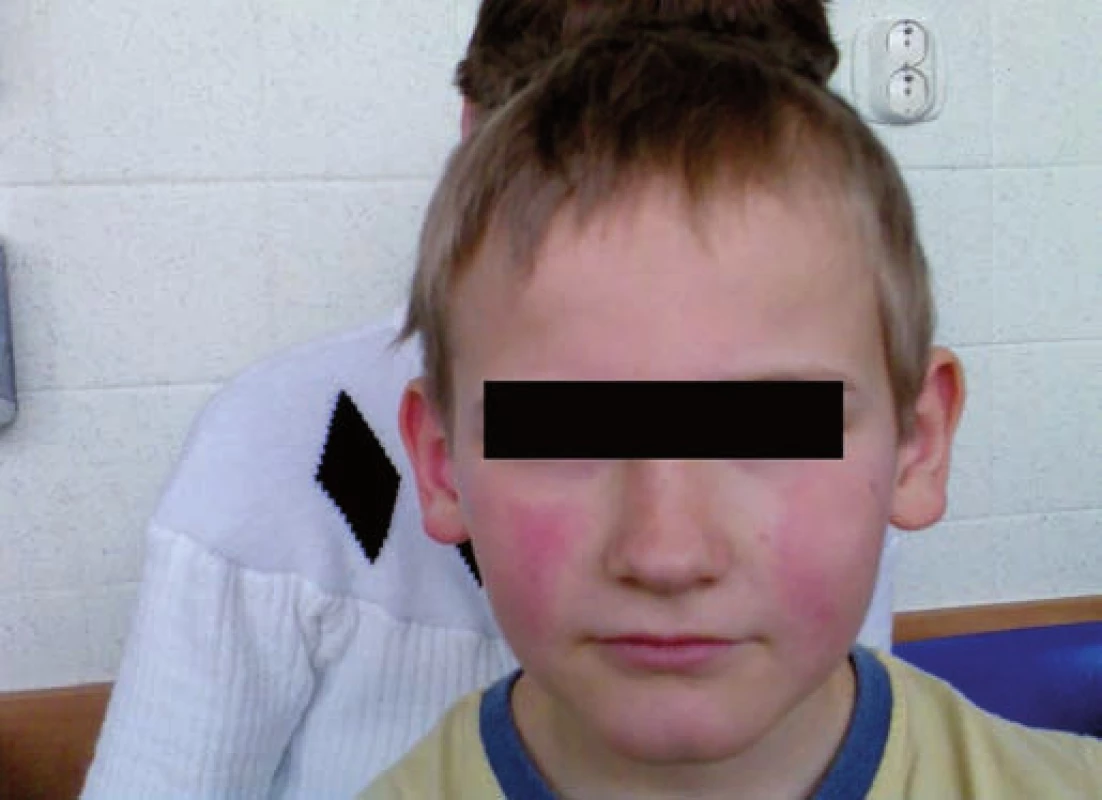
Obr. 2. Erythema infectiosum: exantém na horní končetině u pacienta č. 2. Fig. 2. Erythema infectiosum: rash on the upper extremity in patient No. 2. 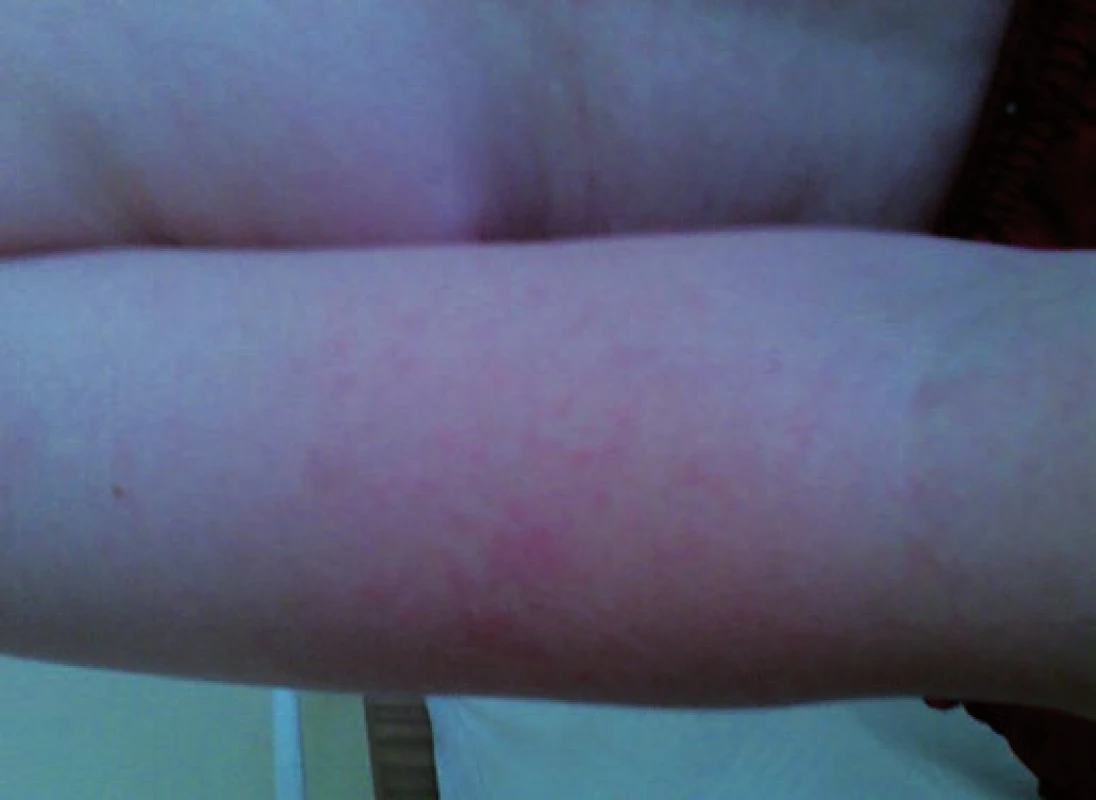
Obr. 3. Obrovský proerytroblast v kostní dřeni typický pro infekci parvovirem B19 u pacienta č. 2. Fig. 3. Giant proerythroblasts in the bone marrow, typical for infection caused by parvovirus B19 in the patient No. 2. 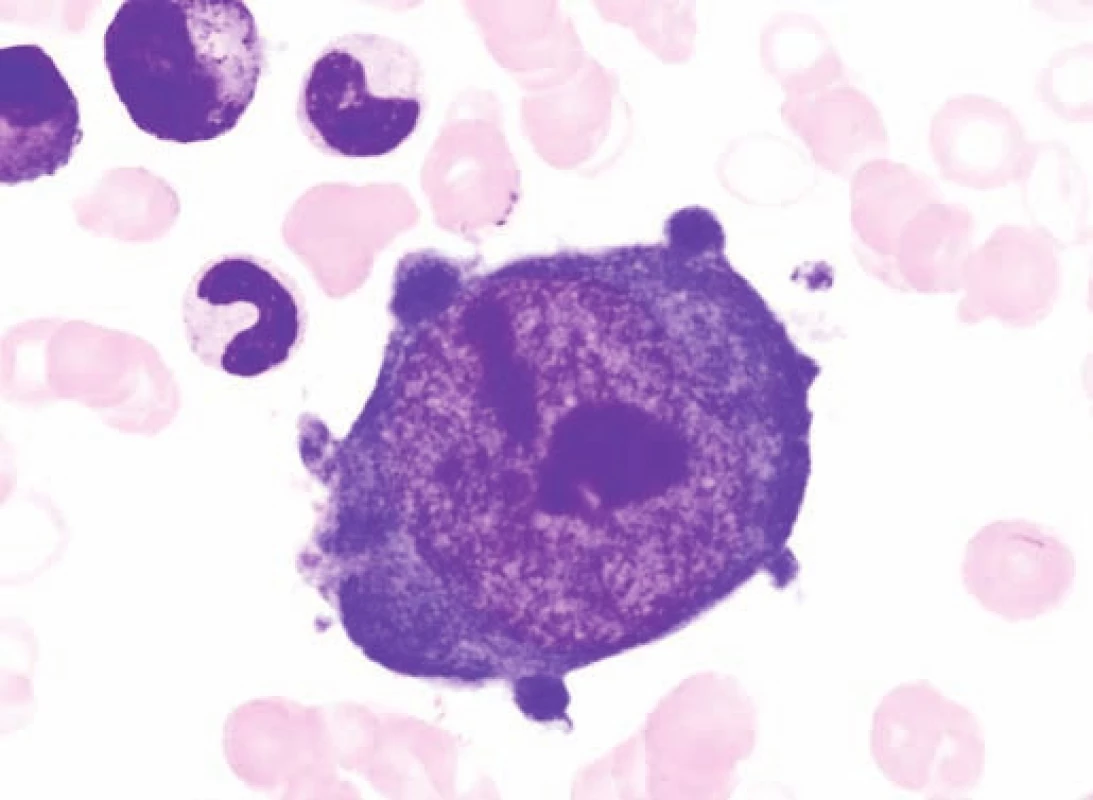
Po půl roce sledování se opět objevily známky sideropenické anemie, na jejímž vzniku se u pacienta podílely dva rozdílné etiologické faktory: chronické ztráty krve při progredující hemangiomatóze sigmoidea a masivní infekce Helicobacter pylori. Po léčbě helikobacterové infekce došlo k úpravě krevního obrazu, po dalších 3 měsících však byla zaznamenána opět recidiva anemie při pozitivitě okultního krvácení. Chlapec je nyní v péči hematologické a gastroenterologické ambulance pro rozsáhlou hemangiomatózu střevní stěny v oblasti sigmoidea doprovázenou chronickými ztrátami krve. Je léčen preparáty železa a propranolonem, který je jedním z nových slibných léků používaných při léčbě hemangiomů u dětí [15].
Pacientem č. 3 byl 3,5letý chlapec, který byl přivezen rodiči na dětskou pohotovostní ambulanci v odpoledních hodinách pro 4 dny trvající potíže jako teploty, zvracení, nechutenství a bolesti břicha. Pro incipientní dehydrataci byl přijat s diagnózou akutní gastroenteritidy na standardní oddělení k rehydratační terapii. Při přijetí byl bledý, zpocený, měl snížený kožní turgor, chladnější periferii a mírnou hepatomegalii. Byla zahájena parenterální rehydratace s roztoky krystaloidů rychlostí 8 ml/kg/hod. Po dvou hodinách rehydratace progredovala hepatomegalie. Pro narůstající tachykardii a progresi hepatomegalie byl chlapec po 3 hodinách přeložen na jednotku intenzivní a resuscitační péče. Při překladu měl tachykardii 171/min a krevní tlak 108/75 mmHg. Na rtg snímku srdce a plic byla patrná dilatace srdečního stínu.
Obr. 4. Rtg snímek srdce a plic s dilatací srdečního stínu u pacienta č. 3. Fig. 4. X-ray of heart and lungs with dilatation of the heart shadow in the patient No. 3. 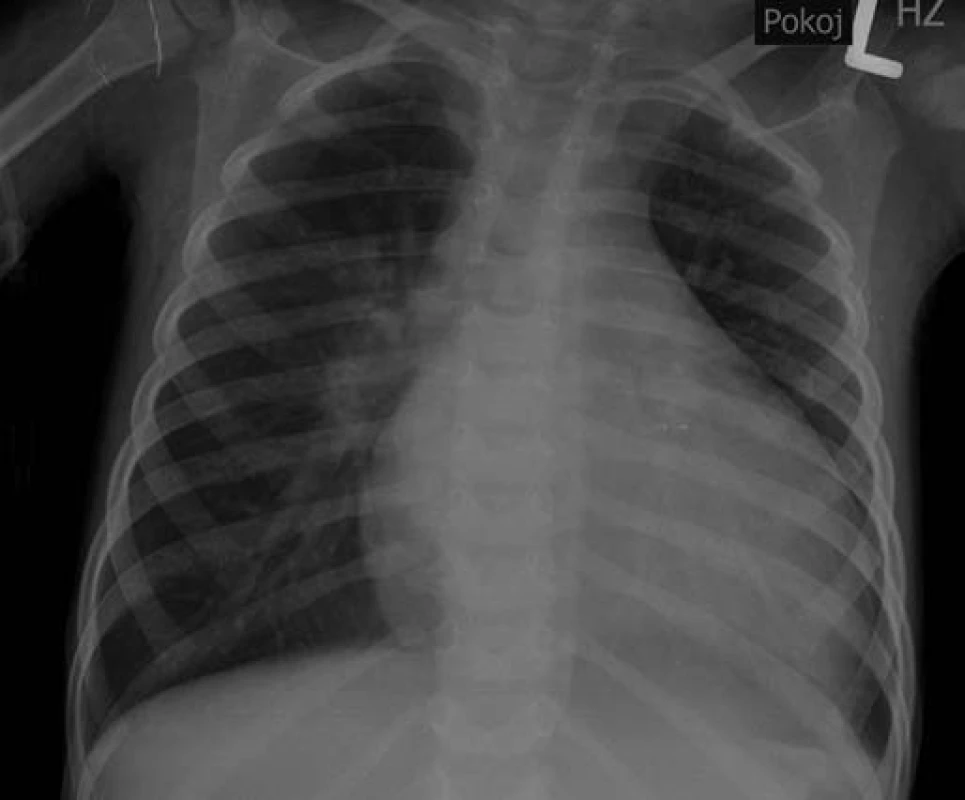
Bylo provedeno echokardiografické vyšetření, při kterém byla zjištěna závažná dilatace a systolické selhání myokardu levé srdeční komory, mitrální insuficience 3. stupně a trikuspidální insuficience 2. stupně. Ejekční frakce byla pouze 12 %. Laboratorní vyšetření prokázalo elevaci troponinu T 0,239 μg/l (norma do 0,014). Byla zahájena intenzivní léčba srdečního selhání včetně podání dobutaminu, milrinonu a levosimendanu. Po 3 hodinách pobytu na JIP nastala asystolie. Byla zahájena kardiopulmonální resuscitace včetně podání adrenalinu, atropinu, nepřímá srdeční masáž a pacient byl napojen na umělou plicní ventilaci. Přes protrahovanou kardiopulmonální resuscitaci nedošlo k restituci sinusového rytmu a pacient umírá 8 hodin po přijetí. Konečná sekční diagnóza byla: akutní lymfocytární myokarditida a akutní lymfocytární gastroenteritida. Vyšetření bioptického vzorku myokardu odebraného při sekci prokázalo výraznou lymfocytární infiltraci v intersticiu (obr. 5) a nekrózu myocytů (ztráta barvitelnosti jader a zvýšená eozinofilie cytoplazmy). Vzorek postižené tkáně myokardu byl také zaslán k virologickému vyšetření, při kterém byla PCR metodou prokázána přítomnost DNA parvoviru B19 jednoznačně svědčící pro infekci virem.
Obr. 5. Histologický nález tkáně myokardu u pacienta č. 3. Fig. 5. Histological finding of myocardial tissue in patient No. 3. 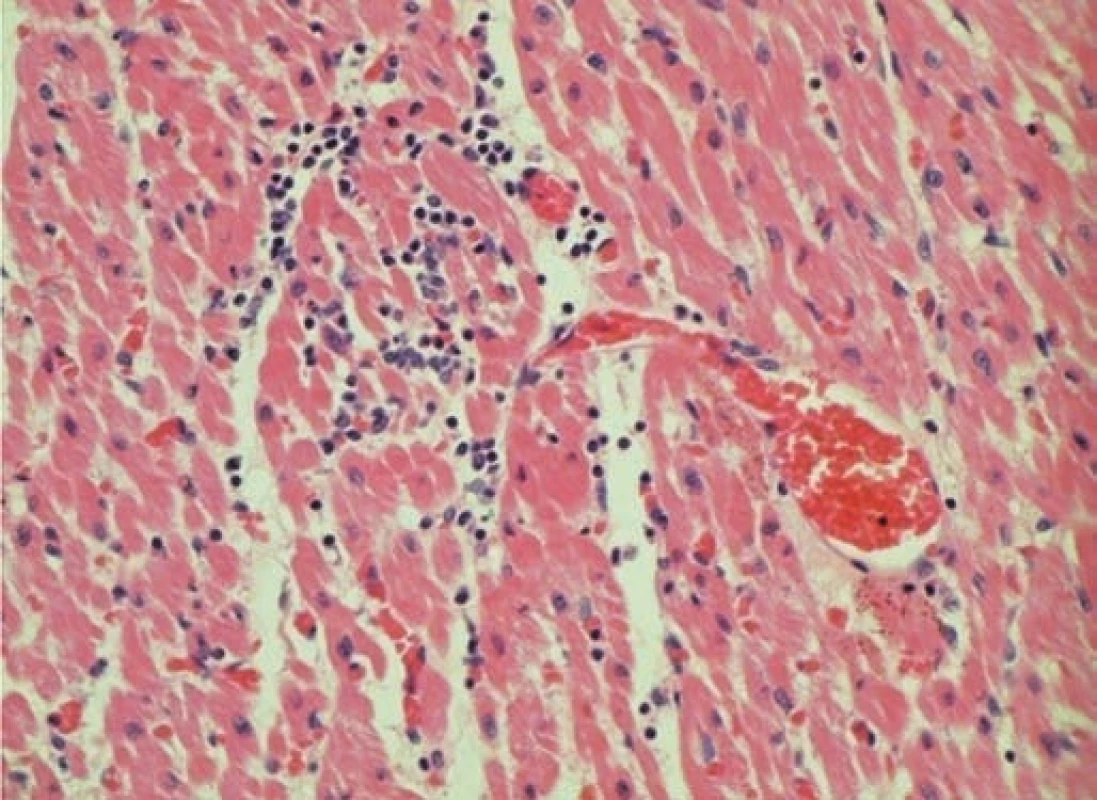
Dalších 5 pacientů – dvě dívky a tři chlapci ve věkovém rozmezí 7 až 11 let – bylo přijato k hospitalizaci pro náhlý rozvoj velmi závažné anemie vyžadující transfuzi (Hb 44–69 g/l – tab. 1). Jednalo se o doposud „zdravé děti“, pouze jedno z nich bylo sledováno pro mírný intermitentní ikterus, který byl připisován Gilbertově nemoci. První tři děti byly primárně vyšetřeny pro vysoké teploty doprovázející u dvou dětí gastroenteritidu a u jednoho tracheobronchitidu. U dalších dvou dětí byly důvodem k vyšetření celková slabost a vyčerpání. Při fyzikálním vyšetření dominovala u všech pacientů výrazná bledost s tachykardií, u dvou doprovázená subikterem sklér a mírnou splenomegalií potvrzenou sonograficky.
Při vyšetření krevního obrazu s diferenciálním rozpočtem leukocytů a počtem retikulocytů byla zjištěna závažná anemie s normálním nebo lehce vyšším počtem retikulocytů, která si vyžádala transfuzi erytrocytární masy.
Kromě základních biochemických analýz bylo provedeno i vyšetření markerů hemolýzy (nekonjugovaný bilirubin, laktátdehydrogenáza – LDH, volný hemoglobin plazmy a haptoglobin). Výsledky vyšetření potvrdily různý stupeň extravaskulární hemolýzy u všech pacientů: hraniční nebo zvýšená hladina LDH (5,61–10,71 μkat/l), haptoglobin byl snížen (0,39–0,04 g/l). Nekonjugovaný bilirubin byl zvýšený pouze u 1 pacienta, u 3 pacientů byl hraniční, u jednoho pacienta normální. Vzhledem k přidruženým febriliím a náhle vzniklé anemii byla u tří nemocných provedena také analýza periferní krve k průkazu DNA parvoviru B19 metodou PCR, která byla ve všech případech pozitivní (tab. 1), u dvou dětí bylo provedeno pouze sérologické vyšetření, které potvrdilo pozitivitu protilátek třídy IgM a posléze i IgG proti parvoviru B19. Nálezy u všech dětí tedy prokázaly infekci parvovirem B19.
S odstupem 4 týdnů po odeznění infekce byl pro přetrvávání mírné anemie s retikulocytózou proveden test kryohemolýzy k vyloučení patologie membrány erytrocytů s pozitivním nálezem u všech pacientů (tab. 2).
Tab. 2. Hodnoty krevního obrazu a biochemické parametry u pacientů č. 4 až 8. 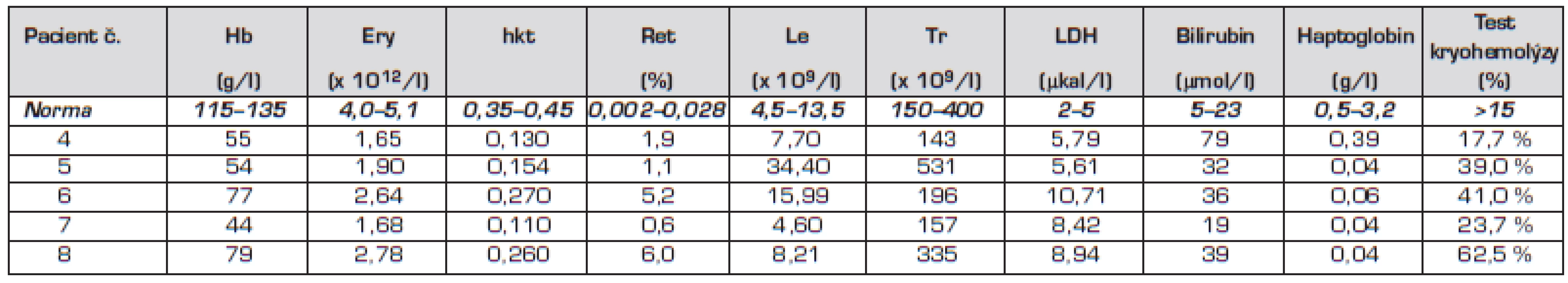
Uvedená vyšetření společně s nálezem sférocytů v nátěru periferní krve potvrdila diagnózu sférocytární anemie. U všech pěti nemocných byla tedy stanovena stejná diagnóza: Tranzientní aplastická krize při infekci parvovirem B19 jako první manifestace hereditární sférocytózy.
U dvou pacientů se za 10 a 14 dní po propuštění objevil kožní exantém typický pro pátou nemoc. U pacienta č. 1 byla doplněna rodinná anamnéza údaji o matce, která byla ve stejnou dobu jako její dítě hospitalizována na hematologickém oddělení pro těžkou anemii s nutností aplikace dvou transfuzí erytrocytární masy a u které byla rovněž nově diagnostikována lehká forma hereditární sférocytózy.
DISKUSE
Diagnóza infekce parvovirem B19 u pacientů s klasickými klinickými projevy obvykle nečiní potíže. Diagnostické rozpaky však mohou nastat v případě vzácných manifestací infekce. Je tomu tak především u imunosuprimovaných nemocných, u kterých mohou být klinické projevy atypické. U pacienta č. 1 byla kombinace prvních klinických příznaků pro parvovirovou infekci necharakteristická, hematologické příznaky však upozornily na možnost parvovirové etiologie. Všechny projevy onemocnění u pacienta je možné dát do souvislosti s infekcí parvovirem B19. Perikardiální a pleurální výpotky byly u parvovirové infekce vzácně popsány [16, 17], a to právě u imunosuprimovaných nemocných. Anemie a trombocytopenie jsou u parvovirové infekce popisovány poměrně často. Na jejich vzniku se u našeho pacienta kromě cytopatického efektu viru a protilátek proti trombocytům mohla podílet i hemofagocytóza, kterou jsme prokázali v kostní dřeni a která byla u parvovirové infekce rovněž popsána jak u dětí, tak u dospělých [18, 19]. Neobvykle závažný a protrahovaný průběh parvovirové infekce vedl posléze k pátrání po diagnóze vrozeného imunodeficitu a nakonec k odhalení CVID. Právě u pacientů s primárním, ale i sekundárním imunodeficitem je při oslabení imunity popisován velmi těžký nebo protrahovaný průběh parvovirové infekce, která se může manifestovat například jako hepatitida [20], pancytopenie [21], hemofagocytující lymfohistiocytóza, vzácně i generalizované infekce s multiorgánovým selháním, se kterým jsme se setkali u pacientky po transplantaci kostní dřeně [22]. Protilátková odpověď bývá nedostatečná a infekce tak může přejít do chronicity.
Za nejčastější viry způsobující myokarditidu jsou považovány enteroviry, Coxackie B viry a adenoviry [23]. V souvislosti s rychlým rozvojem molekulární diagnostiky je však v posledních 10 letech často diskutována etiologická souvislost parvovirové infekce s myokarditidou, dilatační kardiomyopatií a izolovanou dysfunkcí levé komory u dětí i dospělých. Přítomnost DNA viru lze prokázat metodou PCR v materiálu z endomyokardiální biopsie nebo z autoptického materiálu u fulminantně probíhajících myokarditid.
Byla publikována kazuistická sdělení o fatálním průběhu parvovirové myokarditidy u osmiletého a pětiletého dítěte [24, 25] a velmi těžkém průběhu parvovirové myokarditidy u dalších 3 pacientů vyžadujícím agresivní léčbu [26]. V souboru 11 dětských pacientů s těžce probíhající akutní myokarditidou [27] byl parvovirus zjištěn u 2 z 5 dětí, u kterých byla prokázána virová etiologie. Ve studii 172 dospělých pacientů s myokarditidou byla při endomyokardiální biopsii prokázána přítomnost DNA parvoviru B19 PCR metodou ve 37 % případů (9), v další studii německých autorů byl parvovirus B19 v endomyokardiálních biopsiích rovněž nejčastějším nálezem [23]. V souboru 38 dospělých pacientů s izolovanou dysfunkcí levé komory byla DNA viru nalezena u 84 % pacientů [28]. Myokarditida způsobená parvovirem B19 byla překvapivě stanovena jako příčina úmrtí u 9 % [29] a 11 % [30] kojenců se syndromem náhlého úmrtí.
Na rozdíl od myokarditidy způsobené například enteroviry a adenoviry, u kterých je popsána virem indukovaná cytolýza buněk myokardu, bylo u parvovirem indukované kardiomyopatie popsáno spíše postižení intrakardiálních endoteliálních buněk malých arteriol a vén, které může být asociováno s endoteliální dysfunkcí, poškozením myokardiální mikrocirkulace, penetrací buněk zánětu a sekundární nekrózou myocytů [31]. V případě závažného průběhu myokarditidy je nutná agresivní léčba s použitím diuretik, ACE inhibitorů, umělé plicní ventilace a výjimečně i extrakorporální membránové oxygenace. Otázka použití imunosupresiv je stále diskutována. Podle některých studií by jejich podání mělo mít pozitivní efekt ve smyslu zlepšení myokardiální funkce [32], podle jiných však nebyl prokázán efekt imunosupresivní terapie ve srovnání s „klasickou“ léčbou [33]. Terapie imunosupresivy by měla opodstatnění při navození imunopatologické reakce v myokardu. Těžký průběh parvovirové myokarditidy je naštěstí vzácnou komplikací této běžně se vyskytující infekce. Myokarditida však může v některých případech proběhnout subklinicky/inaparentně a následně vyústit do nezvratného kardiálního selhání, smrti pacienta nebo do obrazu dilatační kardiomyopatie. Vzhledem k nízké séroprevalenci ve věkové skupině dětí mladších 5 let (2 %) a 5–9 let (21 %) jsou právě tyto děti nejohroženější skupinou pacientů, u které je třeba na tuto komplikaci myslet.
Parvovirus B19 může vést k rozvoji těžké anemie u všech stavů se zvýšenými nároky na erytropoezu. Může tomu tak být nejen u pacientů s hemolytickou anemii, ale například i u anemie z nedostatku železa [34, 35]. U uvedených nemocí je pro korekci anemie nutná zvýšená produkce erytrocytů, která vede k úpravě anemie. Obrat erytropoezy tak může být zvýšen 3–10násobně. Při parvovirové infekci dochází vždy k přechodnému zpomalení až zástavě erytropoezy, která se u zdravých jedinců klinicky většinou neprojeví. Ztráta možnosti kompenzačního zvýšení produkce erytrocytů u stavů se zvýšeným nárokem na obrat erytropoezy však vede rychle k rozvoji těžké anemie. Tento stav je znám jako tzv. tranzientní aplastická krize (TAC) a může vzácně skončit i fatálně. Jak ukazujeme na souboru pacientů s doposud nerozpoznanou sférocytární anemií, může být TAC u mírnějších forem hemolytické anemie její první manifestací. Na souboru našich pacientů jednak demonstrujeme závažnost anemie v těchto případech a jednak zdůrazňujeme nutnost pečlivého dodatečného hematologického vyšetření pacienta s TAC, které může překvapivě odhalit lehčí formy vrozené hemolytické anemie nebo chronickou sideropenickou anemii způsobenou onemocněním, které vyžaduje léčbu.
Je nutno rovněž zdůraznit, že v akutní fázi aplastické krize u hemolytických anemií nemusí být přítomna žloutenka a počet retikulocytů je relativně snížen, což ji odlišuje od hemolytické krize, při které je hemolýza doprovázená výrazným ikterem a retikulocytózou. U dvou pacientů souboru byl podle anamnézy přítomen před manifestací parvovirové infekce kolísavý ikterus, který byl v jednom případě uzavřen jako Gilbertova žloutenka. Jak vyplývá z uvedeného případu, u dětského pacienta s intermitentní žloutenkou by mělo být samozřejmostí vyšetřit krevní obraz vždy s počtem retikulocytů, který může i v případě s lehce nižší nebo vzácně i normální hodnotou hemoglobinu odhalit dobře kompenzovanou hemolýzu u vrozené hemolytické anemie.
Kožní exantém typický pro pátou dětskou nemoc je považován za následek ukládání imunokomplexů do kůže. Objevuje se až s nástupem protilátkové odpovědi, většinou s odstupem 2–3 týdnů od začátku onemocnění. U dvou pacientů se sférocytární anemií se objevil exantém až za 10 a 12 dní od začátku teplot, nebyl však hodnocen správně jako pátá nemoc, ale jako kožní alergická reakce.
ZÁVĚR
Parvovirus B19 je typickým příkladem patogenního agens, jehož klinické příznaky mohou být velmi pestré a plně závisí na poměru vnitřních vlastností patogenu na jedné straně a celkového stavu organismu na straně druhé. Klinický obraz infekce kolísá od asymptomatického průběhu k život ohrožujícím komplikacím. Těžký nebo neobvykle protrahovaný průběh infekce může poukázat na dosud nediagnostikovanou vrozenou či získanou poruchu imunity.
Infekce parvovirem B19 by měla být zahrnuta do diferenciálně diagnostických úvah nejen u běžně známých klinických jednotek, ale i v případech celé řady možných vzácných nanifestací. Při nálezu těžké anemie při parvovirové infekci je vždy nezbytné vyloučit vrozenou hemolytickou anemii, především hereditární sférocytózu, která může být před manifestací aplastické krize přehlédnuta.
Podpořeno granty NT/13587 a CZ.1.07/2.2.00/15.0305.
Došlo: 29. 11. 2011
Přijato: 6. 4. 2012
MUDr. Barbora Ludíková
Na Zákopě 15
772 00 Olomouc
e-mail: ludikova.b83@gmail.com
Zdroje
1. Cossart Y. Parvovirus B19 finds a disease. Lancet 1981; 2 : 988–989.
2. Heegaard ED, Brown KE. Human parvovirus B19. Clin Micorb Rev 2002; 15 : 485–505.
3. Moffatt S, Yaegashi N, Tada K, Tanaka N, Sugamura K. Human parvovirus B19 nonstructural(NS1) protein induces apoptosis in erythroid lineage cells. J Virol 1998; 72 : 3018–3028.
4. Young NS, Brown KE. Parvovirus B19. NEJM 2004; 350 : 586–597.
5. Weigel-Kelley KA, Yoder MC, Srivastava A. Alpha5beta1 integrin as a cellular coreceptor for human parvovirus B19: Requirement of functional activation of beta1 integrin for viral entry. Blood 2003; 102 : 3927–3933.
6. Munakata Y, Saito-Ito T, Kumura-Ishii K, Huang J, Kodera T, et al. Ku80 autoantigen as a cellular coreceptor for human parvovirus B19 infection. Blood 2005; 106 : 3449–3456.
7. de Jong EP, Walther FJ, Kroes AC, Oepkes D. Parvovirus B19 infection in pregnancy: new insights and management. Prenat Diagn 2011; 31 (5): 419–425.
8. Lehman HW, Knoll A, Kuster RM, Modrow S. Frequent infection with a viral pathogen, parvovirus B19, in rheumatic diseases in childhood. Arthritis Rheum 2003; 48 : 1631–1638.
9. Pankuweit S, Ruppert V, Eckhardt H, Strache D, Maisch B. Pathophysiology and aetiological diagnosis of inflammatory myocardial diseases with a special focus on parvovirus B19. J Vet Med B Infect Dis Vet Publ Health 2005; 52 (7–8): 344–347.
10. Hatakka A, Klein J, He R, Piper J, Tam E, Walkty A. Acute hepatitis as a manifestation of parvovirus B19 infection. J Clin Microbiol 2011; 49 (9): 3422–3424.
11. Meyer P, Jeziorski E, Bott-Gilton L, Foulongne V, Rivier F, et al. Childhood parvovirus B19 encephalitis. Arch Pediatr 2011; 18 (12): 1310–1314.
12. Wen JQ, Zhou N, Li D, Feng HL, Wang H. Study on clinical characteristics and follow-up visit of acquired aplastic anemia associated with parvovirus B19 onfection. Indian J Pediatr 2011; (Epub ahead of print).
13. Gutermuth J, Nadas K, Zirbs M, Seifert F, Hein R, et al. Papular-purpuric gloves and socks syndrome. Lancet 2011; 378 (9786): 198.
14. Chuhjo T, Nakao S, Matsuda T. Successful treatment of persistent erythroid aplasia caused by parvovirus B19 infection in a patient with common variable immunodeficiency with low-dose immunoglobulin. Am J Hematol 1999; 60 : 222–224.
15. Menezes MD, McCarter R, Greene EA, Bauman NM. Status of propranolol for treatment of infantile hemangioma and description of a randomized clinical trial. Ann Otol Rhinol Laryngol 2011; 120 (10): 686–695.
16. Sairam S, Goel N, Lisse J, McNearney T. Pericardial effusion and cardiomyopathy following arthritis with parvovirus B19 infection: response to intravenous immunoglobulin. J Clin Rheumatol 2001; 7 (5): 346–349.
17. Ergül Y, Nişli K, Keleşoğlu F, Dindar A. Acute pericarditis and transient erythroblastopenia associated with human parvovirus B19 infection. Turk Kardiyol Dern Ars 2010; 38 (5): 349–351.
18. Sato T, Ueda D, Sakota S, Haseyama K, Chiba S, Kudoh T. Pancytopenia with hemophagocytosis secondary to parvovirus B19 infection in a family with hereditary spherocytosis. Pediatr Int 1999; 41 (5): 561–564.
19. Shirono K, Tsuda H. Parvovirus B19-associated haemophagocytic syndrome in healthy adults. Br J Haematol 1995; 89 (4): 923–926.
20. Mogensen TH, Jensen JM, Hamilton-Dutoit S, Larsen CS. Chronic hepatitis caused by persistent parvovirus B19 infection. BMC Infect Dis 2010; 10 : 246.
21. Mihal V, Dusek J, Hajduch M, Cohen BJ, Fingerova H, Vesely J. Transient aplastic crisis in a leukemic child caused by parvovirus B19 infection. Pediatr Hematol Oncol 1996; 13 : 173–177.
22. Šrámková L, Sedláček P, Pospíšilová D, Petrtýlová K, Starý J. Bone marrow transplantation and postransplant care in Diamond-Blackfan anemia: report of three cases. Abstract. European Society of Pediatric Haematology and Immunology Annual Meeting, Luzern 6/2001. Pediatr Res 2001; 49 (6).
23. Mahrholdt H, Wagner A, Deluigi CC, Kispert E, Hager S, et al. Presentation, patterns of myocardial damage, and clinical course of viral myocarditis. Circulation 2006; 114 (15): 1581–1590.
24. Dettmeyer R, Kandolf R, Baasner A, Banaschak S, Eis-Hubinger AM, Madea B. Fatal parvovirus B10 myocarditis in an 8-year boy. J Forensic Sci 2003; 48 (1): 183–186.
25. Zack F, Klingel K, Kandolf R, Wegener R. Sudden cardiac death in a 5-year-old girl associated with parvovirus B19 infection. Forensic Sci Int 2005; 155 (1): 13–17.
26. Munro K, Croxson MC, Thomas S, Wilson NJ. Three cases of myocarditis in childhood associated with human parvovirus(B19 virus). Pediatr Cardiol 2003; 24 (5): 473–475.
27. Amabile N, Fraisse A, Bouvenot J, Chetaille P, Ovaert C. Outcome of acute fulminant myocarditis in children. Heart 2006; 92 (9): 1269–1273.
28. Tschope C, Bock CT, Kasner M, Noutsias M, Westermann D, et al. High prevalence of cardiac parvovirus B19 infection in patients with isolated left ventricular diastolic dysfunction. Circulation 2005; 111 (7): 879–886.
29. Baasner A, Dettmeyer R, Graebe M, Rissland J, Madea B. PCR-based diagnosis of enterovirus and parvovirus B19 in paraffin-embedded heart tissue of children with suspected sudden infant death syndrome. Lab Invest 2003; 83 (10): 1451–1455.
30. Dettmeyer R, Baasner A, Schlamann M, Padosch SA, Haag C, et al. Role of virus-induced myocardial affections in sudden infant death syndrome: a prospective postmortem study. Pediatr Res 2004; 55 (6): 947–952.
31. Kandolf R. Virus etiology of inflammatory cardiomyopathy. Dtsch Med Wochenschr 2004; 129 (41): 2187–2192.
32. Aziz KU, Patel N, Sadullah T, Tasneem H, Thawerani H, Talpur S. Acute viral myocarditis: role of immunosuppression: a prospective randomised study. Cardiol Young 2010; 20 (5): 509–515
33. Hia CP, Yip WC, Tai BC, Quek SC. Immunosuppressive therapy in acute myocarditis: an 18 year systematic review. Arch Dis Child 2004; 89 (6): 580–584.
34. Tarantino MD, Shahidi NT. Parvovirus B19-induced red blood cell aplasia complicating iron-deficiency anemia. Clin Pediatr (Phila) 1995; 34 (2): 108–109.
35. Nesher G, Moore TL. Human parvovirus infection. Infect Med 1997; 14 : 638–642.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článek Čtení o logopedii – 1. částČlánek Nedonošený novorozenec
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2012 Číslo 3- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficitmi v reálnej praxi
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
-
Všetky články tohto čísla
- Incidence dyslipidemií v populaci dětí s obezitou
- Deficit pyruvátkinázy v dětském věku
- Neobvyklé manifestace infekce parvovirem B19 u dětí
- Vyšetření sérové koncentrace prealbuminu a selenu ke sledování nutričního stavu pacientů s fenylketonurií a hyperfenylalaninemií
- Variabilita klinické manifestace norovirové infekce u novorozence – od perakutní nekrotizující enterokolitidy po asymptomatický průběh
- Benigní infantilní křeče asociované s norovirovou gastroenteritidou
- Současné užití léků blokujících adrenergní receptory beta u dětí se srdečním selháním
- Čtení o logopedii – 1. část
- Nedonošený novorozenec
- Poruchy vnitřního prostředí novorozenců
- Vzpomínky na budoucnost: Nefrologie na II. dětské klinice FDL UK a na Dětské klinice FN Pod Petřínem v Praze
- Primář MUDr. Petr Tax šedesátiletý
- VI. Martinské neonatologické dni
- X. český pediatrický kongres s mezinárodní účastí
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Nedonošený novorozenec
- Neobvyklé manifestace infekce parvovirem B19 u dětí
- Poruchy vnitřního prostředí novorozenců
- Deficit pyruvátkinázy v dětském věku
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



