-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Nové tváře mitochondriálního onemocnění u dětí
Autori: M. Magner
Pôsobisko autorov: Klinika dětského a dorostového lékařství 1. LF UK a VFN, Prahapřednosta prof. MUDr. J. Zeman, DrSc.
Vyšlo v časopise: Čes-slov Pediat 2013; 68 (1): 61-63.
Kategória: Abstrakta
(Abstrakt přednášky, kterou autor přednesl na X. českém pediatrickém kongresu v Liberci při příležitosti převzetí Ceny České pediatrické společnosti za vědeckou činnost pro pediatry ve věku do 35 let)
Mitochondrie (mitos – vlákno, chondros – zrno) jsou buněčné organely tvořené vnější a vnitřní membránou, mezimembránovým prostorem a matrix. V buňce tvoří retikulum představující až 25 % objemu savčí buňky. Morfologie této sítě je závislá na funkčním a anatomickém stavu buňky.
Hlavním úkolem mitochondrií je tvorba energie v systému oxidativní fosforylace. Tento systém je lokalizován na vnitřní mitochondriální membráně a v matrix mitochondrie. Je tvořen pěti složitými proteinovými komplexy, které obsahují více než 80 proteinů. Celá řada dalších proteinů je nutná k jejich správnému sestavení. První čtyři komplexy patří do respiračního řetězce, ve kterém se při přenosu elektronů na konečný akceptor kyslík za vzniku vody zároveň vytváří protonový gradient. Tento gradient a zpětný tok protonů přes vnitřní membránu slouží k „pohonu“, tedy k indukci konformačních změn pátého komplexu za vzniku ATP.
Významné je genetické pozadí mitochondriálních onemocnění. Mitochondrie jsou řízeny nukleárním genomem i v mitochondriích uloženou mitochondriální DNA. Ta však obsahuje pouze 37 genů kódujících 22 transferových a 2 ribozomální RNA a třináct z celkově cca 1500 bílkovin, které se na stavbě mitochondrií podílejí. V eukaryotické buňce se nachází 103 až 104 kopií mitochondriální DNA. Podíl mutované k nemutované mtDNA se nazývá heteroplazmie.
Heteroplazmie se může mezigeneračně výrazně lišit, může být však rozdílná i v jednotlivých tkáních jedince. Hladina heteroplazmie, při které se mitochondriální onemocnění projeví, se nazývá treshold. I když je množství mutací v mitochondriální DNA přibližně 10–17krát vyšší než v nukleární DNA, nukleárně kódované onemocnění tvoří přibližně 75 % z více než 180 známých mitochondriálních onemocnění v dětském věku.
Mitochondriální onemocnění nejsou vzácná. Jejich incidence se udává až 1 : 5000. Přitom se často jedná o onemocnění dětí. Více než jedna čtvrtina z dosud více než 420 pacientů diagnostikovaných v Laboratoři pro studium mitochondriálních onemocnění při Klinice dětského a dorostového lékařství v Praze se manifestovala již v novorozeneckém věku. Postižen může být jakýkoli orgán nebo orgánový systém, a to samostatně nebo v kombinacích, které spolu zdánlivě nemusí souviset. Nejčastěji se jedná o orgány s nejvyššími energetickými nároky, tj. mozek, srdce, sval a smysly [1].
Diagnostika mitochondriálních onemocnění je náročná. Vyžaduje multidisciplinární přístup a kromě pečlivé anamnézy, klinického vyšetření a rozšířeného biochemického vyšetření jsou nutná široká metabolická vyšetření. Zlatým standardem zůstává specializované vyšetření svalové a kožní biopsie s vyšetřením oxygrafie, polarografie, western blot. Důležitá jsou i histologická, imunohistochemická a elektronmikroskopická vyšetření s nálezem rozeklaných svalových vláken (ragged red fibres) v barvení Gomoriho trichromem, nálezem COX deficitních vláken či akumulací SDH produktu. Definitivní diagnózu pak může potvrdit molekulárně genetické vyšetření. Diagnózu na molekulárně genetické úrovni se však zatím daří stanovit pouze v cca 30 % případů [2].
Předmětem sdělení jsou především nové formy mitochondriálního onemocnění v dětském věku. Jedná se o onemocnění s mírnější manifestací nebo bez kompletní a známé klinické manifestace.
Příklad byl ilustrován na souboru 41 dětí s deficitem komplexu IV při deficitu proteinu Surf1 [3]. Ve spojení s nonsense mutacemi se jednalo o závažný průběh s hlubokým regresem ve vývoji, většinou v batolecím věku, s rozvojem Leighova syndromu, přítomností Kussmaulova dýchání při závažné laktátové metabolické acidóze, ataxií, hypertrichózou a nepříznivou prognózou (přežití >7 let pouze ve 4 %). Při mírnějších formách s missense mutacemi se onemocnění manifestovalo později, žádné z dětí nemělo laktátovou acidózu ani vyjádřený Leighův syndrom (tab. 1). Prognóza byla v této skupině pacientů výrazně lepší (přežití >7 let v 75 %).
Tab. 1. Ilustrace závažného a mírnějšího průběhu onemocnění u 41 dětí s deficitem proteinu Surf1. 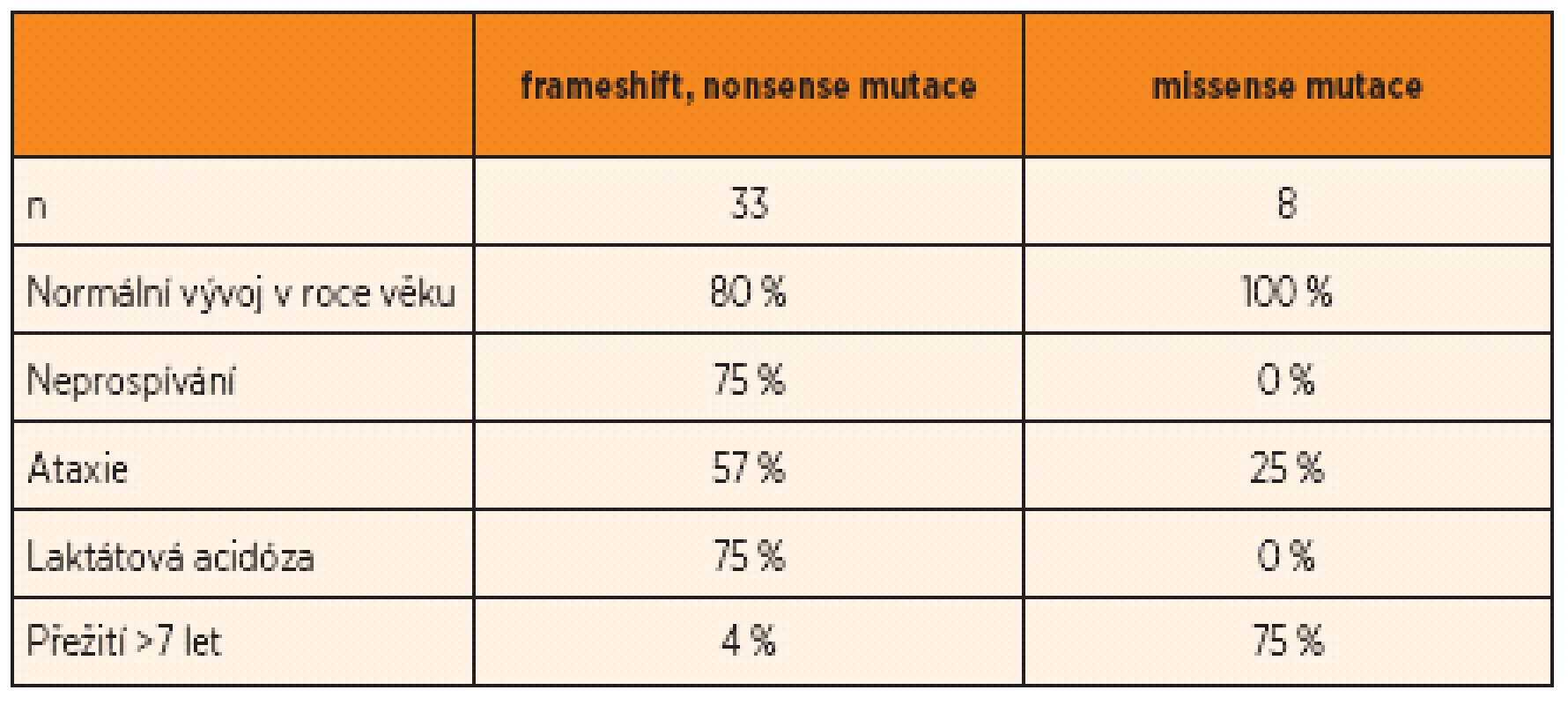
Podobný příklad je možné uvést u zřejmě nejznámějšího mitochondriálního onemocnění MELAS – Mitochondriální myopatii, Encefalopatii, Laktátové acidóze, Stroke-like episodes syndromu. V Čechách jsme diagnostikovali 29 pacientů s prevalentní mutací 3243A>G v mitochondriální DNA vedoucí k tomuto onemocnění [4]. Pouze jedna pětina pacientů splňovala kritéria syndromu. Nejčastějšími příznaky v souboru byla porucha sluchu (76 %), zraku (48 %), svalová slabost (52 %), postižení kardiovaskulárního systému a zejména kardiomyopatie (54 %), diabetes mellitus (31 %). Laktátová acidóza byla přítomna pouze u 42 %, iktu podobné příhody pouze u 28 % pacientů.
V další části byla rozebrána problematika měření hladiny laktátu. Ten je u mitochondriálních onemocnění typicky zvýšen. Často je však zvýšen i u jiných dědičných poruch metabolismu, či sekundárně při poruchách perfuze, intoxikaci, zvýšené svalové námaze či křečích. Význam měření laktátu v krvi a likvoru jsme zkoumali ve skupině 108 dětí s mitochondriálním onemocněním, epilepsií, psychomotorickou retardací, hnisavou meningitidou a meningismem [5]. Vysoký laktát v likvoru jasně odlišil děti s bakteriální meningitidou od dětí s meningismem. Měření laktátu v likvoru dokázalo odlišit děti s mitochondriálním onemocněním (zvýšená hodnota v 83 %) od dětí s primární epilepsií (pouze u 3 %) nebo opožděním vývoje z jiných důvodů (9 %) (obr. 1). Krátce trvající křeče v trvání do dvou minut v naší skupině nezvýšily hladinu laktátu v likvoru. Při tomto nálezu je proto vždy nutné na mitochondriální onemocnění pomýšlet. Měření laktátu bylo v likvoru u dětí s mitochondriálním onemocněním rovněž senzitivnější (83 %) než vyšetření v krvi (54 %).
Obr. 1. Srovnání hladin laktátu v likvoru u 108 dětí s potvrzeným mitochondriálním onemocněním, epilepsií, psychomotorickou retardací, purulentní meningitidou a meningismem. Blíže viz text. 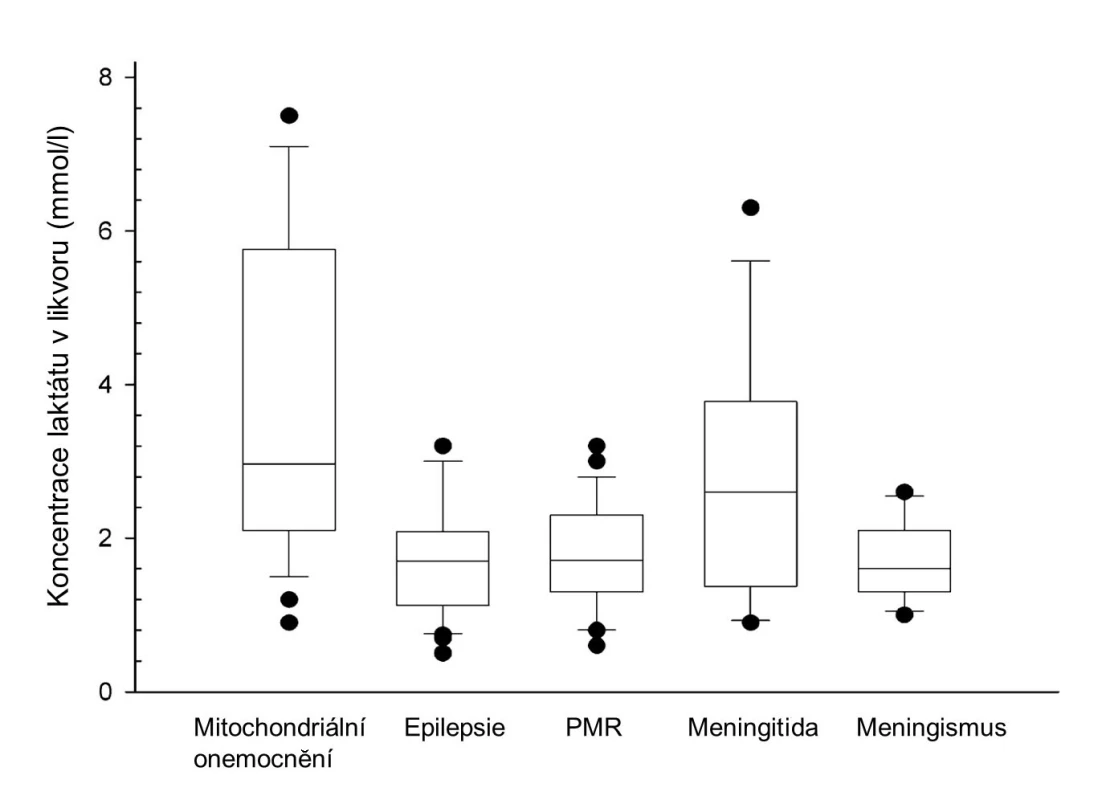
ZÁVĚR
Mitochondriální onemocnění patří mezi nejčastější dědičné poruchy metabolismu. Vyhledávat děti s mírnější formou onemocnění je důležité nejenom pro stanovení molekulárně genetické diagnózy a možnosti genetického poradenství v rodině, ale do budoucna pro nabídnutí zatím pouze experimentálních modalit terapie. Normální hladiny laktátu v krvi mitochondriální onemocnění nevylučují.
Podpořeno grantem RVO-VFN64165/2012 a UNCE 204011.
Zdroje
1. Böhm M, Pronicka E, Karczmare-wicz E, et al. Retrospective, multicentric study of 180 children with cytochrome C oxidase deficiency. Pediatr Res 2006; 59 : 21–26.
2. Honzik T, Tesarova M, Magner M, et al. Neonatal onset of mitochondrial disorders in 129 patients: clinical and laboratory characteristics and a new approach to diagnosis. J Inherit Metab Dis 2012; 35 : 749–759.
3. Piekutowska-Abramczuk D, Magner M, Popowska E, et al. SURF1 missense mutations promote a mild Leigh phenotype. Clin Genet 2009; 76 : 195–204.
4. Magner M, Niedobová V, Tesařová M, et al. MELAS syndrom nejsou jenom iktu podobné příhody. Čes--slov Pediat 2012; 5 : 355.
5. Magner M, Szentiványi K, Svandová I, et al. Elevated CSF--lactate is a reliable marker of mitochondrial disorders in children even after brief seizures. Eur J Paediatr Neurol 2011; 15 : 101–108.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2013 Číslo 1- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficitmi v reálnej praxi
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
-
Všetky články tohto čísla
- Vliv menarché na hladinu cholesterolemie u adolescentních dívek s familiární hypercholesterolemií
- Somatický vývoj a úrazy u dětí v období pubertálního spurtu – nové poznatky o významu dynamiky růstu a podmíněnosti úrazového rizika u současné populace
- X. Slovenský pediatrický kongres
- Analýza rizikových faktorů suicidálního jednání v dětství a adolescenci
- Masivní plicní embolie jako první příznak nefrotického syndromu u 18leté pacientky
- Sekundárne malignity u pediatrických pacientov po transplantácii kmeňových krvotvorných buniek
- Tělesná aktivita a návykové nemoci: překvapivá zjištění
- Nové tváře mitochondriálního onemocnění u dětí
- Recenze
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Nové tváře mitochondriálního onemocnění u dětí
- Masivní plicní embolie jako první příznak nefrotického syndromu u 18leté pacientky
- Somatický vývoj a úrazy u dětí v období pubertálního spurtu – nové poznatky o významu dynamiky růstu a podmíněnosti úrazového rizika u současné populace
- Analýza rizikových faktorů suicidálního jednání v dětství a adolescenci
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



