-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Sekundárne malignity u pediatrických pacientov po transplantácii kmeňových krvotvorných buniek
Secondary malignancies in pediatric patients after hematopoietic stem cell transplantation
There is an increased risk of early and late complications following allogeneic hematopoietic stem cell transplantation despite its demonstrated success in children. Among the life-threatening complications, which occur between 6 months and several years following the transplantation and the first diagnosis of malignancy, are secondary leukemias or secondary solid tumours.
In this review we summarise relevant genetic polymorphisms associated with increased risk of secondary malignancies. Additionally, we pay specific attention to screening, management and prophylaxis in pediatric patients following hematopoietic stem cell transplantation.Key words:
hematopoietic stem cell transplantation, secondary malignancies, genetic polymorphisms
Autoři: L. Géczová 1,2; S. Šufliarska 2; J. Horáková 2; B. Mladosievičová 1; doc. MUDr. Prednosta Ústavu M. Bernadič, CSc.; mim. prof.
Působiště autorů: Oddelenie klinickej patofyziológie, Ústav patologickej fyziológie LFUK, Bratislavavedúca doc. MUDr. B. Mladosievičová, CSc. 1; Klinika detskej hematológie a onkológie LFUK a DFNsP, Transplantačná jednotka kostnej drene, Bratislavaprednostka doc. MUDr. E. Kaiserová 2
Vyšlo v časopise: Čes-slov Pediat 2013; 68 (1): 49-56.
Kategorie: Přehledový článek
Souhrn
Napriek nepopierateľným úspechom patrí alogénna transplantácia kmeňových krvotvorných buniek u detí k liečebným modalitám so zvýšeným rizikom včasných aj neskorých komplikácií. Medzi život ohrozujúce potransplantačné komplikácie vznikajúce najmenej 6 mesiacov až niekoľko rokov po diagnóze prvej malignity patria sekundárne leukémie alebo sekundárne solídne nádory.
Predkladaná práca poskytuje stručný prehľad najnovších poznatkov týkajúcich sa genetických polymorfizmov súvisiacich s rizikom vzniku sekundárnych malignít. Zaoberá sa tiež skríningom sekundárnych malignít a ich manažmentom a prevenciou u pacientov po transplantácii kmeňových krvotvorných buniek v detskom veku.Klíčová slova:
transplantácia kmeňových krvotvorných buniek, sekundárne malignity, genetické polymorfizmyÚVOD
Transplantácia kmeňových krvotvorných buniek (TKB) je nezastupiteľnou liečebnou metódou používanou v hematoonkológii. Na Slovensku sa vykonávajú TKB u detí od roku 1995. Cieľom transplantácie je reštitúcia krvotvorby pacienta-recipienta prostredníctvom prenosu pluripotentných kmeňových krvotvorných buniek od darcu. Súčasťou prípravného režimu pred TKB je vysokodávkovaná chemoterapia. Najčastejšie sa používa chemoterapia – cyklofosfamid a bu-sulfan s alebo bez celotelového ožiarenia (TBI), prípadne iné cytostatické alkylačné látky, epipodofylotoxíny a antimetabolity. Medzi indikácie pre TKB patria hematologické a nehematologické malignity, vrodené metabolické poruchy, imunologické a v posledných rokoch aj autoimunitné ochorenia [1, 2]. S klesajúcou mortalitou a stúpajúcim počtom indikácií pre TKB narastá neustále aj počet dlhodobo prežívajúcich pediatrických pacientov.
Mortalita pacientov liečených TKB je 4–9-krát vyššia v porovnaní s vekovo primeranou bežnou populáciou, a to najmenej 30 rokov po transplantácii. Medzi najčastejšie príčiny úmrtí pacientov patrí chronická reakcia štepu proti hostiteľovi (graft versus host disease, GVHD), infekcie, sekundárne malignity (SM), respiračné a kardiovaskulárne ochorenia [3].
SEKUNDÁRNE MALIGNITY
Sekundárne malignity (SM) sú život ohrozujúcou komplikáciou transplantácie kmeňových krvotvorných buniek nielen u pediatrických pacientov. Riziko vzniku akejkoľvek SM rastie s odstupom času od TKB a je výrazne ovplyvnené cytotoxickou chemorádioterapiou používanou v prípravných režimoch. Tumory indukované žiarením majú pomerne dlhú latenciu – objavujú sa aj niekoľko desiatok rokov od TKB [4].
V literatúre je dobre opísaný vzťah celotelového ožiarenia (total body irradiation, TBI) a veku pacienta počas ožiarenia. Čím nižší je vek pacienta v čase rádioterapie, tým je vyššie riziko vzniku SM. Riziko vzniku SM po vysokodávkovej TBI je podľa rôznych autorov približne 3–6-krát vyššie ako u pacientov bez celotelového ožiarenia. Z tohto dôvodu sú najmä deti vystavené oveľa vyššiemu riziku získania SM, a to pre predpokladané dlhodobé prežívanie po TKB a vyššiu senzitivitu vyvíjajúcich sa tkanív dieťaťa voči karcinogénom a rádioterapii [4, 5].
SM vzniknuté po transplantácii kmeňových krvotvorných buniek sa tradične rozdeľujú do troch hlavných skupín:
- leukémie – terapiou indukovaná t-MDS//AML (therapy-related myelodysplasia or acute myeloid leukemia),
- lymfómy, medzi ktoré patria aj potransplantačné lymfoproliferatívne ochorenia (post transplant lymphoproliferative disorders, PTLD) a
- solídne nádory [6–8].
SM sú štvrtou najčastejšou príčinou úmrtia u pacientov bez relapsu základného ochorenia a prežívajúcich minimálne 2 roky od transplantácie [9–12]. Medzi zriedkavo sa vyskytujúce SM patrí MDS (myelodysplastický syndróm) a sekundárne leukémie, naopak veľmi časté sú solídne sekundárne tumory a PTLD úzko súvisiace s infekciou EBV (Ebsteina-Barrovej vírusom). Iné vírusy majú len minoritný vplyv na vznik potransplantačných malignít. Medzi onkogénne vírusy patria okrem EBV aj HPV (human papilloma virus), hepatotropné vírusy ako HCV (hepatitis C virus) [4, 6, 9, 13, 14].
RIZIKO VZNIKU SEKUNDÁRNYCH MALIGNÍT PO TRANSPLANTÁCII KMEŇOVÝCH KRVOTVORNÝCH BUNIEK
Kumulatívna incidiencia vzniku solídnych malignít sa pohybuje od 1,2 % do 1,6 % pri 5-ročnom prežívaní, 2,2 % až 6,1 % pri 10-ročnom prežívaní a 3,8 % až 14,9 % pri 15-ročnom prežívaní pacientov po alogénnej transplantácii kmeňových krvotvorných buniek [9, 10, 15, 16]. Autori Bhatia a spol. uvádzajú incidienciu všetkých malignít vzniknutých do 13 rokov po transplantácii u 9,9 % ± 2,3 % pacientov [15].
Riziko vzniku solídnej malignity po TKB narastá časom, pričom je až 3-násobne vyššie u pa-cientov prežívajúcich 15 rokov od transplantácie. Takáto zvýšená incidiencia SM je z patofyziologického hľadiska multifaktoriálna. Na karcinogenéze SM sa podieľajú ako negenetické, tak aj genetické faktory. Z negenetických faktorov je to vek pacienta, jeho endokrinný a metabolický status, typ primárneho nádoru, chemoterapia, prípadne rádioterapia súvisiaca s primárnym ochorením, aktivácia onko-génnych vírusov, imunosupresia, stimulácia imunitného systému rastovými faktormi, imunosupresívna liečba GVHD [3, 4, 9, 17].
Genetická predispozícia pacienta má vplyv na vznik nielen primárnych, ale aj sekundárnych malignít. Bolo popísaných viacero genetických polymorfizmov, ktoré súvisia so zvýšeným rizikom vzniku SM u pacientov, ktorí boli liečení alkylačnými látkami. TBI u pacienta vedie ku genómovej instabilite, deléciám, translokáciam a mutáciam chromozómov a následne k zvýšenému riziku vzniku SM. U pacientov s chronickou GVHD sú popisované časté genómové alterácie [9, 18].
Ku genetickým polymorfizmom, ktoré majú vzťah k vzniku SM, patria:
- polymorfizmy génov zodpovedných za opravu poškodenej DNA (TP53 – tumor protein 53, XRCC1 – X-ray repair cross-complementing protein 1), a tiež
- polymorfizmy génov, ktoré zodpovedajú za detoxifikáciu xenobiotík z organizmu, a teda majú úlohu v metabolizme liečiv v organizme pacienta. K tejto druhej skupine génov patrí napríklad polymorfizmus NQO1 – detoxifikačného génu NAD(P)H oxidoreduktázy, tiež funkčné polymorfizmy glutation S-transferázy (GSTM1, GSTP1, GSTT1) a cytochrómu P450 [7, 17, 19, 20].
T-MDS/AML vzniká u pacientov vystavených chemoterapii, rádioterapii, prípadne kombinácii oboch liečebných modalít a je asociovaná s používaním alkylačných látok a inhibítorov topoizomerázy II u pacientov. Je hlavnou príčinou mortality nesúvisiacej s relapsom u pacientov liečených pre HL/NHL (Hodgkinov lymfóm/non-Hodgkinov lymfóm). Existujú dve hlavné skupiny liečbou indukovaných leukémií – jednou skupinou sú tie s deléciou alebo stratou dlhého ramienka chromozómu 5 a 7 (-5/del[5q]) a (-7/del[7q]), ktoré sú indukované podávaním alkylačných látok a objavujú sa s latenciou 4–7 rokov po ich podávaní. Druhou skupinou sú leukémie s MLL (Mixed-Lineage Leukemia, MLL), translokáciou a inými translokáciami génov indukované podávaním inhibítorov topoizomerázy II, hlavne epipodofylotoxínov, ktoré sa u pacientov objavujú s latenciou vzniku 6 mesiacov – 5 rokov od podávania inhibítorov topoizomerázy II [6–8, 19, 21–24].
Dexrazoxán (Cardioxane), ktorý je analógom kyseliny etyléndiamíntetraoctovej (EDTA), patrí medzi inhibítory topoizomerázy II, podáva sa u pacientov na prevenciu chronickej kumulovanej kardiotoxicity spôsobenej antracyklínmi. Na základe štúdie Tebbi a spol., v ktorej autori popisujú zvýšenú incidienciu SM u pacientov, ktorí dostávali dexrazoxán ako kardioprotektívum v kombinácii s inými inhibítormi topoizomerázy II, bolo používanie dexrazoxánu kontraindikované u detí a dospievajúcich vo veku do 18 rokov. Výskyt SM u pacientov, ktorí dostávali v liečbe dexrazoxán, možno čiastočne pripísať účinku kombinovania dexrazoxánu s inými inhibítormi topoizomerázy II [25–27].
Alkylačné látky spôsobujú DNA poškodenie buniek, ktoré vyžaduje apoptózu bunky alebo opravu DNA. Práve poškodenie reparačných funkcií vedie k chromozómovým aberáciam a leukemogenéze. V súčasnej dobe sa odhaduje, že zo všetkých akútnych myeloidných leukémií 10–20 % tvoria práve t-AML. Jedným z najvýznamnejších tumor supresorových génov je p53 (označovaný aj ako TP53 – tumor protein 53). Poškodenie DNA vedie k jeho aktivácii, uvoľneniu regulačného proteinu p53, ktorého úlohou je pozastavenie delenia poškodenej bunky, alebo navodenie jej apoptózy. U pacientov s t-AML bolo identifikovaných viacero polymorfizmov génu p53, teda tzv. „strážcu genómu“. Niektorí autori uvádzajú, že pri zníženej funkcii TP53 a zároveň zníženej aktivite MTHFR (methylenetetrahydrofolate reductase – MTHFR) u pacientov dochádza k akumulácii progenitorových buniek s chromozomálnym poškodením, čo vedie k zvýšenému riziku vzniku t-AML/MDS. Zvýšené riziko vzniku SM majú napríklad aj pacienti s Li-Fraumeniho syndrómom, ktorého príčinou je germinatívna mutácia v tumor supresorovom géne p53. Táto mutácia spolu s karcinogénnou liečbou takýchto pacientov zvyšuje riziko vzniku následných malignít [7, 19, 20, 23, 28].
Polymorfizmy génov bázovej excíznej opravy napr. XRCC1 a detoxifikačných génov NAD(P)H oxidoreduktázy – NQO1 (napr. NQO1 C609T) vedú k zvýšenému riziku vzniku AML, ALL (acute lymphoblastic leukemia) a iných typov akútnych leukémií, terapiou indukovaných leukémií, hematotoxicite. Smith a spol. uvádzajú o 49 % vyššie riziko vzniku akútnej leukémie u pa-cientov heterozygotných alebo homozygotných s polymorfizmom NQO1 C609T oproti pacientom bez polymorfného génu NAD(P)H oxidoreduktázy [29–31].
Existujú minimálne 3 funkčné polymorfizmy glutation S-transferázy (GSTs – gluthatione S-transferases), enzýmu kľúčového v detoxifikácii xenobiotík z organizmu, GSTM1, GSTT1, GSTP1. Z nich GSTP1 signifikantne zvyšuje náchylnosť pacienta na terapiou indukovanú karcinogenézu a vznik t-AML. Ye a spol. na druhej strane uvádzajú zvýšené riziko vzniku t-AML u pacientov s polymorfizmom GSTM1 a GSTT1, ale nie u tých s polymorfizmom GSTP1 [23, 32, 33].
Prostredníctvom cytochrómu P450 (CYP) 3A je metabolizovaných takmer polovica všetkých liečiv používaných v dnešnej dobe, medzi nimi aj chemoterapeutiká – epipodofylotoxíny. Polymorfizmus CYP3A4 génu (CYP3A4-V) je spojený s epipodofylotoxínmi indukovanou leukemogenézou [21, 23].
Pacienti po transplantácii KD (kostnej drene), ktorí boli infikovaní HCV, majú vysoké riziko vzniku cirhózy pečene a následne hepato-celulárneho karcinómu [9]. Peffault de Latour a spol. uvádzajú kumulatívnu incidenciu he-patocelulárneho karcinómu u pacientov prežívajúcich 20 rokov po transplantácii 5 % [34].
Pacienti s akútnou GVHD majú zvýšené riziko vzniku skvamocelulárneho karcinómu kože. U pacientov s chronickou GVHD a imunosupresívnou liečbou je zvýšené riziko vzniku solídnych nádorov, najmä skvamocelulárneho karcinómu kože a bukálnej sliznice a aj bazocelulárneho karcinómu. Epitelové bunky bukálnej sliznice sú pre chronickú GVHD vystavené mikrosatelitnej instabilite. Výskyt skvamocelulárneho karcinómu je úzko spätý s dĺžkou imunosupresívnej terapie chronickej GVHD, najmä liečbou azatioprimom. Riziko vzniku skvamocelulárneho karcinómu sa rapídne zvyšuje s dávkou radiačnej záťaže a nízkym vekom pacienta v dobe transplantácie. Toto riziko je u pacientov ožiarených a mladších ako 30 rokov v čase TKB takmer 10-krát vyššie ako u pacientov bez použitia rádioterapie v prípravnom režime [3, 4, 9, 16, 35].
Vek pacienta v čase transplantácie je najsilnejším rizikovým faktorom vzniku sekundárneho nádoru štítnej žľazy (ŠŽ). Curtis a spol. v multicentrickej štúdii na takmer 20 000 pacientoch, ktorí podstúpili TKB, uvádzajú, že deti ktoré boli mladšie ako 10 rokov v čase TKB, mali až 36,6-krát vyššie riziko vzniku malignity v porovnaní s kontrolnou skupinou. Deti, ktoré boli vystavené radiačnému žiareniu, hlavne ak v prípravnom režime podstúpili TBI, majú vysoké riziko vzniku sekundárneho tumoru mozgu a štítnej žľazy. Z ostatných SM sa so stúpajúcim časom od TKB vyskytuje nádor prsníka, slinných žliaz, kostí, spojivového tkaniva [4, 36].
SKRÍNING, MANAŽMENT A PREVENCIA VZNIKU SEKUNDÁRNYCH MALIGNÍT U PEDIATRICKÝCH PACIENTOV PO TRANSPLANTÁCII KMEŇOVÝCH KRVOTVORNÝCH BUNIEK
Najčastejšími malignitami vznikajúcimi po TKB sú solídne sekundárne tumory a po-transplantačné lymfoproliferatívne ochorenia. Solídne sekundárne tumory sa častejšie vyskytujú v ústnej dutine, ezofágu, štítnej žľaze, na koži, v pečeni, kostiach, prípadne v mozgu, kým lokalizácia napríklad v tenkom čreve či nazálnej sliznici je pomerne zriedkavá, prípadne má incidienciu výskytu porovnateľnú s bežnou populáciou. Pacientov je vhodné sledovať aspoň 10 rokov od TKB a minimálne každých 12 mesiacov ambulantne vyšetriť [9, 37, 38].
U pediatrických pacientov by sa malo zvýšene dbať na aktívny skríning a vyhľadávanie nádorov kože, najmä u tých pacientov, ktorí mali chronickú GVHD a boli v prípravnom režime vystavení radiačnému žiareniu. Je vhodné aktívne vyhľadávať a včas podchytiť aj minimálne kožné lézie, ako sú vitiligo a sklerodermia. Podľa odporúčaní Children’s Oncology Group Long-Term Follow-Up Guidelines for Children, Adolescent, and Young Adult Cancers verzie 3.0 z roku 2008 (COG LTFU) by mali detskí pacienti absolvovať ročné dermatologické prehliadky. Pre častý výskyt nádorov kože by sa všetci pacienti mali aktívne chrániť pred UV žiarením používaním vysokoochranných opaľovacích krémov [3, 9, 37].
V anamnéze pacientov by sme sa mali zamerať na únavu, bolesti končatín, bledosť, krvácavé prejavy ako ľahkú tvorbu modrín, výskyt petéchií a purpury, ktoré by mohli byť príznakmi sekundárnych potransplantačných malignít [37].
U žien a adolescentiek, ktoré počas TKB absolvovali ožiarenie hrudníka alebo TBI, sú odporúčané ročné gynekologické kontroly s onkocytológiou krčka maternice a pravidelné ročné mamografické vyšetrenia od dosiahnutého 25. roku veku alebo 8 rokov po ožiarení (podľa toho, čo bolo neskôr). Pacientky by mali byť poučené o dôležitosti pravidelného samovyšetrenia prsníkov [3, 9, 37].
Pre častý výskyt potransplantačných malignít hlavy a krku, nádorov ústnej dutiny a skvamocelulárneho karcinómu bukálnej sliznice by mali pacienti absolvovať prehliadky každých 6, prípadne 12 mesiacov so zameraním sa na vyhľadávanie tumorov v tejto lokalite [3, 4, 37].
Skríning malignít štítnej žľazy (ŠŽ) by mal byť každých 12 mesiacov, a to minimálne palpačným vyšetrením, aby sa u pacienta zachytili prípadne noduly vznikajúce v tkanive ŠŽ, ktoré by mohli svedčať pre karcinóm. American Thyroid Association pri nájdení nodulu väčšieho ako 5 mm odporúča tenkoihlovú biopsiu u pacientov, ktorí sú vysoko rizikoví. Takýmito pacientmi sú deti po TBI, pacienti po ionizujúcom radiačnom žiarení, pacienti s pozitívnou rodinnou anmnézou karcinómu ŠŽ a s pozitívnym vychytávaním 18-fluorodeoxy-glukózy na PET (pozitrónová emisná tomografia, PET) vyšetrení [3].
U pacientov s chronickou GVHD postihujúcou pečeň, alebo HCV infekciou hrozí riziko cirhózy, prípadne sekundárneho nádoru pečene približne v 25 %. Z tohto dôvodu je odporúčané ročné zhodnotenie funkčných pečeňových testov (celkový bilirubín, alkalická fosfatáza a transaminázy). Pri HCV a HBV (hepatitis B virus) infekcii sa odporúča aj sledovanie hladiny HbsAg, u pacientov s chronickou hepatitídou typu C biopsia pečene na zhodnotenie stupňa cirhózy pečene [14].
Pacientom po TKB by mala byť vhodnou cestou vysvetlená dôležitosť pravidelných ročných ambulantných vyšetrení a skríningov, aby sa zlepšila „compliance“ – spolupráca pacienta. Takisto je zo strany pacienta nutné vyhýbať sa excesívnemu slnečnému žiareniu a karcinogénom, ako sú tabak a alkohol [3].
Ak sa u pacienta zachytí akákoľvek SM, jeho terapeutický plán by mal byť zostavený s pri-hliadnutím na primárne ochorenie pacienta a prípadnú predchádzajúcu radiačnú záťaž. Napriek vzniku SM je prognóza u týchto pacientov porovnateľná s bežnou populáciou, samozrejme podľa štádia tumoru a pridružených ochorení pacienta [3].
Stručné zhrnutie odporúčaného manažmentu pediatrických pacientov upravené podľa Long-Term Follow-Up Guidelines for Survivors of Childhood, Adolescent, and Young Adult Cancers verzie 3.0 z októbra 2008 a podľa Faraci a spol. z 2008 uvádzame v tabuľke 1 [37, 39].
Tab. 1. Odporúčaný manažment pediatrických pacientov po transplantácii kmeňových krvotvorných buniek (upravené podľa Children’s Oncology Group, 2008 a Faraci a spol., 2008). 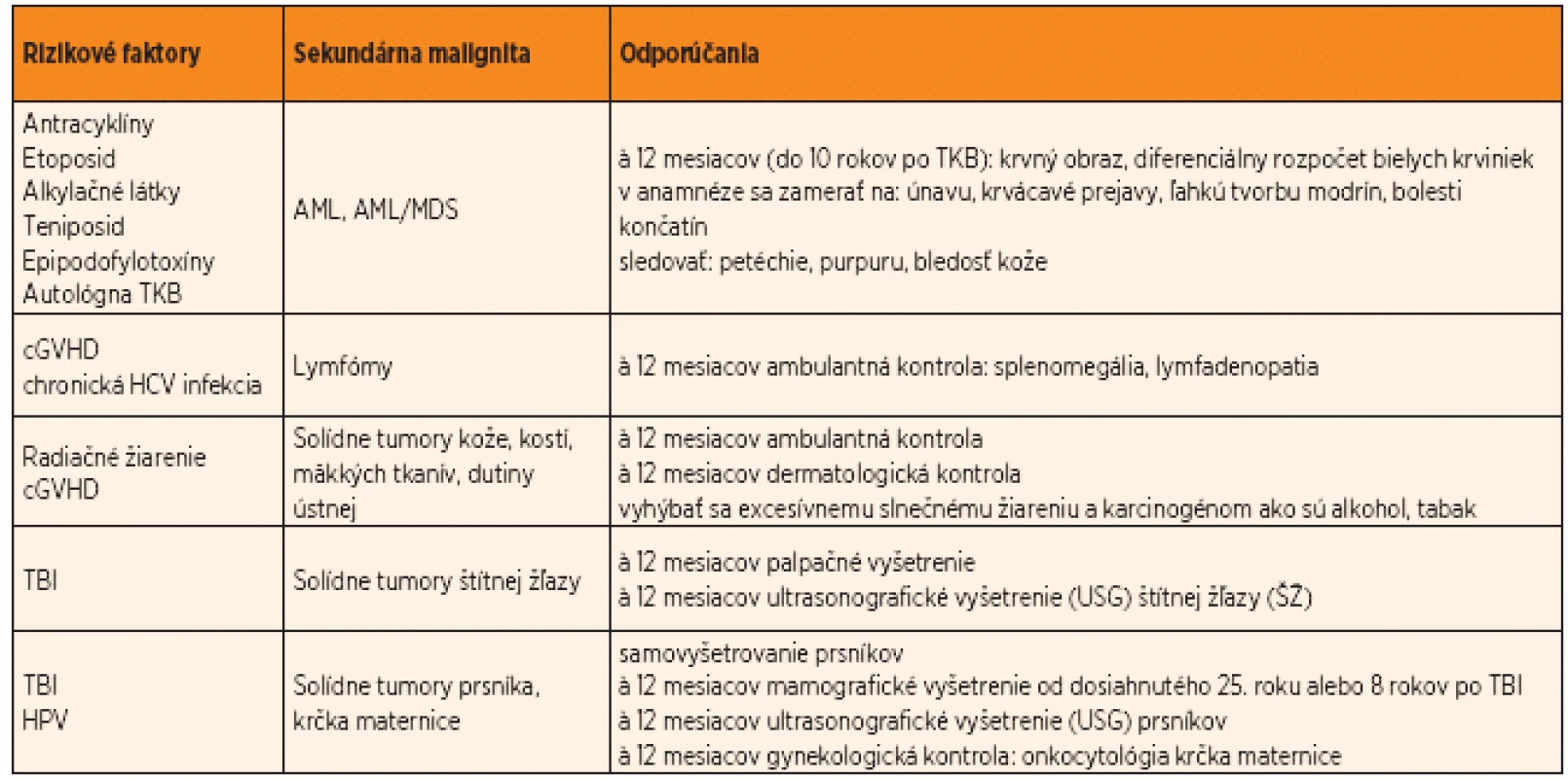
ZÁVER
Transplantácia kmeňových krvotvorných buniek sa stala nádejnou liečebnou modalitou u pacientov s inak fatálnymi malígnymi aj nemalígnymi diagnózami. Počet pacientov úspešne vyliečených a dlhodobo prežívajúcich tak neustále narastá. S postupujúcim časom od transplantácie rapídne stúpa aj riziko vzniku neskorých komplikácií, medzi ktorými sú aj sekundárne malignity. Počet dlhodobo prežívajúcich pediatrických pacientov sa neustále zvyšuje. Práve z tohto dôvodu sme sa zamerali na SM a manažment pacientov po TKB. Obzvlášť detskí pacienti sú vystavení vyššiemu riziku vzniku SM v porovnaní s veku primeranou bežnou populáciou. Zabezpečenie čo najlepšej kvality života pacientov predstavuje multidisciplinárny problém.
Našou snahou bolo vytvoriť na základe najnovších svetových odporúčaní zhrnutie manažmentu dlhodobého sledovania pacientov po TKB, na ktoré by mal myslieť každý lekár prichádzajúci do kontaktu s vyliečeným onkologickým pacientom. Ak by sa v budúcnosti venovala vyššia pozornosť pacientom s vybranými genetickými polymorfizmami, pravdepodobne by bolo možné individualizovať terapiu u týchto pacientov a prípadne vzniknuté SM by bolo možné podchytiť u týchto pacientov v skorších štádiách. To by viedlo k lepšiemu prežívaniu takýchto pacientov, úspešnejšej liečbe, menšej toxicite a v neposlednej miere aj k zníženým finančným nákladom na terapiu. Iba primeranou informovanosťou lekárov, majúcich v starostlivosti vyliečených onkologických pacientov a lepšou spoluprácou týchto pacientov s lekármi môže byť zabezpečená adekvátna kvalita života po transplantácii.
Práca vznikla s čiastočnou podporou grantu MZSR 2007/42-UK-18.
Došlo: 6. 6. 2012
Přijato: 22. 9. 2012
MUDr. Lucia Géczová
Ústav patologickej fyziológie LFUK
Sasinkova 4
811 08 Bratislava
Slovenská republika
e-mail: luciageczova@gmail.com
Zdroje
1. Šufliarska S, Horáková J, Boďová I. Transplantácie krvotvorných buniek v pediatrickej onkológii. Onkológia (Bratislava) 2006; 1 (2): 93–97.
2. Horáková J, Lukáč J, Šufliarska S, et al. Transplantácia krvotvorných buniek u detí. Čes-slov Pediat 2006; 61 (10): 610–616.
3. Savani BN, Griffith ML, Jagasia S, et al. How I treat late effects in adults after allogeneic stem cell transplanta-tion. Blood 2011 Mar 17; 117 (11): 3002–3009.
4. Lowe T, Bhatia S, Somlo G. Second malignancies after allogeneic hematopoietic cell transplantation. Biol Blood Marrow Transplant 2007; 13 (10): 1121–1134.
5. Socié G, Curtis RE, Deeg HJ, et al. New malignant diseases after allogeneic marrow transplantation for childhood acute leukemia. J Clin Oncol 2000 Jan; 18 (2): 348–357.
6. Roziakova L, Bojtarova E, Mistrik M, et al. Secondary malignancies after hematopoietic stem cell transplantation. Neoplasma 2011; 58 (1): 1–8.
7. Socié G, Baker KS, Bhatia S. Subsequent malignant neo-plasms after hematopoietic cell transplantation. Biol Blood Marrow Transplant 2012 Jan; 18 (1): 139–150.
8. Bhatia S. Long-term health impacts of hematopoietic stem cell transplantation inform recommendations for follow-up. Expert Rev Hematol 2011 Aug; 4 (4): 437–454.
9. Socié G, Rizzo JD. Second solid tumors: Screening and management guidelines in long-term survivors after allogeneic stem cell transplantation. Semin Hematol 2012 Jan; 49 (1): 4–9.
10. Wingard JR, Majhail NS, Brazauskas R, et al. Long-term survival and late deaths after allogeneic hematopoietic cell transplantation. J Clin Oncol 2011 Jun 1; 29 (16): 2230–2239.
11. Martin PJ, Counts GW Jr, Appelbaum FR, et al. Life expectancy in patients surviving more than 5 years after hematopoietic cell transplantation. J Clin Oncol 2010 Feb 20; 28 (6): 1011–1016.
12. Bhatia S, Francisco L, Carter A, et al. Late mortality after allogeneic hematopoietic cell transplantation and functional status of long-term survivors: report from the Bone Marrow Transplant Survivor Study. Blood 2007 Nov 15; 110 (10): 3784–3792.
13. Bhatia S, Louie AD, Bhatia R, et al. Solid cancers after bone marrow transplantation. J Clin Oncol 2001 Jan 15; 19 (2): 464–471.
14. Rizzo JD, Wingard JR, Tichelli A, et al. Recommended screening and preventive practices for long-term survivors after hematopoietic cell transplantation: joint recommendations of the European Group for Blood and Marrow Transplantation, the Center for International Blood and Marrow Transplant Research, and the American Society of Blood and Marrow Transplantation (EBMT/CIBMTR/ASBMT). Bone Marrow Transplant 2006; 37 : 249–261.
15. Bhatia S, Ramsay NK, Steinbuch M, et al. Malignant neoplasms following bone marrow transplantation. Blood 1996 May 1; 87 (9): 3633–3639.
16. Rizzo JD, Curtis RE, Socié G, et al. Solid cancers after allogeneic hematopoietic cell transplantation. Blood 2009 Jan 29; (5): 1175–1183.
17. Fenske TS, McMahon Ch, Edwin D, et al. Identification of candidate alkylator-induced cancer susceptibility genes by whole genome scanning in mice. Cancer Res 2006 May 15; 66 (10): 5029–5038.
18. Khan FM, Sy S, Louie P, et al. Genomic instability after allogeneic hematopoietic cell transplantation is frequent in oral mucosa, particularly in patients with history of chronic graft-versus-host disease, and rare in nasal mucosa. Blood 2010 Sep 9; 116 (10): 1803–1806.
19. Ding Y, Sun C-L, Li L, et al. Genetic susceptibility to therapy-related leukemia after Hodgkin lymphoma or non-Hodgkin lymphoma: role of drug metabolism, apoptosis and DNA repair. Blood Cancer Journal (2012) 2, e58; doi:10.1038/bcj.2012.4.
20. Ellis NA, Huo D, Yildiz O, et al. MDM2 SNP309 and TP53 Arg72Pro interact to alter therapy-related acute myeloid leukemia susceptibility. Blood 2008 Aug 1; 112 (3): 741–749.
21. Felix CA, Walker AH, Lange BJ, et al. Association of CYP3A4 genotype with treatement-related leukemia. Proc Natl Acad Sci USA 1998 October 27; 95 (22): 13176–13181.
22. Pedersen-Bjergaard J, Klarskov Andersen M, Christiansen DH. Therapy-related acute myeloid leukemia and myelodysplasia after high-dose chemotherapy and autologous stem cell transplantation. Blood 2000 Jun 1; 95 (11): 3273–3279.
23. Bhatia S. Role of genetic susceptibility in development of treatment-related adverse outcomes in cancer survivors. Cancer Epidemiol Biomarkers Prev 2011 Oct; 20 (10): 2048–2067.
24. Smith SM, Le Beau MM, Huo D, et al. Clinical-cytoge-netic associations in 306 patients with therapy-related myelodysplasia and myeloid leukemia: the University of Chicago series. Blood 2003 Jul 1; 102 (1): 43–52.
25. Tebbi CK, London WB, Friedman D, et al. Dexrazoxane-associated risk for acute myeloid leukemia/myelodysplastic syndrome and other secondary malignancies in pediatric Hodgkin’s disease. J Clin Oncol 2007 Feb 10; 25 (5): 493–500.
26. http://www.sukl.sk.
27. Mladosievičová B, a kol. Kardioonkológia. 1. vyd. Bratislava: SAP, 2012 : 34–36.
28. Mladosievičová B, Kaiserová E, Foltinová A. Možné neskoré následky protinádorovej liečby v detstve. 1. vyd. Bratislava: SAP, 2007 : 107–109.
29. Seedhouse C, Faulkner R, Ashraf N, et al. Polymorphisms in genes involved in homologous recombination repair interact to increase the risk of developing acute myeloid leukemia. Clin Cancer Res 2004 Apr 15; 10 (8): 2675–2680.
30. Smith MT, Wang Y, Kane E, et al. Low NAD(P)H: quinone oxidoreductase 1 activity is associated with increased risk of acute leukemia in adults. Blood 2001 Mar 1; 97 (5):1422–1426.
31. Larson RA, Wang Y, Banerjee M, et al. Prevalence of the inactivating 609C→T polymorphism in the NAD(P)H: quinone oxidoreductase (NQO1) gene in patients with primary and therapy-related myeloid leukemia. Blood 1999 Jul 15; 94 (2): 803–807.
32. Allan JM, Wild ChP, Willett EV, et al. Polymorphism in glutathione S-transferase P1 is associated with susceptibility to chemotherapy-induced leukemia. Proc Natl Acad Sci USA 2001 September 25; 98 (20): 11592–11597.
33. Ye Z, Song H. Glutathione s-transferase polymor-phisms (GSTM1, GSTP1 and GSTT1) and the risk of acute leukemia: A systematic review and meta-analysis. Eur J Cancer 2005 May; 41 (7): 980–989.
34. Peffault de Latour R, Lévy V, Asselah T, et al. Long-term outcome of hepatitis C infection after bone marrow transplantation. Blood 2004 Mar 1; 103 (5): 1618–1624.
35. Curtis RE, Metayer C, Rizzo JD, et al. Impact of chronic GVHD therapy on the development of squamous-cell cancers after hematopoietic stem-cell transplantation: an international case-control study. Blood 2005 May 15; 105 (10): 3802–3811.
36. Curtis RE, Rowlings PA, Deeg HJ, et al. Solid cancers after bone marrow transplantation. N Engl J Med 27 March 1997; 336 (13): 897–904.
37. Children’s oncology group. Long-Term Follow-Up Guidelines for Survivors of Childhood, Adolescent, and Young Adult Cancers, version 3,0 – October 2008.
38. Baker KS, DeFor TE, Burns LJ, et al. New malignancies after blood or marrow stem-cell transplantation in children and adults: Incidence and risk factors. J Clin Oncol 2003 Apr 1; 21 (7): 1352–1358.
39. Faraci M, Békássy AN, De Fazio V, et al. Non-endocrine late complications in children after allogeneic hematopoietic SCT. Bone Marrow Transplant 2008 Jun; 41 (Suppl 2): S49–57.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2013 Číslo 1- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficitmi v reálnej praxi
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
-
Všetky články tohto čísla
- Vliv menarché na hladinu cholesterolemie u adolescentních dívek s familiární hypercholesterolemií
- Somatický vývoj a úrazy u dětí v období pubertálního spurtu – nové poznatky o významu dynamiky růstu a podmíněnosti úrazového rizika u současné populace
- X. Slovenský pediatrický kongres
- Analýza rizikových faktorů suicidálního jednání v dětství a adolescenci
- Masivní plicní embolie jako první příznak nefrotického syndromu u 18leté pacientky
- Sekundárne malignity u pediatrických pacientov po transplantácii kmeňových krvotvorných buniek
- Tělesná aktivita a návykové nemoci: překvapivá zjištění
- Nové tváře mitochondriálního onemocnění u dětí
- Recenze
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Nové tváře mitochondriálního onemocnění u dětí
- Masivní plicní embolie jako první příznak nefrotického syndromu u 18leté pacientky
- Somatický vývoj a úrazy u dětí v období pubertálního spurtu – nové poznatky o významu dynamiky růstu a podmíněnosti úrazového rizika u současné populace
- Analýza rizikových faktorů suicidálního jednání v dětství a adolescenci
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



